- Преподавателю
- Математика
- Интегрированный урок по физике и химии
Интегрированный урок по физике и химии
| Раздел | Математика |
| Класс | - |
| Тип | Конспекты |
| Автор | Гордиенко Л.И. |
| Дата | 30.10.2014 |
| Формат | docx |
| Изображения | Есть |











 Интегрированный урок по химии и физике на тему "Электролиз расплавов и растворов солей" с мультимедийной презентацией
Интегрированный урок по химии и физике на тему "Электролиз расплавов и растворов солей" с мультимедийной презентацией
" Электролиз", "Волховский алюминиевый завод","Применение электролиза"
Цели:
Образовательная:
- Наблюдая, что происходит с расплавами и растворами солей при электролизе, научиться объяснять происходящие процессы на электродах, составлять уравнения химических реакций.
- Закрепить правила:
-
восстановления катионов на катоде;
-
окисления анионов на аноде;
- Узнать о применении электролиза в химической промышленности.
Развивающая: совершенствовать умения учащихся анализировать, сравнивать, наблюдать, делать выводы, устанавливать взаимосвязь между физическими и химическими процессами.
Воспитательная: продолжать воспитывать у учащихся культуру умственного труда, положительного отношения к знаниям и их применению в жизни.
Методическая цель: используя сотрудничество преподавателя химии и физики, добиться создания на уроке атмосферы деловой заинтересованности и глубокого проникновения студентов материал изучаемой темы.
Оснащение: персональный компьютер, интерактивная доска, диск с кинофрагментами "Электролиз", "Алюминий", презентация к уроку, источник тока, амперметр, ключ, реостат, соединительные провода, стакан, электроды, весы, часы.
Тип урока: урок изучения нового материала.
Вид урока: интегрированный урок с применением сообщений- презентаций студентов.
Методы и приемы обучения: метод исследовательских творческих заданий( подготовка презентаций, поиск и обработка информации по заданной теме),
метод алгоритмических предписаний ( составление опорного конспекта по заданной схеме),
дифференцированная самостоятельная работа(составление схем электролиза расплавов и растворов, решение расчетных задач)
Образовательные технологии: технология сотрудничества, исследовательская, метод проектов
Основные этапы урока
Деятельность преподавателей
Деятельность студентов
I. Организационный этап
Преподаватель химии: Здравствуйте, на прошлых уроках мы рассмотрели теоретически процессы, проходящие при диссоциации. Ребята, сегодня мы закрепим и обобщим знания и практические умения по данной теме, не совсем обычно. Мы проведем интегрированный урок химии с физикой.
Преподаватель физики: Физика и химия - необыкновенные науки. Их законы универсальны. Они с успехом объясняют свойства кристаллов и живых клеток, помогают производить стыковку космических кораблей и выполнять сложнейшие операции. Сегодня мы рассмотрим связь между физикой и химией на примере одного процесса.
II. Актуализация опорных знаний
Преподаватель физики на интерактивной доске показывает основные понятия, которыми пользовались обучающиеся при изучении темы «Диссоциация».
Преподаватель химии на интерактивной доске показывает основные понятия, которыми пользовались обучающиеся при изучении темы "Окислительно-восстановительные реакции"
Студенты на интерактивной доске выполняют тест - дополнении по понятиям катод, анод, катионы, анионы
Студенты на интерактивной доске выполняют тест - дополнении по понятиям окисление, восстановление, окислитель, восстановитель
II. Мотивация учебной деятельности
Сообщение цели урока.
Показ презентации
Осмысление цели урока,
просмотр презентации
Запись темы урока и определения. Электролиз
Электролиз - окислительно-восстановительная реакция, протекающая на электродах при прохождении электрического тока через расплав или раствор электролита.
III . Изучение нового материала и поэтапное закрепление
1.Электролиз расплава
1.Электролиз расплава
Преподаватель химии
Показ кинофрагмента фильма: электролиз расплава хлорида свинца
Просмотр фильма
Обсуждение опыта
Объяснение электролиза расплава хлорида натрия
Показ презентации
Просмотр презентации
Запись электролиза расплава хлорида натрия
1.NaCl N a++Cl-
(К-) восстановление: Na++1ē→Na0
(А+) окисление: 2Cl--2ē→Cl20
2NaCl(расплав) 2Na+Cl2
Закрепление.
Организация самостоятельной работы: составление схемы электролиза расплава бромида калия
Проверка при помощи презентации
Самостоятельная работа
2. КВr К++ Вr-
(К-) восстановление: К++1ē→К0
(А+) окисление: 2 Вr---2ē→ Вr20
2КВr (расплав) 2 К + Вr2
2.Электролиз раствора
2.Электролиз раствора
Объяснение особенностей электролиза растворов.
Показ презентации
Конспектирование, использование презентации
Правила составления схем электролиза растворов
1.На катоде не будут восстанавливаться активные металлы( до АI включительно), а будет восстанавливаться водород из воды : 2H2O + 2ē -> H2 + 2OH-
2.На аноде окисляются бескислородные анионы ( CI-, Br-, I-, S2- ), если же анионы содержат кислород, то окисляться будет кислород из воды:
2H2O - 4ē -> О2 + 4H+
Объяснение электролиза раствора хлорида натрия
Показ презентации
Просмотр презентации
Запись электролиза раствора хлорида натрия
1.NaCl N a++Cl-
Н2О Н+ ОН-
(К-) вос-ие: 2Н+ ОН+2ē→Н20+2ОН-
(А+) окисление: 2Cl--2ē→Cl20
2NaCl+ Н2О 2NaОН+Cl2 + Н2
(К-) восстановление: Na++1ē→Na0
(А+) окисление: 2Cl--2ē→Cl20
2NaCl(расплав) 2Na+Cl2
Закрепление.
Организация самостоятельной работы: составление схемы электролиза раствора сульфата меди
Проверка при помощи презентации
Самостоятельная работа
CuSO4 ® Cu 2+ + SO42-
Н2О Н+ ОН-
(К-) восстановление: Cu 2++2ē -> Cu 0
(А+) окисление: 2H2O - 4ē -> О2 + 4H+
2CuSO4 +2Н2О 2Cu +О2 +2Н2 SO4
Показ кинофрагмента фильма: электролиз раствора хлорида меди
Просмотр фильма
Обсуждение опыта
Преподаватель физики
Обсуждение определения электролиза с точки зрения физики Показ презентации
Обсуждение. Конспектирование
Носителями заряда в водных растворах или расплавах электролитов являются положительные и отрицательные ионы. При ионной проводимости прохождение тока связано с переносом вещества
3.Закон электролиза
3.Закон электролиза
Объяснение первого закона Фарадея.
Разбор формулы.
Показ презентации
Запись закона Фарадея
Масса вещества, выделившегося на электродах при электролизе, прямо пропорциональна величине заряда, прошедшего через электролит
m= k I t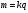
Показ кинофрагмента
Фронтальная беседа
-
Какой газ выделялся на катоде?
-
Почему анод приобрел красный цвет?
-
Какой раствор содержится в электролизере после окончания электролиза?

Просмотр кинофрагмета.
Обсуждение, ответы на вопросы.

Объяснение решения задачи на закон Фарадея
Показ презентации
Запись решения задачи
Решение задач
№1.Дано: Решение
I=2А по 1 закону Фарадея
t=42мин m= k I t t=2520с
k=3*10-кг\Кл m=3*10-7 *2 *2520
Найти:m =0,0015(кг)
Закрепление
Организация самостоятельной работы: решение задачи №2.
Проверка при помощи презентации
Самостоятельная работа: решение задачи
№2
№1.Дано: Решение
I=40кА m= k I t ,
t= m\ k I
m =1т t= 10з\ 0,93*10-7
k=0,93*10-7кг\Кл *4*10-4 =
Найти: t 4480мин=
74,67час =
=3,1сутки
4.Применеие электролиза
4.Применеие электролиза
Организация защиты проекта и акцентирование на ключевые моменты применения электролиза.
Защита проекта «Применение электролиза» одним студентом.
Показ презентации.
Конспектирование, опираясь на проект и презентацию.
Преподаватель химии .
Фронтальная беседа: где применяется электролиз в работе продавца?
Есть ли в нашем регионе химические предприятия, использующие процесс электролиза?
Устные ответы студентов.
Защита исследовательской работы «Волховский алюминиевый завод»
Показ презентации
IV . Закрепление изученного материала
Преподаватель физики
Выдача тестов уровня В.
Организация взаимопроверки.
Самостоятельная работа:
выполнение тестов.
Взаимопроверка тестов.
V.Задание для самостоятельной работы
Преподаватель физики : на дом вам предлагается дифференцированное задание : написать схему электролиза оксида алюминия или
предложить два способа получения железа методом электролиза.
Студенты по выбору записывают одно из заданий.
VI.Подведение итогов урока
Преподаватель химии подводит итог, благодарит всех за урок, знакомит с оценками


