- Преподавателю
- Музыка
- Коллоидтық химия негіздері туралы
Коллоидтық химия негіздері туралы
| Раздел | Музыка |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Шукенов А.К. |
| Дата | 09.02.2015 |
| Формат | doc |
| Изображения | Есть |
-
Шукенов Адай Кайрашевич
-
КГУ «Жалтырская основная школа района Шал акына» село Жалтыр, Северо-Казахстанская область, Республика Казахстан
-
Учитель химии
Коллоидтық химия негіздері
Основы коллоидной химии
(для классов с углубленным изучением химии)
Мазмұны.
-
Кіріспе.
-
Беттік энергия және беттік құбылыстар.
-
Адгезия.
-
Адсорбцияның негізгі заңдылықтары.
-
Сұйықтық - газ шекарасындағы адсорбция.
-
Қатты беттердегі адсорбция.
-
Қос электрлік қабат және электрокинетикалық құбылыстар.
-
Майдалық жүйелердің оптикалық қасиеттері.
-
Жоғары майдалық жүйелердің молекулалық - кинетикалық қасиеттері.
-
Майдалық жүйелердің тұрақтылығы.
-
Майдалық жүйелердің құрылымдық-механикалық қасиеттері.
-
Майдалық жүйелердің алынуы мен тазартылуы.
-
Эмульсиялар.
-
Көбіктер.
-
Аэрокірнелер.
-
Қатты майдалағыш ортасы бар жүйелер.
-
Жоғары молекулалық қосылыстар.
Коллоидтық химия атауының шығуына коллоидтар мен коллоидты ерітінділерге парызды. Коллоидтардың аты грек тілінде «желім» деген мағынаны білдіретін сөзден шыққан; осылай ерекше түрлі сулы ерітінді түзетін желімтәрізді заттарды атаған. Шынайы ерітінділерде заттар молекулаларға дейін бөлшектелген, ал еріген затпен еріткіш арасында фазаның бөліну шекарасы болмайды.
Қазіргі коллоидтық химия өзінің шекарасын елеулі түрде ұлғайтты. Бөлшектерінің мөлшері коллоидты ерітінділердің бөлшектерінен әлдеқайда үлкен болатын майдалық жүйелер коллоидтық химияның зерттеу нысанасы болып саналады. Коллоидты ерітінділер майдалық жүйелердің тек көп түрлерінің бірі.
Майдалық жүйелер - ең аз дегенде екі фазадан тұратын гетерогенді жүйелер, оның бірі - майдалық фаза - бөлшектелген (үздікті), екіншісі майдалағыш орта - бөлшектелмеген (үздіксіз) жүйе бөлігі. Бөлшектену майдалық фаза мен майдалағыш орта арасындағы бөліну бетінің кенет ұлғаюына әкеледі. Фазаның бөліну бетінің фазааралық В шекарасын бағалау үшін оны майдалық фазаның М массасының бірлігіне қатыстырады:
Вменш=В/М (1.1)
В шамасы меншікті фазаның бөліну бетін сипаттайды.бірдей мөлшерлі бөлшектер үшін меншікті бет бір бөлшектің В1 бетінің 1 кг майдалық фазадағы n бөлшектер санының көбейтіндісіне тең:
Вменш=В1*n (1.2)
1 кг майдалық фазадағы сфера тәрізді бөлшектер саны:
n = (4πr3ρ/3)-1 (1.3)
мұндағы ρ - майдалық фаза затының тығыздығы, кг/м3; r - В бөлшектерінің радиусы, м.
Сфера тәрізді бөлшектердің беті 4π r2 екенін ескере (1.2) және (1.3) формулаларынан келесі формуланы шығарамыз:
Вменш=3/r*ρ немесе Вменш =6/а*ρ (1.4)
Меншікті бет майдалық (Д) түсінігімен байланысты. Д бөлшектер мөлшеріне кері шама:
Д=1/а (1.5)
Сфера тәрізді бөлшектерде а шамасы осы бөлшектер диаметріне тең. Майдалық, меншікті бет сияқты бөлшектер мөлшеріне кері пропорционал. м2/кг өлшеміндегі меншікті бетті майдалық арқылы көрсетуге болады:
Вменш=6Д/ρ (1.6)
Меншікті бет бөлшектер мөлшерінің беттік құбылыстарға әсерін анықтайды.
Бөлшектерден басқа фаза жіптерден, талшықтардан, кеуектерден, пленкалардан түзілуі мүмкін. Олардың меншікті беттерінің айырмашылықтары келесітүрде көрсетіледі:
Вменш=В/М (1.6 а)
мұндағы В,М - майдалық фазаның ауданы мен массасы; а,L - цилиндр диаметрі және биіктігі; ρ - майдалық фаза затының тығыздығы.
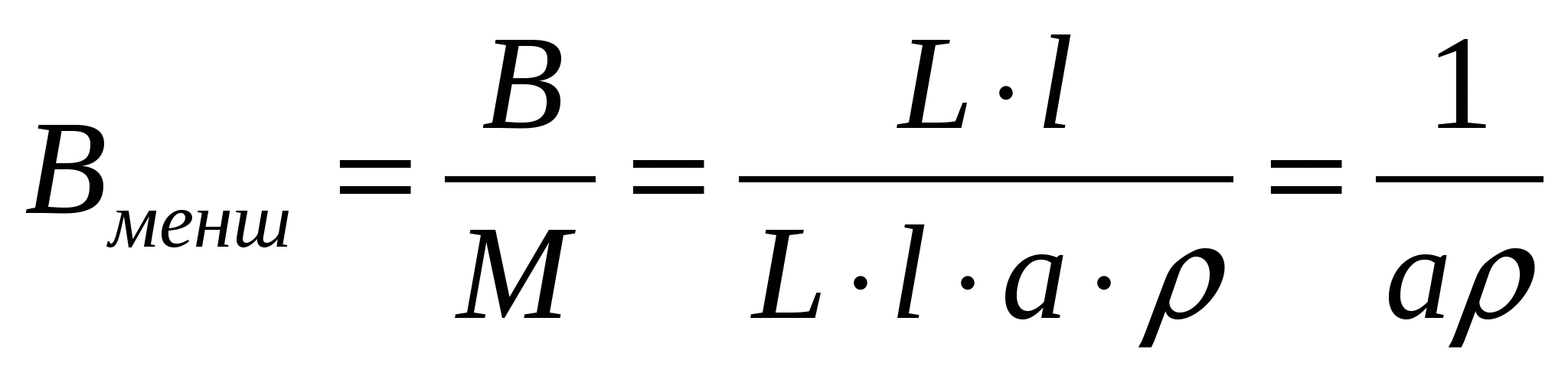 кг/м2, (1.6, б)
кг/м2, (1.6, б)
Майдалық жүйелерді келесі белгілер бойынша жіктеуге болады:
-
Майдалық фаза мен майдалағыш ортаның жентекті күйі;
-
Бөлшектер мөлшері және бөлшектердің мөлшері арқылы майдалық фазада орналасуы;
-
Майдалық фаза түрі;
Майдалық жүйелердің қасиеттері майдалық фазаның концентрациясы мен бөлшектер мөлшерінің диапазонымен анықталады. Сандық (ν), көлемдік (νк), массалық концентрацияларды айырады.
Сандық (есептік немесе бөлшектік) концентрация майдалық фазаның N бөлшектер санының майдалық майдалық жүйенің Vм.ж. көлем бірлігіне қатысымен анықталады. Ол бір метр кубтегі бөлшектер санын көрсетеді:
ν=N/Vм.ж. (1.7)
Массалық концентрация - майдалық жүйе көлемінің бірлігіндегі Мм.ф. майдалық фаза массасын сипаттайды:
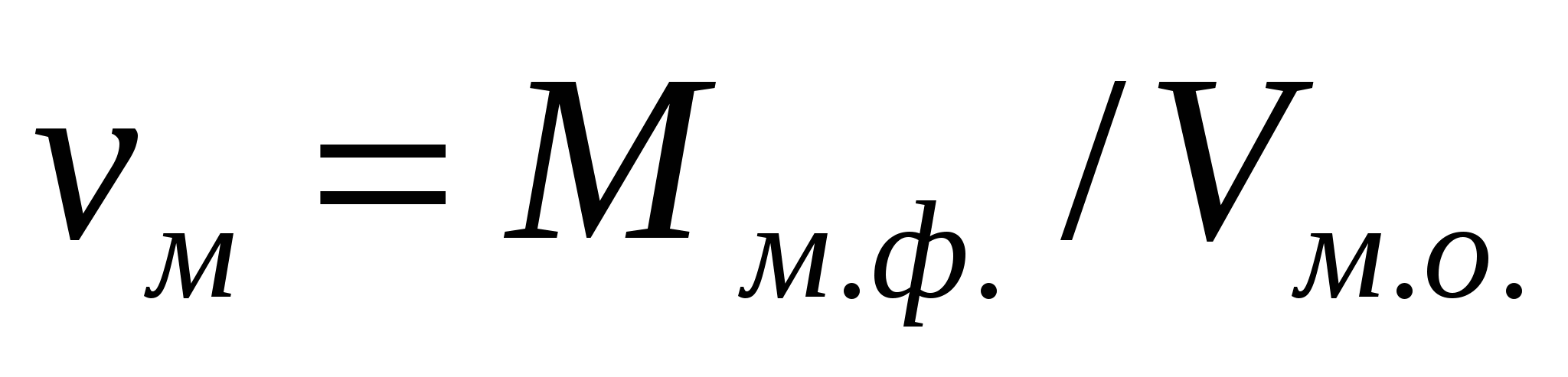 , кг/м3. (1.8)
, кг/м3. (1.8)
Көлемдік концентрация - өлшемсіз шама, ол майдалық жүйенің қай бөлігі майдалық фазаның көлемін алатындығын көрсетеді: 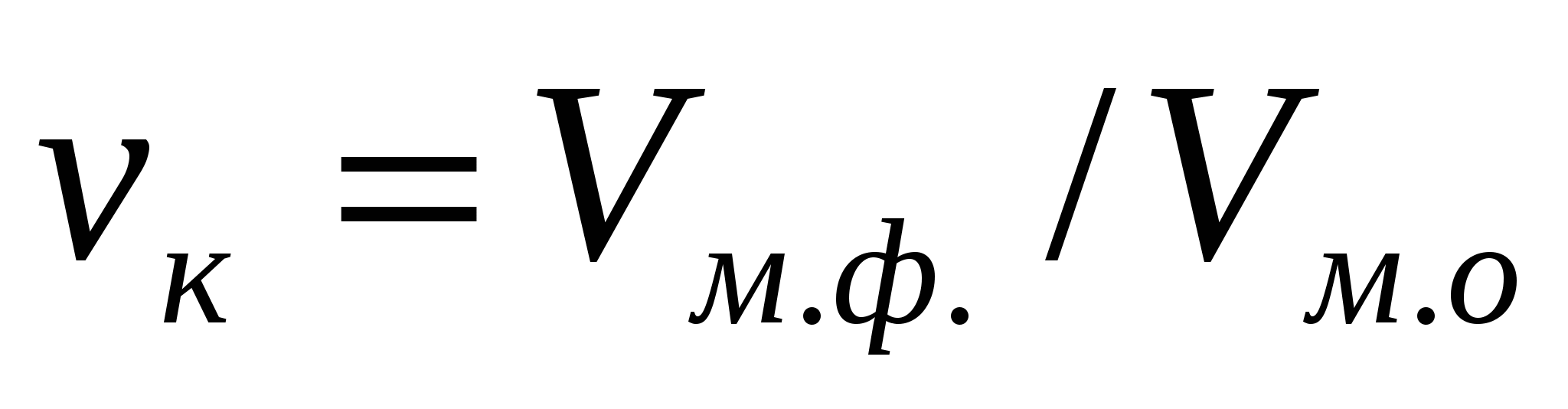 , немесе
, немесе 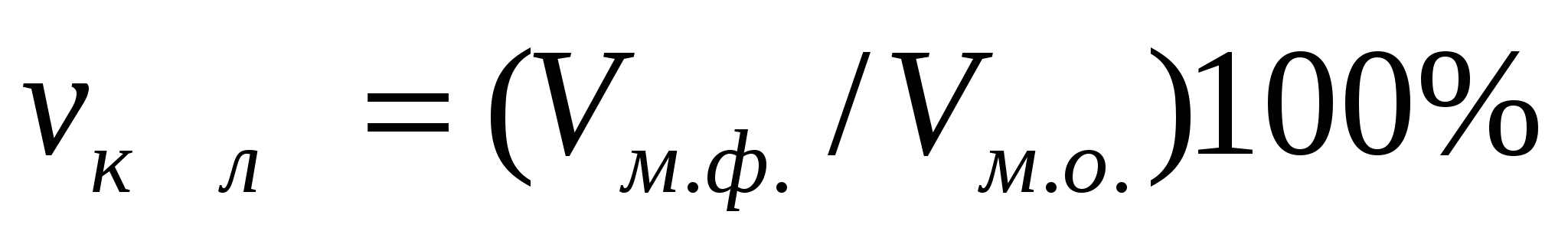 (1.9)
(1.9)
Сандық концентрацияны массалық концентрацияға айналдыру үшін келесі мәнерді қолданамыз:
![]() , (1.10)
, (1.10)
мұндағы V1, ρ - бір бөлшектің көлемі мен бөлшек материалының тығыздығы.
Жүйелер мономайдалық және полимайдалық жүйелер болып ажыратылады.
Мономайдалық жүйелер бір мөлшерлі бөлшектерден тұрады. Мұндай жүйелер сирек кездеседі. Майдалық жүйелердің көбі полимайдалық жүйелерге жатады. Олар әртүрлі мөлшерлі бөлшектерден тұрады.
Жаттығулар.
1-есеп.
Соустарда май эмульсиясының тамшыларының диаметрі дайындалу әдісі бойынша қолмен былғау кезінде - 20 мкм, машинамен араластырғанда - 4мкм болады. Майдалығын, майдалық фазаның меншікті бетін, оған коса тығыздық масса 1,14*103 кг/м3 болған кездегі осы шамалардың қатынасын анықтау керек.
Шешуі:
(1.5) формуласымен майдалықты табамыз:
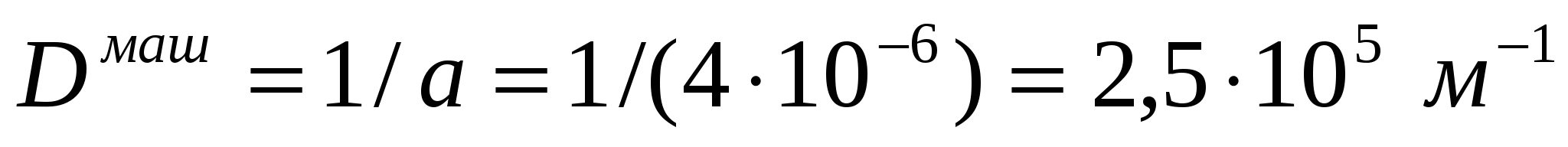
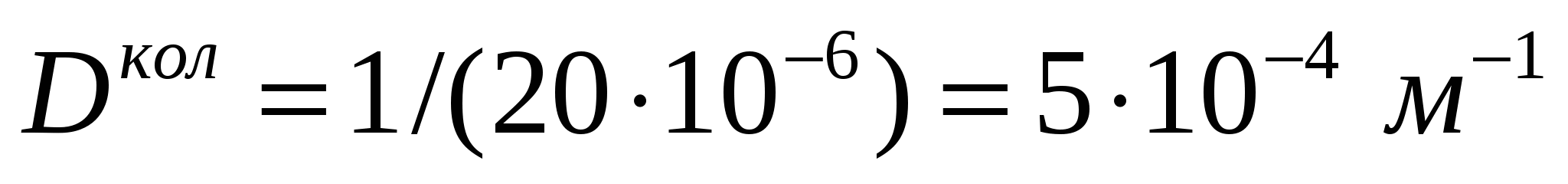 .
.
Вменш=6Д/ρ формуласымен майдалық фазаның меншікті бетін таба- мыз:
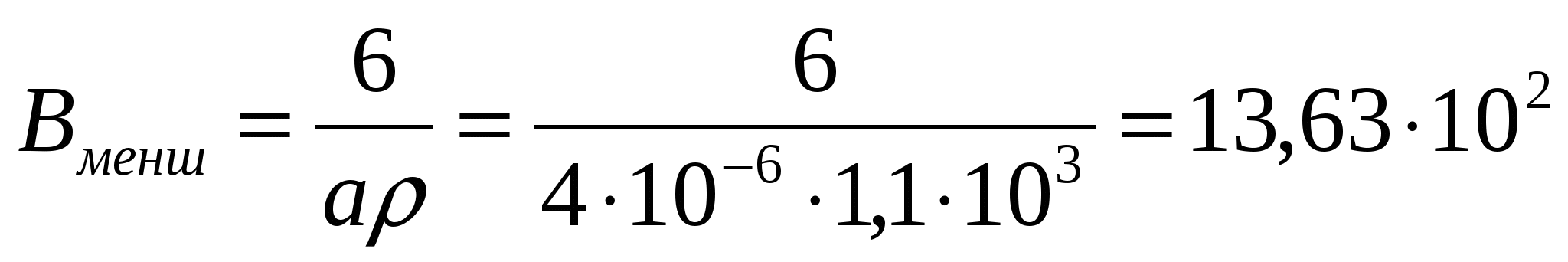 м2/кг;
м2/кг;
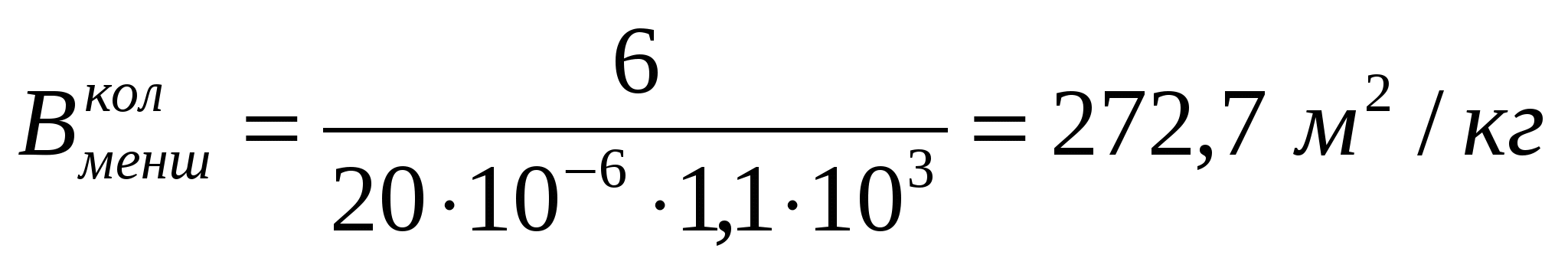 ;
;
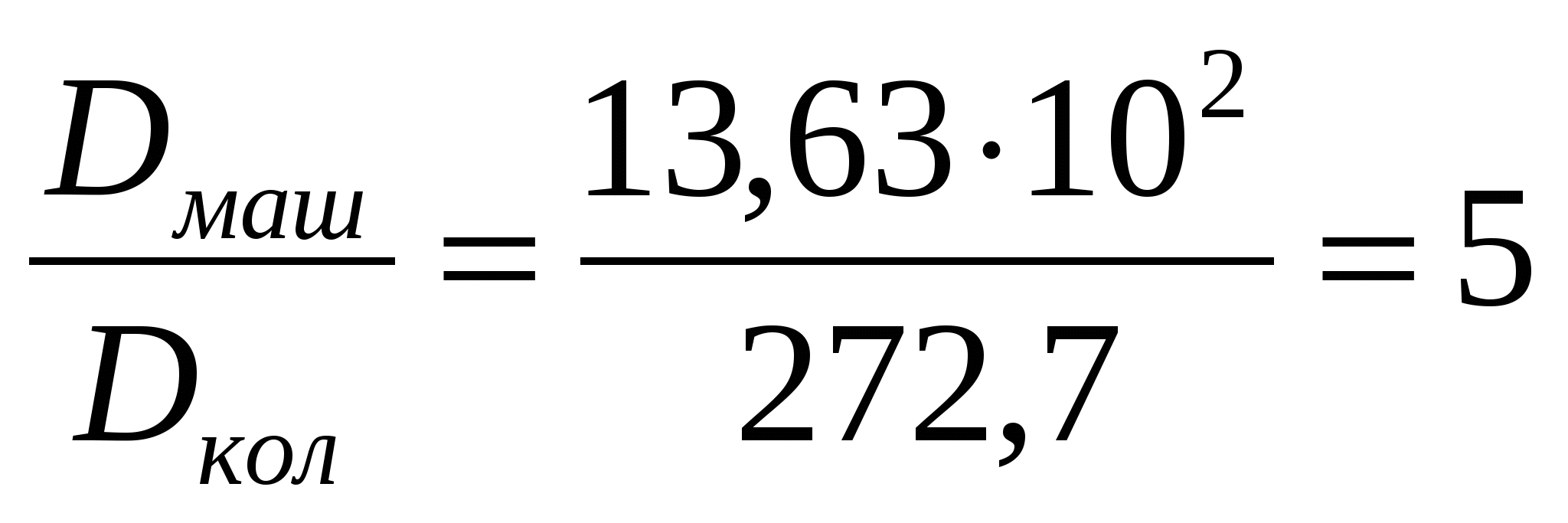 ;
; 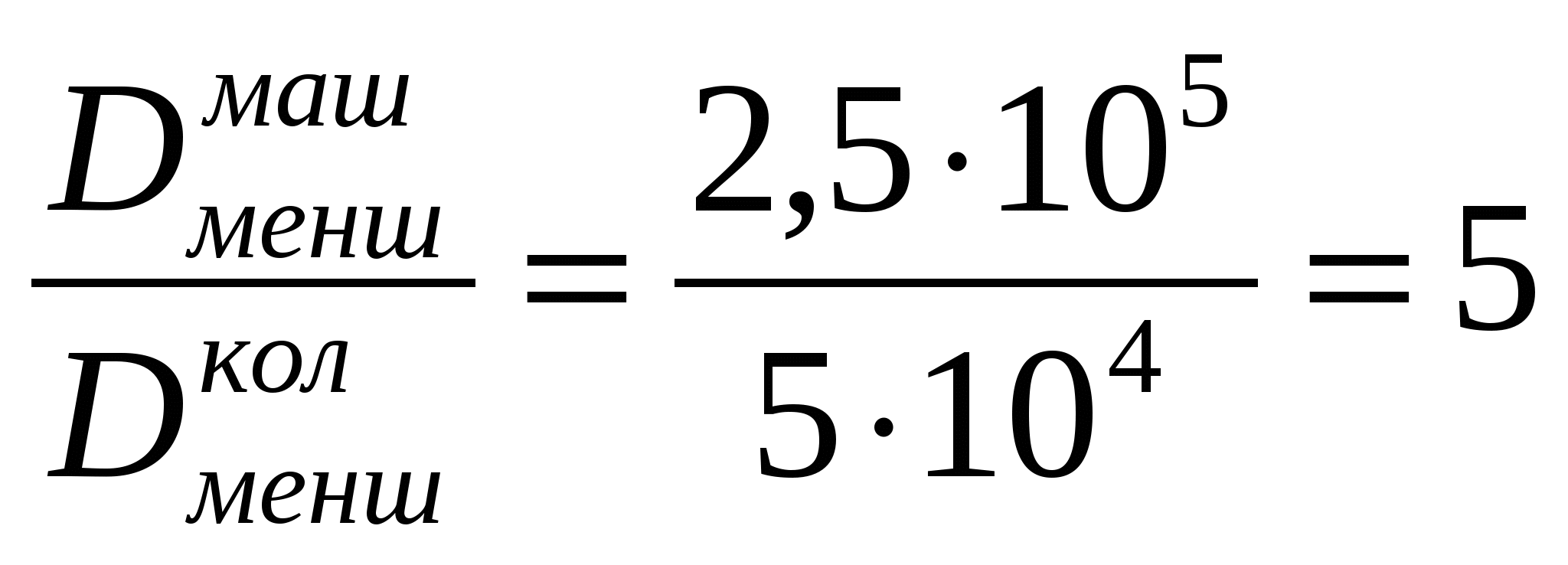 .
.
2-есеп.
Сүттің майлылығы 3,2%, сыйымдылығы 1 литр болатын сүт ыдысының майдалық фазасының көлемін, майдалық фазасының сандық концентрациясын анықтау қажет. Май тамшысының диаметрі 85мкм болса, бір метр кубке есептегендегі сандық концентрацияның мәні қанша?
Шешуі:
Майдың майдалық фазасының көлемі (1.9) формуласымен 32*10-6м3 болады. 1литр сүттегі май бөлшектерінің N1 санын былай анықтауға болады: N1=Vм.ф./V1, V1 - бір бөлшектің көлемі (4/3πr3). Сонда:
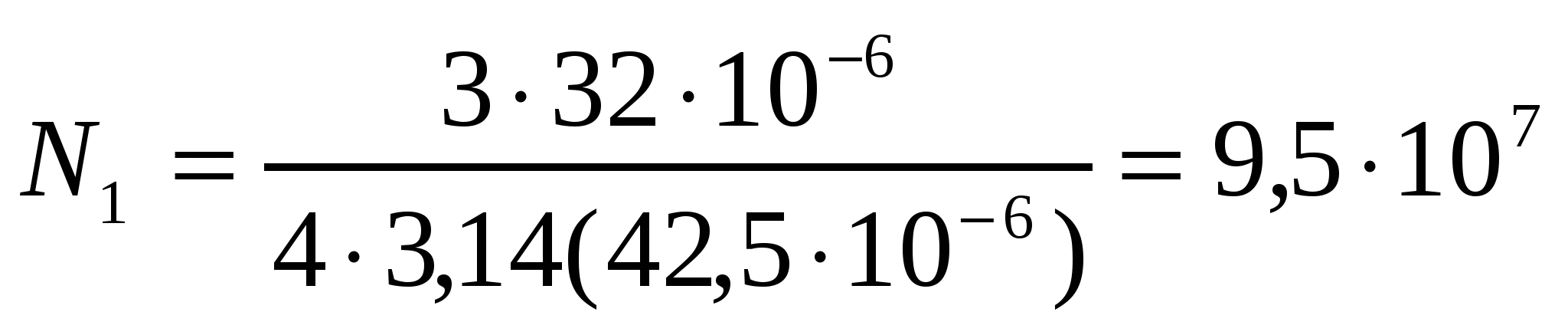 .
.
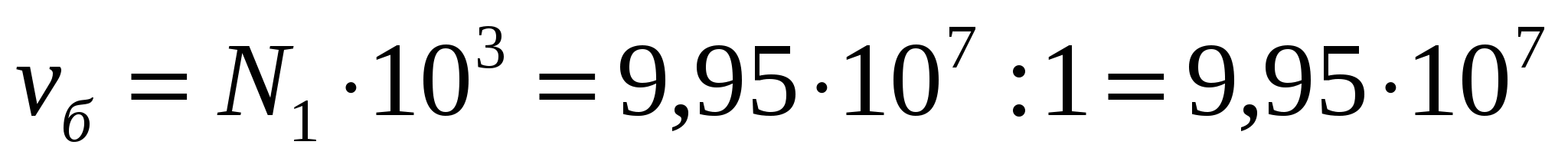 м-1.
м-1.
3-есеп.
Жұмыс ғимаратының аймағындағы ауадағы шаңның массалық концентрациясы 4,2 мг/м3. Егер бөлшектің орташа диаметрі 3,7 мкм, тығыздығы 1,1*103кг/м3 болғандағы шаңның массалық концентрациясын анықтау қажет.
Шешуі:
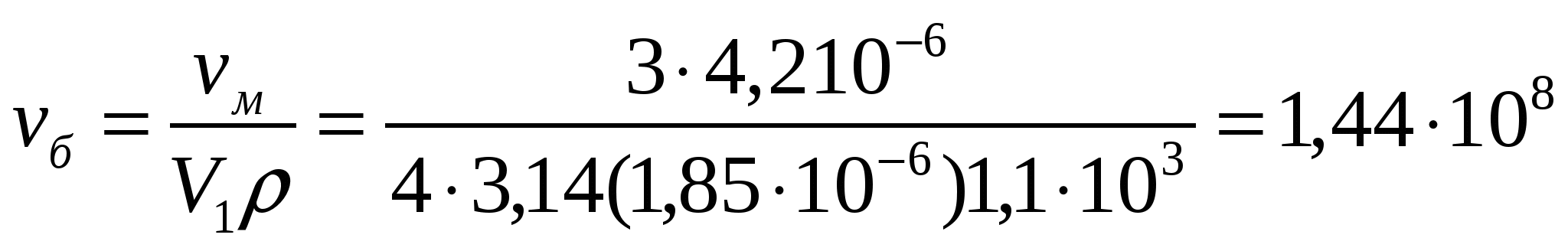 м-3
м-3
1м3 ауа құрамында 144 млн бөлшек бар.
4-есеп.
Бөлшек пен цилиндр диаметрі және пленка қалыңдығы 10 мкм, майдалық фаза затының тығыздығы 1,5*103кг/м3 болғандағы бір өлшемді, қос өлшемді, үш өлшемді майдалық фазаның меншікті бетін есептеу керек.
Шешуі:
Бір өлшемді жүйе (бөлшек) үшін: 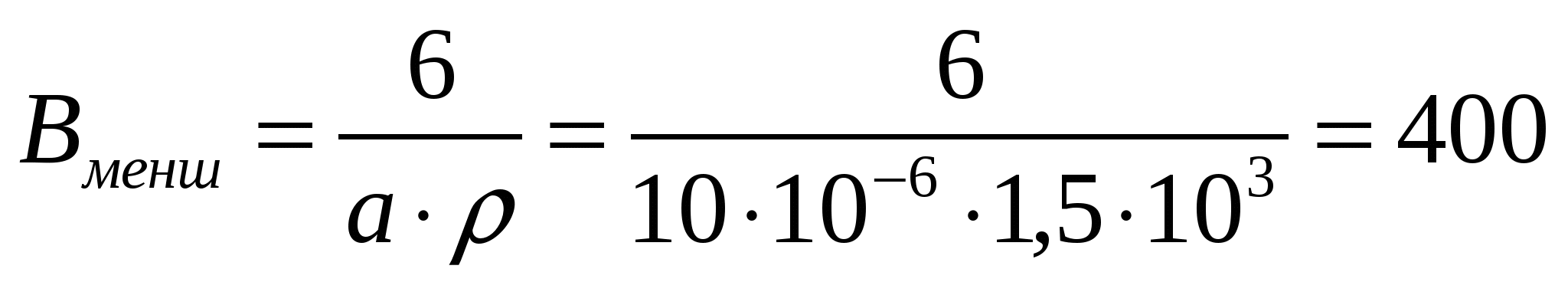 м2/кг,
м2/кг,
Қос өлшемді жүйе (цилиндр) үшін: 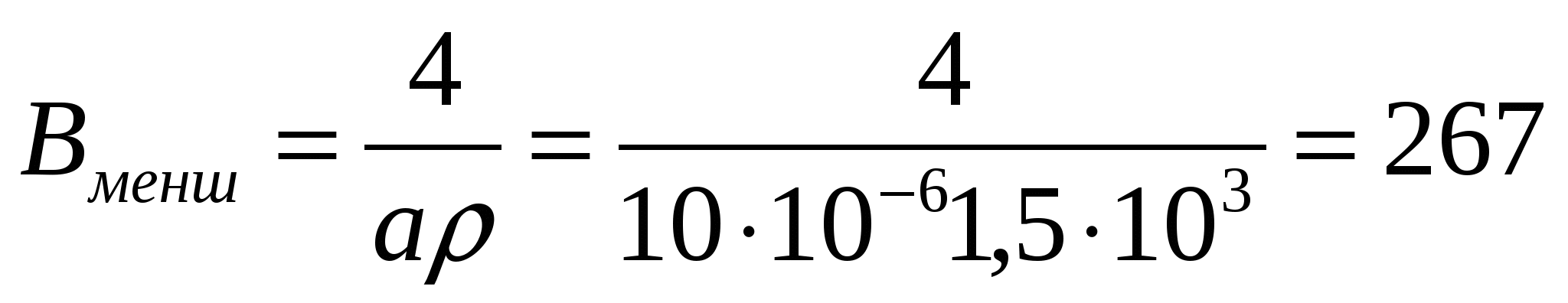 м2/кг,
м2/кг,
Үш өлшемді жүйе (пленка) үшін: 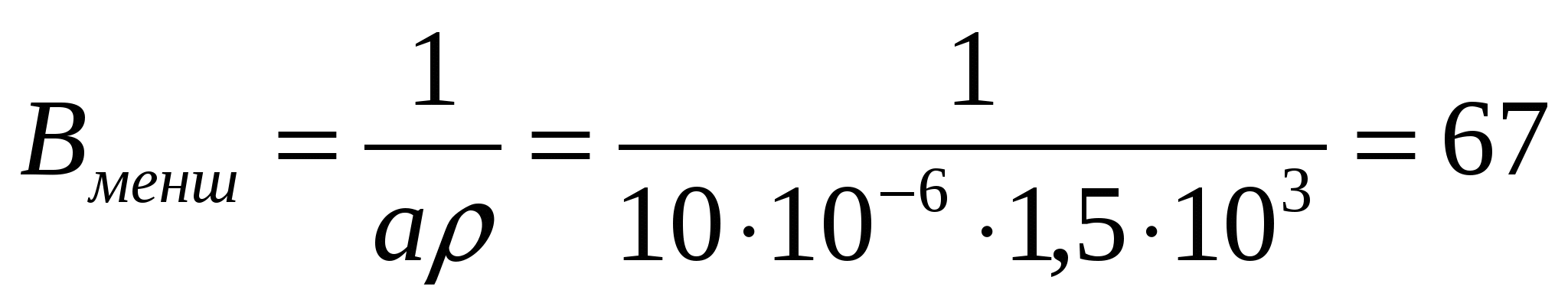 м2/кг
м2/кг
Берілген жағдайда максималды меншікті бет - үш өлшемді, минималды - бір өлшемді жүйе үшін тән.
2.Беттік энергия және беттік құбылыстар.
Фазаның бөліну бетінің айырмашылықтарымен байланысты құбылыстар - беттік құбылыстар деп аталады.
Майдалық жүйелердің қасиеттері майдалықпен, гетерогенділікпен, беттік энергиямен байланысты. Беттік энергияның пайда болуының себебін, беттік құбылыстарға тигізетін әсерін анықтау үшін химиялықтермодинамикаға жүгінеміз.
Бөліну бетіндегіеркін беттік энергияны термодинамиканың бірінші және екінші бастаулары негізінде Гиббс энергиясының өзгеруі түрінде көрсетуге болады:
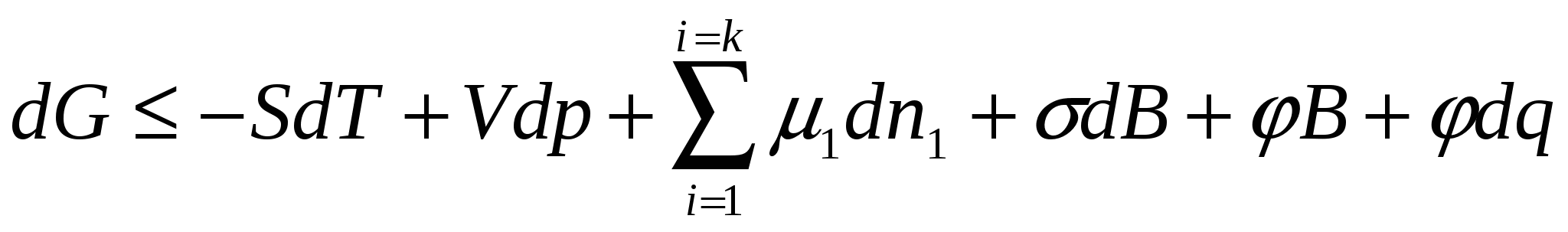 (2.1)
(2.1)
мұндағы S - энтропия; dT, dP - температура және қысымның өзгеруі; V - көлем; σ - беттік керілу; dB - фазаның бөліну бетінің өзгеруі; μі, nі - і компоненттің химиялық әлуеті мен моль саны; φ,q - бетің электрлік әлуеті мен заряды.
Изобарлы-изотермиялық процесс жағдайында (dT=0, dP=0) шекаралас фазалардың физико-химиялық және электростатикалық әрекеттесуі болмағанда (d nі=0, d q=0) (2.1) формуласынан келесі түрді шығарамыз:
![]() (2.2)
(2.2)
Көп құрауышты жүйелер үшін қос беттік керілу мәнерінің айырмашылығын, мысалы, сулы ерітінділер үшін термодинамикалық түсініктер негізінде бейнелеуге болады. (2.2) жағдайына сәйкес Гиббс энергиясының өзгеруі барлық фазаның бөліну бетіне қатысты қарастырылады. Мұндай өзгерісті GB аудан бірлігіне есептегенде келесі түрде көрсетуге болады.
G = GB*B (2.3)
Майдалық жүйелерде тегіс бетке қарағанда бөлшектер бетінің қисықтығы болады. Сұйық майдалық фаза бетінің қисықтығы арқасында артық ішкі (∆Р) қысым пайда болады. Ол бөлшек ортасына бағытталған және оның бетіне перпендикуляр. Нәтижесінде дененің көлемі dV шамасына азаюына әкелетін dW жұиысы атқарылады:
dW = ∆Р*dV (2.4)
мұндағы ∆Р - артық ішкі қысым.
Беттік энергияның өзгеруін Гиббс энергиясы арқылы көрсетуге болады. Теңдік (dF=0) және басқа параметрлердің тұрақтылық (dt=0, dnі=0, dq=0) жағдайында (2.4) қатынасын ескеріп келесі түрді шығарамыз.
∆Р = σ *( dB/dV) (2.5)
мұндағы dB/dV - беттің қисықтығы, сфера тәрізді бөлшектер үшін радиусқа кері шама, яғни dB/dV= +2r немесе dB/dV= -2r ("+" қайқы бет, "-" дөңес бет). Осыны ескере (2.5) формуласын басқаша жазуға болады:
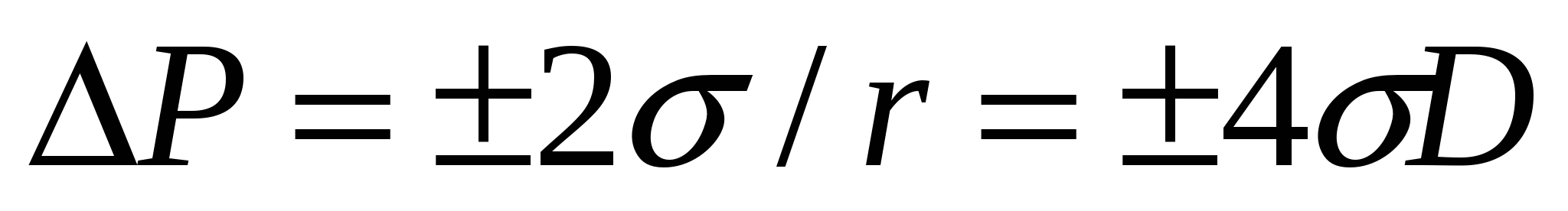 , (2.6)
, (2.6)
мұндағы Д - майдалық, м-1.
(2.1) теңдігінен бастап dT=0, dB=0, dq=0 жағдайында жеке дара заттар үшін V=VM (VM - мольдік көлем) болғанда келесі теңдікті аламыз:
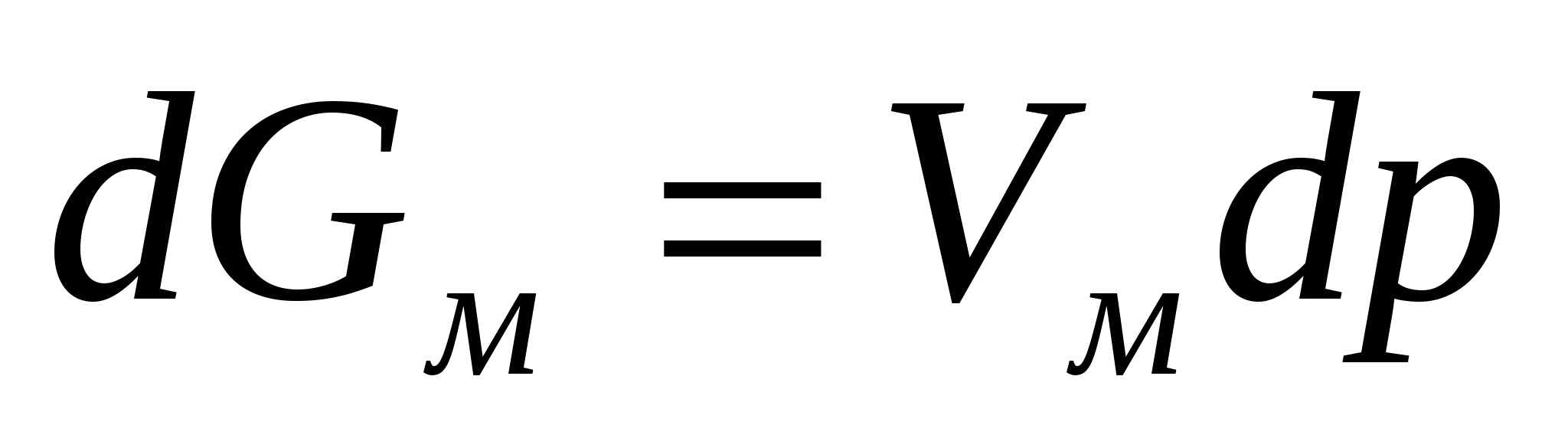 немесе
немесе 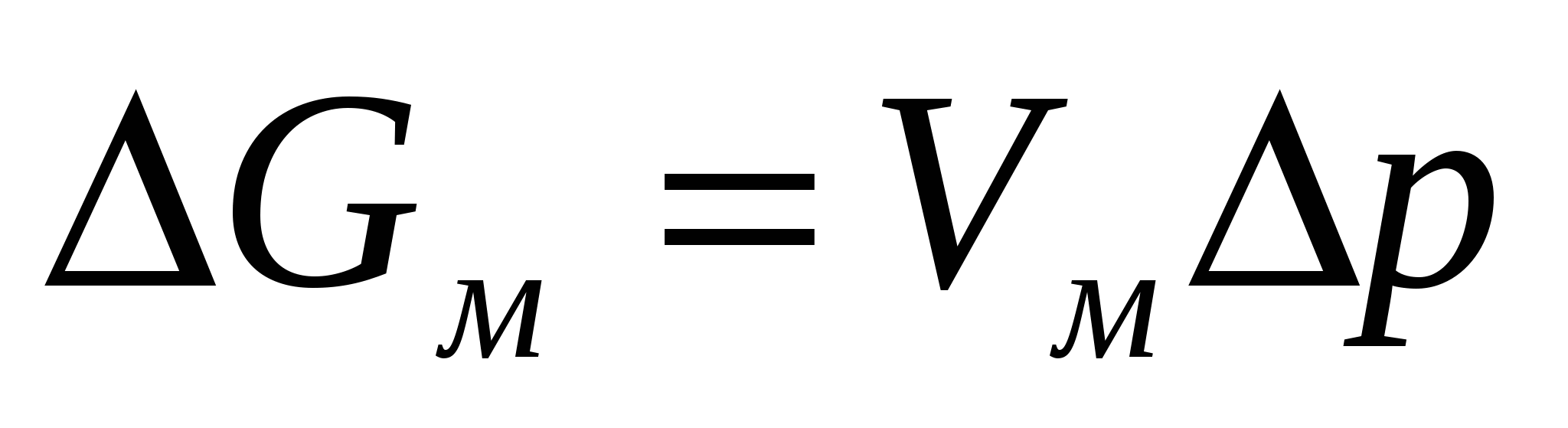 . (2.7)
. (2.7)
(2.6) теңдігін қолдансақ (2.7) формуласынан келесі жағдайды алуға болады:
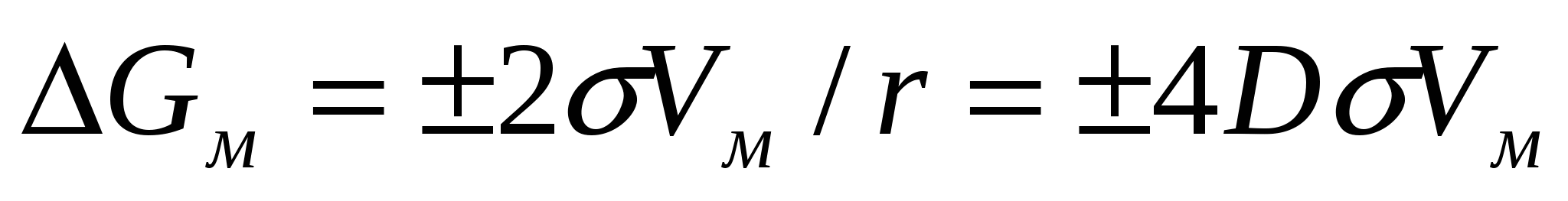 . (2.8)
. (2.8)
∆GM шамасы дөңес бет қисықтығы есебіне Гиббс энергиясының қаншаға өскенін көрсетеді. Гиббс энергиясының өсуін майдалық фазаның бөлшектену нәтижесінде, яғни беттің қосымша артық беттік энергия алғанда көрсетуге болады. Бұл жағдай барлық беттік құбылыстардың қарқындылығына әсер тигізіп, өздігімен жүретін процестердің өтуіне ықпал жасайды.
Жаттығу.
Есеп.
Ауданы 0,65*10-3 м2 болатын ұсақталмаған майонез массасына қарағанда 1 кг майонездегі тамшылардың беттік еркін энергиясы қалай өседі? Диаметрі 35 мкм болатын майонездің май фракциясының тамшылары үшін ішкі қысым және өсімді Гиббс энергиясының мәні неге тең?
Шешуі:
Майонез тамшыларының меншікті беті: 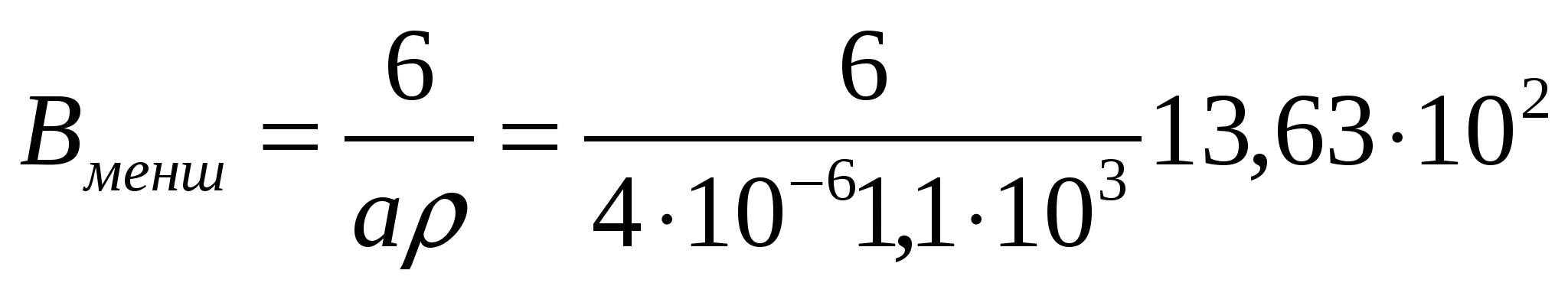 м2/кг;
м2/кг;
Тамшылардың беті ұсаұталмаған бетке қарағанда n рет өседі:
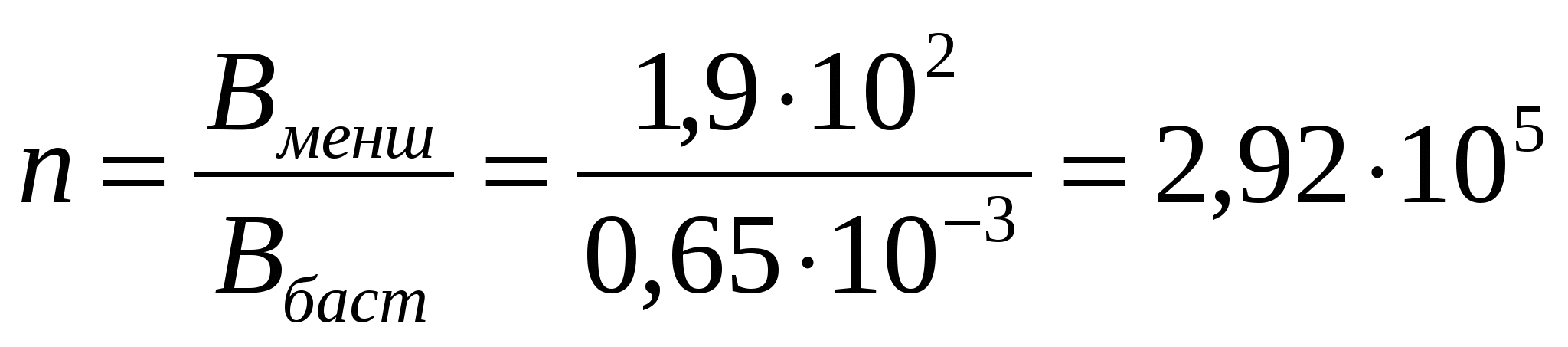 ;
;
ішкі қысым: 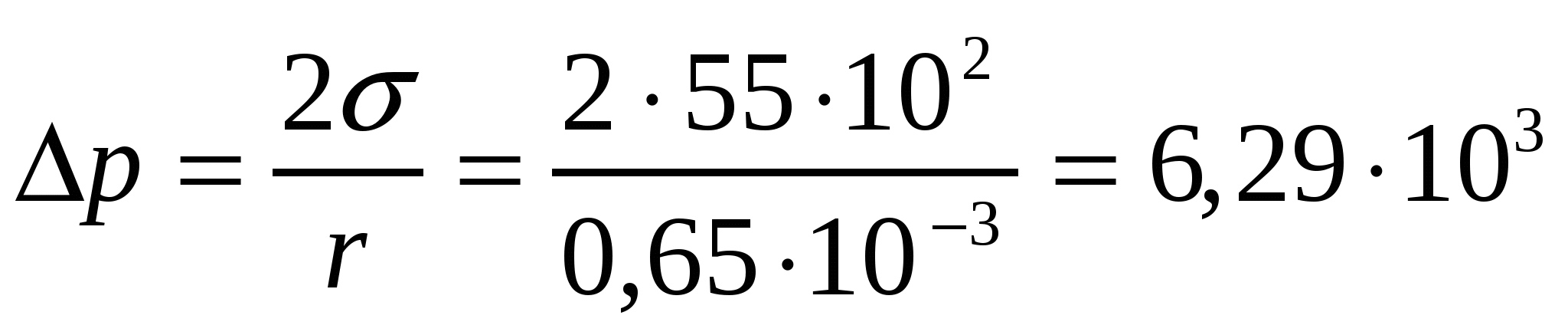 Па = 6,29 кПа.
Па = 6,29 кПа.
Тамшы қисықтығына байланысты өсімді Гиббс энергиясын анықтай- мыз:
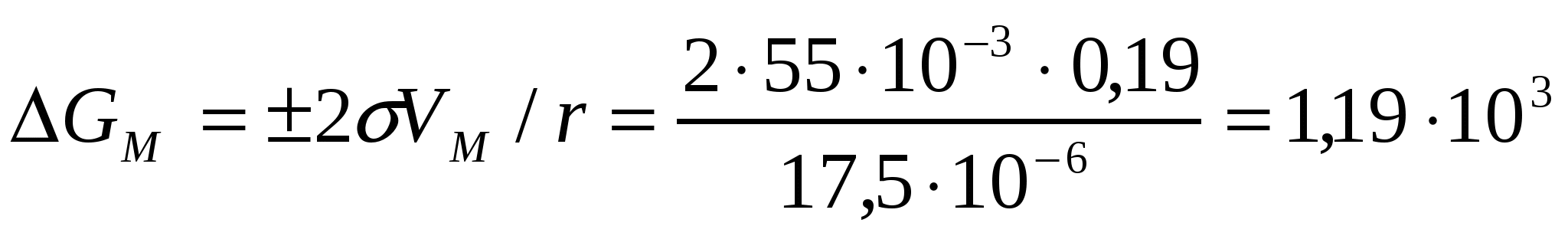 кДж/моль
кДж/моль
3.Адгезия.
Адгезия (жабысу) - көп тараған құбылыс. Адгезия әртекті жабысқан денелердің молекулалық жақындасу (контактілеу) кезіндегі әсерлесу нәтижесінде пайда болады. Адгезия техникалық құрылғылардың өнімділігіне әсерін тигізіп, лакбояғыш жабын сапасын анықтайды.
Сұйық, борпылдақ (сусымалы), серпімді тұтқырлы пластикалық массалар жоғары адгезиялы болып келеді. Оларға қамыр, битумдар, асфальт массасы және т.б. жатады.
Адгезия - өз еркімен жүретін құбылыс. Ол беттік энергияның төмендеуіне әкеліп соқтырады. Адгезия мен сұйықтықтың сулануы адгезиялық әсерлесудің бір түріне жатады. Олардың айырмашылықтары қатты беттің қасиеттерімен анықталады және жеңіл өлшенетін шамалар арқылы мөлшерлі түрде сипатталуы мүмкін.
Сұйықтық, құрылымдық массалар, бөлшектер мен пленкалардың адгезиясының жалпы ұқсастығы бар. Барлық жағдайларда бұл бұзылуы үшін сыртқы әсер керек болатын фазаның бөліну шекарасындағы әртекті жабысқан денелер арасындағы байланыс.
Жоғарыда айтылғандай адгезия өз еркімен жүретін беттік құбылыс. өз еркімен жүретін процестер беттік энергияның төмендеуімен байланысты. Берілген жағдайда ол Гиббс энергиясы. Гиббс энергиясын фазаның бөліну бетінің бірлігіне қатыстыруға болады. Онда өз еркімен жүретін процесс үшін ∆GM<0 жағдайы орындалады.
Тепе-теңдік қайтымды процесс үшін адгезия жақындасқан денелерді айыру үшін жұмсалған Wa жұмысымен бағаланады. Адгезия нәтижесінде меншікті еркін беттік энергия адгезия жұмысын сипаттайтыншамаға төмендейді. Адгезия жұмысы меншікті еркін беттік энергия сияқты, беттік керілу арқылы жақындасқан қос дене беті ауданының бірлігіне есептеумен анықталады. Егер ол адгезия нәтижесінде σ12 -ге тең болса, алгезиялық әсерлесуден кейін келесі нәтижеге тең болады: σ12 + σ23
Адгезияның тепе-теңдік жұмысы соңғы және бастапқы беттік керілу нәтижесінің мәндері айырмасына тең, яғни:
Wa= (σ13 + σ23) - σ12 (3.1)
мұндағы σ12, σ13, σ23 1 және 2 денелерінің 3 ортасының шекарасындаңы адгезияға дейінгі, адгезиядан кейінгі беттік керілулер.
(3.1) теңдігі көмегімен кез келген жабысқан тепе-теңдік адгезия жұмысын анықтауға болады. (3.1) теңдігі жақындасқан денелердің арасында электрлік және химиялық әсерлесу болмайтын изобарлы-изотермиялы процестер үшін ғана қолданбалы. Осы шектеулерді біле тұрып, қатты денелердің беттік керілуін тәжірибелі түрде анықтау қиын екенін ескере (3.1) теңдігін тек сұйықтықтың тепе-теңдік адгезия жұмысын анықтауға қолданылатынын айта кеткен жөн. Тепе-теңдік адгезия жұмысын тепе-теңдік когезия жұмысымен салыстыруға болады.
Дене когезиясының бұзылуынан кейін ортамен жанасатын қос бет түзіледі. Тепе-теңдік когезия жұмысы түзілген қос беттің беттік керілуінің екі еселенген нәтижесіне тең, яғни:
WК = 2σ12 (3.2)
Ауа ортасында сұйықтықтың когезиялық біртұтастылығының бұзылуы болса, тепе-теңдік когезия жұмысы:
WК = 2σc.г. (3.3)
(3.3) теңдігінің 3.3) теңдігімен сәйкес шектеулері бар.
Сұйықтық адгезиясы сұйықтық пен қатты беттің жақындасуы кезінде пайда болатын адгезиялық әсерлесудің бір түрі. Егер 1 дене газ ьолса, сұйыұтық адгезиясы қолданбалы (3.1) теңдігін келесі түрде көрсетуге болады:
Wa= (σқг + σc.г) (3.4)
(3.4) теңдігіне кіретін қатты денелердің беттік керілулерін тәжірибелі түрде анықтау қиын, ал газ ортасы шекарасындағы сұйықтықтың беттік керілуін анықтау айтарлықтай жеңіл. Сондықтан сұйықтықтың тепе-теңдік адгезия жұмысын тәжірибелі түрде анықталатын шамалармен көрсетеді. Осындай бір шама газ ортасындағы сұйықтықтың беттік керілуі болып табылады.
Контактілік сулану кезіндегі қатты беттегі сұйықтық тамшысының орнын келесі фазалар шекарасындағы беттік керілудің мәндері анықтайды: сұйықтық - газ σc.г , қатты дене - газ σқг , қатты дене - сұйықтық σқс . тамшының қатты денемен жақындасуының периметрінде векторлар түрінде көрсетілген үш беттік керілудің бір мезгілде әсері тамшы тепе-теңдігін анықтайды. Беттік керілулер сәйкес бетке жанамалы бағытталған. Екеуі (σқг және σқс) қатты дене бетімен қарама-қарсы бағытталған. Газ ортасымен сұйықтық шекарасындағы беттік керілу σc.г жақындасу ауданына белгілі бір бұрышпен өтеді. Бұл бұрыш қиыр суланубұрышы деп аталып θ арқылы белгіленеді. Кейде қысқаша "қиыр бұрыш"деп аталады. Қиыр бұрыш үш фазаның бөліну шекарасындағы беттік керілулермен байланысты. Сұйықтық адгезиясын сипаттайтын негізгі шамалардың арасында байланыс орнату үшін сұйықтық тамшысының қатты беттегі тепе-теңдігін қарастырайық.
Тепе-теңдік жағдайында σc.г беттік керілуін σқс мен σқг беттік керілулердің бағыты мен ауданына сәйкес оське кескіндейміз.
σқг = σқc + σсг cosθ (3.5)
өзгерістер жасағаннан кейін:
σсгcosθ = σқг - σқс (3.6)
cosθ = (σқг - σқс)/ σсг (3.7)
σқг қатты дененің беттік керілуімен және σқс (σқг - σқс) арасындағы айырым (3.6) жағдайына сәйкес σсг cosθ. (σқг - σқс) айырмасының мәнін (3.6) теңдігінен (3.4)теңдігіне қоямыз. Нәтижесінде сұйықтық адгезиясының тепе-теңдік жұмысын анықтайтын формуланы шығарамыз:
Wa= σсг (1+ cosθ) (3.8)
Осыған ұқсас түрде бөлшектің көпіршікке деген адгезияның тепе-теңдік жұмысын анықтауға болады (қатты дене - газ бөліну шекарасында). Айырмашылығы cosθ мәнінің терістілігінде.
Жаттығу.
Есеп.
Беттік керілуі 30 мДж/м2 болатын 0,1 пайыздық сахароза эфирлерінің ерітіндісінің когезия мен адгезия тепе-теңдік жұмысын, көпіршікке деген адгезия жұмысын анықтау қажет. Қатты бетке суланудың қиыр бұрышы 150.
Шешуі:
Тепе-теңдік когезия жұмысы: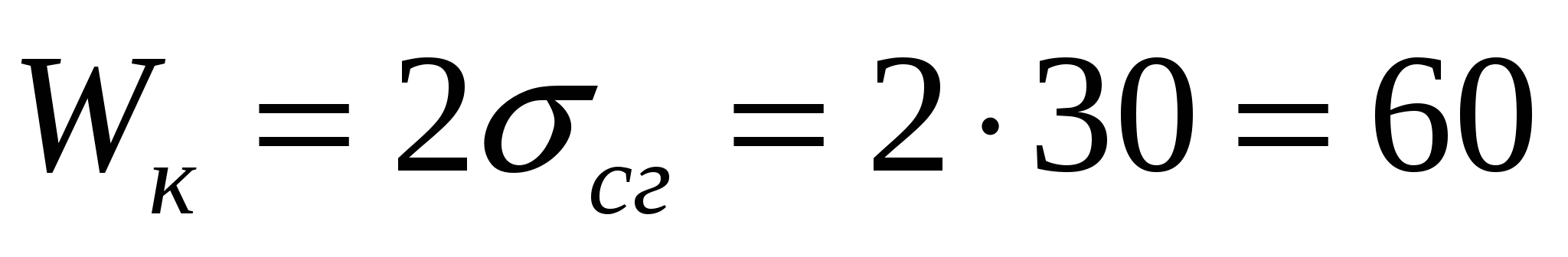 мДж/м2
мДж/м2
Тепе-теңдік адгезия жұмысы:
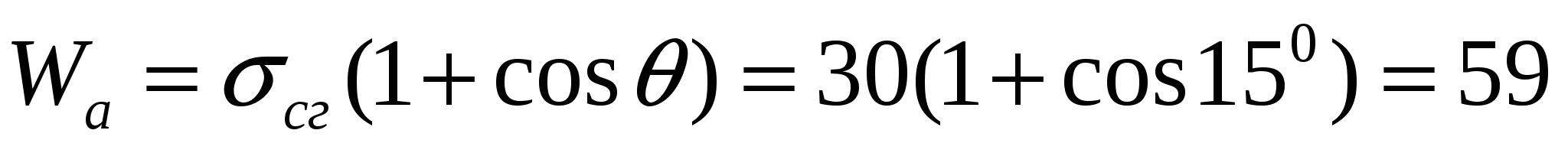 мДж/м2.
мДж/м2.
Бөлшектің көпіршікке деген адгезияның тепе-теңдік жұмысы: 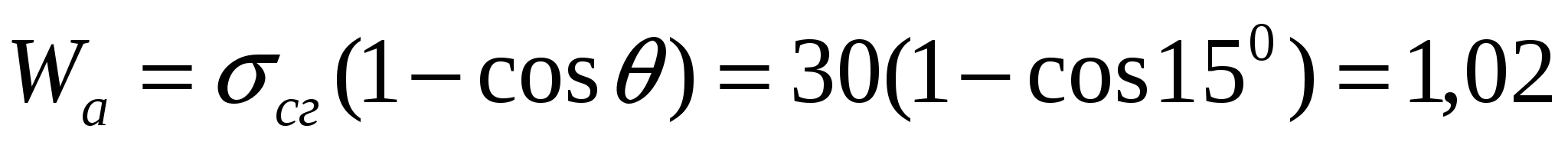 мДж/м2
мДж/м2
4. Адсорбцияның негізгі заңдылықтары.
Адсорбция сұйық және газ орталарын тазартқанда, айырғанда, концентрлегенде қолданылатын кең тараған құбылыс. Адсорбциялық процестердің әртүрлілігін, айырмашылығын түсіну үшін олардың жалпы заңдылықтарын қарастыру керек.
Адсорбция теориясында негізгі орынды адсорбция мен беттік энергияның өзгерісін байланыстыратын іргелі Гиббс теңдігі алады.
Адсорбцияны абсолютті және артық шамалар арқылы көрсетеді.
Абсолютті адсорбция (А) - адсорбент беті бірлігіндегі адсорбат саны (мөлшері). Ол адсорбаттың беттік қабаттағы СВ концентрациясының осы қабаттың n қалыңдығының мәніне көбейтіндісіне тең:
А = СВ*n (4.1)
Бастапқы беттік қабаттағы адсорбат мөлшерінің артықтылығы артық немесе Гиббстік адсорбцияны (Г) сипаттайды. Ол адсорбат мөлшерінің адсорбция нәтижесінде қаншаға өскенін көрсетеді:
Г= A - c*h = Г - N (4.2)
мұндағы с - адсорбтивтің көлемдегі тепе-теңдік концентрациясы; N - адсорбциялық қабаттағы адсорбат мөлшері (оның беттегі концентрациясы көлемдік фазадағы коцентрацияға тең).
Адсорбент бетіндегі адсорбат концентрациясы оның көлемдегі концентрациясынан әлдеқайда көп болса, яғни СВ>>C , онда N шамасын елемеуге болады.
Г= A (4.3)
Сұйықтық - газ бөліну шекарасындағы тегіс беттегі адсорбция кезінде Г және А шамалары фазаның бөліну шекарасы ауданының бірлігіне қатысты көрсетіледі, яғни Г мен А өлшем бірлігі моль/м2 болады.
Қатты, әсіресе кеуекті ұнтақ тәрізді адсорбенттер үшін адсорбцияны адсорбент массасының бірлігіне қатысты көрсетеді, яғни Г мен А өлшем бірлігі моль/кг болады. Осыған байланысты і компоненттің адсорбция шамасы:
![]() моль/м2 немесе
моль/м2 немесе 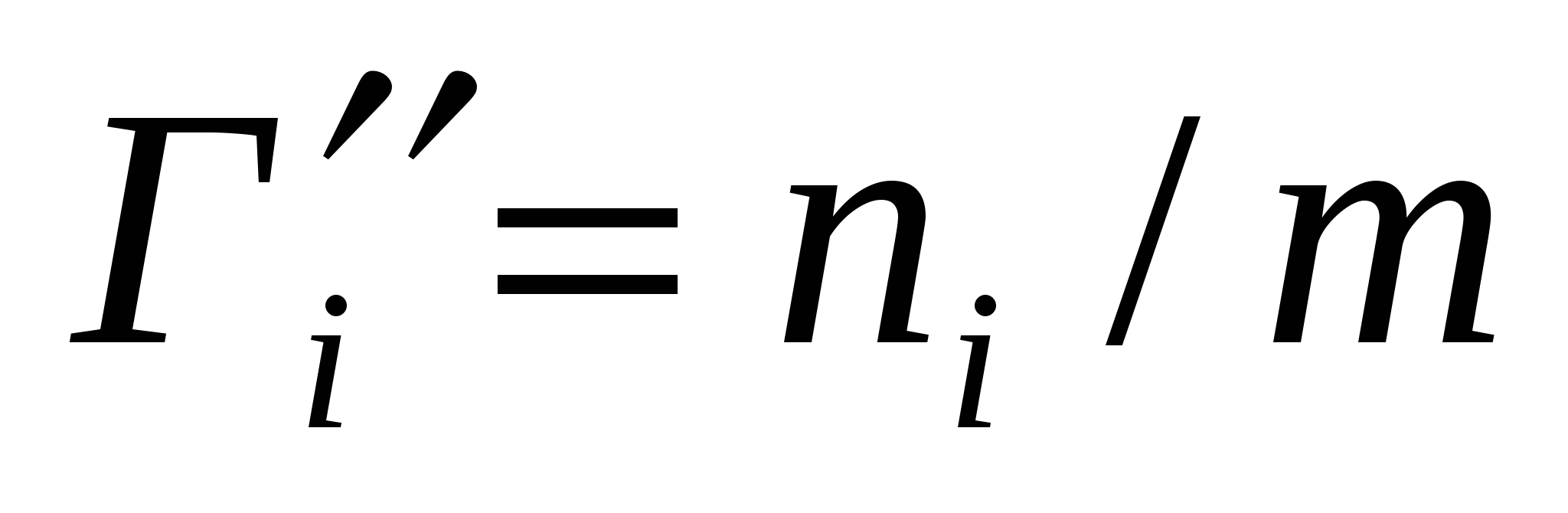 моль/кг, (4.4)
моль/кг, (4.4)
мұндағы nі - і компоненттің көлемдегі мөлшеріне қарағандағы беттегі артық моль саны; В - фазаның бөліну бетінің ауданы, м2; m - кеуекті ұнтақ тәрізді адсорбент массасы, кг.
Бір компонентің адсорбциясы (4.4) теңдігін жеңілдетеді:
Г = п/В, немесе Г' = п/т. (4.5)
Майдалық жүйелердің бөлшектелуіне байланысты меншікті бет кенет ұлғаяды. Ол адсорбат мөлшерінің айтарлықтай өсуіне әкеледі.
Адсорбция - өз еркімен жүретін беттік құбылыстарға жатады.
Фазаның бөліну бетіндегі заттардың концентрленуі адсорбция мен десорбция процестері арасында теп-теңдік орналасқанша жүреді.
Өз еркімен жүретін тепе-теңдік процесі өту жағдайларын анықтау үшін химиялық термодинамика негіздеріне жүгінеміз.
Гиибс энергиясының төмендеуі орын алған жағдайда, яғни ∆G<0, адсорбция өз еркімен жүреді. (2.1) теңдігіне сәйкес изобарлы-изотермиялық процесс үшін фазаның бөліну беті ауданының өзгеруі мен беттің заряды болмағанда:
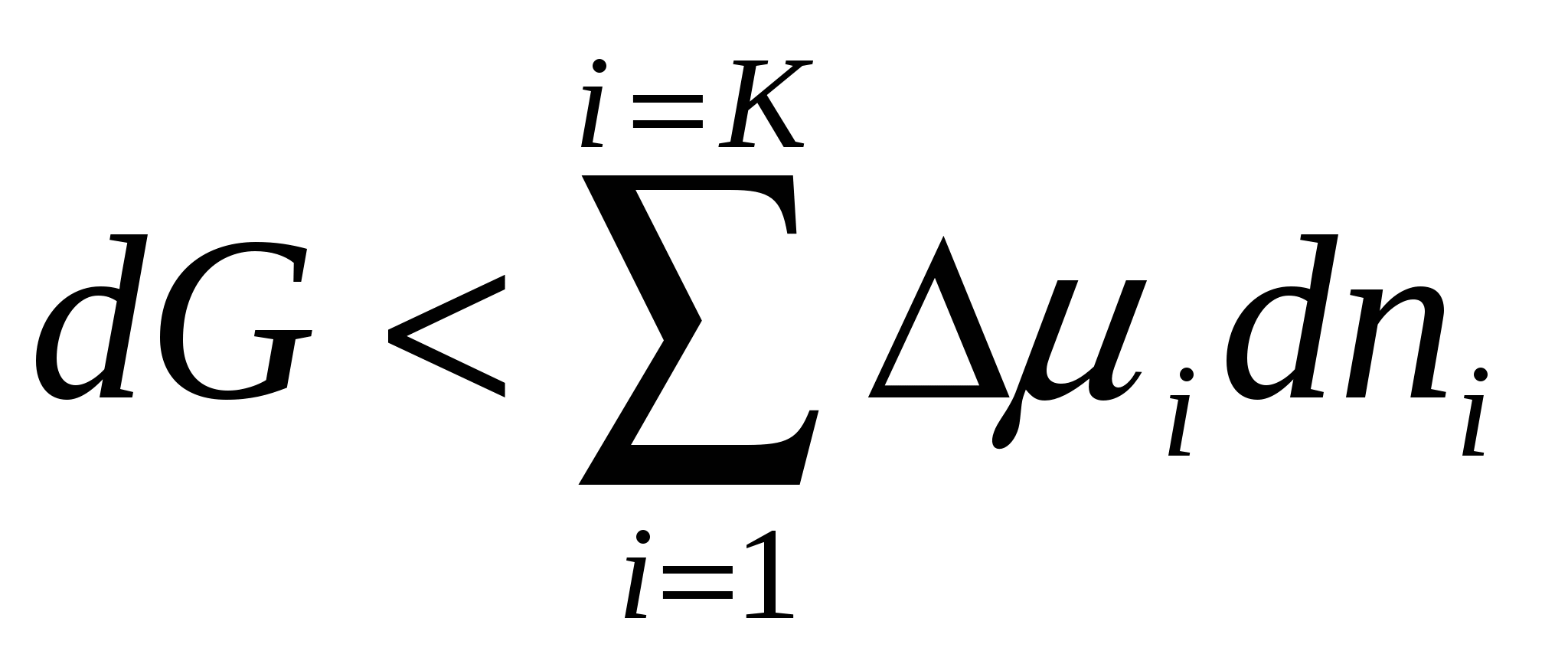 (4.6)
(4.6)
Бір компонентті жүйе үшін:
dG < dμ dni немесе ∆G <∆μ dni (4.7)
Адсорбтив көлеміндегі і компоненттің химиялық әлуетін μіV, ал адсорбент бетіндегі химиялық әлуетін μіВ деп белгілесек, (4.7) теңдігіне сәйкес Гиббс энергиясының өзгерісі келесі түрде анықталады:
∆G < (μіВ - μіV ) dni (4.8)
Өз еркімен жүретін процестерге (∆G <0) (4.8) теңдігінен келесі жағдай болады:
μіВ < μіV (4.9)
Химиялық әлует әр физико-химиялық процестердің, оның ішінде адсорбция қарқындылығының себепкер шарты. (4.9) теңдігіне сәйкес көлемдегі заттың μіV химиялық әлуеті сол заттың μіВ химиялық әлуетінен артық. Адсорбция тепе-теңдік жағдай орналғанща, яғни (4.8) теңдігіне сәйкес μіВ = μіV болғанша жүреді. Бұл жағдайда адсорбция мен десорбция жылдамдықтары теңеседі. Осыған негізделіп адсорбцияны көлемдегі концентрацияға қарағанда, фазаның бөліну шекарасындағы компоненттердің концентрациясының өсуіне әкелетін химиялық әлуеттердің теңесу процесі деп атауға болады.
Изобарлы-изотермиялық процесс кезінде (dT=0, dP=0, dq=0) барлық жүйедегі барлық компонентерді есептеп, тепе-теңдік жағдайда (2.1) теңдігінен келесі формуланы аламыз:
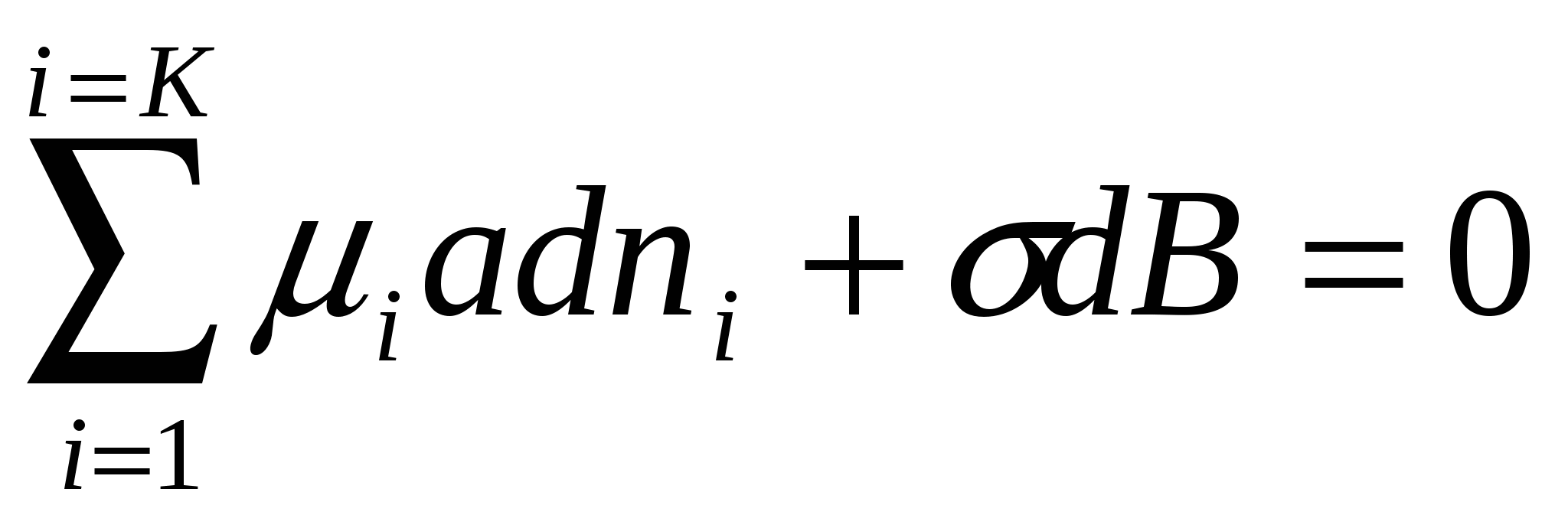 . (4.10)
. (4.10)
Бұл теңдік беттік керілуді фазаның бөліну шекарасындағы өтіп жатқан процестермен байланыстырады. Онда экстенсивті шамалар (dni және dB) дифференциал белгісінің астында тұр. Экстенсивті шамаларға қатысты бірінші дәрежелі біртекті функция үшін Эйлер теориясынқолдануға болады. Ол бұл теңдеулердің тұрақты мәндерінің (μі және σ) дифференциалдарын интегралдауға мүмкіндік береді. Сондықтан егер беткі қабат құрамы өзгермесе, В мен nі соңғы мәндеріне сәйкес келесі түрде жазуға болады:
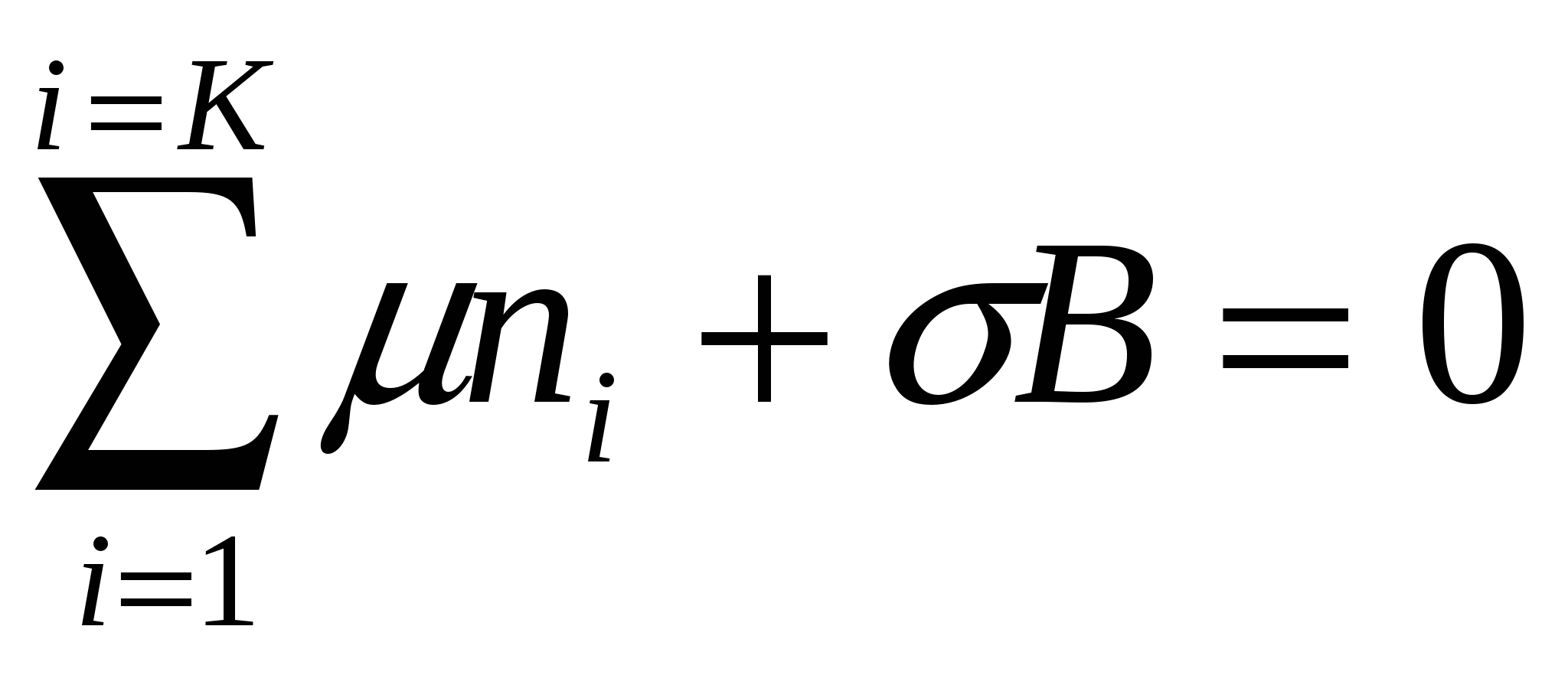 . (4.10, а)
. (4.10, а)
Барлық ауыспалылардың толық дифферециалы былай көрсетіледі:
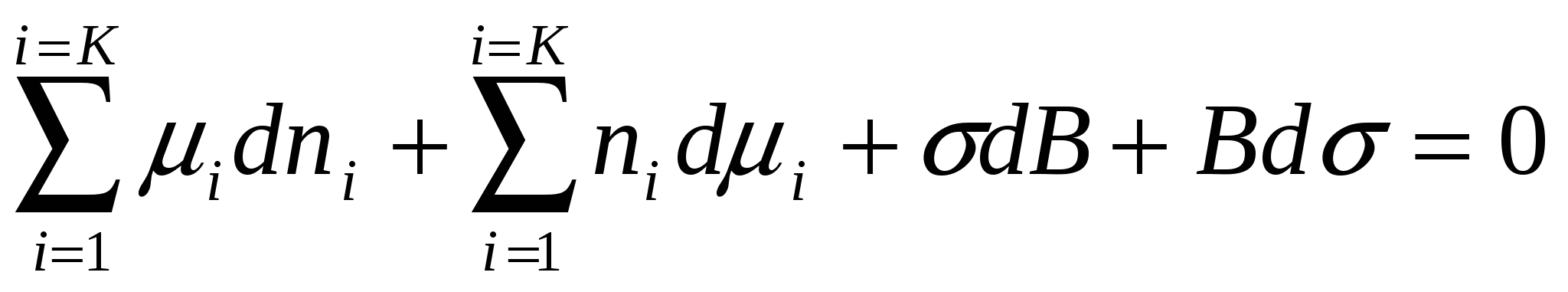 . (4.11)
. (4.11)
(4.11)теңдігінен (4.10) теңдігін аламыз:
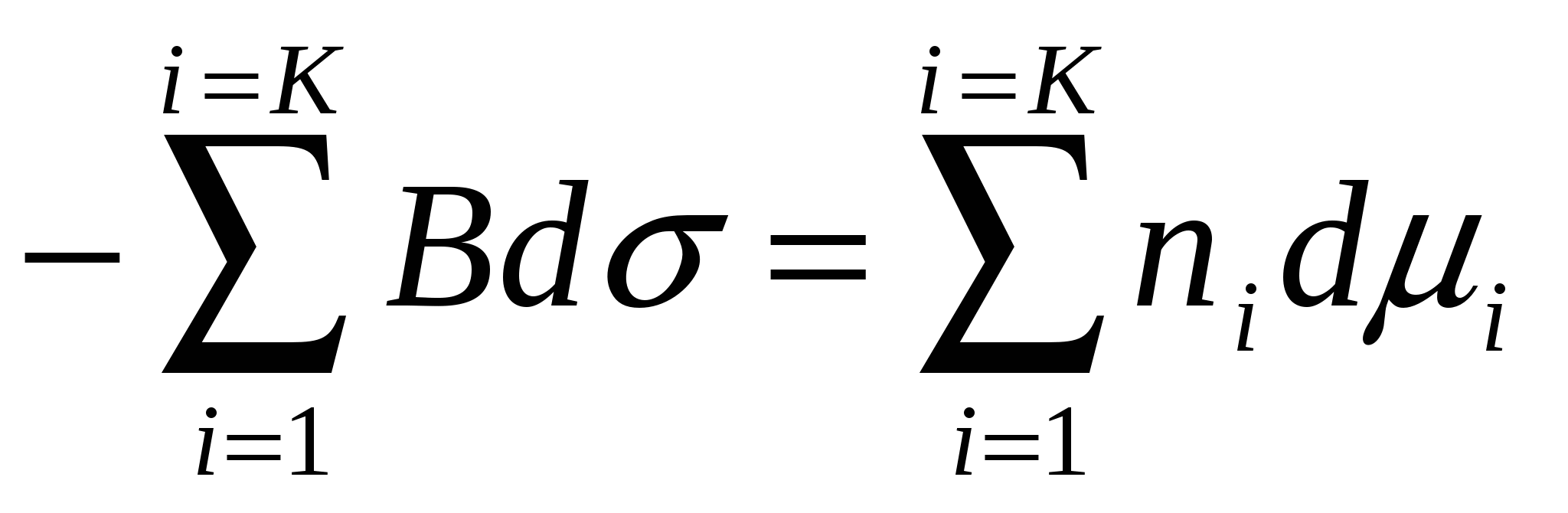 . (4.12)
. (4.12)
Адсорбцияны сипаттайтын (4.4) теңдігін қолданып (4.12) формуласы орнынакелесі нәтижені жазуға болады:
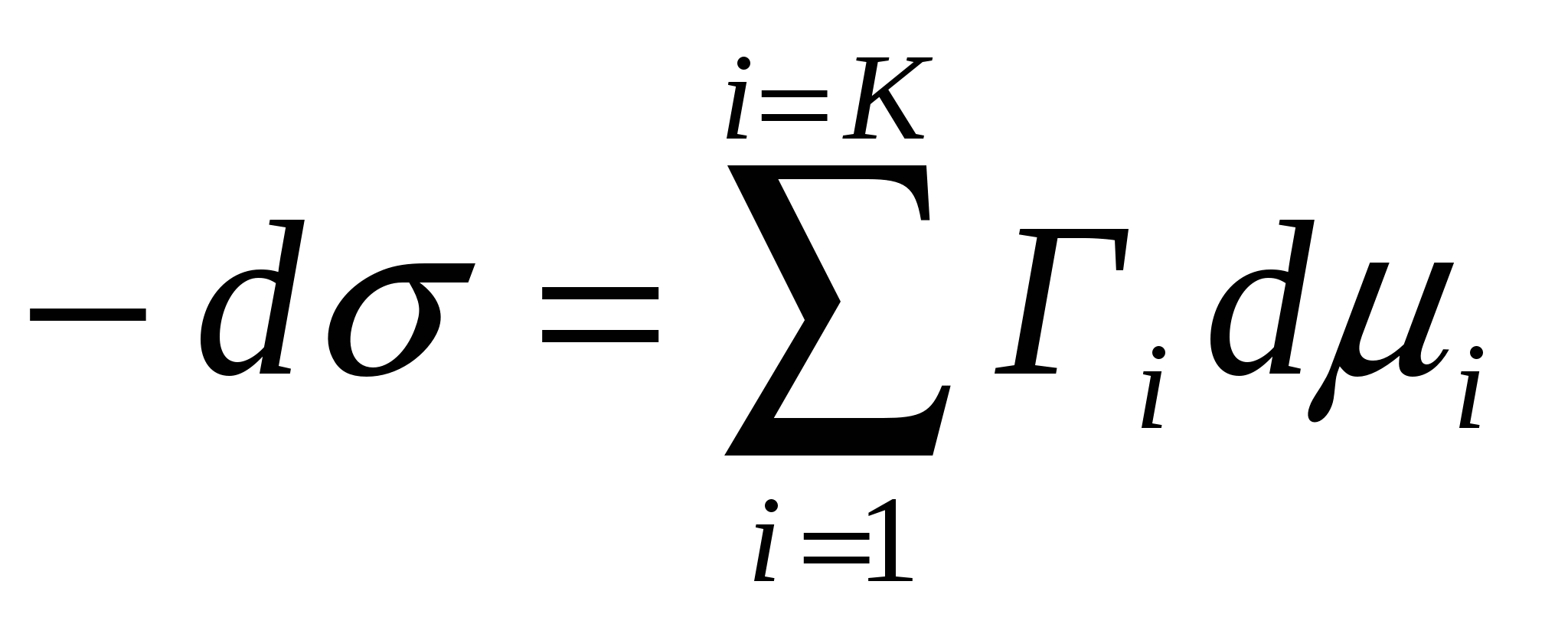 ;
; 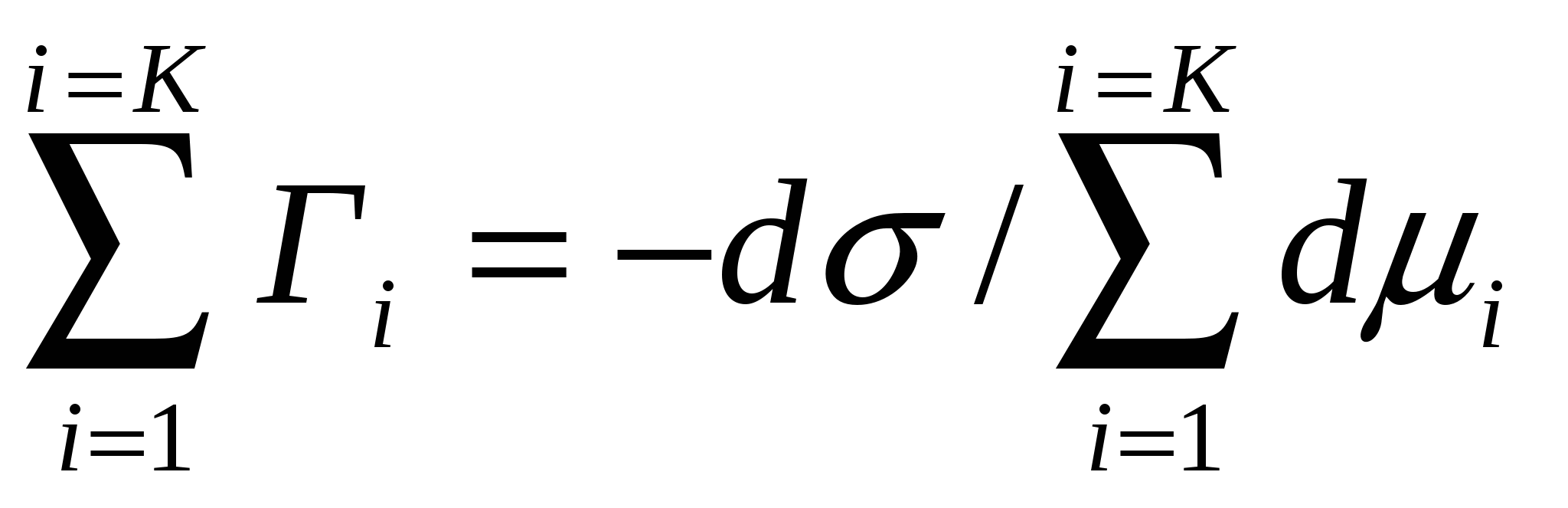 (4.13)
(4.13)
Бұл теңдік Гиббстік адсорбцияның іргелі теңдігі деп аталады. Бір компоненттің адсорбциясы кезінде (4.13) теңдігін келесі түрде көрсетуге болады:
-dσ = Гdμ (4.14)
(4,13) және (4.14)теңдіктері барлық адсорбция түрлеріне қолданбалы. Олар адсорбция кезінде химиялық әлуеттің өзгеруімен өз еркімен меншікті еркін беттік энергияның (беттік керілудің) төмендеуін көрсетеді.
Адсорбция адсорбтивтің артық С коцентрациясымен анықталады. Және де беттік керілудің өзгеруімен себептелген әрі температураға тәуелді. Адсорбцияны анықтай тын барлық шамалар бір-бірімен тығыз байланысты, яғни Г = f(c, σ, T). Бұл тәуелділікті (4.13) теңдігі арқылы табамыз. Ондағы dσ - адсорбция кезіндегі өз еркімен өтер процестің нәтижесінде төмендеген беттік керілуді сипаттайды; Гі - адсорбцияны мөлшерлі түрде анықтайды, ал dμі - химиялық әлуеттер өзгерісі нәтижесінде өз еркімен өтер процестің мүмкіндігі мен қарқындылығын көрсетеді.
(4.13) теңдігін қолданып заттар қоспасындағы бір компоненттің адсорбциясын анықтаймыз:
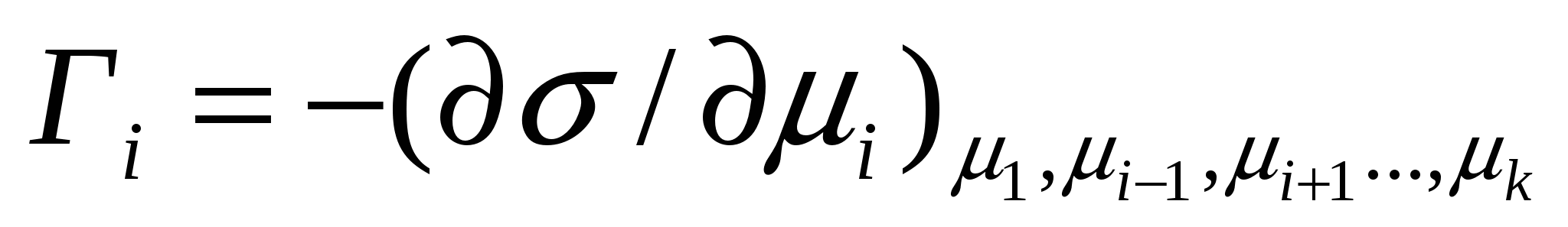 . (4.15)
. (4.15)
(4.15) жағдайында бір компоненттің адсорбциясы беттік керілуден басқа компоненттердің химиялық әлуеттері тұрақты болатын химиялық әлует өзгеруіне жеке туынды.
Химиялық әлуетті табу үшін келесі қатынасты қолданамыз:
μі = μі0 +RT ln C `(4.16)
мұндағы μі, μі0 - адсорбтивтің тепе-теңдік және стандартты химиялық әлуеттері; с - адсорбтив концентрациясы.
Егер адсорбтив күшті электролит болса, онда оның концентрациясы жоғары, сондықтан бұл теңдікте α белсенділікті қолданған жөн.
(4.16) теңдеуін дифференциалдау арқылы, μі0 - тұрақты шама екенін ескеріп:
μі = RT d ln C = RT (dC/C) (4.17)
формуласын аламыз.
(4.13) теңдігінде dμі алмастырып, алынған нәтжені (4.17) теңдігіне қоямыз:
Г = -(C/RT)*(dσ/dC) (4.18)
(4.18) теңдігі Гиббстік адсорбцияның іргелі теңдігінен шығады. Ол адсорбтив концентрациясы мен темпераураның артық адсорбцияға әсерін, адсорбтив концентрациясына байланысты беттік керілуді сипаттайды. (4.18) теңдігі адсорбцияны сипаттайтын параметрлерді (Г, с, Г мен α) байланыстырады. Оған қоса беттік керілудің төмендеу есебіне өз еркімен өтер процестің нәтижесін анықтайды. Келесіде жайшылықта қолданатын адсорбцияның адсорбтив концентрациясынан тәуелділігін қолданамыз.
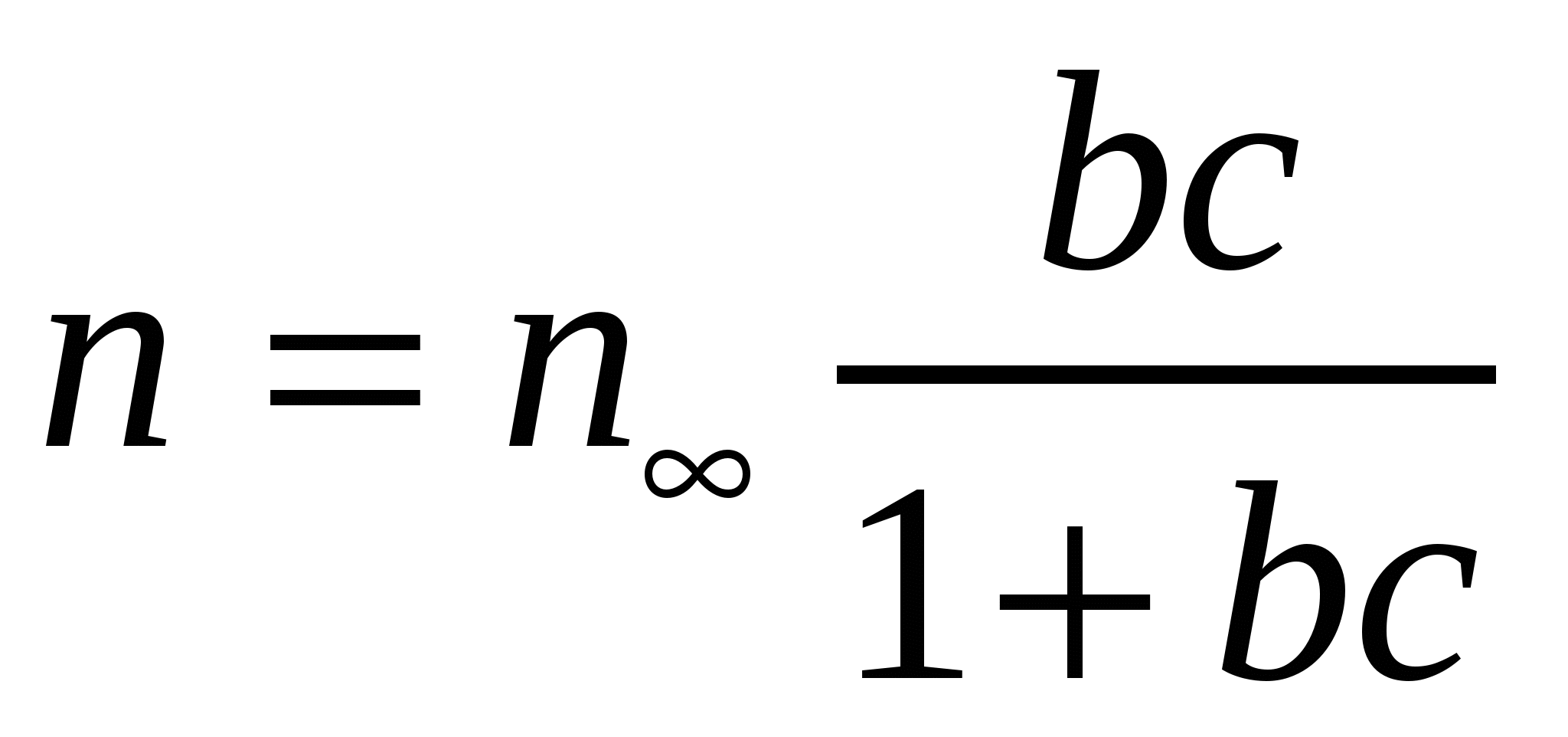 ;
; 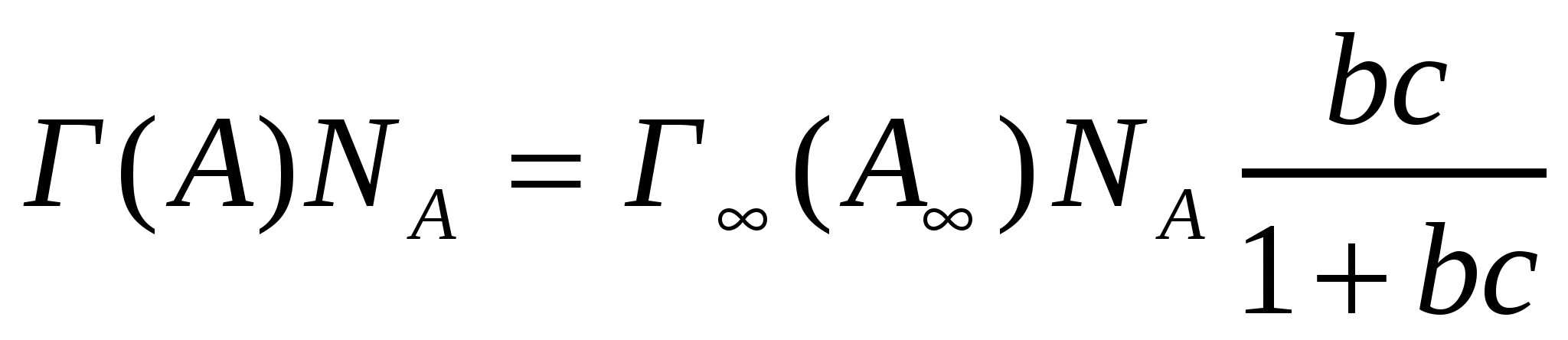 ;
; 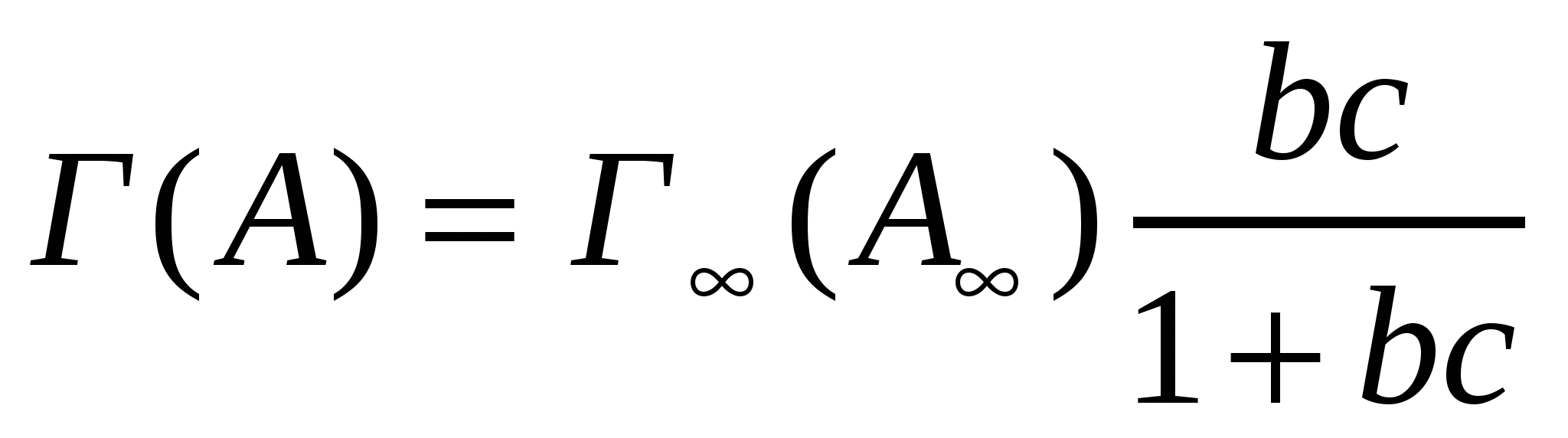 . (4.19)
. (4.19)
мұндағы b - адсорбциялық тепе-теңдіек тұрақтысы; Г(А) - адсорбция; n және n∞ - қаныққан және қанықпаған молекулалар саны; NА - Авогадро саны.
Жаттығулар.
1-есеп.
Адсорбция нәтижесінде адсорбат концентрациясы 17 есе көбейгенде артық адсорбция абсолютті адсорбцияның қанша бөлігін алады?
Шешуі:
Есептің берілгенімен адсорбат концентрациясы СВ= 17с. А = СВ*n және Г= A - c*h = Г - N теңдіктері негізінде артық адсорбцияны анықтауға болады:
Г= A - c*h = СВ*n - с*n = (СВ- c)*n
Артық және абсолютті адсорбция қатынасы:
Г/А= СВ- c)*n/ СВ*n = 17СВ-с/17с = 16/17 = 0,941
Артық және абсолютті адсорбцияның 0,941 бөлігін немесе 94,1 %-ын алады.
2-есеп.
Бөлшектер диаметрі 70 мкм, тығыздығы 1,25*103 м3/кг, ұнтақтағы моль/м2г және моль/кг өлшемдерінде көрсетілген адсорбцияның ара қатынасы қандай?
Шешуі:
Вменш=В/М, Вменш=6/а*ρ,формулаларын қолданамыз.
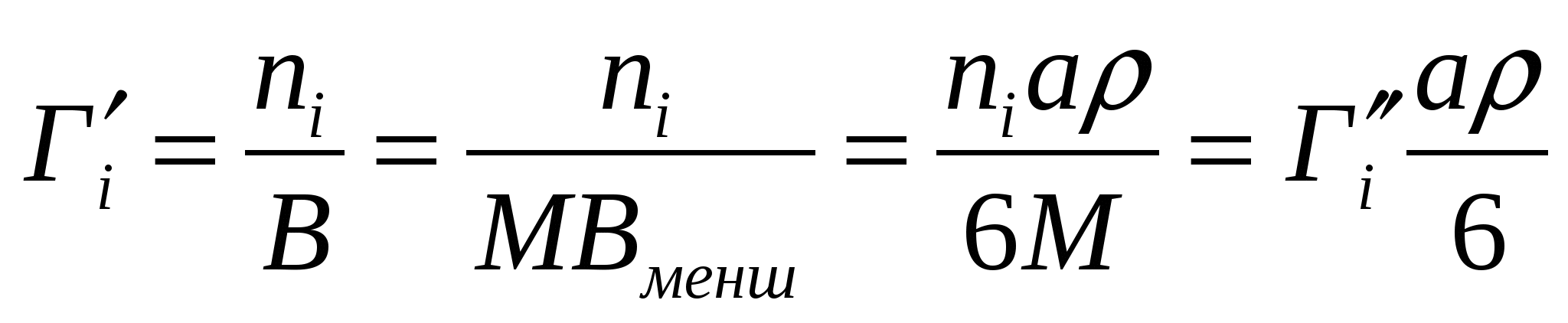 ;
; 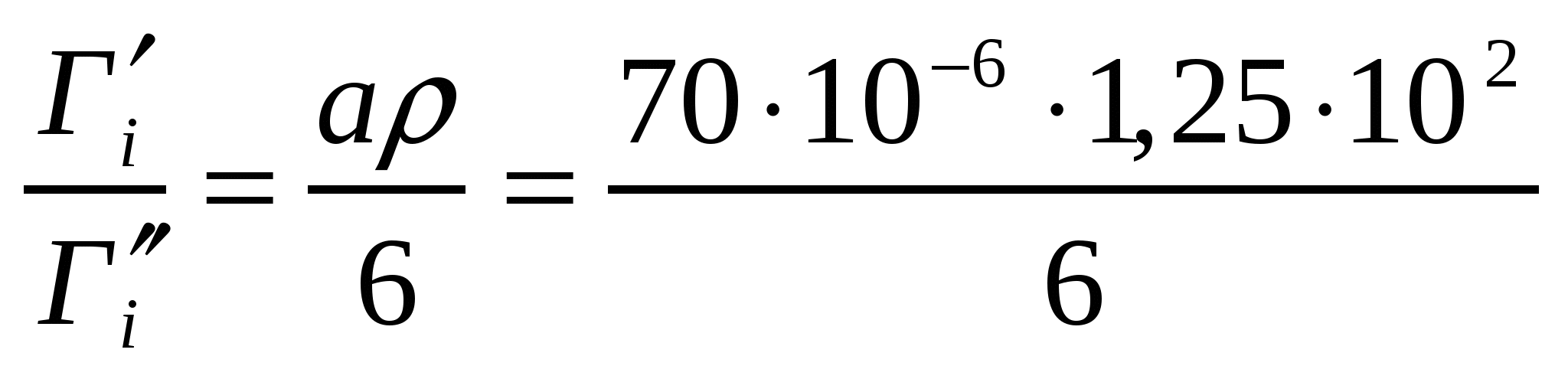
5. Сұйықтық - газ шекарасындағы адсорбция.
Сұйықтық - газ (су - ауа) бөліну шекарасында өз еркімен беттік белсенді заттар (ББЗ) молекулалары адсорбциялануы мүмкін. Олар күрделі түрде фазаның бөліну беті мен майдалық жүйелердің қасиеттерін өзгертетін шекаралас адсорбциялық қабат түзеді. Адсорбция беттік керілудің өзгеруіне әкеледі. Еріген заттың (адсорбтивтің) концентрациясының өсу шамасына байланысты беттік керілу өседі немесе төмендейді.
Адсорбция нәтижесінде беттік керілуді төмендететін заттар - беттік белсенді заттар деп, ал беттік керілуді өсіретін заттар - беттік бейбелсенді заттар деп аталады.
Заттың көлемдегі концентрациясына тәуелді адсорбция кезінде фазаның бөлу шекарасында беткі керілуді төмендету мүмкіндігі беттік белсенділік деп аталады. Ол Гиббстік адсорбцияның іргелі теңдігіне кіретін заң мен dσ/dc қатынасының мағынасымен анықталады. Бұл туынды мәні тұрақты емес және еріген заттың концентрациясына тәуелді. Бірдей жағдайда туындының шекті мәнін алғанда (с→0) концентрация әсерін елемеуге болады. Онда (4.18) теңдігін келесі түрде жазамыз:
g = - ( dσ/dc) с→0 = RT(Г/C) с→0 (5.1)
Беттік белсенділіктің өлшем бірлігі беттік керілу (нм немесе Дж/м2) және концентрация (моль/м3) өлшемдерімен анықталады, яғни ол Дж*м/моль немесе нм2/моль бірлігінде көрсетілуі мүмкін.
ББЗ адсорбциясы нәтижесіндегі беттік керілудің төмендеуін тәжірибелі түрде анықтауға болады.
Сұйықтық - газ бөліну шекарасындағы ББЗ адсорбциясы нәтижесіндегі ∆σ беттік керілудің төмендеуін Шишковский теңдігі арқылы анықтауға болады:
∆σ = σo- σ = a ln (1 + bc) (5.2)
мұндағы a, b - тәжірибелік коэффициенттер.
Бұл теңдік тәжірибелік мәндерді өңдеу арқылы алынған. Бұл беттік керілу изотермасының аналитикалық көрсетілімі. а коэффициенті ББЗ молекулаларының үйексіз радикалдардың гомологиялық қатарында өзгермейді. b коэффициентін тәжірибелі түрде анықтайды. Оның мәні сұйықтық пен ББЗ қасиеттеріне тәуелді. а мен b коэффициенттері, еріткіштің σo беткі керілу белгілі болса (5,2) теңдігін қолданып концентрациясы С болатын ББЗ ерітіндісінің беттік керілуін есептеу оңай болады.
Адсорбция изотермасын анықтайтын Ленгмюр теориясы мен (4.19) теңдігі ерітінділер адсорбциясына да қолданбалы, оның ішінде ББЗ адсорбциясы да бар.
Ленгмюр мен Гиббс теңдіктерін қолданып Шишковский теңдігіндегі а мен b коэффийиенттерін анықтаймыз. Ол үшін (4.3) жағдайын алып, (4.18) және (4.19) теңдіктерінің оң жақтарын теңестіреміз:
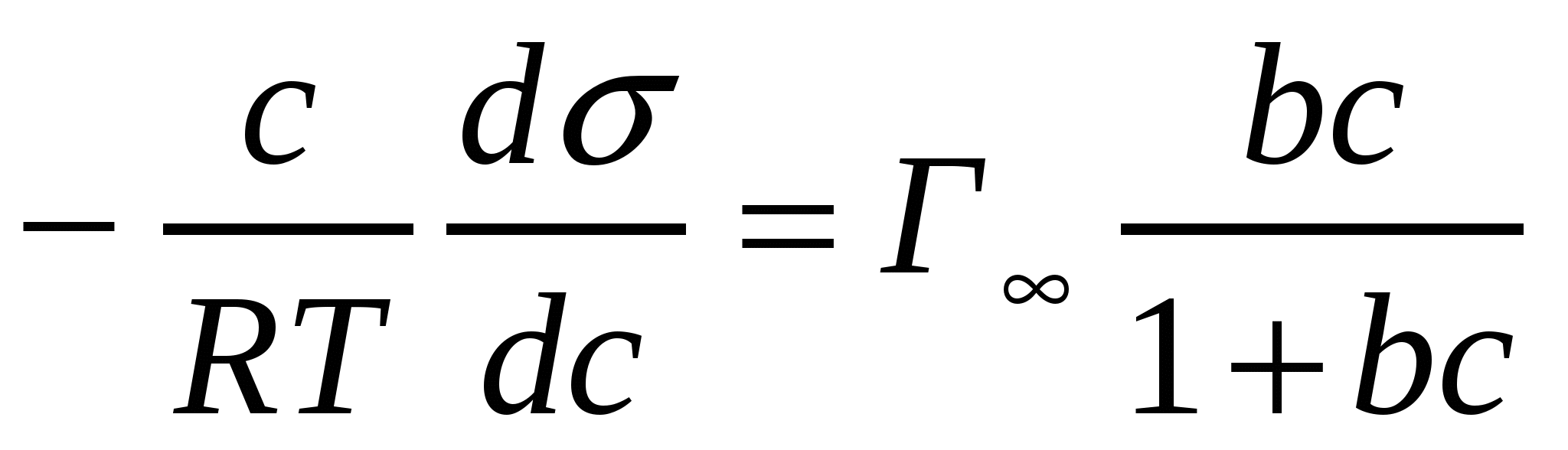 . (5.3)
. (5.3)
Айнымалыларды айырамыз:
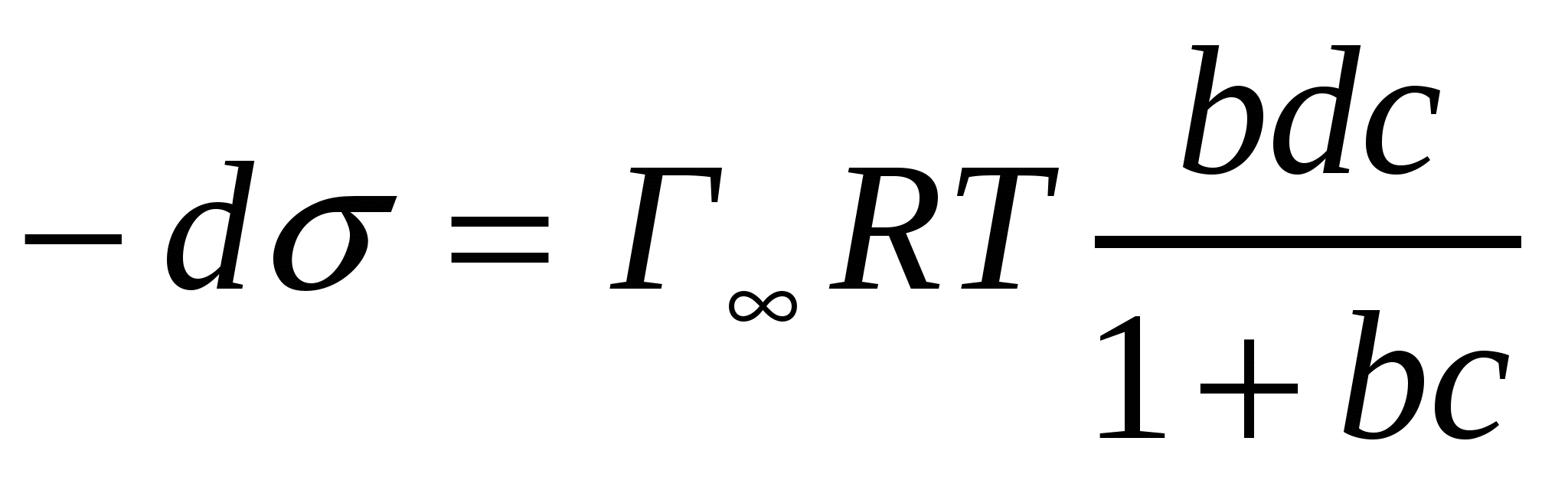 . (5.4)
. (5.4)
(5.4)теңдігінің сол және оң жақтарын интегралдаймыз, Т = const:
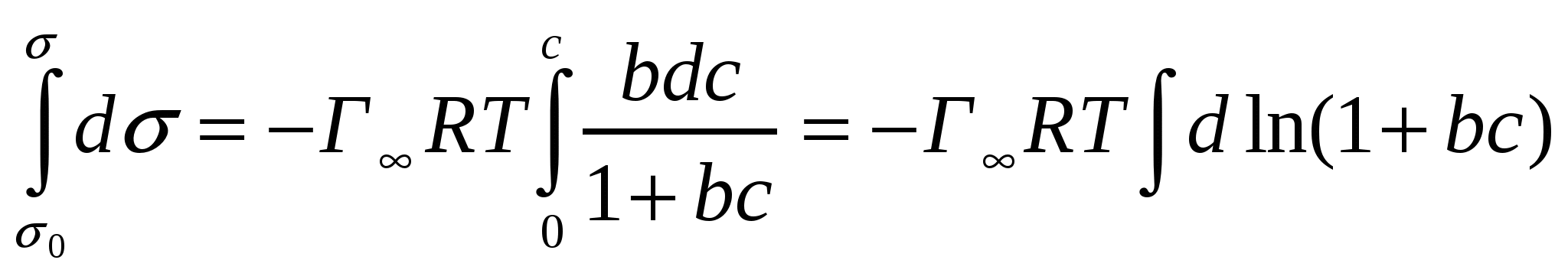 . (5.5)
. (5.5)
Интегралдаудан кейін (5.5) теңдігінде d(1+bc) = d(bc) екенін ескеріп, келесі формуланы аламыз:
σ = σo - Г∞RT ln (1 + bc) (5.6)
Г∞RT көбейтіндісін а арқылы белгілейміз:
Г∞ = a/RT (5.7)
(5.7) теңдігін (5.6)теңдігіне қойсақ (5.2) теңдігіне сәйкес Шишковский теңдігін аламыз.
Тәжірибелік деп саналған а мен b коэффициенттері белгілі бір физикалық мәнге ие бола бастайды. (5.7) теңдігіне сәйкес а коэффициенті шекті адсорбцияны анықтайды, ал b коэффициентіадсорбцияның тепе-теңдік сипатын анықтап, тепе-теңдік тұрақтысы болады.
(5.2) теңдігінен басқа Фрукмин теңдігі арқылы да адсорбция нәтижесіндегі беткі керілудің төмендеуін анықтауға болады:
∆σ = σo- σ = - Г∞RT ln (1 -Г/Г∞)
Г∞ шекті адсорбция мәні арқылы адсорбциялық қабаттың параметрін анықтауға болады: Во - бір ББЗ молекуласының алатын ауданы және δ - адсорбциялық қабат қаклыңдығы.
Ауданы 1м2 қаннықан адсорбциялық қабаттың молекула санын n∞ арқылы белгілнсек, онда бір молекула алатын аудан келесі формуламен анықталады:
В∞ = 1/ n∞ = 1/Г∞*NА (5.8)
мұндағы NА - Авогадро саны.
Жаттығулар.
1-есеп.
Т = 273К кезіндеШишковский теңдігінің коэффициенттері а = 14.72*10-3 , b = 10.4 болғандағы валериан қышқылының қандай концентрациясында оның беттік керілуі 52,1 мДж/м2 болады?
Шешуі:
∆σ = σo- σ = a ln (1 + bc) формуласынан ∆σ = σo- σ = 2,3a lg (1 + bc) формуласын шығарамыз.
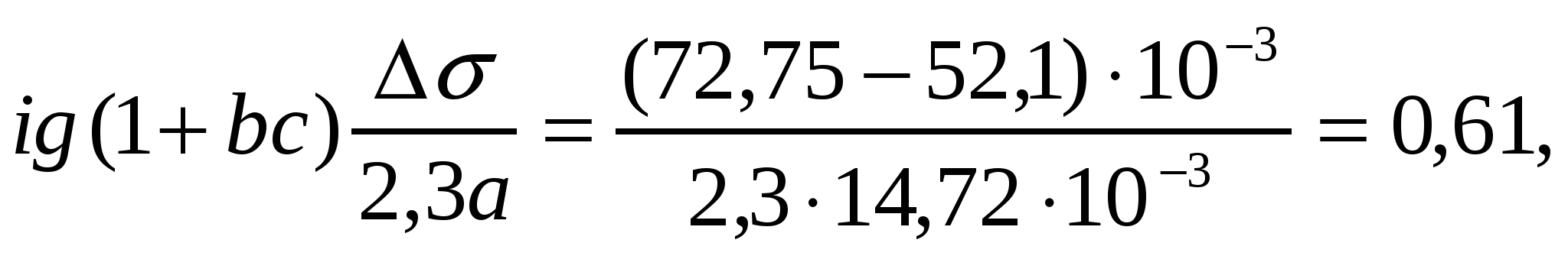
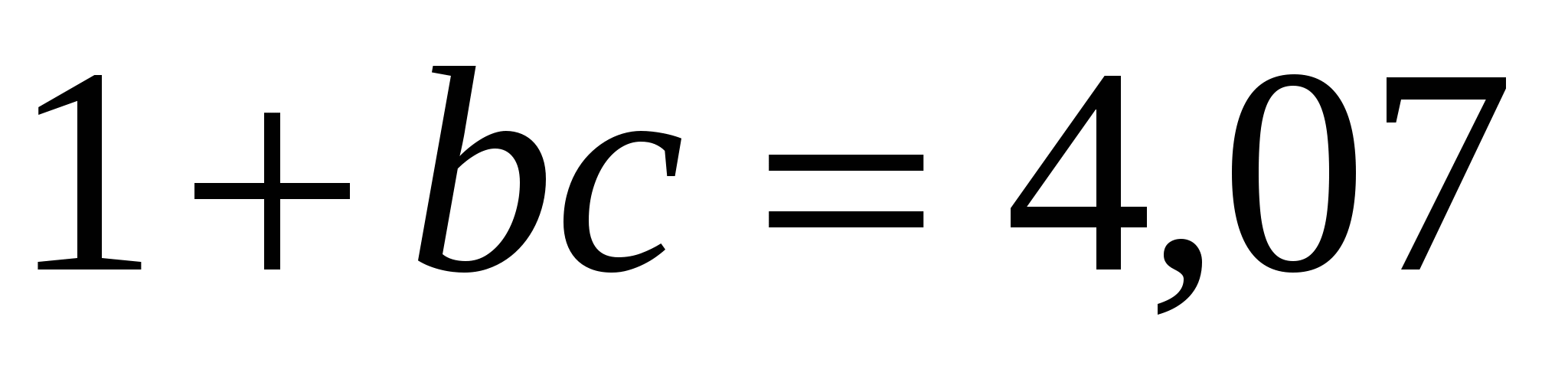 ,
,
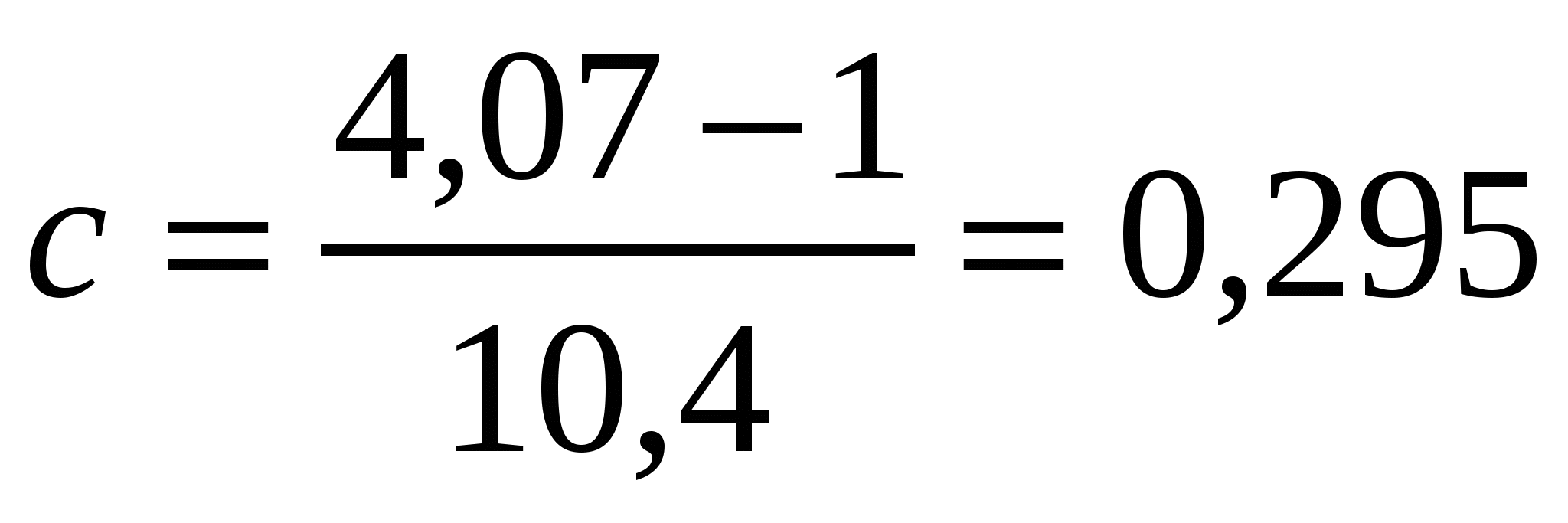 кмоль/м3.
кмоль/м3.
2-есеп.
Температура 293К және пропион қышқылының концентрациясы 0,1 кмоль/м3 Шишковский теңдігінің коэффициенттері а = 12,8*10-3 , b = 7,16. адсорбциямен беткі белсенділікті анықта.
Шешуі:
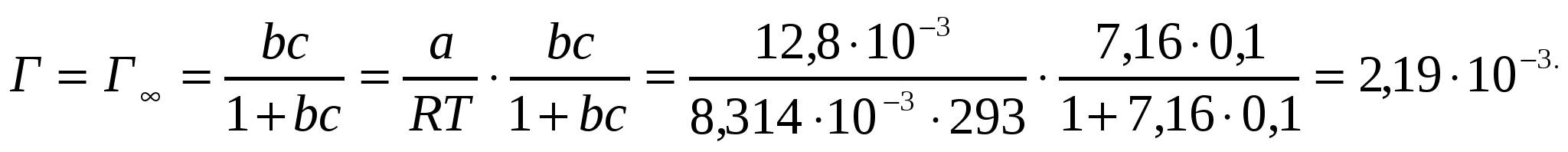 кДж/м2, или 2,19 моль/м2.
кДж/м2, или 2,19 моль/м2.
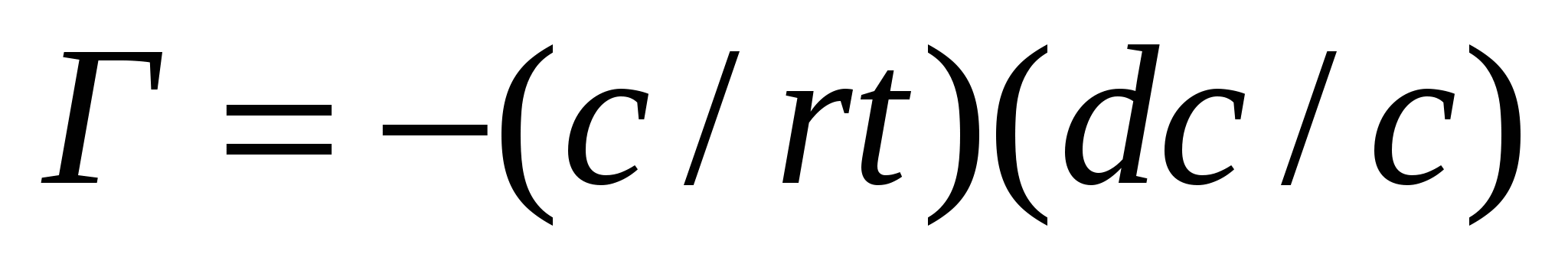 теңдігіне сәйкес
теңдігіне сәйкес
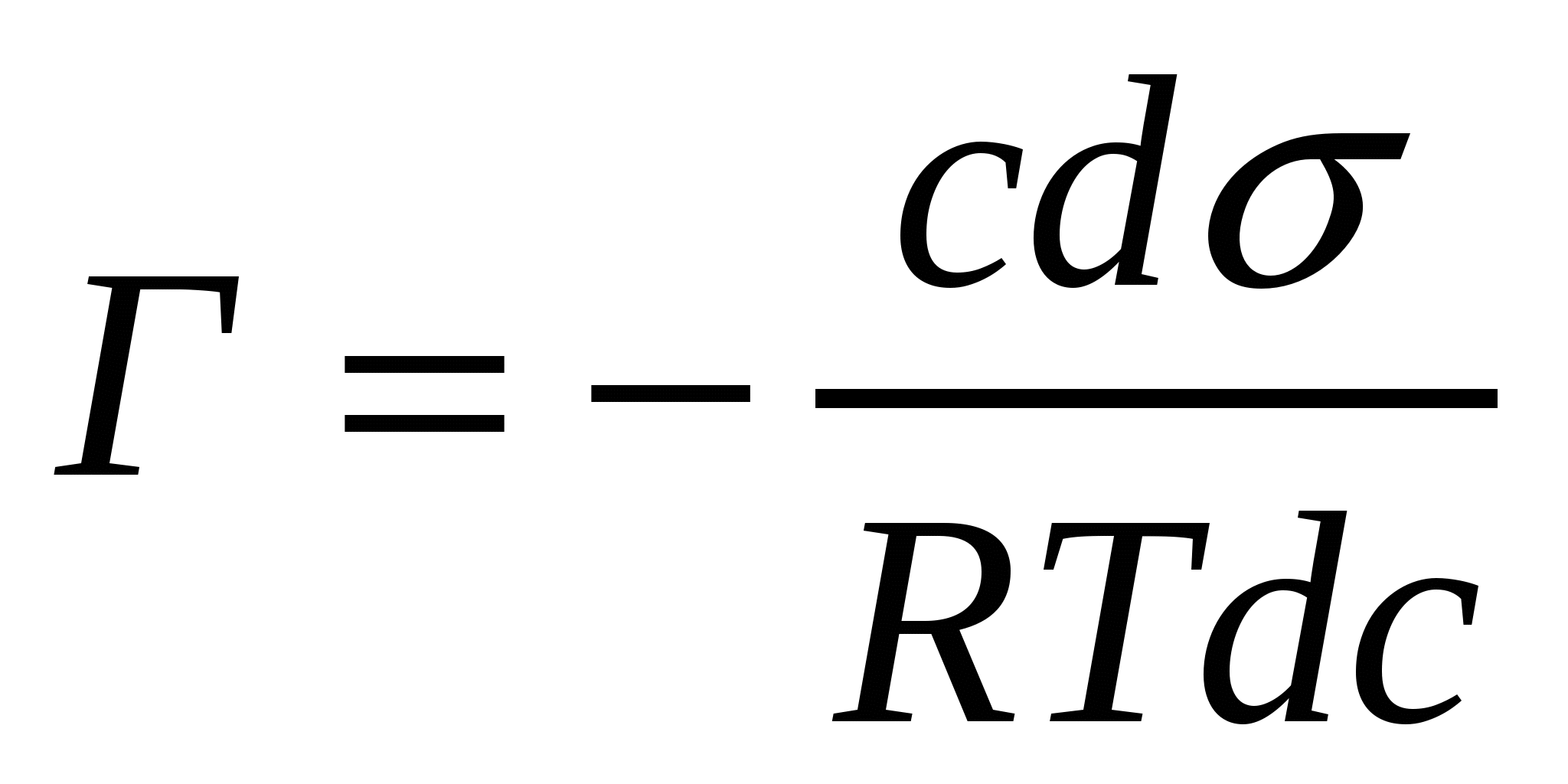 ;
; 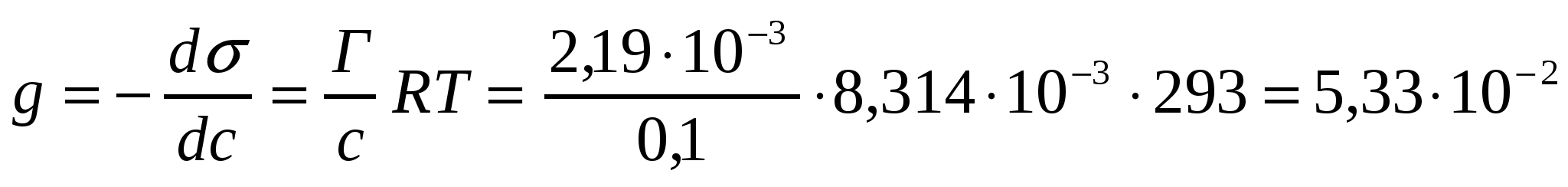
Дж•м/кмоль, или 53,3 мДж•м/кмоль.
Беттік белсенділіктің өлшем бірлігі:
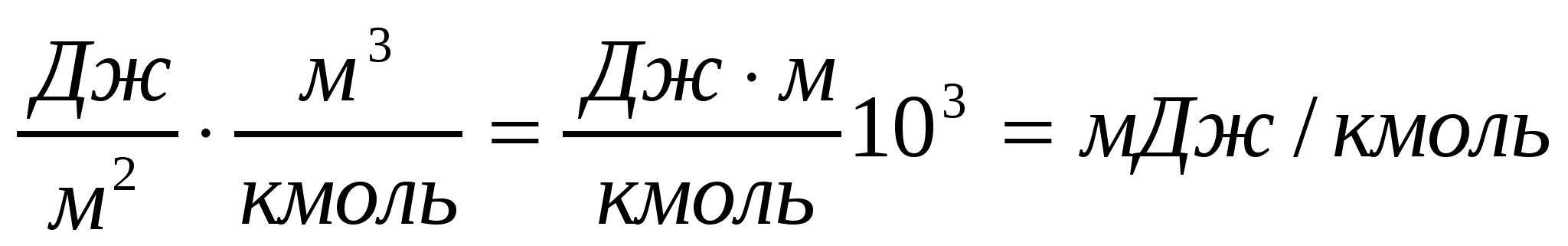 .
.
3-есеп.
Анилиннің С6H5NH2 бір молекуласына келетін аудан мен оның ауамен шекарасындағы моноадсорбциялық қабат қалыңдығын анықтау қажет. Г∞ = 6,0*10-9 кмоль/м2.
Шешуі:
В∞ = 1/ n∞ = 1/Г∞*NА формуласынан: В∞ = 1/Г∞*NА = 1/6,0*10-9*6,023*1026 = 0,277*1018м2 немесе 0,277нм. Г∞*М = δ*ρ формуласынан δ мәнін есептейміз:
δ = Г∞*М/ ρ = 6,0*10-9*93/1,022*103 = 0,546*10-9 немесе 0,546нм
4-есеп.
Ленгмюр теңдігімен пропион қышқылының адсорбциясын анықтау керек. Ерітіндінің беттік керілуі 55,6 мДж/м2. Ерітіндідегі қышқыл концентрациясы 0,5моль/л. Ленгмюр теңдігіндегі b коэффициенті 7,73л/моль. 295К кезінде судың беттік керілуі 71,96мДж/м2.
Шешуі:
σ = σo - Г∞RT ln (1 + bc) теңдігінен шекті адсорбцияны табамыз:
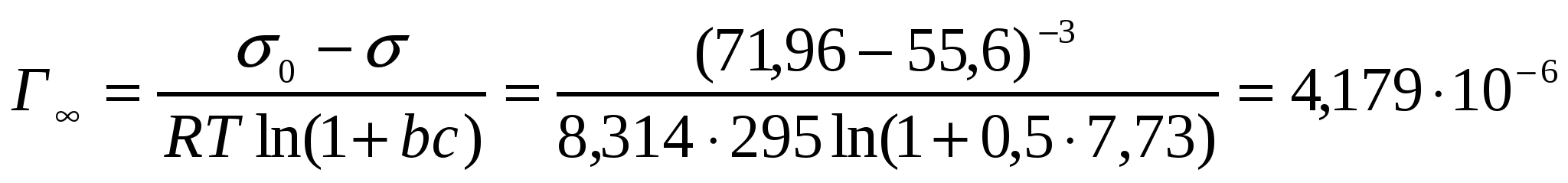 моль/м2.
моль/м2.
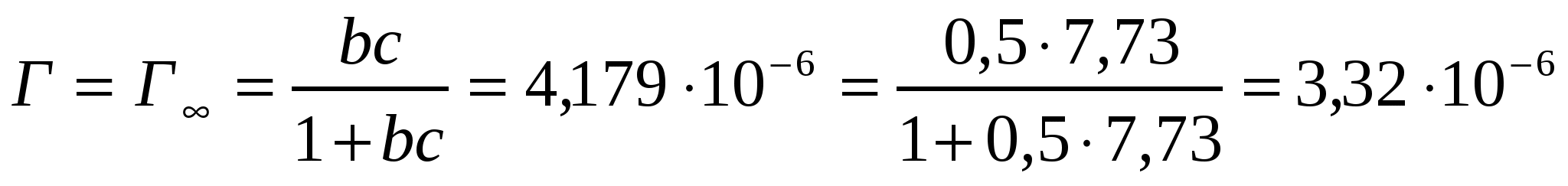 моль/м2.
моль/м2.
5-есеп.
Валериан қышқылының шекті адсорбциясы 4*10-6моль/м2. Егер ерітіндідегі валериан қышқылының концентрациясы 4ммоль/л (293К) болғанда беттік керілудің 2мДж/м2 шамаға азаятындығы белгілі болса, Шишковский теңдігінің коэффициенттерін есептеу керек.
Шешуі:
Г∞ = a/RT формуласынан а коэффициентін табамыз:
а = Г∞ RT = 4*10-6*8,314*293 =9,74*10-3
Шишковский теңдігінен b коэффициентін есептейміз:
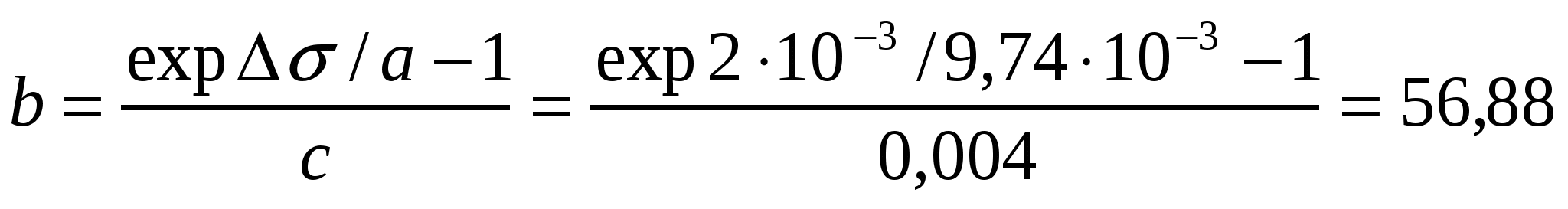 л/моль.
л/моль.
6. Қатты беттердегі адсорбция.
Қатты беттердің айырмашылығы олардың кеуектілігінде. Адсорбент бетінің табиғаты, оның кеуектерінің мөлшері мен түрі адсорбцияға әсерін тигізіп, оның сапалық және сандық сипатын, яғни адсорбция механизмін өзгертеді.
Қатты беттер адсорбент ретінде газдар мен сұйықтар адсорбциясында қолданылады, ал адсорбциялық процестер қатты дене - газ (Қ-Г) және қатты дене - сұйықтық (Қ-С) бөліну шекарасында өтеді.
Сұйықтық бетіне қарағанда қатты денелер бетігеометриялық әрі энергетикалық әртекті, себебі қатты денелердің кеуектері болуы мүмкін. Осындай адсорбенттердің негізгі сипатының бірі болып кеуектілік саналады. Ол кеуектердің жалпы көлемінің (VK) адсорбенттің жалпы көлеміне (Vкөлем ) қатынасына тең:
К = VK/ Vкөлем
Кеуектілігіне байланысты адсорбенттер кеуекті және кеуексіз болып екі топқа бөлінеді. Кеуексіз адсорбенттердің фазаларының бөліну беті қатты дененің жобасына сәйкес. Кеуекті адсорбенттерде бұл бет кеуектер есебіне едәуір жоғары. Кеуекті адсорбенттер көбінесе ұнтақтар түрінде қолданылады.ұнтақтәрізді адсорбенттердегі адсорбция оның меншікті бетімен анықталады. Ол (1.1) формуласымен есептелінеді. Ұнтақтәрізді адсорбенттердің меншікті беті кеуексіз адсорбенттердің меншікті бетінен едәуір жоғары. Ол көбінесе бөлшектің жобасын анықтайтын бетке қарағанда жоғары дәрежелі түрде кеуек бетіне тәуелді болып келеді.
Кеуекті адсорбенттерде әртүрлі мөлшерлі кеуектер болуы мүмкін. Адсорбенттер кеуектеррінің мөлшеріне бай ланысты микрокеуекті, ауыспалы кеуекті және макрокеуекті болып бөлінеді. Микрокеуектер диаметрі молекула мөлшерімен өлшемдес. Кеуектілік адсорбенттердің меншікті бетін ұлғайтып, адсорбция механизміне әсерін тигізеді. Микрокеуекті адсорбенттердегі адсорбция кеуек кеңістігінің көлемді толуына пайымдалса, мезокеуекті адсорбенттерде - адсорбат буларының қылтүтікті конденсациясына пайымдалған. Макрокеуектердің адсорбциялық сыйымы тек оның меншікті бетімен ғана емес, сол макрокеуектердің көлемімен де анықталады.
Жаттығулар.
1-есеп.
1 кг белсендірілген көмірге қанша микрокеуек келетінін анықтау керек. Микрокеуек цилиндр тәрізді, диаметрі 1,2 нм, биіктігі 1,7 нм, меншікті көлемі 0,5*10-3 м3/кг.
Шешуі:
Бір микрокеуек көлемі: V =πr2h = 3,14*(1,2*10-9)2*1,7*10-9 = 7,8686*10-27м3
Микрокеуектер саны: N = V2/V1 = 0,5*10-3/7,686*10-27 = 6,505*10-22
2-есеп.
Меншікті беті 3,2*105м2/кг, тығыздығы 0,47*103мг/м3, диаметрі а=65 мкм болатын белсендірілген көмір бөлшектерінің меншікті беті Вб.к. кеуектер есебіне неше есе өседі?
Шешуі:
Кеуексіз адсорбенттің меншікті беті: Вуд= 6/а*ρ = 6/65*10-6*0,47*103= 196,4 м2/кг
Кеуектер есебіне меншікті беттің өсуін есептейміз: N = Вб.к/ Вуд = 3,2*103/196,4 = =1629 есе өседі.
3-есеп.
Цеолит микрокеуектерінің көлемі 0,235 см3/кг. 100 г цеолит қолданып концентрациясы 6,5% болатын көміртегі қостотығынан қанша көлем ауа тазартуға болады? Ауа тығыздығы 1,293 кг/м3, СО2 тығыздығы 1977 кг/м3, кеуектердің толу дәрежесі α = 45%.
Шешуі:
1 м3 аудағы көмірқышқыл газының көлемін анықтаймыз:
mCO2=1,293*6,5/100=0,084г.
VCO2 = mCO2/ρCO2 = 0,084/1,977 = 0,0425 м2.
Тазартылған ауа көлемі:
Vауа = VCO2 *α/Vг = 0,0425*0,45/0,235*10-3 =81,38 м2
7. Қос электрлік қабат және электрокинетикалық құбылыстар.
Сұйықтықпен жанасу кезінде қатты дененің бетінде қарсы иондармен компенсацияланатын артық электрлік заряд пайда болады.нәтижесінде Қ-С бөліну шекарасында қос электрлік қабат қалыптасады. Қос электрлік қабаттың түзілуібеттік энергия ның минимумға ұмтылуы мен Қ-С бөліну шекарасының өзіндік қасиеттері нәтижесінде өз еркімен өтеді. Майдалық фаза бөлшектерінің меншікті бетінің үлкендігі фазаның бөліну бетінде зор электрлік зарядтың жиналуына себепкер болады. Ол электрокинетикалық құбылыстардың себебі болады. Олар сыртқы электрлік өрістің әсерімен ортаның орын ауысуы, майдалық фаза бөлшектері немесе сұйық майдалық ортаның жылжуы кезінде электр зарядтарының пайда болуы. Электрокинетикалық құбылыстар сырғу шекарасы мен майдалық фаза және майдалағыш ортаға қатысты орын ауысуы мен байланысты. Олардың қарқындылығы ζ - потенциал мәнімен анықталады. Сондықтан бұл шаманы электрокинетикалық құбылыстарды бағалау үшін қолданады. Қос элетрлік қабатты (ҚЭҚ) өзіндік коденсатор ретінде қарастыруға болады.
Майдалық фаза мен майдалағыш орта қозғалысының қатыстылығы f1 және f2 күштерімен анықталады. f1 күші әлует түзгіш қабаттың артық зарядтарының адсорбциялық қабатқа қатысты әсерлесу нәтижесінде пайда болады; ол диффузиялық қабат зарядын сипаттап, үйкеліс күшіне қарсы әрекеттеніп, сырғу шекарасына параллель бағытталған. f1 күші келесі формуламен анықталады:
![]() , (7.1)
, (7.1)
мұндағы Е - кернеулік немесе сырқы өріс градиенті, gB - беттегі заряд тығыздығы.
f2 күші сұйықтықтың орын ауысуы кезіндегі үйкелісті анықтайды:
![]() , (7.2)
, (7.2)
мұндағы η - үйкеліс коэффициенті; ω - сұйықтықтың орын ауысуы кезіндегі қозғалыс жылдамдығы; һ - беттер арасындағы қашықтық.
Белгілі бір қозғалыста бұл қозғалыстар тең, яғни:
![]() , немесе
, немесе 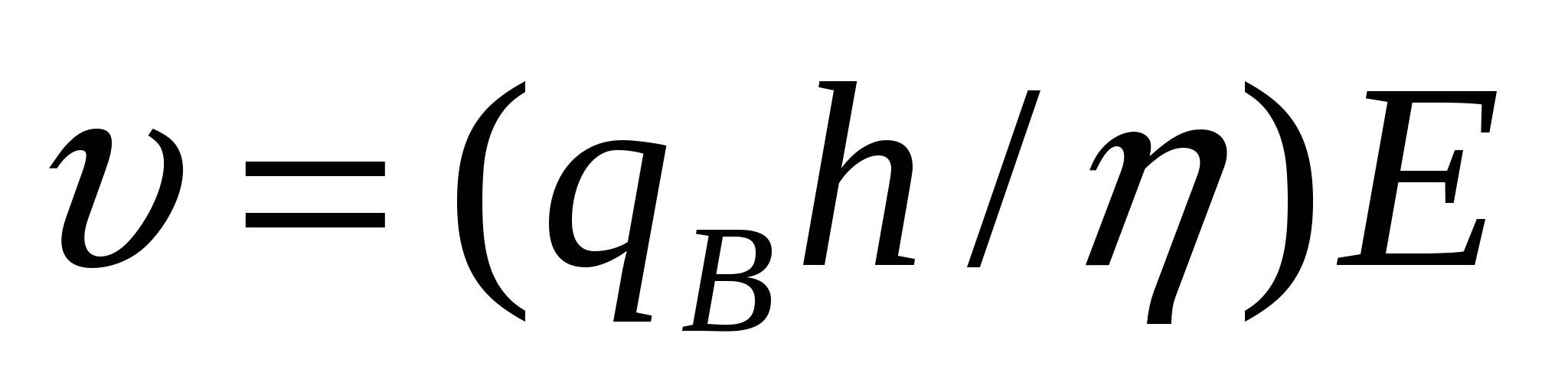 (7.3)
(7.3)
(7.3) формуласы майдалық фаза мен майдалағыш ортаның орын ауысуының жылдамдығын анықтайды. Меншікті зарядты (gB) φ - әлуетпен байланыстыруға болады:
![]() ;
; 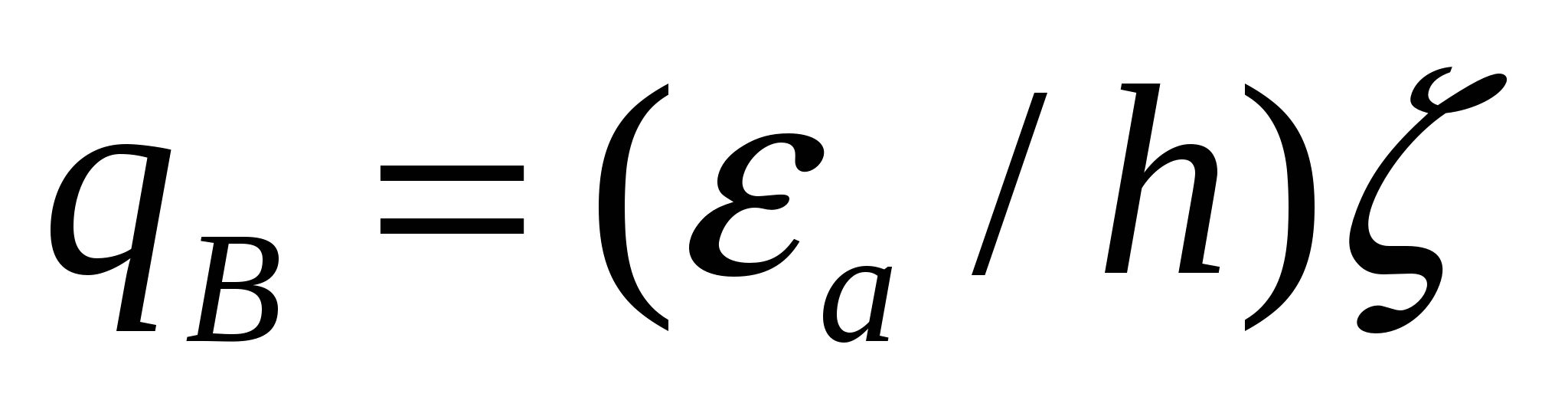 , (7.4)
, (7.4)
мұндағы εа - абсолютті диэлектрлік өтімділік.
(7.4) теңдігін (7.3) формуласына қойсақ:
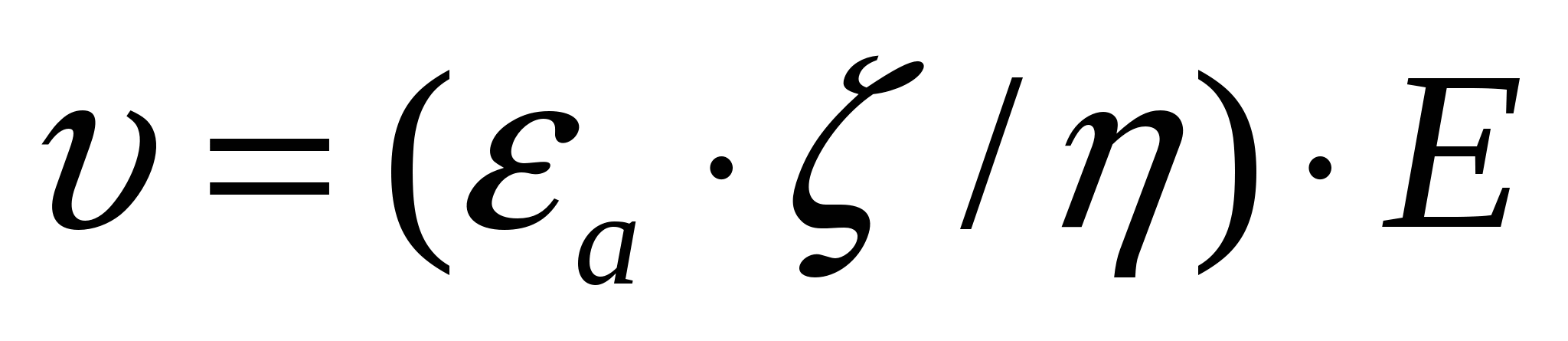 . (7.5)
. (7.5)
Электр өрісі кернеулігінің бірлігіне есептегендегі қозғалыс жылдамдығын электрожылыстық ширақтық деп атайды, ол келесі формуламен табылады:
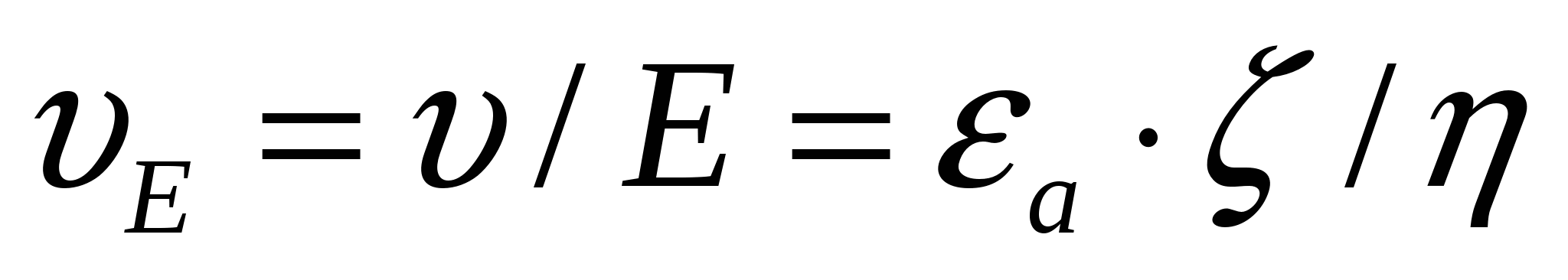 . (7.6)
. (7.6)
Майдалық фаза бөлшегінің түрін есептегенде (7.5) және (7.6) теңдіктері келесі түрде жазылады:
![]() , (7.7)
, (7.7)
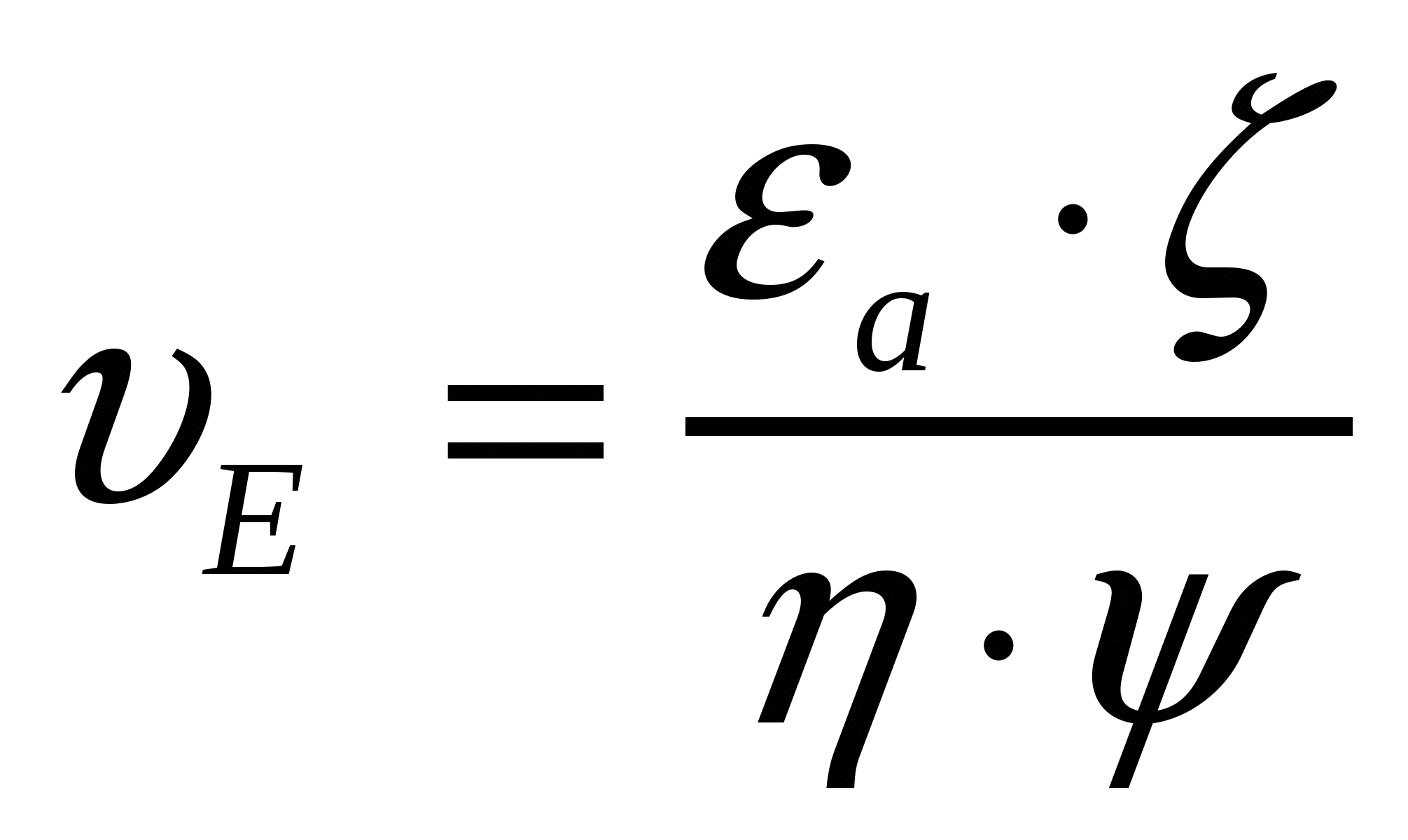 , (7.8)
, (7.8)
мұндағы υ - жылдамдық, м/с; υЕ - электрожылыстық ширақтық, м2/с*В; ψ - бөлшек түріне тәуелді коэффициент; ζ - дзэта әлует, В; Е - кернеулік немесе сырқы өріс градиенті, В/м.
Ψ коэффициенті бөлшек түрін және олардың электр өрісінің бағытын ескереді. Шар тәрізді бөлшектер үшін Ψ коэффициенті 0,66 , ал электр өрісінің күштік сызықтарының ен бойынан бағытталған цилиндр тәрізді бөлшектер үшін бірге тең.
Абсолютті диэлектрлік өтімділік: εа = εо* ε , мұндағы ε- қатысты диэлектрлік өтімділік; εо - вакуумның абсолютті диэлектрлік өтімділігі (8,85*1012Ф/м).
(7.7) формуласында абсолютті диэлектрлік өтімділік мәнін қолдансақ, келесі формуланы аламыз:
![]() , немесе
, немесе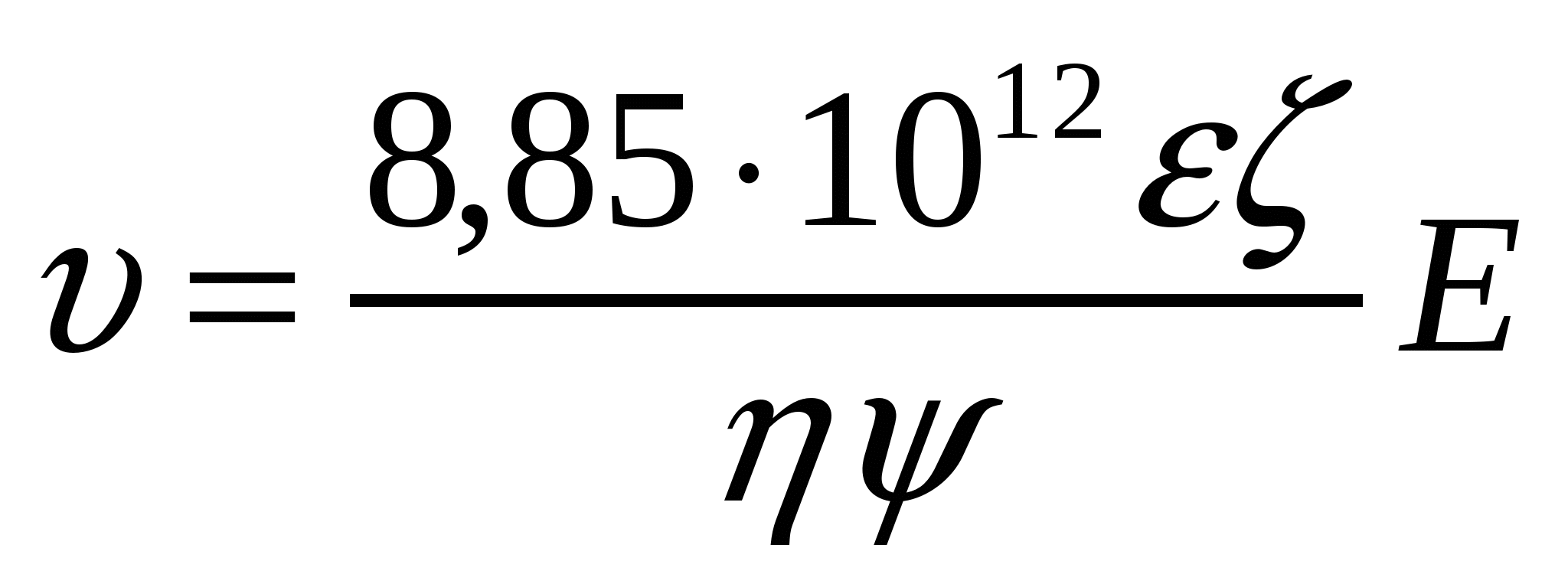 . (7.9)
. (7.9)
(7.9) теңдігіне сәйкес электрожылыстау мен электроосмос қарқындылығын анықтайтын шамалар орта қасиеттеріне (ε, η), бөлшек түрлеріне (ψ), сыртқы электр өрісінің кернеулігіне (Е), ҚЭҚ құрылымымен анықталатын электрокинетикалық әлуетке (ζ) тәуелді. Электрожылыстық ширақтық пнг электрокинетикалық әлуеттімайдалық фазаның орын ауысуы жылдамдығы арқылы тәжірибелі түрде оңай анықтауға болады. Әдетте электрожылыстық ширақтық 5,0*108м2/с*В мәнінен, электрокинетикалық әлует 100мВ мәнінен аспайды.
(7.7) және (7.9) формулаларында майдалық жүйелердің бірқатар айырмашылықтары ескерілмейді. Мысалы: майдалық фаза бөлшектерінің электрөткізгіштігі, майдалық жүйенің саңылауда, қылтүтікте, арықта орналасқандағы өзіндік қасиеттері. Бұған қарамастан бұл формулалар электрокинетикалық құбылыстарды мөлшерлі түрде сипаттайды.
Р1 сырқы әсерімен орын алатын Еа ағу әлуетін есептеуге келесі формула қолданылады:
![]() , (7.10)
, (7.10)
мұндағы ∆p = р1 - р2 майдалағыш ортаның ағысы кезіндегі қсымның өзгеруі; χ - майдалағш ортаның меншікті электрөткізгіштігі.
Ендеше электрокинетикалық құбылыстармен электрожылыстық ширақтықты фазаның бөліну бетінде прайда болған ҚЭҚ салдары деп қарастыруға болады. Фазаның қатысты орын ауысуының мүмкіндігі мен қарқындылығы ҚЭҚ құрылымымен анықталатын ζ шамасымен табылады.
Жаттығулар.
1-есеп.
Апельсин шырыны кірнесінің жоғары майдалық бөлшектерінің электрокинетикалық әлуеті 50 мВ. Электрожылыс жылдамдығын, сфера тәрізді кірне бөлшектерінің электрожылыстық ширақтығын анықтау қажет. Ортаның қатысты диэлектрлік өтімділігі 54,8 , сырқы э.қ.к. 120 В, электродтар арасы 40 см, орта тұтқырлығы 4,5*10-3 Па*с.
Шешуі:
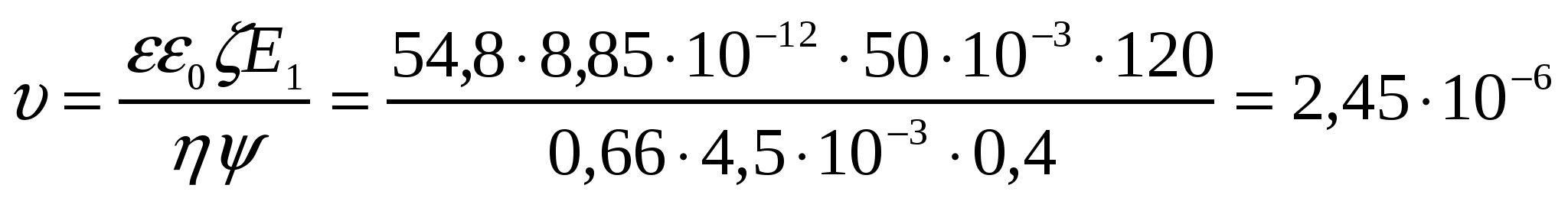 м/с = 2,45мкм/с;
м/с = 2,45мкм/с;
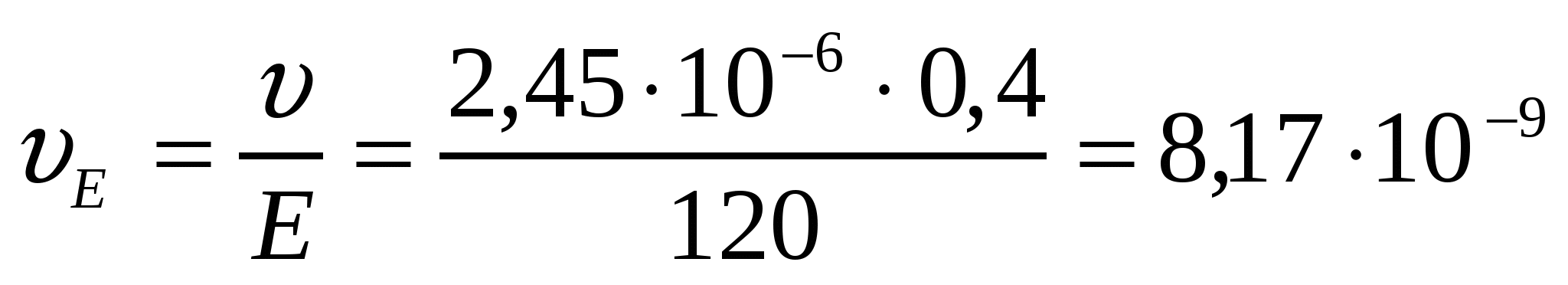
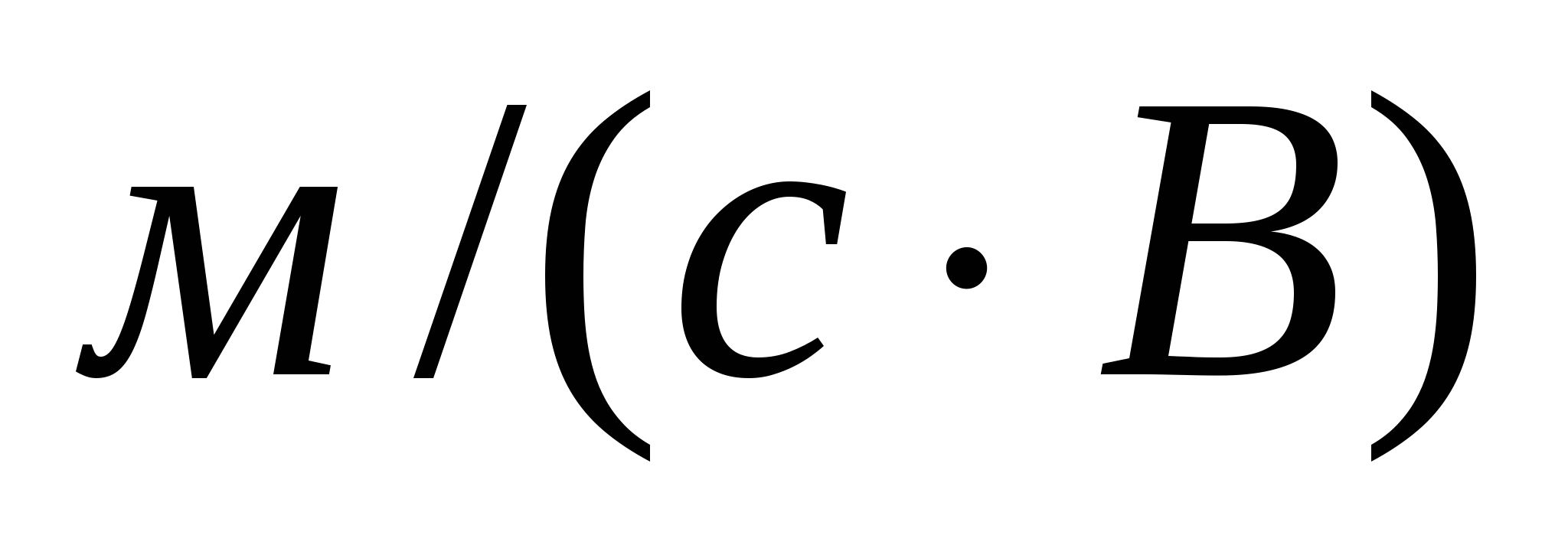 .
.
2-есеп.
20 пайыздық сахароза ерітіндісінің коллоидтарының электрокинетикалық әлуетін анықта. Сыртқы электр өрісінің градиенті 400 В/м, қатысты диэлектрлік өтімділік 69,1 , тұтқырлығы 2,5*10-3 Па*с, электрожылыс жылдамдығы 13,5 мкм/с.
Шешуі:
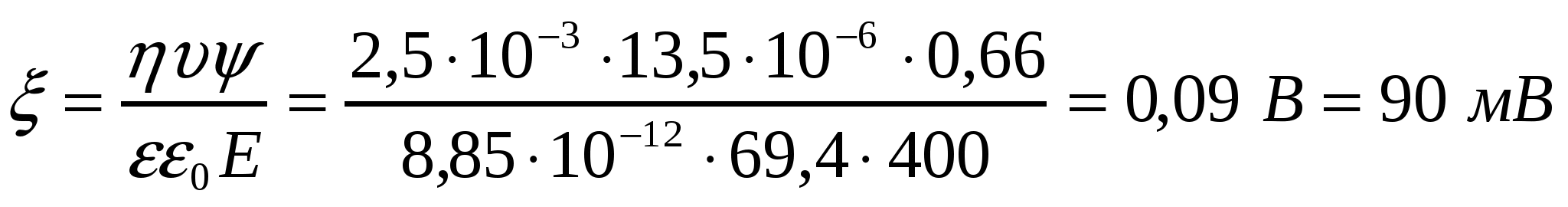
3-есеп.
Егер келесі жағдайда: ∆р = 20*10-3Па, меншікті электрөткізгіштігі χ = 1,3*10-3см*м-1, қатысты диэлектрлік өтімділік ε = 41,3 , тұтқырлығы η = 0,9*10-3 Па*с, электрокинетикалық әлует ξ = 6*10-3, жарғақ арқылы 42,4 пайызды спирт қысылып өткізілсе, ағыс әлуетінің мәні неге тең?
Шешуі:
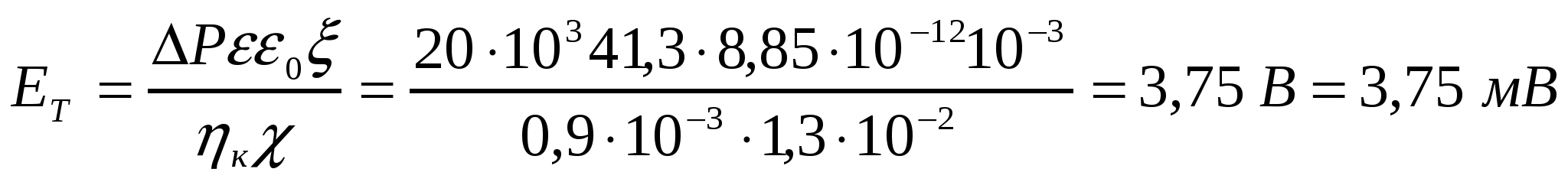 .
.
4-есеп.
Артық қысыммен (∆р = 3,1*10-4Па) және ағыс әлуеті ЕА = 1,2*10-2В кезінде керамикалық сүзгіш арқылы 0,01М KCl ерітіндісін ағызғандағы электрокинетикалық әлует неге тең? Т = 298К, ерітінді тұтқырлығы 8,94*10-4 Па*с, меншікті электроөткізгіштік 0,141 см*м-1, қатысты диэлектрлік өтімділік 78,5.
Шешуі:
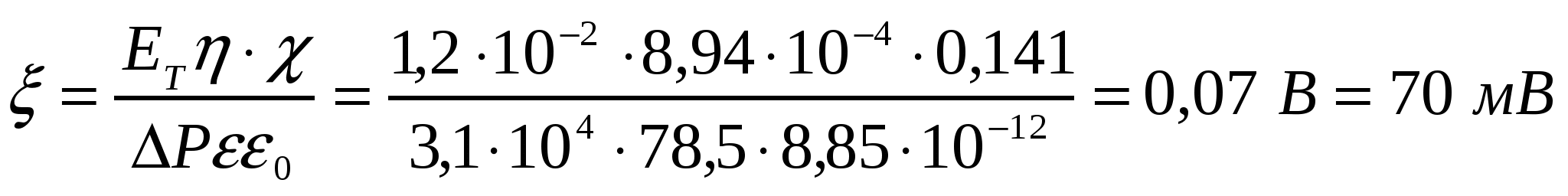 .
.
Майдалық жүйелердің қасиеттері
8. Майдалық жүйелердің оптикалық қасиеттері.
Майдалық жүйелердің оптикалық қасиеттері белгілі энергияға ие электромагниттік сәулеленудің майдалық фаза бөлшектерімен әсерлесуінен туындайды. Майдалық жүйелердің оптикалық қасиеттерінің айрықшалығы бөлшектердің мөлшері мен табиғаты, электромагниттік сәулеленудің толқын ұзындығымен бөлшектер мөлшері арасындағы арақатынаспен анықталады. майдалық жүйелерге тән оптикалық қасиеттердің бірі жарық сәулесін шашырату. Майдалық фаза бөлшектерінің қасиеттері мен жарық сәулесі мөлшеріне байланысты майдалық жүйе арқылы өткен сәуле жұтылуы, шағылуы, шашылуы мүмкін. Майдалық жүйелерге жарық сәулесі әсерінің (интерференция, дифракция, шағылу және т.б.) салдары геометриялық оптика заңдарымен анықталады.
Майдалық жүйелер жарық сәулесін шашуы мүмкін. Коллоидтық ертінді арқылы өткен жарық сәулесі шашырау нәтижесінде көзге көрінеді (Тиндаль пәрмені). Бұл шашылудың түрі опалесценция деп аталады. Молекулулық және иондық ерітінділер үшін мұндай пәрмен байқалмайды. Жарық сәулесін шашырату қабілеті тек бөлшектерде ғана емес, молекулалар ассоциаттарында, макромолекулаларда және ортаның біртектілігін бұзатын жіберулерде де бар. Жарық сәулесінің шашырауы заттардың сәуле бағытын өзгертумен байланысты. Сәулелі толқын бөлшектердің сәулесін өткізбейтін және жұтпайтын молекулаларды үйектейді. Осы уақытта пайда болатын қосүйектік сәт келесі түрде анықталады: μ = α*Е , мұндағы α - үйектелгіштік, Е - қозған сәуле түскенде түзілген электр өрісінің кернеулігі.
Егер сәуле кванты һν жұту энергиясы һν1 квант шашу энергиясына тең болса, онда шашылу рэлейлік немесе серпінді болады. Ол майдалық фаза бөлшектерінің мөлшері сәуле толқынының λ ұзындығынан сәл аз болса ғана мүмкін:
а < 0,1λ (8.1)
Шашырау нәтижесінде түсіп жатқан жарық сәулесінің қарқындылығы Іо өзгеріп, Іш шамасымен сипатталады. Ол Рэлейдің шашырау теориясы бойынша табылады:
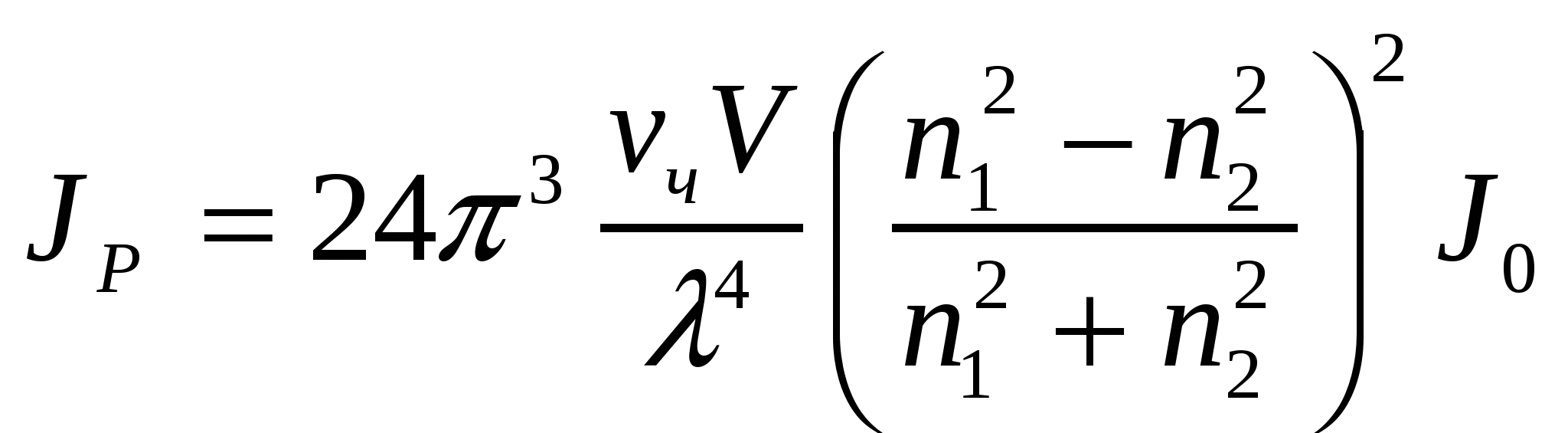 , (8.2)
, (8.2)
мұндағы νч - майдалық фазаның сандық концентрациясы; V - бөлшек көлемі (шар тәрізді үшін 4πr3/3); r - бөлшек радиусы, λ - түсіп жатқан сәуленің толқын ұзындығы, n1, n2 - майдалық фазаның, майдалағыш ортаның сыну көрсеткіші.
(8.2) теңдігіне сәйкес шашырылған жарық сәулесінің қарқындылығы басқа да тең жағдайларда бөлшек мөлшері мен сандық концентрацияға тәуелді:
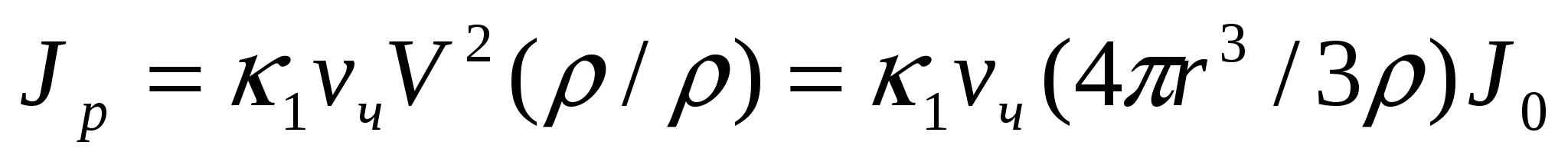 (8.3)
(8.3)
мұндағы Jp - шашырылған жарық сәулесінің қарқындылығы; Jо - түсіріліп жатқан жарық сәулесінің қарқындылығы; νм - майдалық фазаның массалық концентрациясы; к1 - пропорционалдық коэффициент (Рэлей теңдеуінің басқа мүшелері тұрақты екенін көрсетеді); ρ - бөлшек материалының тығыздығы.
(8.2) теңдігінен шашырылған жарық сәулесінің қарқындылығы түсіп жатқан сәуленің дәрежесі төрт толқын ұзындығына кері пропорционал екенін көреміз:
![]() . (8.4)
. (8.4)
Өткен және түсіп жатқан жарық сәулелерінің қарқындылығының арақатынасын бағалау үшін Бугер - Ламберт теңдігін қолданамыз:
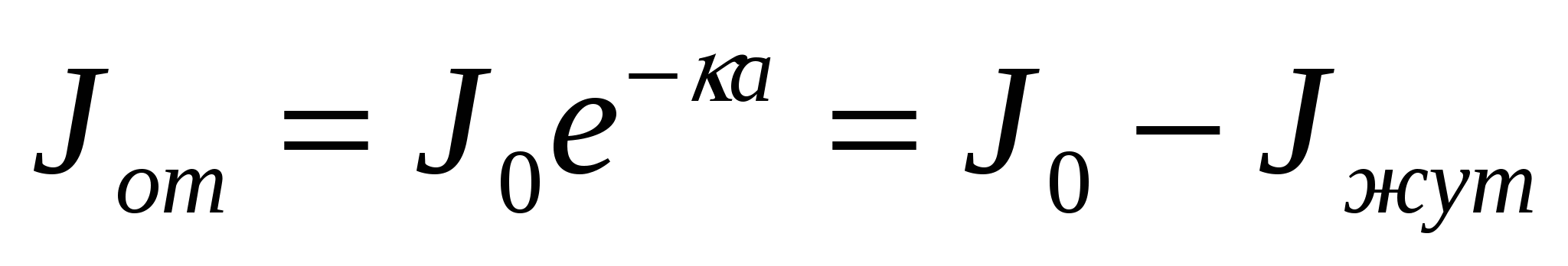 ,
,
мұндағы к- жұту коэффициенті, а - майдалық фаза бөлшегінің мөлшері, Jпр - өткен жарық сәулесінің қарқындылығы, Jпог - затпен жұтылған жарық сәулесінің қарқындылығы, Jо - түсіп жатқан жарық сәулесінің қарқындылығы. Бұдан:
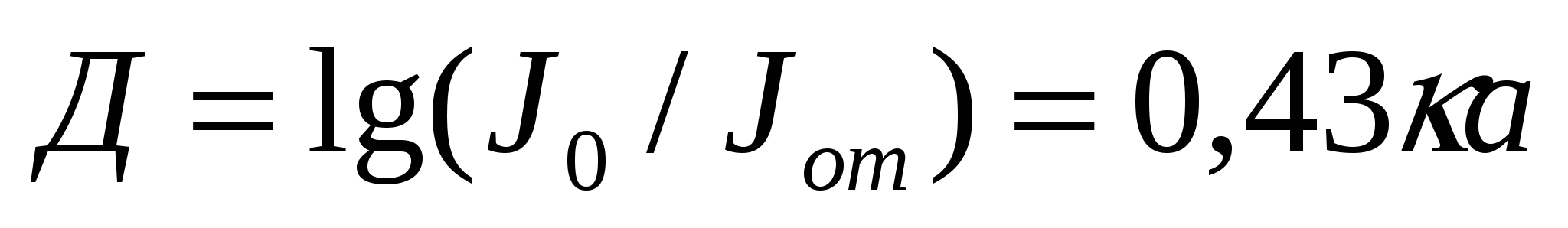 (8.5)
(8.5)
мұндағы Д - оптикалық тығыздық немесе экстинция.
Экстинция жарық сәулесінің затта тарлу кезіндегі әлсізденуді сипаттайды.
Жаттығулар.
1-есеп.
Егер бөлшек материалының тығыздығы мен бөлшек концентрациясы және түсірілген жарық сәулесінің қарқындылығы тұрақты болса, бөлшектер мөлшерін жиырмадан сексен нанометрге дейін ұлғайтса, шашырылған жарық сәулесінің қарқындылығы қалай өзгереді?
Шешуі:
(8.3) формуласын екі жоғары майдалық жүйе үшін былай көрсетуге болады:
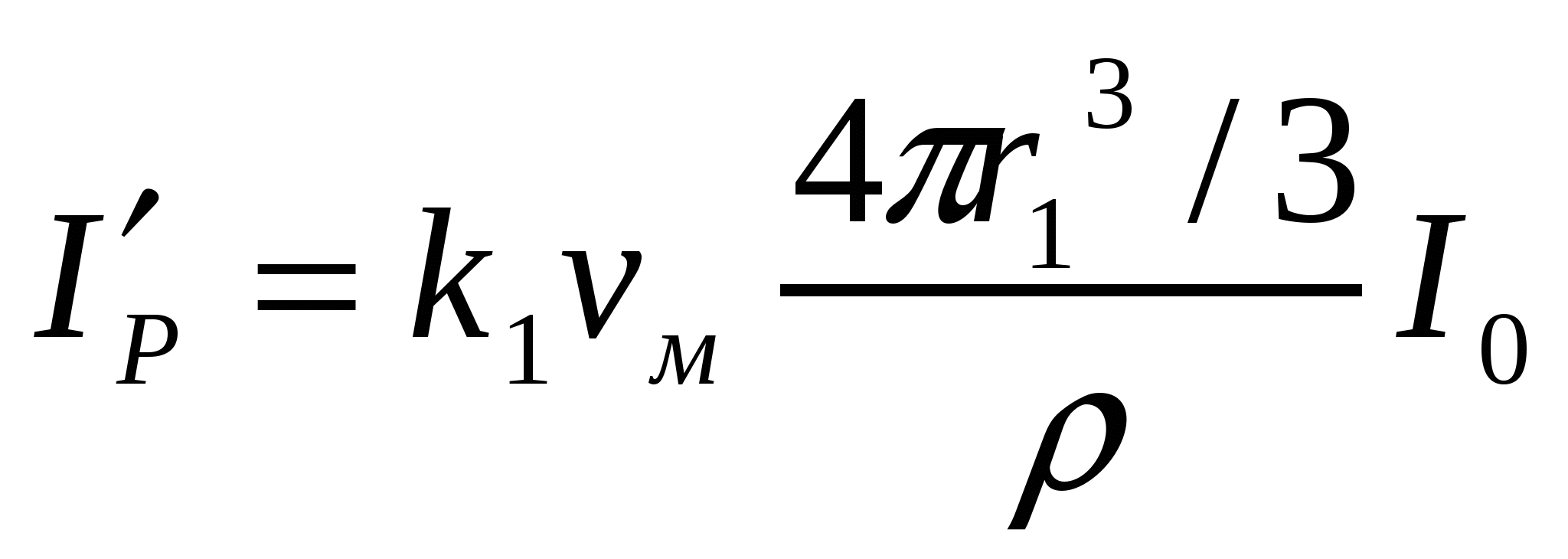 ;
; 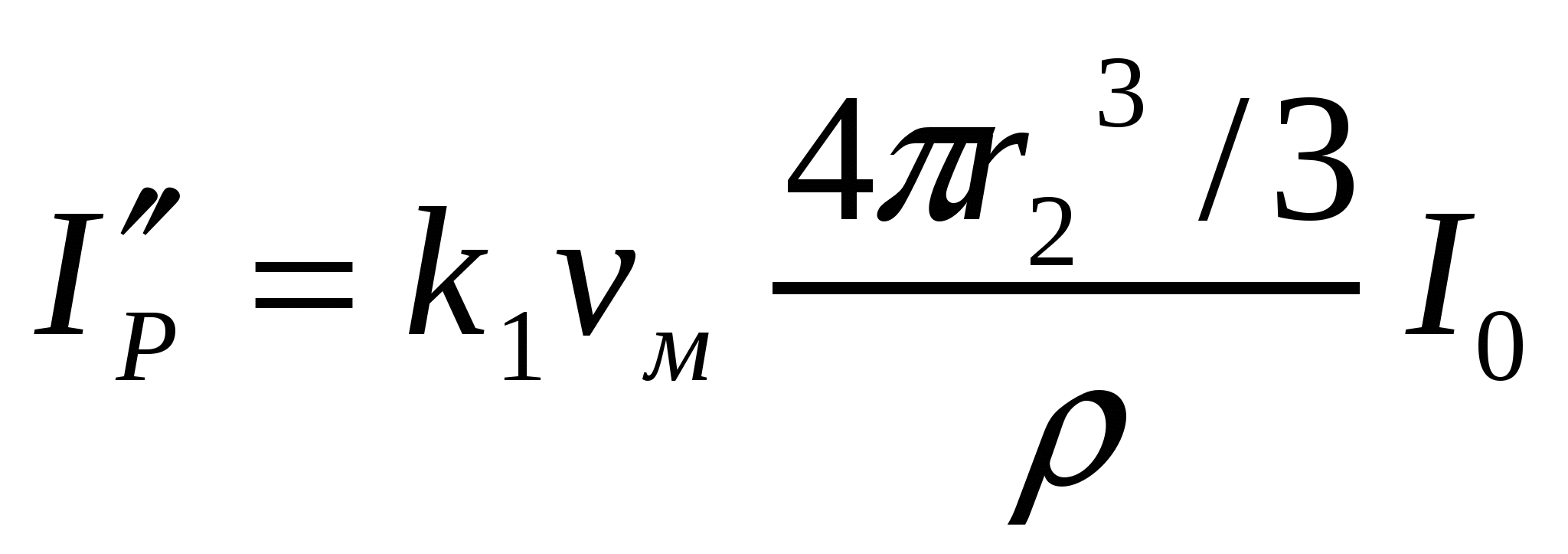 ;
;
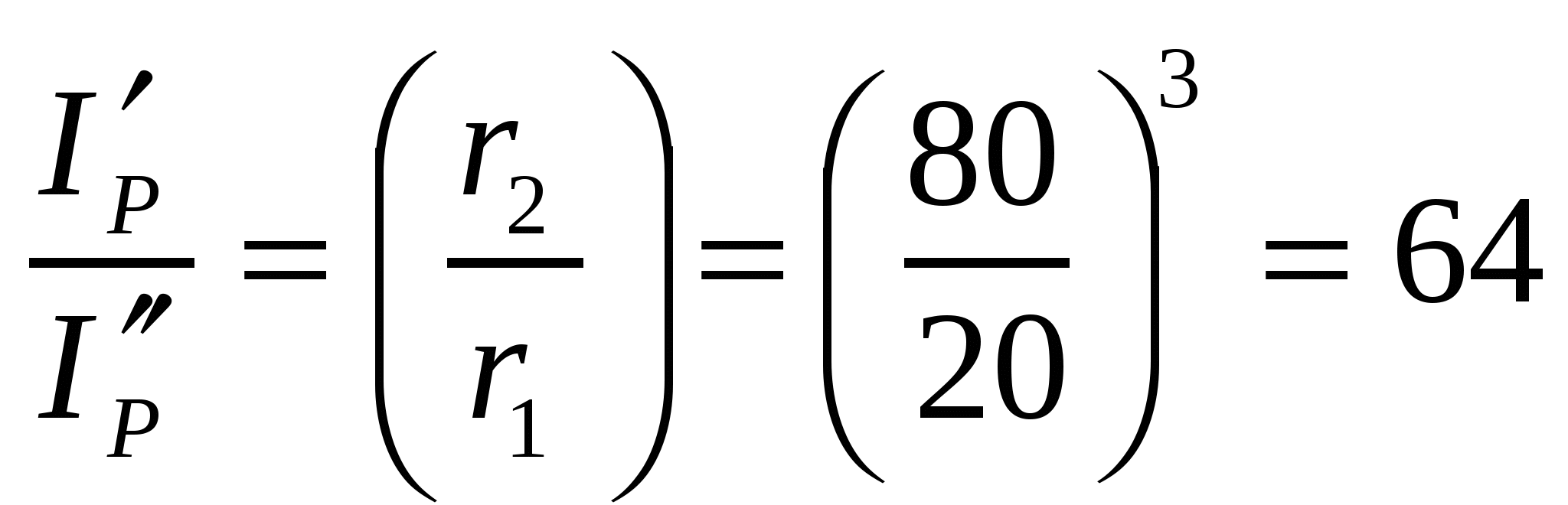 .
.
бөлшектер өлшемін 20-дан 80 нм-ге дейін ұлғайтқанда шашырылған жарық сәулесінің қарқындылығы 64 есе азаяды.
2-есеп.
Майдалық жүйе болатын жеміс шырынына жарық сәулесімен (λ1 = 430нм, λ2 = 680нм) әсер еткенде шашылған жарық сәулесінің қарқындылығы қалай өзгереді?
Шешуі:
(8.4) формуласымен толқын ұзындығының қос мәндері арқылы қарқындылық мәнін есептеуге болады:
![]() ;
; 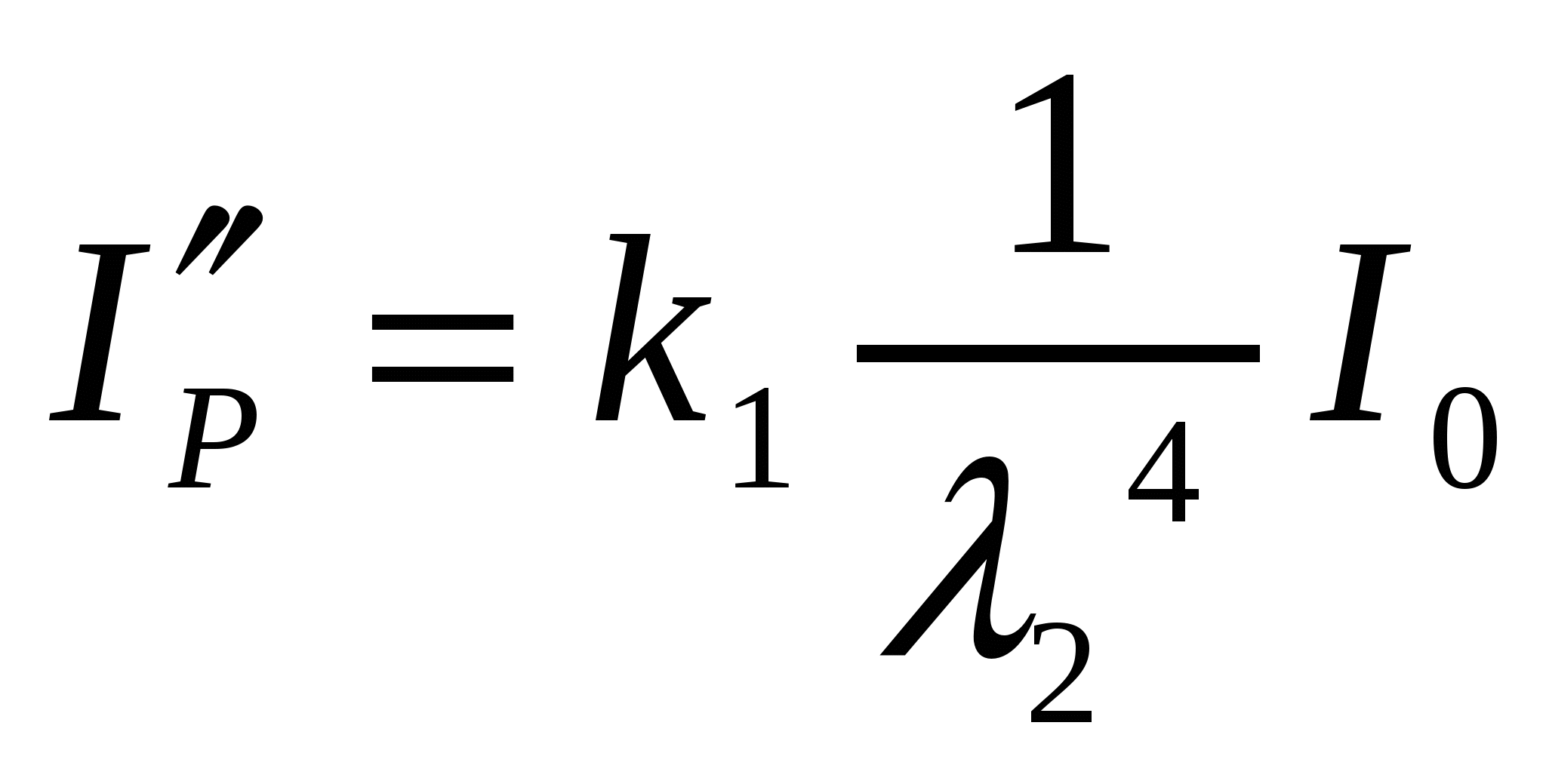 ;
; 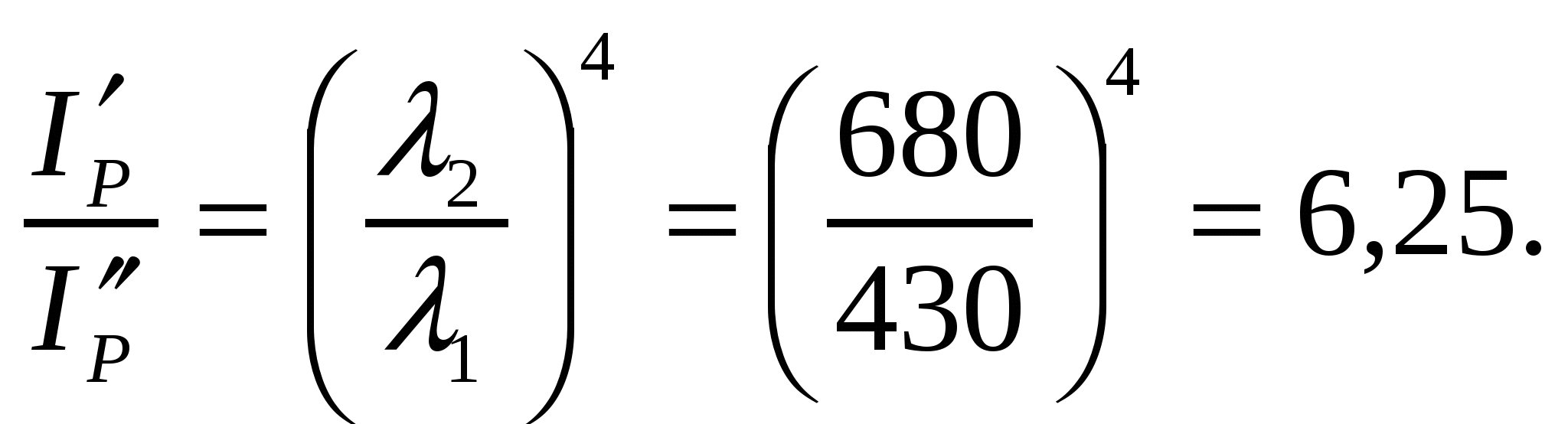
Жарық сәулесінің толқын ұзындығын 430-дан 680-ге дейін өсіргенде шашырылған жарық сәулесінің қарқындылығы 6,25 есе азаяды.
3-есеп.
Түсірілген жарық сәулесінің ұзындығы 0,6 мкм болғандағы қалыңдығы 12 мм нан түйірінің экстинциясын анықтау керек. Сіңу (жұту) коэффициенті бұл жағдайда 270 м-1 мәніне тең.
Шешуі:
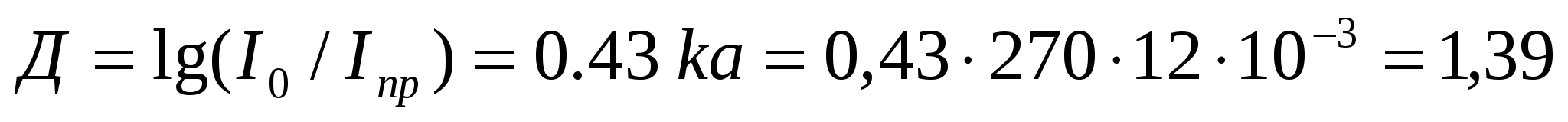
9. Жоғары майдалық жүйелердің молекулалық - кинетикалық қасиеттері.
1914 жылы неміс физико-химигі Вольфран Оствальт кең ғылыми қоғамды «айналып өтілген шамалар» деп атаған дүниеге, яғни бөлшектері молекулалар мөлшерінен үлкен, бірақ микроскоппен көрінбейтін майдалық жүйелерге назар аудартты. Мұндай жүйелер үшін айрықша молекулалық-кинетикалық қасиеттер тән.
Молекуллық-кинетикалық теорияның ашылуы А.Эйнштейн атымен байланысты және ХХ ғасыр басында заттың молекулалық табиғатын көрсететін дәлел ретінде берікті мәнге ие болды.
Молекулалық-кинетикалық қасиеттер молекулалардың өз еркіндік қозғалысынан шығады және ол броундық қозғалыста, диффузияда, осмоста, седиментациялық тепе-теңдікте көрінеді. Газ немесе сұйықтықта жүзгінделген ұсақ бөлшектердің майдалағыш орта молекулаларының әсері есебінен хаостық, әр бағытқа тең мүмкіндікті қозғалысы броундық деп аталады. Массасы үлкен емес бөлшектер майдалағыш орта молекулалары тарапынан бірдей соққыға ұшырамайды; Ғ нәтижелегіш күш үздіксіз бағытпен импульсті өзгертеді, сондықтан бөлшектер хаостық қозғалыс жасайды. Ғ нәтижелегіш күшті анықтау үшін есептеулер негізінде орташа жылжу алынған. Ол орта квадраттық бөлшектер ығысуын анықтайды:
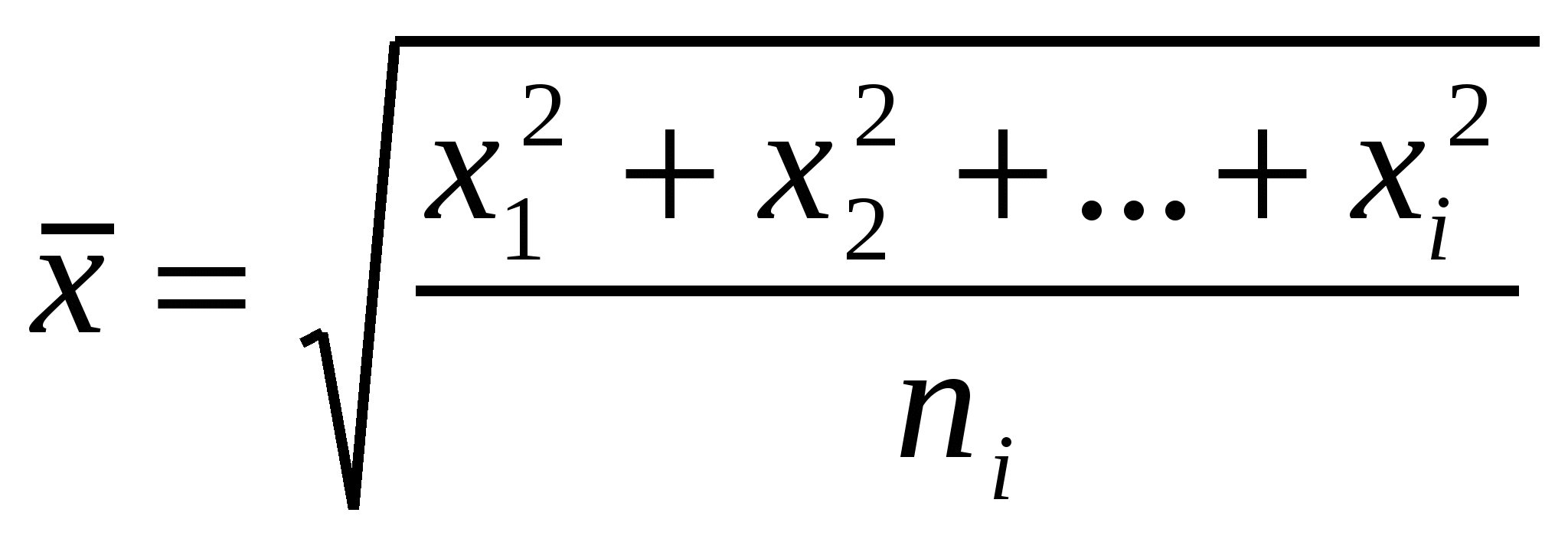 , (9.1)
, (9.1)
мұндағы х1,х2, ..., хі - белгілі уақыттағы бөлшектер ығысуы.
Броундық қозғалыс теориясы молекулалар соққысын сипаттайтын кездейсоқ f(τ) күшінің уақытқа тәуелді Ғτ күшінің майдалағыш ортада майдалық фаза бөлшектерінің қозғалысы кезінде үйкеліс күші әрекеттесуінен шығады. Кездейсоқ броундық қозғалыс (Ланжевен) теңдеуі:
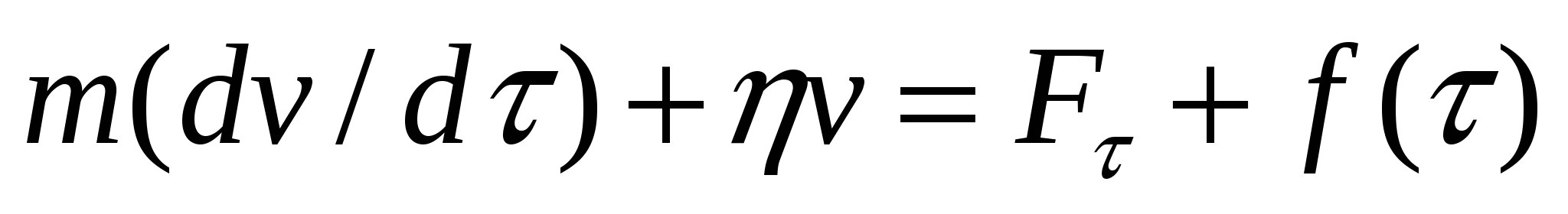 , (9.2)
, (9.2)
Уақыт аралығы үлкен болғанда (τ >>m/η) бөлшектер инерциясын (m(dν/dτ)) елемеуге болады. (9.2) интегралдаудан кейін импульстардың орташа көбейтіндісі нөлге тең деп алынған жағдайда, флуктуацияның (орташа жылжудың) орташа мәнін табамыз:
![]() , (9.3)
, (9.3)
мұндағы τ - уақыт, r - майдалық фаза бөлшектерінің радиусы, NA - Авогадро саны.
(9.3(формуласында майдалық фаза мен майдалағыш ортаның параметрлері көрсетілген: RT/NA шамасы майдалағыш ортаның молекулалық-кинетикалық қасиеттерін сипаттайды, η оның тұтқырлығы, r майдалық фазаға жататын параметр,τ уақыт, майдалағыш орта мен майдалық фазаның әрекеттесуін анықтайды.
Бөлшектің өз еркімен жоғары коцентрлі аймақтан төмен концентрлі аймаққа таралуын диффузия деп атайды. Диффузияның келесі түрлері болады: молекулалық, иондық және коллоидтық бөлшектер диффузиясы. (9.3) формуласын қолданып диффузия коэффициентін келесі түрде көрсетуге болады:
![]() , (9.4)
, (9.4)
Егер диффузия коэффициенті белгілі болса, (9.4) формуласымен бөлшек мөлшерін табуға болады:
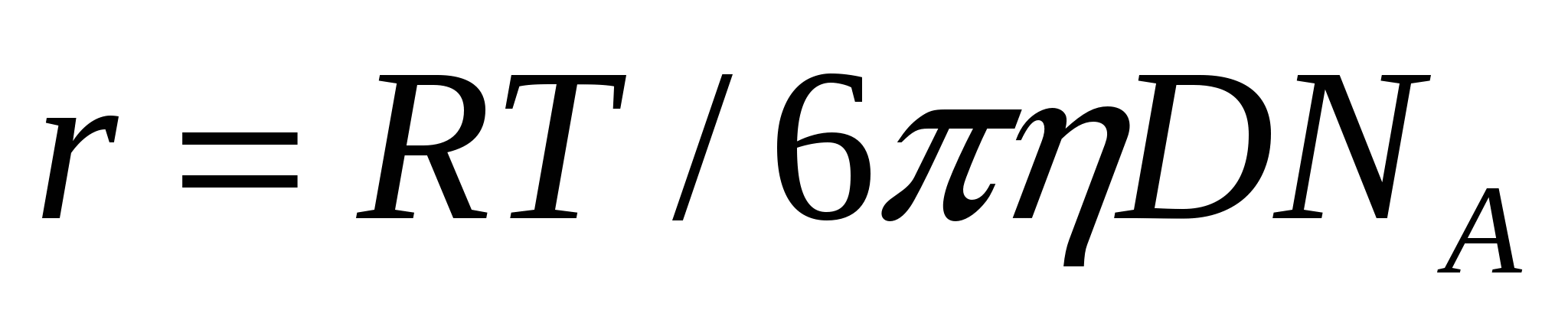 ;
; 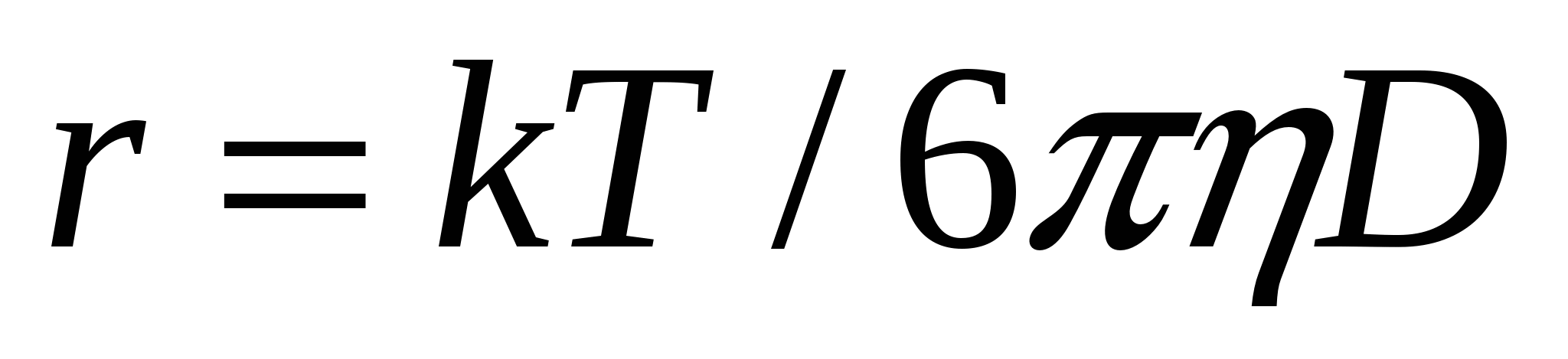 (9.5)
(9.5)
Берілген формулалар эксперименталды түрде Больцман тұрақтысы мен Авогадро санын анықтауға мүмкіндік береді.
Әртүрлі концентрациялы ерітінділерді немесе ерітінді мен таза еріткішті жарғақ арқылы бөлсек, еріткіштің төмен концентрациядан жоғары концентрацияға концентрацияны теңестіретін ағысы пайда болады. Бұл процесс осмос деп аталады. Осмостық қысымды келесі формуламен анықтауға болады:
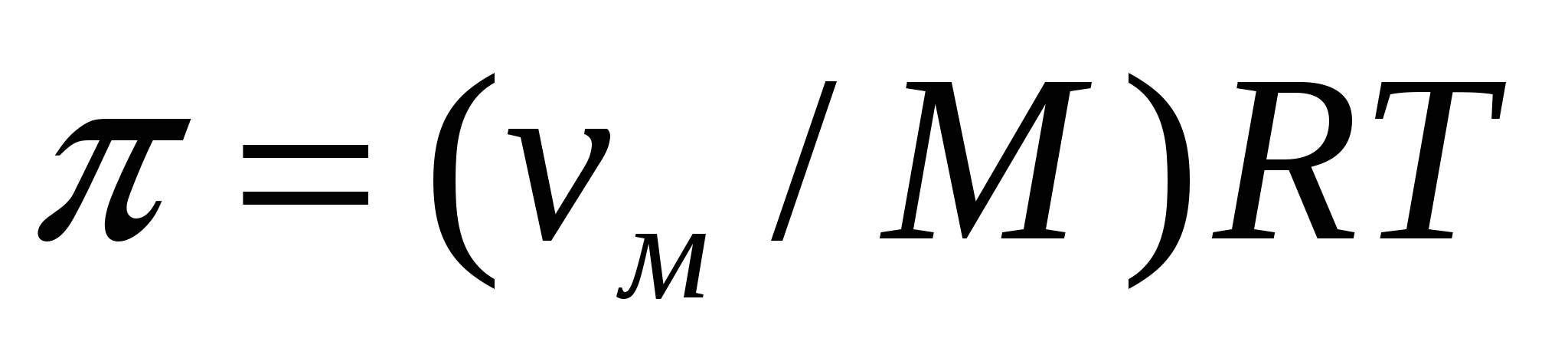 (9.6)
(9.6)
мұндағы π - осмостық қысым, νм - массалық концентрация, М - еріген заттың молекулалық массасы.
(9.6) формуласы осмостық қысымды анықтауда негізгі болып танылады. Ол осмостық қысымның еріген заттың бөлшектер мөлшерінен тәуелді екенін көрсетуге қолданылады. Бұл мақсатта майдалық фаза массасын келесі түрде көрсетуге болады:
![]() ,
, 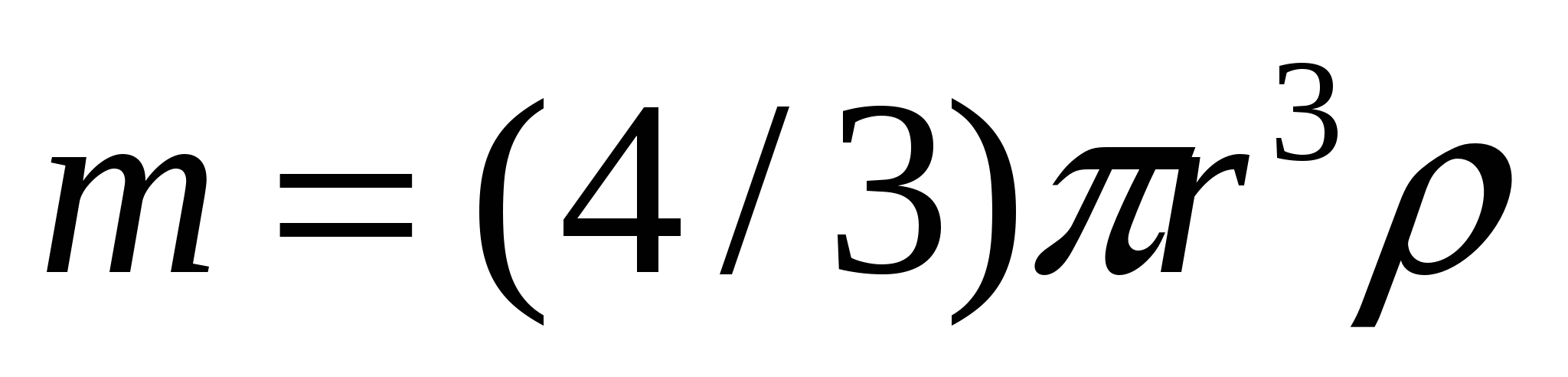 , (9.7)
, (9.7)
мұндағы m, r - майдалық фазаның массасы мен радиусы, ρ - бөлшек материалының тығыздығы.
(9.6)теңдігіне (9.7) теңдігінен М мәнін қоямыз, сонда
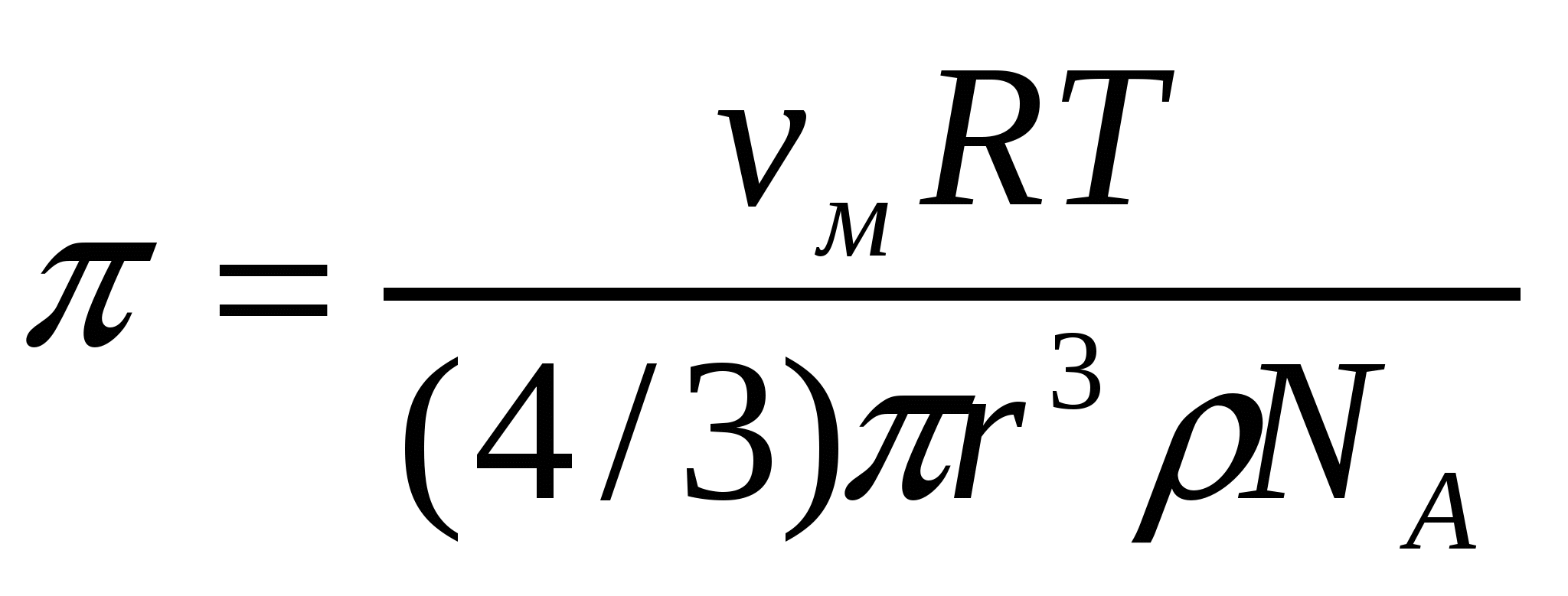 . (9.8)
. (9.8)
(9.8)формуласын коллоидтық ерітінділерді анықтау үшін қолданады.
Жаттығулар.
1-есеп.
Т = 293К, η = 10-3Па*с кезінде, τ = 4с уақыт ішінде радиусы 10м эмульсия тамшысының орташа ығысуын анықтау керек.
Шешуі:
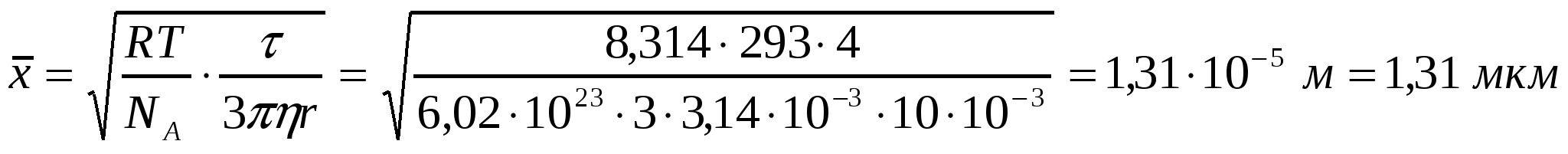 .
.
2-есеп.
Сабын суда радиусы 12,5 нм болатын мицеллалар түзеді. 313К кезіндегі диффузия коэффициентін анықтау қажет. Ерітінді тұтқырлығы 6,5*10-4 Па*с.
Шешуі:
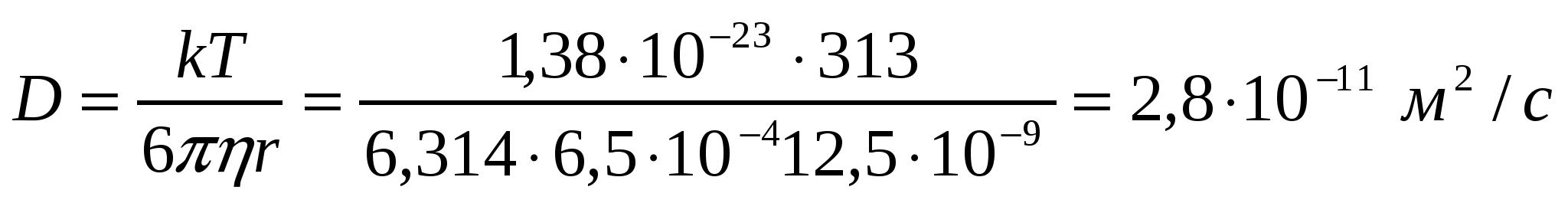
3-есеп.
293К кезінде, егер диффузиялық коэффициент 7,8*10-11м2/с және су тұтқырлығы 10-3 Па*с болса,судағы жұмыртқа альбуминінің бөлшектерінің мөлшерін анықтау қажет.
Шешуі:
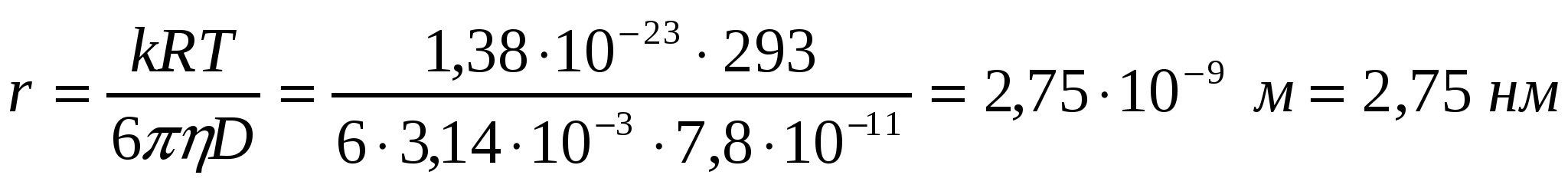
4-есеп.
Молекула диаметрі d1 0,8 нм болатын қант қызылшасы шырыны ерітіндісінің осмостық қысымы π1, молекула диаметрі d2 80 нм болатын қызылшаның коллоидты ерітіндісінің осмостық қысымынан қанша есе жоғары? Коллоидты және молекулалық ерітінділер концентрациялары мен тығыздықтарын бірдей деп есептеу керек.
Шешуі:
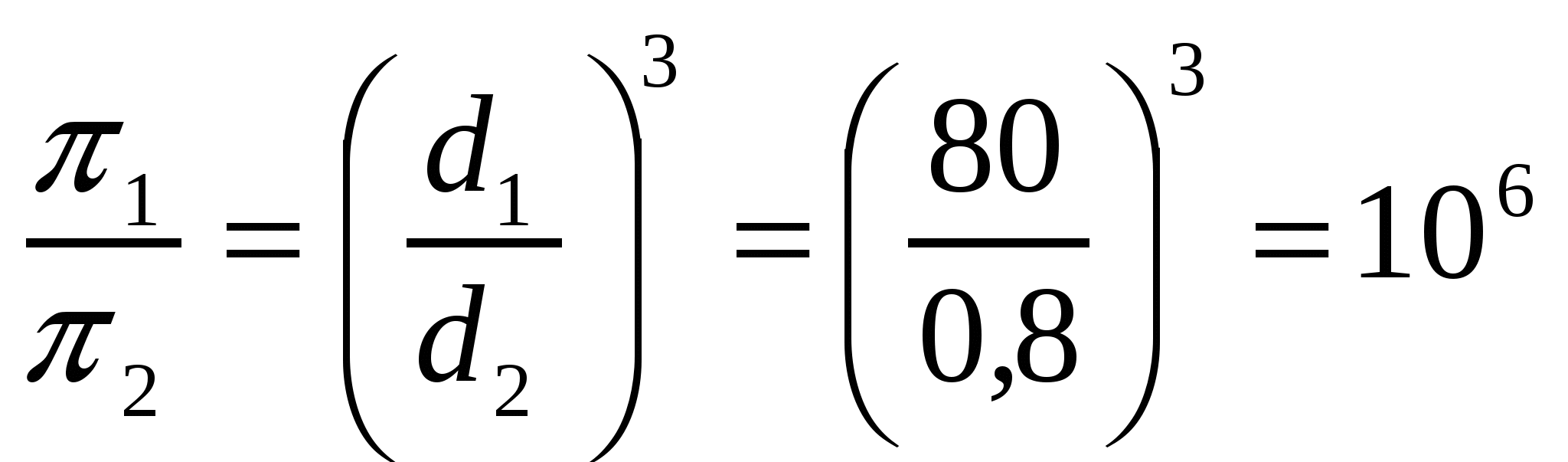
Молекулалық ерітіндінің осмостық қысымы 106 есе жоғары.
5-есеп.
Тығыздығы 1,3*103 кг/м3, бөлшектердің орташа радиусы 40мкм, концентрациясы 1,5*10-2 кг/м2 болатын шаңның осмостық қысымын табу керек (293К).
Шешуі:
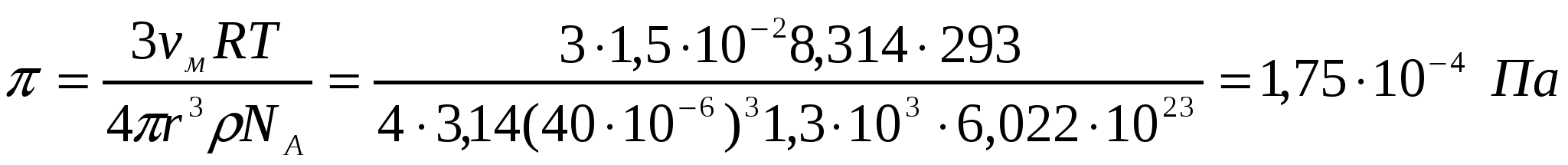
яғни осмостық қысымы аз.
10. Майдалық жүйелердің тұрақтылығы.
Тұрақтылық мәселесі - коллоидтық химияда негізгі мәселе болып табылады, бұл майдалық жүйелердің «өлім мен өмір» мәселесі. Майдалық жүйе тұрақтылығы майдалық фаза қасиеттерімен (бөлшектер мөлшерімен, майдалағыш ортамен, жентекті күймен, қоспалардың болуымен)анықталады және ол фазаның бөліну шекарасының болуының, сол шекарадағы артық беттік энергияның тіке салдары болып саналады. Майдалық жүйені сақтау немесе жою, яғни оны тұрақты немесе тұрақсыз ету тәжірибе қойған қарама-қарсы мақсаттар. Мысалы: қан майдалық жүйе болып танылады, оның тұрақтылығы ағзаның бар өмірлік ғұмырында сақталады. Азықтық массалар тұрақты болуы тиіс. Су қоймалардағы су майдалық жүйелердің бірі, сондықтан оны қолданғанда тазарту керек, яғни тазарту кезінде майдалық жүйе бұзылады. Майдалық жүйелердің тұрақтылығы олардың өз құрамын сақтап қалу мүмкіндігі, яғни уақыт ішінде майдалық фаза концентрациясымен бөлшектер таралуының тұрақты болуы. Тұрақтылық сұйық және газ майдалағыш ортасы бар майдалық жүйелердің маңызды сипаттамасы.
Тұрақтылықтың екі түрін ажыратады: седиментациялық және жентектік.
Седиментациялық тұрақтылық бөлшектердің тұнуына әрекетесу мүмкіндігімен анықталады. седиментация немесе тұну майдалық жүйенің бұзылуына әкеледі. Майдалық фаза бөлшектеріне Р гравитациялық күші әсер етеді. Бұл бөлшектердің тұнуын тудырады. Седиментациялық тепе-теңдік бөлшектер мөлшері 100 нм-ден жоғары болғанда бұзылады, себебі бөлшектер тұна бастайды. Тұну жылдамдығы тұрақты жағдайда Р гравитация Ғүйк үйкеліс күші арасында тепе-теңдік орнатады:
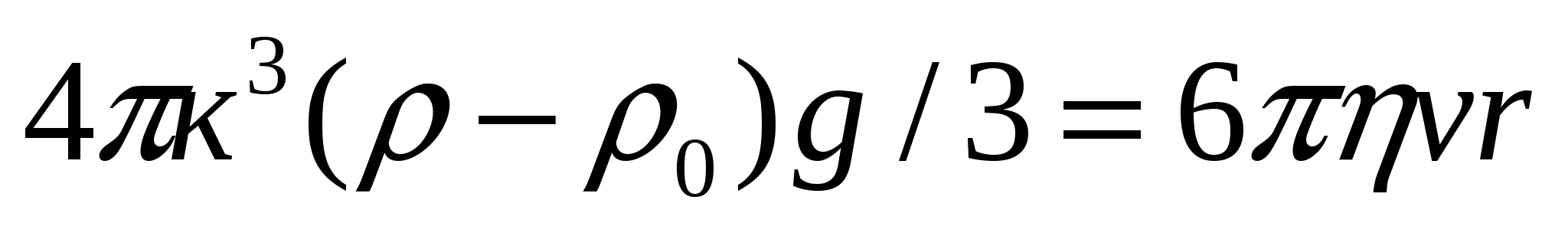 , (10.2)
, (10.2)
мұндағы η - майдалағыш орта тұтқырлығы, ν - тұну жылдамдығы, ρ - бөлшектер материалының тығыздығы, ρо - майдалағыш орта тығыздығы.
Жентекті тұрақтылық пен тұрақсыздық бөлшектердіңғ жақындасу мүмкіндігімен анықталады, яғни белгілі қашықтыққа дейін жақындау. Бөлшектердің жақындасуы - іріленуге қажет жағдай. Бөлшектердің жабысу және ірілену кинетикасы химиялық кинетика тұрғысынан екінші реттік реакция деп қарастырылады:
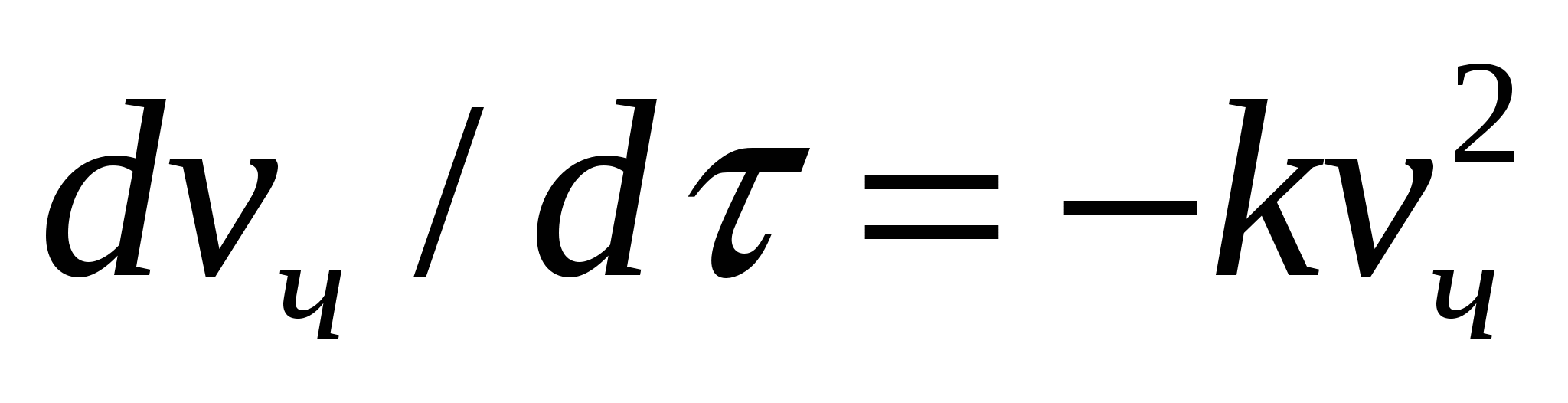 , (10.3)
, (10.3)
мұндағы к - ірілену жылдамдығының тұрақтысы, νч - сандық концентрация, d νч/dτ - ірілену жылдамдығы.
(10.3) теңдігін интегралдаймыз:
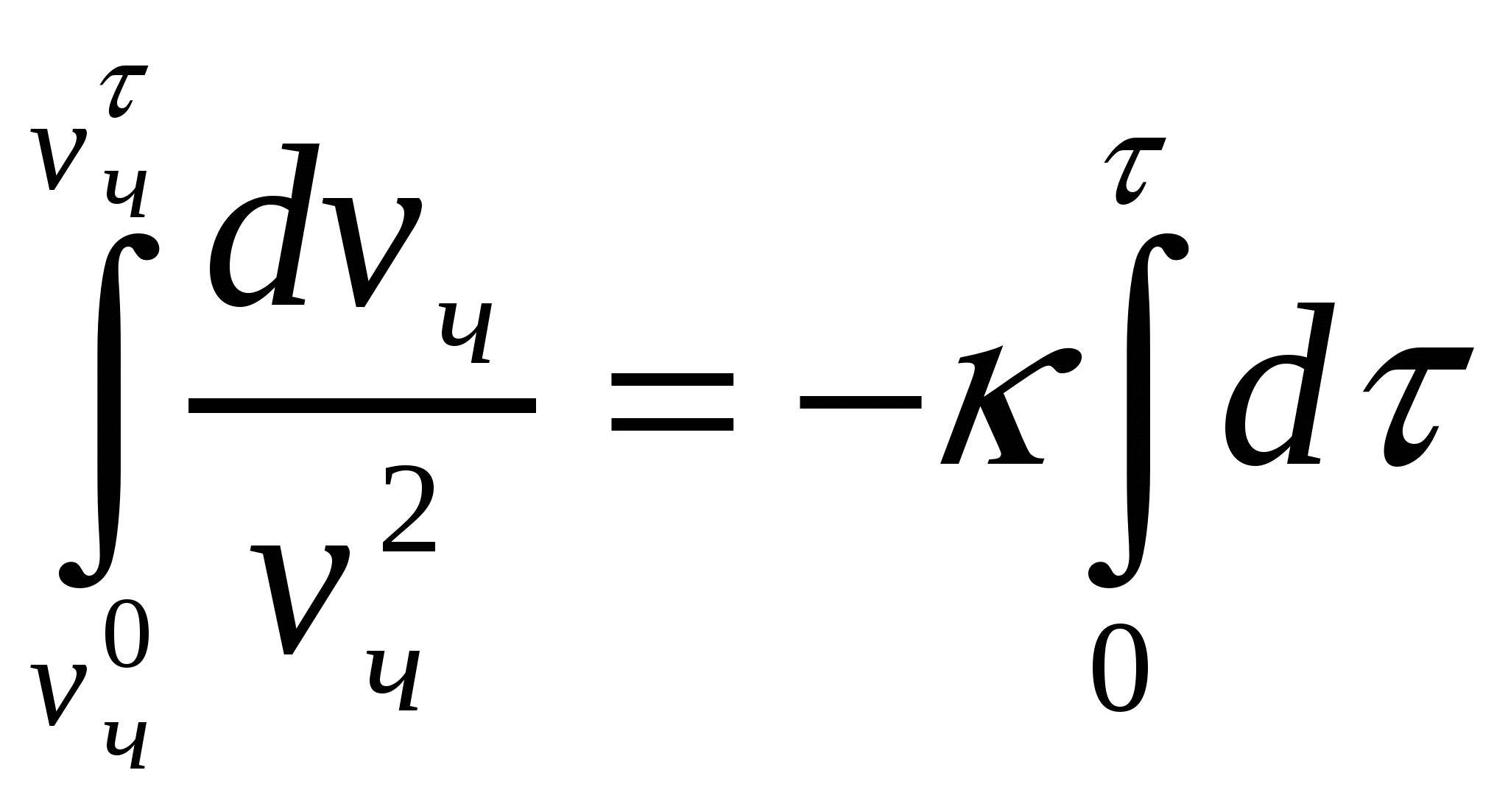 .
.
Интегралдау нәтижесі келесі түрге әкеледі:
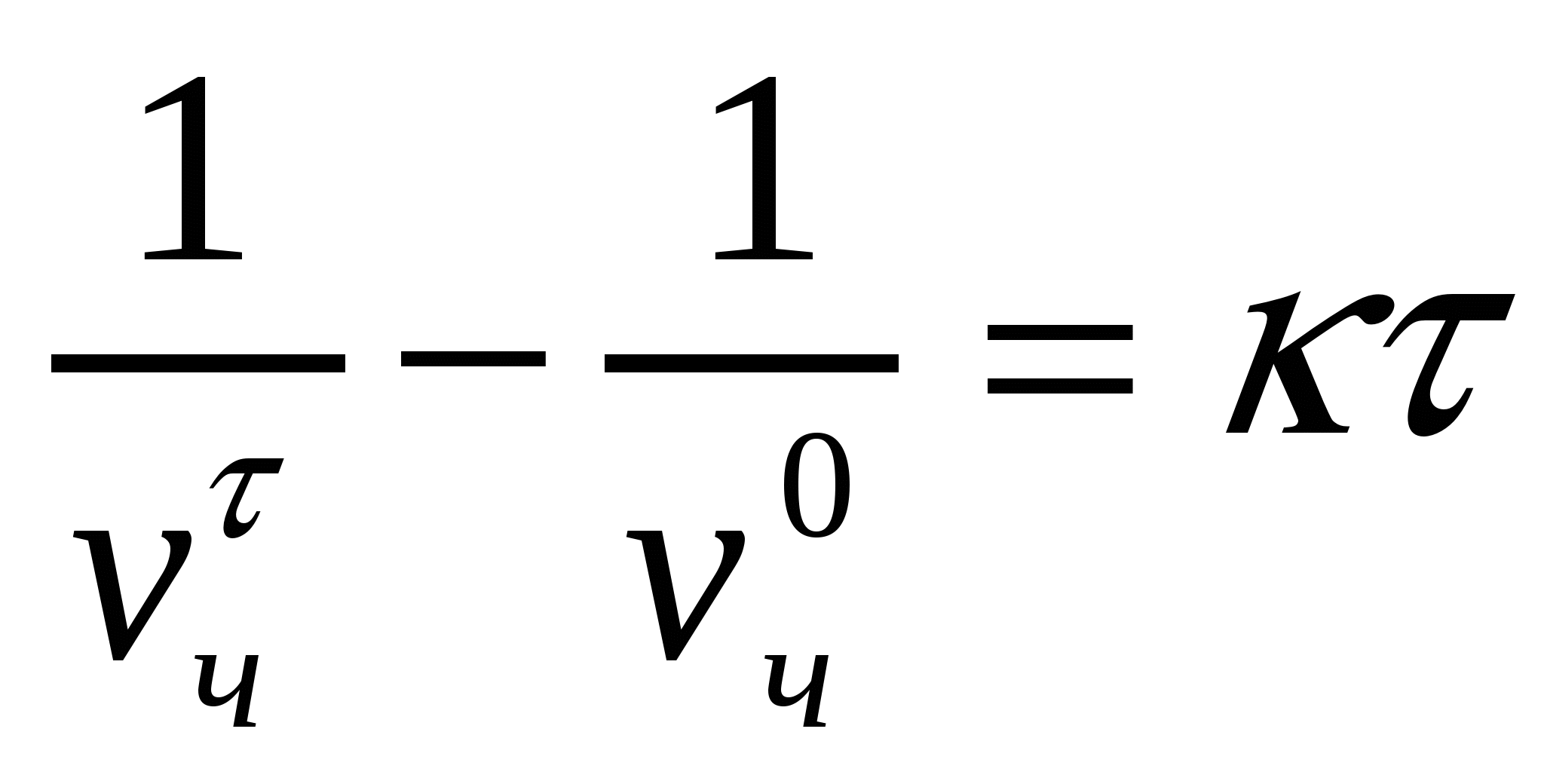 , немесе
, немесе 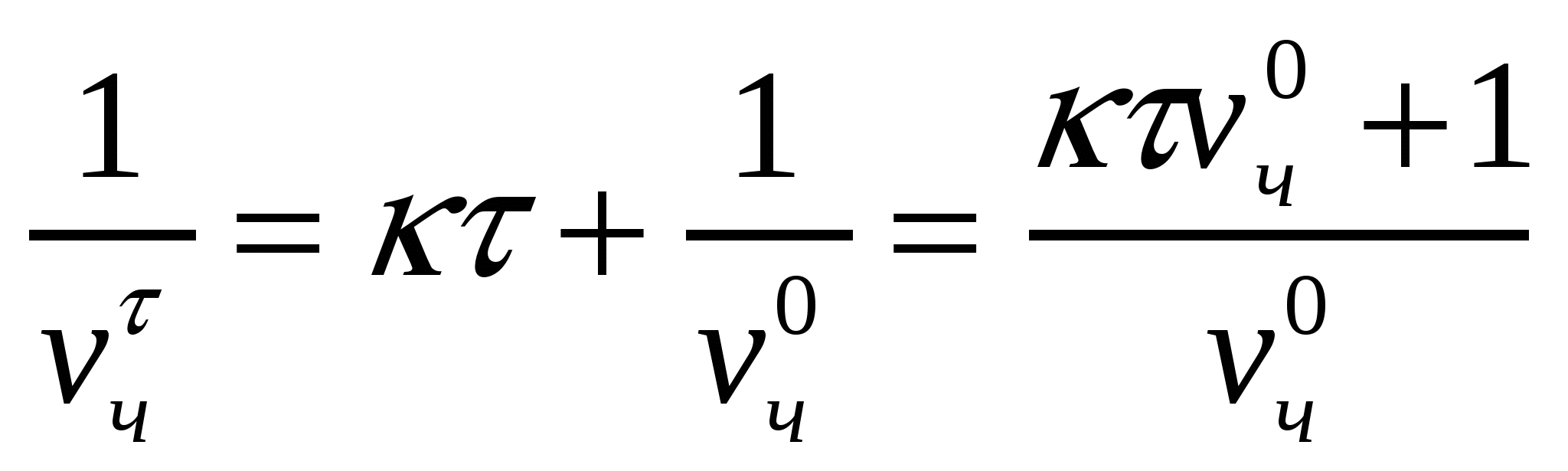 . (10.4)
. (10.4)
Сандық концентрацияны табамыз:
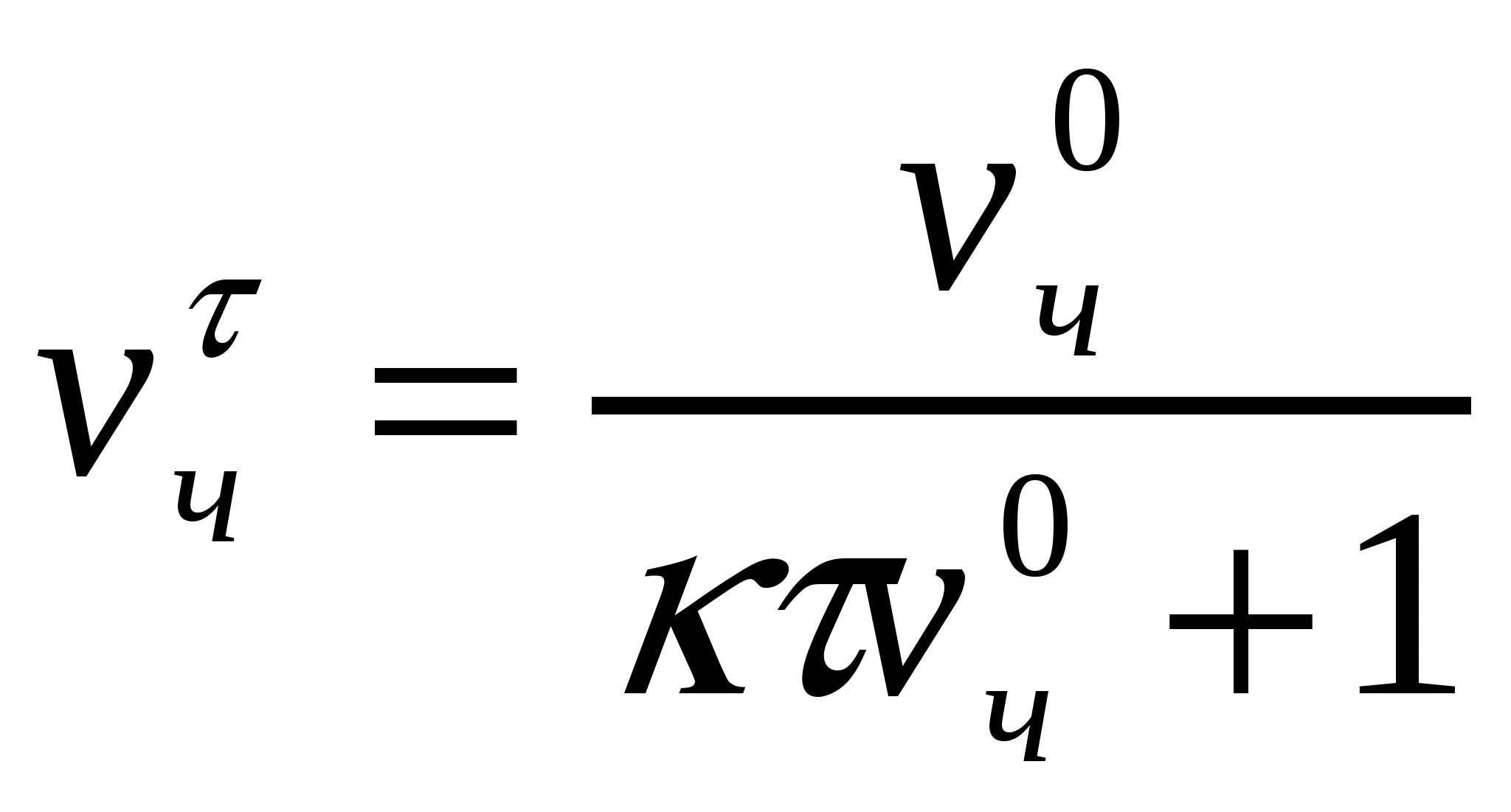 , (10.5)
, (10.5)
νчо, νчτ - іріленуге дейін және іріленуден кейінгі сандық концентрациялар.
Теңдікті жеңілдету үшін кνс шамасын жартылай ірілену арқылы көрсетеді (θ). Бұл уақыт кезінде батапқы сандық концентрация екі есе төмендейді. Ол тәжірибе арқылы анықталады. Егер νчо/2= νчτ , ал τ = 0 болса, онда:
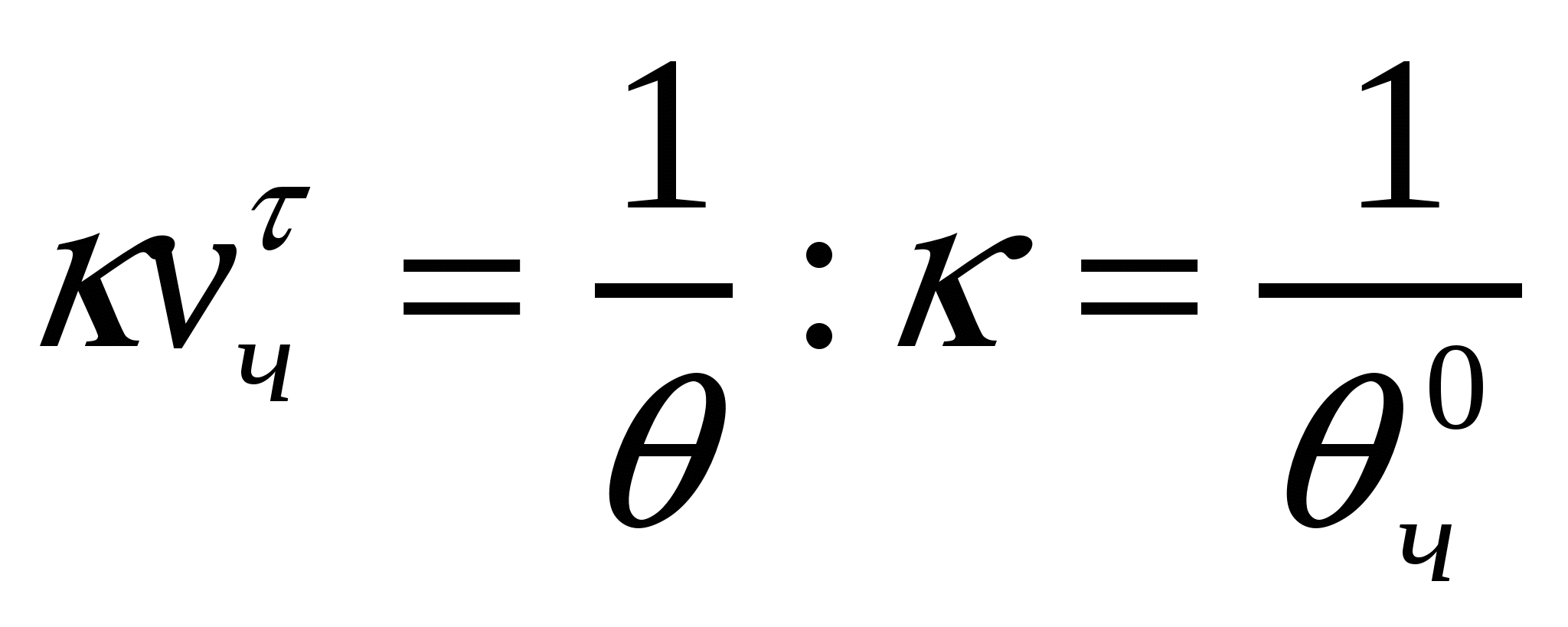 (10.6)
(10.6)
![]() . (10.7)
. (10.7)
(10.7) формуласы жылдам ірілену кинетикасын анықтайды.
Смолуховский теориясына сәйкес ірілену жылдамдығының тұрақтысы Д диффузия коэффициентіне және бөлшектердің һ арақашықтығына тәуелді:
![]() (10.8)
(10.8)
Һ қашықтықта бөлшектер арасында әсерлесу болады. Бұл қашықтық теорияға сәйкес радиустар қосындысына тең: һ = 2*r. Диффузия коэффициенті (10.1) формуласымен есептелінеді. (9.4) теңдігін (10.8) теңдігіне қойып бөлшектердің һ арақашықтығын алмастырамыз:
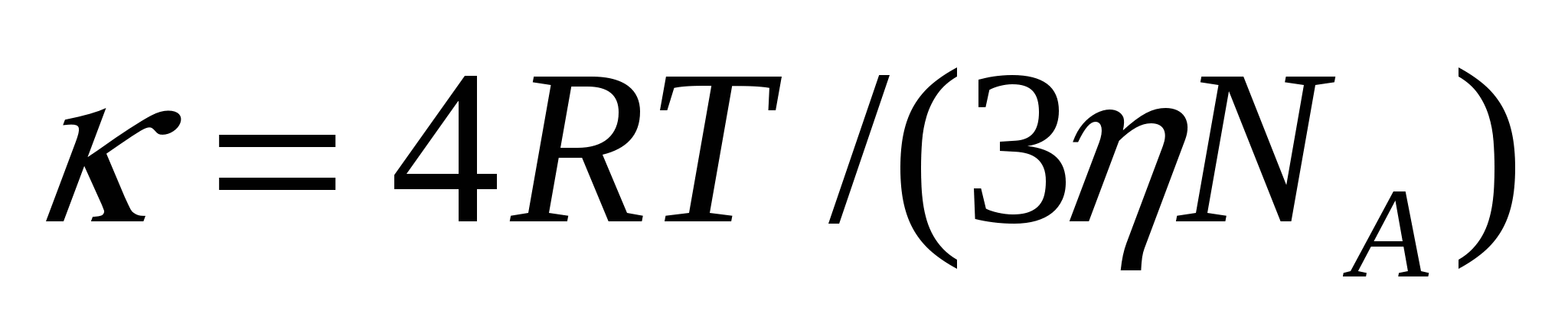 , (10.9)
, (10.9)
мұндағы η - майдалағыш орта тұтқырлығы.
Ірілену жылдамдығының тұрақтылығы, (10.9) формуласына сәйкес майдалық фаза бөлшектерінің бастапқы концентрациясына және бөлшектер мөлшеріне тәуелді емес. Ол ірілену процесі өту кезінде өзгермейді. (10.9) формуласынан есептеумен табылған Ктеор тұрақтысы жылдам іріленуді сипаттайды. Егер Кэкс > Ктеор (10.10) жағдайы сақталса, эксперименталды мәндер теориялық мәндерге сәйкес келуі мүмкін, яғни баяу ірілену орын алады.
Майдалық жүйелердің, әсіресе кірнелердің тұрақтылығын өлшеудің бір әдісі электролиттер енгізу. Электролиттер арқылы ірілену кейбір тәжірибелік ережелерге бағынады. Оларға Шульце-Гарди ережесі жатады. Ол бірдей және әртүрлі валентті қарсыиондар қосқандағы іріленудің сандық концентрациясын анықтайды. Шульце-Гардидің бірінші ережесі: неғұрлым ірілендіргіш ионның валенттілігі жоғары болса, соғұрлым іріленуге аз жұмсалады. Сандық концентрация молекулааралық әселесуде электростатикалық итерілетін электролит ионының дәрежесі алты Z валенттілігіне кері пропорционал:
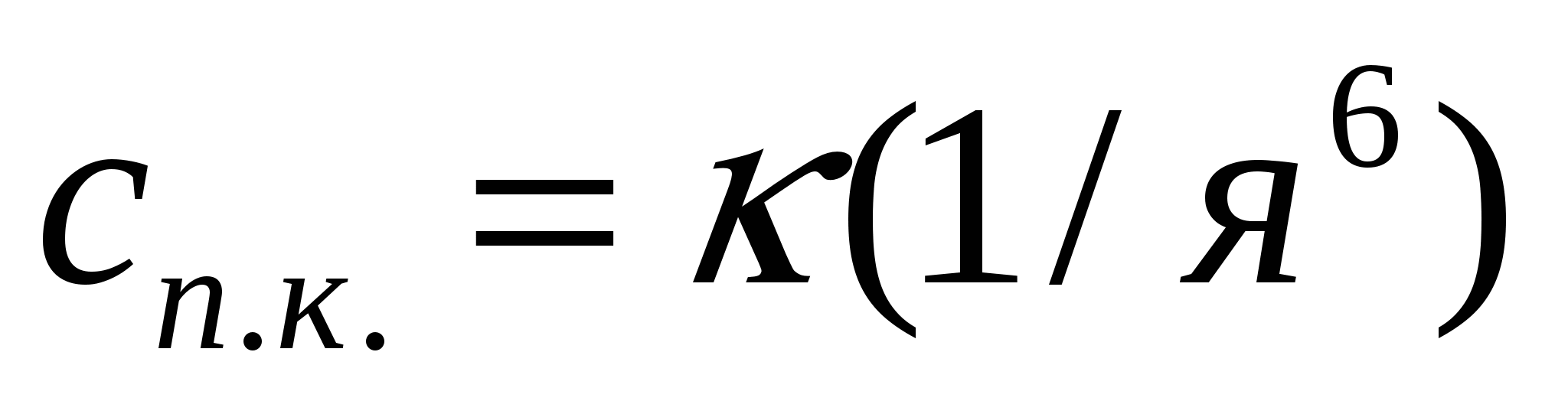 (10.11)
(10.11)
мұндағы к - майдалық фаза, майдалағыш орта мен ҚЭҚ құрылымын сипаттайтын коэффициент.
Егер 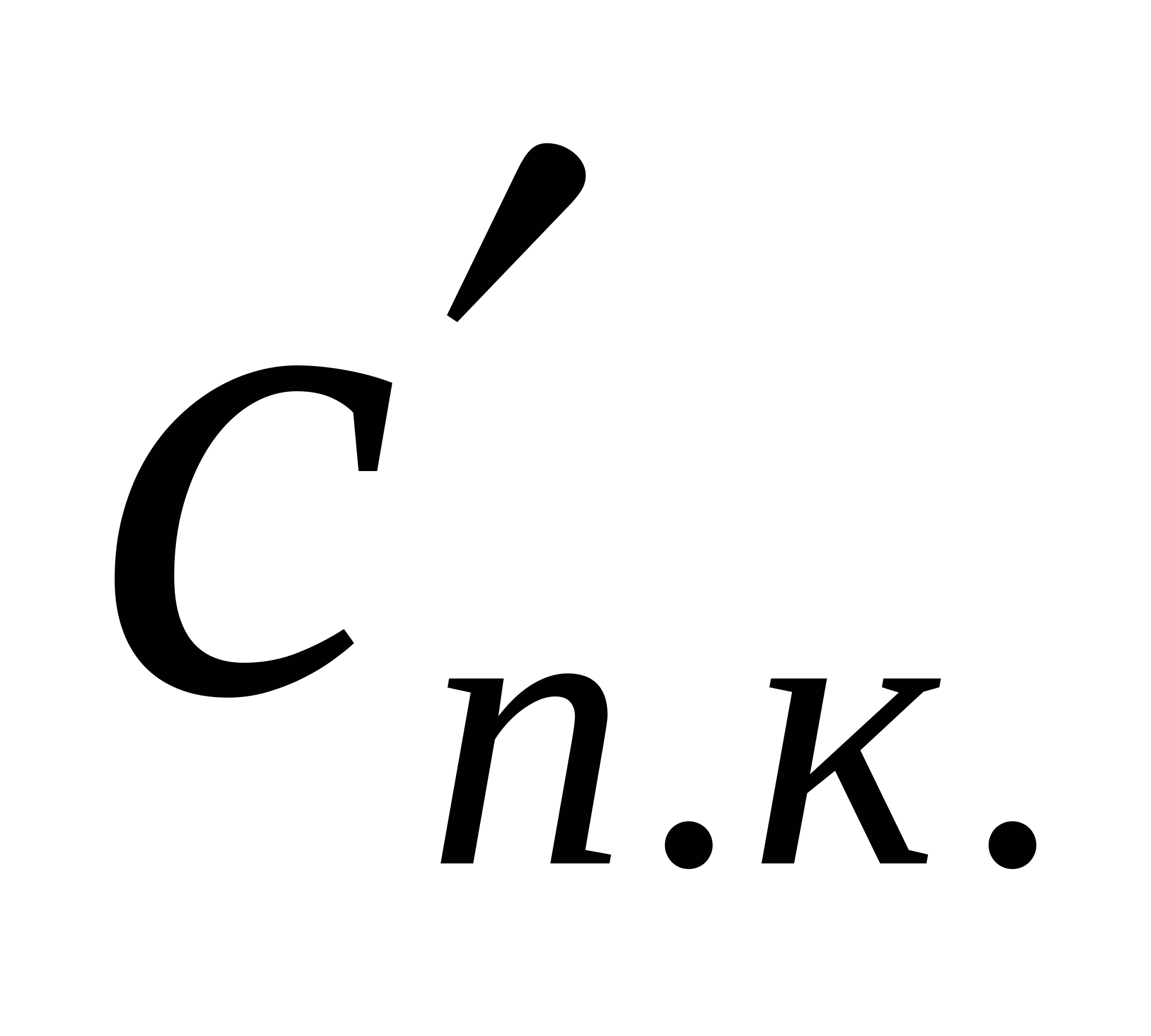 ,
, ,
,  арқылы бір, екі және үш валентті иондар туғызатын іріленудің сандық концентрациясын белгілесек, (10.11) жағдайына сәйкес бір майдалағыш орта үшін осы шамалар арақатынасы:
арқылы бір, екі және үш валентті иондар туғызатын іріленудің сандық концентрациясын белгілесек, (10.11) жағдайына сәйкес бір майдалағыш орта үшін осы шамалар арақатынасы:  ,
, ,
,  = 1:(1/26):(1/36) = 1:0,016: 0,0014 (10.12) мәндеріне ие болады.
= 1:(1/26):(1/36) = 1:0,016: 0,0014 (10.12) мәндеріне ие болады.
Іріленудің сандық концентрациясын басқа да әдіспен анықтауға болады. Ол үшін электролит концентрациясын (СЭ, моль/м3), кірненің Vкірне (м3) көлем бірлігіне есептегендегі ірілену туатын V (м3) көлемге көбейту керек:
Сс.к. = СЭ * V/Vкірне (10.13)
Формула Vкірне > V болғанда ғана қолданбалы, ал іріленудің сандық концентрациясы моль/м3 өлшемімен анықталады.
Жаттығулар.
1-есеп.
Кофе дәндерін суда (η = 1,0*103Па*с) және ауада (η = 1,81*10-7Па*с) үгкенде радиусы 10мкм болатын бөлшектердің тұну жылдамдығын анықта; кофе тығыздығы ρ = 1,1*103кг/м3, су тығыздығы ρ = 1,0*103 кг/м3 және ауа тығыздығы 1,205 кг/м3 (Т = 293К).
Шешуі:
(10.2) формуласынан
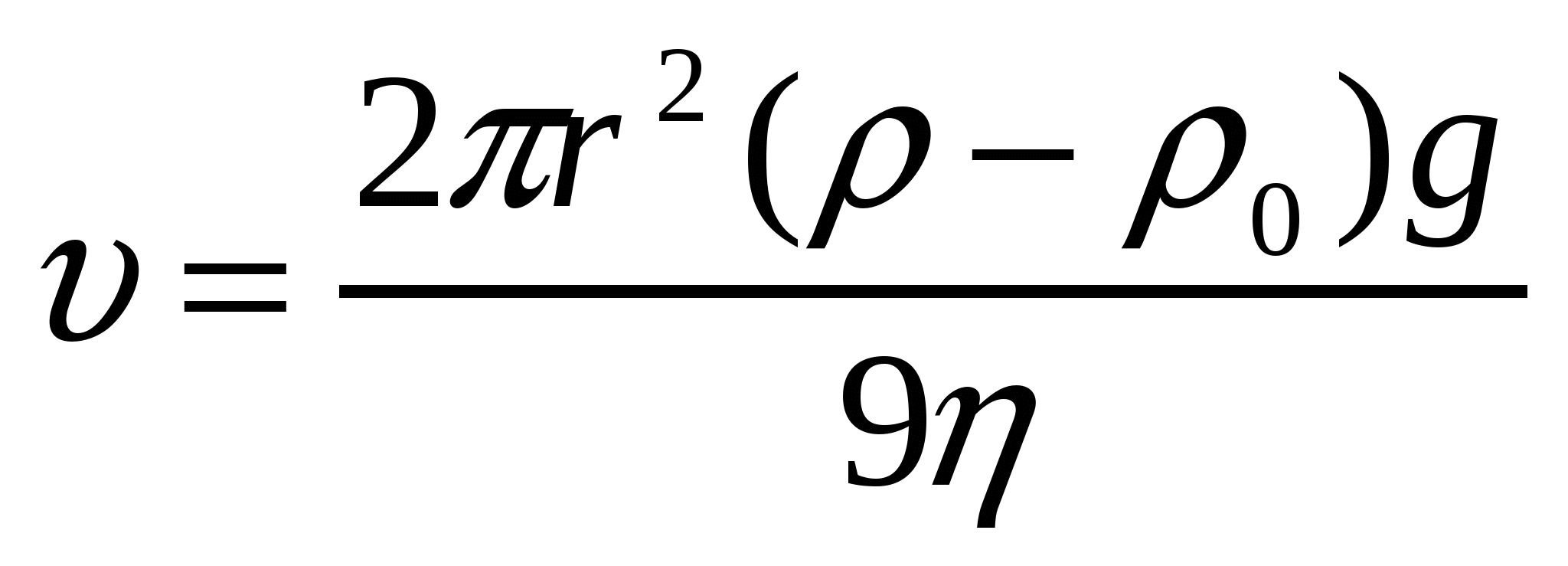 ;
;
су ортасында
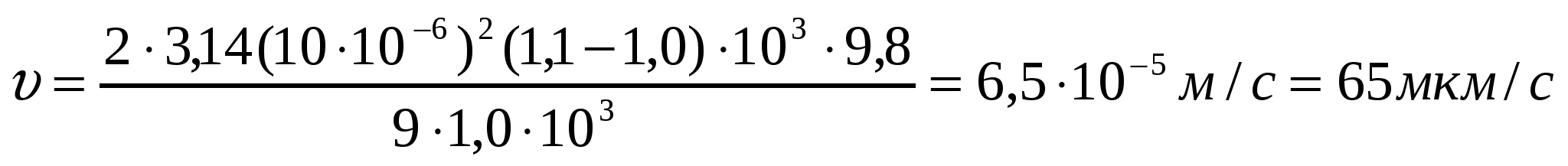 ;
;
ауаортасында 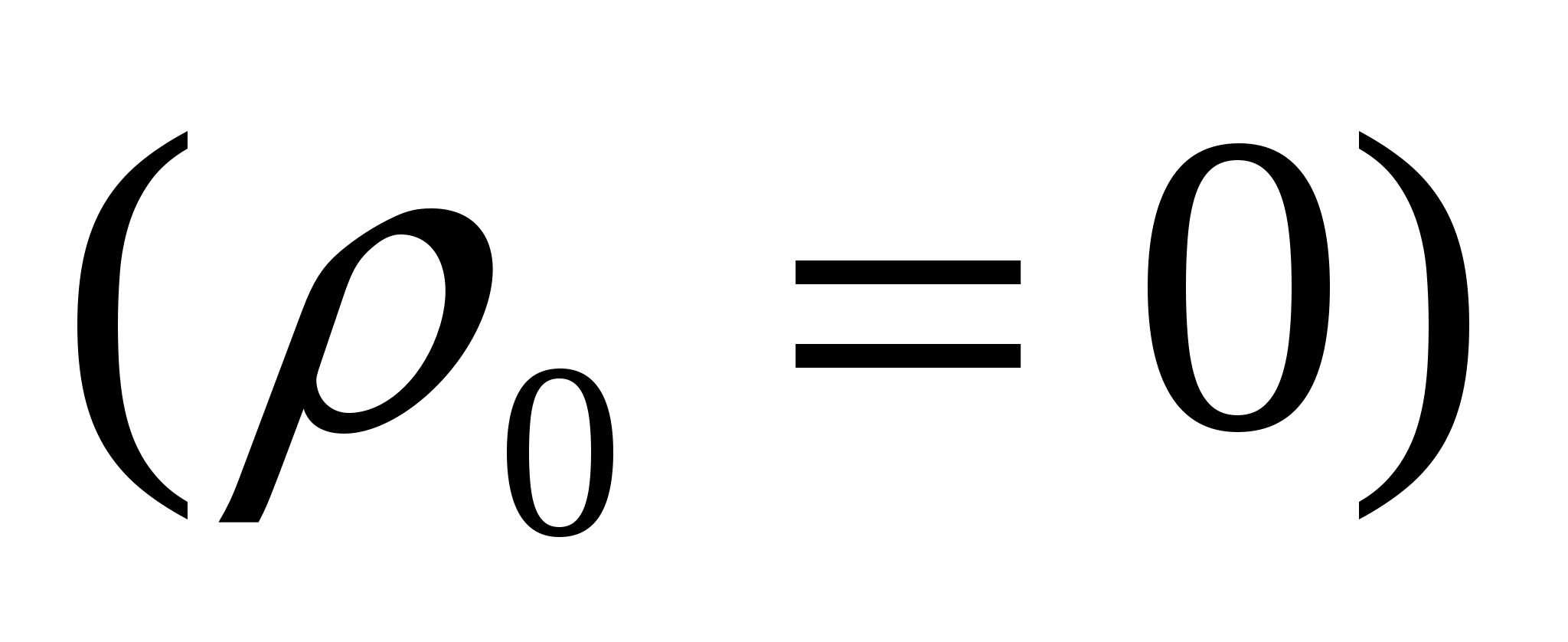
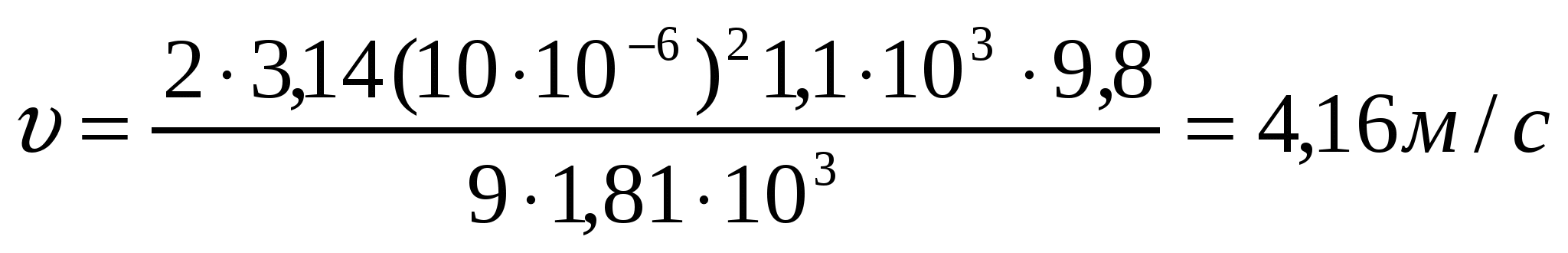 .
.
2-есеп.
Берілген мәліметтерді қолданып коалиннің жоғары майдалы жүзгіндерінің жартылай ірілену орташа уақытын есептеу қажет.
Ірілену уақыты,с 0 105 255 420
Сандық конц.,1014м-3 5,0 3,90 2,92 2,26
Шешуі:
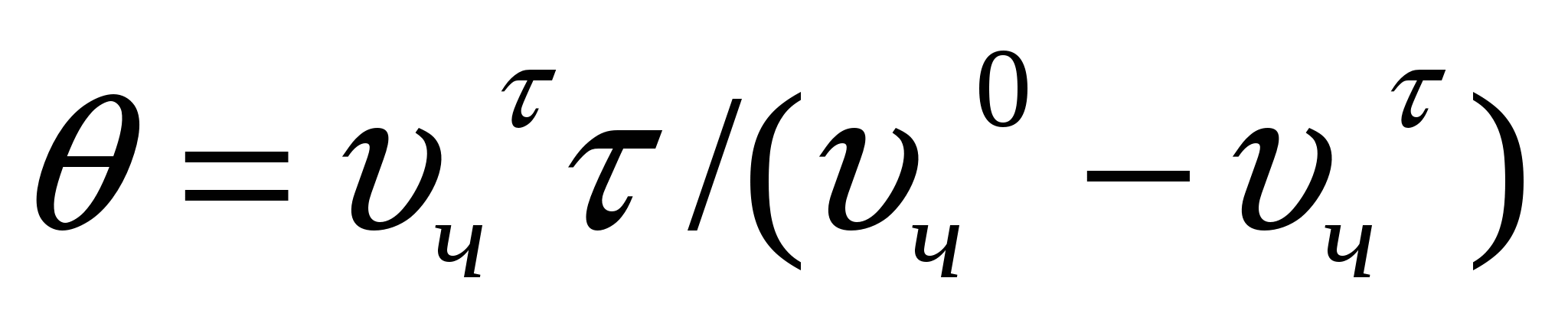 .
.
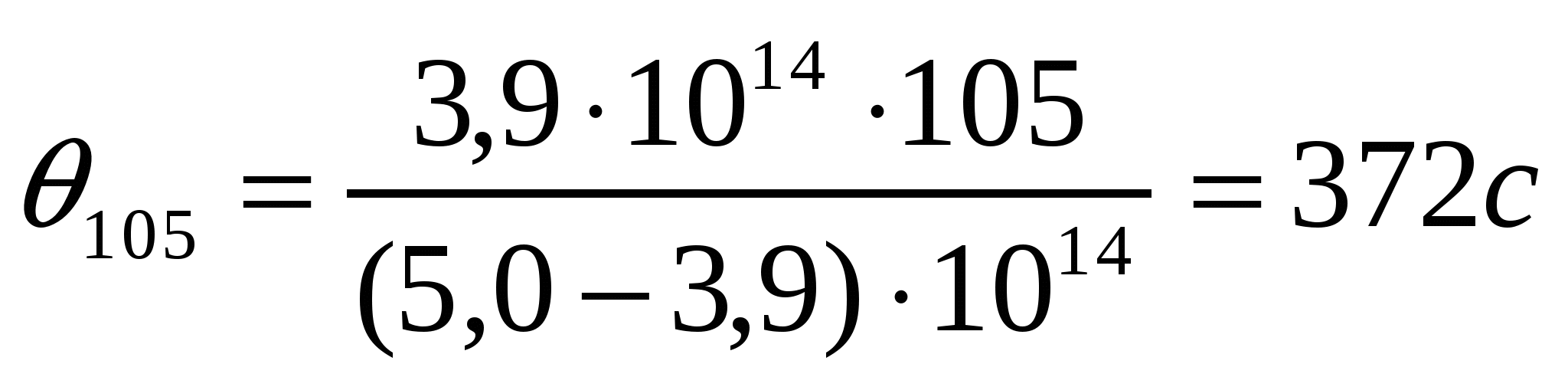 ;
;
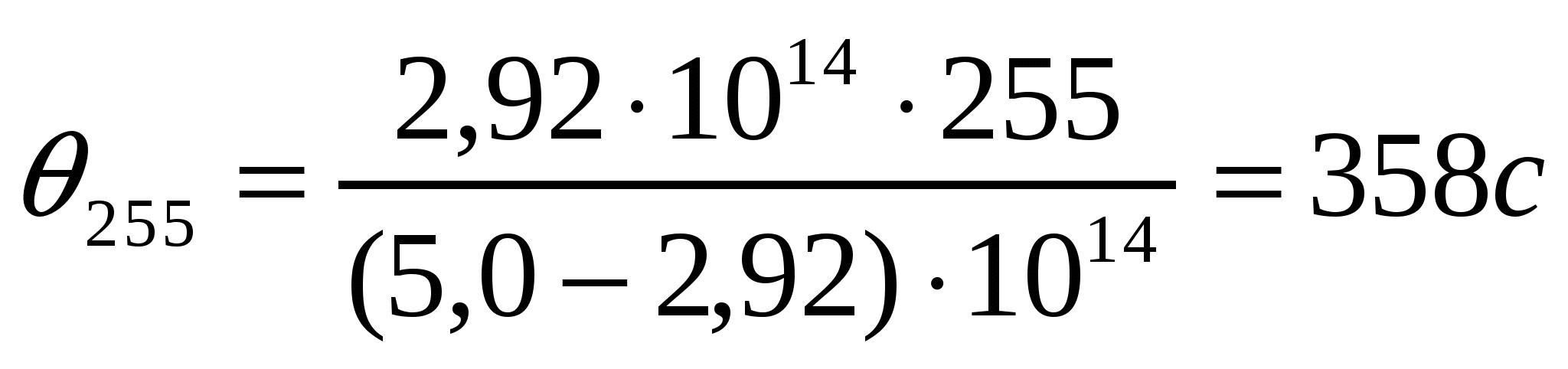 ;
;
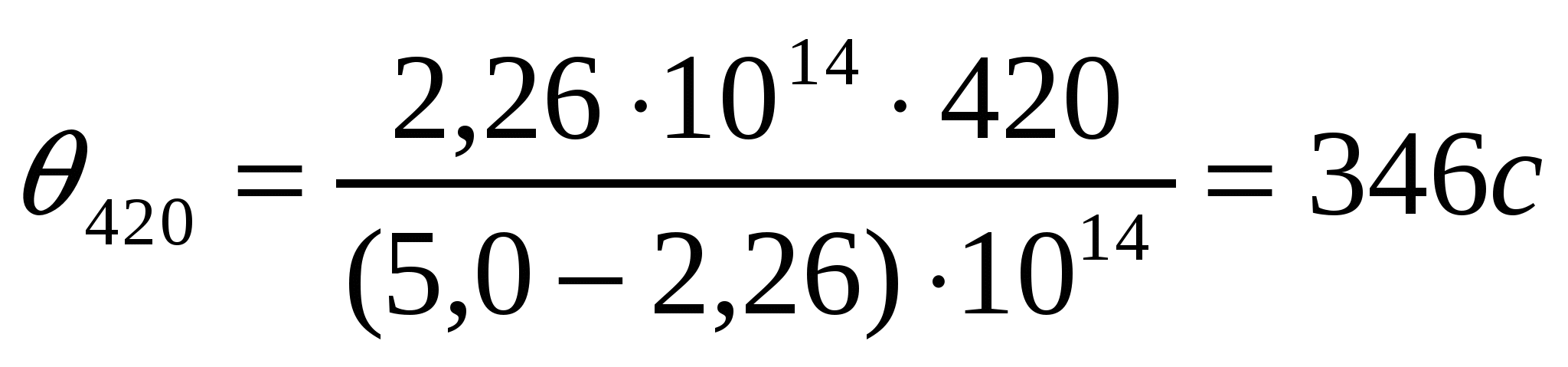 ;
;
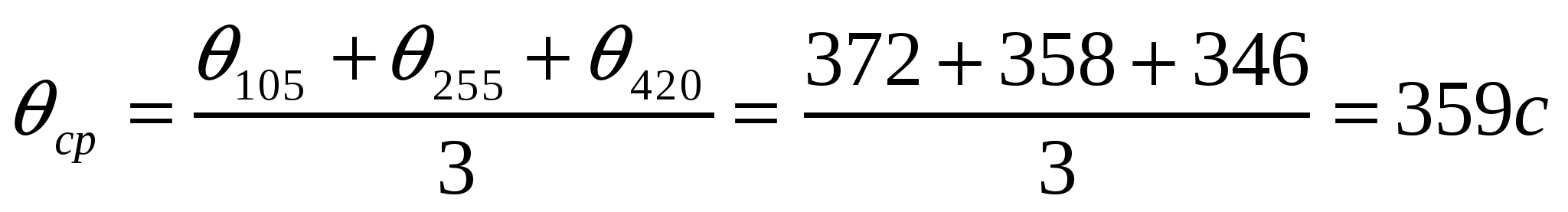 .
.
3-есеп.
Бастапқы сандық концентрациясы 3,2*104 м-3, жартылай ірілену уақыты θ = 11,5 с болатын Ag I кірнесінің ірілену жылдамдығының тұрақтысын анықтау керек.
Шешуі:
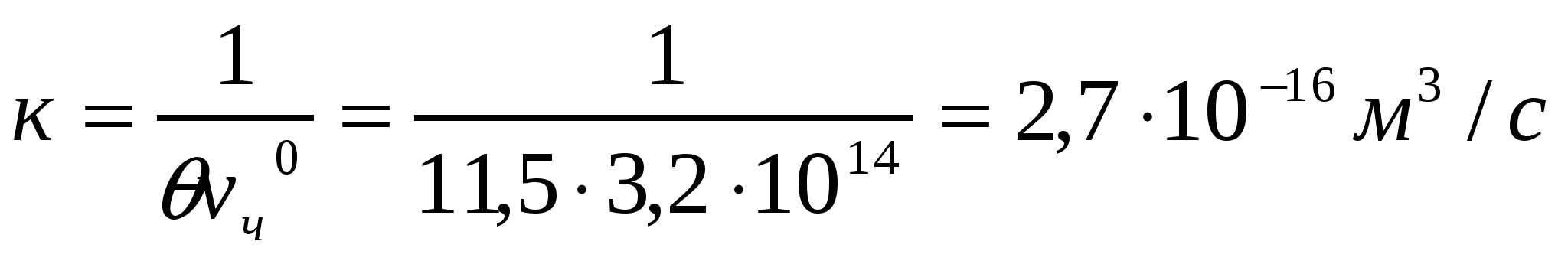
4-есеп.
Алюминий хлоридімен (293К) іріленіп жатқан күкірт кірнесі үшін есептеу және тәжірибелі түрде алынған ірілену жылдамдығының тұрақтыларын салыстыру арқылы іріленудің тез немесе баяу екенін анықтау керек.
Ірілену уақыты,с 0 1 4 10
Сандық конц.,1017м-3 16,0 1,78 0,50 0,20
Шешуі:
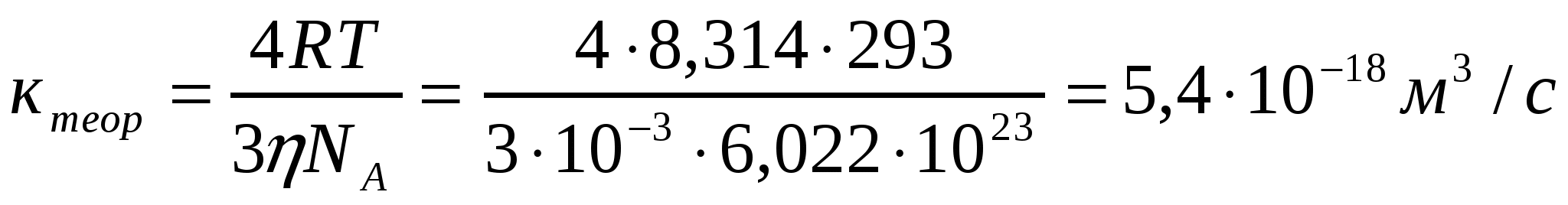 .
.
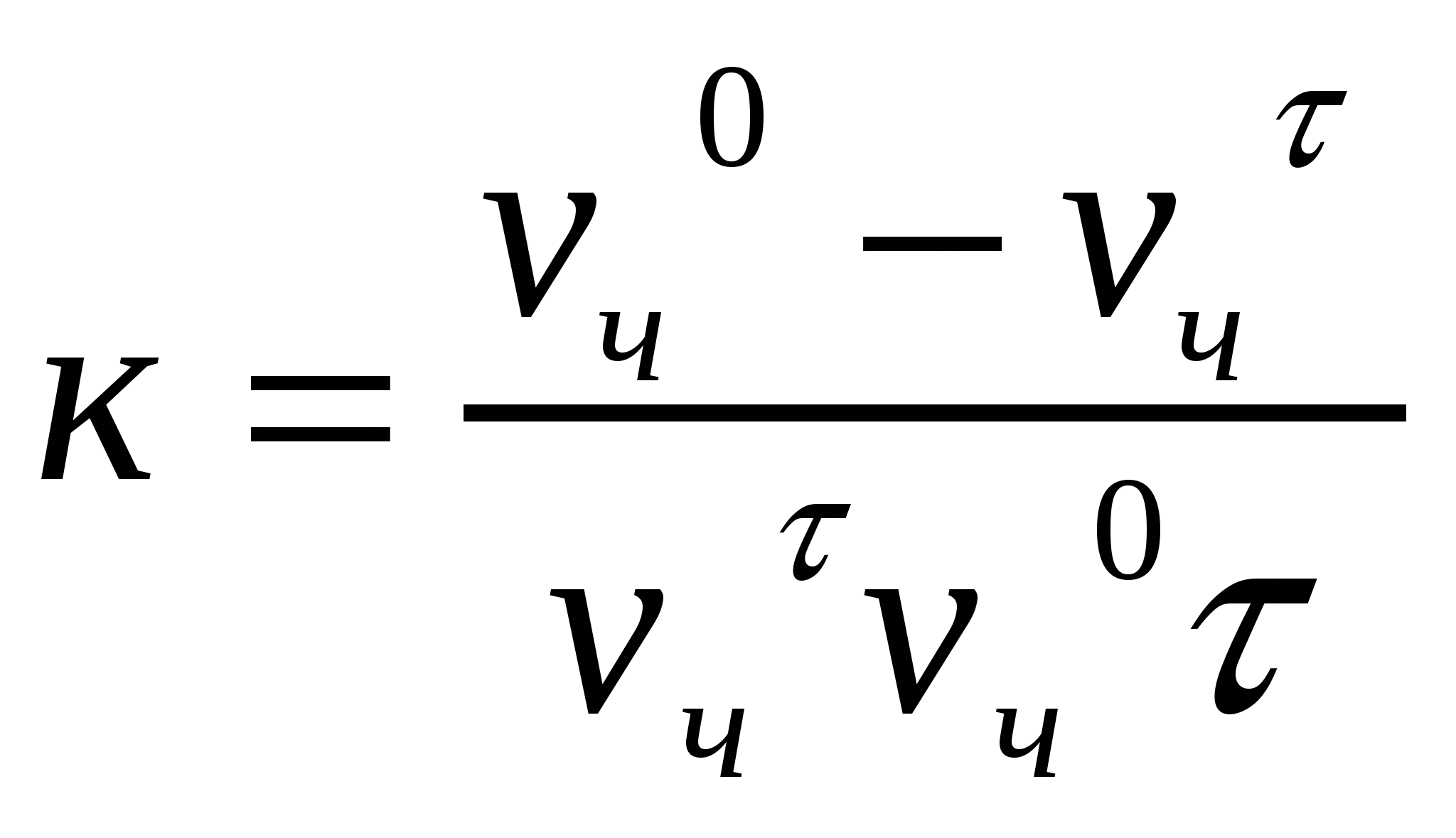 .
.
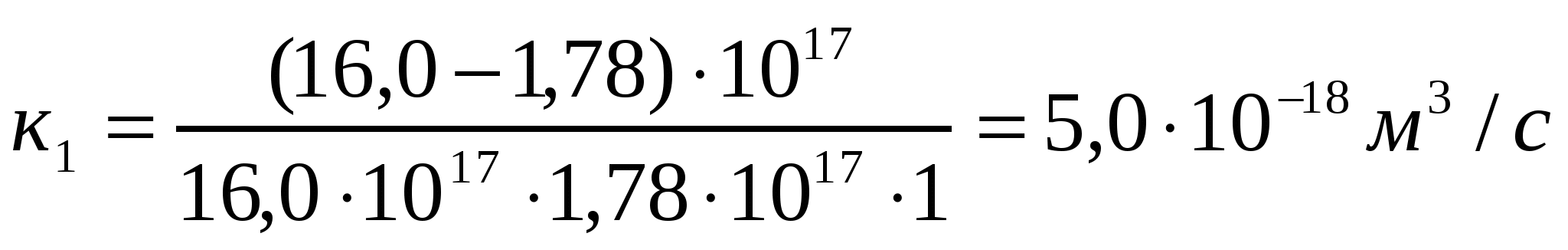 ;
; 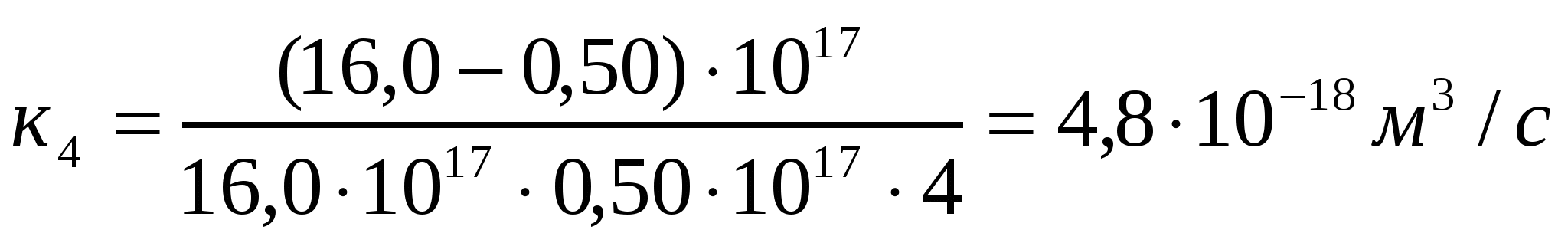 ;
;
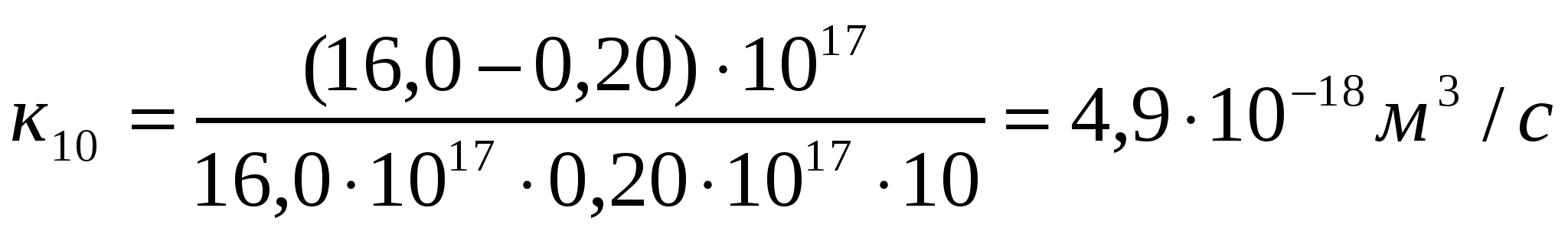 ;
;
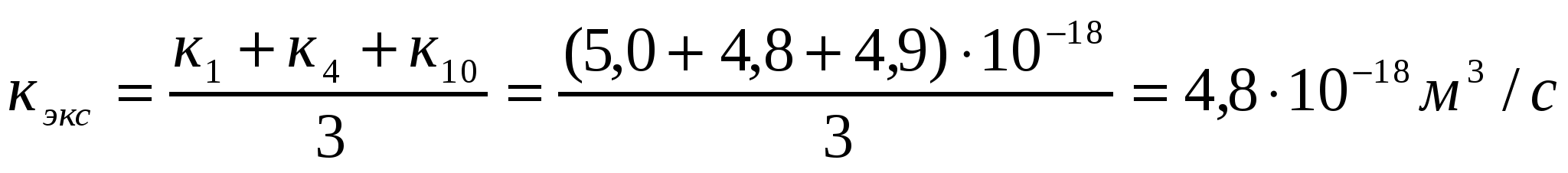 ;
;
Кэксп> Ктеор жағдайы орындалады, яғни баяу ірілену орын алады.
5-есеп.
Егер 10*10-6м3 As2S3 кірнесін ірілендіру үшін 1,2*10-6м3 концентрациясы 0,5 кмоль/м3 NaCl ерітіндісі керек болса, As2S3 кірнесінің ірілену сандық концентрациясы қалай өзгереді? Концентрациясы 0,036 кмоль/м3 MgCl2 (10*10-6м3 кірнеге 0,4*10-6м3 қажет) және концентрациясы 0,01 кмоль/м3 AlCl3 (10*10-6м3 кірне үшін 0,1*10-6м3 қажет) ерітінділерімен іріленудің сандық концентрациясын анықтау керек. (10.12) жағдайының орындалуын тексеру қажет.
Шешуі:
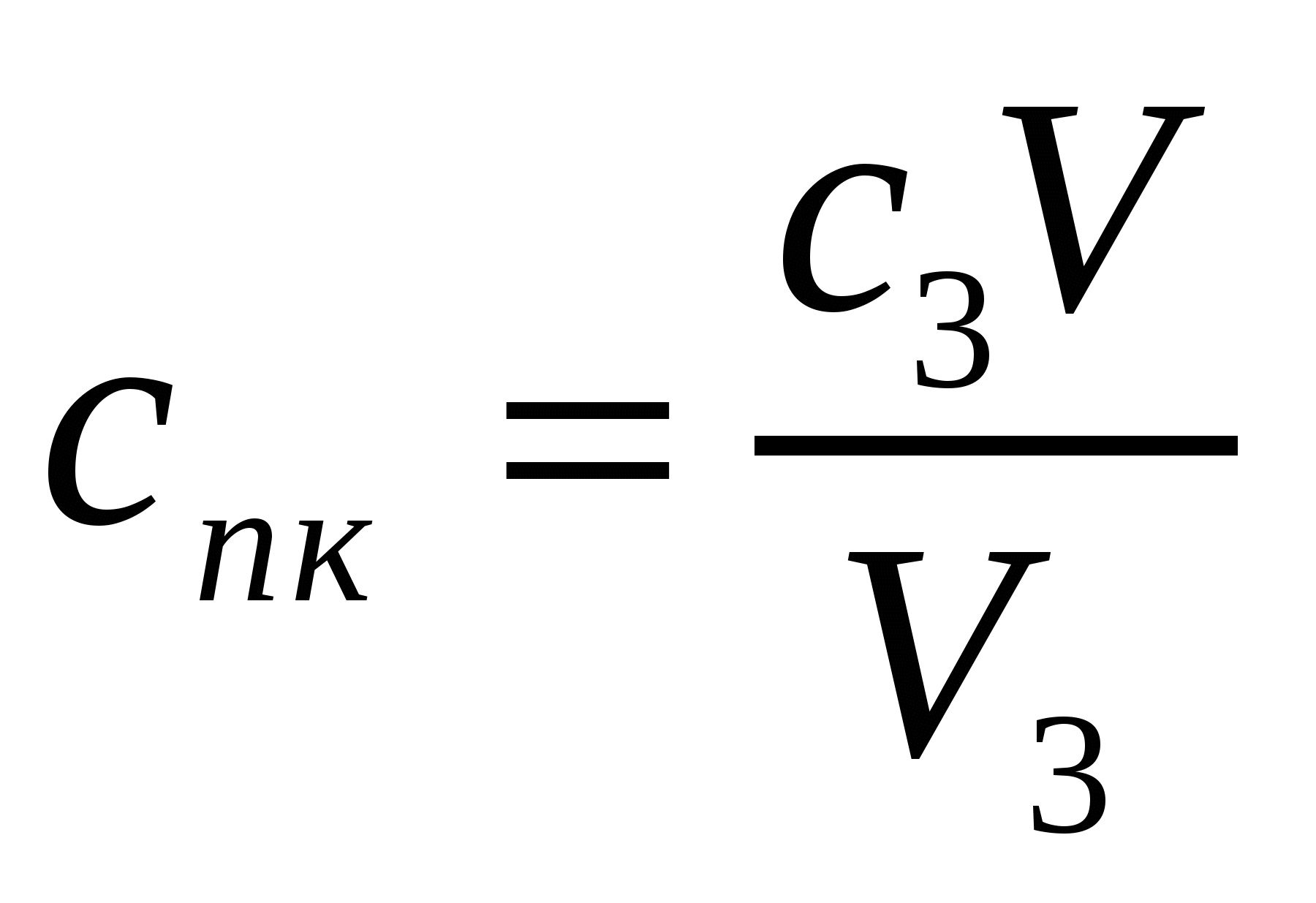 .
.
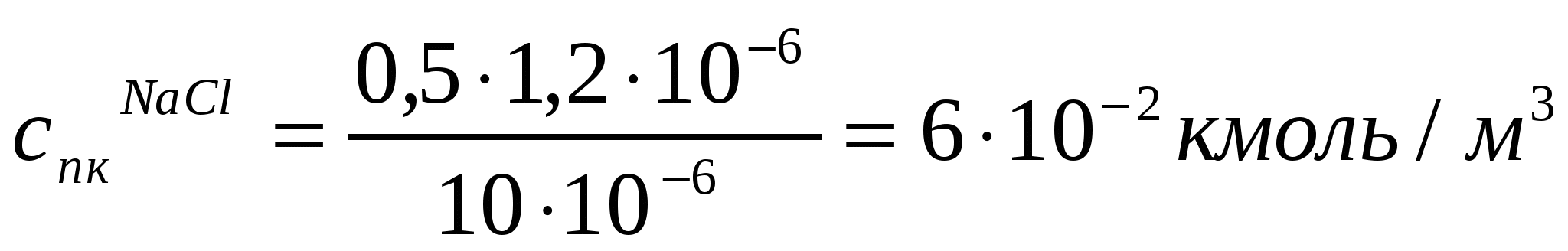 ;
;
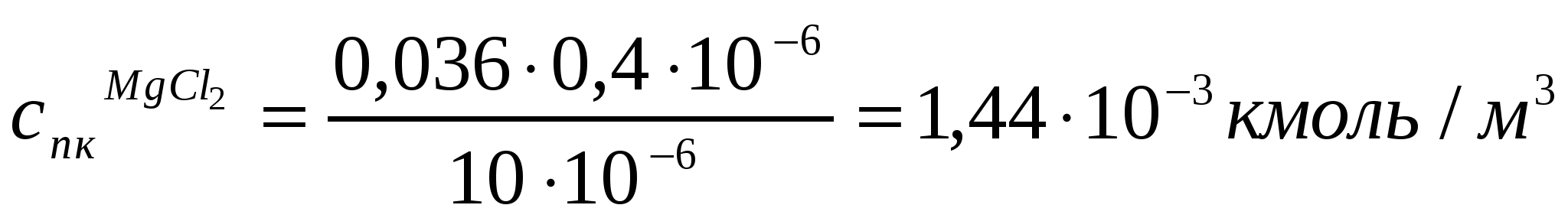 ;
;
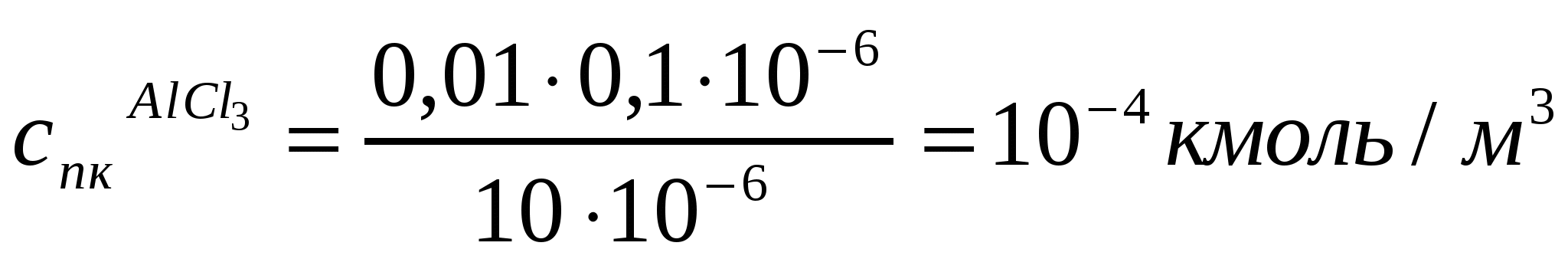 ;
;
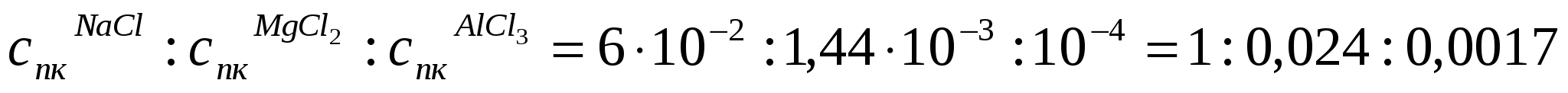 .
.
Алынған мәндерден қанағаттанарлық жағдай орындалатынын байқаймыз.
11. Майдалық жүйелердің құрылымдық-механикалық қасиеттері.
Майдалық жүйе қасиеттері майдалық фаза бөлшектерінің санымен анықталады. Егер ьөлшектер көп болса, олардың арасында жақындасу мен әсерлесу блады да, ол тұрақтылыққа әкеледі. Майдалық жүйе сыртқы әсерге қарсы тұрар мүмкіндіктер қалыптастырады. Белгілі жағдайда бұл майдалық жүйе ағуы мүмкін. Мұндай жүйелерді реология әдістерімен зерттейді. Реология денелердің пішінсіздену мен ағуын зерттецтін ғылым. Майдалық жйелердің құрылымдық-механикалық қасиеттері деген терминмен құрылым түзілу заңдылықтары, механикалық және реологиялық қасиеттер жиынтығы (тұтқырлық, серпінділік, пластикалық,тұрақтылық) түсініктері жалпыланған. Бұл қасиеттерді коллоидтық химияның бөлімдерінің бірі физико-химиялық механика зерттейді.Физико-химиялық механика - ғылымның шекаралас аймағы; ол физикалық химия, қатты денелер физикасы және материалдар механикасы тоғысында пайда болды; оның алғашқы қағидасы академик П.А.Ребиндермен қаланған.
Серпімді, тұтқырлы, пластикалық денелер (қамыр, битум, асфальт) және борпылдақ материалдардың (ұн, жарма, цемент) құрылымдық-механикалық қасиеттерін ажыратқан жөн. Физико-химиялық механика әдістері осы қасиеттерді реттеп, қажетті құрылымды өнім алуға мүмкіндік туғызады.
Жүйелер тұтқырлық арқасында ағуы мүмкін. Тұтқырлы денелер кез келген Рτжылжу кернеуінде ағады:
Рτ = F/B (11.1)
мұндағы Ғ - тұтқырлы қарсыласу күші, В - осы күш ықпалы тарайтын аудан.
Тұтқырлы денелердің ағуы Ньютон заңымен анықталады:
![]() ;
; 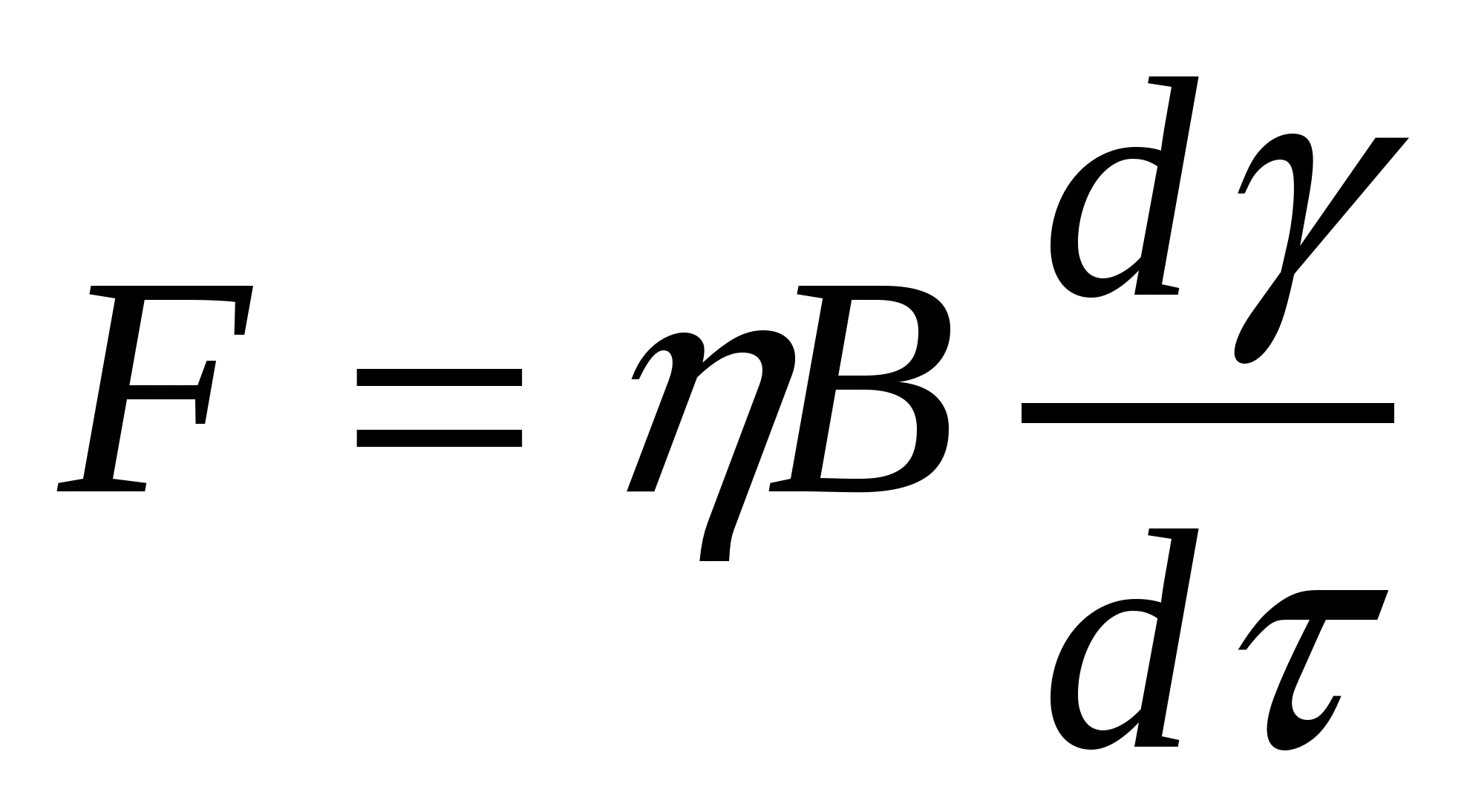 , (11.2)
, (11.2)
мұндағы η - тұтқырлық коэффициенті, dν/dτ - уақыт ішіндегі пішінсізденудің өзгеруі (пішінсіздену жылдамдығы).
Егер пішінсіздену жылдамдығын ν арқылы белгілесек (11.2) формуласына сәйкес жүйе тұтқырлығы келесіге теңболады:
η = Рτ /ν (11.3)
Еркін майдалық жүйе тұтқырлығы майдалық фаза концентрациясының өсуімен қатар өседі. Майдалық фаза бөлшектерінің болуы осы бөлшектердің жанындағы сұйықтық ағысының бұрмалануына әкеледі. Бұл майдалық жүйе тұтқырлығына әсерін тигізеді. Егер концентрация әсері жоғары болмаса, бөлшектер соқтығысу мүмкіндігі азайып, бір бөлшек жанындағы сұйықтықтың қозғалыс сипаты басқа бөлшектер жанындағы сұйықтық қозғалысына әсерін тигізеді. Осындай жағдайда еркін майдалық жүйе тұтқырлығын анықтау үшін Эйнштейн формуласын қолданамыз:
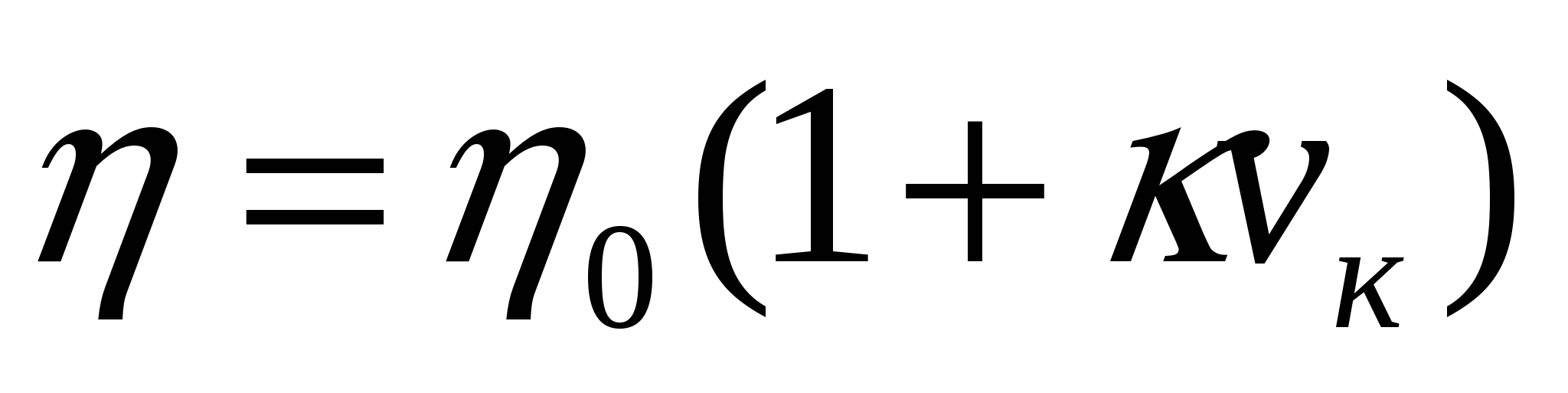 ;
; 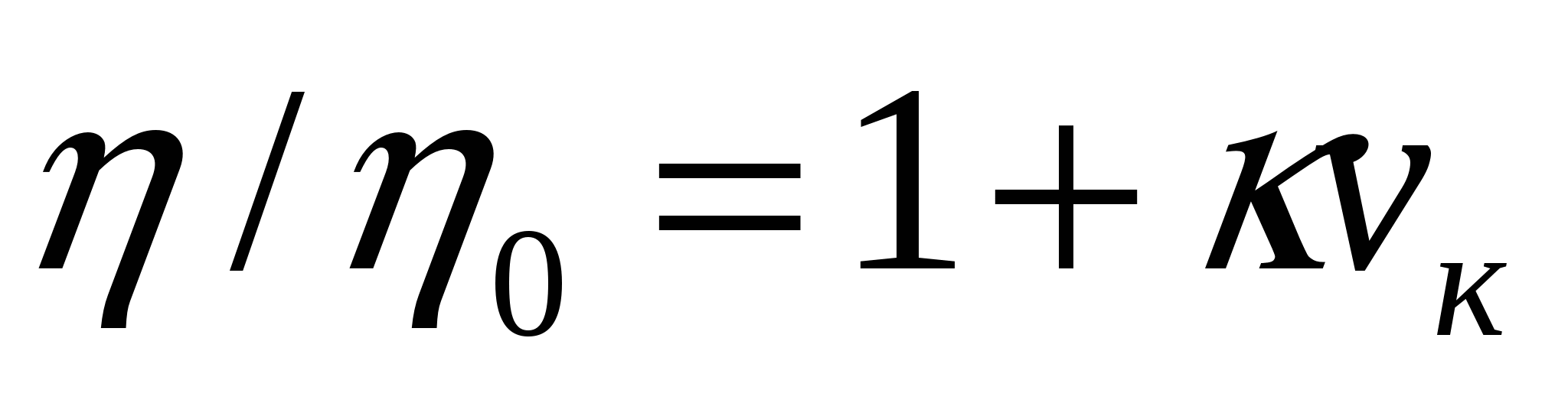 , (11.4)
, (11.4)
мұндағы η, ηо - майдалағыш ортадағы еркін майдалық жүйе тұтқырлығының коэффициенттері, к - бөлшек түріне тәуелді коэффициент ( сфера тәрізді үшін 2,5), νкөлем - майдалық фазаның көлемдік концентрациясы (1.9).
Борпылдақ заттар да сыртқы әсермен ағуы мүмкін. Бірыңғай денелерге қарағандағы борпылдақ материалдардың айырмашылығы бөлшек қабатының беттен немесеөзі сияқты материалдан жұлынып алынуы және жеке бөлшектердің немесе бөлшектер жентегінің арасында бөліну шекарасын сақтап ығысуында. Борпылдақ материалдарға Рс.қ. қысым әсер етуі мүмкін. Оны үстінде жатқан бөлшек массасы немесе сырқы жүктеліс туғызуы мүмкін. Борпылдақ материалдарды ағызу үшін бөлшектер қабатын қатты бетке немесе басқа бөлшектерге қатысты ығыстыру керек. Ығысу Ғτ сырқы әсер әрекетінен болады. Ғτ шамасы ығысу кернеулігі деп аталып, борпылдақ материалдардың аудан бірлігіне есептелінеді. Ығысқанда үйкеліс күші өтіледі. Үйкелістің бір заңы болып Амонтон заңы саналады. Оған сәйкес үйкеліс күші қалыпты қысым күшіне тура пропорционал. Ғτ сырқы әсерімен үйкеліс күші өтіледі. Сырқы қысым бөлшектер қабатына қарағанда қалыпты және Рс.қ. мәніне тең. Борпылдақ материалдар бөлшектері үшін Амонтон заңы:
Ғτ = μ* Рс.ә. (11.5)
мұндағы μ - пропорционалдық коэффициент (борпылдақ материалдардың үйкеліс коэффициенті).
Адгезия мен аутогезия Амонтон заңына түзетулер енгізеді. (11.5) теңдігіне сәйкес Ғτ мен Рс.қ. арсындағы тәуелділік координата басынан өтетін түзу болып көрсетіледі. Тәжірибелік мәліметтер бұл заңдылықтың орындалмайтынын көрсетеді. Бұл айырмашылықтар себептерін қарастырайық. Борпылдақ материал бөлшектері арасында үйкелістен басқа аутогезия пайда болады.бөлшектер бетпен жанасқанда адгезия әсер етеді. Адгезиялық және аутогезиялық әрекеттесу жақындасудың ауданына перпендикуляр бағытталған. Адгезия нәтижесінде борпылдақ материал бөлшектері бетке қысылса, аутогезия әсерінен - бір-біріне қысылады. Бұл мағынада адгезия мен аутогезия сыртқы әсерге парапар. Сондықтан адгезия ҒаN мен аутогезияны ҒаутN борпылдақ материалдарға әсер ететін қосымша себеп деп қарастыруға болады. Адгезия мен үйкелісті есепке алып борпылдақ материал жылжуын келесі түрде көрсетуге болады:
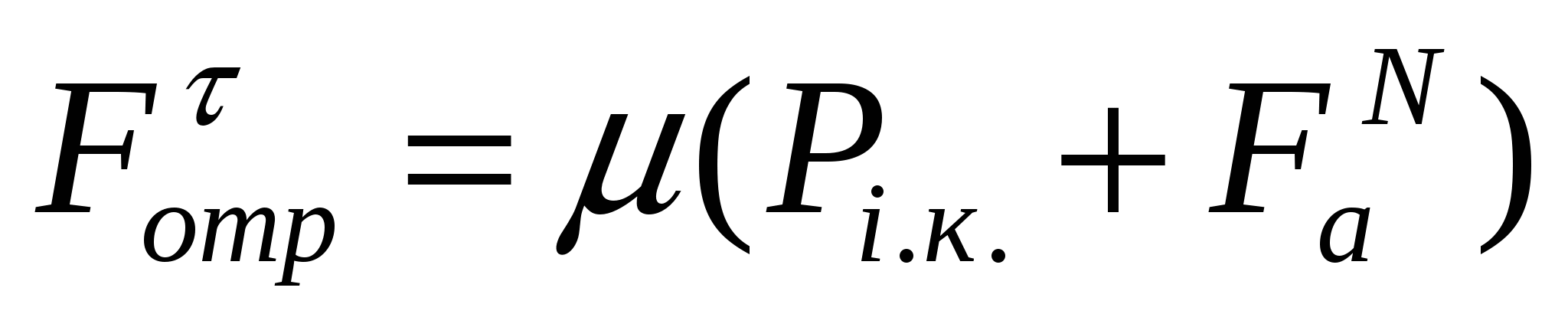 . (11.6)
. (11.6)
Борпылдақ материалдың аутогезия мен ағуы жағдайында:
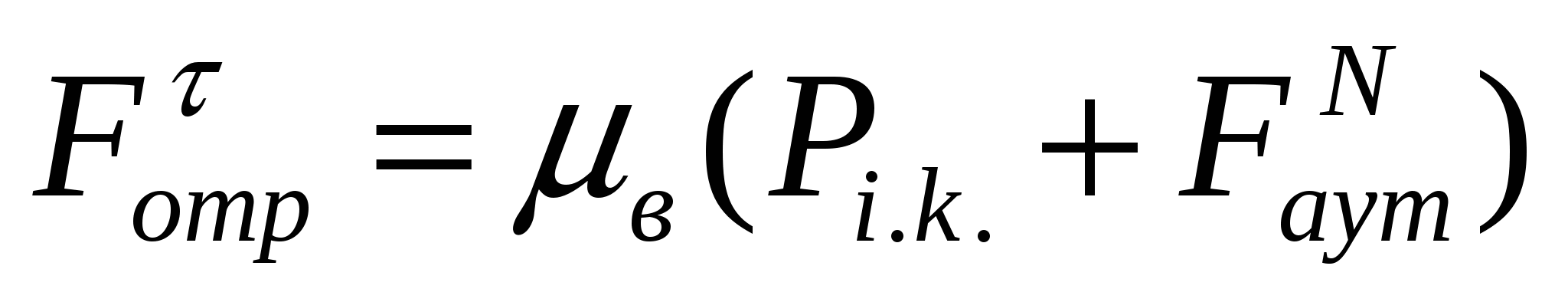 , (11.7)
, (11.7)
мұндағы μв - үйкеліс коэффициенті.
Ғаут = 0 болғанда (11.7) теңдігі жеңілдетіледі және (11.5) формуласына өзгертіледі. Мұндай жағдай тары бөлшектеріне тән. Борпылдақ материалдардың Рс.қ.=0 болғанда (11.5) теңдігіне сәйкес аутогезия жоғаыр болады:
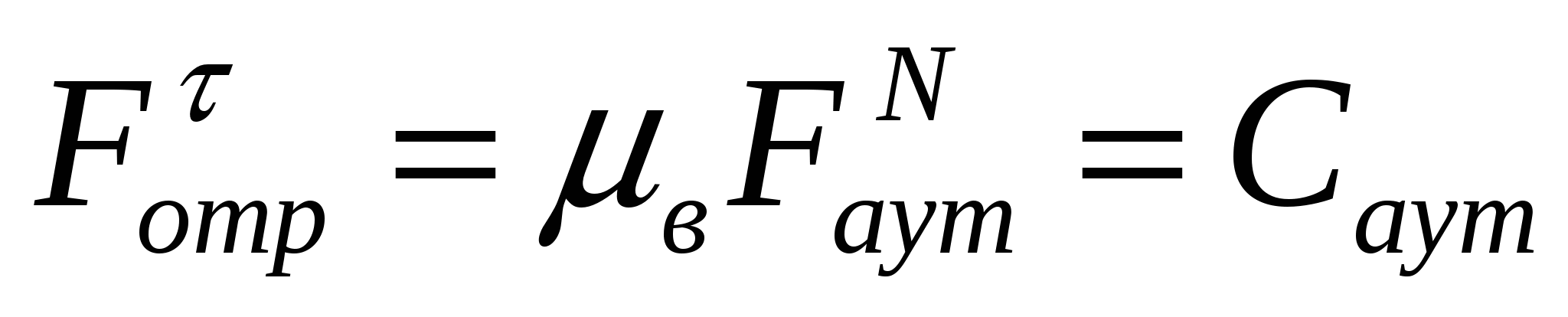 , (11.8)
, (11.8)
Бұл жағдайды жылжу кернеулігін тіркеу деп атап, Саут арқылы белгілейді. Тіркелу борпылдақ материалдардың аутогезия тудырған жылжуға деген тұрақтылығын сипаттайды. Борпылдақ материалдардың адгезиялық орын ауысуы кезінде (Рс.қ.) тіркелу:
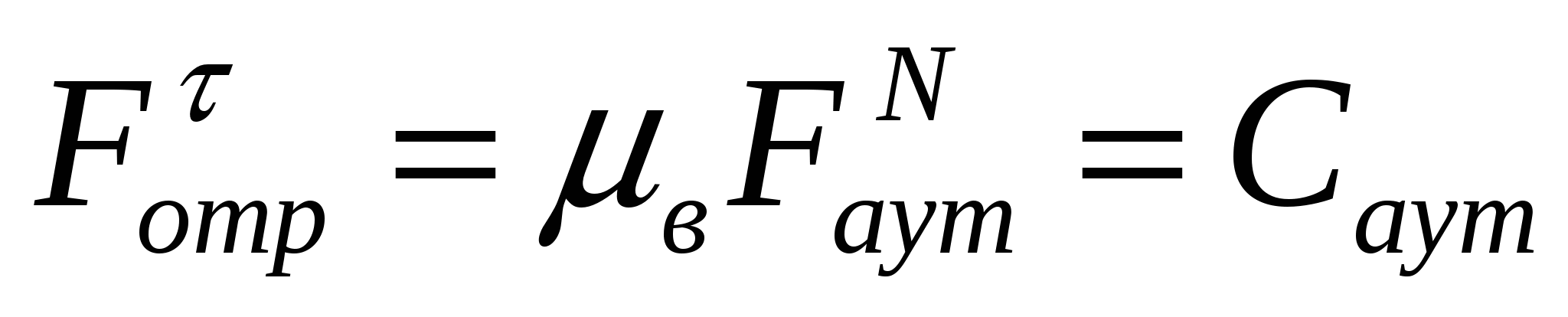 , (11.8)
, (11.8)
Жаттығулар.
1-есеп.
Егер 293К кезінде бөлшектер сфера тәрізді, су тұтқырлығы 1,005*103 Па*с болса, майдалық жүйе бөлшектерінің концентрациясы майдалық жүйенің бес пайызын құрағандағы сулы жүзгіннің тұтқырлығын анықтау қажет.
Шешуі:
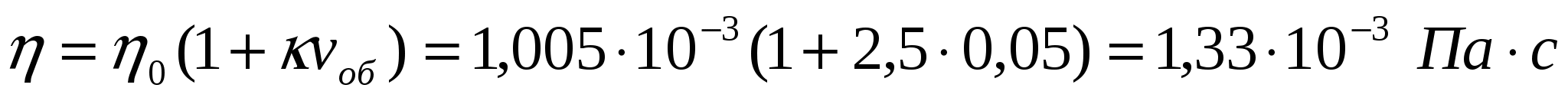
2-есеп.
Еркін майдалы материалдарға жататын өзен құмының сыртқы үйкеліс коэффициенті болат бетіндегі қозғалыс үшін 0,43 бетон бетіндегі қозғалыс үшін 0,58. Әр беттегі бірдей сыртқы әсерде бір массаның орын ауысуы үшін қажет сыртқы үйкелістің өзгеруін анықтау керек.
Шешуі:
Амонтонның үйкеліс заңына сәйкес:
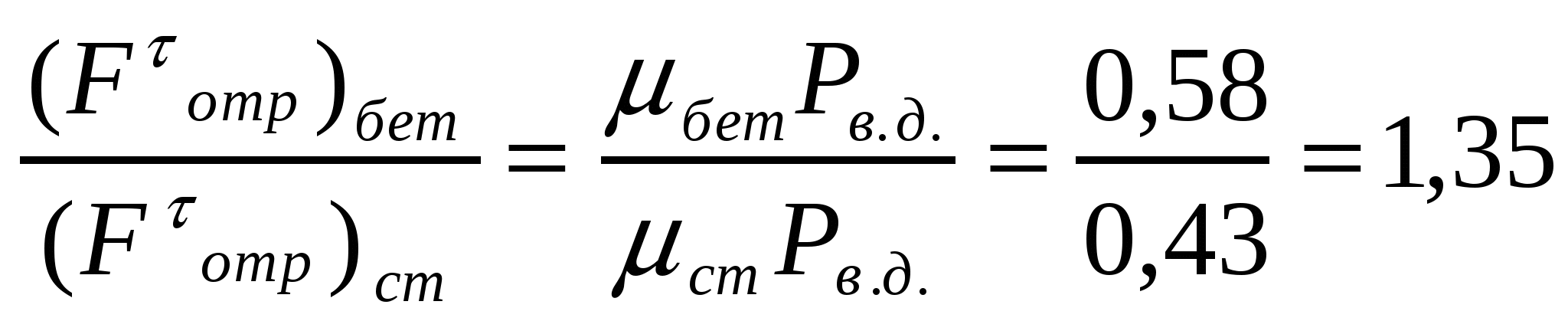
3-есеп.
Бірінші сорт бидай ұнының бетон сүрлеміндегі қозғалысы кезіндегі жалғасуды, жылжудың күшеюін, адгезия мен аутогезия арақатынасын анықтау керек. Үйкеліс коэффициенті 0,40; ішкі үйкеліс 0,53; сыртқы қысым 5,0кПа; ҒаутN=8.68 кПА; ҒаN=9.5 кПа.
Шешуі:
(11.8) және (11.9) формулаларын қолданамыз.
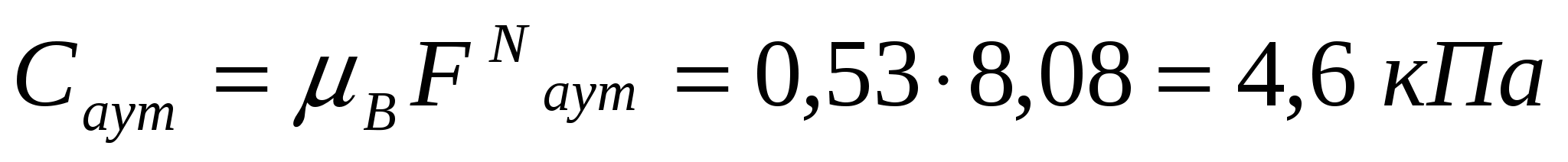 ;
;
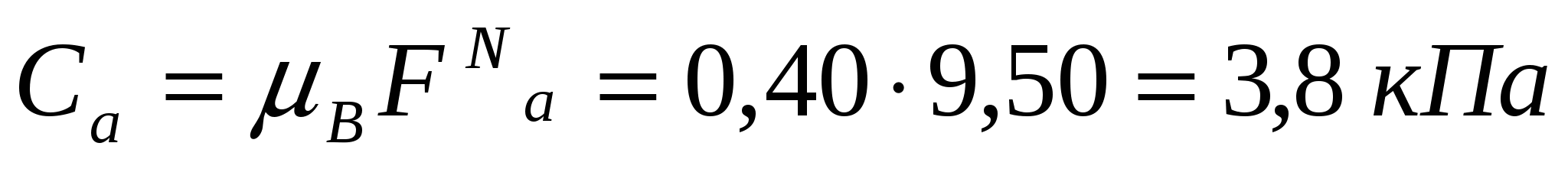
Жылжудың күшейгенін қос мүшелі үйкеліс заңы негізінде анықтаймыз:
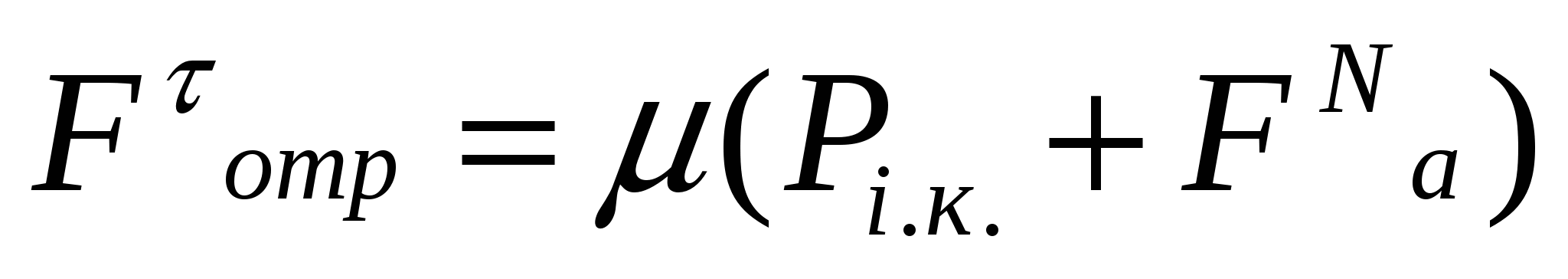 и
и 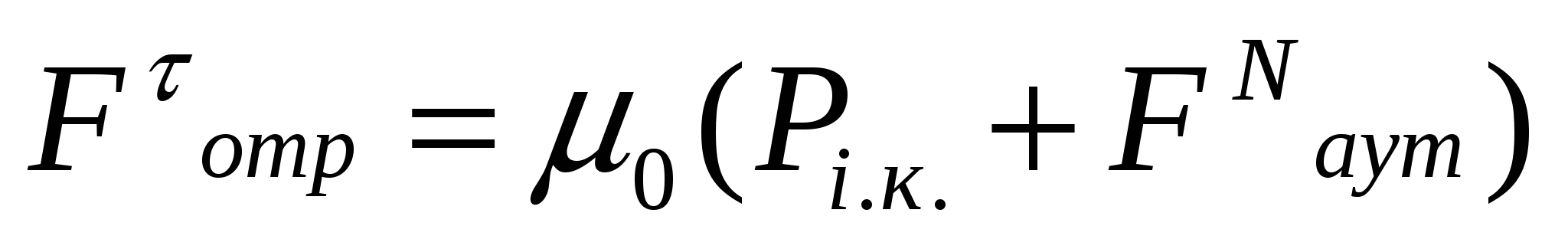 .
.
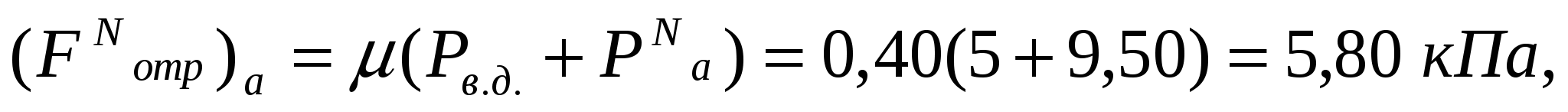
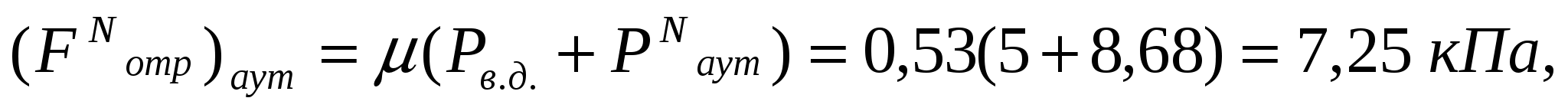
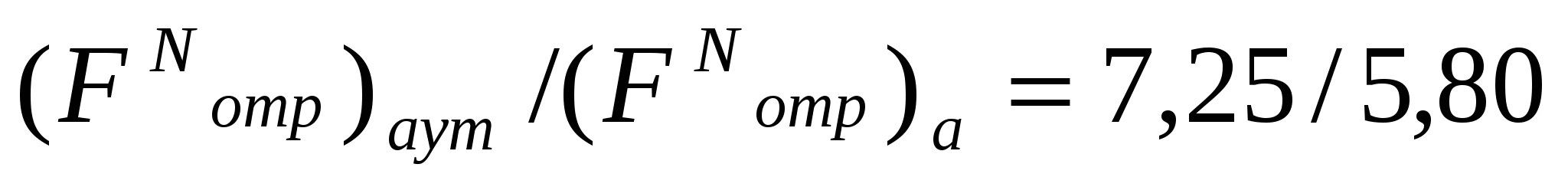 .
.
Аутогезияны өту үшін қажет жылжудың күшеюі үлкен емес, адгезияны өту үшін қажет жылжудың күшеюінен 1,25 есе ғана жоғары. Сондықтан ұн қозғалысының адгезиялық немесе адгезиялы-аутогезиялы сипатын болжауға болады.
12. Майдалық жүйелердің алынуы мен тазартылуы.
Өндірістің әр бөлімінде маман майдалық жүйелерді алу мәселесімен кездеседі. Бұл мақсатта әртүрлі әдістер қолданылады, бірақ бұл әдістер не заттың үлкен түйірінің керекті майдалыққа дейін бөлшектелуіне, не иондар немесе молекулалардың майдалық фаза жентегіне дейін бірігуіне әкеледі. Осыған сәйкес майдалану және біріктіру әдістерін қарастыру керек. Бұл әдістер түбінде қарама-қарсы жатса да, бәрібір бір нәтижеге - майдалық жүйелердің алынуына әкеледі. Майдалық жүйелер әртүрлі процестер нәтижесінде табиғи түзілуі мүмкін. Бар өсімдік және жануарлар әлемін құрайтын майдалық жүйелер олардың пайда болуынан бастап түзіледі. Жер қыртысы жер планетасы дамыған мыңжылдықтарда түзілген майдалық жүйе.
Өндірістің кейбір түрлерінде майдалық жүйелер қолдан жасалады. Майдалық жүйелерді қолдан жасау әдістерін екі түрге бөлуге болады: біріншісі тегіс әрі ірі денені майдалық фазаның ұсақ бөлшектеріне дейін ұсақтау, екіншісі молекулалық мөлшерлі бөлшектерді майдалық фаза бөлшектеріне дейін ірілендіріп фазаның бөліну шекарасының пайда болуы.
Майдалану өз еркімен немесе өзеркінсіз болуы мүмкін. Өз еркімен майдалану лиофильді жүйелерге тән және жүйе тәртіпсіздігінің өсуімен байланысты (бір үлкен бөліктен көптеген ұсақ бөлшектер түзіледі). Майдалану кезінде температура тұрақты болса, энтропияның өсуі энтальпия өзгерісінен артық болуы тиіс. Изобарлы-изотермиялық процесс кезінде энтальпия өзгерісі когезия және адгезия жұмыстары арақатынасымен табылады; бұл фазааралық әсерлесу энергиясын анықайды:
∆Н = WK - WA (12.1)
(12.1) жағдайы майдалану нәтижесіндегі энтальпия өзгерісін көрсетеді. Онда өз еркімен майдаланатын лиофильдік жүйелер үшін ∆S >0, ал ∆Н < 0, сондықтан:
WK < WA (12.2)
(12.2) жағдайынан орындалуы үлкен бөліктің өз еркімен көптеген ұсақ бөлшектерге бөлінуін көрсетеді. Осы секілді процкстер келесі лиофильді жүйелер үшін: ерітінділер, ЖМҚ, майбалшық бөлшектері және т.б. тән. (12.1) жағдайына сәйкес өз еркінсіз майдалану энтальпияның өсуіне әкеледі, бұл майдалану және бір дәннен көптеген бөлшектер алу үшін ∆Н мәніне парапар энергия жұмсалу керектігін білдіреді. Энтальпия өсуі (∆Н>0) Гиббс энергиясының өсуіне сәйкес.
∆Н > T∆S; ∆G>0 (12.3)
(12.3) арақатынасы майдаланудың өз еркінсіз және сыртқы энергия арқылы өтетінін көрсетеді.
Жентекті күйге сәйкес майдалану шаңдану, үгіту және барботаж арқылы жүзеге асады. Майдалану майдалану дәрежесімен мінезделеді. Ол бастапқы өнім мөлшері мен жүйеден алынған майдалық фаза бөлшектері арақатынасымен анықталады және келесі түрде көрсетіледі:
α1 = dб /dс ; α2 = Вб/Вс; α3 = Vб/Vc (12.4)
мұндағы dб, dс, Вс, Вб, Vб, Vс майдалануға дейін және кейінгі бөлшектердің диаметрлері, беттік аудандары және көлемдері. Осыған сәйкес майдалану дәрежесі майдалық фаза бөлшектерінің мөлшерлі (α1),беттің ауданы (α2), көлем (α3) бірліктерінде көрсетілуі мүмкін, яғни сызықтық, беттік, көлемді болуы мүмкін.
Жарғақты процестерді қолданудағы маңызды бағыт болып кері осмос арқылы қоспасыз (молекулалар мен иондар) сұйықтықтар алу. Сыртқы қысыммен жарғақ арқылы сұйықтық қозғалысы кері осмос деп аталады. Кері осмосты жүзеге асыратын жұмыс Wос негізінде жартылай өткізгіш жабқыш кеуектері арқылы сұйықтықты итеруге (қысуға) жұмсалады. Бұл жұмысты келесі түрде көрсетеміз:
Wос = ∆p*V (12.5)
мұндағы ∆p - жарғақтың қос жағындағы қысымның өзгеруі, V - жарғақ кеуектерінен өткен сұйықтық көлемі. ∆p келесі түрде анықталады:
∆p = p - π (12.6)
Мұндағы р - ерітінді бетіндегі артық қысым, π - осмостық қысым.
Жаттығулар.
1-есеп.
Бидайдан ұн алған кездегі сызықты, беттік және көлемді майдалану дәрежесін анықтау керек. Ұн және бидай бөлшектерінің өлшемдері 38 мкм және 2,27 мм мәндеріне сәйкес парапарлы диаметрге келтірілген.
Шешуі:
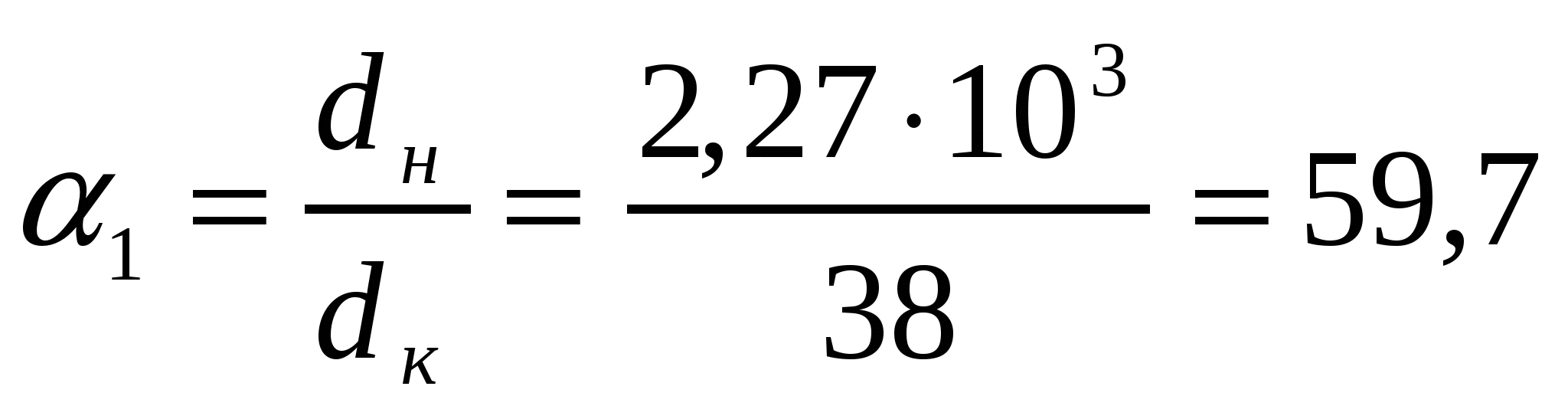 ;
; 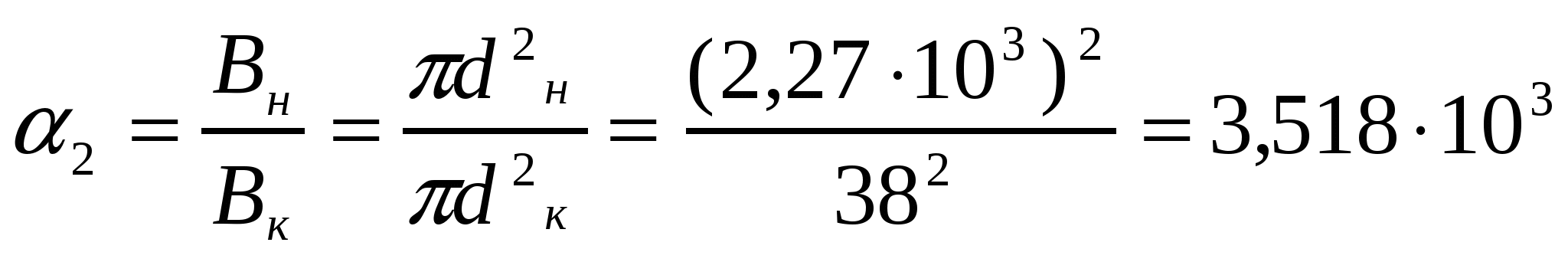 ;
;
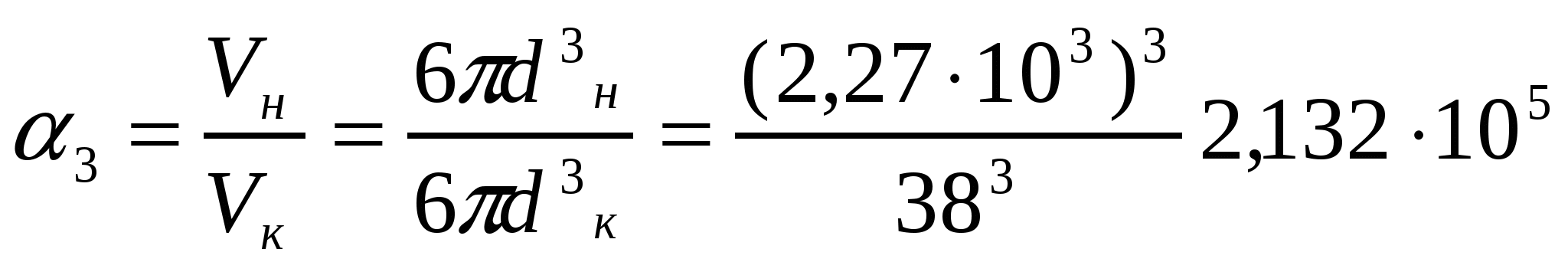
2-есеп.
Егер қысым өзгерісі 4*105 Па болса, концентрациясы 0,5 кмоль/м2 глюкоза ерітіндісіүшін жарғақ арқылыкері осмос үшін қажет қысымды анықтау керек.
Шешуі:
∆p = p - π жағдайынан p = ∆p + π болатынын анықтаймыз. Осмостық қысым келесі түрде есептелінеді:
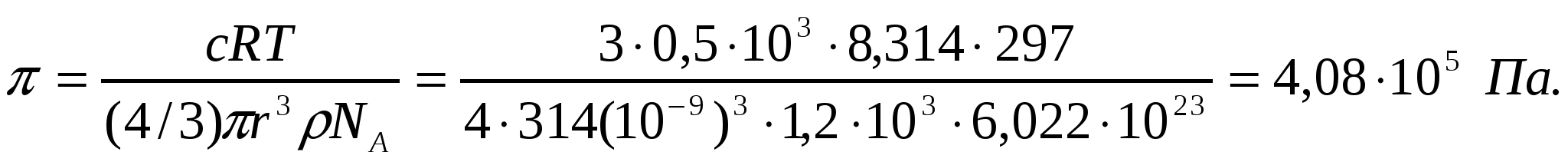
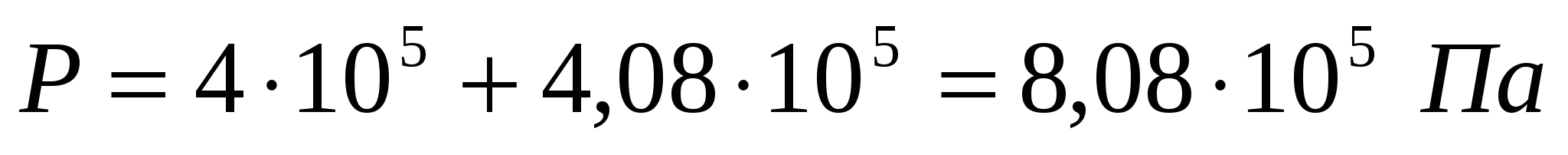 .
.
Майдалық жүйелердің түрлері.
13. Эмульсиялар.
Эмульсиялар - майдалық фаза мен майдалағыш ортаның бір-бірінде ерімейтін немесе аз еритін сұйықтықтардан тұратын майдалық жүйелер. Бұл жағдай эмульсиялардың өздеріне тән концентрацияның үлкен диапазонында (0,001-90%) сфера тәрізді майдалық жүйелер түзуін анықтайды. Эмульсиялардың алынуы, тұрақтылығы және бұзылуы С-С бөліну шекарасының айрықшалығымен анықталады. Эмульсиялар басқа да майдалық жүйелер сияқты өндірісте кеңінен қолданылады. Олар кейбір азық-түлік өнімдерінің қасиеттерін анықтайды. Эмульсиялар майдалық фаза және майдалағыш орта құрамына тәуелді тура және кері болады. Тура М/с түрлі эмульсиялар - бұл майдың судағы майдалығы. Тура эмульсиядағы бөлшектелген фаза болып май танылады. с/М түрлі эмульсиялар - судың майдағы майдалығы. Мұнда су бөлшектерінің майлы ортадағы таралуы орын алады. Тура эмульсияға сүтті, кері эмульсияларға маргарин, мұнайды жатқызуға болады. Эмульсияларды майдалық фаза құрамына тәуелді айырады, оны көлемдік концентрация арқылы көрсетеді:
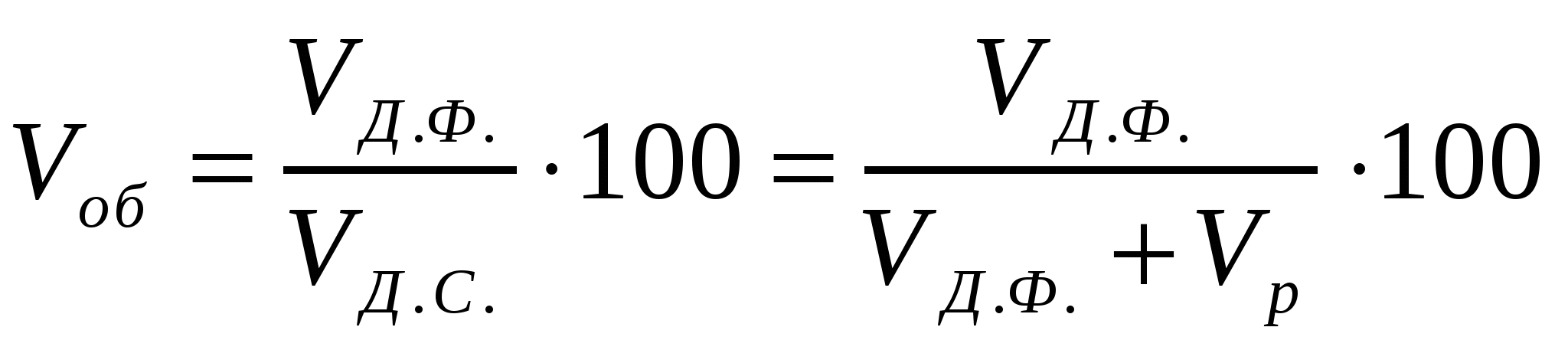 (13.1)
(13.1)
мұндағы VД.Ф., VД.С., Vр - майдалық фаза, майдалық жүйе (эмульсияның), майдалағыш ортаның (еріткіштің) көлемдері.
Жаттығу.
Есеп.
Сулы-майдалық майдалық фаза көлемінің 17 пайызын алса (Vp= 0,17VД.Ф.), маргариннің майлы фазасының концентрациясын анықтау керек.
Шешуі:
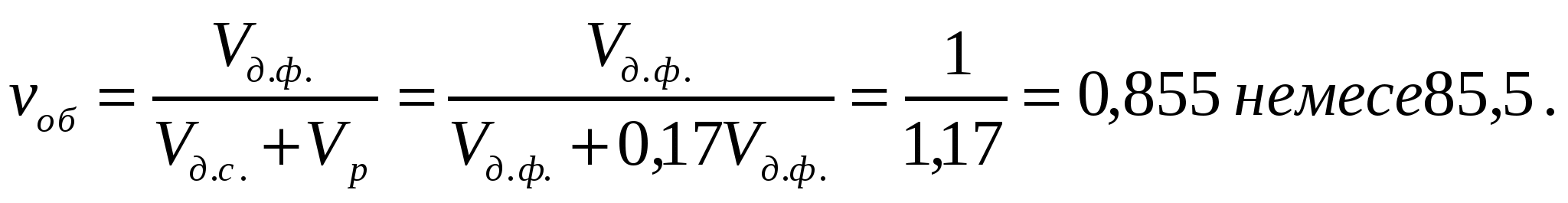 .
.
14. Көбіктер.
Көбіктердің басқа майдалық жүйелерден айырмашылығы олардың қозғалғыштығымен фазаның бөліну бетін өзгерту қабілетінде. Фазаның бөліну едәуір төмендеуі көбіктердің өмір сүру уақытын қысқартады және көбіктердіңтұрақтылығын сақтау үшін ББЗ қолдануға жағдай жасайды. Қозғалғыш фазаның бөлінушекарасының меншікті бетінің әжептәуір өсуі көбіктерге ерекше қасиеттер береді. Көбіктер бірқатар технологиялық процестерде, әртүрлі препараттарды қолданғанда түзіледі. Көбіктер Г/с түрлі майдалық жүйе болып табылады, ондағы майдалық фаза - газ, ал майдалағыш орта - сұйықтық.. майдалық фаза ретінде судағы ауа көпіршіктерін қарастыруға болады. Көбіктер концентрлі және жоғары концентрлі майдалық жүйелер. Басқа майдалық жүйелерге қарағанда көбіктер майдалағыш орта құрамымен мінезделеді. Газдық майдалық фаза массасы мен көлемі тұрақсыз әрі тез өзгергіш болғандықтан майдалық фазаның көлемдік құрамы β көбік еселігімен мінезделеді. Ол Vk көбік көлемінің оны түзу үшін қажет Vc сұйықтық көлемінен неше есе артық екенін көрсетеді:
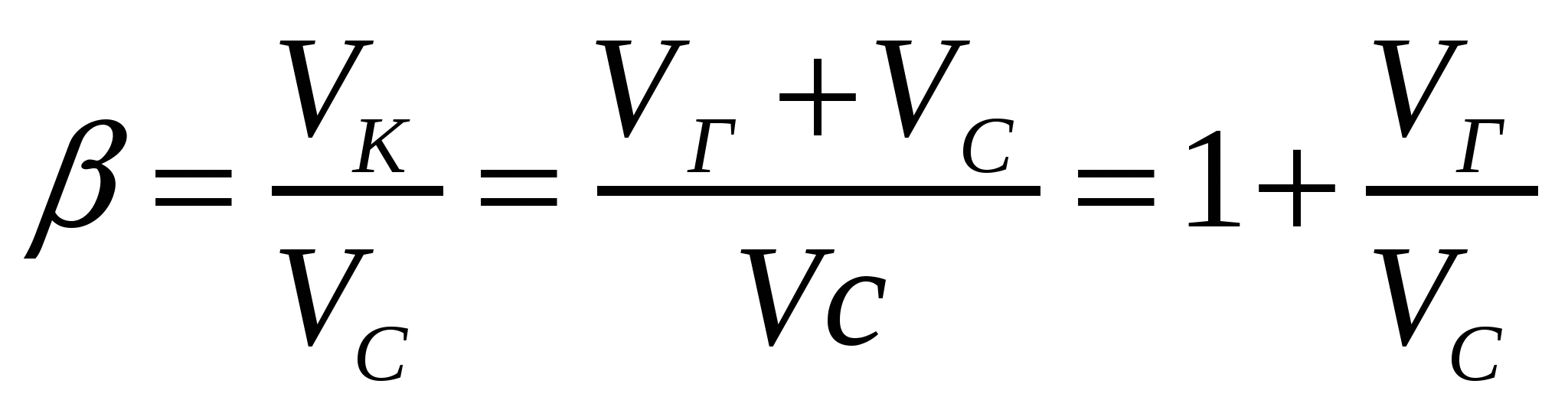 (14.1)
(14.1)
мұндағы  ,
,  ,
,  , - көбік, газ, сұйықтық көлемдері.
, - көбік, газ, сұйықтық көлемдері.
Көбіктерге сәйкес жентекті және седиментациялық тұрақтылықтарды ажыратады. Бұл тұрақтылықтар басқа майдалық жүйелерге де тән. Көбіктердің жентекті тұрақтылығын сипаттайтын негізгі параметр болып көбік бірлігіндегі меншікті беттің төмендеу (νм.б.) немесе ірілену арқылы көпіршіктердің үлкею (Δνм.б.) жылдамдығы болады. Жентекті тұрақтылық (AT) мәніне νм.б. беттің төмендеу жылдамдығына немесе көпіршіктің 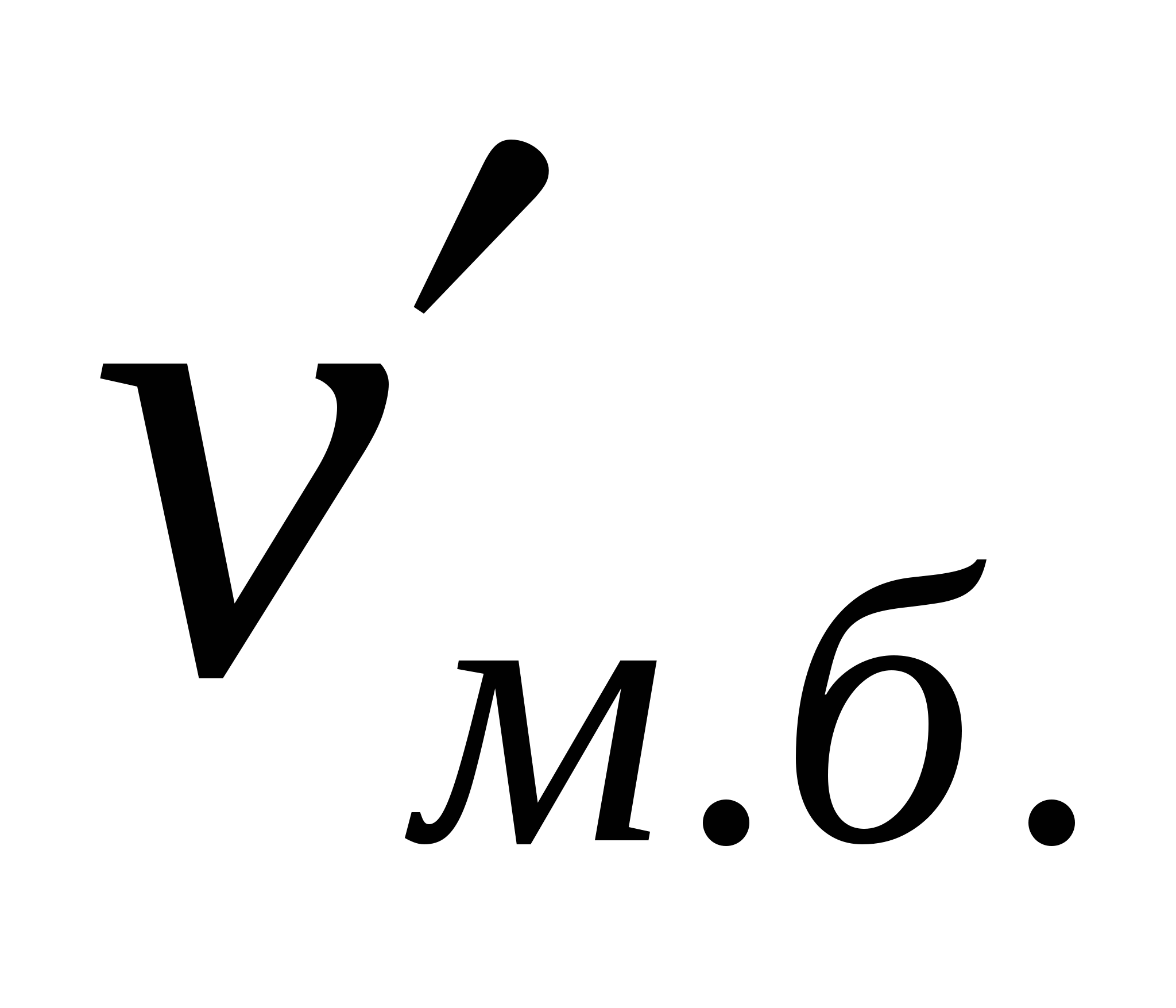 орта мөлшерінің өсу жылдамдығына кері шама алынады:
орта мөлшерінің өсу жылдамдығына кері шама алынады:
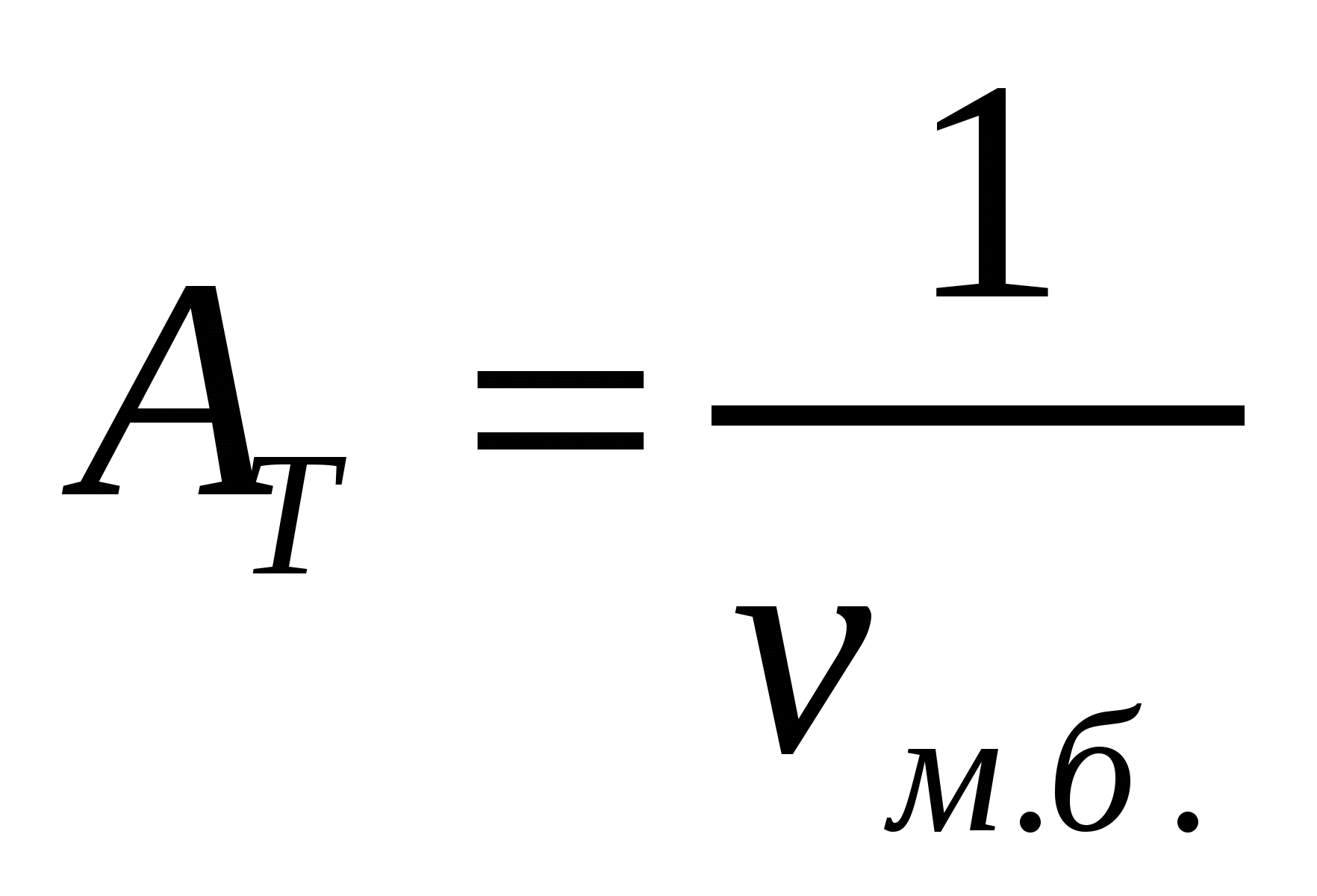 ;
; 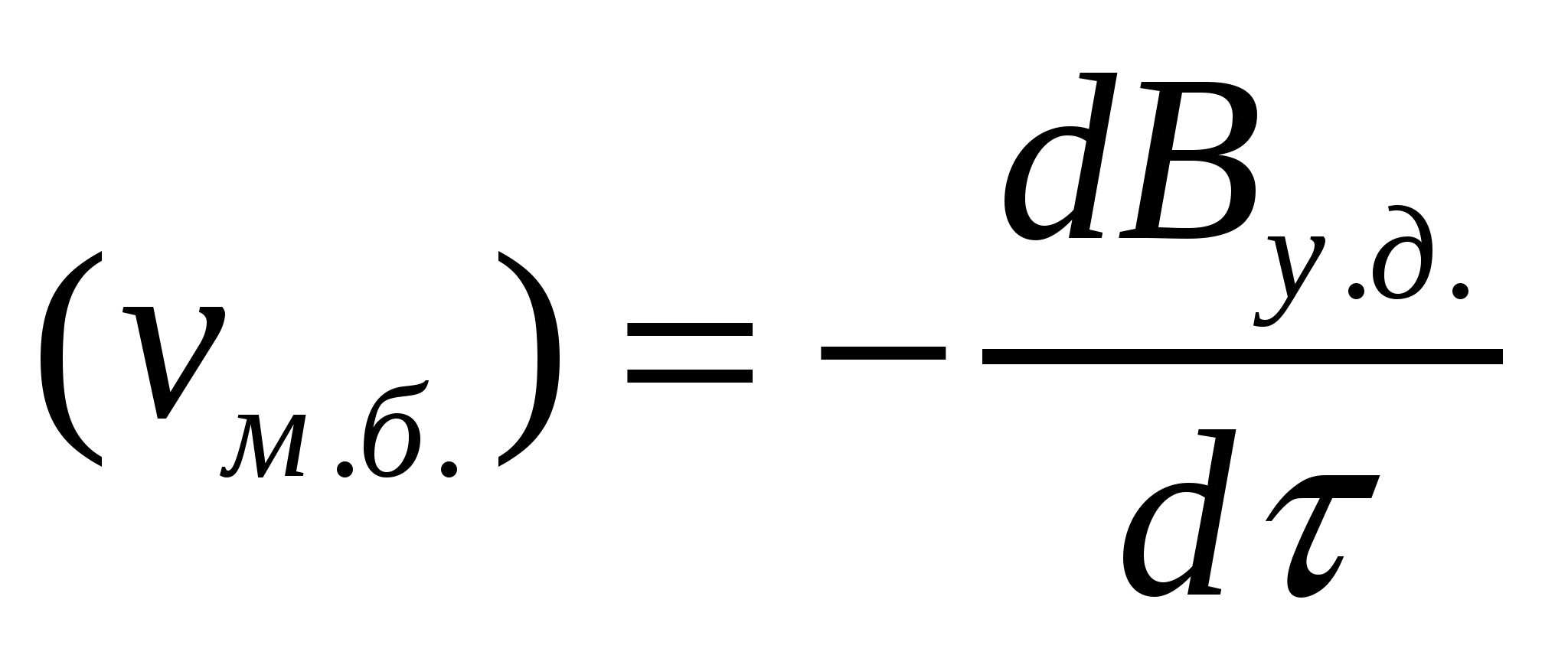 ,
,
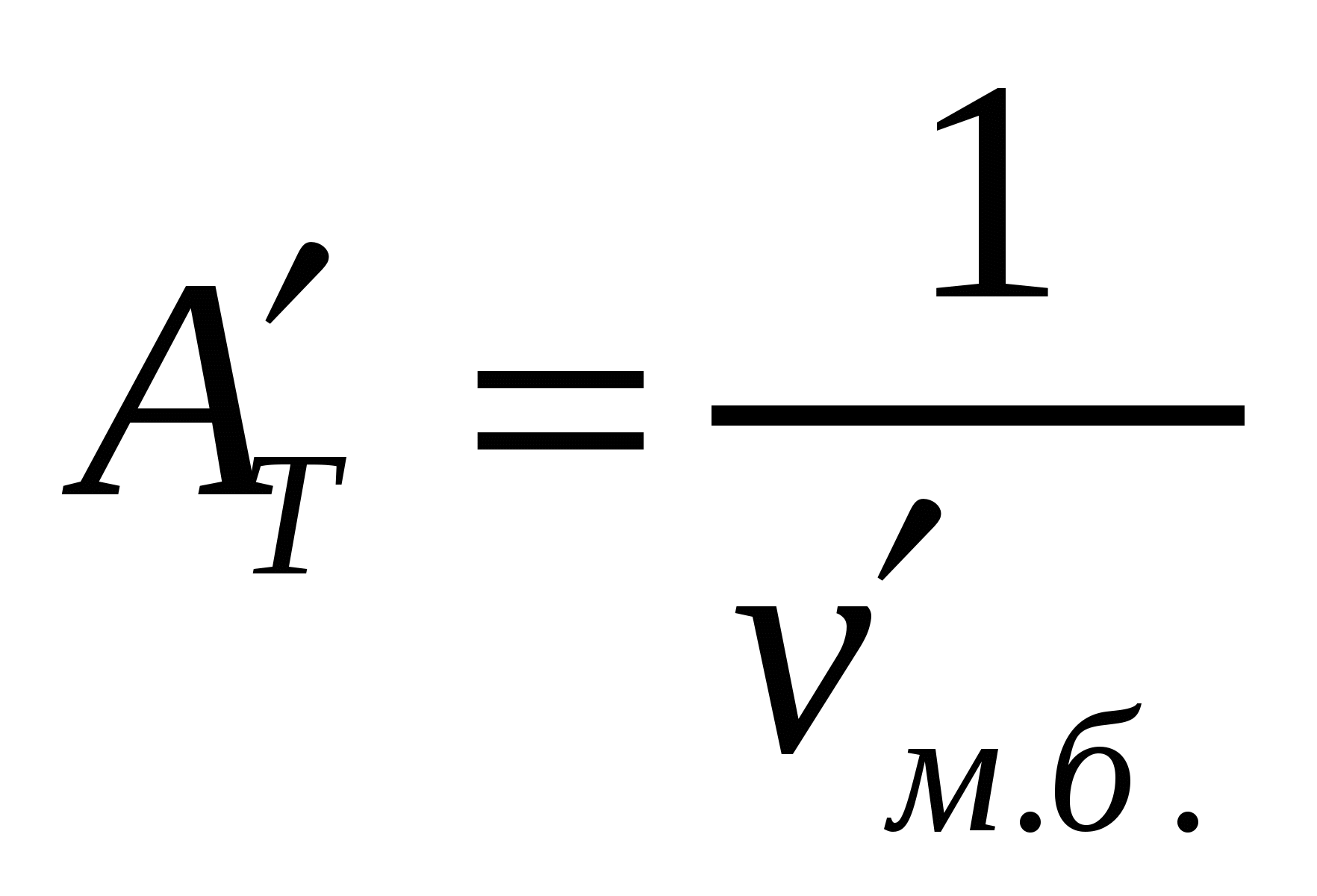 ;
; 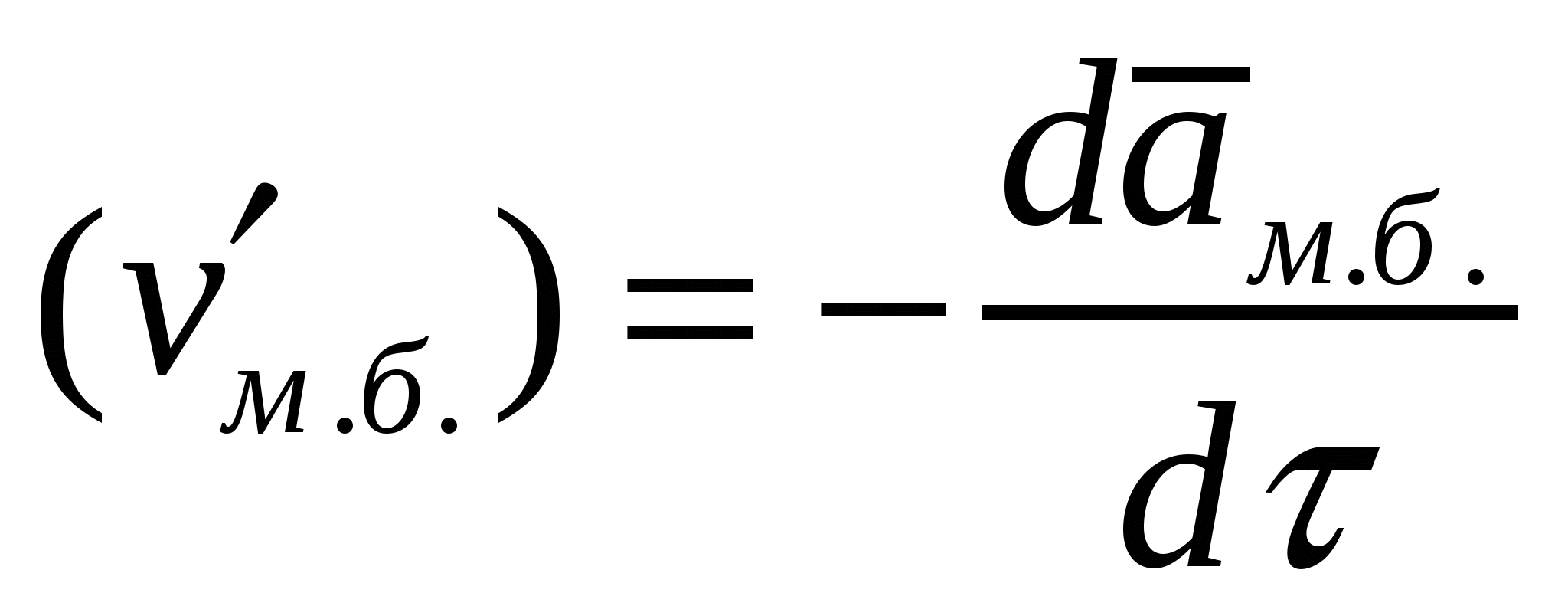 (14.2)
(14.2)
Жаттығулар.
1-есеп.
Көпіршіктер диаметрі 250 мкм еселігі 100 болатын 1 литр сыра көбігінің фазалық бөліну бетін анықтау қажет.
Шешуі:
Сұйықтықтың көлемі: 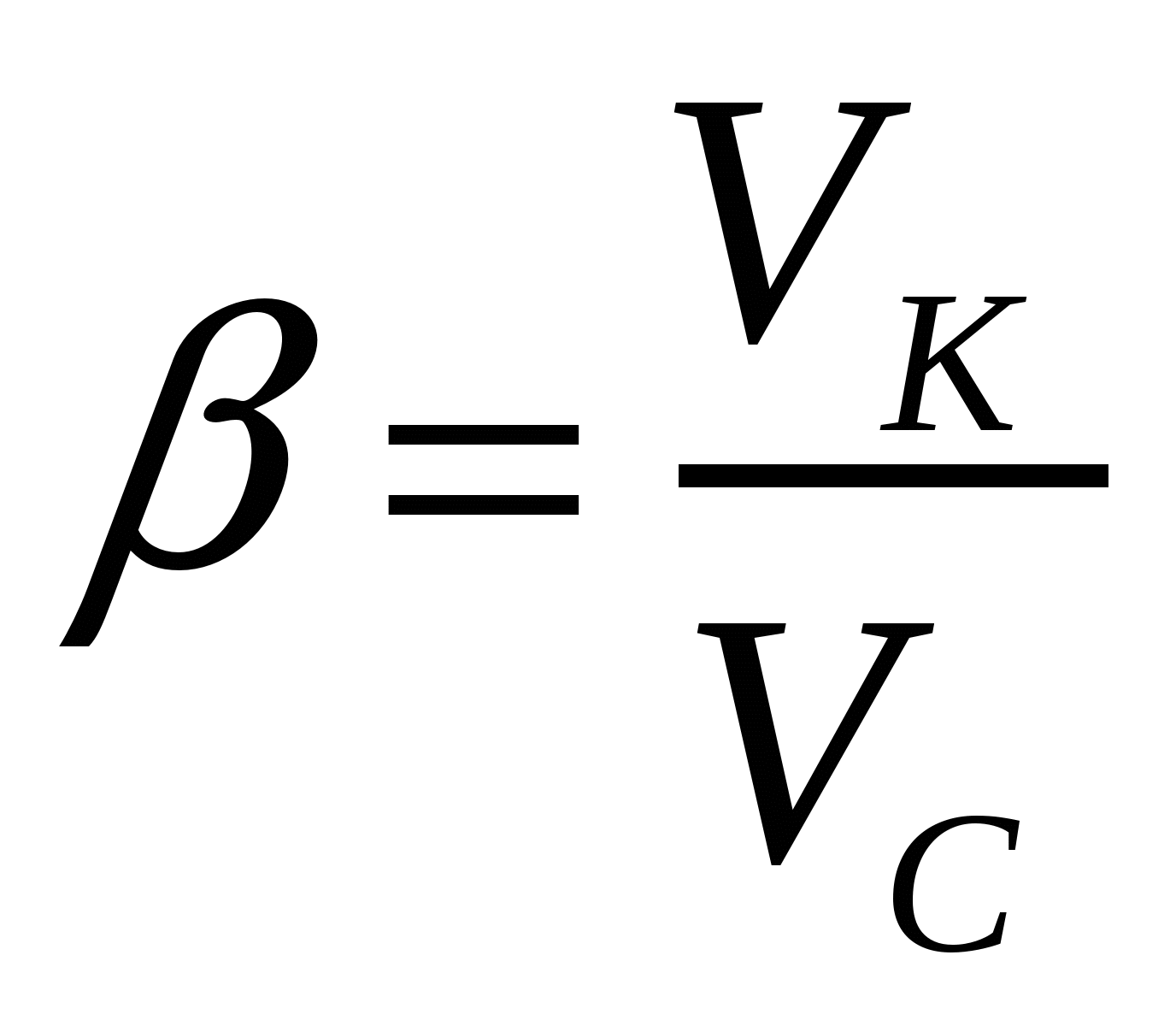 ;
; 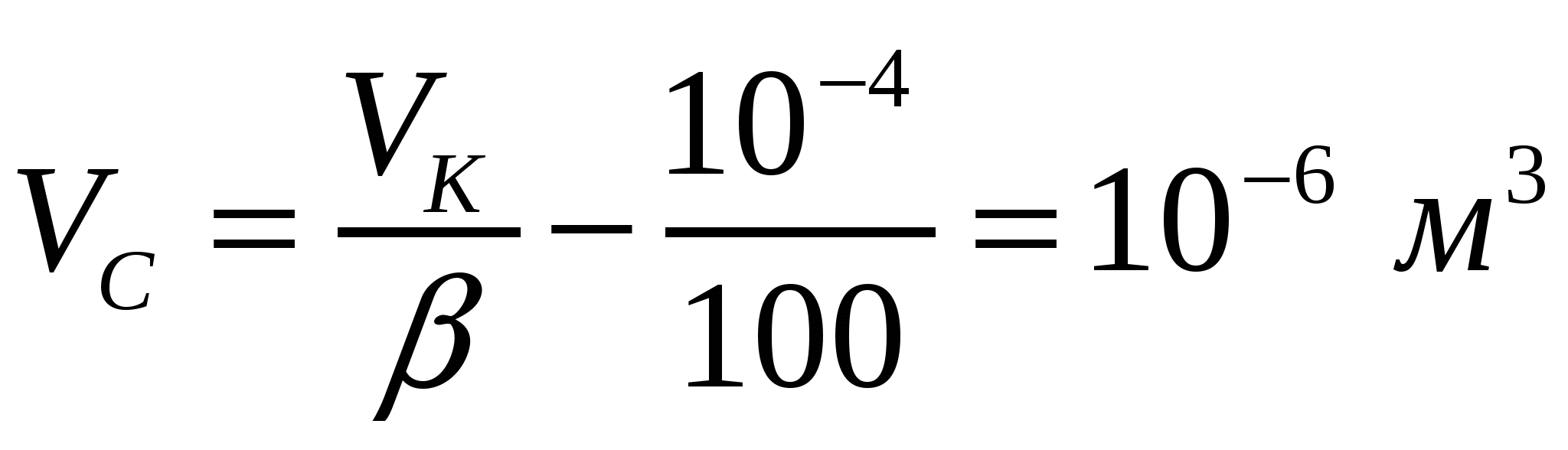 ,
,
Көпіршіктер саны: 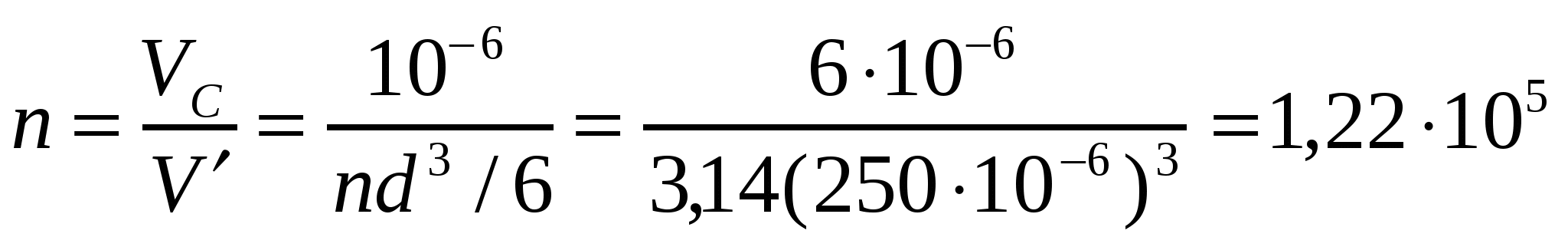
В', В - көбіктегі бір және барлық көпіршіктер беті:
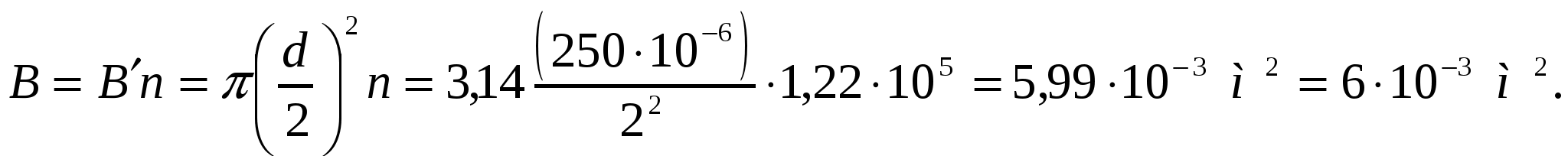
2-есеп.
Көбік түзілу уақыты 120-дан 360 секундқа дейін өсіп, көпіршіктер диаметрі 300-ден 1600 мкм-ге дейін үлкейсе, көбік ретінде көпіршіктердің өлшемінің үлкею жылдамдығын табу керек.
Шешуі:
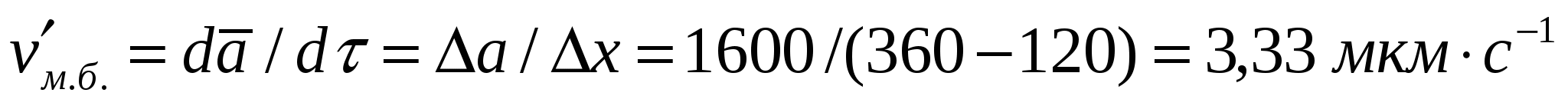 =
=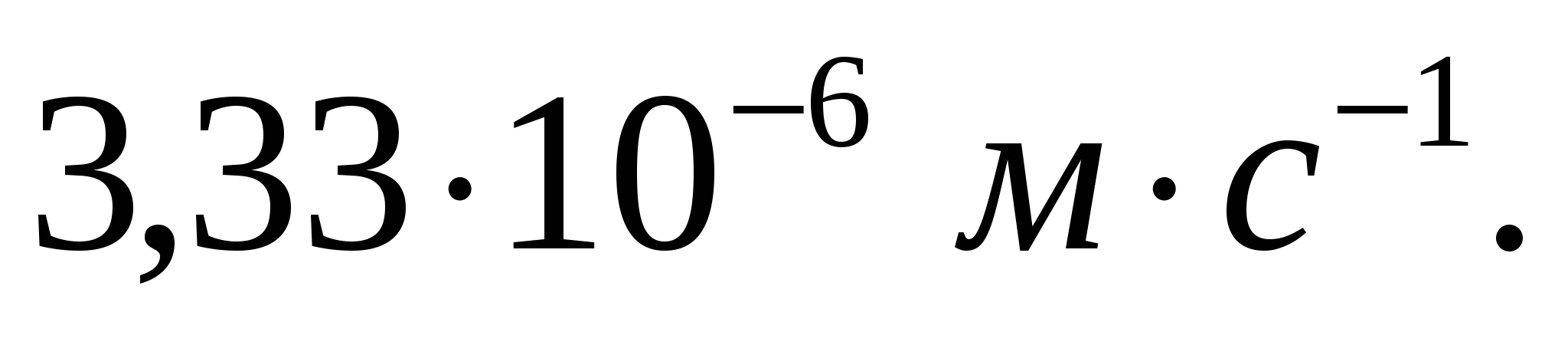
15. Аэрокірнелер.
Аэрокірнелердің табиғаттағы және адам өміріндегі маңызы зор. Мысалы жерді қоршаған ауа кең тараған табиғи аэрокірнелік жүйе болып табылады. Ауаның шаңдануына қарсы қоршаған ортаны қорғау жұмысы аэрокірнелерді бұзумен негізделген. Аэрокірне шөгінділері сусымалы материалдар (ұнтақтар) түзеді. Жер атмосферасында аэррокірнелердің түзілуі ауа ағысының әсерімен өтеді. Бөлшекке ауа ағысы тарапынан осы ағыс жылдамдығына тәуелді және ұзыннан бағытталға аэродинамикалық күш әсер жасайды. Бөлшектің ауа ортасына өтудің керекті жағдайыболып тігінен бағытталған 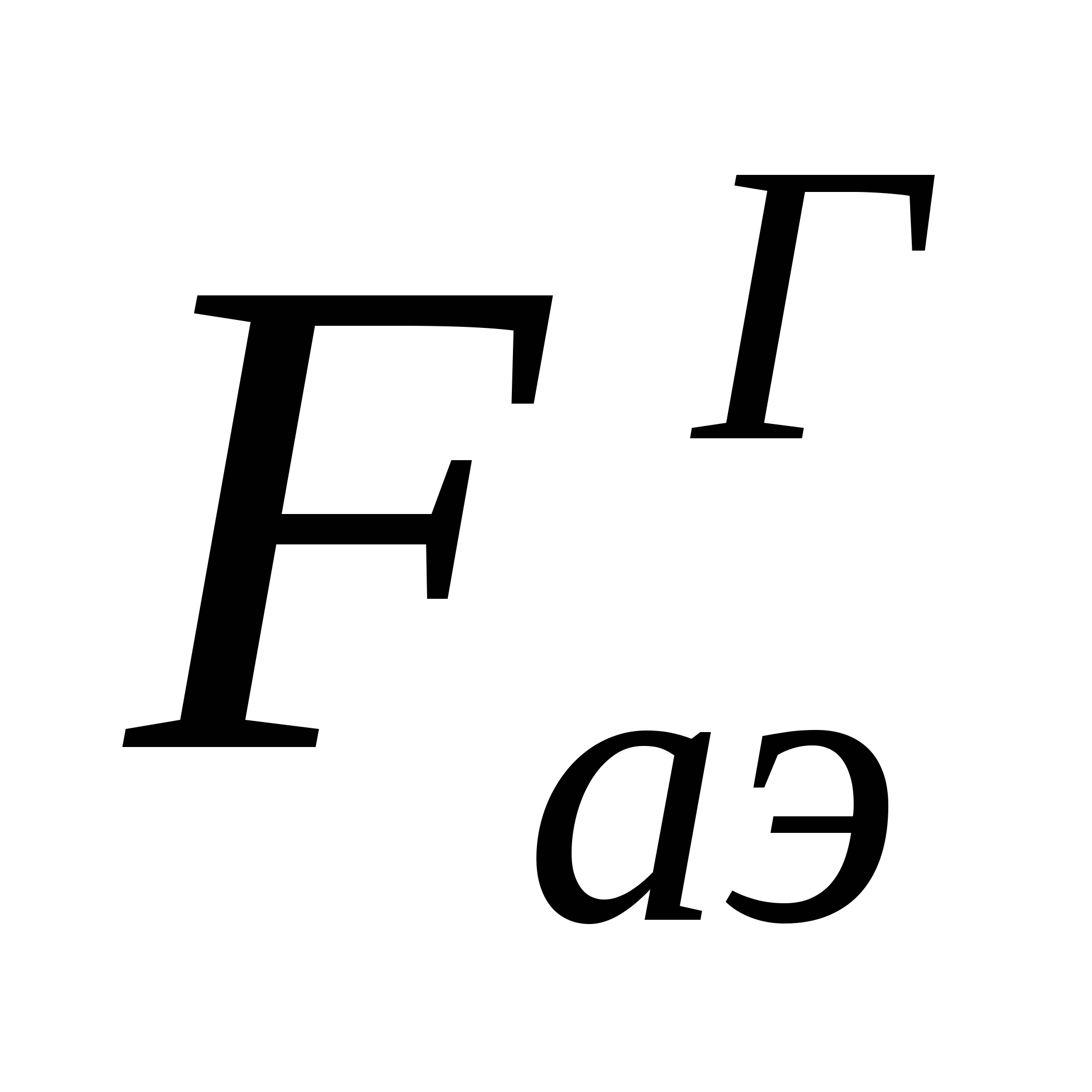 аэродинамикалық күштің
аэродинамикалық күштің 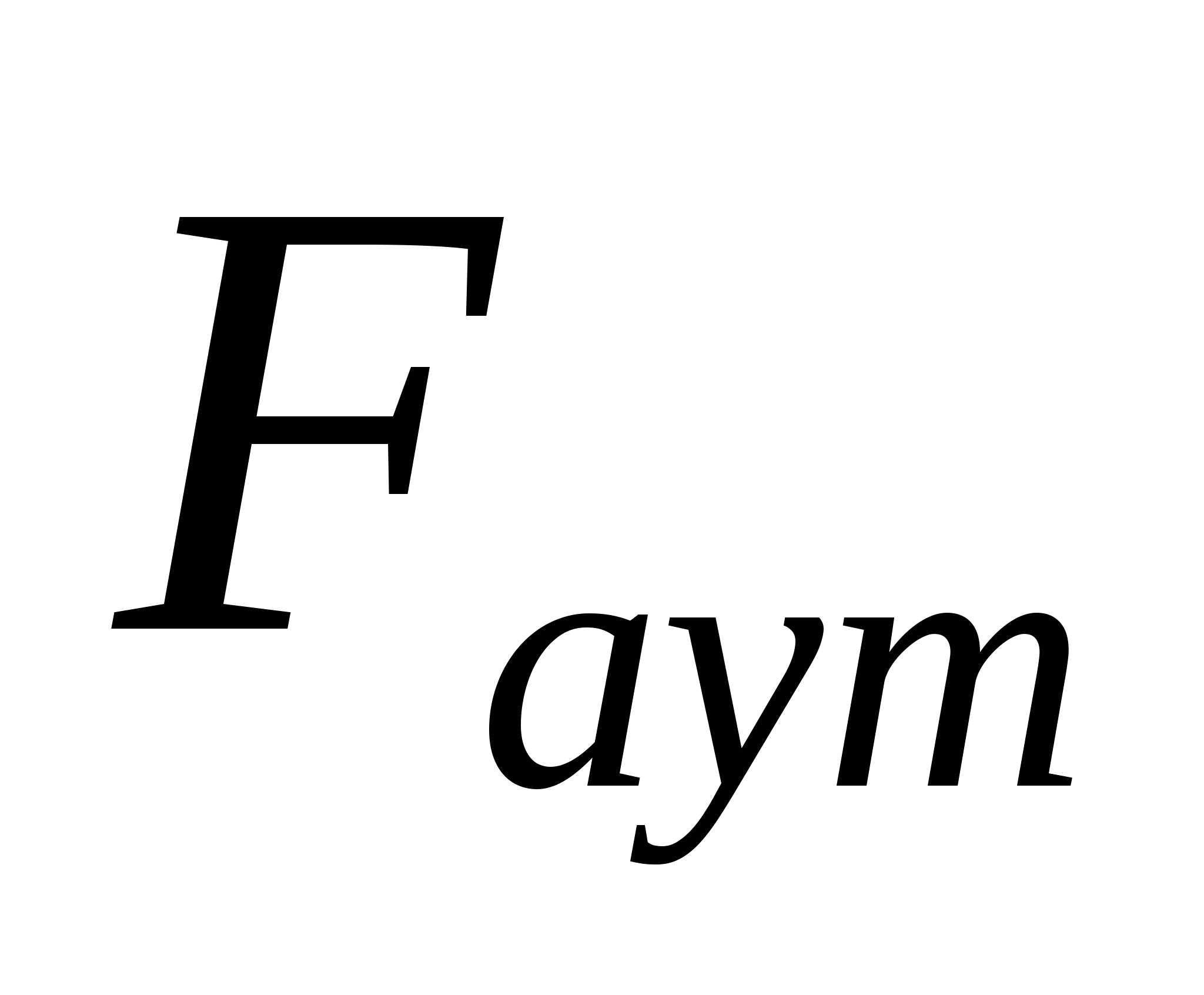 аутогезия күші мен бөлшек салмағының Р жалпы әсерінен артық болуы болып табылады:
аутогезия күші мен бөлшек салмағының Р жалпы әсерінен артық болуы болып табылады:
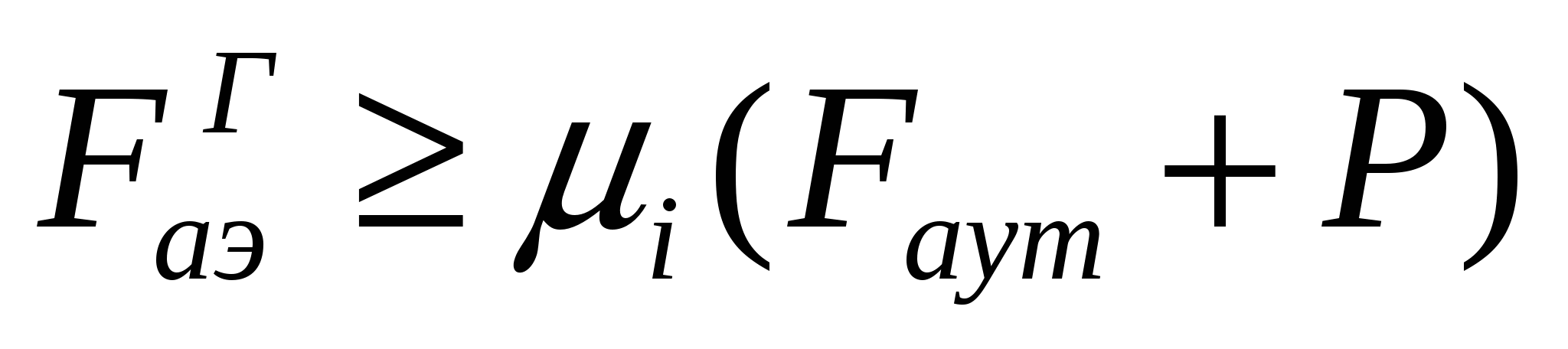 , (15.1)
, (15.1)
мұндағы μ - ішкі үйкеліс коэффициенті (күштердің әртүрлі бағыттарын ескереді).
Егер аутогезия күші бөлшек салмағынан әлдеқайда үлкен болса, (15.1) жағдайы жеңілдетіледі:
![]() (15.2)
(15.2)
Турбулентті ағыс кезінде ауа қозғалысы қарқынды араласумен қатар жүреді. Бөлшектерге әсер тигізетін аэродинамикалық күш келесі формуламен анықталады:
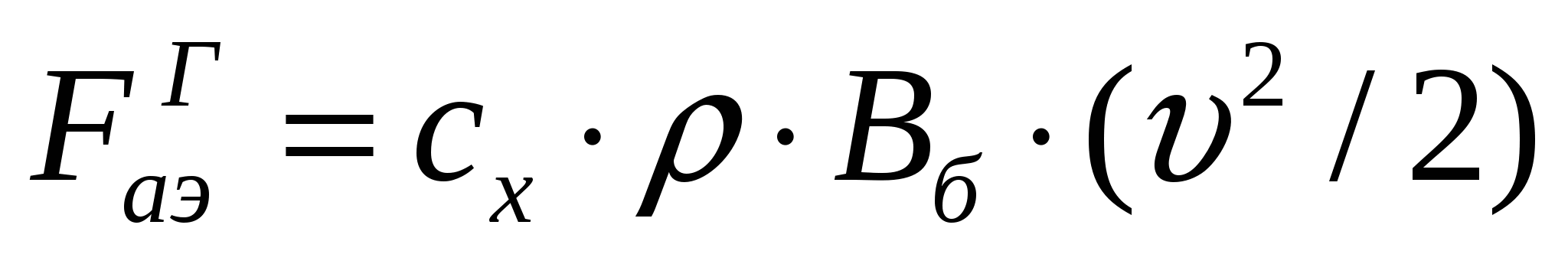 (15.3)
(15.3)
мұндағы ![]() - бөлшектердің қарсыласу коэффициенті; ρ - ауа тығыздығы; Вб - бөлшектің қиылысу ауданы (шар тәрізді бөлшектер үшін - шеңбер ауданы);
- бөлшектердің қарсыласу коэффициенті; ρ - ауа тығыздығы; Вб - бөлшектің қиылысу ауданы (шар тәрізді бөлшектер үшін - шеңбер ауданы);  - ауа ағысының жылдамдығы.
- ауа ағысының жылдамдығы.
Бөлшектердің ауа ағысымен жұлынуынан кейін аэродинамикалық күштің тігінен бағытталған құрауышы түзіледі. Тігінен және ұзыннан бағытталған аэродинамикалық күштер бөлшектердің аэрокірнелік жағдайға өтуін көрсетеді. (15.2) және (15.3) жағдайларын ескеріп, бөлшектердің аэрокірнелік жағдайға өтуіне қажет ауа ағысының жылдамдығын бағалауға болады:
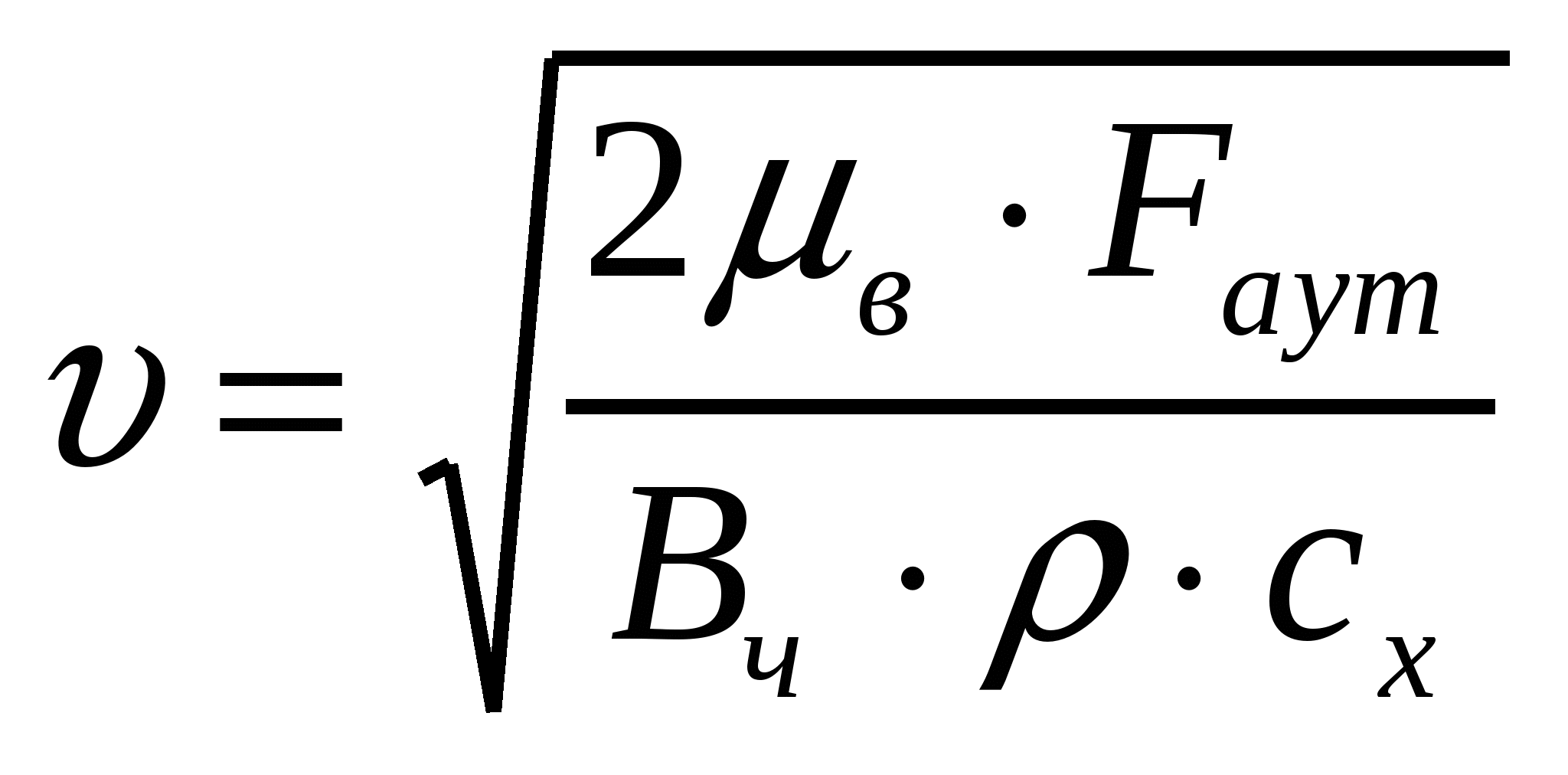 (15.4)
(15.4)
Есеп.
Парапарлық радиусы 10 мкм болатын бөлшектердің аэрокірнелік күйге жеткізетін ауа ағысының жылдамдығын анықтау қажет.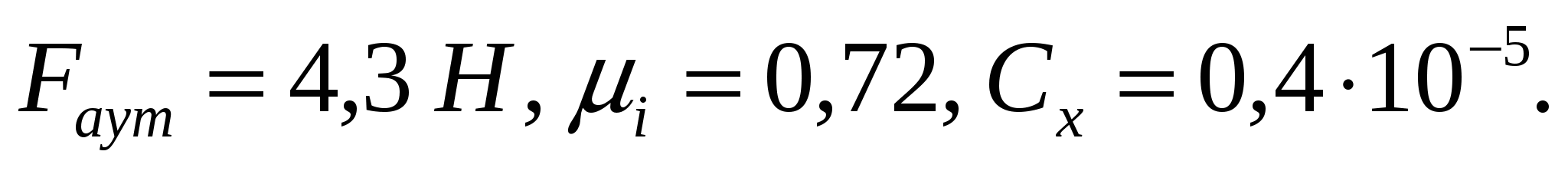
Шешуі:
(15.4) формуласында 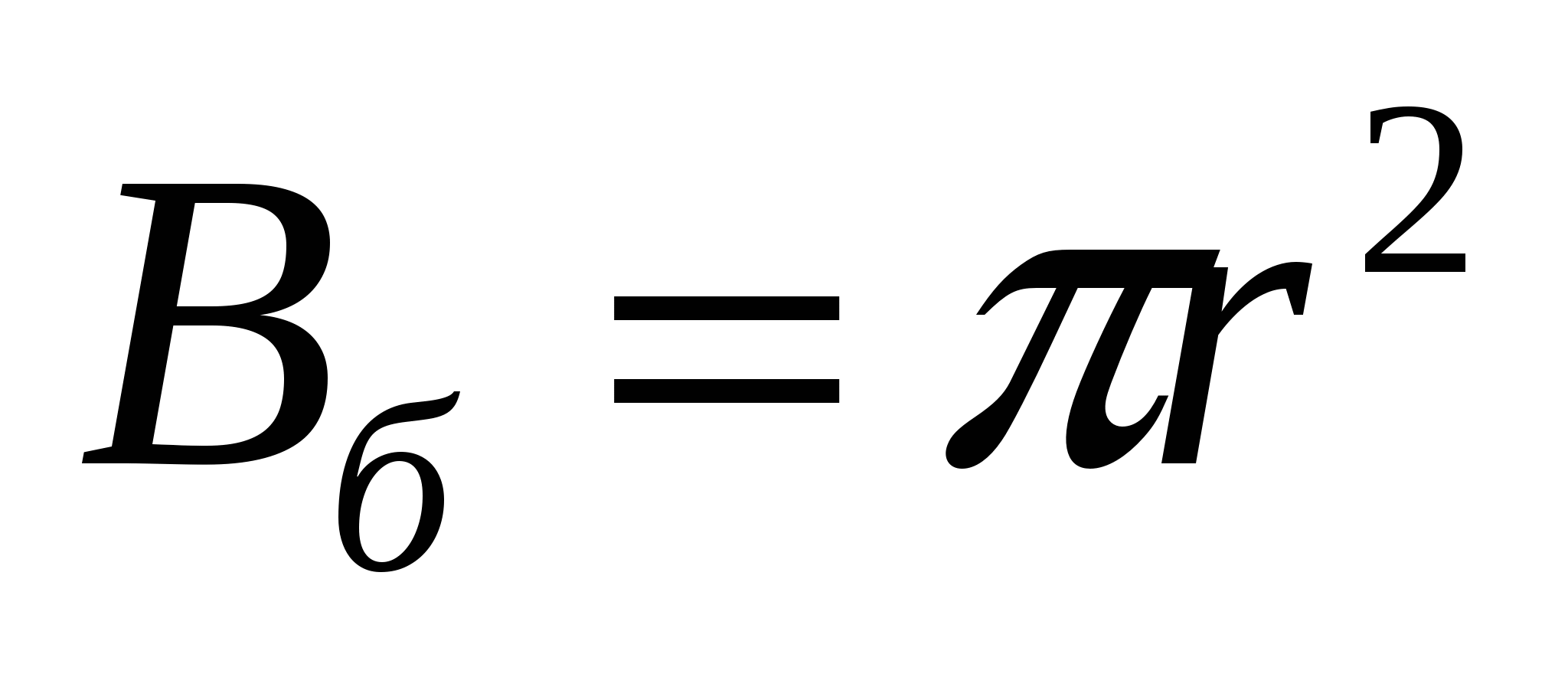 екенін ескереміз:
екенін ескереміз:
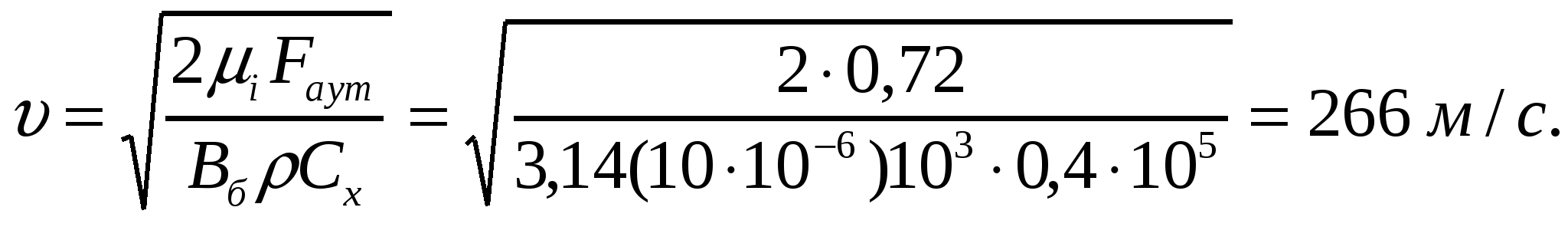
16. Қатты майдалағыш ортасы бар жүйелер.
Қатты майдалағыш ортасы бар жүйелерге нан, кірпіш, ағаш бетон және тағы басқалары жатады. Осы тәрізді жүйелерге М.В. Ломоносовпен алғаш рет балқыған шыныда Au3+ тотықсыздануымен алынған рубин шыныларын жатқызуға болады; лоар жоғары майдалы бөлшектер түрінде таралған аз мөлшерлі алтыны (0,01%-0,1%) бар шынылар.
Өзінің формасын сақтай алмайтын қозғалғыш сұйық және газ ортасы бар жүйелерге қарағанда, қатты майдалағыш ортасы бар жүйелердің коллоидтық және химиялық қасиеттері өзгеше болып табылады.
Г/Қ түрлі майдалық жүйелерде газ көпіршіктері қатты жабынмен қоршалған; мұндай жүйелерді қаттыкөбіктер деп атайды. Жай көбіктерге (Г/С) қарағанда, қатты көбіктердің құрылымдық негізі беріктілігімен және сыртқы әсерге төзімділігімен сипатталады. (14.1) жағдайына сәйкес қатты көбік еселігі келесі түрде көрсетіледі:
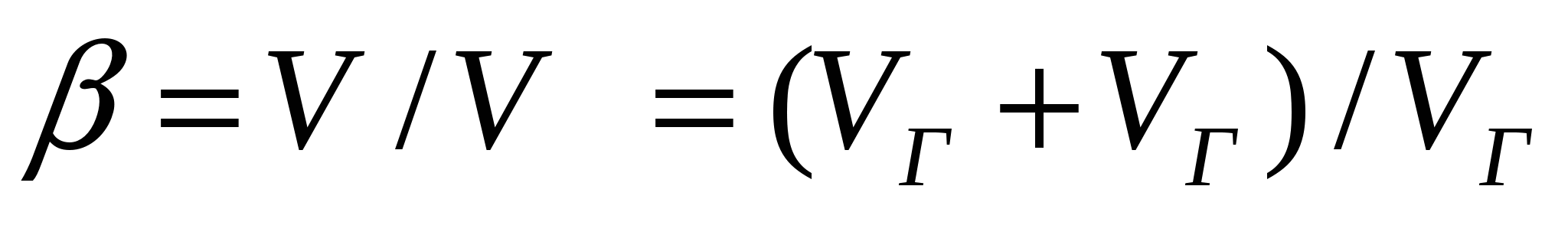 , (16.1)
, (16.1)
мұндағы VГ, VҚ, V - майдалағыш ортаны түзетін газ қосылымы мен қатты құрылымдық негіз, майдалық жүйе көлемдері.
Қылтүтікті-кеуекті денелерайрықша қасиеттерімен көзге түседі. Олардың майдалағыш ортасы қылтүтік мөлшерлі кеуектерге толы. Егер қылтүтіктер газбен толса - С/Қ жүйесін құрайды. Кей кезде сұйықтықпен кеуектің белгілі бір бөлімі толады, онда дене Г, С/Қ жүйесін құрайды. Қылтүтікті-кеуекті денелерге ағаш, мата, қағаз, кірпіш, киіз және т.б. жатады. Ылғалдылыққа тәуелді Г/Қ, С/Қ немесе Г,С/Қ жүйелерін ажыратады.
(2.6) формуласына сәйкес беттің қиғаштығына байланысты қысымды келесі түрде көрсетуге болады:
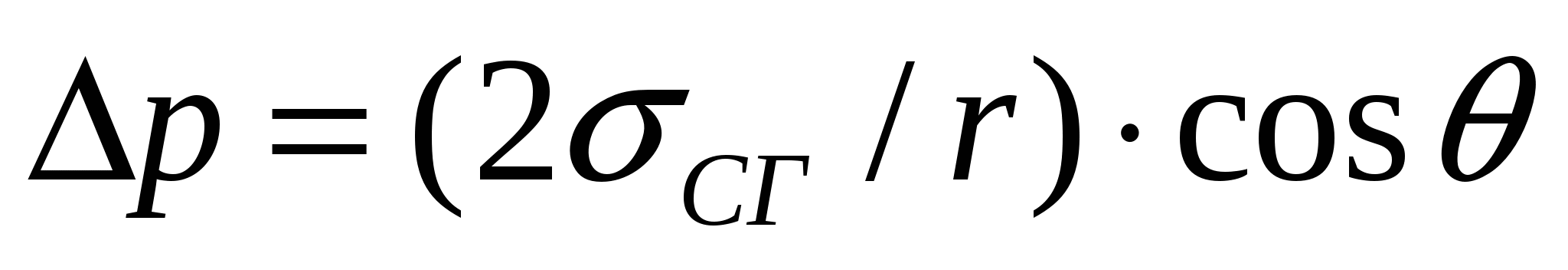 , (16.2)
, (16.2)
мұндағы θ - қиыр бұрыш.
Қылтүтікті қысым Н, салмағы РН сұйықтық бағанасымен теңестіріледі, яғни 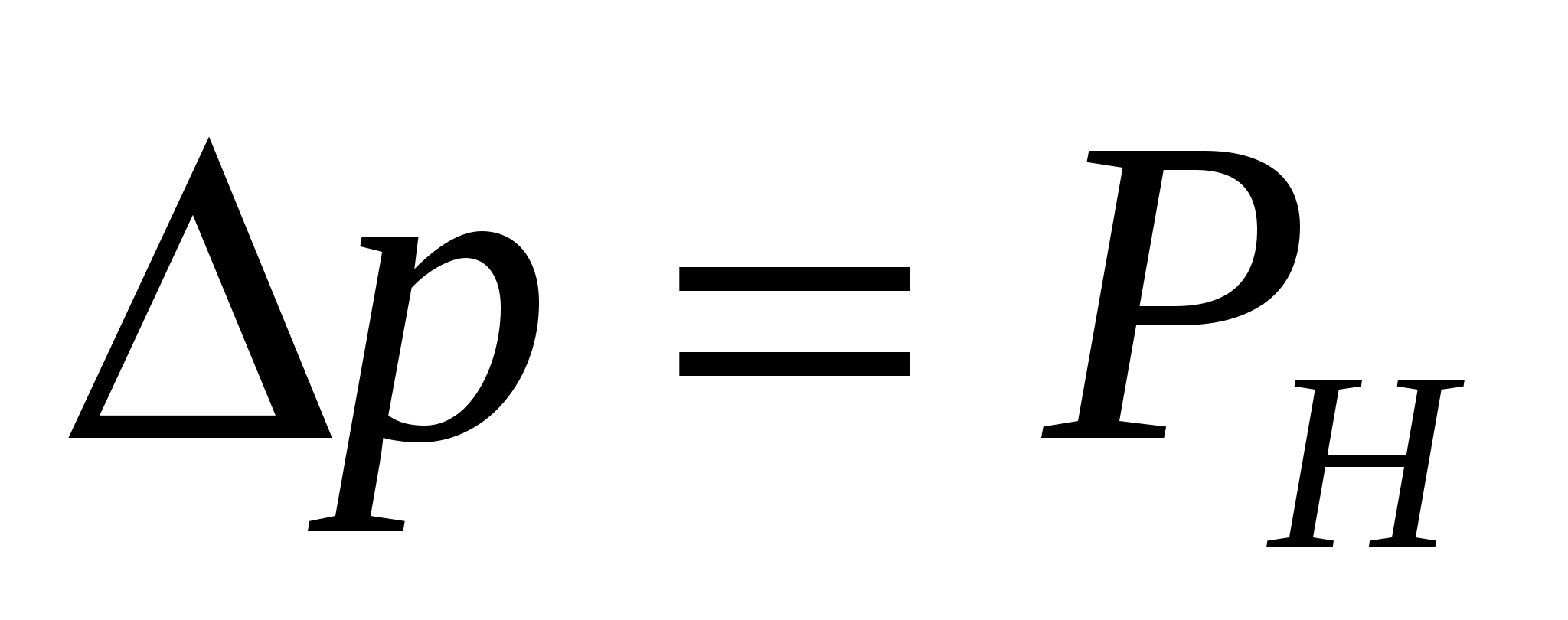 . Бұл теңдікті (16.1) теңдігімен сұйықтық бағанының салмағын ескеріп, келесі түрде жазуға болады:
. Бұл теңдікті (16.1) теңдігімен сұйықтық бағанының салмағын ескеріп, келесі түрде жазуға болады:
 , (16.3)
, (16.3)
мұндағы ρ, ρ0 - сұйықтық және газ тығыздығы.
 >>
>>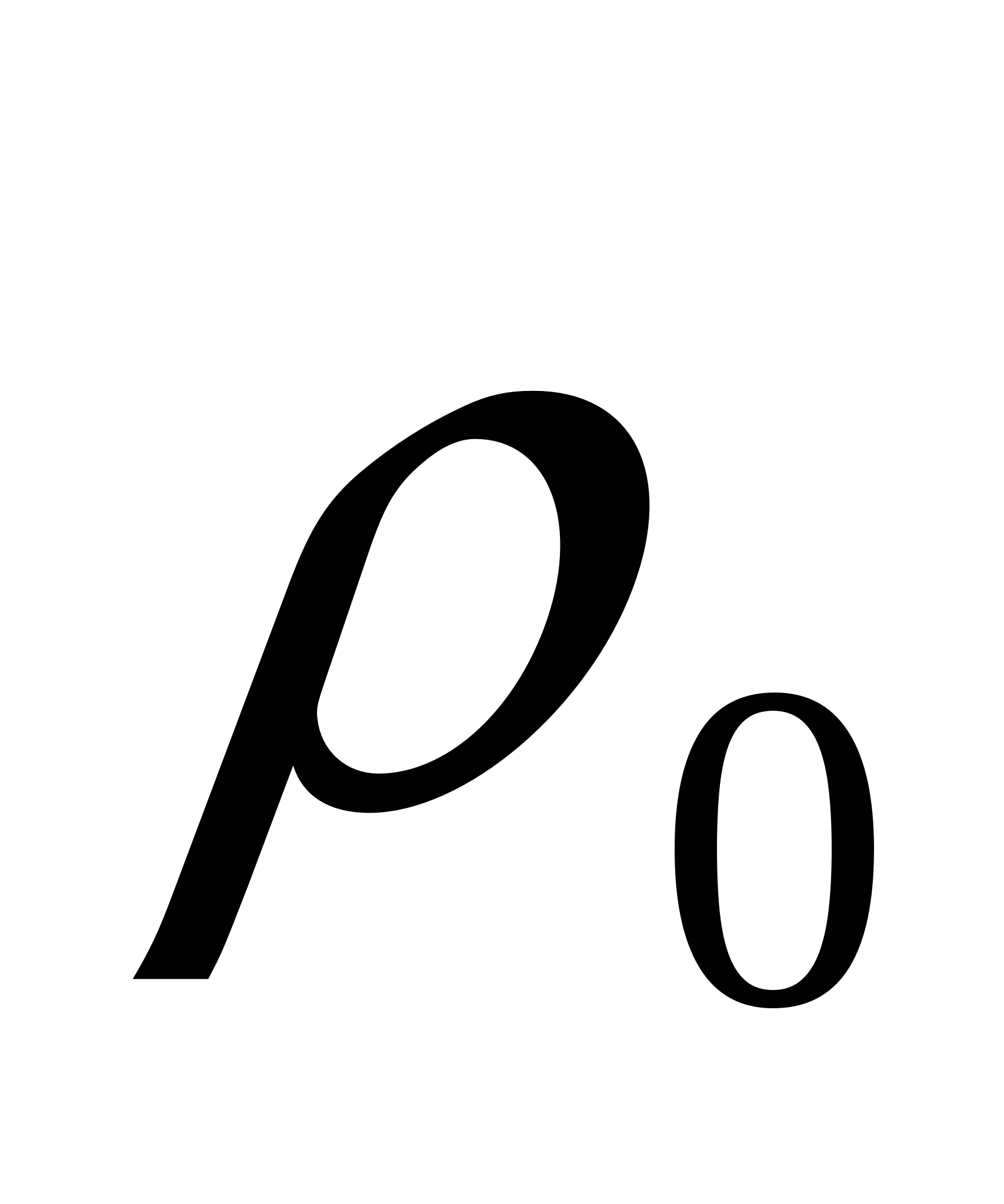 болғандықтан газ тығыздығын елемеуге болады, ал қылтүтіктегі сұйықтықтың көтерілу биіктігін келесі формуламен анықтаймыз:
болғандықтан газ тығыздығын елемеуге болады, ал қылтүтіктегі сұйықтықтың көтерілу биіктігін келесі формуламен анықтаймыз:
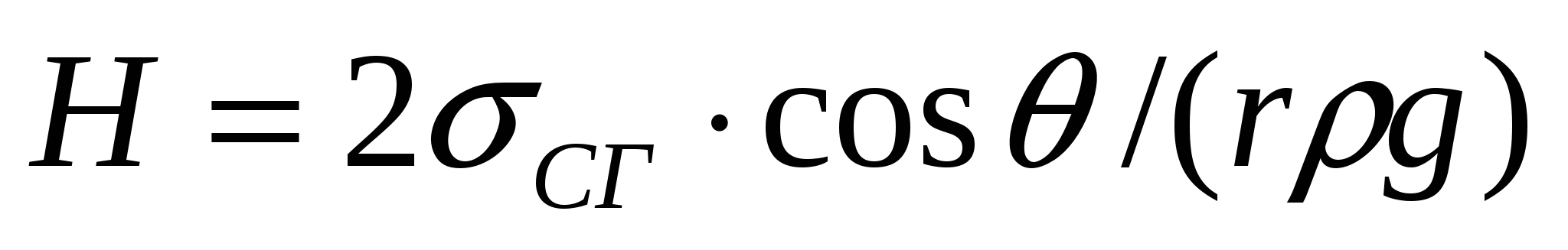 (16.4)
(16.4)
түгелімен суланғанда θ = 0, cos θ = 1 болғанда (16.4) теңдігі келесі түрде болады:
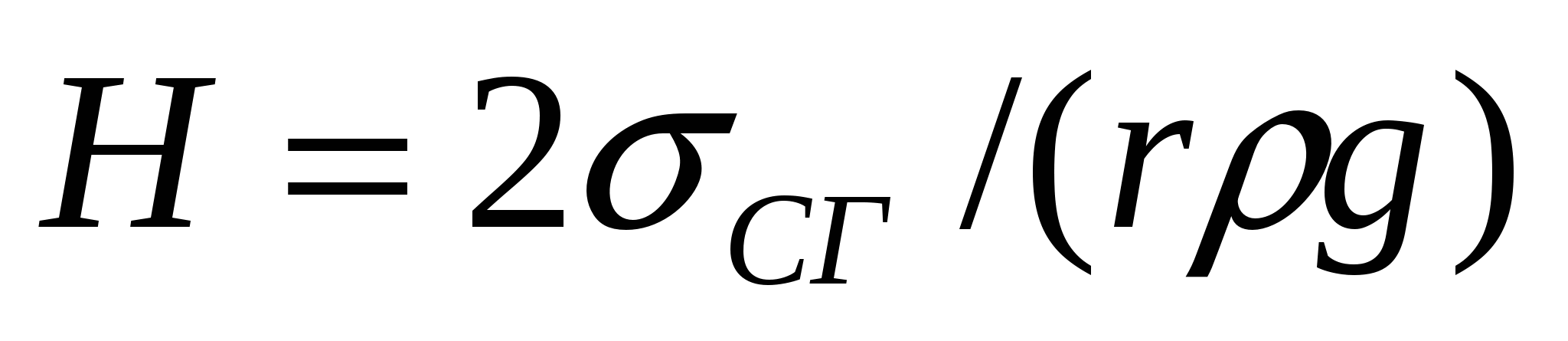 (16.5)
(16.5)
(16.4) және (16.5) теңдіктерімен қылтүтікті-кеуекті денелердегі сұйықтықтың көтерілу биіктігін анықтауға болады.
Жаттығулар.
1-есеп.
Қамырдағы көпіршіктер көлемі 4%. Егер нан пісіргенде ол 40 есе өссе, көбік еселігі қаншаға өседі?
Шешуі:
Көбік еселігін табу үшін (16.1) формуласын қолданамыз.
Қамыр үшін: 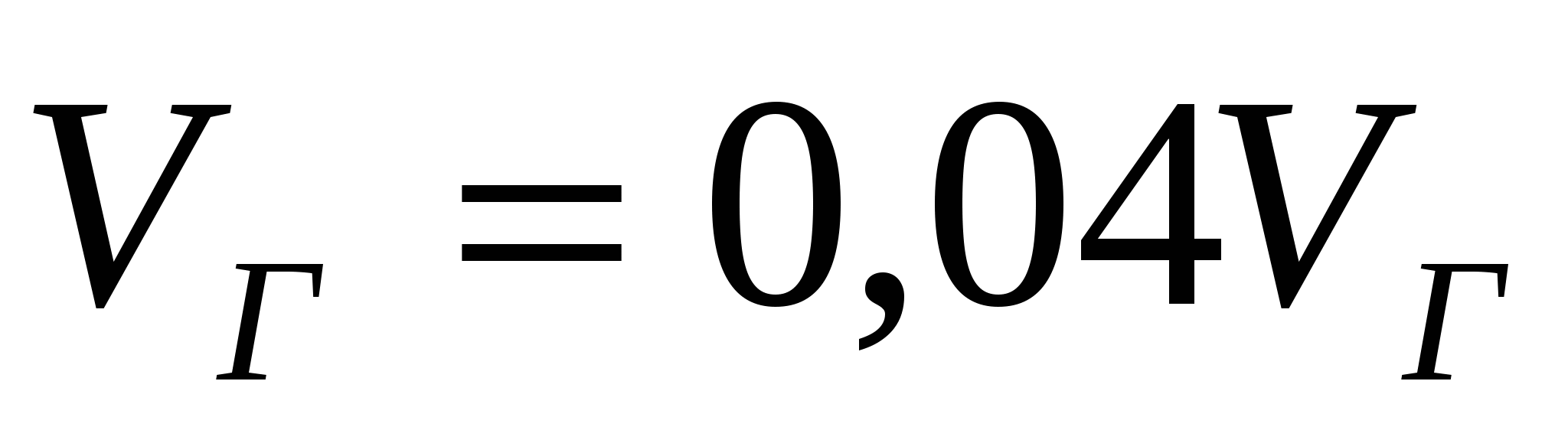 , нан үшін:
, нан үшін: 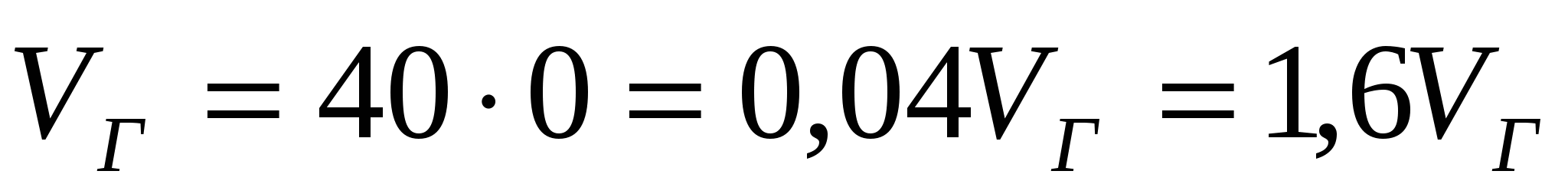 ,
,
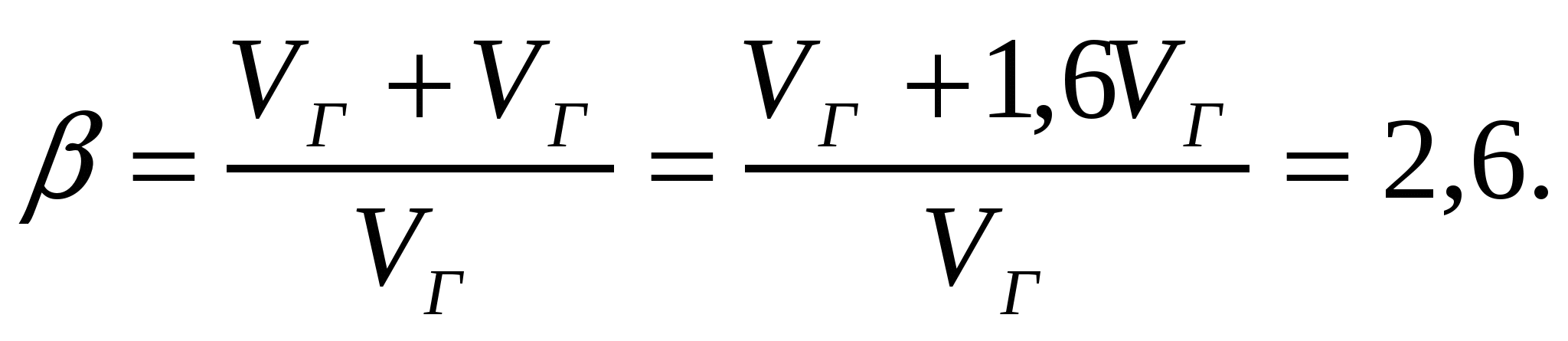
Көбік еселігі нан пісіргенде 1,04-тен 2,6-қа дейін өседі, яғни 2,5 есе.
2-есеп.
Егер ағаш кеуектерінің радиусы 1 мм-ден 1мкм аралығында өзгерсе, ағаш кеуектерінде су қандай биіктікке көтерілуі мүмкін? θ = 0 деп есептеңдер.
Шешуі:
(16.5) теңдігін қолданамыз. Егер кеуек радиусы 1мкм болса:
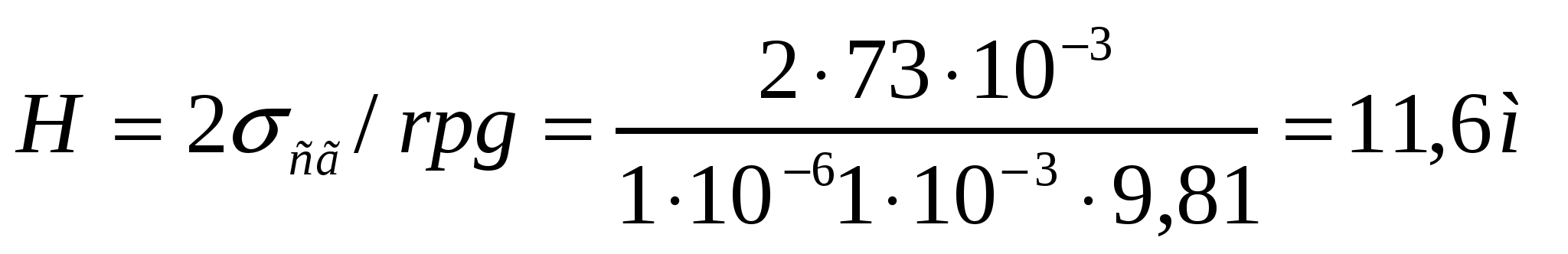
1 мм болғанда:
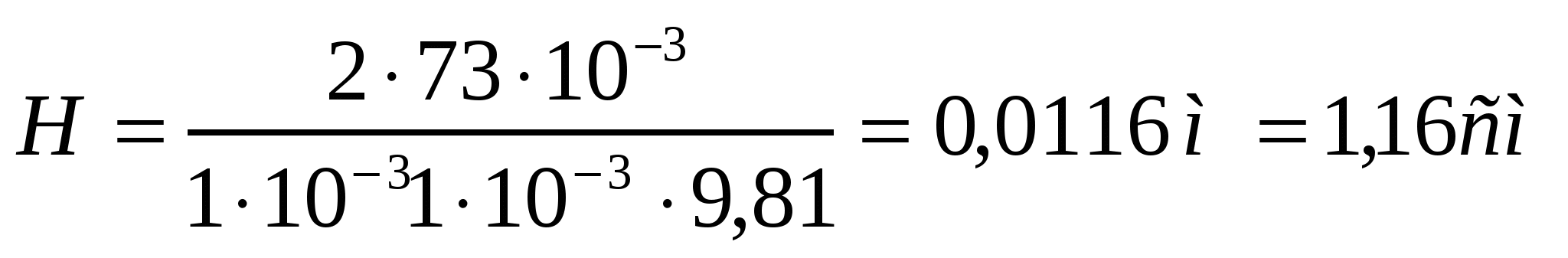
кеуек мөлшері 1000 есе азайса, сұйықтықтың биікке көтерілуі 1000 есе жоғарылайды.
17. Жоғары молекулалық қосылыстар.
ЖМҚ табиғи және синтетикалық болып ажыратылады. Табиғи ЖМҚ - ағуыздар, крахмал, целлюлоза - өсімдік әлемін құрап қана қоймай, азық-түлік құрамына да енеді. Азық-түлік өндірісінің бірқатар бөліктері табиғи ЖМҚ қолдануға негізделген. Синтетикалық ЖМҚ өндіріс пен тұрмыста кең қолданылады. Олардың негізінде табиғатта кездеспейтін және табиғи материалдарға тән емес қасиеттері бар материалдар алынады.
ЖМҚ ерітінділері майдалық жүйелерге және өздеріне тән қасиеттерге ие. Бұл жағдай коллоидтық химияның «ЖМҚ коллоидтық химиясы» атты бөлімінің ашылуына әкелді. ЖМҚ ерітінділеріне 3 топ қасиеттер тән. Алғашқы екеуі шынайы және коллоидтық ерітінділерге тән қасиеттер. Үшіншісі ЖМҚ-ға ғана тән қасиеттер: ісіну және қатқыл түзу.
Шынайы және коллоидтық ерітінділердің осмостық қысымы (9.6) формуласымен анықталса, ЖМҚ ерітіндісінің осмостық қысымы келесі формуламен есептелінеді:
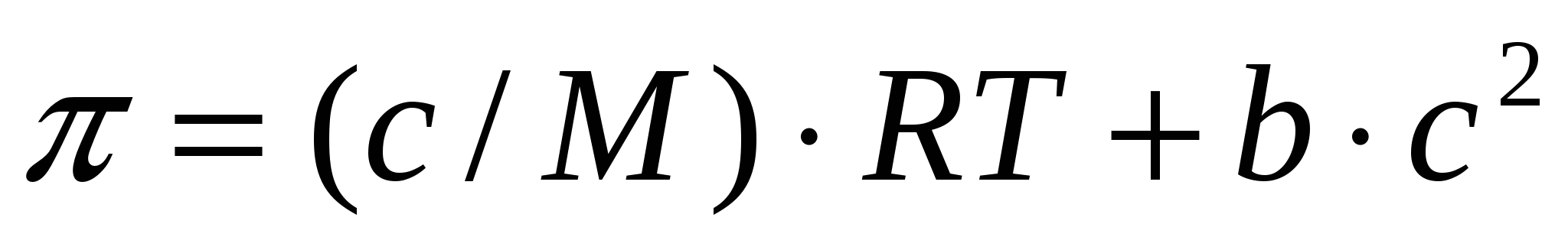 , (17.1)
, (17.1)
мұндағы с,М - ЖМҚ концентрациясы мен молекулалық массасы; b - екінші вариалды коэффициент.
Сипаттаушы тұтқырлықты визкозиметриялық өлшемдер негізінде анықтайды. Ол айтарлықтай қасиетке ие. Ол ЖМҚ макромолекуласының молекулалық массасымен байланысты. Ескерту: көптеген табиғи ЖМҚ-да молекулалық масса тұрақты болады. Сондықтан молекулалық массаны синтетикалық және кейбір табиғи ЖМҚ үшін анықтайды. Бір еріткіш үшін сипаттаушы тұтқырлық пен молекулалықмасса арасындағы байланыс келесі түрде көрсетіліді:
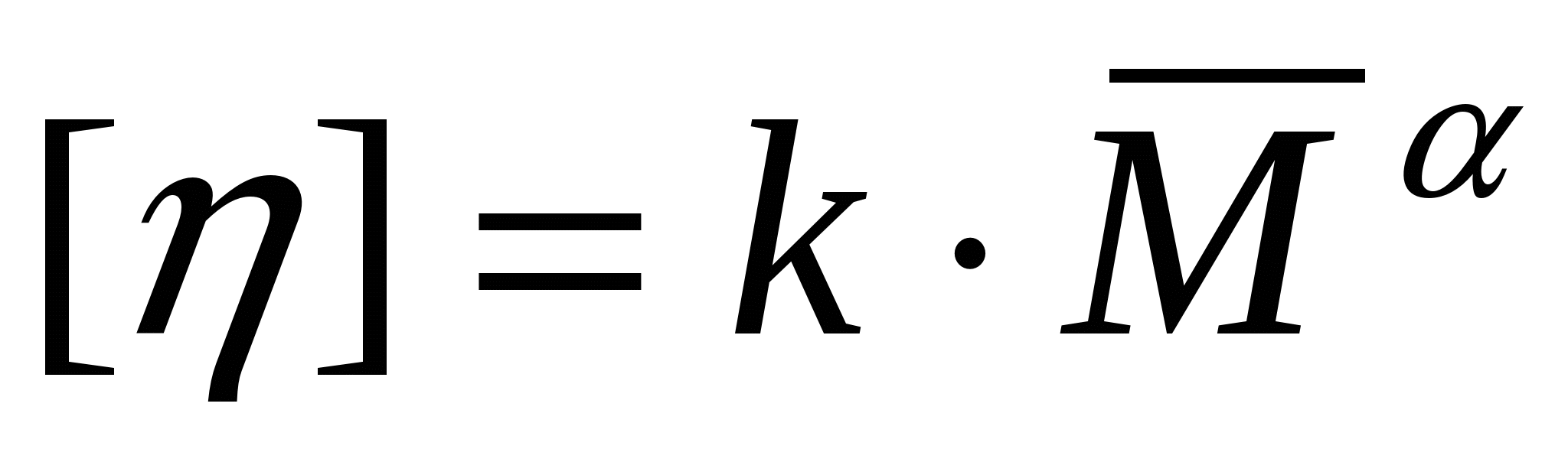 ,
,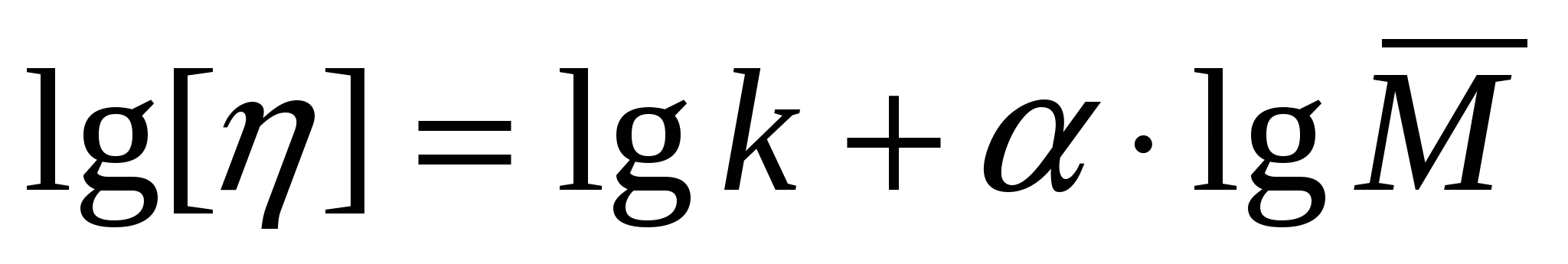 (17.2)
(17.2)
мұндағы М - молекулалық масса (синтетикалық және кейбір ЖМҚ-ға орташа, табиғи ЖМҚ-ға шынайы мән қолдану керек); 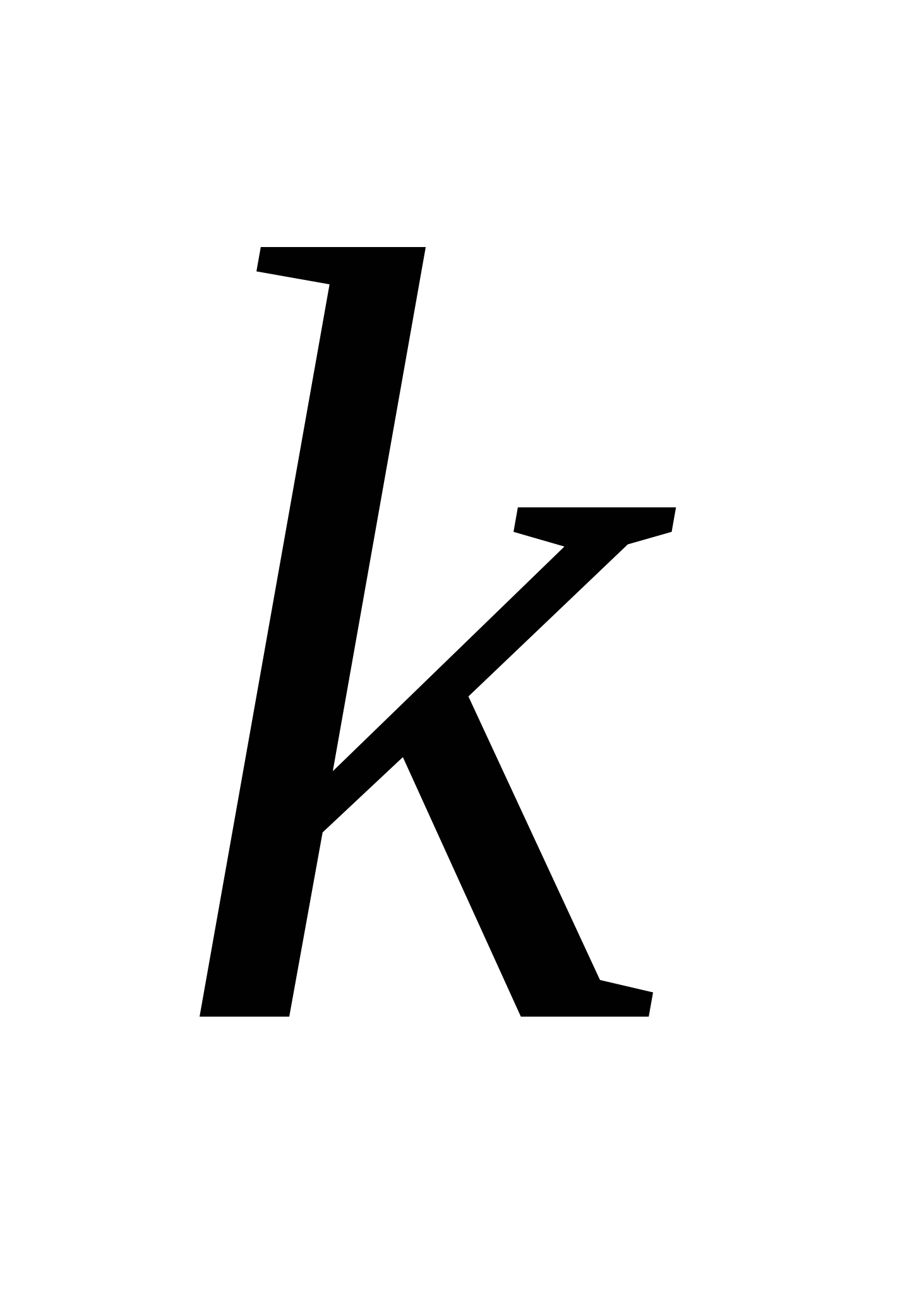 - берілген еріткіштегі бір гомологиялық қатардағы ЖМҚ ерітінділеріне тұрақты коэффициент; α - макромолекулалар тізбегінің майыскыштығы менконформациялық күйге тәуелді олардың формасын сипаттайтын коэффициент.
- берілген еріткіштегі бір гомологиялық қатардағы ЖМҚ ерітінділеріне тұрақты коэффициент; α - макромолекулалар тізбегінің майыскыштығы менконформациялық күйге тәуелді олардың формасын сипаттайтын коэффициент.
ЖМҚ макромолекулалары еріткішпен әсерлескенде ісінуі мүмкін. Ісіну - ЖМҚ-дың төмен молекулалық қосылыстарды сіңіру (жұту) арқылы массасы мен көлемін ұлғайту. Ол ЖМҚ массасының өсуін көрсететін ісіну дәрежесімен сипатталады:
 , (17.3)
, (17.3)
мұндағы ![]() ,
, ![]() - ЖМҚ-дың ісінуге дейін және кейінгі массасы;
- ЖМҚ-дың ісінуге дейін және кейінгі массасы; ![]() - сіңген сұйықтық массасы.
- сіңген сұйықтық массасы.
Ісіну кинетикасы, яғни уақыт ішіндегі ісіну жылдамдығының өзгеруі бірінші тәртіпті реакция механизмімен жүреді. Осыған байланысты ісіну жылдамдығы:
 , (17.4)
, (17.4)
мұндағы ki - ісіну жылдамдығы тұрақтысы;  - ісіну уақыты;
- ісіну уақыты;  - τ уақытындағы ісіну дәрежесі;
- τ уақытындағы ісіну дәрежесі;  - шекті ісіну дәрежесі.
- шекті ісіну дәрежесі.
(17.4) формуласын интегралдау арқылы, ісіну жылдамдығының тұрақтысын табамыз. Ол бірінші тәртіпті реакция жылдамдығының тұрақтысына сәйкес түрде көрсетіледі:
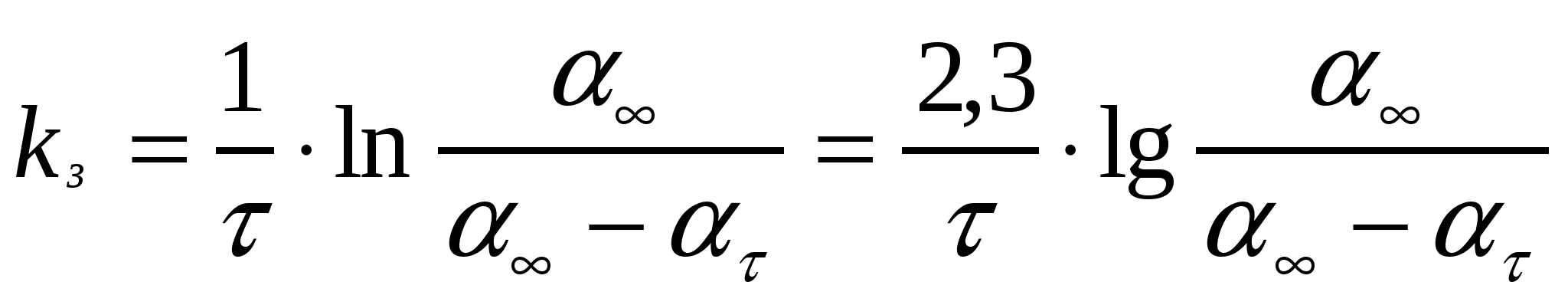 (17.5)
(17.5)
Ісіну жылдамдығының тұрақтысы және  ісіну дәрежесі процесс кинетикасын сипаттаса,
ісіну дәрежесі процесс кинетикасын сипаттаса,  - оның соңғы нәтижесін сипаттайды. Ісіну жылу бөлінумен өтеді. Ісіну кезінде бөлінген жылулық пәрмен - ісіну жылуы деп аталады. Жылудың бөлінуі бірінші сатыда, яғни еріткіш молекуласының сольватациясы кезінде байқалады. Екінші саты, яғни макромолекула бөлімшілері тізбекшелерінің диффузиясы энтропия факторымен негізделген.
- оның соңғы нәтижесін сипаттайды. Ісіну жылу бөлінумен өтеді. Ісіну кезінде бөлінген жылулық пәрмен - ісіну жылуы деп аталады. Жылудың бөлінуі бірінші сатыда, яғни еріткіш молекуласының сольватациясы кезінде байқалады. Екінші саты, яғни макромолекула бөлімшілері тізбекшелерінің диффузиясы энтропия факторымен негізделген.
Интегралды және дифференциалды ісіну жылуын ажыратады. Интегралды ісіну жылуы - қатты зат массасы бірлігінің сұйықтықтың белгілі бір массасын жұту кезіндегі ісінудің барысындағы жылу мөлшері. Оны келесі эмпирикалық формуламен анықтауға болады:
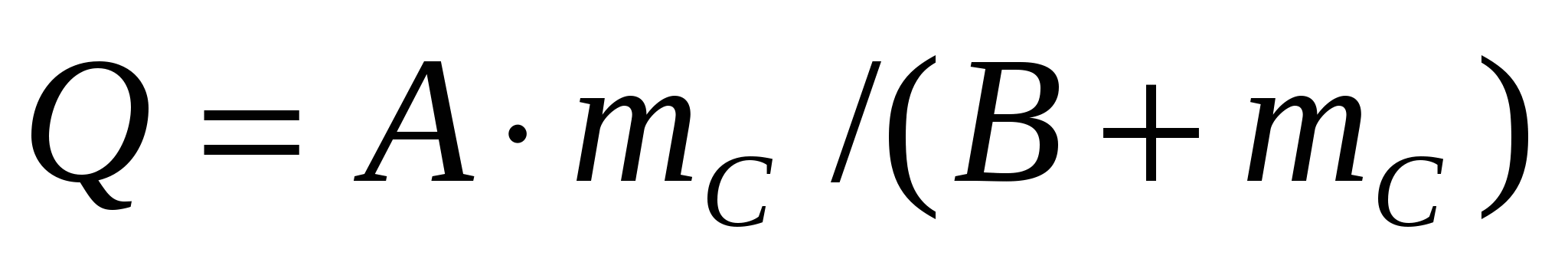 , (17.6)
, (17.6)
мұндағы А,В - тәжірибелік коэффициенттер; mС - ісінген ЖМҚ-тағы сұйықтық массасы.
Интегралды ісіну жылуы үлкен мәнге ие болуы мүмкін. Мысалы1 кг желатин ісінгенде 27,9 кДж, 1кг крахмал ісінгенде 32,3 кДжжылу бөлінеді.  интегралды ісіну жылуын mС бойынша дифференциалдау кезінде дифференциалды ісіну жылуын табамыз. Ол сұйықтық массасы (1кг) бірлігі сіңгендегі ісінудің кез келген сатысындағы жылу мөлшерін көрсетеді:
интегралды ісіну жылуын mС бойынша дифференциалдау кезінде дифференциалды ісіну жылуын табамыз. Ол сұйықтық массасы (1кг) бірлігі сіңгендегі ісінудің кез келген сатысындағы жылу мөлшерін көрсетеді:
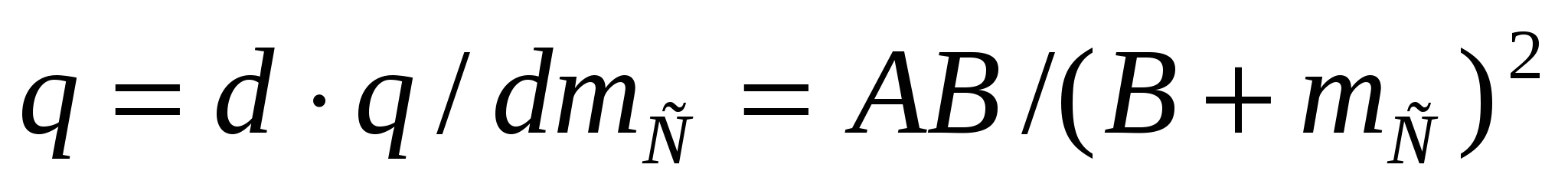 (17.7)
(17.7)
Жаттығулар.
1-есеп.
Массалық концентрациясы 2,50кг/м2 болатын желатин ерітіндісінің 293К кезіндегі осмостық қысымын анықтау қажет. өнімнің молекулалық массасы 104600, b коэффициентінің мәні 0,60.
Шешуі:
(19.1) формуласы бойынша:
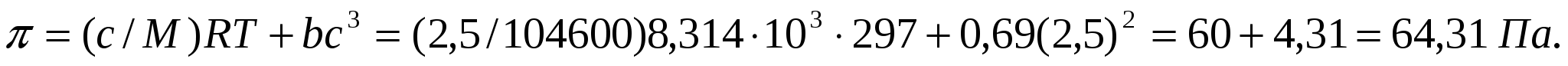
2-есеп.
Ісінуге дейінгі заттың массасы 1,09*10-3кг, максималды сіңген су мөлшері 21,12*10-6м3 болса, желатиннің суда ісіну дәрежесін, ісіну жылдамдығы тұрақтысын табу қажет.
291К кезіндегі ісіну уақытына байланысты сіңген су мөлшері:
ісіну уақыты t, мин 50 100 150
сіңген су көлемі V, м3 6,05 10,46 13,57
Шешуі:
Ісіну дәрежелері:
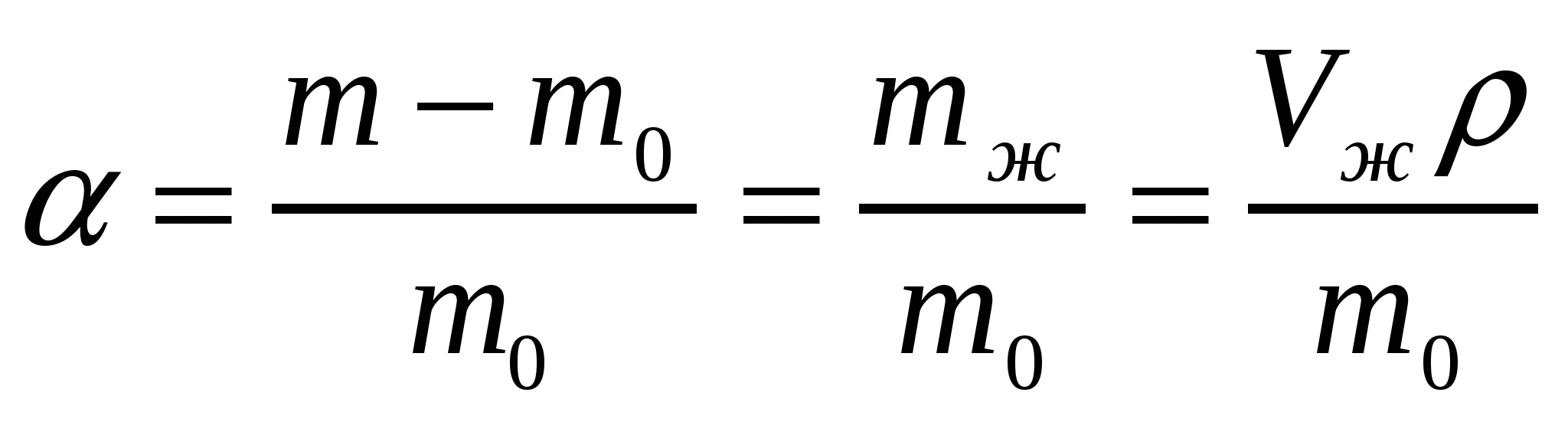 ;
;
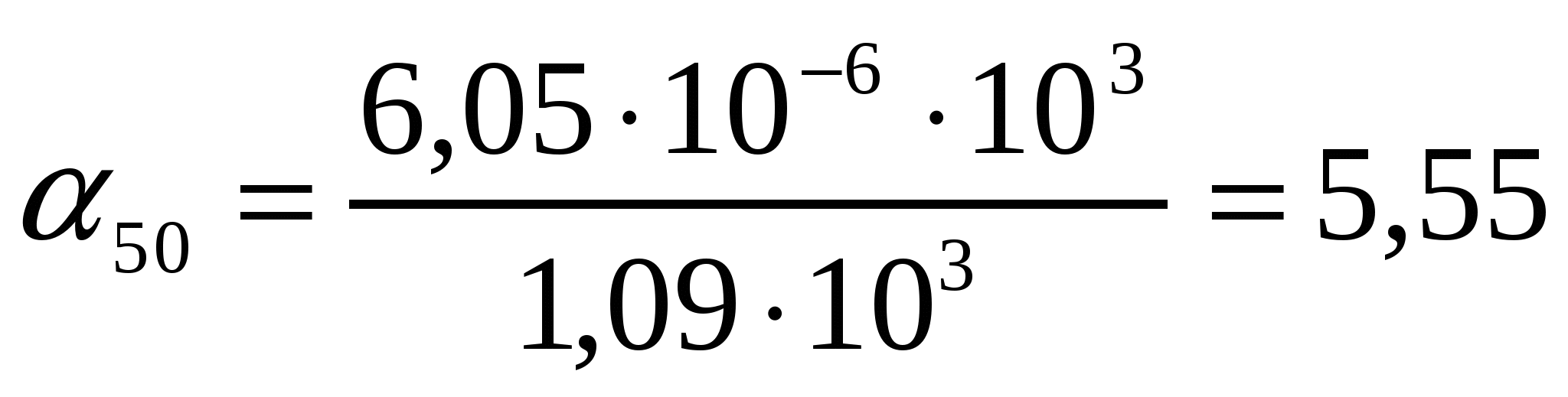 ,
,
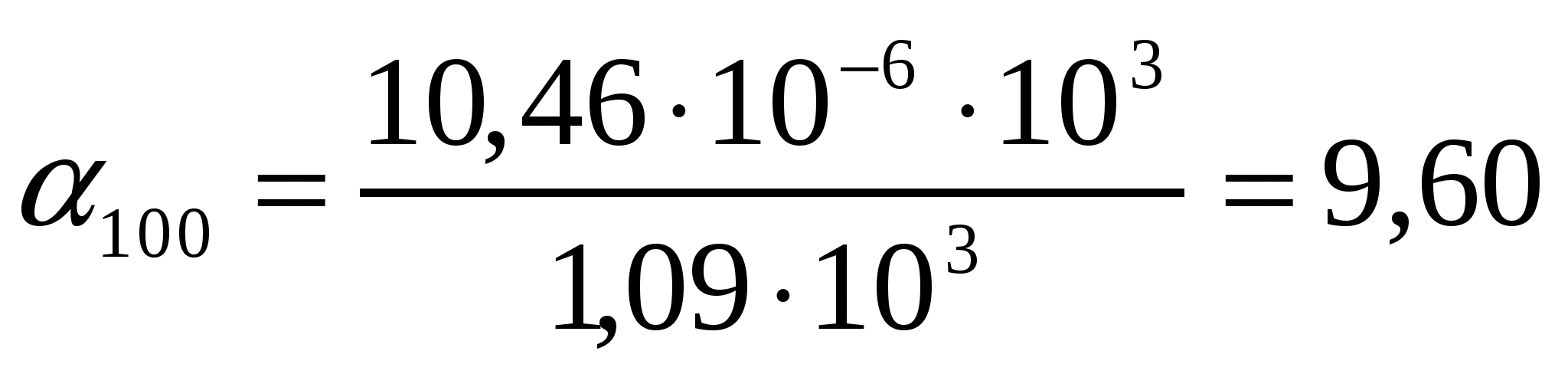 ,
,
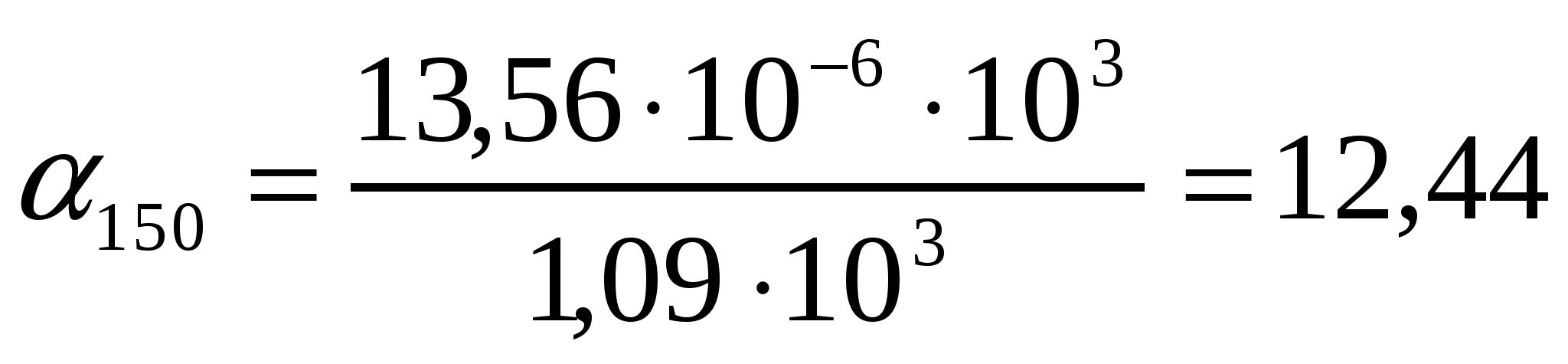 ,
,
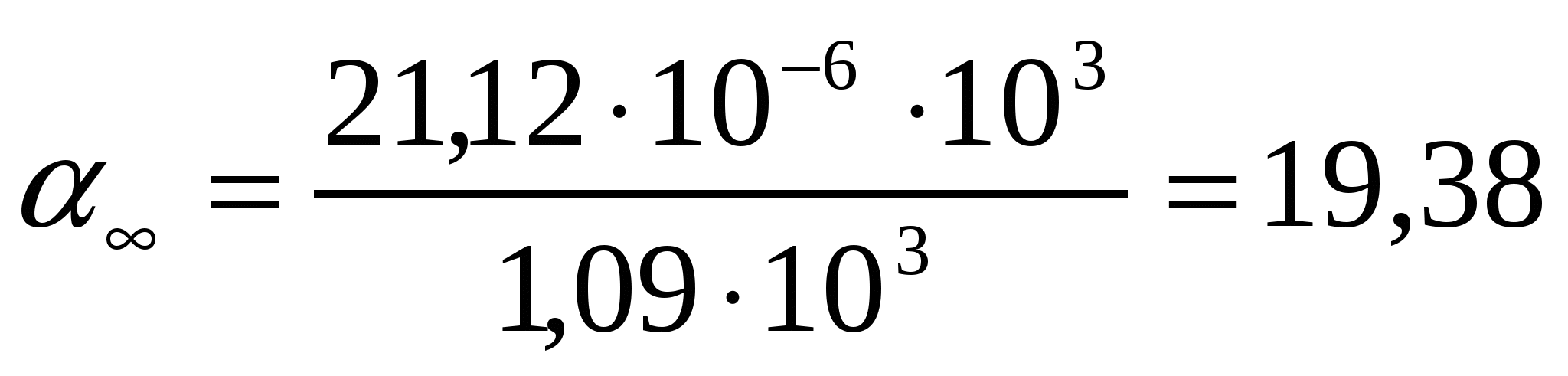 .
.
Ісіну жылдамдығының тұрақтылары:
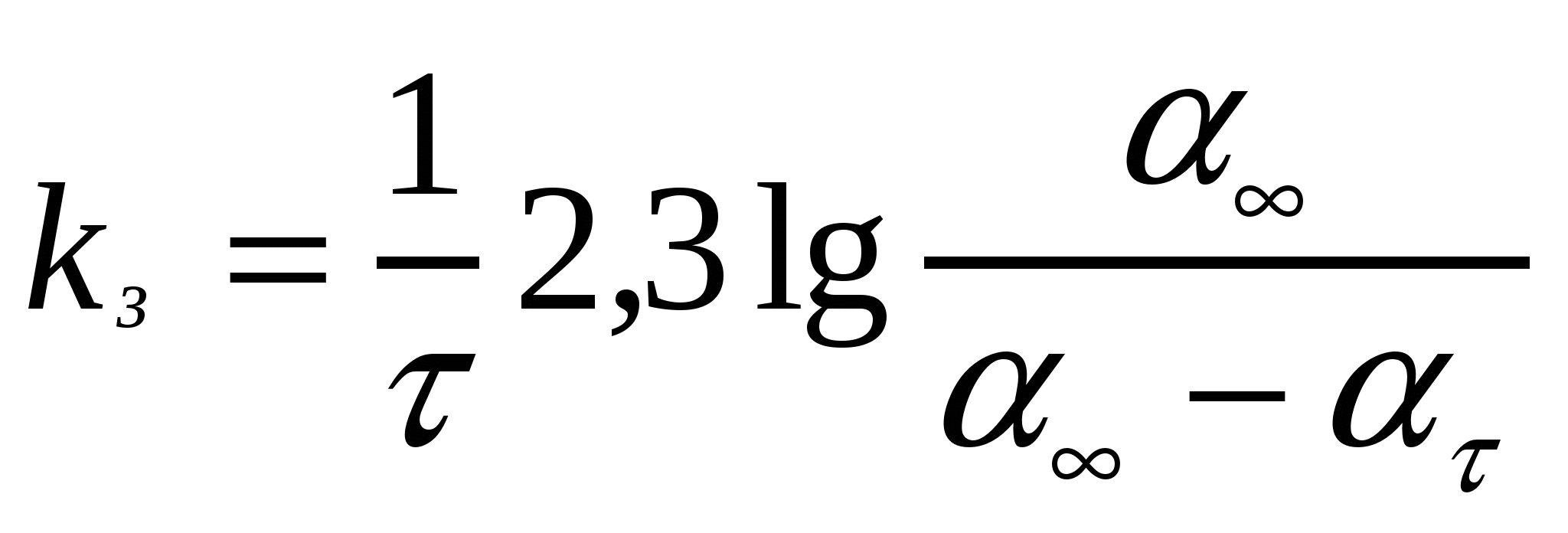 ;
;
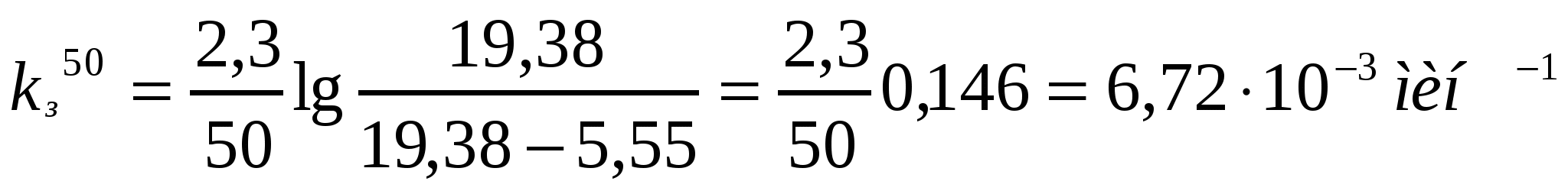 ;
;
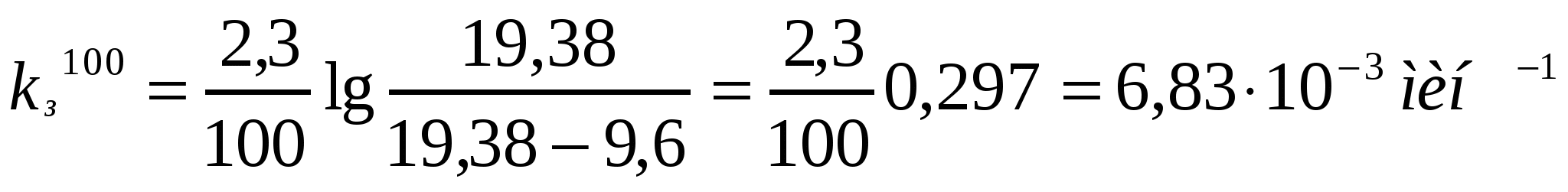 ;
;
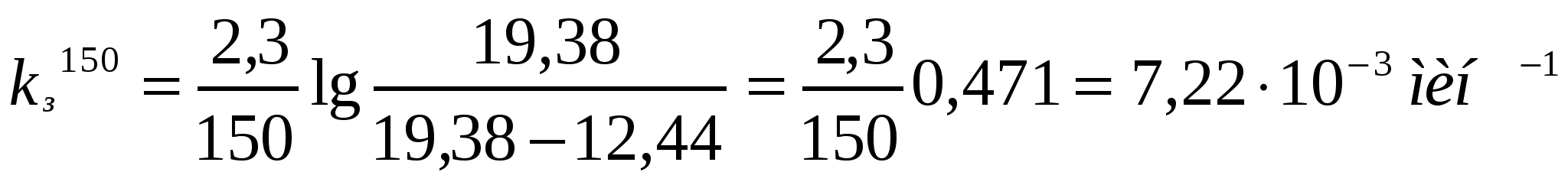 .
.
Ісіну жылдамдығы тұрақтысының орташа мәні:
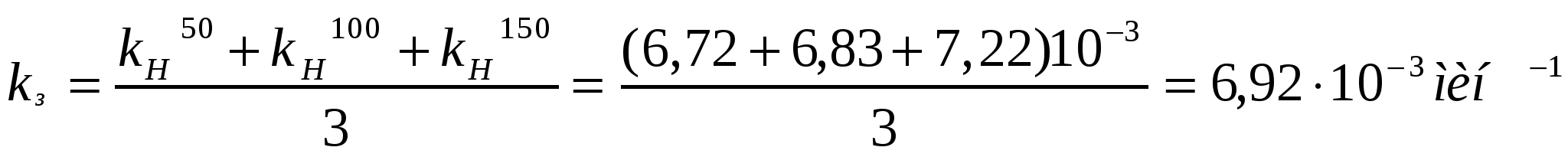 .
.
Әдебиет:
-
Зимон А.Д., Лещенко Н.Ф. Коллоидная химия. М.: Химия.1991
-
Гамеева О.С. Физическая и коллоидная химия. М.: "Высшая школа", 1969
-
Гельфман М. Коллоидная химия. С-Пб., Лань 2003
-
Марченко Р.Т. Физическая и коллоидная химия. М.: "Высшая школа",1967
-
Ребиндер П.А. Поверхностные явления в дисперсных системах. Коллоидная химия. Избранные труды. М.: Наука, 1978
-
Фридрихсберг Д.А. Курс коллоидной химии. Л.: Химия, 1984
-
Фролов Ю.Г. Курс коллоидной химии. Поверхностные явления и дисперсные системы. М.: Химия, 1988


