- Преподавателю
- Математика
- Научная работа по теме Применение математических методов в химии
Научная работа по теме Применение математических методов в химии
| Раздел | Математика |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Толстихина Н.С. |
| Дата | 16.01.2015 |
| Формат | docx |
| Изображения | Есть |
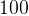
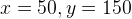
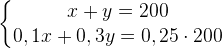
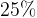
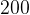
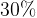
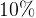
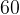
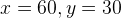
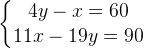
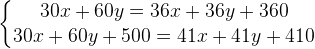
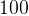
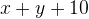
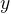
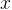
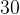
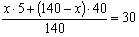
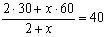
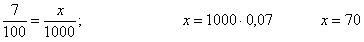
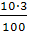
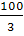
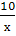
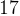
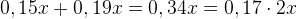
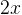
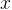
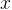
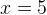
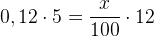
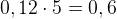
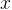
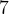
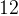
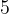
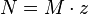
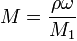
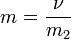
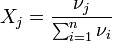
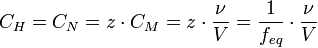
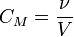
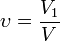
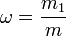
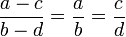
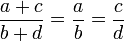
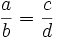
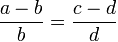
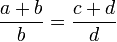
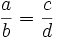
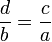
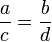
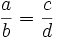
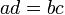
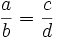
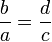
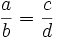
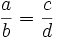
Научно - исследовательская работа по теме: «Применение математических методов в химии»
Содержание.
Введение…………………………………………………………………………. 3
1. Основные понятия математики и химии, применяемые в задачах на концентрацию……………………………………………………………………. 6
-
Основные понятия математики…………………………………………... 6
1.2. Основные понятия химии………………………………………………… 8
1.2.1.Понятие концентрации раствора…………………………………. 8
1.2.1.1. Массовая доля………………………………………………... 8
1.2.1.2. Объемная доля……………………………………………….. 9
1.2.1.3. Молярность (молярная объёмная концентрация)…………. 9
1.2.1.4. Нормальная концентрация (мольная концентрация эквивалента)…………………………………………………………… 9
1.2.1.5. Мольная (молярная) доля………………………………..… 10
1.2.1.6. Моляльность…………………………………………………10
1.2.1.7. Другие способы выражения концентрации растворов……11
1.2.1.8. Применимость способов выражения концентрации растворов, их свойства………………………………………………..11
1.2.1.9. Формулы перехода от одних выражений концентрации растворов к другим……………………………………………………11
1.2.2. Понятие раствора……………………………………………12
1.2.2.1. Твёрдые, жидкие, газообразные растворы…………………12
1.2.2.2. Истинные и коллоидные растворы…………………………13
1.2.2.3. Растворение…………………………………………………..13
1.2.2.4. Растворы электролитов и неэлектролитов…………………14
1.2.2.5. Растворы полимеров……………………………………… ..14
1.2.2.6. Концентрация растворов……………………………………14
1.2.3. Понятие смеси………………………………………………...…..16
1.2.4. Понятие сплава……………………………………………………16
1.2.4.1. Виды сплавов…………………………………………………16
1.2.4.2. Свойства сплавов……………………………………………..17
1.2.4.3. Сплавы, используемые в промышленности……………..…17
2. Исследовательское изучение различных задач на концентрацию………..18
2.1. Задачи на концентрацию растворов…………………………………….18
2.2. Задачи на смеси…………………………………………………………. 28
2.3. Задачи на сплавы…………………………………………………………32
Заключение……………………………………………………………………… 35
Список литературы………………………………………………………………36
Введение.
"Стремящийся к ближайшему изучению химии должен быть
сведущ в математике"
М.В.Ломоносов
В настоящее время, математика широко применяется в разных областях знаний, в том числе в химии. Существует даже такое понятие, как математическая химия. Возникает вопрос о изучении и исследовании математических методов и их возможности для применения в химической науке. Понятие «процента» вошло в нашу жизнь не только с уроками в средней школе и с проведением сложных научно-исследовательских работ, но и с выпечкой кулинарных изделий и приготовлением лакомств, солений и варений. Эта работа поможет систематизировать знания и умения по теме проценты, повысить свою математическую и алгоритмическую культуру, достичь уверенных навыков в решении стандартных задач по алгебре, освоить эвристические подходы к решению творческих задач, а также сформировать привычку поисковой активности, существенную отнюдь не только при занятиях математикой, но и в обыденной жизни.
Эта работа для тех, кто изучает математику, химию, кому завтра предстоят экзамены выпускные, кому в повседневной жизни приходится производить расчеты на определение концентрации раствора.
Химия сродни не только искусству, но и волшебству. Многие химические опыты, сопровождающиеся неожиданным изменением цвета, объема или агрегатного состояния, производят на непосвященных людей магическое впечатление. Химикам присущ уникальный, характерный только для них, взгляд на окружающий мир. Химики должны проявлять такие характеристики креативной личности, как быстрота, точность, оригинальность мышления, богатое воображение, самообладание, мобильность, инновационность и уверенность в себе. Креативный химик всегда «чувствует вещество». Это проявляется и в лаборатории, где создаются рецепты синтеза новых веществ, и в быту, где, например, бывает нужно подобрать подходящий клей или растворитель. Современные креативные химики при изучении химических процессов используют законы математики.
Для описания веществ и реакций используют теории, в которых роль математики настолько велика, что иногда трудно понять, где химия, а где математика. Отсюда следует, что и химия немыслима без математики.
Математика для химиков - это, в первую очередь, полезный инструмент решения многих химических задач. Очень трудно найти какой-либо раздел математики, который совсем не используется в химии. Функциональный анализ и теория групп широко применяются в квантовой химии, теория вероятностей составляет основу статистической термодинамики, теория графов используется в органической химии для предсказания свойств сложных органических молекул, дифференциальные уравнения - основной инструмент химической кинетики, методы топологии и дифференциальной геометрии применяются в химической термодинамике. Выражение «математическая химия» прочно вошло в лексикон химиков. Многие статьи в серьезных химических журналах не содержат ни одной химической формулы, зато изобилуют математическими уравнениями.
Не ставя своей целью охватить огромное количество вопросов темы «Применение математических методов в химии», которые достаточно подробно освещены в различных учебниках по высшей математике и химии, учебных пособиях, мы считаем необходимым остановиться на задачах на концентрацию растворов, сплавы и смеси.
Объектом нашего исследования являются различные задачи на концентрацию.
Предмет - математические методы, применяемые для решения этих задач.
Задачи научного исследования:
1. На основе анализа учебной и научно-популярной литературы по теме «Применение математических методов в химии» показать особенности различных видов химических задач.
2. Обосновать необходимость применения математических расчетов при решении таких задач.
3. Классифицировать основные виды задач.
4. Провести исследование разных видов задач и показать эффективность такого исследования.
Цель работы: определение содержания, видов, форм, методов исследования химических задач методами математики.
Практическая значимость научной работы: проведенные исследования могут быть использованы на уроках математики и химии.
Актуальность темы: В рамках общеобразовательной школы процентам уделяется несправедливо мало времени, а, следовательно, уровень знаний, необходимый для приобретения умений, навыков для свободного оперирования ими на уроках математики, химии, физики и просто в быту, оказывается недостаточным. Проценты изучаются на первом этапе основной школы, когда учащиеся в силу возрастных особенностей еще не могут получить полноценные представления о процентах, об их роли в повседневной жизни. На последующих этапах обучения повторного обращения к этой теме не предусматривается. Во многих школьных учебниках можно встретить задачи на проценты, однако в них отсутствует компактное и четкое изложение соответствующей теории вопроса. Текстовые задачи включены в материалы итоговой аттестации за курс основной школы, в КИМы и ЕГЭпо математике (задача В13) и химии (задача В9).
-
Основные понятия математики и химии, применяемые в задачах на концентрацию.
-
Основные понятия математики.
Проценты были известны индусам еще в V веке нашей эры. Это неудивительно потому , что в Индии счет велся с древних времен в десятичной системе счисления. В Европе проценты появились на 1000 лет позже, их ввел фламандский математик и инженер Симон Стевин. Он же в 1584 году впервые опубликовал таблицы процентов.
Вавилонцы использовали шестидесятичную систему счисления. Ростовщики начисляли рост денег, выданных в долг, с помощью шестидесятой части долга.
В связи с установлением десятичной системы исчисления, рост денег, выданных в долг, прибыль в торговле, сравнение частей целого предмета, вычисляли с помощью одной сотой части величины.
В учебниках XIII - XVI веков начали приводиться вычисления с помощью процентов. Слово "процент" появилось от латинского выражения "procentum", перевод которого обозначает "от ста" или "со ста".
В рукописях слово "procentum" сокращенно писали "cento" (сто), затем в сокращенном виде - "cto". В изданной в Париже в 1685 году книге об указаниях к коммерческой арифметике, наборщики вместо слова "cto" ошибочно набрали знак - %. После этой ошибки для обозначения процента стали использовать знак - %
Процент (лат. per cent - на сотню) - одна сотая доля. Обозначается знаком «%». Используется для обозначения доли чего-либо по отношению к целому.
Пропорция (лат. proportio - соразмерность, выравненность частей), равенство двух отношений, т. е. равенство вида a : b = c : d, или, в других обозначениях, равенство (часто читается как: «a относится к b так же, как c относится к d»). Если a : b = c : d, то a и d называют крайними, а b и c - средними членами пропорции.
В математике пропорция - это равенство двух отношений.
В IV веку до Н. Э. древнегреческий математик Евдокс, дал определение пропорции составленной из величин любой природы.
Древнегреческие математики с помощью пропорций решали задачи, которые в настоящее время решают с помощью уравнений, выполняли алгебраические преобразования, переходя от одной пропорции к другой.
Основные свойства пропорции.
Обращение пропорции. Если , то
Перемножение крайних членов пропорции со средними (крест-накрест). Если , то
Перестановка средних и крайних членов. Если , то
(перестановка средних членов пропорции),
(перестановка крайних членов пропорции).
Увеличение и уменьшение пропорции. Если , то
(увеличение пропорции),
(уменьшение пропорции).
Составление пропорции сложением и вычитанием. Если , то
(составление пропорции сложением),
(составление пропорции вычитанием).
-
Основные понятия химии.
-
Понятие концентрации раствора.
-
Концентрация - величина, характеризующая количественный состав раствора.
Согласно правилам ИЮПАК, концентрацией растворённого вещества (не раствора) называют отношение количества растворённого вещества или его массы к объёму раствора (моль/л, г/л), то есть это отношение неоднородных величин.
Те величины, которые являются отношением однотипных величин (отношение массы растворённого вещества к массе раствора, отношение объёма растворённого вещества к объёму раствора), правильно называть «долями». Однако на практике для обоих видов выражения состава применяют термин «концентрация» и говорят о концентрации растворов.
Существует много способов выражения концентрации растворов.
-
Массовая доля.
Массовая доля - отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в долях единицы или в процентах:
,
где:
m1 - масса растворённого вещества, г;
m - общая масса раствора, г .
Массовое процентное содержание компонента, m%
m%=(mi/Σmi)*100
В бинарных растворах часто существует однозначная (функциональная) зависимость между плотностью раствора и его концентрацией (при данной температуре). Это даёт возможность определять на практике концентрации важных растворов с помощью денсиметра (спиртометра, сахариметра, лактометра).
Некоторые ареометры проградуированы не в значениях плотности, а непосредственно концентрации раствора (спирта, жира в молоке, сахара). Следует учитывать, что для некоторых веществ кривая плотности раствора имеет максимум, в этом случае проводят два измерения: непосредственное, и при небольшом разбавлении раствора.
Часто для выражения концентрации (например, серной кислоты в электролите аккумуляторных батарей) пользуются просто их плотностью. Распространены ареометры (денсиметры, плотномеры), предназначенные для определения концентрации растворов веществ.
-
Объемная доля.
Объёмная доля - отношение объёма растворённого вещества к объёму раствора. Объёмная доля измеряется в долях единицы или в процентах.
,
где:
V1 - объём растворённого вещества, л;
V - общий объём раствора, л.
Как было указано выше, существуют ареометры, предназначенные для определения концентрации растворов определённых веществ. Такие ареометры проградуированы не в значениях плотности, а непосредственно концентрации раствора. Для распространённых растворов этилового спирта, концентрация которых обычно выражается в объёмных процентах, такие ареометры получили название спиртомеров или андрометров.
-
Молярность (молярная объёмная концентрация).
Молярная концентрация - количество растворённого вещества (число молей) в единице объёма раствора. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л. Также распространено выражение в «молярности». Возможно другое обозначение молярной концентрации , которое принято обозначать М. Так, раствор с концентрацией 0,5 моль/л называют 0,5-молярным.
Примечание: единица «моль» не склоняется по падежам. После цифры пишут «моль», подобно тому, как после цифры пишут «см», «кг» и т. п.
,
где:
ν - количество растворённого вещества, моль;
V - общий объём раствора, л.
-
Нормальная концентрация (мольная концентрация эквивалента).
Нормальная концентрация - количество эквивалентов данного вещества в 1 литре раствора. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов). Для записи концентрации таких растворов используют сокращения «н» или «N». Например, раствор, содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н.
,
где:
ν - количество растворённого вещества, моль;
V - общий объём раствора, литров;
z - число эквивалентности (фактор эквивалентности ).
Нормальная концентрация может отличаться в зависимости от реакции, в которой участвует вещество. Например, одномолярный раствор H2SO4 будет однонормальным, если он предназначается для реакции со щёлочью с образованием гидросульфата калия KHSO4, и двухнормальным в реакции с образованием K2SO4.
-
Мольная (молярная) доля.
Мольная доля - отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы.
,
где:
νi - количество i-го компонента, моль;
n - число компонентов;
-
Моляльность.
Моляльность - количество растворённого вещества (число моль) в 1000 г растворителя. Измеряется в молях на кг, также распространено выражение в «моляльности». Так, раствор с концентрацией 0,5 моль/кг называют 0,5-мольным.
,
где:
ν - количество растворённого вещества, моль;
m2 - масса растворителя, кг.
Следует обратить особое внимание, что, несмотря на сходство названий, молярная концентрация и моляльность - величины различные. Прежде всего, в отличие от молярной концентрации, при выражении концентрации в моляльности расчёт ведут на массу растворителя, а не на объём раствора. Моляльность, в отличие от молярной концентрации, не зависит от температуры.
-
Другие способы выражения концентрации растворов.
Существуют и другие, распространённые в определённых областях знаний или технологиях, методы выражения концентрации. Например, в фотометрии часто используют массовую концентрацию, равную массе растворённого вещества в 1 л раствора. При приготовлении растворов кислот часто указывают, сколько объёмных частей воды приходится на одну объёмную часть концентрированной кислоты (например, 1:3). Концентрация загрязнений в воздухе может выражаться в частях на миллион (ppm - от англ. partspermillion). Иногда используют также отношение масс (отношение массы растворённого вещества к массе растворителя) и отношение объёмов (аналогично, отношение объёма растворяемого вещества к объёму растворителя).
-
Применимость способов выражения концентрации растворов, их свойства.
В связи с тем, что моляльность, массовая доля, мольная доля не включают в себя значения объёмов, концентрация таких растворов остаётся неизменной при изменении температуры. Молярность, объёмная доля, титр, нормальность изменяются при изменении температуры, так как при этом изменяется плотность растворов. Именно моляльность используется в формулах повышения температуры кипения и понижения температуры замерзания растворов.
Разные виды выражения концентрации растворов применяются в разных сферах деятельности, в соответствии с удобством применения и приготовления растворов заданных концентраций. Так, титр раствора удобен в аналитической химии для волюмометрии (титриметрического анализа) и т. п.
-
Формулы перехода от одних выражений концентрации растворов к другим.
От массовой доли к молярности:
,
где:
ρ - плотность раствора, г/л;
ω - массовая доля растворенного вещества в долях от 1;
M1 - молярная масса растворенного вещества, г/моль.
От молярности к нормальности:
,
где:
M - молярность, моль/л;
z - число эквивалентности.
-
Понятие раствора.
Раствор - гомогенная (однородная) смесь, состоящая из частиц растворённого вещества, растворителя и продуктов их взаимодействия. "Гомогенный" - значит, каждый из компонентов распределён в массе другого в виде своих частиц, то есть атомов, молекул или ионов.
Раствор - однофазная система переменного, или гетерогенного, состава, состоящая из двух или более компонентов.
Растворитель - компонент, агрегатное состояние которого не изменяется при образовании раствора. В случае же растворов, образующихся при смешении газа с газом, жидкости с жидкостью, твёрдого вещества с твёрдым, растворителем считается компонент, количество которого в растворе преобладает.
Образование того или иного типа раствора обусловливается интенсивностью межмолекулярного, межатомного, межионного или другого вида взаимодействия, то есть, теми же силами, которые определяют возникновение того или иного агрегатного состояния. Отличия: образование раствора зависит от характера и интенсивности взаимодействия частиц разных веществ.
По сравнению с индивидуальными веществами по структуре растворы сложнее.
Растворы бывают газовыми, жидкими и твёрдыми.
-
Твёрдые, жидкие, газообразные растворы.
Чаще под раствором подразумевается жидкое вещество, например раствор соли или спирта в воде (или даже раствор золота в ртути - амальгама).
Существуют также растворы газов в жидкостях, газов в газах и жидкостей в жидкостях, в последнем случае растворителем считается вода, или же компонент, которого больше.
В химической практике обычно под растворами понимают гомогенные системы, растворитель может быть жидким, твёрдым (твёрдый раствор), газообразным. Однако нередко допускается и микрогетерогенность - см. «Золи».
«Раствором» именуют и смесь цемента с водой, песком и так далее. Хотя это и не является раствором в химическом смысле этого слова.
-
Истинные и коллоидные растворы.
Коллоидные и истинные растворы (изучением коллоидных систем занимается коллоидная химия) отличаются главным образом размерами частиц.
В истинных растворах размер частиц менее 1•10−9 м, частицы в таких растворах невозможно обнаружить оптическими методами; в то время как в коллоидных растворах размер частиц 1•10−9 м - 5•10−7 м, частицы в таких растворах можно обнаружить при помощи ультрамикроскопа (эффект Тиндаля).
-
Растворение.
Растворение - переход молекул вещества из одной фазы в другую (раствор, растворенное состояние). Происходит в результате взаимодействия атомов (молекул) растворителя и растворённого вещества и сопровождается увеличением энтропии при растворении твёрдых веществ и её уменьшением при растворении газов. При растворении межфазная граница исчезает, при этом многие физические свойства раствора (например, плотность, вязкость, иногда - цвет, и другие) меняются.
В случае химического взаимодействия растворителя и растворённого вещества сильно меняются и химические свойства - например, при растворении газа хлороводорода в воде образуется жидкая соляная кислота.
Растворы образуются при взаимодействии растворителя и растворённого вещества. Процесс взаимодействия растворителя и растворённого вещества называется сольватацией (если растворителем является вода - гидратацией).
Растворение протекает с образованием различных по форме и прочности продуктов - гидратов. При этом участвуют силы как физической, так и химической природы. Процесс растворения вследствие такого рода взаимодействий компонентов сопровождается различными тепловыми явлениями.
Энергетической характеристикой растворения является теплота образования раствора, рассматриваемая как алгебраическая сумма тепловых эффектов всех эндо- и экзотермических стадий процесса. Наиболее значительными среди них являются:
- поглощающие тепло процессы - разрушение кристаллической решётки, разрывы химических связей в молекулах;
- выделяющие тепло процессы - образование продуктов взаимодействия растворённого вещества с растворителем (гидраты) и др.
Если энергия разрушения кристаллической решетки меньше энергии гидратации растворённого вещества, то растворение идёт с выделением теплоты (наблюдается разогревание). Так, растворение NaOH - экзотермический процесс: на разрушение кристаллической решётки тратится 884 кДж/моль, а при образовании гидратированных ионов Na+ и OH-выделяется соответственно 422 и 510 кДж/моль.
Если энергия кристаллической решётки больше энергии гидратации, то растворение протекает с поглощением теплоты (при приготовлении водного раствора NH4NO3 наблюдается понижение температуры).
-
Растворы электролитов и неэлектролитов.
Электролиты - вещества, проводящие в расплавах или водных растворах электрический ток. В расплавах или водных растворах они диссоциируют на ионы. Неэлектролиты - вещества, водные растворы и расплавы которых не проводят электрический ток, так как их молекулы не диссоциируют на ионы. Электролиты при растворении в подходящих растворителях (вода, другие полярные растворители) диссоциируют на ионы. Сильное физико-химическое взаимодействие при растворении приводит к сильному изменению свойств раствора (химическая теория растворов).
Вещества, которые в тех же условиях на ионы не распадаются и электрический ток не проводят, называются неэлектролитами.
К электролитам относятся кислоты, основания и почти все соли, к неэлектролитам - большинство органических соединений, а также вещества, в молекулах которых имеются только ковалентные неполярные или малополярные связи.
-
Растворы полимеров.
Растворы высокомолекулярных веществ ВМС - белков, углеводов и др. обладают одновременно многими свойствами истинных и коллоидных растворов.
-
Концентрация растворов
В зависимости от цели для описания концентрации растворов используются разные физические величины.
Ненасыщенный раствор - раствор, в котором концентрация растворенного вещества меньше, чем в насыщенном растворе, и в котором при данных условиях можно растворить еще некоторое его количество.Поместив в 100 г воды при 200C меньше 36 г NaCl мы получим ненасыщенный раствор.
Насыщенный раствор - раствор, в котором растворённое вещество при данных условиях достигло максимальной концентрации и больше не растворяется. Осадок данного вещества находится в равновесном состоянии с веществом в растворе.(Например, если поместить 50 г NaCl в 100 г H2O, то при 200C растворится только 36 г соли).
Пересыщенный раствор - раствор, содержащий при данных условиях больше растворённого вещества, чем в насыщенном растворе, избыток вещества легко выпадает в осадок. Обычно пересыщенный раствор получают охлаждением раствора, насыщенного при более высокой температуре (пересыщение).При нагревании смеси соли с водой до 1000C произойдёт растворение 39,8 г NaCl в 100 г воды. Если теперь удалить из раствора нерастворившуюся соль, а раствор осторожно охладить до 200C, избыточное количество соли не всегда выпадает в осадок. В этом случае мы имеем дело с перенасыщенным раствором. Перенасыщенные растворы очень неустойчивы. Помешивание, встряхивание, добавление крупинок соли может вызвать кристаллизацию избытка соли и переход в насыщенное устойчивое состояние.
Концентрированный раствор - раствор с высоким содержанием растворённого вещества в противоположность разбавленному раствору, содержащему малое количество растворённого вещества. Деление растворов на концентрированные и разбавленные не связано с делением на насыщенные и ненасыщеные. Так насыщенный 0,0000134М раствор хлорида серебра является очень разбавленным, а 4М раствор бромида калия, будучи очень концентрированным, не является насыщенным.
Разбавленный раствор - раствор с низким содержанием растворённого вещества. Отметим, что не всегда разбавленный раствор является ненасыщенным - например, насыщенный 0,0000134М раствор практически нерастворимого хлорида серебра является очень разбавленным. Граница между разбавленным и концентрированным растворами весьма условна.
-
Понятие смеси.
Смесь (химия) - продукт смешения, механического соединения каких-либо веществ, характеризующаяся содержанием примесей выше определенного предела. Например: горючая смесь, гелиево-кислородная смесь.
Смесь - случайная, беспорядочная, лишенная стройности, единства совокупность чего-либо разнородного, собранного вместе. Синонимы: «смешение», «мешанина», «месиво», «микстура», «микс».
-
Понятие сплава.
Сплав - макроскопически однородный металлический материал, состоящий из смеси двух или большего числа химических элементов с преобладанием металлических компонентов.
Сплавы состоят из основы (одного или нескольких металлов), малых добавок специально вводимых в сплав легирующих и модифицирующих элементов, а также из не удаленных примесей (природных, технологических и случайных).
Сплавы являются одним из основных конструкционных материалов. Среди них наибольшее значение имеют сплавы на основе железа и алюминия. В технике применяется более 5 тыс. сплавов.
-
Виды сплавов.
По способу изготовления сплавов различают литые и порошковые сплавы. Литые сплавы получают кристаллизацией расплава смешанных компонентов. Порошковые - прессованием смеси порошков с последующим спеканием при высокой температуре. Компонентами порошкового сплава могут быть не только порошки простых веществ, но и порошки химических соединений. Например, основными компонентами твёрдых сплавов являются карбиды вольфрама или титана.
По способу получения заготовки (изделия) различают литейные (например, чугуны, силумины), деформируемые (например, стали) и порошковые сплавы.
В твердом агрегатном состоянии сплав может быть гомогенным (однородным, однофазным - состоит из кристаллитов одного типа) и гетерогенным (неоднородным, многофазным).Твёрдый раствор является основой сплава (матричная фаза). Фазовый состав гетерогенного сплава зависит от его химического состава. В сплаве могут присутствовать:твердые растворы внедрения, твердые растворы замещения, химических соединений (в том числе карбиды, нитриды, интерметаллиды) и кристаллиты простых веществ.
-
Свойства сплавов.
Свойства металлов и сплавов полностью определяются их структурой (кристаллической структурой фаз и микроструктурой). Макроскопические свойства сплавов определяются микроструктурой и всегда отличаются от свойств их фаз, которые зависят только от кристаллической структуры. Макроскопическая однородность многофазных (гетерогенных) сплавов достигается за счёт равномерного распределения фаз в металлической матрице. Сплавы проявляют металлические свойства, например: электропроводность и теплопроводность, отражательную способность (металлический блеск) и пластичность. Важнейшей характеристикой сплавов является свариваемость.
-
Сплавы, используемые в промышлености.
Сплавы различают по назначению: конструкционные, инструментальные и специальные.
Конструкционные сплавы: стали, чугуны, дюралюминий.
Конструкционные со специальными свойствами (например, искробезопасность, антифрикционные свойства): бронзы, латуни.
Для заливки подшипников: баббит.
Для измерительной и электронагревательной аппаратуры: манганин, нихром.
Для изготовления режущих инструментов: победит.
В промышленности также используются жаропрочные, легкоплавкие и коррозионностойкие сплавы,
термоэлектрические и магнитные материалы, а также аморфные сплавы.
-
Исследовательское изучение различных задач на концентрацию.
2.1. Задачи на концентрацию растворов.
Как рассчитать концентрацию вещества
Концентрация раствора - это величина, показывающая, какая масса того или иного вещества содержится в определенном объеме или массе раствора. Даже самый далекий от химии человек сталкивается с этим понятием буквально на каждом шагу: например, покупая в магазине 9% уксус для домашнего консервирования, или 20% сливки, чтобы добавлять их в кофе. Как же вычисляется концентрация раствора?
Инструкция:
-
Предположим, в количестве 200 или 300 миллилитрах воды растворили 58,5 граммов хлористого натрия, то есть хорошо знакомой всем поваренной соли. Потом, приливая воду, довели общую массу раствора до одного килограмма. Несложно догадаться, что раствор в этом случае будет содержать 58,5 граммов соли и 941,5 граммов воды. Какова будет массовая доля соли?
-
Вычислить это проще простого, для этого количество соли разделите на общую массу раствора и умножьте на 100%, это будет выглядеть следующим образом:
(58,5/1000) * 100% = 5,85%.
-
Сформулируйте задачу немного по-другому. Такое же количество соли растворили в воде, потом довели объем раствора до одного литра. Какова будет молярная концентрация раствора?
-
Вспомните само определение молярной концентрации. Это - количество молей растворенного вещества, содержащееся в одном литре раствора. А чему равен моль поваренной соли? Ее формула - NaCl, молярная масса - примерно 58,5. Иными словами, в одном литре раствора у вас содержится ровно один моль соли. Вы получите 1,0 молярный раствор.
-
Ну, а теперь вернитесь к первоначальным условиям задачи - там, где общий вес раствора составил ровно один килограмм. Как вам найти моляльность такого раствора?
-
Выше вы уже вычислили, что на 58,5 граммов поваренной соли приходится 941, 5 граммов воды. Подставляя известные величины в формулу m = v/M, где m - значение моляльности, v - количество молей вещества в растворе, а M - масса растворителя в килограммах, получите:
1,0/0,9415 = 1,062 моляльный раствор.
Полезные советы:
Концентрацию можно выразить самыми разными способами. Например, с использованием понятий: «массовая доля», «молярность» (то есть, сколько молей вещества находится в 1 литре раствора), «моляльность» (то есть, какое количество молей вещества находится в 1 килограмме растворителя) и т.д.
Алгоритм:
-
Массовая доля - это отношение массы вещества к массе раствора или смеси: w = m(в)/m(р-ра), где w - массовая доля, m(в) - масса вещества, m(р-ра) - масса раствора, или w = m(в)/m(см), где m(см) - масса смеси. Выражается в долях единицы или процентах.
Дополнительные формулы, которые могут понадобиться для решения задач на массовую долю вещества:
1)m = V*p, где m - масса, V - объем, p - плотность.
2)m = n*M, где m - масса, n - количество вещества, M -молярная масса. -
Мольная доля - это отношение числа молей вещества к числу молей всех веществ: q = n(в)/n(общ), где q - мольная доля, n(в) - количество определенного вещества, n(общ) - общее количество веществ.
Дополнительные формулы:
1)n = V/Vm, где n - количество вещества, V - объем, Vm - молярный объем(при нормальных условиях равен 22,4 л/моль).
2)n = N/Na, где n -количество вещества, N - число молекул, Na - постоянная Авогадро(является константой и равна 6,02*10 в 23 степени 1/моль). -
Объемная доля - это отношение объема вещества к объему смеси: q = V(в)/V(см), где q - объемная доля, V(в) - объем вещества, V(см) - объем смеси.
-
Молярная концентрация - отношение количества данного вещества к объему смеси: Cm = n(в)/V(см), где Cm - молярная концентрация(моль/л), n - количество вещества(моль), V(см) - объем смеси(л). Решим задачу на молярную концентрацию. Определите молярную концентрацию раствора, полученного при растворении сульфата натрия массой 42,6 г в воде массой 300 г, если плотность полученного раствора равна 1,12 г/мл. Пишем формулу для вычисления молярной концентрации: Cm = n(Na2SO4)/V(см). Видим, что необходимо найти количество вещества натрия и объем раствора.
Рассчитываем: n(Na2SO4) = m(Na2SO4)/M(Na2SO4).
M(Na2SO4) = 23*2+32+16*4 = 142 г/моль.
n(Na2SO4) = 42,6/142 = 0,3 моль.
Ищем объем раствора: V = m/p
m = m(Na2SO4) + m(H2O) = 42,6 + 300 = 342,6 г.
V = 342,6/1,12 = 306 мл = 0,306 л.
Подставляем в общую формулу: Cm = 0,3/0,306 = 0,98 моль/л. Задача решена.
Основные допущения, которые принимаются в задачах подобного рода, состоят в следующем:
а) все получающиеся сплавы или смеси однородны;
б) при слиянии двух растворов, имеющих объемы V1 и V2, получается смесь, объем которой равен V1+V2, т.е. V0 =V1+V2.
Заметим, что такое допущение не представляет собой закон физики и не всегда выполняется в действительности. На самом деле при слиянии двух растворов не объем, а масса или вес смеси равняется сумме масс или весов составляющих ее компонент.
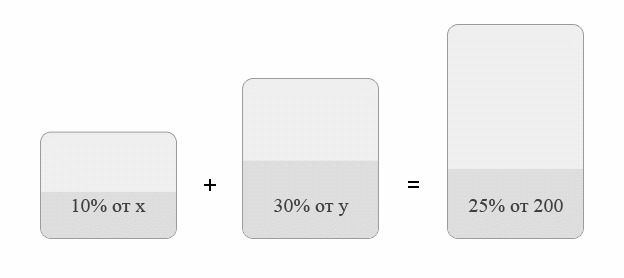
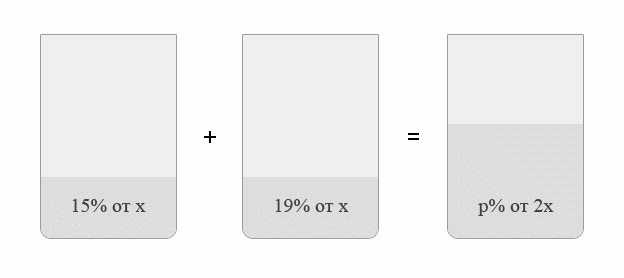
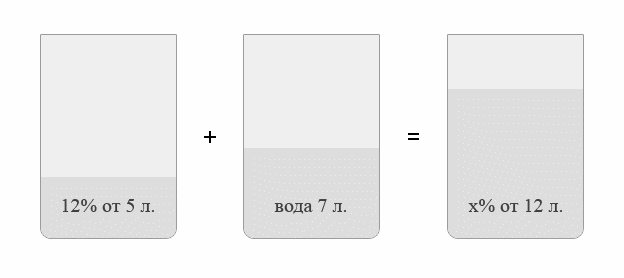
Задача №1.В сосуд, содержащий литров -процентного водного раствора некоторого вещества, добавили литров воды. Сколько процентов составляет концентрация получившегося раствора?
Решение: В решении подобных задач помогает картинка. Изобразим сосуд с раствором схематично - так, как будто вещество и вода в нем не перемешаны между собой, а отделены друг от друга, как в коктейле. И подпишем, сколько литров содержат сосуды и сколько в них процентов вещества. Концентрацию получившегося раствора обозначим .
Первый сосуд содержал литра вещества. Во втором сосуде была только вода. Значит, в третьем сосуде столько же литров вещества, сколько и в первом:
.
Задача № 2. Смешали некоторое количество -процентного раствора некоторого вещества с таким же количеством -процентного раствора этого вещества. Сколько процентов составляет концентрация получившегося раствора?
Решение: Пусть масса первого раствора равна . Масса второго - тоже . В результате получили раствор массой . Рисуем картинку.
Получаем:
Ответ: .
Задача № 3. К 60 г. соли добавили 100 г. воды. Определите содержание соли в растворе (содержимость соли в %).
Решение:
- найдем массу всего раствора: 60+100=160 (г)
- отсюда находим содержание соли в %: 150 г. -100%
60 г. - х
х=60*100/150=40%
Ответ: в растворе 40% соли.
Задача № 4.К 200г. 20% раствору соли добавили 60г. соли. Найдите концентрацию раствора.
Решение:
1)Находим массу соли в первом растворе:
200г. - 100%
х - 20% х= 200*20/100 = 40г. соли
2) Найдем массу соли во всем растворе 40+60=100г.
3) Найдем массу нового раствора: 200+60=260г.
4) Найдем % концентрацию соли в конечном растворе: 260 - 100%
100 - у
у=100*100/260=38,46%
Ответ: в новом растворе содержимость соли будет 38,46%.
Покажем как решаются такие задачи на уроках химии.
Задача № 5. Двухдневное вымачивание семян свеклы в растворе бромида калия с массовой долей КВr 0,3% повышает урожайность свеклы. Вычислите массы КВr и воды, необходимые для приготовления такого раствора. Решение
1. Определим массу КВr в исходном растворе, исходя из определения «процентной концентрации»: 0,3% раствор КВr означает, что
0,3г КВr содержится в 100г раствора КВr ; m Н2О = m раствора. - mв-ва m Н2О = 100-0,3=99,7г
Ответ: m КВr = 0,3г ; m Н2О = 99,7г
Задача № 6. При выпаривании 500 г 10% раствора сульфата лития получили раствор массой 200г Какова процентная концентрация полученного раствора?
Решение:
1. Определим массу Li2CO3 в исходном растворе
w1(Li2CO3))=m(Li2CO3))/m(р-ра); m(Li2CO3))=w(Li2CO3))·m1(р-ра)
m(Li2CO3))=0,1·500г=50г
2. Определим процентную концентрацию полученного раствора (масса Li2CO3 при выпаривании не изменилась)
w2(Li2CO3))=m(Li2CO3))/m(р-ра);
w2(Li2CO3))=50г/200г=0,25 или 25%;
Ответ: w2(Li2CO3)= 25%
Задача № 7. Вычислите массовую долю (%) хлорида калия в растворе, полученном при смешивании 250 г10% и 750 г 35% растворов.
Решение:
Составляем уравнение :
250 • 10 +750 • 35 = (250+750) • ω3
28750=1000 • ω3
ω3 = 28,8%
Ответ: ω3 = 28,8%
Задача № 8. Определите массы 10%-ного и 50%-ного (по массе) растворов, необходимые для получения 200 г 20%-ного раствора.
ω1 = 10%, ω2 = 50%, ω3= 20%, m3 = 200 г, m2 = 200 - m1
Решение:
Составляем уравнение :
m1• 10 + (200 - m1) • 50 = 200 • 20
40 • m1 = 6000
m1 = 150 (г),
m2 = 200 - m1 = 200 - 150 = 50 (г)
Ответ: 150 г, 50 г.
Задача № 9. Определите массы 25%-ного (по массе) раствора и воды, необходимые для получения 200 г 10%-ного раствора.
Решение:
ω1 = 25%, ω2 = 0%, ω3= 10%, m3 = 200 г
Составляем уравнение:
m1• 25 + m2 • 0 = 200 • 10
25 • m1 = 2000
m1 = 80 (г),
m2 = 200 - m1 = 200 - 80 =120 (г)
Ответ: 80 г, 120 г.
Задача № 10: В аптеке требовалось приготовить 1 кг нашатырного спирта (10% раствор аммиака) путем разбавления 25% раствора аммиака дистиллированной водой. В каком массовом отношении следует смешать 25% раствор и воду?
Решение:
Дано:
m 3(р-раNН3) = 1 кг W3 (NН3) = 10% (0,1)
W1 (NН3) = 25% (0,25) W2 (NН3) = 0 ___________________
m1 : m2 ?
Поскольку разбавление 25% раствора аммиака ведется дистиллированной водой, то очевидно, что ω аммиака в ней равна 0.
Запишем формулу правила смещения и подставим в нее соответствующие величины:
m1 : m2 = (W3 - W2) : (W1 - W3);
m1 : m2 = (0,1 - 0) : (0,25- 0,1) = 0,1:0,15 =2:3
Ответ. Чтобы приготовить 1кг 10% раствора аммиака следует смешать две части 25% раствора аммиака с тремя частями воды.
Задача № 11.Смешали 30%-ный раствор серной кислоты с 10%-ным и получили 600 г 15%-ного раствора. Сколько граммов каждого раствора было взято?
Решение:Пусть взяли х г первого раствора, тогда второго раствора (600-х) г. Составим таблицу:
Состояние смеси (сплава)
Масса смеси (сплава) (г)
Концентрация вещества(%)
Масса вещества (г)
1
х
30%
0,3х
2
600-х
10%
0,1(600-х)
Итоговое состояние
600
15%
90
Составим и решим уравнение:0,3х+0,1(600-х)=90
Произведя преобразования, в результате получим:х=150(г),600-х=450(г).
Эту задачу можно было решить с помощью системы уравнений, обозначив за х - массу первого раствора, за у- массу второго раствора.
Задача № 12. Из сосуда, наполненного кислотой, вылили несколько литров и долили водой; потом опять вылили столько же литров смеси, тогда в сосуде осталось 24л чистой кислоты. Емкость сосуда 54л. Сколько кислоты вылили в первый и второй раз?
Решение:
Пусть в первый раз вылили х литров кислоты. Тогда в сосуде осталось 54-х литров кислоты. Во второй раз вылили х литров раствора кислоты концентрации
100(54-х)/54%., то есть в этом растворе было х(54-х)/54 чистой кислоты. То есть
х+х =54-24
54х +54х-х2 =54 30
х2 - 108х + 1620 = 0
х1=90-не удовлетворяет условию задачи
х2= 18
Ответ: в первый раз вылили 18л кислоты, во второй раз - 12л.
Задача № 13. В домашней аптечке всегда есть 3% раствор зеленки. Сколько красителя бриллиантовой зелени надо растворить в спирте, чтобы получить 10г раствора зеленки?
Решение: Понятно, 10 г раствора- это спирт и бриллиантовая зелень вместе. Для решения задачи составим соотношение. За Х г обозначим массу красителя бриллиантовой зелени.
10г− 100%
Х г − 3%, составим и решим пропорцию
=, х=; х=0,3. Значит, в 10г 3% раствора зеленки содержится 0,3г бриллиантовой зелени. А сколько спирта в этом растворе? 10-0,3=9,7(г)
Задача № 14. В 200г раствора для лечения фурункулов содержится 80 г спирта. Найдите процентное содержание спирта в этом растворе. Обозначим за Х % процентное содержание спирта.
Решение: 200г − 100% ;
80г − Х%; Х= (80 ∙ 100) : 200=40%.
Задача № 15. В водный раствор спирта добавили 100 граммов воды. В результате концентрация спирта понизилась на один процент. Определите первоначальную массу раствора, если известно, что в нем содержалось 30 г спирта.
Решение: Обозначим первоначальную массу раствора Х г. Определим концентрацию этого раствора.
Х г ---- 100%; 30 г-------А%. А% = 30∙100: Х.
После того, как добавили 100 г воды, масса раствора стала (х+100)г, спирта в этом растворе по прежнему 30г, найдем концентрацию нового раствора
(Х+100)г------100%; 30г -----В%; В%= 3000 : (Х+100), зная, что В на 1% меньше, чем А, составим и решим уравнение: (3000:х) - 3000:(х+100)=1. Вот у нас и получилось рациональное уравнение, решив которое, мы узнаем ответ на вопрос задачи.
Ответ 500г.
Задача № 16. Два раствора, из которых первый содержал 800 г спирта, а второй 600 г спирта, соединили вместе и получили 10 кг нового раствора спирта.. Определите массу первого и второго растворов, входящих в смесь, если известно, что процент содержания спирта в первом растворе на 10 больше, чем процент содержания спирта во втором растворе.
Решение:
1. Выражаем массу в одних единицах. Данные внесем в таблицу
Раствор
Масса
Масса спирта
Концентрация
1раствор
Х кг
0,8кг
(0,8∙100:х)%= 80:х
2 раствор
(10-х) кг
0,6кг
(0,6∙100:(10-х))% =60: (10-х)
Зная, что концентрация первого раствора на 10% больше составим и решим уравнение (80:х) - (60: (10-х)) =10. Решив уравнение, получим 2 корня, х=20 и х=4, по условию Х<10, значит, масса первого раствора равна 4кг, а второго− 6кг.
Задача № 17 Найдите концентрацию всего раствора, если к 200(г) 40% раствору добавили 300(г) 50% раствора этого вещества.
Решение: (удобно решать алгебраическим способом).
1. Найдем массу соли в каждом растворе:
I раствор - 200(г) - 40% -- 200*0,40=80(г) соли .
II раствор - 300(г) - 50% - 300*0,50=150(г) соли.
Смесь: 500(г) - ? -
2. Найдем концентрацию всего раствора:
500(г) - 100%
230(г) - х-?
х=230*100:500=46% - соли содержится в новом растворе Ответ: 46%
Задача №18. Для засола огурцов используют 7% водный раствор поваренной соли (хлорида натрия NaCl). Именно такой раствор в достаточной мере подавляет жизнедеятельность болезнетворных микроорганизмов и плесневого грибка, и в то же время не препятствует процессам молочнокислого брожения. Рассчитайте массу соли и массу воды для приготовления 1 кг такого раствора.
Решение:
Задача № 19. При смешивании 2кг 30%-го раствора щелочи с некоторым количеством 60%-го раствора щелочи получился 40%-й раствор щелочи. Какое количество 60%-го раствора было добавлено?
Решение: Пусть добавили х литров 60%-го раствора. По расчетной формуле получаем:
60 + 60х = 80 + 40х
20х = 20
х = 1
Задача № 20.10 г Naпровзаимодействовали со 100 г воды. Найти массовую долю гидроксида натрия в растворе.
Решение:
2Na + 2НОН =2NaOH +H2
n (Na)= 10:23=0,43 моль
n (HOH)=100 : 18= 5,56 моль ( избыток)
n (NaOH) = 0,43 моль
m (NaOH)= 40∙ 0,43= 17,2 г
n (H2) = 0,43:2= 0,215 моль
m (H2)=0,215 ∙2=0,43г
w (NaOH)= 17,2/ 10+100- 0,43=0,157( 15,7%)
2.2. Задачи на смеси.
Задача № 1. Имеется сталь двух сортов с содержанием никеля 5% и 40%. Сколько тонн стали первого сорта нужно взять, чтобы в смеси со вторым сортом, получить при плавке 140 тонн стали с содержанием никеля 30%?
Решение: Пусть взяли х тонн первого сорта, тогда второго (140-х) тонн
5 * х + 5600 - 40х = 4200
- 35х = -1 400
х = 40
Ответ: 40 т.
Задача № 2. Вычислить массовую долю хлорида алюминия в растворе, полученном при смешивании 25г 10%-ного и 750г 25%-ного растворов.
а) Вычисляем массу растворенного вещества в 1- растворе:
m1вещества = W1 . m1раствора : 100%
m1вещества = 10. 25:100=2,5 г.
б) Вычисляем массу растворенного вещества в 2- растворе:
m2вещества = 25. 750:100=187,5 г.
в) Определяем массу растворенного вещества в смеси:
mвещества = m1вещества + m2вещества
mвещества = 2,5 + 187,5=190г
г) Определяем массу нового раствора (масса смеси растворов):
m3раствора = m1раствора + m2раствора
m3раствора =25 + 750 = 775г
д) Вычисляем массовую долю растворенного вещества в смеси:
W= mвещества :mраствора . 100%
W=190 : 775 . 100% = 24%
Задача № 3.Смешав -процентный и -процентный растворы кислоты и добавив кг чистой воды, получили -процентный раствор кислоты. Если бы вместо кг воды добавили кг -процентного раствора той же кислоты, то получили бы -процентный раствор кислоты. Сколько килограммов -процентного раствора использовали для получения смеси?
Решение: Пусть масса первого раствора , масса второго равна . Масса получившегося раствора равна . Запишем два уравнения, для количества кислоты.
Решаем получившуюся систему. Сразу умножим обе части уравнений на , поскольку с целыми коэффициентами удобнее работать, чем с дробными. Раскроем скобки.
Ответ: .
Задача № 4. 11,2л смеси кислорода и азота имеют массу 15,2г. Определите объем каждого газа?
Решение:
1. Масса смеси? m(см) = m(O2) + m(N2)
2. Масса вещества рассчитывается по формуле? m(в-ва) = M*ν
3. Масса смеси равна? m(см) = M(O2)*ν(O2) + M(N2)* ν(N2)
4. Подставим известные числа в полученную формулу:
15,2 = 32* ν(O2) + 28* ν(N2)
5. Что можно рассчитать зная объем смеси? ν(см) = V/Vm = 0,5 моль
ν(см) = ν(O2) + ν(N2)
6. Подставим расчетные числа в полученную формулу:
0,5 = ν(O2) + ν(N2)
7. Выразим неизвестные числа, через Х и У
8. Запишем полученное выражение:
0,5 = Х + У
15,2 = 32Х + 28У , что получается?
+Х + У=0,5 ( -28) -28Х + 28У = -14
32Х + 28У = 15,2 32Х + 28У = 15,2
4Х = 12
Х = 0,3 Х = 0,3
У - Х = 0,5 У = 0,2
V(в-ва) = Vm*ν;
V(O2) = 0,3* 22,4 = 6,72л
V(N2) = 0,2*22,4 = 4,48л
Ответ: V(O2) = 6,72л; V(N2) = 4,48л
Задача № 5.
Навеску смеси хлорида аммония, сульфата аммония и сульфата натрия массой 65гр. растворили в воде и добавили избыток хлорида бария. В результате реакции образовался осадок массой 93,2гр. Когда точно такую же порцию сухой смеси обработали щелочью, то удалось получить 47,6гр. 25%-го раствора аммиака. Вычислите массовые доли каждого компонента в смеси.
Решение:
Читаем еще раз задачу и определяем уравнения реакций:
1).(NH4)2SO4 + BaCL2 = BaSO4↓ + 2NH4CL
2).Na2SO4 + BaCL2 = BaSO4↓ + 2NaCL
3).NH4CL + NaOH = NaCL + NH3 + Н2О
4).(NH4)2SO4 + 2NaOH = Na2SO4 + 2NH3 + 2Н2О
Дальше идем по алгоритму 1-ой задачи.
m(см) = m(NH4CL) + m(NH4)2SO4) + m(Na2SO4)
m(в-ва) = M*ν
m(см) = M1*ν1 + M2*ν2 + M3*ν3
53,5*ν1 + 132*ν2 + 142*ν3 = 65
Выразим количества вещества, через
ν(NH4CL) = Х; ν(NH4)2SO4) = У; ν(Na2SO4) = Z
53,5Х + 132У + 142Z = 65
Рассчитаем количества вещества осадка:
ν(BaSO4) = m/ M = 93,2/233 = 0,4 моль
осадок выпадает в уравнениях 1) и 2), следовательно
У + Z = 0,4
В условии задачи говорится об растворе аммиака, рассчитаем его массу:
m(NH3) = 47,6 *0,25 = 11,9гр.
ν(NH3) = 11,9/17 = 0,7 моль
Аммиак образуется в уравнения 3) и 4), следовательно:
Х + 2У = 0,7
Объединим полученные уравнения:
53,5Х + 132У + 142Z = 65
У + Z = 0,4
Х + 2У = 0,7 ,
53,5Х + 132У + 142Z = 65
Z = 0,4 - У
Х = 0,7 - 2У
53,5(0,7 - 2У) + 132У + 142(0,4 -У) = 65
37,45 - 107У + 132У + 56,8 - 142У = 65
-117У = -29,25
У = 0,25
Z = 0,15
Х = 0,2
Найдем массы веществ в смеси:
m(NH4CL) = 0,2 * 53,5 = 10,7г
m(NH4)2SO4) = 0,25 * 132 = 33гр
m(Na2SO4) = 0,15 * 142 = 21,3гр
Зная массы веществ, найдем массовую долю каждого:
W(NH4CL) = 10,7/65*100% = 16,5%
W(NH4)2SO4) = 33/65*100% = 50,7%
W(Na2SO4) = 21,3/65*100% = 32,8%
Ответ: 16,5%, 50,7%, 32,8%
2.3. Задачи на сплавы.
Задача № 1.
Сплав меди и цинка содержал меди на 640 г больше, чем цинка. После того как из сплава выделили 6/7, содержащейся в нем меди и 60% цинка, масса сплава оказалась равной 200г. Сколько весил сплав первоначально?
Решение:
Было:х(г) цинка ----------------- Осталось: 1- 0,6 = 0,4 части цинка,
х + 640 г меди ------------- 1 - 6/7 = 1/7 часть меди.
Сплав: 200 = 0,4 х + 1/7(х + 640)
Отсюда х = 200.
Значит, первоначально, было 200(г) цинка, 840 (г) меди, а масса сплава равна 200 + 840 = 1 кг 40 г.
Ответ: Сплав весил 1 кг 40 г.
Задача № 2
Имеется два сплава золота и серебра. В одном количества этих металлов находится в отношении 2:3, а в другом - 3:7. Сколько нужно взять каждого сплава, чтобы получить 8 кг нового сплава, в котором золото и серебро были бы в отношении 5:11?
Решение:
Взято (кг)
Отношение золота к серебру
Отношения веса золота к весу сплава
Взяли золота
(кг)
1 сплав
Х
2:3
2:5
2/3 Х
2 сплав
8 - Х
3:7
3:10
3/10 (8 - Х)
новый
8
5:11
5:16
2/3 Х+3/10 (8 - Х)
(2/3 Х+3/10 (8 - 10)) : 8=5/16
Отсюда находим, что Х=1
1кг. взяли из 1сплава, 7кг. - 2 сплав.
Ответ: 1 (кг) и 7 (кг).
Задача № 3.Имеется два сплава. Первый сплав содержит никеля, второй - никеля. Из этих двух сплавов получили третий сплав массой кг, содержащий никеля. На сколько килограммов масса первого сплава меньше массы второго?
Решение: Пусть масса первого сплава равна x, а масса второго равна y. В результате получили сплав массой .
Запишем простую систему уравнений:
Первое уравнение - масса получившегося сплава, второе - масса никеля.
Решая, получим, что .
Ответ: .
Задача № 4. Даны два куска с различным содержанием олова. Первый, массой 300 г, содержит 20% олова, Второй, массой 200 г, содержит 40% олова. Сколько процентов олова будет содержать сплав, полученный из этих кусков?
Решение. До сплавления в двух кусках было 300*20/100+200*40/100=140 г олова. После сплавления кусок массой 200+300=500 г будет содержать 140*100/500 (%) = 28(%) олова.
Ответ. 28%.
Заключение.
Объем задач, которые относятся к применению математики в химии, достаточно велик. Но наиболее интересовали задачи на концентрацию растворов и сплавов, тем более, что многие из них пригодятся в повседневной жизни и в профессии. Подводя итог всему вышесказанному, можно сделать следующие выводы:
1. На основе анализа учебной и научно-популярной литературы по теме «Применение математических методов в химии» мы показали особенности различных видов химических задач.
2. Обосновали необходимость применения математических расчетов при решении таких задач.
3. Классифицировали основные виды задач.
4. Провели исследование разных видов задач и показали эффективность такого исследования.
Список литературы.
-
Математика. Подготовка к ЕГЭ: учебно-методическое пособие/ Под редакцией Ф.Ф. Лысенко, С.Ю. Кулабухова. - Ростов-на-Дону: Легион, 2012. - 416 с.
-
ЕГЭ. Математика. Подготовка к ЕГЭ. Вступительные испытания/ Л.Д. Лаппо, М.А. Попов. - М.: Издательство «Экзамен», 2013. - 334, [2] с.
-
ЕГЭ 2014. Математика. Типовые тестовые задания/ И.Р. Высоцкий, П.И. Захаров и др.; под редакцией А.Л. Семенова, И.В. Ященко. - М.: Издательство «Экзамен», 2014. - 55, [1]с.
-
ЕГЭ 2014. Математика. 30 вариантов типовых тестовых заданий и 800 заданий части 2 (С)/ И.Р. Высоцкий, П.И. Захаров и др.; под редакцией А.Л. Семенова, И.В. Ященко. - М.: Издательство «Экзамен», 2014. - 215, [1]с.
-
ЕГЭ 2013. Математика. Задача В 13. Задачи на составление уравнений. Рабочая тетрадь / Под ред. А.Л. Семенова и И.В. Ященко. - 4 -е изд., стереотип. - М.: МЦНМО, 2013. - 64 с.
-
Задачи на смеси и сплавы./ Н.И. Прокопенко. - М.: Чистые пруды,
2010.- 32 с.: ил. - (Библиотечка «Первого сентября», серия «Математика».Вып. 31).
7.him.1september.ru/
8. xumuk.ru
9. ru.wikipedia.org


