- Преподавателю
- Математика
- Контрольное тестирование по химии
Контрольное тестирование по химии
| Раздел | Математика |
| Класс | - |
| Тип | Тесты |
| Автор | Мешева А.А. |
| Дата | 06.02.2015 |
| Формат | docx |
| Изображения | Есть |
Вариант 1
1. К химическим явлениям относятся:
A)*фильтрование
B) горение дров
C) испарение воды
D) плавление стекла.
2. Смесь алюминиевого и железного порошка может быть разделена с помощью:
A) перегонки
B) фильтрования
C)*магнитом
D) растворением в воде.
3. К простым веществам относятся:
A)*водород (Н2)
B) вода (Н2О)
C) углекислый газ (СО2)
D) сульфид железа (FeS)
4. Валентность серы в соединенияхSO2, SO3, H2S равна соответственно:
A) II ,VI , IV
B) IV , II , VI
C) VI ,IV , II
D)*IV ,VI , II .
5. О кислороде как о химическом элементе идёт речь:
A) Кислород растворяется в воде.
B)*Кислород входит в состав воды.
C) Кислородом мы дышим.
D) Кислород поддерживает горение.
6. Наибольшую относительную молекулярную массу имеет:
A)*HClO4
B) H2SO4
C) NH3
D) HI.
7. РеакцияZn + 2HCl = ZnCl2 + H2относитсякреакциям:
A) соединения
B) разложения
C) обмена
D)*замещения.
8. Коэффициент перед формулой натрия в уравнении реакции, схема которой
Na + O2Na2O
A) 1
B) 2
C) 3
D)*4.
9. 40 грамм оксида меди (II) соответствует:
A) 0,25моль
B)*0,5моль
C) 1 моль
D) 1,25моль.
10.Массовая доля (%) хлоравMgCl2:
A) 25%
B) 37%
C)*75%
D) 95%.
11. Масса воды, которая образуется при взаимодействии 20 г водорода с кислородом (2H2 + O2 = 2H2О):
A) 40 г
B) 80 г
C)160г
D)*80 г
12. К физическим явлениям относится:
A) Образование ржавчины
B) Ржавление железа
C) Скисание молока
D)*Измельчение сахара.
13. К смесям относится:
A) Кислород
B)*Воздух
C) Дистиллированная вода
D) Алюминий
14. К сложным веществам относится:
A) Водород (Н2)
B) Цинк (Zn)
C)*Хлорид натрия (NaCl)
D) Медь (Cu)
15. Наивысшая валентность азота в оксиде:
А)*NO2
B) N2O3
C) NO
D) N2O
16. О кислороде, как о простом веществе, идёт речь:
A) Кислород входит в состав гидроксидов.
B) Кислород входит в состав оксидов.
C)*Кислород-это бесцветный газ.
D) В состав воды входит кислород.
17. Наименьшую молекулярную массу имеет:
A) CaS
B) К2О
C) Al2O3
D)*H2CO3.
18. РеакцияCu(OH)2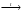 CuO + H2Oотносится к реакциям:
CuO + H2Oотносится к реакциям:
A) Соединения.
B)*Разложения.
C) Обмена.
D) Замещения.
19. Сумма коэффициентов в уравнении реакцииAl + Cl2→AlCl3:
A) 3
B) 5
C) 6
D)*7.
20. 90 гН20 соответствуют:
A) 2 моль
B) 3 моль
C) 4 моль
D)*5 моль.
Вариант 2
1. О простом веществе кислороде идет речь в выражении:
A) кислород входит в состав воды;
B)кислород содержится в земной коре;
C)*кислород входит в состав воздуха;
D) кислород входит в состав оксидов;
E) кислород входит в состав многих органических веществ;
2. В лабораториях кислород получают:
A) разделением воздуха;
B)*разложением перманганата калия (KMnO4);
C) взаимодействием метана CH4 с водой;
D) взаимодействием натрия с водой;
E) разложением карбоната кальция СаСО3.
3.Объемная доля (%) кислорода в воздухе приблизительно равна:
A) 1%;
B)* 21%;
C) 23%;
D) 78%;
E) 91%;
4.Кислороднельзяполучитьразложением:
A) бертолетовой солиKClO3
B) водыH2O
C) перманганата калияKMnO4
D)*карбоната кальцияCaCO3
E) оксида ртути (II) HgO
5.Высшую валентность марганец проявляет в оксиде:
A) MnO;
B) MnO2;
C)*Mn2O7;
D) Mn2O3;
E) MnS;
6.Молярная масса оксида натрия (вг/моль):
A) 39;
B)* 62;
C) 72;
D) 124;
E) 136;
7.Сумма коэффициентов в уравнении реакции горения алюминия:
A) 3;
B) 5;
C)* 7;
D) 8;
E) 9;
8.Общее число атомов всех элементов в молекуле вещества оксид серы (IV):
A) 2;
B)* 3;
C) 4;
D) 5;
E) 6;
9. Формулой оксида является:
A) H2S
B) AlCl3
C) CaCO3
D)*NO2
E) PH3
10. Валентность углерода в соединениях CO, CO2иCH4равна соответственно:
A) I, II и III
B) II, II и IV
C) I, II, иIV
D)*II, IVиIV
E) IV, IIиIV
11. Молярная масса оксида кальция (вг/моль):
A) 40;
B)* 56;
C) 80;
D) 112;
E) 120;
12. Сумма коэффициентов в уравнении реакции горения магния:
A) 3;
B) 4;
C)* 5;
D) 6;
E) 7;
13. Общее число атомов всех элементов в молекуле вещества оксид алюминия:
A) 2;
B) 3;
C) 4;
D)* 5;
E) 6;
14. Наименьшую массу (в граммах) имеет 1 моль вещества:
A)*СО2
B) NO2
C) SO2
D) SeO2
E) SiO2
15. Сумма коэффициентов в уравнении реакции, схема которой H2S + O2→SO2 + H2O:
A) 5;
B) 6;
C) 7;
D) 8;
E)* 9;
16. Массовая доля кислорода в оксиде углерода (IV) равна приблизительно:
A) 13%;
B) 20%;
C) 30%;
D) 50%;
E)* 73%;
17. Количество молей оксида алюминия, составляющих 204 г данного соединения:
A) 1;
B)* 2;
C) 3;
D) 4;
E) 5;
18. Масса11,2 л кислорода (н. у.):
A) 8 г;
B)*16 г;
C) 32 г;
D) 64 г;
E) 128 г.
19.Объем 2 моль кислорода при нормальных условиях:
A) 11,2л;
B) 22,4л;
C)*44,8л;
D) 67,2л;
E) 112 л;
20.Присгорании 32 г. Метана СН4 выделилось 1604 кДж теплоты. Вычислите тепловой эффект химической реакции Q (CH4 (г) + 2O2 (г) = CO2 (г) + 2H2O(г) + Q ):
A) + 401 кДж;
B)* + 802 кДж;
C) - 802 кДж;
D) + 1604 кДж;
E) - 1604 кДж;
Вариант 2
1. О простом веществе водороде идет речь в выражении:
A) водород в ходит в состав воды;
B) массовая доля водорода в воде составляет 11%;
C)*водород - газ, без цвета и запаха;
D) водород входит в состав оксидов;
E) водород входит в состав кислот;
2. В лабораториях водород получают:
A) разделением воздуха;
B)*взаимодействием активных металлов с кислотами;
C) взаимодействием метана CH4с водой;
D) разложением перманганата калия;
E) разложением карбоната кальция СаСО3.
3.Водород нельзя получить:
A) взаимодействием натрия с водой;
B) взаимодействием метана CH4 с водой;
C) разложением воды с помощью постоянного электрического тока;
D) взаимодействием активных металлов с кислотами;
E)*разделением воздуха
4. Сумма коэффициентов в уравнении реакции взаимодействия метана с водой
(СН4 + Н2О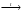 СО2 + Н2):
СО2 + Н2):
A) 9;
B) 4;
C) 5;
D) 6;
E)* 8;
5.Сумма коэффициентов в уравнении реакции взаимодействия натрия с водой:
A) 9;
B)* 7;
C) 5;
D) 6;
E) 8;
6. В результате взаимодействия активных металлов с кислотами образуются:
A) гидроксид металла и водород;
B) гидроксид металла и вода;
C)*соль и водород;
D) соль и вода;
E) оксид металла и водород;
7.Металл, который можно использовать для получения водорода (путем взаимодействия его с водой прин.у.):
A) Zn;
B) Аg;
C) Au;
D) Hg;
E)*Na;
8. Металл, который можно использовать для получения водорода (путем взаимодействия его с кислотой):
A) Cu;
B)* Mg;
C) Au;
D) Hg;
E) Pt;
9.Сумма коэффициентов в уравнении реакции взаимодействия оксида меди (II) с водородом:
A) 2;
B) 8;
C)* 4;
D) 5;
E) 9;
10. Сумма коэффициентов в уравнении реакции Al + HCl→AlCl3 + H2:
A)* 13;
B) 4;
C) 5;
D) 6;
E) 7;
11. Сумма коэффициентов в уравнении реакции взаимодействия магния с соляной кислотой:
A) 3;
B) 4;
C)*5;
D) 6;
E) 7;
12. Общее число атомов всех элементов в молекуле вещества хлорид цинка:
A) 2;
B)* 3;
C) 4;
D) 5;
E) 6;
13. Сумма коэффициентов в уравнении реакции взаимодействия оксида железа (III) с водородом:
A) 2;
B) 8;
C) 4;
D) 5;
E)* 9;
14. Сумма коэффициентов в уравнении реакции H2SO4 + Al→Al2(SO4)3 + H2:
A) 5;
B) 6;
C) 7;
D) 8;
E)* 9;
15. Массовая доля водорода в метане (СН4):
A) 13%;
B) 20%;
C) 30%;
D) 50%;
E)* 25%;
16. Количество молей водорода, образующихся при взаимодействии 32,5 г цинка с соляной кислотой:
A) 1 моль;
B) 2 моль;
C) 3 моль;
D)* 0,5моль;
E) 5 моль;
17. Масса11,2 л водорода (н.у.):
A) 8 г;
B)*1 г;
C) 2 г;
D) 64 г;
E) 6 г;
18.Объем 2 моль водорода (н.у.):
A) 11,2л;
B) 22,4л;
C)*44,8л;
D) 67,2л;
E) 112 л;
19.Масса соляной кислоты, необходимая для получения 67,2 л водорода (Zn +2HCl = ZnCl2 + H2):
A)*219 г;
B) 109,5г;
C) 70 г;
D) 64 г;
E) 61 г;
20.Массовая доля водорода в соединении ЭН4 равна 12,5%. Название элемента Э в соединении-это:
A)*кремний;
B) хлор;
C) азот;
D) титан;
E) углерод;
Вариант 1
1. К химическим явлениям относятся:
A)*фильтрование
B) горение дров
C) испарение воды
D) плавление стекла.
2. Смесь алюминиевого и железного порошка может быть разделена с помощью:
A) перегонки
B) фильтрования
C)*магнитом
D) растворением в воде.
3. К простым веществам относятся:
A)*водород (Н2)
B) вода (Н2О)
C) углекислый газ (СО2)
D) сульфид железа (FeS)
4. Валентность серы в соединениях SO2, SO3, H2S равна соответственно:
A) II ,VI , IV
B) IV , II , VI
C) VI ,IV , II
D)*IV ,VI , II .
5. О кислороде как о химическом элементе идёт речь:
A) Кислород растворяется в воде.
B)*Кислород входит в состав воды.
C) Кислородом мы дышим.
D) Кислород поддерживает горение.
6. Наибольшую относительную молекулярную массу имеет:
A)*HClO4
B) H2SO4
C) NH3
D) HI.
7. Реакция Zn + 2HCl = ZnCl2 + H2относитсякреакциям:
A) соединения
B) разложения
C) обмена
D)*замещения.
8. Коэффициент перед формулой натрия в уравнении реакции, схема которой
Na + O2?Na2O
A) 1
B) 2
C) 3
D)*4.
9. 40 грамм оксида меди (II) соответствует:
A) 0,25моль
B)*0,5моль
C) 1 моль
D) 1,25моль.
10.Массовая доля (%) хлоравMgCl2:
A) 25%
B) 37%
C)*75%
D) 95%.
11. Масса воды, которая образуется при взаимодействии20 г водорода с кислородом (2H2 + O2 = 2H2О):
A) 40 г
B) 80 г
C)160г
D)*80 г
12. К физическим явлениям относится:
A) Образование ржавчины
B) Ржавление железа
C) Скисание молока
D)*Измельчение сахара.
13. К смесям относится:
A) Кислород
B)*Воздух
C) Дистиллированная вода
D) Алюминий
14. К сложным веществам относится:
A) Водород (Н2)
B) Цинк (Zn)
C)*Хлорид натрия (NaCl)
D) Медь (Cu)
15. Наивысшая валентность азота в оксиде:
А)*NO2
B) N2O3
C) NO
D) N2O
16. О кислороде, как о простом веществе, идёт речь:
A) Кислород входит в состав гидр оксидов.
B) Кислород входит в состав оксидов.
C)*Кислород-это бесцветный газ.
D) В состав воды входит кислород.
17. Наименьшую молекулярную массу имеет:
A) CaS
B) К2О
C) Al2O3
D)*H2CO3.
18. Реакция Cu (OH)2CuO + H2Oотносится к реакциям:
A) Соединения.
B)*Разложения.
C) Обмена.
D) Замещения.
19. Сумма коэффициентов в уравнении реакции Al + Cl2>AlCl3:
A) 3
B) 5
C) 6
D)*7.
20. 90 гН20 соответствуют:
A) 2 моль
B) 3 моль
C) 4 моль
D)*5 моль.
21.Массовая доля (%) натриявNa2S:
A) 29%
B)*59%
C) 78%
D)88%.
22. Масса водорода, которая образуется при разложении воды массой 72 г
(2H2O = 2H2 + O2):
A) 6 г
B)*8 г
C) 10 г
D) 12 г.
Вариант 2.
1. О простом веществе кислороде идет речь в выражении:
A) кислород входит в состав воды;
B) кислород содержится в земной коре;
C)*кислород входит в состав воздуха;
D) кислород входит в состав оксидов;
E) кислород входит в состав многих органических веществ;
2. В лабораториях кислород получают:
A) разделением воздуха;
B)*разложением перманганата калия (KMnO4);
C) взаимодействием метана CH4 с водой;
D) взаимодействием натрия с водой;
E) разложением карбоната кальция СаСО3.
3.Объемная доля (%) кислорода в воздухе приблизительно равна:
A) 1%;
B)* 21%;
C) 23%;
D) 78%;
E) 91%;
4.Кислород нельзя получить разложением:
A) бертолетовой солиKClO3
B) воды H2O
C) перманганата калияKMnO4
D)*карбоната кальцияCaCO3
E) оксида ртути (II) HgO
5.Высшую валентность марганец проявляет в оксиде:
A) MnO;
B) MnO2;
C)*Mn2O7;
D) Mn2O3;
E) MnS;
6.Молярная масса оксида натрия (в г/моль):
A) 39;
B)* 62;
C) 72;
D) 124;
E) 136;
7.Сумма коэффициентов в уравнении реакции горения алюминия:
A) 3;
B) 5;
C)* 7;
D) 8;
E) 9;
8.Общее число атомов всех элементов в молекуле вещества оксид серы (IV):
A) 2;
B)* 3;
C) 4;
D) 5;
E) 6;
9. Формулой оксида является:
A) H2S
B) AlCl3
C) CaCO3
D)*NO2
E) PH3
10. Валентность углерода в соединениях CO, CO2 и CH4 равна соответственно:
A) I, II и III
B) II, II и IV
C) I, II, и IV
D)*II, IV и IV
E) IV, II и IV
11. Молярная масса оксида кальция (в г/моль):
A) 40;
B)* 56;
C) 80;
D) 112;
E) 120;
12. Сумма коэффициентов в уравнении реакции горения магния:
A) 3;
B) 4;
C)* 5;
D) 6;
E) 7;
13. Общее число атомов всех элементов в молекуле вещества оксид алюминия:
A) 2;
B) 3;
C) 4;
D)* 5;
E) 6;
14. Наименьшую массу (в граммах) имеет 1 моль вещества:
A)*СО2
B) NO2
C) SO2
D) SeO2
E) SiO2
15. Сумма коэффициентов в уравнении реакции, схема которой H2S + O2>SO2 + H2O:
A) 5;
B) 6;
C) 7;
D) 8;
E)* 9;
16. Массовая доля кислорода в оксиде углерода (IV) равна приблизительно:
A) 13%;
B) 20%;
C) 30%;
D) 50%;
E)* 73%;
17. Количество молей оксида алюминия, составляющих204 г данного соединения:
A) 1;
B)* 2;
C) 3;
D) 4;
E) 5;
18. Масса11,2 л кислорода (н. у.):
A) 8 г;
B)*16 г;
C) 32 г;
D) 64 г;
E) 128 г.
19.Объем 2 моль кислорода при нормальных условиях:
A) 11,2л;
B) 22,4л;
C)*44,8л;
D) 67,2л;
E) 112 л;
20.Присгорании32 г. метанаСН4выделилось 1604 кДж теплоты. Вычислите тепловой эффект химической реакции Q (CH4 (г) + 2O2 (г) = CO2 (г) + 2H2O(г) + Q ):
A) + 401 кДж;
B)* + 802 кДж;
C) - 802 кДж;
D) + 1604 кДж;
E) - 1604 кДж;
Вариант 1
1. О простом веществе водороде идет речь в выражении:
A) водород в ходит в состав воды;
B) массовая доля водорода в воде составляет 11%;
C)*водород - газ, без цвета и запаха;
D) водород входит в состав оксидов;
E) водород входит в состав кислот;
2. В лабораториях водород получают:
A) разделением воздуха;
B)*взаимодействием активных металлов с кислотами;
C) взаимодействием метана CH4 с водой;
D) разложением перманганата калия;
E) разложениемкарбонатакальцияСаСО3.
3.Водород нельзя получить:
A) взаимодействием натрия с водой;
B) взаимодействием метана CH4 с водой;
C) разложением воды с помощью постоянного электрического тока;
D) взаимодействием активных металлов с кислотами;
E)*разделением воздуха
4. Сумма коэффициентов в уравнении реакции взаимодействия метана с водой
(СН4 + Н2ОСО2 + Н2):
A) 9;
B) 4;
C) 5;
D) 6;
E)* 8;
5.Сумма коэффициентов в уравнении реакции взаимодействия натрия с водой:
A) 9;
B)* 7;
C) 5;
D) 6;
E) 8;
6. В результате взаимодействия активных металлов с кислотами образуются:
A) гидроксид металла и водород;
B) гидроксид металла и вода;
C)*соль и водород;
D) соль и вода;
E) оксид металла и водород;
7.Металл, который можно использовать для получения водорода (путем взаимодействия его с водой прин. у.):
A) Zn;
B) Аg;
C) Au;
D) Hg;
E)*Na;
8. Металл, который можно использовать для получения водорода (путем взаимодействия его с кислотой):
A) Cu;
B)* Mg;
C) Au;
D) Hg;
E) Pt;
9.Сумма коэффициентов в уравнении реакции взаимодействия оксида меди (II) с водородом:
A) 2;
B) 8;
C)* 4;
D) 5;
E) 9;
10. Сумма коэффициентов в уравнении реакции Al + HCl >AlCl3 + H2:
A)* 13;
B) 4;
C) 5;
D) 6;
E) 7;
11. Сумма коэффициентов в уравнении реакции взаимодействия магния с соляной кислотой:
A) 3;
B) 4;
C)*5;
D) 6;
E) 7;
12. Общее число атомов всех элементов в молекуле вещества хлорид цинка:
A) 2;
B)* 3;
C) 4;
D) 5;
E) 6;
13. Сумма коэффициентов в уравнении реакции взаимодействия оксида железа (III) с водородом:
A) 2;
B) 8;
C) 4;
D) 5;
E)* 9;
14. Сумма коэффициентов в уравнении реакции H2SO4 + Al>Al2(SO4)3 + H2:
A) 5;
B) 6;
C) 7;
D) 8;
E)* 9;
15. Массовая доля водорода в метане (СН4):
A) 13%;
B) 20%;
C) 30%;
D) 50%;
E)* 25%;
16. Количество молей водорода, образующихсяпривзаимодействии32,5 г цинка с соляной кислотой:
A) 1 моль;
B) 2 моль;
C) 3 моль;
D)* 0,5моль;
E) 5 моль;
17. Масса11,2 л водорода (н.у.):
A) 8 г;
B)*1 г;
C) 2 г;
D) 64 г;
E) 6 г;
18.Объем 2 моль водорода (н.у.):
A) 11,2л;
B) 22,4л;
C)*44,8л;
D) 67,2л;
E) 112 л;
19.Массасолянойкислоты, необходима я для получения 67,2 л водорода (Zn +2HCl = ZnCl2 + H2):
A)*219 г;
B) 109,5г;
C) 70 г;
D) 64 г;
E) 61 г;
20.Массовая доля водорода в соединении ЭН 4 равна 12,5%. Название элемента Э в соединении-это:
A)*кремний;
B) хлор;
C) азот;
D) титан;
E) углерод;


