- Преподавателю
- Иностранные языки
- Исследовательская работа по химии на тему Химический образ естественных растворов Приднестровья
Исследовательская работа по химии на тему Химический образ естественных растворов Приднестровья
| Раздел | Иностранные языки |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Дикусар А.И. |
| Дата | 17.02.2015 |
| Формат | doc |
| Изображения | Есть |
Министерство просвещения ПМР
МОУ «Незавертайловская ОШ-ДС №1»
Исследовательская работа
на тему:
«Химический образ естественных растворов Приднестровья»
Авторы, ученицы IX класса:
1. Ганенко Александра Андреевна
2. Петко Наталья Юрьевна
3. Трандафир Аксинья Степановна
Руководитель:
Дикусар Андрей Иванович
2014 - 2015 гг.
СОДЕРЖАНИЕ
Глава I. Мотивация проблемы исследования………………………………………...…3
Глава II. Экспериментальные исследования…………………………………………....5
Глава III. Результаты исследования естественных растворов Приднестровья….14
Выводы и рекомендации…………………………………………………………………..19
Информационные источники.....................................................................................20

Глава I. Мотивация проблемы исследования.
Если путь к цели
неизвестен, то к такой цели
интересно идти.
ИОУ «Вещество»
1.1. Введение
Учение о растворах - один из важнейших разделов химии. Большинство превращений веществ, используемых в фармацевтической, пищевой, металлургической, химической, текстильной, других отраслях промышленности и сельского хозяйства, проходят в растворах.
Все биологические процессы в растительных и животных организмах, в том числе и в организме человека, совершаются в растворах. То же относится и к процессам, протекающим в почве. Предмет изучения таких наук как биология, медицина, почвоведение тесно связан с развитием учения о растворах.
Проблема естественных растворов Приднестровья и их рациональное использование все еще не решена. Это следствие многообразия типов растворов, а также отсутствия в достаточной степени совершенной теории жидкого состояния различных веществ.
При растворении между компонентами в пробирке или природе происходит химическое взаимодействие. Поэтому исследование естественных растворов республики представляет особый интерес. Прежде всего, для улучшения качества жизни людей и экономического развития республики. Исследования посвящены решению этой проблемы.
1.2. Лингвистика естественных растворов.
Итак, что такое естественные растворы. Растворы - это однофазные системы переменного состава, образованные не менее, чем двумя независимыми компонентами. Состав растворов, в отличие от состава химических соединений, может изменяться в широких пределах. Начиная с Каменки и заканчивая Днестровском, состав естественных растворов Приднестровья различный. В этом отношении растворы сходны с механическими смесями, но отличаются от них своей гомогенностью и наличием возрастания энтропии (беспорядка) при смешении компонентов. Растворы бывают газообразные, жидкие и твердые.
Свойства растворов определяются характером межмолекулярного взаимодействия как одного и того же компонента, так и разных компонентов. В некоторых системах существенное значение имеют водородные связи. Растворенные вещества могут образовывать устойчивые комплексы с растворителем - сольваты. В случае воды - это гидраты.
В растворах происходит не только физический процесс, который связан с разрушением кристаллической решетки твердого вещества и равномерным распределение частиц растворенного вещества среди молекул растворителя, но и химический процесс взаимодействия компонентов, приводящий к образованию химических соединений. Возможно их выделение и в чистом виде.
Состав растворов можно выразить не только качественно (наличие ионов - анионов и катионов), но и количественно. Используют понятие массовой доли вещества - процентная (%) концентрация раствора. Это масса вещества в 100 единицах (граммах) раствора:
ω = [m(в-ва) / m(р-ра)] ∙ 100 %
Используют также молярность - число молей растворенного вещества, содержащееся в 1 литре растворе (С).
В количественном химическом анализе концентрацию растворов выражают нормальностью - это число эквивалентов растворенного вещества в 1 литре раствора (N). Величина эквивалента вещества зависит не только от природы вещества, но и от типа реакции. Например, перманганат калия KMnO4 в реакции
2KMnO4 + 5H2C2O4 + 3H2SO4 = 2MnSO4 + K2SO4 +8H2O + 10 CO2↑
Эквивалент перманганата калия равен:
Э(KMnO4)= 158:5 = 31,6, т.к. Mn+7 + 5ē → Mn+2, т.е. молекулярная масса делится на 5 - число присоединенных электронов, участвующих в редокс-процессе.
Величина эквивалента перманганата калия в реакциях обмена и иная:
Э(KMnO4)= 158:1 = 158, 1 - это произведение валентности металла на количество его атомов (1∙1 = 1).
Для кислот: эквивалент определяют делением относительной молекулярной массы растворенного вещества на число атомов водорода; у основания относительную молекулярную массу делят на число гидроксильных групп:
Э(H2SO4) = 98:2 = 49. Э(Ca(OH)2) = 74:2=37. Эквивалент кислорода Э(О)= 16:2=8 и т.д.
Все растворы условно можно делить на естественные, которые в свою очередь делятся на растворы органического или неорганического происхождения; и искусственного приготовления. К первым относят соки различных плодов, овощей, экстракты трав, почвенные - минеральные растворы. Ко вторым - все промышленные и сельскохозяйственные растворы. Питьевая вода не составляет исключение, т.к., прежде чем подавать потребителю, её тщательно очищают, фильтруют, обрабатывают химическим реагентами, а порой искусственно дополняют её некоторыми веществами, недостающими до стандартных условий.

Глава II. Экспериментальные исследования.
Легко изучать и исследовать все растворы.
Но как трудно изучать и исследовать отдельно
взятый раствор от Каменки до Днестровска.
Винить попутчиков? Дорогу? Нет смысла.
Постигая суть, нам надо сердцем искать настойчивее путь!
ИОУ «Вещество»
2.1. Химическая посуда, реагенты и аппаратура.
В исследовании использовали стеклянную посуду:
- стаканы химические с носиком емкостью 50, 100, 500 мл, необходимые для проведения реакций осаждения, переливания жидкостей и других операций с растворами,
- стеклянные палочки разных размеров для перемешивания растворов, переливания жидкостей при фильтровании осадков,
- воронки для фильтрования,
- часовые стекла,
- стеклянные бюксы для хранения веществ;
- промывалки емкостью 200 - 250 мл,
- чашки и тигли фарфоровые для выпаривания жидкостей и прокаливания осадков,
- цилиндры мерные с делениями в 0,2 - 0,5 мл,
- мерные колбы объемом 25 - 100 мл,
- пипетки мерные на 1, 5, 10, 50 и 100 мл,
- колбы мерные на 100, 250 и 1000 мл,
- бюретки на 25 мл, с градуировкой 0,02 - 0,01 мл.


Качественные реакции проводили на фильтровальной бумаге, на стеклах часовых (микрокристаллоскопические реакции), а также в пробирках объёмом 3-5-10 мл.
Использовали и другие приборы и принадлежности: ножницы, скальпель, пробиркодержатели, бумагу фильтровальную для хроматографии, резиновые груши, штативы для пробирок и лабораторные штативы, треножки и сетки асбестовые, спиртовые горелки (спиртовки), магнитные мешалки, чашки Петри, колбы для титрования, подставки кафельные, ареометры, дистиллятор, микроскоп школьный, шкаф сушильный, эксикатор.
Химические реагенты использовали чистые «ч», чисто для анализа «чдa» и химически чистые «xч». Некоторые готовили сами. Очищали их по известным методикам, для чего использовали:
- кислоты: серную H2SO4, соляную HCl, уксусную CH3COOH, винную H2C4H4O6, щавелевую H2C2O4∙2H2O;
- основания: гидроксид натрия NaOH, гидроксид кальция Ca(OH)2, гидроксид аммония NH4OH;
- соли: хлорид натрия NaCl, хлорид калия KCl, хлорид бария BaCl2, карбонат натрия Na2CO3, гидрокарбонат натрия NaHCO3, перманганат калия KMnO4,хлорид кальция CaCl2, азотнокислое серебро (нитрат серебра) AgNO3, сульфат натрия Na2SO4, хлорид магния MgCl2, сульфат магния MgSO4;
- спиртовой раствор йода I2;
- раствор крахмального клейстера;
- этанол С2Н5ОН;
- кислотно-основные индикаторы фенолфталеин, метилоранж, лакмус;
- а также хромоген черный, трилон Б, мурексид, аммиачный буфер.


Объекты нашего исследования - пробы естественных растворов - брали из различных водоемов от Днестра до Днестровского лимана, водоканалы поселков и городов Тирасполя, Слободзеи, Днестровска, Григориополя, Дубоссар, Рыбницы и Каменки, из скважин частных лиц, СОШ №1 с. Незавертайловка, покупали бутилированную воду в коммерческой фирме «Шериф». Все естественные растворы в виде проб взяты были в летнее время в специальной посуде и маркированы.
Многие принадлежности и реактивы приобретали в аптечной сети.
2.2. Методы исследований.
Изучение качественных реакций проводили хроматографией на бумаге, а также микрокристаллоскопические обнаружения некоторых ионов - магния, например, бумажная хроматография - один из способов распределительной хроматографии. В качестве носителя неподвижной фазы используется хроматографическая бумага нескольких сортов - № 1,2,3,4. От плотности бумаги зависит скорость движения подвижного раствора, поэтому №1 и №2 называют «быстрой», а №3 и №4 - «медленной». Для получения одномерных хроматограмм использовали полосы шириной 4,5 - 5,0 см и длиной 30-50 см. Процесс хроматографирования вели в стеклянных цилиндрах в эксикаторах, в чашках Петри.
Кроме физико-химических методов, особое внимание уделяли химическим методам исследования. Они основаны на превращении анализируемого вещества в новые соединения, обладающие определенными свойствами. По образованию характерных соединений устанавливали элементный состав вещества. Например, ионы хлора Cl- - по выпадению белого творожистого осадка хлорида серебра AgCl.
С учетом дорогих и дефицитных реагентов чаще использовали полумикроанализ (сантиргамм-метод). Вполне воспроизводимые результаты получали с 0,05-0,5 г вещества в объеме 1-10 мл раствора.
2.3. Определение водородного показателя, рН.
Всегда использовали универсальный индикатор со шкалой от «0» до «12» единиц. Измерения проводились при комнатной температуре путем внесения индикаторной полоски в исследуемый естественный раствор и сравнения ее окраски со стандартной шкалой. Отмечали ту величину рН, по цвету которой совпадала окраска. Средние из трех измерений приведены в таблице 1.
Жесткость - это характерное свойство естественных растворов. Определяли жесткость естественных растворов по следующей методике: непосредственно титровали 200 мл естественного раствора 0,1 М (децимолярным) раствором солярной кислоты HCl, приготовленным из фиксанала в присутствии метилоранжа:
Ca(HCO3)2 + 2HCl = CaCl2 + 2H2O + 2CO2↑
Mg(HCO3)2 + 2HCl = MgCl2 + 2H2O + 2CO2↑
На процесс титрования расходовано 5,5 мл 0,1015 М (молярного) раствора HCl. Временная жесткость равна:
5,5 ∙ 0,1015 ∙ 1000
Врем. жесткость = ------------------------- = 2,79 мг-экв/ л
200
Этот же раствор использовали для определения общей жесткости, которую определяли комплеснометрическим титрованием с комплексном (трилоном Б):
N (трилона Б) ∙ V (трилона Б) ∙ 1000
Общая жесткость = ----------------------------------------------------
V (естественного раствора)
0,0982 ∙ 6,5 ∙ 1000
Общая жесткость = ---------------------------- = 6,830 мг-экв/л,
100
где 100 мл - объем титруемого естественного раствора;
6,5 мл - объем раствора трилона Б, пошедший на титрование;
0,0982 н. - нормальность рабочего раствора трилона Б.
Жесткость раствора (и воды также) выражается числом миллиграмм - эквивалентов кальция и магния в 1 литре раствора. Индикатором был хромоген черный и величину рН создавали аммонийным буферным раствором равным десяти (рН = 10): Ca²+(Mg²+) + HInd²- = CaInd- (MgInd-) + H+.
2.4. Определение основных характеристик естественных растворов.
Определение грубодисперсных примесей (частицы песка, глины, органических примесей). Пробу в 100 мл естественного раствора фильтровали через плотный фильтр. Фильтр с остатком сушили в шкафу сушильном при температуре 105 ˚С для полного удаления воды. Затем взвешивали. И по разнице в массе до фильтрования и после (с остатком) определяли массу примесей:
m прим = m(ф+н) - mф
Определение окисляемости естественных растворов проводили перманганатометрически. Под окисляемостью понимается количество миллиграммов кислорода, необходимых для окисления органических веществ, растворенных в 1 литре раствора. Таким образом, окисляемость служит оценкой показателя загрязненности органическими веществами; чем выше окисляемость, тем больше загрязнены растворы. Наиболее быстрый окислитель органических примесей не кислород, а перманганат калия.
Отмеривали пипеткой 100 мл исследуемого естественного раствора, переносили в колбу коническую емкостью 250-300 мл и добавляли 5 мл 30%-ного раствора серной кислоты H2SO4. Затем приливали 10 мл 0,01н. (сантинормального) раствора перманганата калия KMnO4 и перемешивали стеклянной палочкой. Содержимое оставляли на 10 минут в темном месте при комнатной температуре. После этого в колбу добавляли 10 мл 0,01 н. раствора щавелевой кислоты H2C2О4 и отфильтровывали ее избыток 0,01 н. раствором KMnO4 до появления розовой окраски. Данная реакция протекает согласно следующему уравнению:
5 H2C2О4 + 2KMnO4 + 3 H2SO4 = 2MnSO4 + K2SO4 + 8 H2O + 10 СО2↑
Окисляемость определяется по формуле:
1000
А = -------- ∙ [(V(KMnO4) + a) ∙ 8,0 ∙ N(KMnO4) ∙ K(KMnO4) - 8,0∙V (H2C2О4) ∙ N(H2C2О4)]
100
Где V(KMnO4) и V(H2C2О4) - объемы рабочих (стандартных или титрованных) растворов; К(KMnO4) - поправочный коэффициент ≈ 1,0; N(KMnO4) и N(H2C2О4) - нормальные концентрации соответствующих растворов (число грамм-эквивалентов вещества в 1 л раствора), эквиваленты которых равны:
Э(KMnO4) = М(KMnO4)/5 = 158,03/5 = 31,61 г;
Э (H2C2О4∙2Н2О) = 126,06/2 = 63,03 г.
При условии что V(KMnO4) = V(H2C2О4) и N (KMnO4) = N(H2C2О4) получим А = = 0,8 ∙ а′, где а′ - объем раствора 0,01 н. KMnO4, израсходованного на обратное титрование избытка H2C2О4. Полученные данные указаны в таблице 1.
Таблица 1. Характеристика естественных растворов по регионам.
N
п/п
Регион
р. Днестр
рН растворов
Окисляемость, мг/л О2
Примеси, мг/л
Сухой остаток, мг/л
Скважины
р.Днестр
Скважины
р.Днестр
1
Каменка
2,5
990
5,5
6,5
2,1
4,5
2
Рыбница
2,5
1000
5,6
6,6
2,0
5,0
3
Григориополь
3,0
1020
5,7
6,6
2,1
4,6
4
Тирасполь
3,2
1040
5,6
6,7
2,1
4,8
5
Слободзея
3,3
1050
5,8
6,6
2,2
5,0
6
Днестровск
3,4
1060
5,8
6,8
2,2
5,2

2.5. Качественное обнаружение катионов.
Для определения качества естественных растворов использовали пробы из различных источников. Определение ионов проводили по известным методикам. Наибольший вклад в определение качества растворов привносят соли угольной, серной и соляной кислот с металлами кальция и магния.
Обнаружение Са2+-иона. В пробирку набирали пипеткой 2-3 капли естественного раствора и добавляли 3-5 капель уксусной кислоты СН3СООН, затем 2-3 капли раствора оксалата аммония (NH4)2C2O4 и 1-2 капли раствора аммиака NH4OH. Наблюдали образование белого кристаллического осадка:
Са(NO3)2 + H2C2O4 = СаС2О4↓ + 2HNO3
Са2+ + C2O42- = СаС2О4↓
Оксалаты бария и стронция остаются при этом в растворе.
Обнаружение Mg2+-иона. В пробирку набирали пипеткой 2-3 капли исследуемого естественного раствора и добавляли 4-5 капель 1М (одномолярного) раствора соляной кислоты НСl, 3-4 капли раствора гидрофосфата натрия Na2HPO4. Затем добавляли по 1капле 2М (двумолярного) раствора аммиака NH4OH для нейтрализации избытка раствора соляной кислоты. При этом происходит образование хлорида аммония NH4Сl, который препятствует образованию осадка гидроксида магния Mg(OH)2.После перемешивания через 3-5 минут наблюдали выпадение характерного белого кристаллического осадка фосфата магния-аммония MgNH4РО4, кристаллы которого мы наблюдали под микроскопом:
Mg(NO3)2 + Na2HPO4 + NH4OH = MgNH4РО4↓ + 2NaNO3 + H2O
Mg2+ + HPO4- + NH4OH = MgNH4РО4↓ + H2O
2.6. Качественное обнаружение анионов.
Общие реакции на карбонат - и гидрокарбонат - ионы. Общая реакция на карбонат- и гидрокарбонат-ионы - это реакция разложения при действии минеральных кислот. Эффектом реакции служит выделение пузырьков газа:
NaHCO3 + HCl = NaCl + H2O +CO2↑ или Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
Реакции отличия карбонат- и гидрокарбонат-ионов: осаждение с насыщенным раствором сульфата магния MgSO4. Образуется белый осадок основного карбоната магния. Карбонаты дают эту реакцию при обычной температуре:
4K2CO3 + 4MgSO4 + 4H2O = 3MgCO3∙Mg(OH)2∙3H2O↓ + 4K2SO4 + CO2↑
Гидрокарбонаты образуют осадок только при нагревании - после того, как переходят в карбонаты.
К исследуемому естественному раствору прибавляют насыщенный раствор сульфата магния - раствор прозрачный, так как гидрокарбонат магния растворим в воде: 2NaHCO3 + MgSO4 = Mg(HCO3)2 + Na2CO3
При кипячении раствора образуется белый осадок:
4Mg(HCO3)2 → 3MgCO3∙Mg(OH)2∙3H2O↓ + 5CO2↑
Проба с фенолфталеином. Интервал изменения окраски pH=8,2-10,0. Растворы гидрокарбонатов при добавлении фенолфталеина окрашиваются в бело-розовый цвет или остаются бесцветными, так как имеют слабощелочную реакцию среды. Растворы карбонатов в присутствии фенолфталеина окрашиваются в малиновый (красный) цвет - сильнощелочной реакции среды.
Обнаружение SO4²-. В пробирку набирали 2-3 капли исследуемого раствора и добавляли 1-2 каплю раствора хлорида бария BaCl2. Наблюдали выпадение белого осадка, нерастворимого в кислотах, BaSO4 - признак наличия сульфат иона SO4²-.
Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
Обнаружение CO3²- - иона. К естественному раствору добавляли 2-3 капли того же раствора хлорида бария. Наблюдали образование осадка белого цвета карбоната бария BaCO3, растворимого в минеральных кислотах, например в соляной кислоте HCl. Эти реакции протекают согласно следующим уравнениям:
Na2CO3 + BaCl2 = BaCO3↓ + 2NaCl BaCO3 + 2HCl = BaCl2 + H2O + CO2↑
Обнаружение Cl- - иона проводили с раствором нитрата серебра:
NaCl + AgNO3 = AgCl↓ + NaNO3
Обнаружение SiO3²- - иона. К исследуемому раствору добавляли 2-3 кристаллика хлорида аммония NH4Cl и нагревали. Образование желеобразных хлопьев белого осадка - признак наличия силикат - иона:
Na2SiO3 + 2H2O +2NH4Cl = Н2SiO3↓ + 2NH4OH + 2NaCl
SiO3²- + 2H2O +2NH4+ = Н2SiO3↓ + 2NH4OH
В случае присутствия этих ионов в естественных растворах идентифицировали при помощи растворов - свидетелей. Или же использовали дробное отделение мешающих ионов - как при обнаружении катионов, так и анионов.
2.7. Количественные определения.
Естественные растворы теоретически содержат все элементы периодической системы Д.И. Менделеева в виде ионов солей различных металлов и кислот. Однако в большей степени приходится учитывать содержание солей кальция и магния с карбонат-, гидрокарбонат-, сульфат-, хлорид - ионами, так как они значительно определяют качество естественных растворов. Если они содержат:
- до 0,1% растворимых веществ то, естественные растворы называют пресными (водами);
- от 0,1% до 5% - минерализованными (водами);
- свыше 5% - рассолы.
Эти три типа естественных растворов широко распространены в нашей республике. Меньше всего среди них - последние.
Совместное определение Ca²+- и Mg²+ - ионов. Пипеткой на 50 мл набирали исследуемый естественный раствор, переносили его в колбу для титрования, приливали 5мл аммонийной буферной смеси, 25-30 мл хромогена чёрного и титровали 0,05 н. (пятисантинормальным) раствором трилона Б до перехода винно-красной окраски раствора в синюю. Титрование повторяли 2-3 раза новыми (порциями) объёмами естественных растворов, затем определяли среднее арифметическое значение:
N (трилона Б) ∙ V (трилона Б) ∙ 1000
m (Ca²+, Mg²+)= -----------------------------------------------------
V (естественного раствора)
где N и V - нормальная концентрация (нормальность) и объём раствора трилона Б.
Определение кальция. 50 мл естественного раствора переносили в колбу для титрования, приливали 2,5 мл 2 н. (двунормального) раствора гидроксида натрия, 30-40 мл смеси индикатора мурексида с хлоридом натрия и приступали к титрованию 0,05н. раствором трилона Б до появления сине-фиолетовой окраски, не исчезающей в течении 2-3 минут. Повторяли титрование 2-3 раза. Количество (масса) кальция в 100 г раствора вычисляли по формуле:
N (трилона Б) ∙ V (трилона Б) ∙ 1000
m (Ca²+)= -----------------------------------------------------
V (естественного раствора)
А масса m (Mg²+) = m ( Ca²+,Mg²+) - m (Ca²+)
Результаты измерений указаны в таблицах 2 и 3.
Таблица 2. Естественные растворы Приднестровья
по регионам (река Днестр).
мг/л
мг-экв/л
Регион
Ca²+
Mg²+
SO4²-
Cl-
SiO3²-
Жесткость
временная
общая
Рыбница
65
10
45
13
9
2,5
3,0
Григориополь
67
11
47
13
12
2,6
3,2
Слободзея
70
12
50
15
15
2,8
3,6
Таблица 3. Естественные растворы скважин.
Регион
Ca²+
Mg²+
SO4²-
Cl-
SiO3²-
Жесткость
временная
общая
Рыбница
70
8
40
10
6
2,4
3,1
Григориополь
75
10
47
13
8
2,8
3,8
Слободзея
80
12
50
15
11
3,1
4,0
Глава III. Результаты исследования естественных растворов Приднестровья.
Ум человека ценится тем, что он знает место молчания не меньше, чем когда говорить необходимо.
ИОУ «Вещество»
Исследовательское общество учащихся Незавертайловской ОШ-ДС №1»Вещество» работает уже много лет. За последние годы ученики нашей школы уже выступали на районных и республиканских конференциях. Например, в 2009 году Багаева Мария выполнила работу на тему «Какую воду мы пьем»; в 2011 году Белая Екатерина выступала с работой «Ацетилсалициловая кислота: лицо и маска»; а в 2013 году Иванченко Елена подготовила работу на тему «Химический образ кофе». Нынешняя работа принципиально не отличается от этих работ. Она представляет собой синтез предыдущих работ и исследований. Она является мостиком для последующих проектов с широкой перспективой проектом долгосрочного исследования растворов естественного происхождения в нашей республике.
Проблема состоит в том, что Днестровский ареал - уникальное территориальное создание на границе нескольких государств. В связи с этим сложилась на территории нашей республики сложная экологическая ситуация. Разного рода встречи и совещания пока не привели к единому мнению и решению этой проблемы. А химические, биохимические и другие процессы идут в атмосфере, в почве, в водных бассейнах постоянно. Каковы они? Как они развиваются? Какое действие они оказывают на окружающую среду? На эти и другие вопросы должны ответить постоянные исследования состава естественных растворов Приднестровья. Во «введении» указаны основные проблемы исследования. Сущность экспериментальной работы и ее реализация подробно описана во второй главе, а также приведен перечень посуды, реагентов, аппаратуры и методов исследования.
Изложена техника эксперимента, правила обращения с лаборатоной посудой, аппаратурой, химическими реагентами с учётом требований техники безопасности. Использованы физико-химические и химические методы исследования, где необходимо хроматографические и микрокристаллоскопические. Широко использованы качественные и количественные методы анализа. Хроматография на бумаге использована для разделения мешающих ионов, например, кальция и магния оксалатом аммония, некоторые тяжёлые металлы - ионы железа(III).
Основой количественных измерений были титриметрические методы: кислотно-щелочной, оксидиметрические и комплексонометрический. Химические процессы при этом следующие.
1. Метод кислотно-основного титрования (метод нейтрализации):
Н+ + ОН- = Н2О; НСl + NaOH = NaCl + Н2О
кислота основание слабый электролит
2. Метод оксидиметрии (перманганатометрии):
MnO4- + 8H+ + 5 ē = Mn2+ + 4Н2О;
5Na2C2O4 + 2KMnO4 +8H2SO4 = 2MnSO4 + K2SO4 + 5Na2SO4 + 8Н2О + 10CO2↑
3. Метод комплексометрии (трилонометрии):
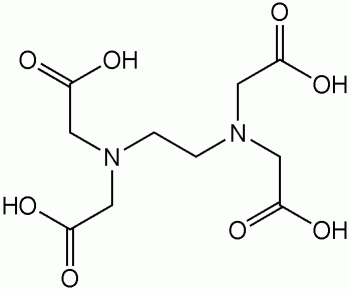 или
или 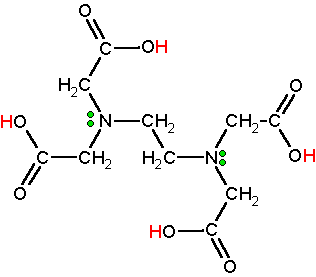
двунатриевая соль этилендиаминтетрауксусной кислоты, ЭДТА или трилон Б
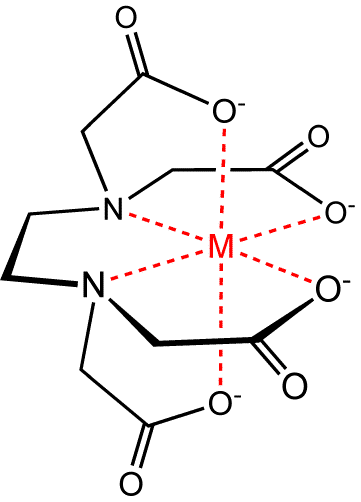
При взаимодействии с различными катионами, например, Mg2+ или Са2+ трилон Б образует различные комплексные соединения типа:
При pH=7-11 индикатор эриохром чёрный Т (эхч-Т) имеет формулу:
H2Ind- ↔ HInd2- ↔ Ind3-
рК 6,3 рК 11,5
красный синий желто-оранжевый
При pH= 7-11 когда индикатор имеет синий цвет. Многие металлы, такие как Mg2+, Ca2+, образуют с этим индикатором комплексы красного цвета:
HInd2- + Mg2+(Ca2+) ↔ Mg (Ca)Ind- + H+
cиний красный
Многие растворы для количественных определений готовили из фиксаналов (заводская фасовка): соляная, щавелевая, серная кислоты. Остальные растворы готовили из навески реагента растворением в дистиллированной воде с последующим определением нормальной концентрации или титра рабочих растворов (стандартных или титрованных растворов). При необходимости реагенты очищали перекристаллизацией или перегонкой. Отборы проб естественных растворов для исследований брали из природных водоёмов (река Днестр, Днестровский лиман), из скважин частных лиц и Незавертайловской ОШ-ДС №1, а так же из системы водоканалов регионов, в том числе и некоторых других сёл.
Экспериментальные данные тщательно анализировали, перепроверяли, уточняли и рассчитывали среднестатистические величины, которые записали затем в таблицах. Так в таблице 1 приведено содержание примесей, сухого остатка, определены значения pH и окисляемость естественных растворов по регионам республики из различных природных источников.
Из их сравнения можно сделать практические выводы: по мере приближения к Одесскому лиману, по левой стороне Днестра и в самой реке, наблюдается определенная закономерность - постепенно возрастает масса примесей сухого остатка, а также окисляемость растворов. Это вызвано, вероятнее всего, с наличием сточных вод, сбрасываемых предприятиями города Тирасполя и города Бендеры, возможно также образующихся в результате сельскохозяйственного производства. В подземных водах (скважинах) наблюдаются практически одинаковые значения pH (кислотности среды) и окисляемости естественных растворов, возможно за счёт дополнительной естественной фильтрации. Все источники слабокислые, вероятно сказывается наличие гидрокарбонатов.
Изучение ионного состава естественных растворов указывает на то, что их минерализация в частности сульфатно-хлоридно-карбонатная составляет 1-3 г/л. Однако на участке Бендеры - Тирасполь наблюдается фолуктуация до 7-10 г/л минеральных солей. Это явление очень интересное. Оно заставляет в будущем исследовать эти растворы более внимательно. Возможно, это связано с наличием варницкого бассейна минеральных вод и неглубоких карбонатных (известняковых) природных залежей. Ниже, ближе к Днестровску, эта величина уменьшается до 4 г/л.
Наличие растворимых солей кальция и магния в воде называется жесткостью воды. Она бывает временная (карбонатная) и постоянная (некарбонатная).
Временная жесткость определяется наличием в воде гидрокарбонатов кальция и магния. Она легко устраняется кипячением:
Са(НСО3)2 = СаСО3↓ + СО2↑ + Н2О Mg(НСО3)2 = MgСО3↓ + СО2↑ + Н2О
Постоянная жесткость вызвана наличием в воде хлоридов, сульфатов и других солей кальция и магния. Устранить постоянную жесткость можно с помощью добавления различных веществ, например, соды:
CaCl2 + Na2CO3 = СаСО3↓ + 2NaCl MgCl2 + Na2CO3 = MgСО3↓ + 2NaCl
Их сумма составляет общую жёсткость воды и измеряется в мг-экв/л (миллиграмм-эквивалентах на 1 л). Условно принято, что если общая жёсткость 3 мг-экв/л - это мягкий раствор (это питьевая вода); от 3 до 6,5 мг-экв/л - минерализованный раствор (минеральная вода); свыше 6,5 мг-экв/л - это жёсткие растворы или рассолы.
В реке Днестр общая жесткость изменяется в пределах 3-3,6 мг-экв/л., т.е. это относительно минерализованные естественные растворы.
Немного более минерализованными являются растворы частных скважин - до 4,0 - мг-экв/л. Пока мы используем и те и другие естественные растворы, и называем их питьевой водой.
А пил ли кто-нибудь чистую воду, которая соответствует формуле Н2O? Ответ один: нет. Такой воды в природе не существует. С научной точки зрения следует говорить, что это естественные растворы. И именно поэтому, мы решили назвать так нашу работу. То, что мы привычно называем водой, на самом деле, это естественный раствор, содержащий множество разнообразных соединений, многие из которых находятся в диссоциированном состоянии, т.е. в виде ионов, ассоциатов, гидратов.
Кроме так называемых минерализованных растворов в природе существует множество растворов органического происхождения - это соки фруктов, овощей, экстрактов трав и т.д. Один из самых распространенных растворов последнего типа в нашей республике глюцидный (виноградный сок) в основе которого глюкоза и фруктоза. Ещё в 1748 году было открыто явление осмоса - способность растворителя проникать через полупроницаемую мембрану из разбавленного в более концентрированный раствор. Когда в организме человека в лечебных целях необходимо ввести так называемый физиологический раствор, они должны иметь осмотическое давление, равное давлению плазмы крови, т.е. 0,86% - ого раствора хлорида натрия NaCl. А состав кровяного раствора, прежде всего, зависит и от наличия других веществ, других растворов.
Наши предки давно заметили действие глюцидных растворов (виноградный сок) на организм человека и успешно использовали для лечения многих заболеваний. Доказано уже и в наше время, что они могут соперничать даже с таким кардиопрепаратом, как аспирин (или ацетилсалициловая кислота).
Не менее значимы естественные растворы в жизни растений. От способа их использования зависит состояние здоровья животных, которые питаются травами - это постоянный круговорот веществ, содержащихся в естественных растворах. Здесь также большое значение имеют осмотические явления. Они определяют упругость растений, плодоношение, устойчивость к заболеваниям.
Среди работников сельского хозяйства до сих пор продолжаются дебаты, какой вид полива естественными растворами выгоднее, экономичнее, результативнее. Физико-химические факторы всегда в пользу капельного применения естественных растворов. Преимущество заключается и в том, что при таком поливе улучшается значительно и качество почвы; нет эрозии, нет загрязнений сельскохозяйственных полей, нет отчуждения целых массивов благородной почвы.
Естественные растворы под маркой «Варница» распространены под названием питьевая минерализованная вода. Однако грамотнее её применять под наблюдением врача. Она избавляет от многих недугов людей не хуже, чем дорогая и недоступная Есентуки-14 и Есентуки-17. По химическому составу они мало чем отличаются друг от друга.
Проекты недалёкого будущего окажут содействие в поиске и других источников природных растворов необходимых жителям республики - наличие радоновых растворов в городе Каменке, тёплые почвенные растворы в селе Незавертайловка по улице Чкалова.
Эти интересные исследования, можно назвать частью химической местной науки. Они служат перспективой на будущую деятельность не только учеников и их учителей, но и молодых исследователей Приднестровья.
Выводы и рекомендации.
Исследование естественных растворов Приднестровья позволили установить:
1. кислотно-щелочную среду от Каменки до Днестровска. Величина pH над почвой естественных растворов выше подпочвенных. Разница - 1 единица показателя pH - слабокислая.
2. все естественные растворы можно отнести к сульфатно-карбонатно-хлоридному типу на протяжении всей длины Днестровского бассейна.
3. жёсткость естественных растворов увеличивается по мере приближения к Днестровскому лиману. На участке Бендеры - Тирасполь заметны флуктуации в 3-7 мг-экв/л.
Состоянием естественных растворов Приднестровья и других стран бассейна реки Днестр обеспокоены участники состоявшейся в Тирасполе V Международной научно-практической конференции «Геологические и биоэкологические проблемы Северного Причерноморья». В работе конференции приняли участие более 300 ученых и представителей гражданского общества из Приднестровья, Молдовы, России, Украины, Румынии, Белоруссии, Греции, Турции и других стран.
От качества и состояния естественных растворов зависят 8 млн. человек, живущих в бассейне реки Днестр. Наша работа - лишь часть заботы и решение проблемы контроля и сохранения естественных растворов Приднестровья.
Эти выводы могут служить рекомендациями для исследователей и пользователей естественных растворов в нынешних и будущих проектах.
Вас ждут открытия - не пропустите.


Информационные источники.
-
Л.С. Гузей и др. Химия 10-11 класс. Т., 2005
-
Н.А. Измаилов. Электрохимия растворов. М.,1986
-
Б.Д. Степин и др. Неорганическая химия. М.,1999
-
Ф. Умланд и др. Комплексные соединения в аналитической химии. М.,1985
-
Дж. Фаитц и др. Количественный анализ. М.,1988
-
Химия и жизнь. М., 2001 - 2014
-
Газета «Аргументы и факты» №49, 2014. www/aif/md


