- Преподавателю
- Химия
- Разработка урока на тему Водород
Разработка урока на тему Водород
| Раздел | Химия |
| Класс | 8 класс |
| Тип | Другие методич. материалы |
| Автор | Рыбцова Г.Н. |
| Дата | 29.10.2015 |
| Формат | docx |
| Изображения | Есть |
МОУ «Разуменская средняя общеобразовательная школа №1 Белгородского района Белгородской области»
Тема урока: Водород
Цель: систематизация знаний учащихся о водороде.
Задачи:
-
Обучающие: привести в систему знания учащихся о водороде; закрепить умения применять полученные знания при объяснении новых фактов; продолжить формирование умения составлять формулы веществ, уравнения реакций, показать взаимосвязь между свойствами водорода и областями его применения, изучить способы получения водорода.
-
Развивающие: развивать мышление учащихся, память, умение работать в атмосфере поиска, творчества. Дать каждому учащемуся возможность достичь успеха, умение анализировать, сравнивать, обобщать, наблюдать, запоминать, умение давать самооценку деятельности на уроке, осуществлять самоконтроль; формировать общеучебные умения и навыки.
-
Воспитательные: воспитывать личностные качества, обеспечивающие успешность исполнительной деятельности (дисциплинированность, ответственность), творческой деятельности (активность, увлечённость, наблюдательность, сообразительность, способность к самооценке). Воспитание активности и самостоятельности при изучении темы, умения работать в группе
Методы, методические приёмы. Беседа с учащимися, работа с инструктивными картами и материалами слайдов, демонстрационный эксперимент, частично-поисковый метод.
Реактивы. Цинк, соляная кислота, оксид меди (II).
Оборудование. Раздаточный дидактический материал, таблица химических элементов Д.И. Менделеева, шкатулка, компьютер, медиапроектор; спиртовка, спички, пробирки, лабораторные штативы, кристаллизатор.
Ход урока
I. Мотивация. Актуализация знаний
Учитель: Сколько всего известно химических элементов?
Учитель: Сколько химических элементов входит в состав веществ, образующих клетки всех живых организмов?
Ученик: более 70.
Учитель: Основу жизни составляют 6 элементов первых трёх периодов (Н, С, N, О, Р, S), на долю которых приходится 98% массы живого вещества. Один из них мы сегодня будем изучать. А вот какой именно мы узнаем из загадок в шкатулочке.
Загадки
-
Первый я на белом свете:
Во Вселенной, на планете,
Превращаюсь в лёгкий гелий,
Зажигаю солнце в небе.
-
Гость из космоса пришёл,
В воде приют себе нашёл.
-
Я, газ легчайший и бесцветный,
Неядовитый и безвредный.
Соединяясь с кислородом,
Я для питья даю вам воду.
Ученик: Водород.
Учитель: Итак, тема урока: Водород. (слайд 1. См. Приложение)
II. Изучение нового материала
Учитель: Сейчас вы отправитесь в путешествие, чтобы познакомится с удивительным химическим элементом - водородом - и образованным им простым веществом. Для этого вам понадобится карточка-путеводитель. Внимательно рассмотрите её и скажите, где вы сегодня побываете и что узнаете.(слайд 2)
Карточка-путеводитель
Название станций
Книга жалоб и предложений
Спец. пометки
"Открытие водорода"
v - это я знаю
+ - новая информация
- - информация, противоречащая моим знаниям
? - информация требует пояснения
! - это интересно
"Распространение водорода"
"Визитка химического элемента"
"Физические свойства простого вещества"
"Химические свойства простого вещества"
"Получение водорода"
"Применение водорода"
"Выбери задание"
"Тест"
"Кроссворд"
Ученики: Называют станции, формулируя при этом цели и задачи урока.
Учитель: На каждой станции есть книга жалоб и предложений, где вы должны поставить специальные пометки. (слайд 3)
Станция 1: "Открытие водорода" (сообщение ученика)
Учитель: Внимательно послушайте сообщение и ответьте на вопрос: "Кто и когда открыл водород?"
Открытие водорода:
Английский ученый Генри Кавендиш в 1766 г. получил водород действием цинка, олова или железа с серной или соляной кислотой. Водород до Кавендиша получали и другие ученые, но они и не пытались изучить его свойства. Интересно отметить, что водород принимали за разновидность воздуха или флогистон. Ломоносов в своей диссертации "О металлическом блеске" писал: "При растворении какого-либо неблагородного металла, особенно железа, в кислотных спиртах из отверстия склянки вырывается горючий пар, который представляет собой флогистон".
Большинство исследователей, в том числе и Кавендиш, принимали водород за флогистон, и называли его "горючий газ". Кавендиш первым подробно описал способы получения, а так же физические и химические свойства водорода. Он установил, что водород не растворяется в воде и щелочах, при смешивании его с воздухом образуется взрывчатая смесь. Поэтому Кавендиш новому газу дал название "горючий воздух". Поскольку при действии кислот на различные металлы выделялся один и тот же газ, Кавендиш утвердился в своем мнении что водород - это флогистон. В 1781 году английский ученый, наблюдая горение водорода на воздухе: Н2 + О2= 2Н2О установил, что водород при горении превращается в чистую воду. Но он сделал неверный вывод, посчитав, что вода, вещество элементарное, т.е. простое. В 1783-1784 гг. А. Лавуазье совместно с Ж. Менье осуществили термическое разложение воды и установили, что она состоит из кислорода и водорода.
Данные Лавуазье: 85 частей кислорода и 15 частей водорода.
Современные данные: 88,9% кислорода и 11,2% водорода.
Современное название водороду дал французский физик и химик А. Гитон де Морво в 1787 году. Он предложил латинское названиегидрогениум, означающее "рождающий воду". Русское название (по смыслу такое же): вода род.
Водород стал первым известным простым газообразным веществом. Его открытие имело огромное значение для становления современной научной химии.
Станция 2: "Распространение водорода" (слайд 4)
Время стоянки 3 мин. Прочтите текст и ответьте на вопрос: Почему водород самый первый, но второй?
По распространенности в нашей Вселенной водород занимает первое место. На его долю приходится около 92% всех атомов (8% составляют атомы гелия, доля всех остальных вместе взятых - менее 0,1% ). Таким образом, водород - основная составная часть звезд и межзвездного газа. В условиях звездных температур (например, температура поверхности Солнца - 6000 °С) и межзвездного пространства, пронизанного космическим излучением, этот элемент существует в виде отдельных атомов.
Массовая доля водорода в земной коре составляет 1% - это девятый по распространенности элемент. Однако его роль в природе определяется не массой, а числом атомов, доля которых среди остальных элементов составляет -17% (второе место после кислорода, доля атомов которого равна -52%). Поэтому значение водорода в химических процессах, происходящих на Земле, почти так же велико, как и кислорода.
В отличие от кислорода, существующего на Земле и в связанном, и в свободном состоянии, практически весь водород на Земле находится в виде соединений; лишь в очень незначительном количестве водород в виде простого вещества имеется в атмосфере (0,00005% по объему).
Основным соединением водорода является вода. Кроме того, большое его количество входит в состав многочисленных соединений с углеродом (органических веществ), составляющих основу нефти, природного газа (формула метана?), угля и др. Он непременная составная часть веществ, образующих живые организмы (-6,5% от сухой массы).
Станция 3: "Визитка химического элемента" (слайд5, слайд 6 - проверка задания)
Время стоянки 3 мин. Работая в паре, определите место положения элемента в Периодической системе, металл это или неметалл, в составе какого известного вещества в виде атомов он находится, тяжелый он или легкий?
Учитель: Молекула водорода состоит из двух атомов и образована ковалентной неполярной химической связью.
Станция 4: "Физические свойства простого вещества" (слайд 7)
Время стоянки 3 мин. Работайте в парах. Запишите в тетради физические свойства простого вещества по рисунку на слайде:
Вкус:
Цвет:
Запах:
Температура кипения:
Растворение в воде:
Станция 5: "Химические свойства простого вещества" (слайд 8)
Время стоянки 15 мин. Работайте в парах. Запишите в тетради химические свойства водорода. Дайте веществам название, определите тип реакции
Химические свойства водорода:
1) + неметалл:
2Н2 + О2 = 2Н2О
Н2 + Сl2 = 2HCl
H2 + S = H2S
3H2 + N2 = 2NH3
2) + металл:
H2 + 2Na = 2NaH
H2 + Ca = CaH2
Учитель: Как вы думаете со сложными веществами водород будет реагировать? И с какими?
Ученик: С основным оксидом.
Учитель: (демонстрационный опыт: CuO + H2 = H2O + Cu)
Ученик: записывает уравнение реакции, определяет тип реакции.
Станция 6: "Получение водорода" (слайд 9, слайд 10 - проверка задания)
Время стоянки 3 мин. Работайте в парах. Запишите в тетради получение водорода. Расставьте коэффициенты в уравнениях реакций.
Получение водорода:
1) В лаборатории:
Zn + HCl = ZnCl2 + H2
2) В промышленности:
С + Н2О = СО + Н2
СН4 + Н2О = СО + Н2
Н2О = Н2 + О2
Станция 7: "Применение водорода" (слайд 11)
Время стоянки 1 мин. Работайте в парах. Запишите в тетради применение водорода, используя материал учебника схема 7, стр.76.
III. Первичная проверка усвоения знаний.
Станция 8: "Выбери задание"
Время стоянки 4 мин. Работайте самостоятельно. Выберите только те задания, с которыми вы справитесь (по выбору):
Задания минимального уровня (проверка заданий устно).
1. Мыльные пузыри, наполненные водородом, поднимаются вверх. Объясните это явление.
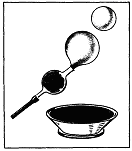
2. На каком рисунке (а или б) отображен способ "переливания" водорода из одного сосуда в другой? Ответ поясните.

Задания общего уровня (проверка заданий устно и у доски)
Запишите уравнения реакций получения водорода конверсией водяных паров:
А) с углём;
Б) с метаном.
Задания продвинутого уровня (проверка заданий устно и у доски)
Запишите уравнения реакций следующих переходов: Н2SO4 - Н2 - Н2О -Н2-Н2S
IV. Закрепление знаний
Станция 9: "Тест"
Время стоянки 5 мин. Работайте самостоятельно. Выберите один правильный ответ:
1. Водород является продуктом взаимодействия:
1) Cu + HCl;
2) Zn + HCl;
3) Cu + H2O;
4) S + NaOH
2. Укажите валентность фосфора в водородном соединении:
1) I;
2) II;
3) III;
4) V
3. Индивидуальным веществом является:
1) чугун;
2) водород;
3) соляная кислота;
4) воздух.
4. Водород не реагирует с:
1) N2;
2) S;
3) O2;
4) HCl
5. Химические свойства водорода используются при:
1) получении сверхнизких температур;
2) наполнении стратостатов и шаров-зондов;
3) получении металлов из их оксидов;
4) отводе теплоты в электрических машинах.
6. Водород в лаборатории получают взаимодействием:
1) железа с водой;
2) натрия с водой;
3) оксида кальция с водой;
4) цинка с соляной кислотой.
7. Формула продукта реакции и коэффициент перед ней в уравнении реакции взаимодействия водорода с хлором:
1) HCl;
2) 2HCl;
3) 3HCl;
4) 4HCl
8. Водород реагирует:
1) только с простыми веществами;
2) с простыми и сложными веществами;
3) только со сложными веществами;
4) только с неметаллами.
9. Водород реагирует с:
1) Н2О;
2) SO3;
3) Cl2;
4) Au
10. В промышленности водород не получали и не получают взаимодействием:
1) метана с водой;
2) железа с водой;
3) электролизом воды;
4) цинка с соляной кислотой.
Ученики: выполнив задание, меняются тетрадями друг с другом, проверяют и выставляют оценки.
Учитель: Правильные ответы:
1-2
Критерии оценок: (слайд 12)
2-3
"5" - 0-2 ошибки
3-2
"4" - 3-4 ошибки
4-4
"3" - 5-6 ошибок
5-3
"2" - более 6 ошибок
6-4
7-2
8-2
9-3
10-4
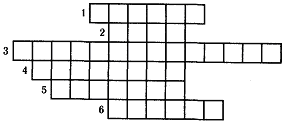
Станция 10: "Кроссворд" (резерв)
Время стоянки 3 мин. Работайте в парах.
Ключевым словом является название ближайшей к Земле звезды, на которой преобладает химический элемент водород. Каждое предложенное химическое явление подтвердите соответствующими уравнениями химических реакций.
-
Сложные вещества, при взаимодействии которых с водородом получают металлы.
-
Вещество, которое образуется при горении водорода в кислороде.
-
Кислоты, состоящие из атомов водорода и другого химического элемента.
-
Кислота, которая легко разлагается на оксид углерода (IV) и воду.
-
Металл, непосредственно взаимодействующий с водородом.
-
Кислота, по уровню производства которой можно судить о мощности химической промышленности страны.
V. Подведение итогов урока
Фронтальная беседа/
VI. Информация о домашнем задании
(слайд 13)
Учитель: параграф 17; упр. № 3,4 на стр.103.
Библиографический список.
-
Габриелян О.С. Химия. 9 класс: учеб. для общеобразоват. учреждений/ О.С.Габриелян. - 12-е изд., стереотип. - М.: Дрофа, 2007.
-
Горковенко М.Ю. Химия. 8 класс: Поурочные разработки к учебникам О.С.Габриеляна; Л.С.Гузея, В.В.Сорокина, Р.П.Суровцевой; Г.Е.Рудзитиса, Ф.Г.Фельдмана. - М.: ВАКО, 2013.
-
В.Г.Денисова. Химия.8класс. Поурочные планы. Волгоград: Учитель,2003.-89С
-
Занимательная химия на уроках 8-11классах: тематические кроссворды/сос.О.В. Галичкина..-Волгоград: Учитель,2005.-119С
-
Катаева Л.Г., Толкачева Т.К. Химия: Карточки-задания по неорган. химии: 8 кл.: Кн. для учителя. - М.: Просвещение, 2014
-
Научно-теоретический и методический журнал "Химия в школе", №10 2002год, №3 2004 год, №4 2008 год.
-
Г.Е.Рудзитис, Ф,Г, Фельдман. Химия Неорганическая химия. 8класс :учеб. для общеобразоват. учреждений с прил.на электр. носителе / Г.Е.Рудзитис, Ф.Г.Фельдман.-15 издание.-М: Просвещение,2011.-176с.
-
Учебно-методическая газета для учителей "Химия" Издательский дом " Первое сентября": №10, 24 2008 год: № 2 2009 год.


