- Преподавателю
- Химия
- Исследовательская работа ученика по теме Как и отчего разрушаются металлы
Исследовательская работа ученика по теме Как и отчего разрушаются металлы
| Раздел | Химия |
| Класс | 7 класс |
| Тип | Другие методич. материалы |
| Автор | Подкладова Л.М. |
| Дата | 02.01.2016 |
| Формат | docx |
| Изображения | Есть |
МуниципальноЕ БЮДЖЕТНОЕ общеобразовательнОЕ учреждениЕ
«Средняя общеобразовательная школа № 37
с углублённым изучением отдельных предметов»
г. Выборг, Ленинградская область
Научно-практическая конференция:
«Моё открытие»
Направление: Химия
Работа: Как и отчего разрушаются металлы
Автор работы
Кочнев Владислав
Научный руководитель Подкладова Л.М., учитель химии
2015 год
Содержание:
1.
2.
3.
4.
5.
6.
7.
Введение. ………………………………………………..
Что я прочитал о коррозии. ……………………………
Исследование влияния среды растворов на коррозию металлов. ………………………………………………..
Значение коррозии. ………………………………………
Способы защиты металлов от коррозии. ……………….
. Вывод. …………………………………………………...
. Список используемой литературы. ……………………
Стр.3
Стр.5
Стр.8
Стр.11
Стр.12
Стр.13
Стр.15
-
Введение.
Когда говорят о прочности или стойкости чего - либо, используют фразы - «прочный как сталь», «железные нервы», «стальной характер». Я узнал, что сталь в основном состоит из железа. Железные изделия широко используются в быту и в технике. Они сделаны не из чистого железа, а из сплавов этого металла с другими металлами и неметаллами - стали и чугуна.
Является ли железо абсолютно прочным металлом?

В Историческом музее г. Выборга, я увидел, что когда-то блестящие и прочные булавы и топоры, и другие металлические изделия почти полностью разрушены или покрыты толстым слоем ржавчины, если они были оставленные в земле или находились в сыром помещении. Следовательно, металлы далеко не такие прочные, как об этом гласит народная молва.

3
Процесс разрушения металлов и изделий из них под воздействием окружающей среды называется коррозией. Коррозия железа в природе сопровождается образованием ржавчины, поэтому русская поговорка говорит: «Ржа ест железо».


В Московском Кремле есть Царь - пушка, которую в 1586 г. отлил русский мастер Андрей Чохов. Там же находится Царь - колокол, изготовленный мастерами Моториными в 1733 г.
За это время они покрылись слоем соединений железа - оксидов, но не разрушились.

В Индии находится Делийский железный «столб счастья», который знаменит тем, что он стоит более тысячи лет и не подвергся разрушающему действию коррозии.
4
2. Что я прочитал о коррозии
Я заинтересовался, что представляет собой процесс коррозии и какие факторы на него влияют.
Используя «Иллюстрированный энциклопедический словарь» и Интернет, я исследовал, что представляет собой коррозия.

Термин коррозия происходит от латинского слова corrodere, что означает разъедать, разрушать.
Коррозия металлов - физико-химическое воздействие металлических материалов и окружающей среды, которое приводит к понижению выносливости и прочности материала, вплоть до его разрушения. При коррозии железа и сталей во влажной атмосфере обычно образуются оксиды железа в виде ржавчины.
 5
5
Все металлы, за исключением золота, платины и серебра, встречаются в природе в виде соединений с кислородом, серой и в виде солей. Чтобы их получить в чистом виде, необходимо затратить химическую или электрическую энергию. При этом из устойчивого состояния в виде сложного вещества, металл переводят в простое вещество - неустойчивое состояние.
Коррозия металлов -это процесс перехода металлов в то естественное состояние, в котором они встречаются в природе.
Почему же при некоторых условиях металлы быстро, а при других медленно, подвергаются коррозии?
Химическая коррозия.
Кислород воздуха взаимодействует с поверхностным слоем металла, при этом образуется пленка из соединений металлов с кислородом - оксидов металлов. Она образуется в условиях сухого воздуха и при комнатной температуре, и при нагревании. Такую коррозию называют химической. Пленка может быть прочной и препятствовать дальнейшему процессу коррозии (цинк, алюминий, хром).
 6
6
Под влиянием водных растворов солей и кислот металлы разрушаются быстрее, чем от действия кислорода.
На скорость коррозии металла влияет его природа. Существует ряд активности металлов. Чем левее расположен металл в этом ряду, тем он активнее. Железо расположено посередине ряда, значит является металлом средней активности.
Электрохимическая коррозия.

Если два металла разной природы поместить в раствор соли, то более активный начнёт быстро разрушаться, и между металлами возникает электрический ток.

7
3. Исследование влияния среды растворов на коррозию металлов.
В своей работе я решил выяснить, как влияют внешние условия на скорость коррозии железа в водных растворах, в чистой воде и в контакте железа с другими металлами, более активными и менее активными.
С этой целью я использовал железные гвозди (Fe), медную проволоку (Cu), цинковую пластинку (Zn), раствор поваренной соли(NaCl), раствор щёлочи (NaOH), соляную кислоту (HCl), дистиллированную воду (H2O)
Гвозди помыл с мылом, высушил, зачистил наждачной бумагой и промыл кипячёной водой.
Поместил железный гвоздь в пробирку, наполнил её доверху водой и опрокинул, зажав отверстие пробкой, в сосуд с водой. После чего вынул пробку и вытеснил воду из пробирки кислородом. (№ 6)
Таким же образом заготовил другие пробирки с гвоздями, но вместо чистой воды в пробирки и сосуды, в которые они будут опрокинуты, налил в раствор поваренной соли - хлорида натрия. (№ 1 - 5)
В одном случае к этому раствору добавил немного раствора гидроксида натрия (№ 2), в другом - соляной кислоты (№ 3).
К одному из гвоздей заранее прикрутил медную проволоку (№ 4), к другому - полоску цинка (№5).
Спустя два дня я наблюдал результат, который изображён на рисунке 1. О скорости протекания коррозия в каждом случае, я узнал по объёму израсходованного кислорода, то есть по поднятию уровня жидкости в пробирке (кислород расходуется на реакцию, его место занимает раствор): если уровень раствора в пробирке большой, то коррозия проходила быстро. Характер осадка в растворе показал продукт коррозии.
Химическая коррозия - № 1, 2, 3, 6.
Электрохимическая коррозия - № 4, 5.
8
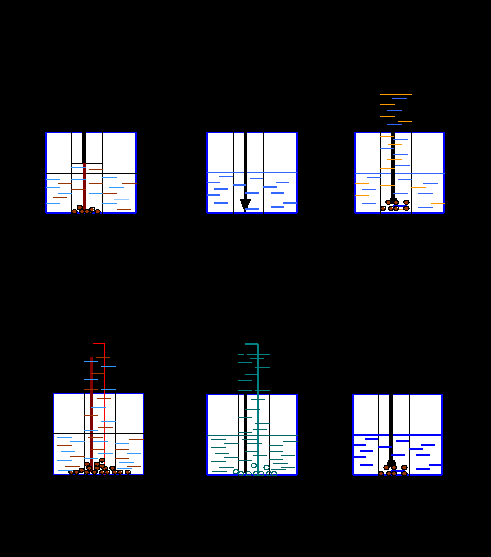
Я сравнил результаты опытов 1 и 4. В обоих случаях железо находилось в одном и том же растворе. Однако в одном случае оно соприкасалось с медью. В обеих пробирках прошла коррозия, появился осадок бурой ржавчины. В опыте 4 - много ржавчины, а в опыте 1 ржавчины мало. Значит коррозия железа резко усиливается, когда оно соприкасается с медью (медь в ряду активности стоит правее железа, то есть она менее активна).
Я сравнил результаты опытов 1 и 5. В этих пробирках железо находилось в одном и том же растворе, но в пробирке 5 оно соприкасалось с цинком (цинк в ряду активности стоит левее железа, то есть он более активен).
9
В опыте 1 осадок коричневый - это ржавчина. В опыте 4 осадок белый - это продукт окисления цинка. Значит, в опыте 4 разрушившийся металл цинк, а не железо. Железо, если оно соприкасается с цинком, коррозии не подвергается.
Результаты опытов 1 и 6 показали, что если добавить к воде поваренную соль, коррозия железа усиливается: израсходовался кислород и образовалось больше ржавчины.
Результаты опытов 1 и 2 показали, что добавка к раствору поваренной соли гидроксида натрия ослабила коррозию, ржавчины получилось очень мало.
Результаты опытов 1 и 3 показывают, что добавка к раствору хлорида натрия соляной кислоты ослабила коррозию: ржавчины получилось мало, но кислород израсходовался, а раствор стал жёлтым (может, ржавчина растворилась в кислоте?).

№
проби
рки
Среда
Уровень жидкости
в пробирке
Следы коррозии
Вид коррозии
1
Раствор NaCl
Поднялся
немного
Наблюдаются
ржавчина
Химическая.
2
Раствор NaCl + NaOH
Не поднялся
Нет
ржавчины
Химическая.
3
Раствор NaCl + HCl
Поднялся
Наблюдаются
ржавчина
Химическая.
4
Раствор NaCl +
Fe + Cu
Сильно поднялся
Большое количество ржавчины
Электрохимическая.
5
Раствор NaCl +
Fe + Zn
Сильно поднялся
Следы коррозии Fe отсутствуют, коррозия Zn (белый осадок)
Электрохимическая
6
H2O
Поднялся
немного
Наблюдаются
ржавчина
Химическая.
10
4.Значение коррозии.
Коррозия приводит к засорению нашей планеты. В настоящее время на земном шаре ежегодно выплавляется более 0,7 млрд т стали, а уничтожается коррозией от 10 до 25% этой величины. Средняя продолжительность жизни стальных изделий составляет около 15 лет. Таков же средний возраст изделий из многих других металлов.
Коррозия металлов выводит из строя трубопроводы, разрушает опоры зданий, транспортные средства. Это приводит к различным катастрофам.
Коррозия металлов создаёт экологические последствия: утечка нефти, газа и других химических веществ.
Коррозия металлов недопустима во многих отраслях промышленности: авиационной, химической, нефтяного и атомного машиностроения.
Коррозия металлов отрицательно влияет на жизнь и здоровье людей.
Коррозия, подобно ненасытному дракону, уничтожает миллиарды тонн железа и приносит громадный ущерб во всех странах.
11

5. Способы защиты металлов от коррозии.
Все применяемые методы защиты металлов можно разделить на три группы:
А. Различные покрытия.


Для предохранения металлических изделий от коррозии их изолируют от внешней среды, покрывая лаками, красками, смазками, защитными слоями других металлов. Покрытие должно быть стойким в данной среде, достаточно плотным и иметь хорошее сцепление с металлом.
12
Б. Обработка среды, в которой металлы находятся.
Для замедления коррозии следует также удалить кислород из раствора, в который погружен металл. Наиболее просто удалить кислород можно кипячением и созданием бескислородной атмосферы.
Для того, чтобы замедлить коррозию металл можно помещать в щелочную среду.
Соли в растворах усиливают процесс коррозии, поэтому нужно использовать вещества, замедляющие коррозию - ингибиторы.
В. Электрохимические методы защиты.

Получение антикоррозионных сплавов.
Для предохранения от коррозии металлических трубопроводов и корпусов судов пользуются защитным действием других, более активных металлов - протекторов, например, цинка.

13
Вывод.
В ходе проведённого исследования я сделал открытие:
-
Разрушение металла под воздействием внешней среды называется коррозией, которая бывает химической и электрохимической.
-
Скорость коррозии металла зависит от состава среды, в которой находится металл.
-
Одни составные части среды усиливают коррозию металлов, другие - уменьшают коррозию, особенно, если среда жидкая.
-
Скорость коррозии металла, помещённого в раствор, значительно зависит от контакта с другим металлом. Контакт металла с менее активным металлом усиливает его коррозию, с более активным - замедляет.
-
Скорость электрохимической коррозии больше, чем химической.

14
6. Список использованной литературы.
-
Терра - Лексикон: Иллюстрированный энциклопедический словарь. М.:ТЕРРА 1998
-
Балезин С.А. Отчего и как разрушаются металлы. М. «Просвещение» 1976
-
Улиг Г.Г., Реви Р.У. Коррозия и борьба с ней. - Л.: Химия, 1989.
-
Косачев В.Б.: Гулидов А.П. Коррозия металлов-М.: НПК «Вектор», 2007
-
Розенфельд И. Л. Атмосферная коррозия металлов - М., 1960;
-
Ходаков Ю.В., Эпштейн Д.А., Глориозов П.А. Неорганическая химия
9 класс. 1976
-
Габриелян О.С., И.Г.Остроумов, А.К.Ахлебинин. Химия. Вводный курс - 7 класс. М. Дрофа 2014
-
Слайды и картинки:
yandex.ru/images/search?img_url=http%3A%2F%2F900igr.net%2Fdatas%2Fkhimija%2FKorrozija%2F0009-009-Faktory-vyzyvajuschie-korroziju.jpg&_=1454778307564&p=2&text=%D0%BA%D0%B0%D1%80%D1%82%D0%B8%D0%BD%D0%BA%D0%B8%20-%20%D0%BA%D0%BE%D1%80%D1%80%D0%BE%D0%B7%D0%B8%D1%8F%20%D0%BC%D0%B5%D1%82%D0%B0%D0%BB%D0%BB%D0%BE%D0%B2%20%D0%B8%20%D1%81%D0%BF%D0%BE%D1%81%D0%BE%D0%B1%D1%8B%20%D0%B7%D0%B0%D1%89%D0%B8%D1%82%D1%8B%20%D0%BE%D1%82%20%D0%BD%D0%B5%D0%B5&noreask=1&pos=65&rpt=simage&lr=2
15


