- Преподавателю
- Химия
- Методическая разработка раздела учебной программы по химии
Методическая разработка раздела учебной программы по химии
| Раздел | Химия |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Каравашкина А.И. |
| Дата | 16.12.2014 |
| Формат | docx |
| Изображения | Есть |







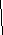






Муниципальное образовательное учреждение
Шараповская средняя общеобразовательная школа
Методическая разработка раздела учебной программы по химии «Растворение. Растворы. Свойства растворов электролитов»
Учитель: Каравашкина Альбина Ивановна
2014 год
СОДЕРЖАНИЕ
1. Пояснительная записка ……………………………………………………………….2
2. Цели и задачи раздела «Растворение. Растворы.
Свойства растворов электролитов» …………………………………………………….3
3. Психолого-педагогическое объяснение специфики восприятия и освоения учебного материала учащимися 8 класса………………………………………………………....4
4. Ожидаемые результаты освоения раздела программы «Растворение. Растворы. Свойства растворов электролитов» …………………………………………………….6
5. Обоснование используемых в образовательном процессе по разделу «Растворение. Растворы. Свойства растворов электролитов» образовательных технологий, методов, форм организации деятельности учащихся ……………………………………………8
6. Система знаний и система деятельности…………………………………………….18
7. Календарно-тематическое планирование раздела «Растворение. Растворы. Свойства растворов электролитов» ……… ……............................................................................20
8. Разработка урока по теме «Химические свойства солей»………………………... 22
9. Литература ………………………………………………………….…………….. …..28
10. Приложения …………………………………………………………………………..29
-
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Методическая разработка темы «Растворение. Растворы. Свойства растворов электролитов» предназначена для учащихся 8 классов. Она составлена на основе программы курса химии для 8-11 классов общеобразовательных учреждений автора О.С.Габриеляна. Курс, предложенный Олегом Сергеевичем Габриеляном, построен на основе концентрической концепции химического образования для основной школы. Особенность ее состоит в том, чтобы сохранить присущий русской школе высокий теоретический уровень и сделать обучение максимально развивающим.
Данная тема является одной из важных составляющих курса химии, так как знание химических свойств важнейших классов неорганических соединений содействует углублению понятий о веществе и химической реакции. Знания учащихся поднимаются на качественно новый этап. Необходимость выявлять ионную сущность реакции требует иного осмысления химических процессов и формирования новых умений. Тема создает теоретическую базу для изучения всего остального курса химии, служит для переосмысливания уже пройденной части курса, т. е. способствует развитию имеющихся у учащихся понятий.
Содержание темы включено в обязательный минимум содержания школьного химического образования и является основополагающей для дальнейшего изучения химии в школьном курсе. Вопросы и задания по данной теме находят место в Едином Государственном Экзамене по предмету. Поэтому в процессе изучения школьного курса химии следует обращать особое внимание на изучение данной темы и усвоение основных понятий.
Освоение знаниями и овладение умениями и навыками по теме служит фундаментом для изучения дальнейшего курса химии. Теория электролитической диссоциации - одна из ведущих теорий курса химии. Причины важности изучения темы заключаются не только в том, что она имеет большое практическое значение, но и во взаимосвязи этой темы со многими курсами химических дисциплин, а так же с другими естественными дисциплинами.
Таким образом, трудно переоценить значение темы для формирования предметной - химической компетенции обучающихся.
Во-первых, происходит углубление и развитие понятий об основных классах неорганических веществ (соли, кислоты, основания), изучаются механизмы реакций между электролитами в растворах, вводится большое число новых понятий, расширяются ранее изученные.
Во-вторых, тема является теоретической базой для понимания химических свойств отдельных элементов и их соединений и служит основой для изучения отдельных групп химических элементов в дальнейшего.
В-третьих, тема имеет огромный потенциал для дальнейшего развития учащихся на основе эксперимента и постановки проблемных вопросов.
В-четвертых, продолжается формирование научного мировоззрения, которое поможет учащимся объяснять многие явления действительности.
-
ЦЕЛИ И ЗАДАЧИ РАЗДЕЛА «РАСТВОРЕНИЕ. РАСТВОРЫ. СВОЙСТВА РАСТВОРОВ ЭЛЕКТРОЛИТОВ»
В рассматриваемой теме изучается теория электролитической диссоциации. Она является очередной теоретической платформой, способствует развитию учения о периодичности, вносит дополнительные представления в систему знаний о строении вещества и базируется на уже известной учащимся теории химической связи. В ней показано под влиянием каких причин может произойти разрыв связей и как это происходит, а также какими свойствами обладают водные растворы электролитов и почему.
Цель изучения темы: расширить и углубить знания о важнейших классах неорганических соединений в свете теории электролитической диссоциации и окислительно-восстановительных реакций.
Образовательные задачи темы - сформировать понятие о сущности, механизмах, условиях процесса диссоциации, понятие о веществах-электролитах, о поведении ионов в растворе и реакциях между ними. Раскрыть принципы классификации, сущность химических реакций, отражающих химические свойства важнейших классов неорганических соединений.
Задачи развития учащихся развивать экспериментальные умения через выполнение практических задач; умение выделять главное в изученном материале, классифицировать, сравнивать, обобщать изученные факты, разрешать проблемные ситуации через выдвижение и проверку гипотез.
Воспитательные задачи: формировать научное мировоззрение, важнейшие философские категории и закономерности, убеждение в познаваемости мира. Способствовать повышению мотивации к учебной деятельности.
3. ПСИХОЛОГО - ПЕДАГОГИЧЕСКОЕ ОБЪЯСНЕНИЕ СПЕЦИФИКИ ВОСПРИЯТИЯ И ОСВОЕНИЯ УЧЕБНОГО МАТЕРИАЛА УЧАЩИМИСЯ 8 КЛАССА
То, что каждому возрасту соответствует свой уровень физического, психического и социального развития, общеизвестно и не требует особых доказательств. Возрастные особенности - это наиболее характерные для каждого возрастного периода детей и учащихся особенности их физического, психического и социального развития. Восьмиклассники относятся к подростковому возрасту. В подростковом возрасте серьезно изменяются условия жизни и деятельности школьника, что приводит к перестройке психики, ломке старых, сложившихся форм взаимоотношений с людьми. В 8 классе школьники переходят к систематическому изучению основ наук. А это требует от психической деятельности более высокого уровня: глубоких обобщений и доказательств, понимания более сложных и абстрактных отношений между объектами, формирования отвлеченных понятий.
Расширение связей с окружающим миром, широкое всепоглощающее общение со сверстниками, личные интересы и увлечения также снижают непосредственный интерес подростков к учению. Сознательно-положительное отношение ребят к учению возникает тогда, когда учение удовлетворяет их познавательные потребности, благодаря чему знания приобретают для них определенный смысл как необходимое и важное условие подготовки к будущей самостоятельной жизни.
Наиболее существенную роль в формировании положительного отношения подростков к учению играют идейно-научная содержательность учебного материала, его связь с жизнью и практикой, проблемный и эмоциональный характер изложения, организация поисковой деятельности, дающей учащимся возможность переживать радость самостоятельных открытий, вооружение подростков рациональными приемами учебной работы, являющимися предпосылкой для достижения успеха.
Другая форма выражения мотивов учения - наличие учебных интересов. Учебные интересы, как правило, избирательны. Учебный интерес зависит от того, насколько связан материал с внеучебными интересами, насколько ясно и понятно излагает материал учитель, насколько активны и разнообразны методы обучения. Поэтому целесообразно проводить уроки с использованием элементов игровых технологий. Игровая форма должна сопровождаться яркими демонстрациями. В данном случае они целесообразны, так как оказывают эмоциональное воздействие на подростка, включают его в игровую ситуацию и в тоже время активизируют мыслительную деятельность. Подобные уроки необходимы детям среднего школьного возраста: они помогают развить воображение, творческие способности, прививают интерес к изучаемому разделу. Но превращать их в главную форму работы, вводить их на каждом уроке нецелесообразно из-за большой потери времени, невысокой результативности. Поэтому нужны и учебные занятия со строгой структурой и установленным режимом работы.
Роль учителя заключается в том, чтобы создавать у учащихся соответствующую установку, указывая на то, что нужно запомнить на время, что - навсегда, а что совсем не следует запоминать, достаточно просто понять. Знание психологических особенностей подросткового возраста, мотивов учения и усвоения знаний школьниками этого возраста - необходимое условие организации наиболее продуктивной учебной работы с ними.
Если в процессе первого года обучения химии не соблюдать выше перечисленные особенности учащихся, вид восприятия и развития, невозможно обеспечить оптимальные темп и уровень усвоения учебного материала.
Психологи утверждают, что 8 класс - пик эмоциональной неуравновешенности. Это может приводить к ухудшению дисциплины, особенно на последних уроках или после контрольных работ. Возрастает обидчивость, раздражительность. Даже незначительное замечание нередко приводит к бурной реакции.
Н.Ф.Талызина дает характеристику данного возраста с применением частицы НЕ:
Не хотят учиться так, как могут
Не хотят слушать советы
Не приходят вовремя
Не хотят слушать педагога
Также для учеников 8 класса характерны:
-
Снижение самооценки
-
Рассеянность, несобранность на уроках
-
Борьба за самостоятельность
-
Обидчивость, раздражительность, упрямство
-
Переутомление, снижение внимания (особенно после 4 урока).
С другой стороны, в процессе изучения темы «Растворение. Растворы. Свойства растворов электролитов» учащимися должно быть усвоено в среднем около двадцати четырех новых понятий и закреплено восемнадцать раннее изученных за сравнительно небольшой промежуток времени. Это при том, что автор учебника использует традиционный подход к изложению учебного материала. К тому же, тема является основополагающей для последующего изучения химии и содержит большое количество вопросов, входящих в задания Единого Государственного Экзамена по предмету, поэтому следует обращать особое внимание контролю за уровнем усвоения материала.
Таким образом, тема « Растворение. Растворы. Свойства растворов электролитов» является сложной как для объяснения учителем, так и для усвоения учащимися по ряду причин:
-
большим количеством новых понятий,
-
избытком информации в текстах учебника
-
возрастными особенностями учащихся 8 класса
Налицо противоречие между важностью и значимостью этой темы и сложностью её усвоения. Если в процессе первого года обучения химии не соблюдать выше перечисленные особенности учащихся 8 класса, вид восприятия и развития, невозможно обеспечить оптимальные темп и уровень усвоения учебного материала, что подтверждает актуальность данной методической разработки, направленной на разрешение этого противоречия.
-
ОЖИДАЕМЫЕ РЕЗУЛЬТАТЫ ОСВОЕНИЯ РАЗДЕЛА ПРОГРАММЫ «РАСТВОРЕНИЕ. РАСТВОРЫ. СВОЙСТВА РАСТВОРОВ ЭЛЕКТРОЛИТОВ»
Учащиеся будут знать /понимать:
-
определение понятия «растворы», «электролит», «неэлектролит», «электролитическая диссоциация», «сильный электролит», «слабый электролит», «окислитель», «восстановитель», «окисление», «восстановление»
-
условия растворения веществ в воде
-
сущность процесса электролитической диссоциации, реакций ионного обмена
-
основные положения теории электролитической диссоциации
-
принципы классификации оксидов. кислот, оснований и солей
-
химические свойства электролитов в свете ТЭД и ОВР
-
генетическую связь важнейших классов неорганических соединений
Учащиеся будут уметь:
-
различать электролиты и неэлектролиты
-
пользоваться таблицей растворимости
-
составлять уравнения, отражающие процесс диссоциации элктролитов
-
составлять уравнения, отражающие химические свойства электролитов в молекулярном и ионном виде
-
проводить химический эксперимент по свойствам растворов электролитов
-
производить расчёты по химическим уравнениям на нахождение количества вещества, массы, объема
-
определять окислители и восстановители, отличать окислительно - восстановительные реакции от других типов реакций
-
распознавать опытным путем: растворы кислот и щелочей, хлорид - , сульфат -, карбонат - ионы.
-
определять качественный состав веществ, пользуясь таблицей определения ионов
-
определять среду раствора с помощью индикаторов.
-
прогнозировать возможность протекания реакций ионного обмена
-
анализировать, применять информацию для решения проблем
-
пользоваться различными источниками информации: учебник, слово учителя, дополнительная литература, электронные пособия, интернет -ресурсы, эксперимент
-
представлять химическую информацию в различных видах (читать и писать формулы веществ и уравнения химических реакций, оформлять результаты экспериментов
5. ОБОСНОВАНИЕ ИСПОЛЬЗУЕМЫХ В ОБРАЗОВАТЕЛЬНОМ ПРОЦЕССЕ ПО РАЗДЕЛУ «РАСТВОРЕНИЕ. РАСТВОРЫ. СВОЙСТВА РАСТВОРОВ ЭЛЕКТРОЛИТОВ» ОБРАЗОВАТЕЛЬНЫХ ТЕХНОЛОГИЙ, МЕТОДОВ, ФОРМ ОРГАНИЗАЦИИ ДЕЯТЕЛЬНОСТИ ОБУЧАЮЩИХСЯ
Цели и содержание определяют выбор методов, обеспечивающих в должной мере формирование знаний и умений учащихся. Для темы «Растворы. Растворение. Свойства растворов электролитов» это прежде всего проблемный подход. Главная проблема - установить зависимость свойств электролитов от свойств ионов, на которые они распадаются в растворе. Для ее решения необходимо ответить на вопросы: Почему электролиты проводят электрический ток, а неэлектролиты не проводят? Почему ионные и полярные соединения диссоциируют на ионы, а неполярные - нет? Что влияет на диссоциацию - растворитель или электрический ток? Существуют ли различия между атомом и ионом? И т. д.
Узловым в теме «Растворы. Растворение. Свойства растворов электролитов» как и в целом в курсе химии, является понятие о веществе, в данном случае - веществе-электролите, поэтому в процессе изучения темы сначала отмечаем различия между электролитами и неэлектролитами как исходный факт, а затем уже рассматриваем сущность процесса диссоциации и вскрываем причины, в результате которых он может осуществляться. Такая последовательность изучения - от фактов к их теоретическому объяснению - способствует использованию проблемного обучения. С другой стороны, для успешного изучения теории электролитической диссоциации необходим демонстрационный и лабораторный эксперимент, которым эта тема очень богата. Поэтому на уроках часто применяю проблемный эксперимент.
Например, при изучении свойств кислот, как правило, весь класс хорошо усваивает, что металлы, стоящие в ряду активности после водорода не вытесняют его из кислот. На опыте убеждаемся, что например, серная кислота не реагирует с медью. Демонстрирую учащимся голубой раствор сульфата меди II.
- Медь не реагирует с серной кислотой, как же получили соль сульфат меди II?
Возникает проблема, требующая разрешения. Учащиеся предлагают гипотезы для её разрешения. Одна из них- использовать вместо меди другое вещество. Гипотеза подкрепляется теоретическим фактом, изложенным на страницах учебника: кислоты реагируют не только с металлами, но и с их оксидами и гидроксидами. После этого лабораторный опыт «Взаимодействие оксида меди II с серной кислотой» приобретает большую значимость и выполняют его учащиеся с большей осознанностью, видят в нем химическую закономерность, а не просто внешний эффект.
Схема применения проблемного эксперимента
Практическая реализация проблемного эксперимента
Проблемная демонстрация
Демонстрация раствора сульфата меди II и отсутствия видимых признаков химической реакции в пробирке с серной кислотой и медной проволокой.
Проблема
-Как можно получить раствор этой соли, если известно, что серная кислота не взаимодействует с медью?
Гипотеза
-Нужно использовать вместо меди другое вещество.
Теория, подтверждающая правильность (ошибочность) гипотезы
Кислота + оксид металла = соль + вода
CuO+H2O4 = CuSO4 +H2O
Новый вывод, новое знание
Раствор сульфата меди II можно получить взаимодействием серной кислоты с оксидом меди II
Проверочный эксперимент, подтверждающий новое знание
Лабораторный опыт «Взаимодействие оксида меди II с серной кислотой». Сравнение образовавшегося в пробирке раствора с демонстрируемым раствором.
В проблемном ключе, например, мы изучаем тему «Основания в свете ТЭД». После изучения классификации оснований предлагаю восьмиклассникам среди реактивов найти основания. Все получают одинаковый результат: находят только растворы щелочей. Возникает необходимость получить нерастворимые основания. Предлагаю, используя таблицу растворимости, выполнить следующие шаги:
-
подобрать формулы веществ для недописанного уравнения реакции обмена:
? + ? = Fe(OH)2 + ?
? + ? = Cu(OH)2 + ?
-
осуществить реакцию практически
На протяжении нескольких лет в 8-х классах с успехом проходит изучение оксидов с применением проблемного эксперимента. После изучения химических свойств основных оксидов даю задание дописать уравнения возможных реакций, среди них следующее:
СuSO4 + Na2O =
Восьмиклассники усвоили, что основные оксиды не могут реагировать с солями и перчёркивают знак равенства. Предлагаю проверить возможность протекания реакции на опыте: добавить к раствору медного купороса порошок оксида натрия. Учащиеся наблюдают признаки химической реакции: изменение цвета, выпадение осадка. Возникает напряжённая учебная ситуация. Если долгое время не рождается решение, даю подсказку: напоминаю, что в опыте используется раствор сульфата медиII. Ситуация разрешается предположением о возможности поэтапного взаимодействия веществ:
Na2O + H2O = 2 NaOH
2NaOH + CuSO4 = Na2SO4 + Cu(OH)2 (cиний осадок)
Далее проводим проверочный эксперимент согласно приведённым выше уравнениям, сравниваем осадки в контрольной и экспериментальной пробирках. Так, экспериментальным путём восьмиклассники самостоятельно приобретают убеждение в том, что основные оксиды не взаимодействуют с солями.
Наряду с интерактивными заданиями неотъемлемым атрибутом изучения темы являются демонстрационные карточки с формулами, которые многократно используются нами для классификации веществ по различным признакам. Применяя элементы технологии критического мышления, предлагаю, например,
-
разделить карточки NaOH CuCl2 H2 SO4 C6 H12O6 P2 O5 Ca(OH)2 K2 S Zn(OH)2
Сначала на 2 группы, затем на 3 группы;
Ответ: на 2 группы: электролиты, неэлектролиты, на 3 группы: неэлектролиты, сильные электролиты, слабые электролиты.
Или:
-
разделить карточки с формулами кислот HCl HNO3 H2S H2CO3 H2SO4 H2SO3 H3PO4
На 2 группы, на 4 группы
Ответ: на 2 группы: бескислородные, кислородсодержащие
На 3 группы: одноосновные, двухосновные, трёхосновные
Игровые технологии использую на этапе закрепления или актуализации опорных знаний учащихся. Ни для одного учителя химии не секрет, что проблема ошибочного составления формул некоторыми учащимися остаётся открытой вплоть до окончания 8 класса, а иногда сохраняется и в 9. К её решению я подхожу целенаправленно, уделяя 2-3 минуты каждого урока отработке навыков по составлению формул и названий веществ Во многом этому способствуют дидактические игры химическое лото, домино - для парной работы, головоломки (например «Логический круг»), ребусы - для индивидуальной работы.
Изучение теоретических аспектов компетентностного подхода к обучению заставило меня пересмотреть отношение к игровым технологиям в том плане, что они не новы в педагогической практике. Я увидела множество преимуществ использования, например, игры «Домино». У нас в кабинете несколько комплектов этой игры по разным классам веществ. Восьмиклассники работают в парах. Если составляемая из формул и названий цепочка не замыкается, они самостоятельно отыскивают ошибку и исправляют её, если же замыкается, то производят самооценку: «Всё правильно!», т.е. формируются навыки саморегуляции собственной деятельности. Наиболее существенным моментом считаю отсутствие внешнего побуждения к исправлению ошибки. Оно заложено в самих правилах игры.
Головоломка «Логический круг»
Используя модель, составьте формулы по зарядам ионов. Прокрутив круги, найдите такое их взаимное расположение, при котором все формулы будут составлены верно. Запишите в тетрадь названия и формулы солей, уравнения их диссоциации.
Игра «Найди пару»
Из названия игры видна форма организации учебной деятельности - парная.
Все получают карточки, встают в круг и разбиваются на пары гидроксид - соответствующий оксид: например, при изучении кислот.
H2SO4- SO3
HNO3- N2O5
H2SO3 - SO2
HNO2 - N2O3
При изучении оснований:
NaOH - Na2 O
Ca(OH)2 - CaO
Fe(OH)2 - FeO
Fe(OH)3 - Fe2O3
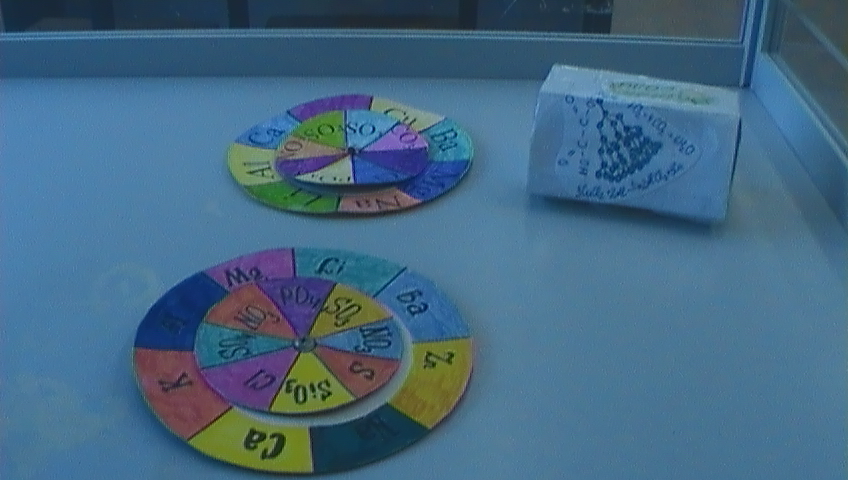
Интерактивная игра «Химическая ромашка»
- Летом вы, наверное, гадали на ромашке «любит - не любит», так и сегодня мы погадаем «взаимодействует - не взаимодействует» данное вещество с соляной кислотой? (На лепестках формулы: Сu, Zn, CuO, CO2, NaOH, KCl, . «Отрываем» ненужные лепестки, остаются: Zn, CuO, NaOH, Na2SiO3, .
- Расположите лепестки в логической последовательности ( Zn, CuO, NaOH, Na2SiO3) - в соответствии со схемой учебника «Типичные реакции кислот».
Игра «Химический футбол»
предусматривает коллективную форму работы и используется нами при отработке навыков по номенклатуре неогранических веществ. На доске демонстрируется ряд формул. Игру начинает учитель - «бросает мяч», называя отвечающего ученика, тот читает формулу, даёт название и назначает (по имени или имени и фамилии) следующего отвечающего и т.д., пока не закончится ряд формул. Игра содействует формированию коммуникативных навыков, класс работает самостоятельно, без вмешательства учителя.
Приём аналогий помогает более глубокому пониманию и осмыслению особенностей кислотно-основных взаимодействий. В предложенных заданиях проводится аналогия между качествами личности и свойствами веществ. Усиливает эффект применения этого приёма инсценировка (приложение 1)
Задание №1.
Лакмус был страстно влюблён в Кислоту и в её присутствии всегда краснел, а ревнивая Щелочь, которая была к нему неравнодушна , раздражала Лакмуса до посинения. Несчастный Фенолфталеин тайно питал нежные чувства к Щелочи, но зная её едкий характер, при малейшем к ней прикосновении весь становился малиновым.
О каких химических явлениях идёт речь?
Задание №2
Вздорная серная кислота всегда доводила Лакмус до аллергического покраснения , причем до такой степени, что он вынужден на помощь звать Едкий натр, который нейтрализовал их общение до получения Нормальной соли с водой. А что же произошло с Лакмусом? Выше уже было отмечено, что тема богата терминологией. Для запоминания некоторых важнейших понятий использую рифмованные строки.
Для двух ребят подарков груз
ИОН взвалил себе на спину:
Для КАТИ ОН несет свой плюс,
Для АНИ ОН несет свой минус.
Тема благоприятна для применения модульной технологии обучения по ряду причин: материал о классификации неорганических веществ уже рассматривался в теме «Соединения химических элементов» - это даёт возможность опоры на ранее изученный материал и проведения входного контроля, материал легко структурировать по смысловым блокам (учебным элементам), в модуль можно включить самые разнообразные задания. Приведу пример разработанного мною модуля по теме « Оксиды, их классификация и свойства» (приложение 2)
Усвоение материала о химических свойства кислотных и основных оксидов представляет трудность для учащихся. Поэтому здесь не обойтись без приёмов повышения мотивации к учению, влекущей за собой перекладывание ответственности с плеч учителя на плечи ученика. Одним из таких приёмов является взаимообучение в паре.
Приведу примеры заданий для парной работы по закреплению знаний о химических свойствах оксидов.
ВЗАИМООБУЧЕНИЕ ПО ТЕМЕ
«Химические свойства оксидов»
Комплект материалов для 1 ученика
ВАРИАНТ 1 ( задания)
Допишите уравнения возможных химических реакций. Дайте объяснение для тех случаев, когда реакция невозможна.
-
Кислотные оксиды взаимодействуют с основаниями.
Ca(OH)2 + P2O5 =
KOH +SO3 =
NaOH +CO =
2. Основные оксиды взаимодействуют с кислотами.
HCl +MgO =
HNO3 + P2O5 =
-
Основные и кислотные оксиды взаимодействуют друг с другом
SO2+CO2 =
SO2+MgO =
4. И основные, и кислотные оксиды взаимодействуют с водой
Na2O +H2 O =
SO3+H2O =
FeO +H2O =
ВАРИАНТ 2. (ответы)
-
Кислотные оксиды взаимодействуют с основаниями.
2NaOH +SO3=Na2SO4 +H2O
Ba(OH)2+CO2=BaCO3+H2O
KOH +N2O =(несолеобразующий оксид)
-
Основные оксиды взаимодействуют с кислотами.
H2SO4 +Li2O =Li2SO4+H2O
HCl+SO3 =(кислота не может реагировать с кислотным оксидом)
-
Основные и кислотные оксиды взаимодействуют друг с другом.
CuO+Na2O=(не могут реагировать два основных оксида)
SO3 +CaO =CaSO4
-
И основные , и кислотные оксиды реагируют с водой.
CO2 +H2O =H2CO3
CaO + H2O =Ca(OH)2
Fe2O3+H2O=(гидроксид железа (3) не растворяется)
После выполнения заданий, работающие в паре обмениваются тетрадями и выполняют взаимопроверку, после чего происходит взаимообучение - объяснение ошибок, допущенных товарищем. Такая форма закрепления значительно повышает ответственность учащихся за результаты учебной деятельности
Комплект материалов для 2 ученика
ВАРИАНТ 2. (задания)
Допишите уравнения возможных химических реакций. Дайте объяснение в тех случаях, когда реакция невозможна.
-
Кислотные оксиды взаимодействуют с основаниями.
NaOH +SO3=
Ba(OH)2+CO2=
KOH +N2O =
-
Основные оксиды взаимодействуют с кислотами.
H2SO4 +Li2O =
HCl+SO3 =
-
Основные и кислотные оксиды взаимодействуют друг с другом.
CuO+Na2O=
SO3 +CaO =
-
И основные , и кислотные оксиды реагируют с водой.
CO2 +H2O =
CaO + H2O =
Fe2O3+H2O=
ВАРИАНТ 1 ( ответы)
-
Кислотные оксиды взаимодействуют с основаниями.
3Ca(OH)2 + P2O5 =Ca3(PO4)2 +3H2O
2KOH +SO3 =K2SO4 + H2O
NaOH +CO = (CO - это несолеобразующий оксид)
2. Основные оксиды взаимодействуют с кислотами.
2HCl +MgO =MgCl2 +H2O
HNO3 + P2O5 =( кислота не может реагировать с кислотным оксидом)
-
Основные и кислотные оксиды взаимодействуют друг с другом
SO2+CO2 =( два кислотных оксида)
SO2+MgO =MgSO3
4. И основные, и кислотные оксиды взаимодействуют с водой
Na2O +H2 O =2NaOH
SO3+H2O =H2SO4
FeO +H2O =(Fe( OH)2 нерастворим)
Рассматриваемая тема сложна для восприятия ученика, т.к. механизм распада молекулы вещества на ионы увидеть невозможно. Этим обусловлена необходимость применения ИКТ. Эффективным оказывается использование презентаций с анимационными моделями и видеофрагментов: «Диссоциация поваренной соли», «Диссоциация хлороводородной кислоты».


Фрагмент видеосюжета «Диссоциация хлороводородной кислоты».
Фрагмент презентации «Основоположники ТЭД»

Фрагмент презентации «Электролитическая диссоциация»
Интерактивная игра по теме «Химические свойства кислот»
Выше уже были описаны игры, мы совместно с учащимися разработали их интерактивные варианты.
Поскольку большую роль в формировании положительного отношения подростков к учению играют связь учебного материала с жизнью и практикой, организация поисковой деятельности, дающей учащимся возможность переживать радость самостоятельных открытий, считаю целесообразным использование компетентностно-ориентированных заданий. Ниже приведены задания, позаимствованные из опыта работы коллег и разработанные мною лично.
-
Новый железный бак, в котором приготовили раствор медного купороса (СuSO4) для опрыскивания растений, прохудился. Объясните причину разрушения стенок бака. Из какого материала следует изготовить бак в целях предупреждения его разрушения? Подтвердите свои предположения экспериментом, составьте уравнения реакций.

Фрагмент презентации с компетентностно -
ориентированным заданием
Мною разработана система критериев для оценки уровня выполнения этого задания. Сумма набранных баллов соответствует оценочному баллу.
Критерии оценки
Баллы
-
Установлена причина разрушения стенок бака - вытеснение менее активного металла более активным металлом из раствора его соли.
1
-
Проведён химический эксперимент «Взаимодействие железа с раствором медного купороса», верно подобраны реактивы, соблюдена техника безопасности.
1
-
Выдвинуто предположение, что теоретически можно изготовить бак из золота или серебра.
1
-
Произведена оценка практической целесообразности такого решения, предложен материал (например, пластмасса)
1
-
Приведены уравнения химических реакций:
СuSO4 +Fe = FeSO4 + Cu
СuSO4 +Au = реакция не идёт
1
-
Поинтересуйтесь, как составляется резюме для приёма на работу. Напишите такое резюме от имени Кислоты Соляной, которая желает устроиться на работу в организацию Неорганические соединения, структурное подразделение Кислоты. В резюме ей необходимо убедить работодателя в том, что она обладает всеми необходимыми качествами для работы в организации. Цветное фото приветствуется.
-
На приём к рентгенологу пришёл Вася Иванов - ученик 8 класса. Врач предложил ему перед рентгеновском исследованием желудка проглотить кашицеобразную массу- сульфат бария. Вася категорически отказался, т.к. узнал на уроке химии, что соединения бария ядовиты. А как бы ты поступил на месте Васи? Предложи способ получения сульфата бария для рентгенологического исследования из двух других солей. Продемонстрируй этот способ практически ( в виде эксперимента) и теоретически (в виде уравнения реакции).
-
В дистиллированной воде приготовили настой лечебных плодов (шиповника, черники, калины). Настой стал проводить электрический ток. Почему?
В разработанном мною календарно- тематическом планировании предусмотрены практические работы. Как правило, провожу их по заданиям учебника, но никогда не упускаю возможности включения компетентностных заданий. Стараюсь предлагать их учащимся как вполне естественную жизненную ситуацию не без некоторой доли артистизма.
-
Очистите химическим способом железный гвоздь от ржавчины, считая, что в состав ржавчины входят оксид железа(III) и гидроксид железа(III).
-
Химическим способом отмойте пробирку, загрязненную на практическом занятии гидроксидом меди(II).
-
После практической работы в колбе остался розовый раствор. Лаборант предполагает, что это раствор лакмуса в кислой среде. Проведите несколько опытов для проверки этого предположения.
Приведённые примеры наглядно иллюстрируют, что компетентностно - ориенированные задания направлены на формирование предметной (химической компетенции): умение провести эксперимент, дать ему научную интерпретацию, умение решать задачи, применять теоретические знания для решения жизненных ситуаций. Кроме того, их применение способствует формированию компетенций ключевых: социокультурной (компетенции в бытовой и культурно-досуговой сфере, опыт освоения учеником научной картины мира, расширяющейся до культурологического и всечеловеческого понимания мира), коммуникативной (включает знание способов взаимодействия с окружающими , навыки работы в группе, владение различными социальными ролями в коллективе. Ученик должен уметь представить себя, написать письмо, анкету, заявление, задать вопрос, вести дискуссию и др. Для освоения данной компетенции выбран такой объект коммуникации как резюме.)
Составным компонентом химической компетенции является исследовательская компетенция. На её формирование направлена пректно-исследовательская деятельность обучающихся. Знакомство с типами растворов я сопровождаю практическим применением теоретических сведений о насыщенных, ненасыщенных и пересыщенных растворах, предлагая трём ученикам их приготовить, предварительно изучив содержание статьи учебника. На этом же уроке закладываем опыт по выращиванию кристаллов. Ежегодно кого- то из восьмиклассников не оставляет равнодушным материал этого урока, возникает желание выполнить исследовательскую работу по выращиванию кристаллов. В кабинете химии мы создали коллекцию кристаллов, выращенных восьмиклассниками разных лет обучения.
Урок, посвящённый классификации солей побудил группу инициативных учащихся к выполнению межпредметного проекта «Соль: жизнь или смерть?». Поставив перед собой цель выяснить, что несёт поваренная соль человеку: вред или пользу, они разделились на группы: историки выяснили, что не раз из-за обладание соляными промыслами возникали войны между странами, филологи собирали и объясняли пословицы, поговорки, мудрые изречения о соли, биологи изучали влияние соли на живые организмы, географы - солёные моря и озёра, образцы аптечной морской соли. В проект был включён и практический аспект - подсчёт ежедневного, еженедельного и ежемесячного потребления соли участниками проекта. Результатом реализации проекта стал вывод о том, что соль издавна почитаема человеком, без неё невозможно существование организма, но в больших количествах она губительна для него. Соль может спасти, а может погубить. Проект был представлен на школьной научно-практической конференции.
Используемые мною при изучении темы формы, приёмы и современные образовательные технологии способствуют формированию целостной системы знаний в процессе деятельности.
-
СИСТЕМА ЗНАНИЙ И СИСТЕМА ДЕЯТЕЛЬНОСТИ
Общенаучные знания:
Тема «Растворение. Растворы. Свойства растворов электролитов» располагает богатым потенциалом для формирования философских категорий: ион и сложное вещество - формы существования материи, ионные и окислительно- восстановительные реакции - формы движения материи. Яркой иллюстрацией закона единства и борьбы противоположностей является существование процесса ассоциации наряду с диссоциацией, окисления и восстановления как противоположных сторон единого процесса- окислительно- восстановительной реакции и т.д. Закон перехода количественных изменений в качественные прослеживается в том, что изменение концентрации некоторых ионов (например, иодид-ионов) в организме человека приведёт к качественному изменению состояния его здоровья.
Знания предметной области:
Содержание темы включает четыре важнейшие группы понятий о веществе: электролиты, ионы в растворе, сущность процесса диссоциации, ионные реакции в растворе. Все эти понятия для учащихся качественно новые, но вполне доступные, так как имеют прочную опору на сформированные ранее понятия. Так, для понимания поведения электролитов в растворе необходимы опорные сведения о видах химической связи и о классах неорганических соединений, которые учащиеся уже приобрели. Эти же знания нужны для объяснения сущности диссоциации. Теория электролитической диссоциации - одна из ведущих теорий курса химии, она связана со многими курсами химических дисциплин, а так же с другими естественными дисциплинами.
Знания из других научных областей:.
Для понимания взаимодействия разноименных ионов используется знание физики. Кроме того, в курсе физики учащиеся уже получили предварительное понятие об электролите, о растворах, об электрическом токе как упорядоченном движении заряженных частиц. В ходе изучения темы закрепляются понятия о химическом составе клетки, первое знакомство с которым состоялось на уроках биологии ещё в 6 классе. Формируются более чёткие представления о внутренних средах организма (кровь, лимфа, межтканевая жидкость, цитоплазма) и внешних (морская вода) как о растворах электролитов. Тема создаёт предпосылки для успешного усвоения знаний о сложных биофизических процессах (осмос, плазмолиз и деплазмолиз, буферная система) в курсе старшей школы. Связь с экологией реализуется через убеждение в том, что накопление в окружающей среде ионов (например, тяжёлых металлов) способно изменить её.
Знания профильного характера:
Химия - наука, имеющая большое значение в практической деятельности человека. В медицине применяются водные растворы солей, соответствующие плазме крови. Эти растворы называют физиологическими. Многие медицинские препараты являются растворами. Природная вода является раствором. Минеральные воды представляют собой растворы газов и солей и применяются при лечении различных заболеваний.
Познавательная деятельность:
На каждом уроке по разделу программы определяются меры для обеспечения условий продуктивной работы мышления учащихся. Они
-
производят классификацию веществ (на электролиты и неэлектролиты, электролиты делят на сильные и слабые, оксиды на основные, кислотные и амфотерные и т.п.),
-
сравнивают их по различным критериям (проводят электрический ток или нет, взаимодействуют с кислотами или щелочами ит.д.)
-
делают общие выводы на основе частных экспериментов
-
находят закономерности (например, как зависит интенсивность взаимодействия металлов с кислотами от их положения в ряду активности),
-
иллюстрируют общие положения частными примерами (проводят несколько химических реакций, отвечающих одному и тому же сокращённому уравнению или проводят серию опытов на одно и то же химическое свойство).
В ходе решения проблемы
-
формулируют проблемную задачу на основании наблюдения эксперимента,
-
выдвигают гипотезы,
-
проверяют новое знание, проводя проверочный эксперимент (примером может служить проблемный эксперимент «Взаимодействие серной кислоты с гидроксидом меди (II)»).
-
оценивают эффективность найденных решений (например, при выполнении компетентностных заданий)
Составляя уравнения реакций в ионном виде,
-
анализируют её.
Приводя сокращённое ионное уравнение,
-
осуществляют синтез.
Среди приемов, оказывающих большое развиваюшее воздействие, следует назвать разнообразные задания нарастающей трудности, которые обеспечивают большую глубину, широту и самостоятельность действий учащихся. Выше были описаны задания, позволяющие усвоить изучаемый материал в преобразовании и развитии.
Преобразующая деятельность
понимается мною как деятельность, направленная на изменение реальных и идеальных объектов, осуществляемая в условиях педагогического процесса с целью формирования умений преобразования и стимулирования процесса саморазвития. Успешнее всего приобщить учащихся к преобразовательной деятельности можно через формирование ключевых компетенций. В ходе реализации компетентностного подхода к обучению учащиеся
-
самостоятельно выявляют противоречия между имеющимися знаниями и действительностью (например при демонстрации свойств амфотерных оксидов или гидроксидов)
-
самостоятельно определяют проблему
-
намечают пути поиска причин противоречий
-
рассматривают разные варианты решения учебной задачи (например, по получению вещества различными способами)
-
рассматривают реальный объект (например, поваренную соль) или явление с точки зрения разных предметных областей
Общеучебная деятельность
На протяжении изучения темы «Растворение. Растворы. Свойства растворов электролитов у учащихся формируются следующие общеучебные умения и навыки.
-
Учебно-организационные:
- ставить учебную задачу;
- сравнивать полученные результаты с учебной задачей;
- оценивать свою деятельность и деятельность других;
-
Учебно-информационные:
- работать с учебником и дополнительной литературой, ЭОР;
- составлять на основании текста таблицы, схемы, графики;
-
Учебно-логические:
- структурировать учебную информацию;
- сравнивать объекты, явления, события по заданным критериям;
- высказывать суждения, подтверждать их фактами;
-
Учебно-коммуникативные
- осуществлять взаимообучение
- высказывать суждения;
- участвовать в учебном диалоге и полилоге;
- задавать вопросы;
Самоорганизующая деятельность:
От способности ученика к самоорганизации зависит успешность изучения темы, требовательность к своей учебной деятельности и адекватная реакция на оценку его деятельности учителем. Приведённые примеры модуля по теме «Оксиды, их классификация и свойства», игровые технологии наглядно иллюстрируют ориентацию на формирование деятельности по самоорганизации:
-
самоконтроль (разумное расходование реактивов, соблюдение правил безопасной работы в кабинете химии при выполнении эксперимента)
-
самоанализ (сравнение собственной работы с эталоном, выявление и исправление ошибок)
-
самокоррекция (планирование работы по ликвидации пробелов)
-
самооценка
-
КАЛЕНДАРНО- ТЕМАТИЧЕСКОЕ ПЛАНИРОВАНИЕ РАЗДЕЛА «РАСТВОРЕНИЕ. РАСТВОРЫ. СВОЙСТВА РАСТВОРОВ ЭЛЕКТРОЛИТОВ»
На изучение раздела отвожу 20 часов учебного времени при условии 2 часа в неделю, ( 70 час. в год). Принципиальным моментом является включение в раздел предусмотренных программой двух практических работ, являющихся экспериментальным подтверждением теоретических положений.
№ урока
Тема 6. РАСТВОРЕНИЕ. РАСТВОРЫ. СВОЙСТВА РАСТВОРОВ ЭЛЕКТРОЛИТОВ
1
Растворение - физико - химический процесс. Типы растворов.
2
Механизм диссоциации веществ с различным типом химической связи.
3
Основные положения теории электролитической диссоциации.
4
Ионные уравнения.
5
Кислоты: состав, названия и классификация.
6
Кислоты в свете теории ЭД.
7
Основания: состав, названия и классификация.
8
Основания в свете теории электролитической диссоциации.
9
Оксиды: состав, названия и классификация.
10
Химические свойства оксидов.
11
Соли: состав, названия и классификация.
12
Соли в свете ТЭД.
13
Химические свойства солей.
14
Практическая работа. Свойства кислот, оснований, оксидов и солей.
15
Генетический ряд металла и неметалла
16
Окислители и восстановители.
17
Окислительно - восстановительные реакции.
18
Обобщающее повторение изученного о свойствах растворов электролитов
19
Контрольная работа по теме «Свойства растворов электролитов»
20
Практическая работа. Решение экспериментальных задач.
-
РАЗРАБОТКА УРОКА ПО ТЕМЕ
«ХИМИЧЕСКИЕ СВОЙСТВА СОЛЕЙ»
ЦЕЛЬ УРОКА:
-
Познавательная: научиться составлять уравнения химических реакций, отражающих химические свойства солей, прогнозировать возможность протекания химических реакций с участием солей.
-
Личностного развития: создать условия для самостоятельного добывания знаний, способствовать развитию исследовательских умений и навыков,
Для учеников: экспериментальным путём изучить химические свойства солей, понять, с какими веществами соли реагируют, а с какими- нет.
Предметные ( химические) компетенции учащихся: составление названий и формул солей, уравнений в ионном виде, проведение ученического эксперимента для получения теоретических знаний.
Ключевые компетенции: ценностно- смысловые(умение принимать решение, иметь собственное мнение), учебно- познавательные(самооценка результатов собственной деятельности, обозначение своего понимания или непонимания изучаемого, навыки прогнозирования), социокультурные компетенции (владение знаниями в каждодневных ситуациях бытовой сферы), информационные
(отбор информации из различных источников, навыки работы с информационными устройствами).
Выбор данных элементов компетенций не случаен, он обусловлен содержательной стороной изучаемого материала.
Тип урока: урок усвоения новых знаний.
ОСНАЩЕНИЕ: пробирки, растворы солей и кислот, железная пластинка, карточки с формулами солей, рабочие листы с тестами и таблицей самоконтроля, мультимедийная презентация к уроку, видеофрагмент «Электролитическая диссоциация», электронное пособие «Виртуальная школа Кирилла и Мефодия. Химия 8-9 класс».
Этапы урока. Содержание этапов.
Обоснование этапов
-
Организационно - мотивационный этап. (2 мин)
Приветствие учащихся, выявление отсутствующих, дежурных, назначение «дежурного по электронной почте».
-
Мотивация и целеполагание.
Учитель: предлагает учащимся приготовить раствор морской соли.
-Миллионы лет этих соли сосуществуют в морской воде. Очевидно, из этого факта следует вывод о том, что соли не взаимодействуют друг с другом? Можно ли дать точный и однозначный ответ? Почему? Каких знаний о солях для этого не хватает?
Какова цель сегодняшнего урока?
Соли проникают во все сферы человеческой деятельности. Сегодня на уроке вы убедитесь в том, что не менее важно знать химические свойства солей. Мы будем их открывать в прямом и переносном смысле. (К доске прикреплены 4 карточки оборотной стороной - по числу химических свойств солей.)
Создание рабочего настроя, деловой, доброжелательной атмосферы.
Мотивация учащихся к активной учебной деятельности, реализация межпредметных взаимосвязей. Реализация компетентностного подхода, осознание личностной значимости изучаемого материала.
-
Актуализация опорных знаний учащихся.
(10 мин)
-
Индивидуальные задания у доски.
-
«Вода мёртвого моря».
К доске прикреплены карточки с символами ионов. Из них нужно составить формулы солей так, чтобы они не повторялись. Так мы узнаем химический состав воды Мёртвого моря.
Na+ SO4 2- Na+ Cl- Cl- Mg2+ K+ Br-
Из данного набора ионов получаются формулы солей: сульфата натрия, хлорида магния, бромида калия.
-
Составить формулы солей:
Стр. 225 № 2 учебника
Сульфат калия - K2SO4, гидросульфат калия, карбонат магния MgCO3, гидрокарбонат магния - Mg(HCO3)2, фосфат натрия - Na3PO4, гидрофосфат натрия - Na2HPO4, дигидрофосфат натрия - NaH2PO4. Почему именно фосфорная кислота образует три ряда солей? Какие кислоты не образуют кислых солей? Почему?
-
Интеллектуальная разминка.
На столах учащихся - карточки с формулами солей. На экране появляется название соли, ученик поднимает соответствующую карточку с формулой и называет её. После этого на экране появляется правильный ответ - формула с иллюстрацией, отражающей применение соли.
По окончании игры один ученик собирает карточки и распределяет их на доске на три группы: средние, кислые, основные.
-
Что такое соли в свете теории ЭД?
-
Какие соли называют средними, кислыми, основными?
Повторение знаний о классификации солей, их диссоциации, умений по составлению формул и названий.
3. Домашнее задание: (1 мин)
Обязательное для выполнения:
Прочитать параграф 41, 2 задания рабочей тетради на выбор: №4- №10 стр.156 -161
Дифференциация домашнего задания, осуществление связи изучаемого материала с жизнью, повседневным бытом учащихся.
4.Операционно- исполнительский этап.
( 20 мин)
На экран выводится слайд с электронным письмом, дежурный по электронной почте открывает его.
Задание.
Новый железный бак, в котором приготовили раствор медного купороса для опрыскивания растений, прохудился. Объясните причину разрушения стенок бака. ( Садоводы)
Учитель: смоделируем эту жизненную ситуацию.
Постановка демонстрационного эксперимента. В стакан с раствором медного купороса опускается железная пластинка, предварительно зачищенная наждачной бумагой.
- Я известно с давних пор
И имею спрос.
Опусти меня в раствор-
В медный купорос.
Изменить хочу я соль.
Ну -ка, выйди, соизволь.
Удивительный момент!
Стал другим раствор.
Вытесняю элемент,
Не вступая в спор.
На меня взгляни, ответь:
Что на мне осело?
Дети: Медь!
- Составьте уравнение происходящей реакции и определите её тип.
CuSO4 + Fe = Cu + FeSO4 (реакция замещения)
- Почему разрушились стенки бака? Из какого металла следует изготовить бак во избежании разрушения? Почему?
- Мы только что открыли одно из химических свойств солей. Какое? С чем реагируют соли?
На доске прикреплены карточки обратной стороной. Вскрывается и переворачивается первая карточка с надписью:
СОЛЬ + МЕТАЛЛ = ДРУГАЯ СОЛЬ + МЕТАЛЛ
более активный менее активный
- Второе свойство солей нам поможет открыть видеосюжет. Проведите эксперимент, составьте уравнение в молекулярном, полном ионном и сокращённом ионном виде. Повторим правила безопасной работы в кабинете химии. На столах у вас лежат памятки. О чём говорят предупреждающие знаки? Просматривается видеосюжет, на доске и в тетрадях составляется уравнение:
AgNO3 + NaCl = NaNO3 + AgCl
Ag+ +NO3- +Na+ + Cl- = Na+ +NO3- +AgCl
Ag++ Cl- = AgCl
Открывается карточка:
СОЛЬ 1+ СОЛЬ 2 = СОЛЬ 3+СОЛЬ 4
- А у нас снова электронное письмо.
Задание.
В нашем городе из - за кислотных дождей разрушаются памятники архитектуры. Можно ли их спасти? (Горожане).
Подсказка:
На земле живут три брата из семейства Карбонатов.
Старший брат - красавец мрамор,
Славен именем Карары,
Превосходный зодчий он
Строил Рим и Парфенон.
Всем известен известняк,
Потому и назван так.
Знаменит своим трудом,
Возводя за домом дом.
И способен, и умел
Младший мягкий братец мел.
Как рисует, посмотри,
Это СаСО3!
Делается вывод о взаимодействии солей с кислотами, открывается карточка, выполняется моделирование ситуации - ученический эксперимент «Взаимодействие мела с азотной кислотой». На экране демонстрируется уравнение реакции.
СaCO3 + 2HNO3= Ca(NO3)2 + CO2 + H2O
СaCO3 + 2 H+ + 2 NO3- = Ca2+ 2NO3 -+ CO2 + H2O
CaCO3 +2H+ = Ca2++ CO2 +H2O
Образование кислотных дождей происходит из -за выбросов в атмосферу оксидов серы и азота. Установка очистных сооружений поможет спасти памятники архитектуры.
CОЛЬ + КИСЛОТА = ДРУГАЯ СОЛЬ + ДРУГАЯ КИСЛОТА
- Осталось одно не открытое свойство солей. Как вы думаете - какое? В случае затруднения - открывается карточка.
СОЛЬ + ЩЁЛОЧЬ = ДРУГАЯ СОЛЬ + ОСНОВАНИЕ
- Соли взаимодействуют со щелочами, если при этом образуется осадок. Демонстрация эксперимента. Взаимодействие соли железа с гидроксидом натрия. На экране демонстрируется уравнение реакции.
FeSO4 + 2NaOH = Na2 SO4 + Fe(OH)2
Fe 2++SO42-+2Na+ +2OH- =2Na++SO42- +Fe(OH)2
Fe 2+ +2OH-=Fe(OH)2
Выводы: Соли взаимодействуют с металлами, друг с другом, кислотами и щелочами. Обязательным условием протекания реакции является образование осадка, газа, воды или мало диссоциирующего вещества.
Введение в тему, осуществление взаимосвязи теории с практикой.
Использование элемента занимательности, необычное преподнесение демонстрационного эксперимента.
Внутрипредметное повторение.
Формирование умения прогнозировать протекание химической реакции, используя электрохимический ряд напряжений металлов.
Обучение умению работать с различными источниками информации. Повторение правил безопасной работы в кабинете.
Экологическое воспитание, решение практических задач.
Моделирование экологической ситуации, поиск пути решения проблемы.
5.Коррекционно - контролирующий этап.(10 мин)
1. ИГРА - ЭСТАФЕТА.
Проводится эстафета между 1 и 2 вариантом. Доска делится на 2 части. 1 вариант составляет уравнение реакции между азотной кислотой и гидроксидом меди , 2 вариант - между сульфатом железа и гидроксидом натрия. 1 участник - молекулярное уравнение, 2- полное ионное, 3- сокращённое ионное. Участники передают мел - эстафетную палочку, каждый имеет право исправить ошибки товарища. Проверка правильности выполнения задания производится путём сверки записей на доске с образцом на слайде.
2 ЭЛЕКТРОННОЕ ТЕСТИРОВАНИЕ.
Виртуальная школа Кирилла и Мифодия. Урок 11. Итоговое тестирование. Сильный ученик выполняет задание с комментированием. На столах учащихся - распечатки теста, содержащего аналогичные задания: вариант А - для более подготовленных и мотивированных учащихся, вариант Б - для менее подготовленных. Вопросы в тестах разные, а ответы - одинаковые (22222). Одновременно предлагается заполнить таблицу самоконтроля. Выясняется, кто допустил в тесте 1-2 ошибки, кто - больше, кто в таблице поставил четыре или три плюса, кто - меньше. Рекомендация учителя: выбирать в качестве домашнего задания упражнения на те свойства, которые вызвали затруднения и постараться самостоятельно восполнить пробелы.
Контроль усвоения знаний, умений по составлению уравнений, отражающих химические свойства солей.
Побуждение к активному, сознательному учению.
-
Рефлексия. (2 мин) Пригодится ли знание химических свойств солей в жизни? Или это нужно только химикам?
Осмысление личностной значимости изученного на уроке.
ТАБЛИЦА САМОКОНТРОЛЯ
Химические свойства
солей
Понял(а) +
Частично понял(а) +?
Не понял(а) -
Соль1+ металл1= соль 2 + металл 2
Соль 1+ соль 2 = соль 3+ соль 4
Соль + кислота = другая соль + другая кислота
Соль1+щёлочь = соль 2+ основание
ТЕСТ вариант А
-
Вещество КНСО3 называется: 1. карбид калия
2. гидрокарбонат калия
3. карбонат калия
-
Na2SiO3 - это: 1. силицид натрия
2. силикат натрия
3. кремниевая кислота
3. При взаимодействии гидроксида натрия с сульфатом меди ׀׀ образуется осадок:
1. Na2SO4
2. Cu(OH)2
3. осадка не образуется
4. Какая из химических реакций неосуществима?
1. Аl + Hg(NO)2=
2. Ag + CaCl2 =
3. Zn + CuSO4 =
5. Какой объём углекислого газа образуется при термическом разложении 20 г СаСО3?
1. 22,4 л
2. 4,48 л
3. 44,8 л
ТЕСТ вариант Б
-
Вещество Mg (H2PO4)2 называется :
-
гидрофосфат магния
-
дигидрофосфат магния
-
фосфат магния
-
Вещество (СаОН)2СО3 называется:
-
карбонат кальция
-
основной карбонат кальция
-
гидрокарбонат кальция
-
При взаимодействии нитрата серебра с хлоридом калия образуется осадок:
1. нитрата калия
2. хлорида серебра
3. осадка не образуется
4. Какая из реакций не протекает:
1. Zn + Cu(NO3)2 =
2. Hg+NaCl =
3. Fe+ CuSO4 =
5. Какой объём углекислого газа образуется при термическом разложении 200 г СаСО3 ?
1. 2,24 л
2. 44,8 л
3. 4,48 л
Уроки Кирилла и Мефодия. Химия 8 класс
Урок 11. СОЛИ
ИТОГОВОЕ ТЕСТИРОВАНИЕ
-
Вещество Са(Н2РО4)2 называется : дигидрофосфат кальция, гидрофосфат кальция, фосфат кальция.
-
Вещество Сu2(OH)2 СО3 называется: основной карбонат меди, карбонат меди, гидрокарбонат меди.
-
При взаимодействии нитрата серебра с хлоридом натрия образуется осадок: хлорида серебра, нитрата натрия, реакция не сопровождается образование осадка.
-
Какая из химических реакций неосуществима?
Fe +MgCl2 =FeCl2+Mg
Fe + CuSO4 = Cu +FeSO4
Cu +AgNO3 = Cu(NO3)2 +Ag
-
Какой объём углекислого газа образуется при термическом разложении 10 г СаСО3 ?
2,24 л 44,8 л 4,48 л
10. ЛИТЕРАТУРА
-
Тимофеева Л. Л. Проблемный урок в контексте личностно ориентированного -образования. Биология в школе № 6 2010
-
Тяглова Е.В. Исследовательская деятельность учащихся по химии. Методология, методика, практика. Москва. Глобус. 2008
-
Урок в современной школе. Формирование ключевых компетенций. Авт. Сост. Фасевич идр.Волгоград. Учитель. 2009
-
ерестнева Е.В. Технологический подход к обучению: система постановки целей. Химия в школе № 9 2011 год
-
Боровских Т.А. Групповая технология на уроках развивающего дифференцированного обучения. Химия в школе №4 2010
-
Воронина Г.А. Модели профильного обучения биологии. Москва. Вентана - Граф 2010
-
Краткий справочник по педагогической технологии. Под ред. Н.Е. Щурковой. Москва. Новая школа. 2007
-
Петунин О.В. Работа с терминами в классах естественно- научного профиля.Биология в школе №7 2010.
-
ПодкопаеваИ.Н. Организация и проведение урока - исследования. Химия в школе. №4 2010
-
ПРИЛОЖЕНИЯ
Приложение 1.
Дилетанты-обыватели:
Сценка1.
На скамейке в кабинете химии сидят обыватели-дилетанты и ведут незатейливый разговор.
1-ый: Вы слышали? В городе оксиды серы и азота появились! Важные такие. Летят - под ногами ничего не видят, ни на кого не смотрят!
2-ой: Как же, как же! Стращают всех! Оказывается, от их благосклонности жизнь на Земле зависит!
3-ий: Ой, не говорите. На днях гуляю, а навстречу оксиды летят. Спрашиваю: «Вы куда?» - «Воду ищем». - «Зачем она Вам?» И что, вы думаете, они ответили? Хотят подбить ее на образование «кислотных дождей». Ой, что будет, что будет! А потом, говорят, может повезет, они и щелочь встретят. Зачем она им нужна?
Ведущий: О чем идет разговор? Какие последствия могут быть? Приведите уравнения реакций.
Сценка 2
1-ый: Ты знаешь соль?
2-ой: Знаю.
1-ый: А какая она?
2-ой: Белая, крупинками, и самое главное - соленая.
3-ий: Ее еще в пищу добавляют.
1-ый: Я не понимаю, так она что - одна?
2-ой: Конечно, одна - разъединственная.
1-ый: А почему они говорят о солях? Значит их много?
Ведущий: Мир солей непредсказуем и разнообразен. В него входят сотни и даже тысячи солей. Какие химические свойства солей Вам известны?
Приложение 2
О П Е Р А Ц И О Н Н Ы Й М О Д У Л Ь ПО Т Е М Е
« Оксиды, их классификация и свойства»
Входной контроль
-
К оксидам не относится вещество, формула которого:
-
K2O 2. SO3 3. H2O2 4. Р2O5
-
Cпень окисления азота равна +5 в оксиде:
-
NO 2. N2O5 3. NO2 4. N2O
-
Формула оксида марганца (IV):
-
MnO2 2. Mn O 3. MnO4 4. Mn2O7
-
Ряд, в котором приведены формулы только оксидов неметаллов
-
СO2 K2O SO2
-
Li2O Fe2O3 N2O3
-
CuO CO N2O
-
Cl2O SiO2 B2O3
-
Оксид, имеющий формулу SO3, называется:
-
Оксид серы (III) 2. Оксид серы (II) 3. Оксид серы (IV) 4. Оксид серы (VI)
ОТВЕТЫ: 1-3 2-2 3-1 4-4 5-4
Модуль для коррекции знаний и умений
УЭ -1
Цель - научиться называть оксиды
-
Назовите соединения, формулы которых:
MgO CaO NO OF2
SiO2 Cl2O7 Fe2S3 K2O
УЭ - 2
Цель - научиться определять степень окисления и
составлять формулы оксидов по степени окисления.
-
Определите степень окисления элементов в оксидах
MnO2 N2O3 SO2
MgO P2O5 Cl2O3
-
Составьте формулы оксидов по степени окисления
+3 +5 +6
AlO PO SO
+4 +2 +7
MnO MnO MnO
Модуль для изучения новой темы
УЭ -1 КЛАССИФИКАЦИЯ ОКСИДОВ
Цель- научиться классифицировать оксиды
-
В каждом столбце имеется одна «лишняя» формула. Определите её и обоснуйте свой выбор.
-
CO
K2O
Al2O3
NO
CaO
Cl2O
N2O
SO2
SO3
CO2
FeO
P2O5
-
Выполните самопроверку по эталону (на столе учителя) и оцените себя.
УЭ-2
ХИМИЧЕСКИЕ СВОЙСТВА ОКСИДОВ
Цель- научиться прогнозировать возможность протекания химических реакций, отражающих химические свойства оксидов, составлять уравнения
-
Составьте уравнения возможных реакций
УЭ 2.1. ВЗАИМОДЕЙСТВИЕ КИСЛОТНЫХ И ОСНОВНЫХ ОКСИДОВ С ВОДОЙ
CO2+ H2O = SiO2 + H2O =
SO2 +H2O = Na2O +H2O =
CuO +H2O= N2O +H2O =
УЭ-2.2. ВЗАИМОДЕЙСТВИЕ КИСЛОТНЫХ И ОСНОВНЫХ ОКСИДОВ ДРУГ С ДРУГОМ
СaO +CO2 = CaO +CO =
N2O5+ K2O = SO3+Li2O =
УЭ-2.3. ВЗАИМОДЕЙСТВИЕ КИСЛОТНЫХ ОКСИДОВ С СОЛЯМИ, А ОСНОВНЫХ - С КИСЛОТАМИ
MgO +HCl = SO2 +HNO3 =
Na2O +KOH= SO3 +NaOH =
FeO + HNO3 = CO2 + LiOH =
УЭ-2.4. ВЗАИМОДЕЙСТВИЕ ОКСИДОВ С СОЛЯМИ
Na2CO3 + SiO2 = K2SiO3 +SO2=
УЭ -3
ЗНАКОМСТВО С ОБРАЗЦАМИ ОКСИДОВ
Цель- научиться решать экспериментальные задачи на основе знаний о химических свойствах оксидов
-
Экспериментальная задача
В двух склянках без этикеток вам выданы порошки: в одной - оксид кальция, в другой - оксид меди(II). Как различить эти вещества, не проводя химических опытов? Как химическими опытами подтвердить наличие в склянках именно этих веществ? Составьте уравнения проведённых реакций.
Выходной контроль
-
Ряд, в котором все оксиды несолеобразующие:
-
CO2 SO3 B2O3
-
CO N2O3 N2O5
-
N2O NO CO
-
P2O5 Cl2O7 NO
-
Формулы только основных оксидов приведены в ряду
1) СО2, СаО, СuО 2) СО2, NaO, N2O5
3) Р2О5, BaO, SO3 4) СаО, Na2O, CuO -
Оксид, в водном растворе которого фенолфталеин становится малиновым:
1) оксид алюминия 2) оксид лития
3) оксид свинца(II) 4) оксид марганца(II)
-
Оксид серы(IV) не взаимодействует
1) с водой 2) со щелочами
3) с кислотами 4) с основными оксидами
-
Ряд, в котором каждое из веществ реагирует с оксидом натрия:
-
Серная кислота , вода, оксид углерода (IV)
-
Оксид калия, соляная кислота, оксид серы(VI)
-
Азотная кислота, гидроксид бария, оксид меди (II)
-
Вода, оксид кальция, фосфорная кислота
ОТВЕТЫ: 1-3 2- 4 3-2 4-3 5-1
Приложение 3
О П Е Р А Ц И О Н Н Ы Й М О Д У Л Ь ПО Т Е М Е
« Кислоты, их классификация и свойства»
Входной контроль
-
Ряд формул, в котором все вещества - кислоты
1. HCl, CaCl2, H2SO4
3. HNO3, H2SO3 , H3PO4
2. NaOH, H2CO3, H2S
4. CaO, Na2CO3, H2S
-
К одноосновным кислотам относится:
-
H2SO4 2. H2SO3 3. HNO2 4. H3РO4
-
Cпень окисления азота в азотистой кислоте равна:
1. +5 2. +3 3. +4 4. +2
-
Азотной кислоте соответствует оксид:
-
1. NO 2. N2O5 3. NO2 4. N2O
-
Ряд, в котором приведены формулы только кислородсодержащих кислот
-
Н2СO3 Н2SO4 H2SO3
-
HCl HNO3 H2SiO3
-
HNO2 H2S H3PO4
-
HBr HClO3 HMnO4
САМООЦЕНКА:
УЭ -1 КЛАССИФИКАЦИЯ
КИСЛОТ
Цель- научиться классифицировать
кислоты
-
Дайте характеристику кислоты (на выбор) по следующим признакам:
-
Основность
-
Наличие кислорода
-
Степень диссоциации
-
Стабильность
-
Растворимость в воде
УЭ-2
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
Цель- научиться прогнозировать возможность протекания химических реакций, составлять уравнения реакций, отражающих химические свойства
кислот

-
Составьте уравнения возможных реакций
-
Взаимодействие кислот с металлами.
Zn + H2SO4 = Mg + HCl =
Cu +HCl =
-
Взаимодействие кислот с основными оксидами (оксидами металлов).
MgO + H2SO4 = Na2O +HNO3 =
СuO+HCl = FeO +HNO3 =
3. Взаимодействие кислот с основаниями.
2 NaOH + H2SiO3 = HNO3 + Са(ОН)2=
4. Взаимодействие кислот с солями если образуется газ, осадок или вода)
K2CO3 +HNO3 = AgNO3 + HCl
УЭ -3
ЭКСПЕРИМЕН-
ТАЛЬНЫЙ
Цель- совершенствовать
умения решать задачи на основе знаний о химических свойствах кислот
-
Задача - мысленный эксперимент
Смесь, состоящую из 20 г магниевых стружек и 32 г медных опилок, залили соляной кислотой. Вычислите объём выделившегося при этом газа.
-
Задача - реальный эксперимент
Вам выдан ржавый гвоздь. Можно ли его очистить от ржавчины, если известно, что в её состав ржавчины входят оксид железа (III) и гидроксид железа (III)? Составьте уравнения проведённых вами реакций в молекулярном, полном ионном и сокращённом ионном виде.
Выходной контроль
-
Ряд, в котором все оксиды взаимодействуют с кислотами:
-
CаO SO3 BаO
-
CuO Al2O3 K2O
-
N2O NO CO
-
P2O5 Cl2O7 ZnO
-
Осадок образуется при взаимодействии серной кислоты с:
1) карбонатом калия 2) магнием
3) оксидом натрия 4) хлоридом бария -
Оксид, в водном растворе которого лакмус становится красным:
1) оксид натрия 2) оксид лития
3) оксид углерода(II) 4) оксид серы (VI)
-
Раствор серной кислоты не взаимодействует:
1) с цинком 2) со щелочами
3) с основными оксидами 4) с кислотными оксидами -
Ряд, в котором каждое из веществ реагирует с солянойкислотой:
-
Оксид магния, медь, оксид углерода (IV)
-
Оксид калия, соляная кислота, оксид серы(VI)
-
Карбонат натрия, гидроксид бария, оксид меди (II)
-
Магний, оксид кальция, фосфорная кислота
Приложение 4.
Контрольная работа по теме
«Растворение. Растворы. Свойства растворов электролитов».
Система оценивания работы:
0-6 баллов - «2»
7-10 баллов - «3»
11-14 баллов - «4»
15-16 баллов - «5»
Контрольная работа № 5
ВАРИАНТ-1
Часть 1
А1. Группа формул веществ, включающая формулы основания, кислоты, соли и кислотного оксида:
1) CuO, Zn(OH)2, AlCl3, K2S
3) SO2, H2SO4, NaCl, CuO
2) Cu(OH)2, HCl, NaNO3, SO3
4) Zn(OH)2 ,HCl, K2S, Na2O
А2. Формула сульфата натрия:
1) Na2SO4
3) Na2S
2) Na2SO3
4) Na2SiO3
А3. Изменение свойств оксидов от кислотных к основным происходит в ряду веществ с формулами:
1) Li2O - BeO - B2O3
3) NO2 - CO2 - SO2
2) P2O5 - SiO2 - Al2O3
4) P2O5 - CаO - SO3
А4. Пара формул веществ, реагирующих с оксидом серы (IV):
1) Ca (OH)2, H2O
3) H2O, NaCl
2) Na2O, Na
4) SO3, H2SO4
А 5. Металл, реагирующий с водным раствором хлорида меди (II):
1) золото
3) ртуть
2) железо
4) серебро
А6. Верны ли следующие высказывания?
А. В уравнении реакции: Х + HCl = NaCl + H2O веществом Х является вещество с формулой Na.
Б. В уравнении реакции: Х + HCl = NaCl + H2O веществом Х является вещество с формулой NaOH.
1) верно только А
3) верно только Б
2) верны оба суждения
4) оба суждения не верны
Часть 2
В задании В1 на установление соответствия запишите в таблицу цифры выбранных вами ответов, а затем полученную последовательность цифр перенесите в бланк ответов без пробелов и других символов. (Цифры в ответе могут повторяться).
В1. Установите соответствие между формулой оксида и соответствующего ему гидроксида:
Формула оксида
Формула гидроксида
А) Cu2O
1) H2SO4
Б) CO2
2) Al (OH)3
В) Al2O3
3) Cu (OH)2
Г) SO3
4) H2CO3
5) CuOH
6) H2SO3
А
Б
В
Г
Ответом к заданиям В2, В3 является последовательность цифр, которые соответствуют номерам правильных ответов. Запишите выбранные цифры в бланк ответов в порядке возрастания без пробелов и других символов.
В2. Металлы, реагирующие с раствором соляной кислоты:
1) Ca
3) Zn
5) Ag
2) Mg
4) Cu
6) Fe
В3. Вещества, реагирующие с раствором гидроксида натрия:
1) соляная кислота
4) хлорид натрия
2) нитрат меди
5) углекислый газ
3) вода
6) оксид калия
Часть 3
С1. Предложите два способа получения сульфата магния. Составьте уравнения реакций в молекулярном и ионном виде, укажите тип реакций.
Приложение 5
CАМОСТОЯТЕЛЬНАЯ РАБОТА ПО ТЕМЕ «КИСЛОТЫ» Вариант 1
-
Даны вещества: железо, ртуть, оксид магния, оксид азота, гидроксид калия, азотистая кислота. Какие из этих веществ будут реагировать с серной кислотой? Составьте уравнения возможных реакций.
-
Допишите уравнения и рассмотрите их в свете ТЭД
Na2SiO3 +HCl =
Ba(NO3)2 + H2SO4 =
САМОСТОЯТЕЛЬНАЯ РАБОТА ПО ТЕМЕ «КИСЛОТЫ»
Вариант 2
-
Какие из приведённых реакций соляной кислоты осуществимы? Допишите уравнения возможных реакций.
a) HCl + AgNO3= г) HCl + SO2=
б) HCl + Ca= д) HCl + Ca(OH)2=
в) HCl + Ag = е) HCl + CuO =


