- Преподавателю
- Химия
- Методические указания по выполнению практических работ
Методические указания по выполнению практических работ
| Раздел | Химия |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Сеитумерова В.И. |
| Дата | 09.12.2015 |
| Формат | docx |
| Изображения | Есть |









 ДЕПАРТАМЕНТ ВНУТРЕННЕЙ И КАДРОВОЙ ПОЛИТИКИ БЕЛГОРОДСКОЙ ОБЛАСТИ
ДЕПАРТАМЕНТ ВНУТРЕННЕЙ И КАДРОВОЙ ПОЛИТИКИ БЕЛГОРОДСКОЙ ОБЛАСТИ
ОБЛАСТНОЕ ГОСУДАРСТВЕННОЕ АВТОНОМНОЕ ПРОФЕССИОНАЛЬНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
«РАКИТЯНСКИЙ АГРОТЕХНОЛОГИЧЕСКИЙ ТЕХНИКУМ»
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
для студентов по выполнению практических и лабораторных работ
учебной дисциплины
Химия
для специальности среднего профессионального образования
19.02.08 Технология мяса и мясных продуктов
Базовый уровень
Срок обучения 3 года 10 месяцев
пос. Ракитное 2015 г.
Составлена в соответствии с рабочей программой по учебной дисциплине Химия профессии 19.02.08 Технология мяса и мясных продуктов
УТВЕРЖДАЮ
заместитель директора по
учебно-методической работе
ОГАПОУ «РАТТ»
___________ О.П. Новикова
«_____» ______________ 2015 г.
Составитель:Сеитумерова Виолетта Ивановна, преподаватель
Рассмотрена и одобрена
на заседании МК преподавателей
общеобразовательных дисциплин
протокол № 1
от «26» августа 2015 г.
председатель МК
ОГАПОУ «РАТТ»
__________ И.Н.Лосева
РЕЦЕНЗИЯ
на методические указания по выполнению лабораторных работ и практических занятий по учебной дисциплине Химия для специальности среднего профессионального образования
19.02.08 Технология мяса и мясных продуктов
-
Фамилия, имя, отчество автора - Сеитумерова Виолетта Ивановна
-
Должность - преподаватель
-
Название методических рекомендаций: Методические указания по выполнению лабораторных работ и практических занятий
-
Полное наименование учебного заведения: Областное государственное автономное профессиональное образовательное учреждение «Ракитянский агротехнологический техникум»
-
Адрес образовательного учреждения: пос.Ракитное Белгородской области, ул.Коммунаров,11
Представленные на рецензию лабораторные работы и практические занятия преподавателя включают теоретическую часть, экспериментальную часть, контрольные вопросы и список литературы.
В теоретической части изложен материал, необходимый для подготовки студентов к лабораторной работе.
Экспериментальная часть представляет собой логично выстроенный ход работы, включающий выполнение опытов в лаборатории с использованием имеющегося оборудования.
Рецензируемые методические указания к выполнению лабораторных работ и практических занятий по курсу Химия являются завершенной учебно-методической работой, которая рекомендуется для использования в качестве необходимого материала для подготовки лабораторных работ и практических занятий студентами Ракитянского агротехнологического техникума.
-
Фамилия, имя, отчество рецензента _____________________________________
-
Должность ___________________________________________________________
-
Место работы ________________________________________________________
М.П.
СОДЕРЖАНИЕ
Введение
Перечень лабораторных работ
Перечень практических работ
Методические рекомендации к лабораторной работе №1. Изучение свойств спиртов
Методические рекомендации к лабораторной работе №2. Получение и свойства карбоновых кислот.
Методические рекомендации к лабораторной работе №3. Решение экспериментальных задач на распознавание органических веществ.
Методические рекомендации к лабораторной работе №4. Изучение свойств углеводов.
Методические рекомендации к практической работе №1. Расчеты по химическим уравнениям. Решение задач.
Методические рекомендации к практической работе №2. Решение задач на нахождение массовой доли растворённого вещества
Методические рекомендации к практической работе №3. Составление уравнений окислительно-восстановительных реакций методом электронного баланса
Методические рекомендации к практической работе №4. Влияние различных факторов на скорость химической реакции
Методические рекомендации к практической работе №5. Генетическая связь неорганических соединений
Методические рекомендации к практической работе №6. Решение задач на идентификацию неорганических соединений
Методические рекомендации к практической работе №7. Составление структурных формул изомеров и названий предельных углеводородов
Методические рекомендации к практической работе №8. Составление формул непредельных углеводородов».
Методические рекомендации к практической работе№9. Решение расчётных задач на нахождение молекулярной формулы органического соединения
Методические рекомендации к практической работе№10. Составление структурных формул изомеров спиртов
Список литературы
Перечень лабораторных работ
Наименование лабораторной работы
Количество часов
Лабораторная работа №1.Изучение свойств спиртов
2
Лабораторная работа №2.«Получение и свойства карбоновых кислот»
2
Лабораторная работа№3. «Решение экспериментальных задач на распознавание органических веществ.»
2
Лабораторная работа №4. «Изучение свойств углеводов»
2
Всего:
8
Перечень практических работ
Наименование лабораторной работы
Количество часов
Практическая работа № 1 «Расчеты по химическим уравнениям. Решение задач»
2
Практическая работа № 2 «Решение задач на нахождение массовой доли растворённого вещества
1
Практическая работа № 3 «Составление уравнений окислительно-восстановительных реакций методом электронного баланса»
2
Практическая работа № 4 «Влияние различных факторов на скорость химической реакции»
2
Практическая работа № 5 «Генетическая связь неорганических соединений»
2
Практическая работа № 6 «Решение задач на идентификацию неорганических соединений»
2
Практическая работа № 7 «Составление структурных формул изомеров и названий предельных углеводородов»
2
Практическая работа №8«Составление формул непредельных углеводородов»
2
Практическая работа № 9 «Решение расчетных задач на нахождение молекулярной формулы неорганических соединений»
1
Практическая работа № 10 «Составление структурных формул изомеров спиртов»
2
Всего:
18
ВВЕДЕНИЕ
Данные методические указания предназначены для выполнения практических работ по дисциплинеХимияобучающимися начального профессионального образования по профессии35.02.08 Электрификация и автоматизация сельского хозяйства
Практические занятия дополняют теоретический курс, позволяют лучше усвоить его, знакомят с фактическим материалом на практике. Целью практических занятий по химии является формирование и совершенствование практических умений и навыковобучающихся в выполнении химического эксперимента с приобретение навыков работы с химическими реактивами, лабораторной посудой, воспитывать аккуратность при работе с опасными веществами, решении экспериментальных задач по распознаванию классов веществ, решении типовых задач.
В методических указаниях даны пояснения к выполнению практических работ. После каждой работы приведены вопросы для проверки.
Каждый обучающийся должен вести рабочую тетрадь, в которую заносятся:
-
Дата выполнения работы
-
Номер работы и её наименование;
-
цель работы
-
задание, которое требуется выполнить
-
Перечень необходимого оборудования
-
Перечень используемых веществ и реактивов
-
Краткое описание хода работы, условий проведения опытов и наблюдений (составляется в произвольной форме, сопровождается рисунками и схемами приборов; наблюдения удобно свести в таблицу).
-
Уравнения протекающих реакций
-
выводы
Все лабораторные и практические работы выполняются в учебной лаборатории техникума. После выполнения всех лабораторных и практических работ рабочая тетрадь подписывается преподавателем-руководителем лабораторных и практических работ и предъявляется для получения зачета по дисциплине «Химия».
Материал по каждому занятию излагается в следующей последовательности: вначале кратко формулируется цель занятия, затем приводятся краткие теоретические сведения и порядок выполнения, приводится перечень необходимого оборудования и материалов, а также методические указания по проведению лабораторной и практической работы и контрольные вопросы.
Преподаватель принимает выполненную студентом лабораторную работу или практическую в индивидуальном порядке. Для зачета, по окончанию лабораторно-практических занятий, студент представляет надлежащим образом оформленную тетрадь.
Целесообразно в конце занятия сообщать тему следующего практического занятия и указывать литературные источники. Обучающиеся в таких случаях приходят с готовыми конспектами, и преподавателю остается дать лишь целевую установку занятия, распределить задания, показать технику выполнения. После этого обучающиеся приступают к самостоятельной работе.
В результате освоения дисциплины обучающийся должен уметь:
-
называть изученные вещества по тривиальной или международной номенклатуре;
-
определять валентность и степень окисления химических элементов, тип химической связи в соединениях, заряд иона, характер среды в водных растворах неорганических и органических соединений, окислитель и восстановитель, принадлежность веществ к разным классам неорганических и органических соединений;
-
характеризовать элементы малых периодов по их положению в Периодической системе Д.И. Менделеева; общие химические свойства металлов, неметаллов, основных классов неорганических и органических соединений; строение и химические свойства изученных неорганических и органических соединений;
-
объяснять: зависимость свойств веществ от их состава и строения, природу химической связи (ионной ковалентной, металлической и водородной), зависимость скорости химической реакции и положение химического равновесия от различных факторов;
-
выполнять химический эксперимент: по распознаванию важнейших неорганических и органических соединений;
-
проводить: самостоятельный поиск химической информации с использованием различных источников (научно-популярных изданий, компьютерных баз данных, ресурсов Интернета); использовать компьютерные технологии для обработки и передачи химической информации и ее представления в различных формах;
-
связывать: изученный материал со своей профессиональной деятельностью;
-
решать: расчетные задачи по химическим формулам и уравнениям;
-
использовать приобретенные знания и умения в практической деятельности и повседневной жизни:
-
для объяснения химических явлений, происходящих в природе, быту и на производстве;
-
определения возможности протекания химических превращений в различных условиях и оценки их последствий;
-
экологически грамотного поведения в окружающей среде;
-
оценки влияния химического загрязнения окружающей среды на организм человека и другие живые организмы;
-
безопасного обращения с горючими и токсичными веществами и лабораторным оборудованием;
-
приготовления растворов заданной концентрации в быту и на производстве;
-
критической оценки достоверности химической информации, поступающей из разных источников.
знать:
-
важнейшие химические понятия: вещество, химический элемент, атом, молекула, относительные атомная и молекулярная массы, ион, аллотропия, изотопы, химическая связь, электроотрицательность, валентность, степень окисления, моль, молярная масса, молярный объем газообразных веществ, вещества молекулярного и немолекулярного строения, растворы, электролит и неэлектролит, электролитическая диссоциация, окислитель и восстановитель, окисление и восстановление, тепловой эффект реакции, скорость химической реакции, катализ, химическое равновесие, углеродный скелет, функциональная группа, изомерия, гомология;
-
основные законы химии: сохранения массы веществ, постоянства состава веществ, Периодический закон Д.И. Менделеева;
-
основные теории химии; химической связи, электролитической диссоциации, строения органических и неорганических соединений;
-
важнейшие вещества и материалы: важнейшие металлы и сплавы; серная, соляная, азотная и уксусная кислоты; благородные газы, водород, кислород, галогены, щелочные металлы;основные, кислотные и амфотерные оксиды и гидроксиды, щелочи, углекислый и угарный газы, сернистый газ, аммиак, вода, природный газ, метан, этан, этилен, ацетилен, хлорид натрия, карбонат и гидрокарбонат натрия, карбонат и фосфат кальция, бензол, метанол и этанол, сложные эфиры, жиры, мыла, моносахариды (глюкоза), дисахариды (сахароза), полисахариды (крахмал и целлюлоза), анилин, аминокислоты, белки, искусственные и синтетические волокна, каучуки, пластмассы.
Правила выполнения лабораторных работ
Перед началом выполнения каждой лабораторной работы проводится опрос с целью проверки знаний и готовности обучающихся к выполнению работы и заданий к ним.
Оборудование лаборатории и рабочих мест лаборатории:
рабочее место преподавателя;
рабочие столы, инвентарь, лабораторная посуда, лабораторное оборудование, вспомогательные приспособления, нагревательные приборы, приборы для получения газа, приборы для фильтрования, электронные весы, химические реактивы.
Практическая работа №1.
«Расчеты по химическим уравнениям. Решение задач»
Цель работы: систематизация и углубление знаний об уравнениях химических реакций, отработка практического навыка всоставлении уравнений химических реакций, в решении типовых задач на вычисление массы (или количества) исходных веществ или продуктов реакции по уравнениям химических реакций.
Теоретические сведения
Уравнение химической реакции - это условная запись химического процесса посредством химических формул, коэффициентов перед ними и математических знаков.
В основе составления уравнений химических реакций лежит закон сохранения массы вещества, согласно которому масса веществ, вступивших в реакцию, равна массе образовавшихся веществ. Это значит, что в результате химической реакции атомы не исчезают и не возникают, происходит лишь их перегруппировка. Следовательно, в химическом уравнении число атомов каждого элемента в исходных веществах и продуктах реакции должно быть одинаковым.
ПРАВИЛА СОСТАВЛЕНИЯ УРАВНЕНИЙ ХИМИЧЕСКИХ РЕАКЦИЙ
(с примерами)
-
В левой части уравнения записывают через знак «+» формулы веществ, вступающих в реакцию, и ставят стрелку:
Н2+О2
-
После стрелки в правой части уравнений пишут формулы веществ, образовавшихся в результате реакции:
Н2+О2 Н2О
-
Расставляют коэффициенты перед формулами веществ так, чтобы слева и справа число атомов каждого элемента было одинаковым:
а) уравнивают число атомов кислорода слева и справа, поставив перед формулой воды коэффициент «2»;
б) уравнивают число атомов водорода слева и справа, поставив коэффициент «2» перед формулой водорода:
2Н2+О2 2Н2О
-
Проверяют число атомов каждого элемента в левой и правой частях уравнения и ставят знак «=»:
2Н2+О2=2Н2О
@ Задание 1. Расставьте коэффициенты в уравнении реакции:
a) Na + Н2NaH б) Са + N2Ca3N2
в) А1+ 02 А1203 г) Р + 02 Р205
д) Са+ НClCaCl2+H2 е) Fe + 02Fe203
ж) H2S+ 02 H20+SO2 з) KBr + Cl2 KCl+Br2
и) Al+ HClAlCl3+ Н2 к) Zn+ HClZnCl2+ Н2
л) HN03+ PH3P04 + N02+ Н20 м)Си+ Н2S04(конц)CuS04+ S02+ H20
АЛГОРИТМ РЕШЕНИЯ ЗАДАЧ НА ВЫЧИСЛЕНИЕ МАССЫ (ИЛИ КОЛИЧЕСТВА) ИСХОДНЫХ ВЕЩЕСТВ ИЛИ ПРОДУКТОВ РЕАКЦИИ ПО УРАВНЕНИЯМ ХИМИЧЕСКИХ РЕАКЦИЙ
-
Записывают уравнение соответствующей химической реакции.
-
По уравнению реакции определяют количество вещества (n), молярную массу (М) и массу по формуле (m=n·M) исходных веществ и продуктов; записывают эти данные под соответствующими формулами.
-
Над формулами записывают данные из условия задачи.
-
Если вещества содержат примеси, нужно определить массу чистого вещества.
-
Необходимо соблюдать единицы измерения и вести вычисления в одинаковых единицах.
-
Составляют пропорцию и решают её или пользуются соответствующей формулой расчёта.
-
Записывают ответ.
Пример 1: Какое количество вещества меди потребуется для получения 20г оксида меди СuО?
Дано: m (CuO)=20г.
Найти: n(Cu)=?
Решение: x моль 20 г
2Cu +О22 CuО
n 2 моля 2 моля
М 64 г/моль 80 г/моль
m 128 г 160 г
Способ 1.
2 моля Сu-160 г СuО
х моль Сu-20 г СuО
х=2·20/160=0,25; n(Cu)=0,25 моля
Способ 2.
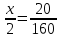 x=
x=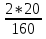 =0,25; n(Cu)=0,25 моля.
=0,25; n(Cu)=0,25 моля.
Ответ:n(Cu)=0,25 моля.
Пример 2: Вычислите количество вещества оксида натрия, образовавшегося в результате взаимодействия натрия количеством вещества 2,3 моль с достаточным количеством кислорода (4Na+O2=2Na2O).
2.3моль х моль
4 Na+O2=2Na2O
4 моль 2 моль
х/2моль=2,3моль/4моль
х=2,3*2/4=1,15 моль.
Ответ: n(Na2O) =1.15 моль
Задание 2. Решите задачи:
Задача 1. Вычислите количество вещества хлора, требуемого для получения 0,6 моля хлорида железа FeCl3.
Задача 2. Рассчитайте массу оксида свинца, если по реакции PbO+H2=Pb+H2O получили 20,7 г свинца.
Задача 3. Вычислите массу серы, необходимую для получения оксида серы (IV) количеством вещества 4 моль (S+O2=SO2).
Содержание отчёта
-
Записать уравнения реакций и указать коэффициенты, согласно правилам составления уравнений химических реакций
-
Решить задачу №1 по указанному алгоритму и рассмотренному примеру, где нужно указать количество вещества хлора, требуемого для получения 0,6 моля хлорида железа. Записать полный ответ в задаче.
-
Решить задачу №2 по указанному алгоритму, где нужно указать массу оксида свинца. Записать полный ответ в задаче.
-
Решить задачу №3 по указанному алгоритму, где нужно указать массу серы. Записать полный ответ в задаче.
Контрольные вопросы
-
Что называется уравнением химической реакции?
-
Какой закон лежит в основе составления уравнений химических реакций?
-
Сформулируйте закон сохранения массы веществ. -
Практическая работа №2.
«Решение задач на нахождение массовой доли растворённого вещества»
Цель работы: закрепление знаний о химических свойствах воды, отработка практического навыка в решении типовых задач на вычисления с использованием массовой доли растворённого вещества.
Теоретические сведения
Массовая доля растворённого вещества ω - это отношение массы растворённого вещества m к массе раствора mр:
ω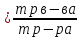 ∙100%
∙100%
Массовую долю выражают в долях единицы или в процентах.
Масса раствора складывается из массы растворённого вещества и массы растворителя:
mр-ра=mр-го в-ва+mр-ля
Если известна плотность раствора ρ и объём V, то массу раствора можно рассчитать по формуле:
mp=ρ∙V
Плотность жидкостей и твёрдых веществ измеряется в г/см3; 1 см3=1 мл.
@Пример:При выпаривании раствора нитрата натрия NaNO3 массой 160г образовался сухой остаток массой 4г. Какова массовая доля нитрата натрия в растворе?
Решение:
Выпаривание - это процесс удаления растворителя. Следовательно, сухой остаток - это масса растворённого вещества. Зная массы раствора и растворённого вещества, рассчитываем массовую долю по формуле:
wр: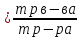
ω (NaNO3)=4/160=0,025 или 2,5%
Ответ: массовая доля NaNO3 в растворе 2,5%.
Задания: Решите задачи:
Задача 1. В 100 граммах воды (Н2О) растворили 25 грамм хлорида алюминия (AlCl3). Определите массовую долю вещества в полученном растворе.
Задача 2. В бензоле (С6Н6) объёмом 170 мл растворили серу массой 1,8г. Плотность бензола равна 0,88г/мл. Определите массовую долю серы в растворе.
Содержание отчёта:
-
Записать ход решения задачи №1 согласно указанному алгоритму решения. Записать полный ответ задачи, где нужно указать массу раствора, массовую долю вещества.
-
Записать ход решения задачи №2 согласно указанному алгоритму решения. Записать полный ответ задачи, где нужно указать массу бензола, массу раствора и массовую долю серы.
-
Сформулировать и записать вывод о проделанной работе.
Контрольные вопросы:
-
Что называется массовой долей растворённого вещества?
-
В чём выражается массовая доля растворённого вещества?
-
Каким образом можно определить массу раствора?
Практическая работа №3
«Составление уравнений окислительно-восстановительных реакций методом электронного баланса».
Цель работы: систематизация и углубление знания об окислительно-восстановительных реакциях, отработка практического навыка всоставлении уравнений окислительно-восстановительных реакций методом электронного баланса.
Теоретические сведения
Окислительно-восстановительными называются реакции, в ходе которых хотя бы один элемент изменил свою степень окисления.
ПРАВИЛА ОПРЕДЕЛЕНИЯ СТЕПЕНЕЙ ОКИСЛЕНИЯ
(с примерами)
1. У свободных атомов и у простых веществ с. о. равна 0.
Н2, Ва, N2, S, AI, Cu, F2.
2. Металлы во всех соединениях имеют положительную с. о.
(ее максимальное значение равно номеру группы - для элементов главных подгрупп):
а) у металлов главной подгруппы I группы +1;
б) у металлов главной подгруппы II группы +2;
в) у алюминия +3.
K2+О, Ca+2CО3, AI+3CI3, Li3+N, Ba+2S04, Mg+2(N03)2.
3. В соединениях кислород имеет с. о. -2 (исключения:OF2 - +2, и пероксиды: Н202, К202 --1).
Н2С03-2, К2О-2
4. В соединениях с неметаллами у водорода с. о. +1,
а с металлами-1:
H+CI, КН -1, NH3+.
-
В соединениях сумма с. о. всех атомов равна 0.
Образец. Н2+Сх 03-2
+1 2 +х + (-2) 3=0
х=+4 (С+4)
Теория окислительно-восстановительных реакций
Атомы, молекулы и ионы, отдающие электроны; называются восстановителями. Во время реакции они окисляются. Например:Al- Зе-→Аl0; Н20- 2е → 2Н+; 2Сl-- 2е- С12°
При окислении степень окисления повышается.
Из простых веществ важнейшими восстановителями являются металлы, водород, уголь и др., среди сложных - восстановительными свойствами будут обладать те, в которых имеются атомы элементов с низшей степенью окисления:
HI-, HCl-, N-3H3,H2S-2идр.
Чем ниже степень окисления элемента, чем меньше его электроотрицательность, тем сильнее восстановительные свойства.
Атомы, молекулы или ионы, присоединяющие электроны, называются окислителями. В ходе реакции они восстанавливаются. Например:
S0 + 2ё → S-2; С12 + 2ё 2Сl-; Fe+3+ ё ->Fe+2
При восстановлении степень окисления понижается.
Из простых веществ важнейшими окислителями являются галогены и кислород, среди сложных веществ окислительными свойствами будут обладать те, в состав которых входят атомы с высшей степенью окисления:
КМп+7О4; К2Сг2+607; Си+2О; Fe+3Cl3 и др.
Чем выше степень окисления элемента и больше его электроотрицательность, тем сильнее окислительные свойства.
Метод электронного баланса
При расстановки коэффициентов методом электронного баланса придерживаются следующего алгоритма:
-
Расставить степени окисления всех элементов.
-
Выбрать элементы, изменившие степень окисления.
-
Выписать эти элементы и показать схематично переход электронов (составить электронный баланс).
-
Число перешедших электронов снести крест накрест и, если нужно, сократить. Эти числа будут коэффициентами в уравнении.
-
Расставить коэффициенты из электронного баланса.
-
Сравнением числа атомов каждого элемента в левой и правой части уравнения реакции определить и проставить недостающие коэффициенты.
Примечание: Индекс в молекулах простых веществ переносится в электронный баланс, индексы из формул сложных веществ в баланс не переносятся.
Пример:
2KMn+7О4 + 16HCl-2Mn+2Cl2+2KCl+5Cl20+ 8H20
Мn+7 +5ё Мn+2 2 - окислитель
2Сl- - 2ё Сl20 5 - восстановитель
Коэффициенты, взятые из электронного баланса, подчеркнуты одной чертой.
Задание. Расставьте коэффициенты в схемах реакций методом электронного баланса. Укажите окислитель и восстановитель, процессы окисления и восстановления.
a) Na + Н2NaH б) Са + N2Ca3N2
_----------------------------------------------------- ---------------------------------------------------------
--------------------------------------------------------- ---------------------------------------------------------
в) А1+ 02 А1203 г) Р + 02 Р205
------------------------------------------------------------ ------------------------------------------------------------------
------------------------------------------------------------ ----------------------------------------------------------------------
д) NH3+ 02 N0+ Н20
----------------------------------------------------------------------------------------------------
----------------------------------------------------------------------------------------------------
е)KMnO4+Na2SO3+H2SO4=MnSO4+Na2SO4+ K2SO4+H2O
-------------------------------------------------------------------------------------------------------------------------------------------------------------------------------ж)С02+ MgMgO+ С
------------------------------------------------------------------------------------------------------з) HN03+ PH3P04 + N02+ Н20
-----------------------------------------------------------------------------------------------к)K2S+KMnO4 +H2O= MnO2+S+KOH
------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
л) P + HNO3 + Н20 = H3PO4 + NO
Содержание отчёта:
-
Записать уравнения реакций и при помощи алгоритма расставить в них коэффициенты методом электронного баланса.
-
Указать окислитель и восстановитель, процессы окисления и восстановления.
-
Записать вывод о проделанной работе
Контрольные вопросы
-
Какие реакции называются окислительно-восстановительными?
-
Каковас.о. простых веществ?
-
У каких элементов с.о. постоянная?
-
Кто такие восстановители? Какой процесс с ними при этом происходит? Приведите примеры.
-
Кто такие окислители? Какой процесс с ними при этом происходит? Приведите примеры.
-
На конкретном примере покажите алгоритм проставления коэффициентов методом электронного баланса.
Практическая работа №4
«Влияние различных факторов на скорость химической реакции»
Цель работы: систематизация и углубление знаний, умений и навыков в объяснении влияния различных факторов на скорость химических реакций путем решения расчётных задач.
Теоретические сведения
Скорость химической реакции-это изменение концентрации одного из реагирующих веществ или одного из продуктов реакции в единицу времени.
Скорость химической реакции определяется формулой
V= C2-C1/t2-t1
Где С1и С2 - молярные концентрации реагирующих и образующихся веществ соответственно в момент времени t1 и t2.
Скорость химической реакции выражается в моль/(л*с)
Зависимость скорости химической реакции от температуры определяется правилом Вант-Гоффа: при изменении температуры(повышении или понижении) на каждые 100С скорость реакции соответственно изменяется(увеличивается или уменьшается в 2-4 раза.
Математически оно выражается формулой:
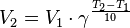
где V1 и V2 скорости химической реакции соответственно при температуре Т1и Т2, γ- температурный коэффициент, который показывает во сколько раз увеличивается скорость химической реакции с повышением температуры реагирующих веществ на каждые 100С.
Пример 1:
Концентрация вещества за 20секунд изменилась 0,6моль/л до 0,004моль/л. Найти скорость реакции.
Решение :
Дано:
С1-0,6моль/л V= C2-C1/t=0,004-0,6/20=0,03моль/(л*с)
С2-0,004моль/л
t-20сек
Найти:
v-?
Ответ :v=0,03моль/(л*с)
Если скорость рассчитывается по исходным веществам, то перед формулой знак '-', т.к. концентрация исходных веществ в результате реакции уменьшается.
Если по продуктам реакции, концентрация которых возрастает, то знак '+'.
Пример 2:
Температурный коэффициент реакции равен 2. Определить во сколько раз увеличилась скорость реакции при новых температурах от 20 до 50 градусов.
Дано: Решение:
γ-2 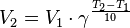
t1-20V2/v1= γt2-t1/10=250-20/10=23=8
t2-50
Найти:
V2/v1-?
Ответ: скорость увеличится в 8 раз.
Задания: решите задания.
Задача №1: Концентрация веществ за 10 сек уменьшилась с 1,2моль/л до 0,2моль/л. Найдите скорость реакции.
Задача №2: Реакция протекает по уравнению А+В=2С. Начальная концентрация вещества А равна 0,22моль/л, а через 10 сек-0,215моль/л. Вычислите среднюю скорость реакции.
Задача №3: Температурный коэффициент реакции равен 3. Во сколько раз увеличилась скорость реакции при увеличении температуры от 00С до 400С.
Ход ответа:
1. Записать ход решения задачи №1 согласно указанному алгоритму решения. Записать полный ответ задачи, где нужно указать скорость реакции.
2. Записать ход решения задачи №2 согласно указанному алгоритму решения. Записать полный ответ задачи, где нужно указать скорость реакции.
3. Записать ход решения задачи №3 согласно указанному алгоритму решения. Записать полный ответ задачи, где нужно указать во сколько раз увеличится скорость химической реакции.
Контрольные вопросы:
1. Что такое скорость химической реакции?
2. В каких единицах выражается скорость химической реакции?
3. Каким образом можно определить скорость химической реакции?
Практическая работа №5
«Генетическая связь неорганических соединений»
Цель работы: систематизация и углубление знаний, умений и навыков в объяснении связи между соединениями различных классов.
Теоретические сведения
Генетическая связь-это связь между разными классами соединений, в результате которой из одного класса соединений можно получить вещество другого класса неорганических соединений.
Генетическим называют ряд веществ- представителей разных классов, являющихся соединениями одного химического элемента, связанных взаимопревращениями и отражающих общность происхождения этих веществ.
Выделяют два вида генетических рядов:
-ряд металла
-ряд неметалла
Пути генетической связи между веществами:
Металл→ основной оксид→ соль→ основание→ новая соль
Неметалл→ кислотный оксид→ кислота→соль
МЕТАЛЛ
Неметалл
КИСЛОТНЫЙ ОКСИД
ОСНОВНОЙ ОКСИД
соль
ОСНОВАНИЕ
КИСЛОТА
ПРИМЕР 1:
Cu→CuO→CuCl2→Cu(OH)2↓→CuSO4
1.2Cu + O2= 2CuO
2. CuO+ 2 HCl= CuCl2+ H2O
3.CuCl2+2 NaOH=Cu(OH)2↓+ 2NaCl
4. Cu(OH)2↓+ H2SO4=CuSO4+2H2O
ПРИМЕР 2:
С→СO2→H2CO3→CaCO3
1. C + O2 =СO2
2. СO2+ H2O = H2CO3
3. H2CO3+ Ca(OH)2 =CaCO3 +2H2O
Задание 1: осуществить цепочку превращений
Li→Li2O→LiOH→Li2SO4
Задание 2: осуществить цепочку превращений
Na→Na2O→NaOH→Na2SO4
Задание 3: осуществить цепочку превращений
S→SO2→H2SO3→K2SO3
Задание 4: осуществить цепочку превращений
P→P2O5→H3PO4→Ca3(PO4)2
Ход ответа:
1. Записать ход решения задания №1 согласно указанному алгоритму решения.
2.Записать ход решения задания №2 согласно указанному алгоритму решения.
3. Записать ход решения задания №3 согласно указанному алгоритму решения.
4. Записать ход решения задания №4 согласно указанному алгоритму решения.
Контрольные вопросы:
1. Что такое генетическая связь?
2. Что такое генетический ряд?
3. Какие есть виды генетических рядов?
Практическая работа №6
«Решение задач на идентификацию неорганических соединений»
Цель работы: систематизация и углубление знаний, умений и навыков в решении задач на идентификацию неорганических соединений.
Теоретические сведения
Массовая доля элемента(w) показывает, какую часть(долю) составляет масса данного элемента от всей массы вещества.
Зная массовую долю элемента, можно определить содержание элемента в любом количестве вещества.
Зная массовые доли всех элементов, составляющих вещество, можно определить химическую формулу вещества.
Пример № 1
Пусть установлено, что вещество, состоящее из углерода и водорода, содержит 75% углерода. Какова формула этого вещества?
Запишем формулу вещества как CxHy. Составим уравнение связывающее известные величины Ar(C)=12, Ar(H)=1, w( C )=75%
W(Н)=100-75=25%
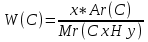 и
и 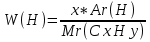
Из этих уравнений запишем выражение для x и y и вычислим их отношение
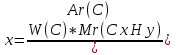 и
и 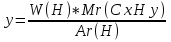
X:Y=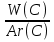 :
: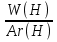 =
=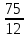 :
: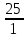 =6,25:25=0,25:1=1:4
=6,25:25=0,25:1=1:4
Следовательно, в данном веществе числа атомов углерода и водорода относятся как 1:4, значит его формула СН4.
Пример №2
Известно, что питьевая сода содержит 27,38% натрия, 1,19% водорода, 14,29% углерода и 57,14% кислорода. Требуется определить формулу питьевой соды NaxHyCzOu
X:Y:Z:U= 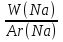 :
: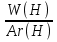 :
: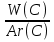 :
: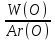 =
=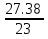 :
: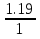 :
: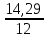 :
: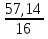 =1,19:1,19:1,19:3,57=1:1:1:3
=1,19:1,19:1,19:3,57=1:1:1:3
Таким образом формула NaHCO3.
Задание: решите задачи
Задача 1:Определите химическую формулу оксида марганца, если он содержит 63,2% марганца и 36,8% кислорода.
Задача 2:Определите химическую формулу карбоната кальция содержащего 40% кальция, 12% углерода и 48% кислорода.
Задача 3: Найти эмпирическую формулу вещества содержащего 43,4% натрия, 11,3% углерода и 45,3% кислорода.
Задача 4:Выведите простейшую формулу соединения, если известен его элементный состав:
-
27,3% углерода и 72,7% кислорода;
-
81,1% кальция и 18,9% азота;
-
17,6% натрия, 39,7% хрома и 42,7% кислорода;
-
17,8% углерода, 3% водорода и 79,2% брома.
Ход ответа:
1. Записать ход решения задачи №1 согласно указанному алгоритму решения. Записать полный ответ задачи.
2.Записать ход решения задачи №2 согласно указанному алгоритму решения. Записать полный ответ задачи.
3. Записать ход решения задачи №3 согласно указанному алгоритму решения. Записать полный ответ задачи.
4. Записать ход решения задачи №4 согласно указанному алгоритму решения. Записать полный ответ задачи.
Контрольные вопросы:
1. Что такое массовая доля элемента?
2. Каким образом можно определить формулу химического вещества?
Практическое занятие №7
«Составление структурных формул изомеров и названий предельных углеводородов».
Цель работы: отработка умений по составлениюструктурных формул изомеров алканов и их названий по международной систематической номенклатуре.
Теоретические сведения
Алканы - это предельные углеводороды, в молекулах которых все атомы связаны одинарными связями. Состав их отражает общая формула СnH2n+2.
Первые четыре члена гомологического ряда метана получили исторически сложившиеся названия. Основой названия следующихалканов нормального строения стали греческие числительные (см. таблицу).
Для составления названий органических веществ по номенклатуре ИЮПАК необходимо знать формулы и названия радикалов. Радикал - это одновалентная частица, которая получается при отщеплении от молекулы алкана атома водорода, т.е. частица, содержащая неспаренный электрон. Название радикала происходит от названия соответствующего алкана с заменой суффикса -ан на суффикс -ил(см. таблицу).
Название
Формула
Формула радикала
Название радикала
Метан
СН4
СН3-
Метил
Этан
С2Н6
С2Н5-
Этил
Пропан
С3Н8
С3Н7-
Пропил
Бутан
С4Н10
С4Н9-
Бутил
Пентан
С5Н12
С5Н11-
Пентил
Гексан
С6Н14
С6Н13-
Гексил
Гептан
С7Н16
С7Н15-
Гептил
Октан
С8Н18
С8Н17-
Октил
Нонан
С9Н20
С9Н19-
Нонил
Декан
С10Н22
С10Н21-
децил
Изомеры - это вещества, имеющие одинаковые молекулярные, но разные структурные формулы и, следовательно, разные свойства.
Например, у вещества бутана, имеющего формулу С4Н10, есть два изомера, имеющие следующие структурные формулы
СН3 - СН2- СН2 - СН3 и СН3 - СН - СН3 .
СН3
 Запомни! Чтобы среди веществ найти изомеры, надо структурные формулы свернуть в молекулярные. У изомеров молекулярные формулы будут одинаковые. Например:
Запомни! Чтобы среди веществ найти изомеры, надо структурные формулы свернуть в молекулярные. У изомеров молекулярные формулы будут одинаковые. Например:
а)СН3 - СН2 - СН2 - СН3 (С4Н10); б) СН3 - СН2 - СН - СН3 (С5Н12); в) СН3 - СН - СН3 (С4Н10)
СН3 СН3
Таким образом, вещество а) и в) изомеры, т.к. имеют разное строение, но одинаковую молекулярную формулу - С4Н10.
В соответствии с международной номенклатурой следует придерживаться следующих правил при составлении названия алканов.
1. В структурной формуле выбирают самую длинную цепь атомов углерода (главную цепь).
2. Атомы углерода главной цепи нумеруют, начиная с того конца, к которому ближе разветвление - боковая цепь.
3. В начале названия перечисляют радикалы и другие заместители с указанием номеров атомов углерода, с которыми они связаны. Если в молекуле присутствуют несколько одинаковых радикалов (два, три, четыре и т.д.), то перед их названием ставят соответственно частицы ди-, три-, тетра- и т.д.
4. Основой названия служит наименование предельного углеводорода с тем же числом атомов углерода, что и в главной цепи.
Задание 1.(образец) Назовите вещества
1 2 3 4
СН3 СН СН2 СН3 (С5Н12)
СН3
2- метилбутан
СН3 СН3
1 2 3 4 5 6 5 4 3 2 1
СН3 СН СН2 СН СН2 СН3(С8Н18) СН3 СН СН2 С СН3(С8Н18)
СН3СН3СН3
2,4 - диметилгексан 2,2,4 - триметилпентан
8 7 6 5 4 3 2 1
СН3 СН2 СН СН2СН2СН2 СН СН3 (С11Н24)
С2Н5 СН3
2-метил-6-этилоктан
Найди, есть ли изомеры среди вышеперечисленных веществ.
Приведите три доказательства, что вышеперечисленных вещества гомологи.
Ответ: 2,4 - диметилгексан и 2,2,4 - триметилпентан изомеры, т.к. имеют одинаковую молекулярную формулу С8Н18 .
Вышеперечисленные вещества гомологи, т.к. 1) имеют одинарную связь; 2) гомологическую формулуСnH2n+2; 3) суффикс -ан в названии.
Задание 2.(образец) Напишите структурную формулу 2,4-диметилпентана, составьте структурные формулы: а) гомолога с более длинной углеродной цепью; б) изомера. Назовите их.
Алгоритм.1. 2,4-диметилпентан - корень слова «пентан», пишем главную цепь С-С-С-С-С.
2. Нумеруем главную цепь, в положении 2 и 4 ставим два радикала «метил»
1 2 3 4 5
С-С-С-С-С
СН3 СН3
3. В основной (главной) цепи доставим недостающие атомы Н (в соответствии с валентностью)
1 2 3 4 5
СН3-СН-СН2-СН-СН3
СН3 СН3
а) Запомни! Чтобы составить гомолог надо структурную исходную формулу вещества свернуть в молекулярную. Гомолог будет отличаться на одну или несколько СН2- групп.
Запомни! Чтобы составить гомолог надо структурную исходную формулу вещества свернуть в молекулярную. Гомолог будет отличаться на одну или несколько СН2- групп.
1 2 3 4 5
СН3-СН-СН2-СН-СН3(С7Н16)
СН3 СН3
Следовательно, гомолог с более длинной углеродной цепью, может иметь формулу С8Н18
СН3 СН2СН2СН2СН2СН2СН2 СН3
октан
б) изомер имеет туже формулу С7Н16, но другое строение
СН3 СН2СН2СН2СН2 СН СН3
СН3
2-метилгептан
@Задание 1.Используя образцы решений, выполни следующее задания:
1. Назовите вещества
СН3 СН СН2 СН3
СН3
______________________________
СН3 СН3
СН3 СН СН2 СН СН2 СН3СН3 С СН2 СН СН3
СН3СН3СН3
_____________________________ __________________________________
СН3 СН2 СН СН2 СН СН2СН2 СН3
С2Н5 СН3
___________________________________________
Найди, есть ли изомеры среди вышеперечисленных веществ.
Приведите три доказательства, что вышеперечисленные вещества гомологи.
Ответ:_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Задание 2. Напишите структурные формулы: а) 2-метилгексана, б) 2,2- диметилпентана, в) 2-метилбутана, г) 2,3,5 -триметилгексана, д) 3,3 -диметилгексана, е) 2,4 - диметил-3- этилоктана. Для вышеперечисленных веществ составьте структурные формулы: а) гомологов с менее длинной углеродной цепью; б) изомеров. Назовите их.
Структурные формулы
Гомологи с менее длинной углеродной цепью
Изомеры
а)
2-метилгексан
б)
2,2- диметилпентан
в)
2-метилбутан
г)
2,3,5-триметилгексан
д) 3,3 -диметилгексан
е)
2,4 - диметил-3- этилоктан
Содержание отчёта
-
Запишите вещества, данные в задании №1 и используя образец решения, дайте им названия по международной систематической номенклатуре.
-
Найдите среди перечисленных веществ изомеры, если они есть, и укажите их.
-
Укажите вещества гомологи среди перечисленных веществ и дайте им названия.
-
В задании №2 напишите структурные формулы приведенных веществ и укажите вещества - гомологи с менее длинной углеродной цепью; вещества - изомеры.
Контрольные вопросы
-
Какие углеводороды относятся к алканам?
-
Что такое радикал? Каким образом складывается название радикалов?
-
Дайте определение изомеров. Приведите примеры изомеров.
-
Перечислите сходства гомологов ряда метана (алканов).
-
Основные правила составления названия алканов (основы международной номенклатуры).
Практическое занятие №8.
«Составление формул изомеров непредельных углеводородов».
Цель работы: отработка умений по составлениюструктурных формул изомеров непредельных углеводородов и их названий по международной систематической номенклатуре.
Теоретические сведения
Алкены - это непредельные углеводороды, в молекулах которых имеются атомы углерода, связанные двойной связью. Состав их отражает общаяформулаСnH2n.
Названия алкенов по рациональной номенклатуре производят от названий соответствующих предельных углеводородов с заменой суффикса -ан на -илен.
Название
Формула
Этен
С2Н4
Пропен
С3Н6
Бутен
С4Н8
Пентен
С5Н10
Гексен
С6Н12
Гептен
С7Н14
Октен
С8Н16
Нонен
С9Н18
Децен
С10Н20
Алкины-это непредельные углеводороды, молекулы которых содержат, помимо одинарных связей, одну тройную углерод-углеродную связь. Состав их отражает общая формула СnH2n-2
Название
Формула
Ацетилен
С2Н2
пропин
С3Н4
бутин
С4Н6
пентин
С5Н8
Гексин
С6Н8
гептин
С7Н12
октин
С8Н14
нонин
С9Н16
Децин
С10Н18
Изомеры - это вещества, имеющие одинаковые молекулярные, но разные структурные формулы и, следовательно, разные свойства.
Например, у вещества бутилена -1, имеющего формулу С4Н8, есть два изомера, имеющие следующие структурные формулы
СН2= СН- СН2 - СН3 и СН2= С(СН3) - СН3 .
 Запомни! Чтобы среди веществ найти изомеры, надо структурные формулы свернуть в молекулярные. У изомеров молекулярные формулы будут одинаковые. Например:
Запомни! Чтобы среди веществ найти изомеры, надо структурные формулы свернуть в молекулярные. У изомеров молекулярные формулы будут одинаковые. Например:
а)СН2= СН- СН2 - СН3 (С4Н8); б) СН2=СН- СН(СН3)- СН3 (С5Н10); в) СН2=С(СН3) - СН3 (С4Н10)
Таким образом, вещество а) и в) изомеры, т.к. имеют разное строение, но одинаковую молекулярную формулу - С4Н8.
В соответствии с международной номенклатурой следует придерживаться следующих правил при составлении названия алкенов.
1. В структурной формуле выбирают цепь, включающую двойную связь если даже она не является самой длинной) и нумеруют с того конца, ближе к которому расположена двойная связь. В конце названия ставят цифру, указывающую номер атома углерода при двойной связи, который должен быть наименьший.
Задание 1.(образец) Назовите вещества
4 3 2 1
СН3 СНСН= СН2(С5Н12)
СН3
3-метилбутен
8 7 6 5 4 3 2 1
СН3 СН2 СН СН2=СН2 СН2 СН СН3 (С11Н24)
С2Н5 СН3
2-метил-6-этилоктен -4
Задание 2. (образец) Напишите структурную формулу 2,4-диметилпентена -1, составьте структурные формулы: а) гомолога с более длинной углеродной цепью; б) изомера. Назовите их.
Алгоритм. 1. 2,4-диметилпентен - 1- корень слова от «пентан», пишем главную цепь С-С-С-С-С.
2. Ставим после первого атома углерода = связь С=С-С-С-С.
3. Нумеруем главную цепь, в положении 2 и 4 ставим два радикала «метил»
1 2 3 4 5
С=С-С-С-С
СН3 СН3
4. В основной (главной) цепи доставим недостающие атомы Н (в соответствии с валентностью)
1 23 4 5
СН2=С-СН2-СН-СН3
СН3 СН3
а)Запомни! Чтобы составить гомолог надо структурную исходную формулу вещества свернуть в молекулярную. Гомолог будет отличаться на одну или несколько СН2- групп.
1 2 3 4 5
СН2=С-СН2-СН-СН3 (С7Н14)
СН3 СН3
Следовательно, гомолог с более длинной углеродной цепью, может иметь формулу С8Н16
СН2=СН СН2 СН2 СН2 СН2 СН2 СН3
Октен -1
б) изомер имеет туже формулу С7Н14, но другое строение
7 6 5 4 3 2 1
СН3 СН2 СН2 СН = СН СН СН3
СН3
2-метилгептен -3
@Задание 1.Используя образцы решений, выполни следующее задания:
1. Назовите вещества
СН3 =СН СН2 СН3
СН3
СН3 СН3
СН3 СН=СН2 СН СН2 СН3СН3 С СН2 С=СН2
СН3СН3СН3
СН3 СН =СН СН2 СН СН2СН2 СН3
С2Н5 СН3
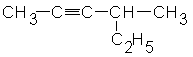
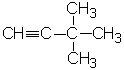
Задание 2. Напишите структурные формулы: а) 2-метилгексена-1, б) 3-метилпентена-1,в) 2-метилбутена-1, г) 2- метил- 4- этилгексена -2, д) 2, 5-диметилгексина-3, е) 4 - метилпентина - 2. Для вышеперечисленных веществ составьте структурные формулы: а) гомологов с менее длинной углеродной цепью; б) изомеров. Назовите их.
Содержание отчёта
-
Запишите вещества, данные в задании №1 и используя образец решения, дайте им названия по международной систематической номенклатуре.
-
Найдите среди перечисленных веществ изомеры, если они есть, и укажите их.
-
Укажите вещества гомологи среди перечисленных веществ и дайте им названия.
-
В задании №2 напишите структурные формулы приведенных веществ и укажитевещества - гомологи с менее длинной углеродной цепью; вещества - изомеры.
Контрольные вопросы
-
Какие углеводороды относятся к алкинам?
-
Что такое радикал? Каким образом складывается название радикалов?
-
Дайте определение изомеров. Приведите примеры изомеров.
Практическое занятие №9.
Решение расчётных задач на нахождение молекулярной формулы органического соединения
Цель работы: систематизация и углубление знаний, умений и навыков в решении задач на нахождение молекулярной формулы органического соединения
Теоретические сведения
-
Массовая доля элемента в веществе.
Массовая доля элемента - это его содержание в веществе в процентах по массе. Например, в веществе состава С2Н4 содержится 2 атома углерода и 4 атома водорода. Если взять 1 молекулу такого вещества, то его молекулярная масса будет равна:
Мr(С2Н4) = 2 • 12 + 4 • 1 = 28 а.е.м. и там содержится 2 • 12 а.е.м. углерода.
Чтобы найти массовую долю углерода в этом веществе, надо его массу разделить на массу всего вещества:
ω(C) = 12 • 2 / 28 = 0,857 или 85,7%.
Если вещество имеет общую формулу СхНуОz, то массовые доли каждого их атомов так же равны отношению их массы к массе всего вещества. Масса х атомов С равна - 12х, масса у атомов Н - у, масса z атомов кислорода - 16z.
Тогда
ω(C) = 12 • х / (12х + у + 16z)
Если записать эту формулу в общем виде, то получится следующее выражение:Массовая доля атома Э в веществе =
Атомная масса атома Э
•
число атомов Э в
молекуле
Аr(Э) • z
------
Mr(вещ.)
Молекулярная масса вещества
-
Молекулярная и простейшая формула вещества.
Молекулярная (истинная) формула - формула, в которой отражается реальное число атомов каждого вида, входящих в молекулу вещества.
Например, С6Н6 - истинная формула бензола.
Простейшая (эмпирическая) формула - показывает соотношение атомов в веществе. Например, для бензола соотношение С:Н = 1:1, т.е. простейшая формула бензола - СН. Молекулярная формула может совпадать с простейшей или быть кратной ей.
Примеры.Вещество
Молекулярная формула
Соотношение атомов
Простейшая формула
Этанол
С2Н6О
С:Н:О = 2:6:1
С2Н6О
Бутен
С4Н8
С:Н = 1:2
СН2
Уксусная кислота
С2Н4О2
С:Н:О = 1:2:1
СН2О
-
Если в задаче даны только массовые доли элементов, то в процессе решения задачи можно вычислить только простейшую формулу вещества. Для получения истинной формулы в задаче обычно даются дополнительные данные - молярная масса, относительная или абсолютная плотность вещества или другие данные, с помощью которых можно определить молярную массу вещества.
-
Относительная плотность газа Х по газу У - DпоУ(Х).
Относительная плотность D - это величина, которая показывает, во сколько раз газ Х тяжелее газа У. Её рассчитывают как отношение молярных масс газов Х и У:
DпоУ(Х) = М(Х) / М(У)
Часто для расчетов используют относительные плотности газов по водороду и по воздуху.
Относительная плотность газа Х по водороду:
Dпо H2 = M(газа Х) / M(H2) = M(газа Х) / 2
Воздух - это смесь газов, поэтому для него можно рассчитать только среднюю молярную массу. Её величина принята за 29 г/моль (исходя из примерного усреднённого состава). Поэтому:
Dповозд. = М(газа Х) / 29 -
Абсолютная плотность газа при нормальных условиях.
Абсолютная плотность газа - это масса 1 л газа при нормальных условиях. Обычно для газов её измеряют в г/л.
ρ = m(газа) / V(газа)
Если взять 1 моль газа, то тогда:
ρ = М / Vm,
а молярную массу газа можно найти, умножая плотность на молярный объём. -
Общие формулы веществ разных классов.
Часто для решения задач с химическими реакциями удобно пользоваться не обычной общей формулой, а формулой, в которой выделена отдельно кратная связь или функциональная группа.
-
Класс органических веществ
Общая молекулярная формула
Формула с выделенной кратной связью и функциональной группой
Алканы
CnH2n+2
-
Алкены
CnH2n
CnH2n+1-CH=CH2
Алкины
CnH2n−2
CnH2n+1-C≡CH
Диены
CnH2n−2
-
Гомологи бензола
CnH2n−6
С6Н5-СnH2n+1
Амины
CnH2n+3N
СnH2n+1NH2
-
Пример 1. Определить формулу вещества, если оно содержит 84,21% С и 15,79% Н и имеет относительную плотность по воздуху, равную 3,93.
Решение примера 1.
-
Пусть масса вещества равна 100 г. Тогда масса С будет равна 84,21 г, а масса Н - 15,79 г.
-
Найдём количество вещества каждого атома:
ν(C) = m / M = 84,21 / 12 = 7,0175 моль,
ν(H) = 15,79 / 1 = 15,79 моль. -
Определяем мольное соотношение атомов С и Н:
С : Н = 7,0175 : 15,79 (сократим оба числа на меньшее) = 1 : 2,25 (домножим на 4) = 4 : 9.
Таким образом, простейшая формула - С4Н9. -
По относительной плотности рассчитаем молярную массу:
М = D(возд.) • 29 = 114 г/моль.
Молярная масса, соответствующая простейшей формуле С4Н9 - 57 г/моль, это в 2 раза меньше истинно молярной массы.
Значит, истинная формула - С8Н18.
Примечание!!!!! Если плотность дана в г/л, то для вычисления молярной массы по плотности необходимо плотность умножать на постоянную Авогадро=22,4л!!!
Выполнение работы
Задача№1. Плотность углеводорода при нормальных условиях равна 1,964г/л. Массовая доля углерода равна 81,82%. Выведите молекулярную формулу этого углеводорода.
Задача №2. Выведите молекулярную формулу углеводорода, массовые доли углерода и водорода соответственно равны 85,71% и 14,29%, а его плотность равна 2,6г/л.
Задача №3. Выведите молекулярную формулу углеводорода, массовые доли углерода и водорода в котором соответственно равны 92,31% и 7,69%, а его плотность по воздуху равна 2,69.
Задача №4. Массовая доля углерода и водорода соответственно равны 88,9% и 11,1%, плотность равна 2,41 г/л. Выведите его молекулярную формулу.
Содержание отчёта:
-
Записать ход решения задачи №1 согласно указанному алгоритму решения. Записать полный ответ задачи, где нужно молекулярную формулу вещества.
-
Записать ход решения задачи №2 согласно указанному алгоритму решения. Записать полный ответ задачи, где нужно молекулярную формулу вещества.
-
Записать ход решения задачи №3 согласно указанному алгоритму решения. Записать полный ответ задачи, где нужно молекулярную формулу вещества.
-
Записать ход решения задачи №4 согласно указанному алгоритму решения. Записать полный ответ задачи, где нужно молекулярную формулу вещества.
Контрольные вопросы:
-
Что называют простейшей (эмпирической) формулой?
-
Что называют молекулярной (истинной) формулой?
-
Каким образом можно найти молекулярную формулу вещества?
Практическая работа №10
«Составление структурных формул предельных одноатомных спиртов»
Цель работы: научиться составлять структурные формулы предельных одноатомных спиртов, а также по формулам определять название спиртов.
Алгоритм названия одноатомных спиртов по формуле
-
В качестве главной выбрать самую длинную углеродную цепь, которая содержит атом углерода с группой ОН и имеет наибольшее число заместителей.
-
Пронумеровать атомы углерода в цепи, начиная с того конца, к которому ближе группой ОН. Если она в центре цепи, то нумерацию начинают с того конца, к которому ближе разветвление.
-
Цифрами указать номера атомов углерода, с которыми связаны заместители, затем назвать их.
-
Назвать главную цепь.
-
Цифрой указать номер атома углерода, от которого отходит группа ОН.
Пример:
5 4 3 2 1
СН3 - СН2 - СН - СН - СН2 - ОН 2,3-диметилпентанол-1
||
Н3ССН3
Алгоритм записи формулы одноатомных спиртов по названию
-
Записать знаки атомов углерода, исходя из названия длинной цепи.
-
Пронумеровать эти атомы углерода.
-
Записатьгруппу ОН от указанного атома углерода.
-
К указанным атомам углерода записать обозначенные заместители.
-
Проставить у всех атомов углерода недостающие атомы водорода (углерод четырехвалентен).
Пример: 2-метилпропанол-2
СН3
СН3 - С - СН3
ОН
Номенклатура спиртов - название спиртов по формуле (тест)
1. Название вещества, формула которого
СН3- СН - СН2- СН - СН2-ОН
||
СН3 СН3
-
2,4-диметилпентанол-1
-
2,4-диметилпентанол-5
-
гексанол-1
-
2,4-метилпентанол
2. Название вещества, формула которого
СН3─СН─СН─СН─ОН
│ │ │
СН3 СН3 СН3
-
3,4-диметилпентанол-2
-
1,2,3-триметилбутанол-1
-
2,3,4-триметилбутанол-4
-
2,3-диметилпентанол-4
3. Название вещества, формула которого
СН3
│
СН3─С─СН─СН2─ОН
│ │
Н3С СН3
-
2,3,3-триметилпентанол-1
-
3,3,2-триметилбутанол-1
-
2,3,3-триметилбутанол-1
-
2,2,3-триметилбутанол-4
4. Название вещества, формула которого
СН3
│
СН3─С─СН─СН2─СН2─СН2─ОН
│ │
Н3С СН3
-
2,2,3-триметилгексанол-6
-
5,5,4-триметилгексанол-1
-
5,5,4-триметилпентанол-1
-
4,5,5-триметилгексанол-1
5. Название вещества, формула которого
СН3 ОН
│ │
СН3─С─СН─СН─СН2─СН2─СН3
│ │
Н3С СН3
-
5,6,6-триметилгептанол-4
-
2,2,3-триметилгексанол-4
-
2,2,3-триметилгептанол-4
-
2,2,3-метилгептанол-4
Номенклатура спиртов - название спиртов по формуле
1. Назовите вещество, формула которого
СН3─СН2─СН─СН2─СН3
│
ОН
2. Назовите вещество, формула которого
СН3─СН2─СН2─СН─СН3
│
ОН
3. Назовите вещество, формула которого)
СН3─СН2─СН─СН─СН2─СН3
│ │
ОН СН3
4. Назовите вещество, формула которого
СН3─СН─СН─СН3
│ │
ОН СН3
5. Назовите вещество, формула которого
СН3
│
СН3─С─СН3
│
ОН
6. Назовите вещество, формула которого
СН3
│
СН3─С─СН2─СН2─СН3
│
ОН
Номенклатура спиртов - составление формул по названию
1. Укажите формулу 3-метилпентанола-2:
-
СН3─СН2─СН(СН3)─СН(ОН)─СН3
-
СН3─СН(ОН)─СН2─СН(СН3)─СН3
-
СН3─СН(ОН)─СН(СН3)─СН3
-
СН3─СН(ОН)─СН2─СН2─СН3
2. Укажите формулу 2-метилбутанола-2:
-
СН3─СН2─С(СН3)(ОН)─СН3
-
СН3─СН(СН3)─СН(ОН)─СН3
-
СН3─СН2─СН(СН3)─СН(ОН)─СН3
-
СН3─СН2─СН─СН(ОН)─СН3
3.Составьте формулу 3-метилбутанола-2:
4. Составьте формулу 3-метил-4,5-диметилгексаноланола-1:
5. Изобразите формулу 3,4-диметилпентанола-2:
Изомерия спиртов
1. Число изомерных спиртов состава С4Н10О (без оптических изомеров) равно:
-
2
-
3
-
4
-
5
2.Число изомерных спиртов состава С3Н8О (без оптических изомеров) равно:
-
1
-
2
-
3
-
4
3. Изомерами являются
-
СН3─СН2─СН2─ОН и НО─СН2─СН2─СН3
-
СН3─СН2─СН2─ОН и СН3─СН(ОН)─СН3
-
СН3─СН2─СН2─ОН и СН3─СН2─СН3
-
СН3─СН2─СН2─СН2─СН2─ОН и СН3─СН2─СН2─СН2─ОН
10. Изомером пентанола-1 не является:
-
2-метилпентанол-1
-
пентанол-2
-
пентанол-3
-
2-метилбутанол-1
11. Изомером пентанола-1 является:
-
СН3─С(СН3)2─СН2─ОН
-
СН3─СН(СН3)─СН2─ОН
-
СН3─СН2─СН2─СН2─ОН
-
СН3─СН2─СН2─ОН
12. Изомером 2-метилпентанола-1 является:
-
СН3─СН2─СН2─СН2─СН2─СН2─ОН
-
СН3─СН2─СН2─СН2─СН2─ОН
-
СН3─СН2─СН2─СН2─СН2─СН2─СН2─ОН
-
СН3─СН2─СН(СН3)─СН2─ОН
13. Составить все возможные изомеры гексанола
Лабораторная работа № 1
Изучение свойств спиртов
Цель: систематизация и углубление знаний, умений и навыков в изучении химических свойств одноатомных спиртов.
Реактивы и материалы: спирты: этиловый, пропиловый, изопропило-
вый, изоамиловый; глицерин, этиленгликоль; безводный и 2 н раствор
сульфата меди (II); оксид меди (II); концентрированный и 2 н раствор
серной кислоты; концентрированная уксусная кислота; концентриро-
ванный раствор аммиака; 0,2 н раствор нитрата серебра; 1% раствор
перманганата калия; 0,5 н раствор бихромата калия; 2 н раствор гидро-
ксида натрия; раствор йода в йодистом калии; 1%-ный спиртовой рас-
твор фенолфталеина; медная проволока; песок.
Оборудование: набор пробирок, пробка с газоотводной трубкой, стакан-
чик (100 мл), пипетка, спиртовка.
Ход работы:
Опыт 1. Растворимость спиртов в воде и их кислотный
характер
В сухую пробирку наливают 1 мл этанола. По каплям добавляют к
спирту 1 мл воды.
Раствор этанола разделяют на две пробирки и добавляют в первую
- 1-2 капли раствора лакмуса, во вторую - столько же раствора фенол-
фталеина.
Опыт повторяют с изоамиловым спиртом.
Вопросы и задания
1. На основании проведенных наблюдений сделайте вывод о растворимо-
сти в воде предложенных спиртов. Объясните причину.
2. Изменяется ли окраска индикаторов? Сделайте вывод о кислотном ха-
рактере водного раствора этанола.
Опыт 2. Обнаружение воды в спиртах и обезвоживание спиртов
В две пробирки помещают по 0,5 г безводного сульфата меди (II) и
добавляют по 1 мл этилового и изопропилового спиртов. Содержимое
пробирок взбалтывают и дают отстояться.
Обезвоженные спирты используют для следующего опыта.
Вопросы и задания
1. Объясните наблюдаемые явления. Напишите соответствующее уравне-
ние реакции.
Опыт 3. Получение диэтилового эфира
В сухую пробирку вносят по 0,5 мл этанола и концентрированной
серной кислоты. Смесь осторожно подогревают до образования бурого
раствора и к еще горячей смеси очень осторожно приливают еще 0,5 мл
этилового спирта.
Вопросы и задания
1. Напишите уравнение реакции и укажите тип реакции. По какому при-
знаку можно определить диэтиловый эфир?
Опыт 4. Образование сложного эфира
В пробирку наливают по 0,5 мл изоамилового спирта и концентри-
рованной уксусной кислоты, затем добавляют 2 капли концентрированной
серной кислоты. Смесь осторожно подогревают и выливают в стакан с
водой.
Вопросы и задания
1. Напишите уравнение реакции, назовите продукты. Укажите тип реак-
ции. По какому признаку можно определить образующийся сложный
эфир?
2. Отметьте растворимость сложного эфира в воде.
Опыт 5. Окисление этанола оксидом меди (II)
В пламени спиртовки сильно прокаливают медную проволоку,
имеющую на конце петлю. Затем опускают ее в пробирку с 1 мл этанола.
Вопросы и задания
1. Какого цвета становится медная проволока после прокаливания? По-
чему? Напишите уравнение реакции.
2. Какого цвета становится проволока после ее опускания в этанол? По-
является ли запах? Какому веществу он соответствует? Свои рассуж-
дения подтвердите уравнениями реакций.
Опыт 6. Окисление этилового спирта сильными окислителями
В пробирку наливают 2-3 капли раствора серной кислоты, 0,5 мл
раствора перманганата калия (или бихромата калия) и столько же этило-
вого спирта. Содержимое пробирок осторожно нагревают в пламени
спиртовки до изменения окраски.
Вопросы и задания
1. Составьте уравнение реакции.
2. Что происходит с окраской раствора? Отметьте характерный запах об-
разующегося вещества (какого?)
Опыт 7. Взаимодействие многоатомных спиртов с гидроксидом
меди (II)
В две пробирки помещают по 1 мл раствора сульфата меди (II) и по
1 мл раствора гидроксида натрия. В первую пробирку добавляют 0,5 мл
этанола, во вторую - столько же глицерина и встряхивают. Нагревают
содержимое пробирок.
Вопросы и задания
1. Опишите наблюдаемые явления и составьте соответствующие уравне-
ния реакций. Отметьте цвет образующихся продуктов реакций.
2. Можно ли данную реакцию считать качественной на многоатомные
спирты?
Ход ответа:
1. Опишите каждый опыт: окраска, запах, выпадает ли осадок?
2. Запишите все уравнения реакций.
3. Какие качественные реакции на одноатомные и многоатомные спирты
Вы изучили?
4. Какие спирты более реакционноспособны: одно- или многоатомные?
Лабораторная работа № 2.
Получение и свойства карбоновых кислот
Цель работы: Получить уксусную кислоту и изучить её свойства.
Реактивы и оборудование: ацетат натрия, серная кислота (конц.), уксусная кислота, магний (порошок), цинк, гидроксид натрия, карбонат натрия, фенолфталеин, универсальная индикаторная бумага, прибор для получения и собирания кислоты, спиртовка, пробирку, вата, спички.
Ход работы:
Внимание!!! Работа с кислотами!! Соблюдайте ТБ!
Опыт 1. Получение уксусной кислоты.
В пробирку с ацетатом натрия прибавить 1- 2 мл концентрированной серной кислоты. Закрыть пробирку пробкой с газоотводной трубкой, конец которой опустите в другую пробирку вход в пробирку прикрыть ваткой, смотрите рисунок:
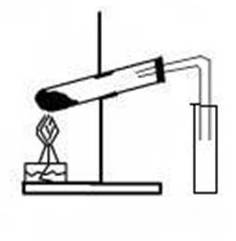
Смесь в пробирке осторожно нагревайте до тех пор, пока в приёмнике - пробирке не собёрётся 1 -2 мл жидкости. Прекратите нагревание, закройте спиртовку.
Опустите в пробирку с образовавшейся жидкости универсальную индикаторную бумагу. Как изменился цвет индикатора? Почему? Запишите уравнение диссоциации уксусной кислоты.
Опишите запах, образовавшейся жидкости? Соблюдайте осторожность при определении запаха! Составьте уравнение данной химической реакции.
Опыт 2. Взаимодействие уксусной кислоты с металлами.
В одну пробирку положите гранулу цинка, в другую порошок магния. В обе пробирки прилейте 1 мл уксусной кислоты. Что наблюдаете? Сравните скорость этих реакций? Запишите соответствующие уравнения химических реакций, назовите продукты, укажите тип реакции.
Опыт 3. Взаимодействие уксусной кислоты с основаниями.
В пробирку налейте 1 мл гидроксида натрия и добавьте 1 каплю фенолфталеина. Что наблюдаете? Почему?
Затем добавьте к содержимому пробирки уксусную кислоту. Почему происходит обесцвечивание? Запишите УХР, назовите продукты.
Опыт 4. Взаимодействие уксусной кислоты с солями слабых неорганических кислот.
В пробирку налейте 1 мл карбоната натрия и по каплям добавьте уксусную кислоту. Что наблюдаете? Почему?
Запишите УХР, назовите продукты.
Оформите работу в виде таблицы
Название опыта. Что делали.
УХР. Наблюдения. Выводы
Сделайте общий вывод о проделанной работе.
Лабораторная работа № 3
Решение экспериментальных задач на получение и распознавание органических веществ
Цель работы: повторить основные качественные реакции органических веществ, научиться решать экспериментальные задачи на распознавание органических веществ.
Теоретические сведения
Таблица № 1. КАЧЕСТВЕННЫЕ РЕАКЦИИ ОРГАНИЧЕСКИХ ВЕЩЕСТВ
Вещество, функциональная группа
Реактив
Уравнение химической реакции
Характерные признаки
Непредельные углеводороды(алкены, алкины,диены), кратные связи
Раствор KMnO4
розовый
1.Взаимодействие этилена с растворомперманганата калия
2.Взаимодействие ацетилена с раствором перманганата калия
Обесцвечивание раствора
Раствор Br2
желтый
1.Взаимодействие этилена с бромной водой
2.Взаимодействие ацетилена с бромной водой
Обесцвечивание раствора
Ацетилен
Аммиачный раствор оксида серебра- реактив Толленса
Получение ацетиленида серебра
Образование осадка желтого цвета (взрывоопасен)
Бензол
Нитрующая смесь
Нитрование бензола
Образование тяжелой жидкости светло-желтого цвета с запахом горького миндаля
Толуол
Раствор KMnO4
розовый
Обесцвечивание раствора
Фенол (карболовая кислота)
Раствор FeCl3
Светло-желтый
Качественная реакция на фенол
Окрашивание раствора в фиолетовый цвет
Анилин
Раствор хлорной извести CaOCl2
(бесцветный)
Окисление анилина раствором хлорной извести
Окрашивание раствора в фиолетовый цвет
Этанол
Насыщенный раствор I2+ раствор NaOH
Качественная реакция на этанол
Образование мелкокристаллического осадка CH3Iсветло-желтого цвета со специфическим запахом
Р-р Na2CO3
Выделение CO2
Оксид меди (прокаленная медная проволока)
Окисление этилового спирта оксидом меди 2
Выделение металлической меди красного цвета, специфический запах ацетальдегида
Гидроксогруппа (спирты, фенол, гидроксикислоты)
Металлический натрий
1.Взаимодействие этилового спирта с металлическим натрием
2.Взаимодействие фенола с металлическим натрием
Выделение пузырьков газа, образование бесцветной студенистой массы
Эфиры (простые и сложные)
H2O(гидролиз) в присутствии NaOH
Специфический запах
Многоатомные спирты, глюкоза
Свежеосажденный гидроксид меди в сильнощелочной среде
Взаимодействие многоатомных спиртов с гидроксидом меди
Ярко-синее окрашивание раствора
Карбонильная группа -СН=О
(альдегиды, глюкоза)
Аммиачный раствор оксида серебра- реактив Толленса
Реакция «серебряного зеркала»
Образование блестящего налета Ag (серебряного зеркала) на стенках сосуда
Свежеосажденный гидроксид меди в сильнощелочной среде
Образование красного осадка Cu2O
Карбоновые кислоты
Лакмус
Диссоциация
Окрашивание раствора в розовый цвет
Спирт+H2SO4(конц.)
Получение уксусного эфира
Специфический запах образующегося сложного эфира
Муравьиная кислота
Лакмус
Диссоциация
Окрашивание раствора в розовый цвет
Аммиачный раствор оксида серебра- реактив Толленса
Образование блестящего налета Ag (серебряного зеркала) на стенках сосуда
Олеиновая кислота
Раствор Br2
Желтый или Раствор KMnO4
розовый
Взаимодействие бромной воды с олеиновой кислотой
Обесцвечивание растворов
Ацетаты (соли уксусной кислоты)
H2O(гидролиз)+фенолфталеин
Гидролиз ацетата натрия
Окрашивание раствора в розовый цвет
Раствор FeCl3
Светло-желтый
Окрашивание раствора в красно-бурый цвет
Стеарат натрия (мыло)
H2SO4(конц.)
Выделение свободных жирных кислот из мыла
Образование белого осадка жирной кислоты
Насыщенный раствор соли кальция
Образование нерастворимых кальциевых солей жирных кислот
Образование серого осадка нерастворимой соли
H2O(гидролиз)+фенолфталеин
Окрашивание раствора в розовый цвет
Задание №1. Оформите таблицу №1 письменно в тетради. В столбике УХР запишите уравнения соответствующих химических реакций, назовите все вещества, укажите условия проведения реакций.
Задание №2. Выполните интерактивное задание «Идентификация органических соединений». Оформите отчет в виде таблицы:
Реактив Cu(OH)2
Температурный режим
Признаки реакции
УХР
Вывод- какое вещество находится в пробирке?
Номер пробирки
№1
Нагревание
Комнатная температура
№2
Нагревание
Комнатная температура
№3
Нагревание
Комнатная температура
Задание №3. Мысленный эксперимент. В трёх пронумерованных пробирках №1,2,3 находятся вещества - этанол, глицерин и уксусная кислота. Предложите план распознавания веществ. Оформите отчёт в виде таблицы подобной заданию №2.
Содержание отчета:
-
Оформите таблицу №1 письменно в тетради. В столбик УХР запишите уравнения химических реакций, назовите все вещества, укажите условия проведения реакций.
-
Выполните интерактивное задание «Идентификация органических соединений». Оформите отчет в виде представленной таблицы.
-
Выполните задание №3. Оформите отчет в виде таблицы.
Контрольные вопросы:
-
Назовите характерные признаки протекания химических реакций.
-
При каких условиях протекают химические реакции?
-
Какие реакции характерны для органических соединений?
Лабораторная работа № 4
Изучение свойств углеводов
ЦЕЛЬ РАБОТЫ:
Изучить свойства углеводов на примере глюкозы, сахарозы, крахмала.
ОБОРУДОВАНИЕ:
Пробирки, спиртовки, растворы: глюкозы, сахарозы, крахмала, йода, сульфата меди, щелочи, гидроксида кальция, аммиачный раствор оксида серебра, серной кислоты, углекислый газ, картофель, хлеб.
ХОД РАБОТЫ:
Опыт 1: Взаимодействие глюкозы с гидроксидом меди (2) и
аммиачным раствором оксида серебра.
-
К 2-3 мл.раствора глюкозы добавить 1 мл. NаОН и 2-3 капли раствора СuSО4 .Встряхнуть пробирку до получения жидкости окрашенной в синий цвет. Осторожно нагревать - наблюдать переход синей окраски раствора в зеленую, затем желто - красного, или коричневого осадка.
-
В чистую пробирку налить четверть ее объема аммиачного раствора серебра, прилить 5 - 10 капель раствора глюкозы. Взболтать и осторожно нагреть над пламенем горелки или в водяной бане.
Что наблюдается?
Записать реакции
-
Структурную формулу глюкозы.
-
Взаимодействие СuSО4 с гидроксидом натрия NaОН.
-
Глюкозы (формулу писать структурную) с гидроксидом меди (2).
-
Глюкозы с аммиачным раствором оксида серебра (реакция «серебряного зеркала»).
Опыт 2: взаимодействие сахарозы с гидроксидом кальция
(Са(ОН)2).
1г. сахарозы растворить в 5 - 6 мл.воды. Добавить по каплям взмученное известковое молоко (Са(ОН)2). Что наблюдаете? Добавляйте Са(ОН)2 до образования белого осадка. Затем профильтровать и фильтрат разделить на две пробирки:
а) через одну часть фильтрата пропустить углекислый газ, вторую часть фильтрата нагреть до образования белого осадка трехкальцевогосахарата.
С12Н22О11 3СаО 2Н2О
Опыт 3: приготовление крахмального клейстера: йодная проба.
Гидролиз крахмала.
Насыпать в пробирку 0,5г. крахмала, прилить четверть пробирки холодной воды и хорошо взболтать. В стакан жидкость с крахмалом и прокипятить, и дать смеси остыть.
В пробирку с оставшимся крахмальным клейстером прибавить йодной воды. Что наблюдается?
Сделать срез картофеля и капнуть йодной воды, что наблюдаете?
Налить в пробирку небольшое количество крахмального клейстера и прибавить к нему 1мл. раствора серной кислоты, 2 - 3 минуты прокипятить. Охладить раствор и затем добавить несколько капель йодной воды, синяя окраска не должна появляться.
Записать наблюдения
Сделать выводы и написать реакции гидролиза крахмала с образованием глюкозы.
Контрольные вопросы
-
Строение молекулы глюкозы?
-
Чем отличается фруктоза от глюкозы?
-
Какие углеводы образуются при гидролизе сахарозы?
-
Какими качественными реактивами можно обнаружить: глюкозу, сахарозу, крахмал?
-
Какие продукты образуются при спиртовом брожении глюкозы?
-
Почему крахмал с серной кислотой после кипячения не дает синей окраски с йодной водой?
Список литературы
Рудзитис Г.Е. Химия. Органическая химия. 10 класс: учеб. для общеобразоват. учреждений: базовый уровень/ Г.Е.Рудзитис, Ф.Г.Фельдман.-13-е изд.-М.:Просвещение, 2009.-192с.
Рудзитис Г.Е. Химия. Основы общей химии. 11 класс: учеб. для общеобразоват. учреждений: базовый уровень/ Г.Е.Рудзитис, Ф.Г.Фельдман.-12-е изд.-М.:Просвещение, 2009.-159с.
Габриелян О.С. Практикум по общей, неорганической химии и органической химии: учеб. пособие для студ.сред. проф.учеб. заведений/ Габриелян О.С., Остроумов И.Г., Дорофеева Н.М.- М., 2007.
Габриелян О.С Химия. 10 класс. Базовый уровень: учеб. для общеобразоват. учреждений.-М.,2005
Габриелян О.С Химия. 11 класс. Базовый уровень: учеб. для общеобразоват. учреждений.-М.,2005.
Габриелян О.С., Остроумов И.Г., Остроумова Е.Е. Органическая химия в тестах, задачах и упражнениях.-М.,2003.
Габриелян О.С., Остроумов И.Г., Введенская А.Г. Общая химия в тестах, задачах и упражнениях:-М.,2003.
Ерохин Ю.М. Химия. - М.,2003.
Пичугина Г.В. Химия и повседневная жизнь человека. -М., 2004.
Габриелян О.С., Лысова Г.Г. Химия в тестах, задачах и упражнениях: учеб.пособие.-М.,2004.
Габриелян О.С., Остроумов И.Г., Дорофеева Н.М. Практикум по общей, неорганической химии и органической химии: учеб. пособие. -М.,2003
Ерохин Ю.М. Химия:учебник. - М.,2003.


