- Преподавателю
- Химия
- КОНСПЕКТ УРОКА СОЕДИНЕНИЯ ЖЕЛЕЗА 9 КЛ
КОНСПЕКТ УРОКА СОЕДИНЕНИЯ ЖЕЛЕЗА 9 КЛ
| Раздел | Химия |
| Класс | - |
| Тип | Конспекты |
| Автор | Мельситова Е.Н. |
| Дата | 06.02.2016 |
| Формат | doc |
| Изображения | Есть |
Тема: «Соединения железа»
Урок-исследование
Цель: изучить состав , получение и свойства гидроксидов железа, научиться распознавать ионы железа с зарядами 2+ и 3+; познакомиться с соединениями железа.
Оборудование и реактивы: растворы сульфата железа (II)(FeSO4), хлорида железа(III)(FeCl3), гидроксида натрия (NaOH), соляной кислты (HCl), красной кровяной соли (K3Fe(OH)6), желтой кровяной соли(K4Fe(OH)6), роданида калия(KCNS), пробирки.
Ход урока
-
Орг. момент. Вступительное слово учителя. Постановка проблемы исследования
Герою знаменитого романа Даниеля Дефо Робинзону повезло в жизни трижды. Первый раз - когда он спасся после кораблекрушения. Второй раз - когда он благополучно добрался до острова. Но, ему повезло еще раз. После долгих поисков он нашел ящик, за который, по его словам, не отдал бы и целый корабль с золотом.
Что было в этом ящике?
Обыкновенные железные инструменты: топор, пила, молоток, гвозди.
Через два столетия на другой необитаемый остров попадают герои другого известного романа - пятеро американцев. Они сумели не только выжить, но и создать более или менее нормальные условия жизни, благодаря тому, что на этом острове была найдена железная руда, из которой были сделаны железные инструменты. Иначе героям Жюля Верна пришлось бы нелегко.
Как видим без, железа не может обойтись даже приключенческая литература.
Чрезвычайно важное место этот металл и его соединения занимает в жизни человека.
И наш сегодняшний урок будет посвящен соединениям, которые образует элемент «железо».
Запись темы и постановка цели урока.
-
Изучение нового материала
- Какие соединения образует железо?
Оксиды, основания, соли.
- А какие степени окисления проявляет железо?
+2; +3.
Соответственно железо с разными значениями степени окисления будет образовывать оксиды, основания и соли с разными формулами.
Соединения железа (табл. на экране)
Степень окисления
Соединения
оксиды
основания
соли
Fe2+
FeO
Fe(OH)2
FeSO4, FeCl2
Fe3+
Fe2O3
Fe(OH)3
Fe2(SO4)3, FeCl3
Как мы видим соединений железа много, и на сегодняшнем уроке мы поговорим об основаниях и некоторых солях железа и изучим их свойства.
Работать мы будем по плану.
План (на экране)
-
Получение
-
Химические свойства
-
Устойчивость на воздухе
-
Взаимодействие с кислотами
-
Взаимодействие со щелочами
-
Качественные реакции на ионы Fe2+ и Fe3+.
Сегодня вы побываете в роли исследователей. Задача, стоящая перед вами: получить гидроксиды железа, исследовать их свойства, провести качественные реакции на ионы Fe2+ и Fe3+.
Объект исследования (слайд на экране): гидроксид железа (II) (Fe(OH)2), гидроксид железа (III) (Fe(OH)3),сульфат железа (II) (FeSO4), хлорид железа (III)(FeCl3).
Цель исследования (слайд): изучение способов получения гидроксидов железа, их химических свойств, проведение качественных реакций на ионы железа Fe2+ и Fe3+.
Методы исследования (слайд): научно-теоретические, экспериментальные.
Исследование мы будем проводить с помощью химического эксперимента.
Первый и второй пункты нашего плана - получение и исследование свойств гидроксидов железа.
Работа поводится по двум вариантам, первый вариант получает и исследует свойства гидроксида железа (II), а второй вариант - гидроксида железа (III).
Результаты всех экспериментов мы занесем в таблицу (по ходу исследования заполняется таблица, которую получает каждый ученик и эта таблица проецируется на экран).
Но прежде чем приступить к выполнению эксперимента, вспомним правила техники безопасности при работе с химическими реактивами и лабораторным оборудованием.
(После каждого опыта заполняется соответствующая графа таблицы, ученики составляют соответствующие уравнения реакций на доске.)
Свойства гидроксида железа (II) гидроксида железа (III)
Признаки для сравнения
Гидроксида железа (II)
Гидроксид железа (III)
1. Получение
FeSO4 + 2NaOH = F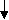 e(OH)2 + Na2SO4
e(OH)2 + Na2SO4
F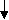 eCl3 + 3NaOH = Fe(OH)3 +3NaCl
eCl3 + 3NaOH = Fe(OH)3 +3NaCl
2. Цвет
Белый
Бурый
3. Кислотно-основный характер гидроксидов:
О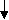 сновные свойства
сновные свойства
Амфотерные свойства
- взаимодействие с кислотами
Fe(OH)2 + 2HCl = FeCl2 + 2H2O
F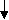 e(OH)3 + 3HCl = FeCl3 + 3H2O
e(OH)3 + 3HCl = FeCl3 + 3H2O
- взаимодействие с концентрированными растворами щелочей
Не взаимодействует
F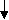 e(OH)3 + 3NaOH = Na3Fe(OH)6
e(OH)3 + 3NaOH = Na3Fe(OH)6
4. Устойчивость на воздухе
Окисляется (не устойчив)
4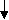
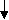 Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3
Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3
Не окисляется
(устойчив)
Давайте подведем итог исследования и сделаем выводы:
-
Как и все нерастворимые основания гидроксид железа (II) и гидроксид железа (III) получают в лаборатории взаимодействием раствора соответствующей соли железа с раствором щелочи.
-
Гидроксид железа (II) не устойчив на воздухе, легко окисляется, гидроксид железа (III) устойчив.
-
Гидроксид железа (II) проявляет основные свойства, гидроксид железа (III) - слабовыраженные амфотерные свойства.
Вы уже знаете, что в химии многие вещества, т. е. ионы, которые их образуют, можно легко распознать, обнаружить с помощью специфических реакций - качественных. Также и ионы Fe2+ и Fe3+ можно обнаружить с помощью некоторых качественных реакций. Именно это нам и предстоит сделать.
Третий пункт плана - качественные реакции на ионы Fe2+ и Fe3+.
Ученики проводят эксперимент, результаты заносятся в таблицу, которая лежит на столах у каждого ученика и проецируется на экран.
Обнаружить данные ионы можно разными способами, с одним вы уже познакомились при получении гидроксидов железа. По цвету полученных осадков определяют наличие данных ионов: Fe2+ - белый осадок, Fe3+ - бурый осадок.
Но есть и другие качественные реакции. Первый вариант проводит исследование сульфата железа (II), второй вариант - хлорида железа (III).
I вариант: для обнаружения Fe2+ используют комплексное соединение железа гексацианоферрат (III) калия ( красная кровяная соль), в результате реакции образуется рсадок темно-синего цвета - турнбулева синь.
II вариант: для обнаружения Fe3+ используют другую комплексную соль железа гексацианоферрат (II) калия ( желтая кровяная соль), в этом случае также образуется темно-синий осадок - берлинская лазурь. На ион Fe3+ есть еще одна качественная реакция - взаимодействие с роданидом калия (KCNS), образуется раствор кроваво-красного цвета.
-
Закрепление
Тестовые задания проецируются на экран, ученики поднимают карточки с номерами правильных ответов.
-
Каких соединений не образует железо:
-
Основания
-
Кислоты
-
Соли
-
Оксиды
-
Какие степени окисления проявляет железо:
-
+1
-
+2
-
+3
-
+4
-
Какие свойства проявляет гидроксид железа (II):
-
Кислотные
-
Основные
-
Амфотерные
-
Какие свойства проявляет гидроксид железа (III):
-
Кислотные
-
Основные
-
Амфотерные
-
Какой цвет имеет осадок гидроксида железа (II)
-
Красный
-
Зеленый
-
Синий
-
Белый
-
Какой цвет имеет осадок гидроксид железа (III)
-
Белый
-
Зеленый
-
Бурый
-
Синий
-
Какое соединение железа легко окисляется на воздухе, изменяя цвет:
-
Гидроксид железа (II)
-
Гидроксид железа (III)
-
Оксид железа
-
Соли железа
-
Какие соединения железа являются нерастворимыми веществами:
-
Хлориды
-
Сульфиды
-
Гидроксиды
-
Заключительный этап урока.
Подводится итог исследовательской деятельности обучающихся, выставляются отметки.
-
Домашнее задание.
Параграф 14 с. 65 - 67, упр. 2
7


