- Преподавателю
- Химия
- Определение константы химического равновесия
Определение константы химического равновесия
| Раздел | Химия |
| Класс | - |
| Тип | Конспекты |
| Автор | Матюгина И.И. |
| Дата | 24.10.2014 |
| Формат | docx |
| Изображения | Есть |
Определение константы химического равновесия».
Цель работы: Опытным путём проверить правила и вычислить значения константы химического равновесия .
Конста́нта равнове́сия - величина, определяющая для данной химической реакции соотношение между термодинамическими активностями (либо, в зависимости от условий протекания реакции, парциальными давлениями, концентрациями или фугитивностями) исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции.
Для реакции в смеси идеальных газов константа равновесия может быть выражена через равновесные парциальные давления компонентов pi по формуле Kp=∏pνii
где νi - стехиометрический коэффициент (для исходных веществ принимается отрицательным, для продуктов - положительным). Kp не зависит от общего давления, от исходных количеств веществ или от того, какие участники реакции были взяты в качестве исходных, но зависит от температуры .Например, для реакции окисления монооксида углерода:2CO + O2 = 2CO2 Kp=p2CO2 : p2CO⋅pO2
Если реакция протекает в идеальном растворе и концентрация компонентов выражена через молярность ci, константа равновесия принимает вид:
Kc=∏cνii Для реакций в смеси реальных газов или в реальном растворе вместо парциального давления и концентрации используют соответственно фугитивность fiи активность ai:
Kf=∏fνii
Ka=∏aνii
В некоторых случаях (в зависимости от способа выражения) константа равновесия может являться функцией не только температуры, но и давления. Так, для реакции в смеси идеальных газов парциальное давление компонента может быть выражено по закону Дальтона через суммарное давление и мольную долю компонента (pi=P⋅xi), тогда легко показать[2], что:
Kp=KxPΔn
где Δn - изменение числа молей веществ в ходе реакции. Видно, что Kx зависит от давления. Если число молей продуктов реакции равно числу молей исходных веществ (Δn=0), то Kp=Kx.
Зависимость константы равновесия от температуры
Зависимость константы равновесия реакции от температуры может быть описана уравнением изобары химической реакции (изобары Вант-Гоффа):
dlnKp=ΔHRT2dT
и изохоры химической реакции (изохоры Вант-Гоффа): dlnKc=ΔURT2dT
Здесь ΔH и ΔU - тепловой эффект реакции, протекающей, соответственно, при постоянном давлении или при постоянном объёме. Если ΔH>0(тепловой эффект положителен, реакция эндотермическая), то температурный коэффициент константы равновесия dlnKpdT тоже положителен, то есть с ростом температуры константа равновесия эндотермической реакции увеличивается, равновесие сдвигается вправо (что вполне согласуется с принципом Ле Шателье).
Ход работы:
-
В 4 цилиндра нальём по 100 мл. раствора Fe(SCN)3. В первый цилиндр прильём 10 мл. NH4SCN. Во второй цилиндр прильём 10 мл. FeCl3. В третий цилиндр прильём 20 мл. NH4Cl. В четвёртый - ничего. Четвёртый цилиндр оставим для сравнения.
№
Объём, мл.
Добавление вещества
Изменение цвета
Направление смещения хим.равновесия
1
10
NH4SCN
Окраска усиливается
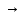
2
10
FeCl3
Окраска усиливается
→
3
20
NH4Cl
Окраска уменьшается
←
4
сравним Fe(SCN)3
Красный цвет
FeCl3 + NH4SCN 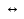 Fe(SCN)3(красный цвет) + 3 NH4Cl
Fe(SCN)3(красный цвет) + 3 NH4Cl
Вывод: На смещение химического равновесия в ту или иную сторону влияют концентрации реагирующих веществ . Для смещения равновесия вправо, нужно увеличить концентрацию исходного вещества (FeCl3 NH4SCN ). Для смещения равновесия влево, нужно увеличить концентрацию продуктов (NH4Clили Fe(SCN)3)
-
Определить равновесные концентрации компонентов системы и константы скорости.


