- Преподавателю
- Химия
- Современные приёмы и методы образования, применяемые на уроках химии
Современные приёмы и методы образования, применяемые на уроках химии
| Раздел | Химия |
| Класс | - |
| Тип | Статьи |
| Автор | Трубачева С.Н. |
| Дата | 13.02.2016 |
| Формат | doc |
| Изображения | Есть |
Современные приёмы и методы образования, применяемые на уроках химии. Метапредметный урок и технология критического мышления
Современная школа кардинально меняется, шагая в ногу со временем и пытаясь соответствовать европейскому образованию. Ускорение темпов развития влияет на жизнь общества и непосредственно на ситуацию в образовании в целом. А значит, школа должна готовить своих учеников к той жизни, о которой сама еще не знает. Поэтому сегодня важно не столько дать ребенку как можно больший багаж знаний, сколько обеспечить его личностное и познавательное развитие, вооружить таким важным умением, как умение учиться, наградить его способностью, черпать знание из всего. Ибо, как говорил И. Кант: «Не мыслям следует учить, а мыслить». По сути, это и есть главная задача новых образовательных стандартов, которые призваны реализовать развивающий потенциал общего среднего образования. И одним из направлений является внедрение метапредметного урока в учебные дисциплины. Впервые сталкиваясь с понятием метапредмет, у учителя возникает ряд вопросов. Какой урок можно назвать метапредметным? В чём отличие метапредметного урока от межпредметного? Как сконструировать метапредметный урок? Попробуем разобраться.
Метапредметный урок предполагает с одной стороны - освоение учащимися межпредметных понятий и с другой - овладение универсальными учебными действиями (регулятивными, познавательными, коммуникативными), обеспечивающими способность их использования в учебной, познавательной и социальной практике, самостоятельность планирования и осуществления учебной деятельности и организации учебного сотрудничества с педагогами и сверстниками, а также построение индивидуальной познавательной траектории.
Целью метапредметного урока является интеграция различных профилей обучения в единую систему знаний о мире и его противоречивости, а также передача учащимся деятельностных способов работы со знаниями.
На метапредметном уроке происходит включение ребёнка в разнообразные виды деятельности, важные для него. Организована поисковая деятельность, связанная с постановкой проблемы, генерацией идей, сопоставлением точек зрения, аргументацией и т.д. Многообразие методических приёмов метапредметного урока позволяет ученику прожить всю историю открытия явления, т.е. воспринять одновременно весь необходимый для этого жизненный опыт, ученик осваивает способы «жизни», формирует собственные системы мировоззрения. В результате учащиеся становятся более мобильными, способными нестандартно мыслить. И ёще, учить мыслям бессмысленно, т.к. в современном мире происходит быстрое устаревание информации, а потому на первый план выходит необходимость в обучении способам работы, саморазвитию и самосовершенствованию, путём сознательного и активного усвоения нового социального опыта. Работа учителя на метапредметном уроке заключается в том, чтобы доказать учащемуся значимость приобретаемых им знаний и в дальнейшем усовершенствовать его умения и навыки.
Что же позволяет нам назвать урок метапредметным?
♦ Использование на уроке многообразных методических приёмов и образовательных технологий (проектно - исследовательская деятельность, технология совместного обучения, игровая деятельность, проблемно-диалогическая технология, эвристическая деятельность …
♦ Способы деятельности на уроке являются универсальными, применимыми к различным предметным областям.
♦ На метапредметном уроке знание «встраивается» в опыт.
♦ Происходит «присвоение» открытия в процессе познания.
♦ Наблюдается рефлексия, т.е. перевод теоретических представлений в плоскость личностных рассуждений и выводов.
♦ Активизируется интерес и мотивация обучения учащихся путём привлечения к предмету урока других областей знаний и опоры на личный практический опыт каждого ученика.
♦ Очень хорошее знание материала традиционных учебных предметов, что позволяет грамотно переорганизовывать учебный материал вокруг деятельностных единиц содержания.
♦ Происходит передача учащимся не знаний, а способов работы со знаниями. Развитие базовых способностей мышления, воображения, работы с взаимосвязями, умения структурировать знания.
«Доводы, до которых человек додумывается сам, обычно убеждают его больше, нежели те, которые пришли в голову другим» (Б. Паскаль).
В чём же сходства и различия метапредметного и межпредметного уроков? Сходства заключаются в развитии личности обучаемого, расширении его кругозора, эрудиции, способности его ориентироваться в мире идей, использовании проблемно - поискового метода, активизации познавательной деятельности, объяснении или закреплении материала с опорой на знания по другому предмету.
Различия между метапредметным уроком и межпредметным значительны.
Межпредметный урок - получение знаний об учебном объекте с точки зрения различных наук.
Метапредметный урок - применение метапредметных и универсальных учебных действий в связи с жизненными потребностями. Определяющий процесс на метапредметном уроке - процесс учебного поиска, ученик учится сам и учит других, а также учится добывать информацию из различных источников.
Как же сконструировать метапредметный урок? Задача непростая.
Сценарий урока нужно составить таким образом, чтобы поставить ребёнка на порог открытия, создать ситуацию неустойчивости, которая заставит ребёнка сделать первый шаг в направлении открытия, и дать инструментарий для анализа своих шагов.
В первую очередь необходимо определиться, какому способу деятельности в рамках урока мы обучим учащихся, какого возраста будут дети, и на каком материале мы будем этому способу учить, а также мы должны показать школьникам выходы из своего учебного предмета в другие предметные области знания. Если мы в конце урока предложим применить учащимся данное средство на другом предметном материале, это позволит вам проверить, насколько данное средство действительно освоено, а школьнику убедиться в том, что оно носит универсальный характер и может быть использовано на разных учебных предметах.
Одним из таких эффективных средств является технология развития критического мышления.
Педагогическая технология развития критического мышления была разработана в середине 90-х годов XX века американскими учеными Дж.Стилом, К.Мередитом, Ч.Темплом и адаптирована нашими отечественными исследователями С.И. Заир-Беком, И.О. Загашевым, И.В. Муштавинской. Технология направлена на развитие критического мышления личности, которое Дж. Браус и Д.Вудт понимают как самостоятельное, «разумное рефлексивное мышление», отличающееся «взвешенностью, логичностью и целенаправленностью». По мнению С.И.Заир-Бека, критическое мышление рассматривается как «процесс соотнесения внешней информации с уже имеющейся и выработка решений: что можно принять, что необходимо дополнить, а что отвергнуть. При этом происходит корректировка собственных убеждений или даже отказ от них, если они неверны. Такое мышление является открытым, не принимающим утверждений» .
Основной идеей технологии является формирование умений работы с информацией, критическое ее осмысление, развитие рефлексивных умений. Для формирования своей позиции необходимо формировать умение высказывать свою точку зрения, аргументируя ее определенными факторами, что возможно при наличии соответствующих предметных знаний, умений.
Формирование компетентностей зависит от уровня развития химической компетентности учащихся, позволяющей успешно изучать вопросы химии и решать экологические проблемы.
Представляет интерес изучение возможности технологии развития критического мышления при усвоении теоретического материала химических дисциплин, имеющего большое количество формул, фактического материала, абстрактных понятий, моделей.
В рамках данной технологии используются различные педагогические и методические приемы, позволяющие актуализировать имеющиеся знания по изучаемой теме, анализировать, интерпретировать, осмысливать полученную информацию. Общим для всех учебных стратегий и приемов является построение образовательного процесса на основе трех фаз. Первая стадия «вызов», позволяет актуализировать уже имеющиеся знания по изучаемому вопросу, выдвигать предположения, обозначать цели, формировать познавательный интерес. Вторая стадия «осмысление» ориентирована на получение новой информации, соотнесение ее с поставленными целями и задачами обучения. На заключительной третьей стадии - «рефлексии» - происходит синтез информации, организация процесса закрепления, сопоставление ее с ранее приобретенными знаниями.
Выстраивание процесса восприятия информации в рамках данной технологии происходит с учетом закономерностей взаимодействия личности и информации, закономерностей и механизмов процессов познания. Обучение выстраивается с учетом принципов сотрудничества, совместного планирования и рефлексии.
Анализ литературных источников показал применение технологии развития критического мышления, в основном, при изучении гуманитарных дисциплин. Известны разработки применения ее при изучении школьного курса математики, химии, физики. При чтении лекции в процессе освоения базового курса химии использовались стратегия «продвинутой» лекции, приемы «Бортовой журнал», «Кластеры», «Инсерт», заполнение таблицы «Знаю - Хочу узнать - Узнал новое» (ЗХУ), «Верные - неверные утверждения». Материал лекции делился на смысловые единицы, передача каждой из которых строилась в технологическом цикле «вызов - осмысление содержания - рефлексия».
На стадии вызова использовались приемы «Кластеры», «Верные - неверные утверждения», заполнение таблицы «ЗХУ», а на стадии осмысления - прием «Инсерт». Изложение теоретического материала, на стадии осмысления проходит, как правило, в форме «диалога» лектор - аудитория, с созданием проблемных ситуаций и сопровождается лекционным демонстрационным экспериментом. Широко используются цифровые образовательные ресурсы, позволяющие совмещать вербальные и визуальные способы восприятия информации, реализовать обратную связь преподавателя с аудиторией.
Технология предусматривает активное самостоятельное изучение нового теоретического материала учеником через чтение текстовой информации. Раздаточный материал, учебное пособие или заранее распечатанный конспект, позволяет организовать работу с химическим текстом. Учитывая специфику химической информации, которая для учащихся является сложной, преподаватель должен организовать работу ученика с данным учебным текстом, направить ее с помощью поисков ответов на предлагаемые вопросы, сформулировать вывод, объяснить какие теории, положения применимы в рассматриваемом вопросе.
С учетом того, что изучение химии базируется на предметных знаниях и умениях курса химии, можно некоторые темы вынести на самостоятельное изучение, предусматривающее составление самостоятельного конспекта лекций, а на уроке, используя индивидуальные, парные, групповые формы работы обобщить, систематизировать материал, используя приемы «Кластер», построение логико-смысловых моделей.
В ходе урока химии внимание учащихся учитель периодически переключает на решение практических, профессионально направленных задач. При этом предоставляется возможность сначала самостоятельно решить задачи, выполнить тестовые задания, а затем обсудить и предоставить групповое решение. Аргументация своего решения сопровождается повторением учебного материала, что способствует его эффективному усвоению. Интересным моментом является проведение рефлексии в конце урока, которая направлена на выявление, усвоение узловых моментов урока, развитие умений составления утверждений, тезисного изложения материала, формулировки вопросов, что способствует усвоению химической информации.
Усиление самостоятельной работы на уроке размывает его границы в традиционном понимании. Уменьшается информационная составляющая, возрастает его практико ориентированность, направленность на организацию видов деятельности по работе с информацией, основанной на включении мыслительных операций сравнения, обобщения, анализа, синтеза.
При изучении химии, при использовании технологии развития критического мышления необходимо, гибко использовать приемы и методы совместно с другими инновационными технологиями, в частности с ИКТ, что позволяет повысить уровень восприятия, понимания информации и способствует развитию умений выражать собственное мнение.
Все эти требования использовались при составлении сценария к уроку, что позволило решить вопросы формирования УУД у учащихся.
Литература:
1. Загашев, И.О. Критическое мышление: технология развития [Текст] / И.О. Загашев, С.И. Заир-Бек.−СПб : Изд-во «Альянс» Дельта»,2003,- 284с.
" Чтобы жить и процветать могла Россия, надо нефть и газ свой продавать"
Урок в 10 классе (Дебаты)
Комарова Елена Анатольевна, учитель химии
МКОУ "Кондровская СОШ №2"
«Не победить, а убедить -
вот что достойно славы»
В. Гюго.
Цель урока: формирование информационной и коммуникативной компетентностей учащихся в ходе работы с медиа-источниками информации и переосмыслением её при обменах мнениями.
Задачи урока:
-
Формировать познавательные УУД: сопоставлять и отбирать нужную информацию по способам использования, переработки нефти и природного газа; перерабатывать информацию, делать выводы.
-
Формировать личностные УУД: освоить личностный смысл учения.
-
Формировать регулятивные УУД: самостоятельно оценивать свою работу;
-
Развивать коммуникативные УУД: участвовать в работе группы, аргументированно отстаивать свою точку зрения, публично выступать, критично относиться к своему мнению.
Технология проведения урока: дебаты в формате Карла Поппера.
Оборудование: компьютер, проектор, бейджики для команд и судей, судейские протоколы.
Подготовительный этап:
За 2-3 недели до проведения урока распределяем роли: выбираем команду утверждения(3 уч-ся), команду опровержения (3 уч-ся), таймпкипера, судей(3 уч-ся), корреспондентов СМИ(5 уч-ся). Команды готовят кейсы.
Команда утверждения должна: 1) подготовить план (что и как должно быть сделано), и 2) определить выгоду, полученную от реализации данного плана (в чём заключается проблема? почему эта проблема обусловлена status quo? как план решит проблему? ) .
Этапы создания кейса утверждения:
-
Определение первичных аргументов путём мозгового штурма.
-
Выбор доказательств, поддерживающих основные идеи.
-
Структурирование и разработка первичных аргументов для обеспечения лучшего объяснения.
-
Написание кейса.
-
Оформление кейса.
Задача команды опровержения сводится к следующему: 1) подвергнуть сомнению часть выгод, представленных командой утверждения (возможные пути: а) это не проблема; б) причиной не является status quo или в) план не решит проблемы), и 2) выявить и продемонстрировать вред или ущерб, причинённый планом утверждения.
1.Определение потенциальных тезисов, на которых утверждение может базировать свою позицию.
2. Далее необходимо определить какие аргументы утверждения наиболее уязвимы и в каких областях доказательства. Опровержение должно развить такую позицию, которая бы могла разрушить позицию через эту уязвимость.
3. Попытаться предугадать возможные ответы команды утверждения на аргументы, приведённые опровержением и составить план по восстановлению этих аргументов.
Найденные аргументы обеих команд представляются в виде видеороликов, компьютерных презентаций.
Ход урока:
1. Организация класса.
2. Проведение дебатов.
Вводное слово учителя: Уважаемые учащиеся! Сегодня на уроке мы подводим итоги по изучению углеводородов и их природных источников. Форма урока - дебаты в классическом формате Карла Поппера. Тема дебатов «Чтобы жить и процветать могла Россия, надо нефть и газ свой продавать» напрямую связана с изучением химии и экономики. Критерием значимости данной темы является утверждение, что для благополучного развития России необходимо продавать свои природные богатства - нефть и газ. Далее учитель кратко формулирует цель и задачи учащихся на уроке.
Вы заранее готовили кейсы утверждения и опровержения, работая с различными источниками информации. Разбейтесь на команды, судьи приготовились оценивать аргументы команд, выступления спикеров. Таймcпикер ведет дебаты, следит за соблюдением времени. Корреспонденты внимательно слушают и готовятся задать интересующие их вопросы.
У1. Представление команды утверждения (6 мин)
Актуальность
Мы утверждаем, что без продажи нефти и газа Россия была бы нищей страной, так как главная ценность в современном мире - это именно энергоресурсы, каковыми являются нефть и газ. Мы богаты этими природными ископаемыми и, продавая их, можем безбедно существовать.
Нефть - это не только деньги. Это ещё и политика. Россия находится сейчас в уникальном положении: в отличие от большинства других богатых нефтью стран мы полностью контролируем свои ресурсы. Поэтому мы имеем возможность серьёзно влиять на страны, зависящие от поставок наших газа и нефти.
Основные понятия темы
Нефть - природная маслянистая горючая жидкость, состоящая из сложной смеси углеводородов и некоторых других органических соединений. По цвету нефть бывает красно-коричневого, иногда почти чёрного цвета, хотя иногда встречается и слабо окрашенная в жёлто-зелёный цвет и даже бесцветная нефть; имеет специфический запах, распространена в осадочных породах Земли. Сегодня нефть является одним из важнейших для человечества полезных ископаемых.
Приро́дный газ - смесь газов, образовавшаяся в недрах земли при анаэробном разложении органических веществ. Основную часть природного газа составляет метан (CH4) - от 92 до 98 %. В состав природного газа могут также входить более тяжёлые углеводороды - гомологи метана:
-
этан (C2H6),
-
пропан (C3H8),
-
бутан (C4H10).
а также другие неуглеводородные вещества:
-
водород (H2),
-
сероводород (H2S),
-
диоксид углерода (СО2),
-
азот (N2),
-
гелий (Не).
В наш кейс входят следующие аспекты.
Аргумент. В современном мире тот, кто владеет энергией, владеет всем.
Доказательство.
Россия - один из лидеров по запасам нефти. Крупнейшие нефтедобывающие компании принадлежат сейчас государству. Поэтому в реальности с того же Газпрома, половиной которого владеет Российская Федерация, бюджет получает не только налоги, но и прибыль, которая, скажем, в 2010 году составила почти триллион рублей:
Чтобы был ясен масштаб этих цифр: в 2010-м году расходы на выплату пенсий составили примерно 3,4 триллиона рублей.
Нефтяные и газовые компании платят так называемый НДПИ - налог на добычу полезных ископаемых. Этот налог «состригает» в пользу государства все сверхдоходы, получаемые нефтяниками/газовиками от высоких цен на нефть.
Например, в прошлом (2010) году поступления НДПИ составили 1,377 триллиона рублей.
В России имеются огромные запасы природного газа. Уже признано, что по запасам природного газа (47 трлн кубометров, или 26,7% всех мировых запасов) Россия занимает первое место в мире.
ОЗ-У1 О3 задает перекрестный вопросы У1(3 мин)
-
Россия, наряду с Саудовской Аравией, является мировым лидером по запасам и добыче нефти. Но обеспеченность рентабельными запасами достигнутой добычи в 500 млн. тонн в год оценивается в 13-15 лет. По вашему мнению, можно продавать исчерпаемый ресурс, не задумываясь о будущем?
-
Правильно ли мы вас поняли, что основные нефтеперерабатывающие предприятия принадлежат государству. В каком соотношении находятся государственные и частные компании? Кто «процветает» в результате продажи сырья частными компаниями: российские граждане или владельцы компаний?
О1 Ответное слово команды опровержения(6 мин)
Мы принимаем определение ключевых понятий и актуальность, предложенные оппонентами, но не согласны с их аргументами.
Мы согласны, что продавая первичное сырье, Россия имеет огромный доход. Но он не стабилен, зависит от мировых цен на нефть и газ. Кроме того человек должен думать о будущем, а не только о настоящем. Чем будет жить Россия, когда исчерпает свои природные богатства?
Вы утверждаете, что, благодаря запасам нефти и газа, мы можем влиять на другие страны. Но Россия не агрессор, мы ведем мирную политику. Достойно выглядеть на мировой арене можно не только за счет продажи нефти и газа, но и за счет развития своей экономики, в том числе проводя политику протекционизма и меркантилизма( поддержки своего производителя).
Аргумент. Еще Д. И. Менделеев впервые обратил внимание на то, что нефть является важнейшим источником химического сырья, а не только топливом; он посвятил ряд работ происхождению и рациональной переработке нефти. Ему принадлежит известное высказывание о попытках топить паровые котлы нефтью вместо угля: «Нефть не топливо, можно топить и ассигнациями» (1885).
Доказательство. Сопровождается показом презентации.
Сырую нефть практически не применяют. Ее подвергают очистке и переработке.
Бывает первичная и вторичная переработка нефти.
Первичная переработка нефти - это перегонка, в результате которой нефтепродукты разделяются на составные части (их называют фракциями):
-
сжиженный газ;
-
бензины (автомобильный и авиационный),
-
реактивное топливо,
-
керосин,
-
дизельное топливо (солярка),
-
мазут.
Первые пять видов нефтепродуктов являются топливом. А мазут перерабатывают для получения:
-
парафина,
-
битума,
-
жидкого котельного топлива,
-
масел.
При смешивании битума с минеральными веществами получается асфальт (асфальтобетон), используемый в качестве дорожного покрытия.
Жидкое котельное топливо используют для обогрева домов.
Из нефти выпускают широкий ассортимент смазочных материалов:
-
смазочное масло;
-
электроизоляционное масло;
-
гидравлическое масло;
-
пластичную смазку;
-
смазочно-охлаждающую жидкость;
-
вазелин.
Масла, получаемые из нефти, идут на приготовление мазей и кремов.
Оставшийся после перегонки нефти концентрат называется гудроном. Он идет на дорожные и строительные покрытия.
Вторичная переработка нефти включает в себя изменение структуры ее компонентов - углеводородов. Она дает сырье, из которого получают:
-
синтетические каучуки и резины;
-
синтетические ткани;
-
пластмассы;
-
полимерные пленки (полиэтилен, полипропилен);
-
моющие средства;
-
растворители, краски и лаки;
-
красители;
-
удобрения;
-
ядохимикаты;
-
воск;
-
и многое другое.
Даже отходы переработки нефти имеют практическую ценность. Из отходов перегонки нефти производится кокс. Его используют в производстве электродов и в металлургии. А сера, которую извлекают из нефти в процессе переработки, идет на производство серной кислоты.
Нефть дает тепло и свет -
Ей замены просто нет.
Делают из нефти много:
И асфальтные дороги,
И костюмы, и рубашки,
Удивительные чашки!
Вспомните, как тепловоз
Вас когда-то к морю вез…
В его топках нефть горела,
А без нефти что за дело?
И недаром в нашем крае,
Всяк нефтяник это знает,
С нетерпением ее ждут,
Черным золотом зовут.
В настоящее время до 90 % горючего газа используется в качестве:
1) топлива на ТЭС, промышленных предприятиях и в быту;
2) природный газ может непосредственно применяться как топливо для автомобильного транспорта. По сравнению с обычным бензином он характеризуется высоким октановым числом (100-105), что позволяет улучшить работу двигателей внутреннего сгорания.
Другое важное преимущество природного газа - его экологическая чистота.
3) С каждым годом все больше расширяется химическая переработка природного газа, и из ценного энергетического средства газ становится не менее важным химическим сырьем. Поэтому метан является незаменимым продуктом для химической промышленности. Он служит для получения ацетилена, метилового спирта, сажи, хлорированных углеводородов и различных растворителей.
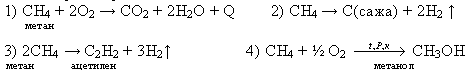
Сажа - не только сырье для автомобильных шин. Она является основой для типографской краски, копировальной бумаги, лент пишущих машин и т.д.
УЗ-О1 У3 задает перекрестные вопросы О1(3 мин)
Сколько стоит строительство нефте- и газоперерабатывающих предприятий? Сколько потребуется времени для развития соответствующей инфраструктуры? Чем тогда жить современной России, если сократить добычу и продажу нефти, дожидаясь светлого будущего?
У2 Команда утверждения опровергает аргументы О1, восстанавливает собственные аргументы, представляет доказательства (5 мин)
В советские времена мы гордились запрятанными в наших недрах богатствами. Геологи были тогда народными героями, про них пели песни и снимали фильмы. Сейчас же слова «нефть» и «газ» стали практически ругательными.
«Нефтяная игла», «сырьевой придаток», «проедание ресурсов», «северная Нигерия»… несколько умело запущенных вирусных идей - и вот мы уже не гордимся, а стыдимся нашим богатством. Примерно так работают сектанты: они сначала убеждают новообращённого, будто деньги - это зло, а потом помогают бедолаге справиться со «злом» путём передачи этих «нечистых» денег самим сектантам.
Тем не менее, каким бы сладким ни было нытьё про счастье быть бедным и про развращающую нефть, главная ценность в современном мире - это именно энергоресурсы.
Вы знаете, что Саудовская Аравия выращивает на экспорт картошку и пшеницу? Та самая Саудовская Аравия, которая почти целиком состоит из пустынь и полупустынь и которой, казалось бы, сам Бог велел закупать продовольствие за рубежом…
А разгадка проста - энергия. В современном мире тот, кто владеет энергией, владеет всем.
Есть энергия - можно качать пресную воду чуть ли не с километровой глубины или опреснять солёную воду Красного моря и Персидского залива. Нет энергии? Молись, чтобы денег хватило на солярку для тракторов и на газ для котельных.
Нефть преобразуется сейчас в любые продукты и товары: от огурцов с помидорами до пластика с титаном. Причём преобразуется не по формуле «нефть - деньги - товар», как думают некоторые читатели прозападных СМИ, а преобразуется напрямую.
Возьмём тот же самый титан, из которого делают самолёты, реакторы, бронежилеты, колёсные диски, протезы и много всего ещё, начиная с добавок в краски. Никогда не задумывались, почему крупнейший в мире производитель титана - компания ВСМПО-АВИСМА - расположена именно в России?
Да потому, что титана на нашей планете - очень много. Но для его извлечения из земных пород требуется столько энергии, что только богатые энергоресурсами державы, типа России или той же Саудовской Аравии, могут позволить себе его производить.
Два века назад, когда потихоньку начиналась эра индустриализации, универсальным ресурсом была не нефть, а сталь. Страны, которые могли производить сталь, были «на коне». Страны, которые сталь производить не могли…
Китай, например, пытался стать всепланетной фабрикой ещё тогда. И - возможно - ему бы это даже удалось. Однако, так уж сгенерировалась карта, месторождения угля и железа были в Китае расположены слишком далеко как друг от друга, так и от морских путей. А сталелитейному заводу были нужны для работы оба этих ресурса. Добросить же до нужного месторождения железную дорогу китайцы не могли - так как для строительства железной дороги требовалась, опять-таки, сталь.
Зато богатая железом и углём Англия, в которой месторождения зачастую находились чуть ли не в нескольких километрах друг от друга, понастроила сталелитейных заводов от души, что и позволило ей удерживать титул величайшей державы мира практически до середины двадцатого века.
Так вот. В настоящее время ни заводы, ни пресная вода, ни географическое местоположение уже не имеют особого экономического значения. Универсальная валюта - энергия - нужна абсолютно всем и может с лёгкостью быть преобразована во что угодно.
О1-У2 О1 задает вопросы У2(3 мин)
-
Но для того, чтобы добывать и продавать нефть нужны миллиарды долларов инвестиций, особенно в экспортные нефтепроводы. Хотя в этом году объем добычи нефти в России должен вырасти на 8%, рост темпов добычи может замедлиться, когда появятся трудности с ее транспортировкой на экспорт. Что дешевле: строить перерабатывающие предприятия и потом получать огромную прибыль за счет продажи ценных продуктов или тратить деньги на строительство нефте- и газопроводов?
О2 Опровержение аргументов утверждения и усиление отрицающей линии(5 мин)
Российская Федерация обладает большими запасами нефти, она занимает 2 место по разведанным запасам нефти (20 млрд.т, что составляет 13% общемировых запасов нефти) после Саудовской Аравии (35,8 млрд.т), но хотя по добыче нефти Россия занимает 3 место в мире (в год добывается 350 млн т), после Саудовской Аравии и США ,но ресурсообеспеченость России нефтью невелика.
Ресурсообеспеченость - это соотношение между величиной природных ресурсов и размерами их использования. Она выражается количеством лет. на которые должно хватить данного ресурса либо его запасами из расчёта на душу населения.
Страны, обладающие крупными
Добыча нефти
Название страны
Добыча в млн т
Саудовская Аравия
440
США
355
Россия
350
Иран
180
Мексика
170разведанными запасами нефти
Название страны
Разведанные запасы нефти
млрд т
Саудовская Аравия
35,8
Россия
20
Ирак
15.1
Кувейт
13.3
ОАЭ
12,6
Ресурсообеспечен
ность стран мира нефтью.
Название страны
Количество лет, на которые хватит нефти
Саудовская Аравия
81,3
Россия
57,1
Ирак
116,1
Кувейт
126,6
ОАЭ
109,5
Таким образом, при современном количестве разведанных ресурсов и данных темпах добычи нефти хватит на 57 лет, это один из самых низких показателей ресурсообеспеченности нефтью в мире.
У1-О2 У1 задает вопросы О2(3 мин)
Любое химическое производство, в том числе и переработка нефти и газа, являются экологически вредными. Что, по вашему мнению, дороже - здоровье людей + прибыль от продажи нефти и газа или получение прибыли на химических заводах + ухудшение экологической обстановки и вред населению?
У3 Проводит сравнительный анализ позиций сторон и делает заключение о большей убедительности аргументов утверждающей команды(5 мин).
Нефтяная промышленность - отрасль тяжелой индустрии, включающая разведку нефтяных и нефтегазовых месторождений, бурение скважин, добычу нефти и попутного газа, трубопроводный транспорт нефти. Нефтяная промышленность имеет большое значение для развития нашей страны. Решение проблем нефтяной промышленности на данном этапе исторического развития стоит очень остро, Сейчас мы с вами выявим значение нефтяной промышленности в экономике России.
Отрасли
Электроэнергетика
11,9 %
Топливная промышленность
19,9 %
Чёрная металлургия
8.1 %
Цветная металлургия
7,7 %
Химическая
6,3 %
Лёгкая
1.5 %
Машиностроение
20.1 %
Лесная
4,4 %
Пищевая
13,9 %
Прочие
6,2 %Для этого мы с вами рассмотрим структуру экономики России. 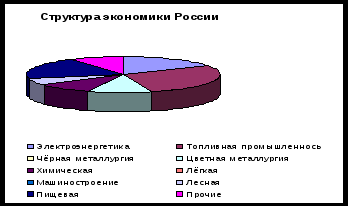
19,9 % в структуре экономики России занимает топливно-энергетический комплекс.
Какова же доля нефтяной промышленности в структуре производства энергоресурсов?
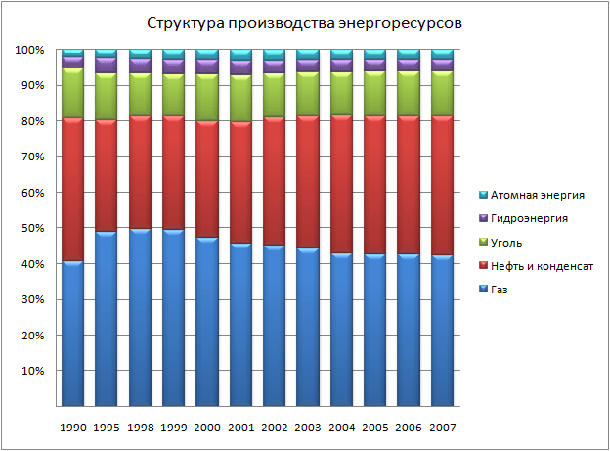
39 % нефтяная промышленность занимает в структуре производства энергоресурсов.
Таким образом, нефтяная промышленность является ведущей отраслью промышленности России. Но нефть не только одна их главных отраслей в экономике России, она составляет основу экспорта России.
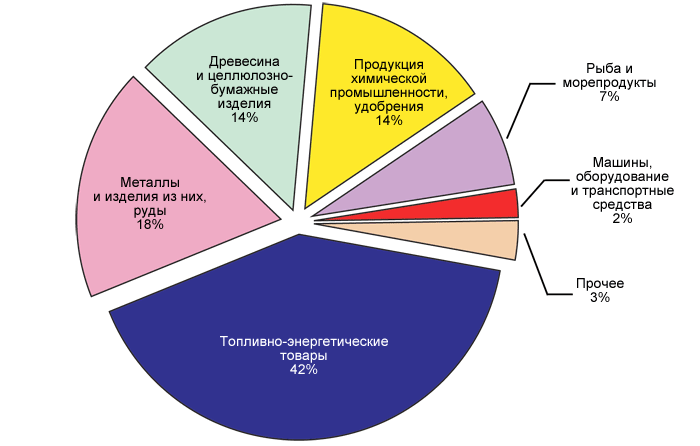
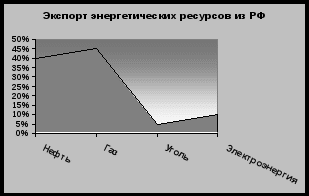
Из России экспортируется 210 млн т нефти в год, что составляет 40% экспорта энергоресурсов. таким образом является не только ведущей отраслью экономики России и поставщиком значительной части валюты. Добыча России составляет 10% мировой, поэтому можно с уверенностью сказать, что страна занимает сильные позиции на международном рынке нефти. Например, эксперты ОПЕК заявили, что государства, входящие в эту организацию, не смогут восполнить нехватку нефти, если мировой рынок покинет РФ.
Хотя сёйчас в условиях мирового финансового кризиса происходит резкое снижение цен на нефть, (себестоимость добычи нефти составляет 7 долларов за баррель, а за 1 баррель нефти на сегодняшний день дают долларов) добывать нефть по-прежнему выгодно. Но в стоимость 1 барреля нефти входит не только цена добычи топлива, но и, переработка нефти, доставка до потребителя, налоговые пошлины.
Динамика цен на нефть в России и на мировом рынке в 2008г.
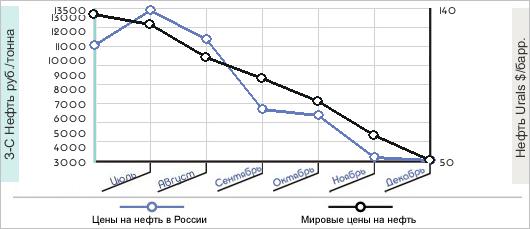
Я тоже считаю, что мы должны экспортировать товары, а не сырьё. Но сегодня доходы от продажи углеводородов - это половина госбюджета. Уберите их - и что останется? Конечно, нефтеперерабатывающие заводы тоже нужны, но главная наша экономическая задача сейчас - строить энергетическую инфраструктуру: трубопроводы и атомные станции. При этом, разумеется, очень важно прокладывать стратегические «нитки» трубопроводов за рубеж, чтобы выбить с их помощью козыри из хищных лап ворующих наш газ транзитных шантажистов.
О3 Проводит сравнительный анализ позиций сторон и делает заключение о большей убедительности аргументов отрицающей команды(5 мин).
Развитие нефтяной промышленности идёт невысокими темпами, одной из главных проблем нефтяной промышленности является низкая ресурсообеспеченость.
Развитие нефтяной промышленности в современном объёме на данном этапе исторического развития, скорее всего, является «бедой» России:
-
большинство месторождений России истощены, Россия теряет свои позиции крупного экспортёра, лишается значительной части валюты, для решения проблемы требуется освоение перспективных месторождений нефти;
-
большинство нефтеперерабатывающих заводов выработало свой ресурс, требуется строительство новых НПЗ или модернизация старых НПЗ;
-
не все скважины в достаточной мере эксплуатируются, часть глубоко залегающих пластов невозможно эксплуатировать из-за отсутствия современного оборудования;
-
на мировом рынке происходит снижение цен на нефть, необходимо увеличивать экспорт не сырой нефти, а продуктов её переработки;
-
создать или войти в действующую группировку стран экспортёров нефти для совместного регулирования цен на нефть на мировом рынке.
Добыча и экспорт нефти всегда было прибыльной сферой производства, хотя дальнейшее развитие нефтяной промышленности требует больших капиталовложений для разведки и освоения новых месторождений нефти, модернизации оборудования на НПЗ.
Я убежден, что нужно строить и новые заводы. Неправильно то, что мы сегодня половину нефти вывозим за рубеж и таким образом поддерживаем там нефтепереработку, создаем рабочие места. Нам нужно у себя строить заводы и отправлять на экспорт бензин, дизельное топливо, керосин и другие продукты переработки. Такой задачи у нас сегодня, к сожалению, нет.
Да, с точки зрения простого счета сегодня торговать нефтью легче. Продал - и голова не болит, а тут надо вкладываться, строить заводы, оснащать их. Годы уйдут на то, чтобы окупить вложения. Но с точки зрения государственной строить новые мощности необходимо.
Необходимо развивать и газохимию. Газ Западной Сибири - это на 98% метан. Но в перспективе газодобыча неизбежно будет смещаться на восток.
А там месторождения в основном нефтегазовые, и газ там содержит много этана, гелия и других компонентов. Нужны технологии переработки такого газа, нужно, чтобы уже сейчас наука на это работала.
Недавно в Оренбурге открыли месторождение так называемой матричной нефти. Это не совсем нефть, а углеводородное соединение с редкоземельными металлами, там их содержится очень много. Это ценное сырье, которое нам нужно научиться извлекать.
Все это касается и попутного газа. Он загрязняет атмосферу, а мог бы приносить большую пользу. Сейчас думают, как штрафовать компании, которые не используют попутный нефтяной газ, а надо бы подумать о том, как стимулировать те компании, которые занимаются разработкой новых технологий использования попутного газа.
III. Подведение итогов
-
Вопросы из зала.
-
Выступление судей: определение команды-победителя и определение лучших спикеров.
-
IV. Заключительное слово учителя.
-
V. Задание для удовольствия: напишите мини-сочинение «Что произойдёт с Россией, когда нефть закончится?».
-
Интернет-ресурсы.
-
burneft.ru/main/news/488
-
konoplyanik.ru/ru/publications/224/224.htm
3. iguru.ru/Shares/Show.aspx?id={55620C5F-8D6E-4320-B153-1C1CD59A3E13}
4. rian.ru/economy/20110427/368898083.html
5. rg.ru/2011/04/28/gazprom-anons.html
6. oilreview.ru/index.html?032
7. botic-yellow.livejournal.com/358431.html
-
allforchildren.ru/why/what18.php
-
ru.wikipedia.org/wiki/%D0%9D%D0%B5%D1%84%D1%82%D1%8C
Приложение.
Классический формат Карла Поппера:
СПИКЕР
ВРЕМЯ
РОЛЬ
1
У1
6 мин.
Представляет команду, показывает актуальность темы, дает определения ключевым понятиям темы, представляет все аргументы команды в организованной форме.
2
О3→У1
3 мин.
О3 задает перекрестные вопросы У1
3
О1
6 мин.
Принимает определения утверждающей команды, за исключением случаев, когда определения У1 является полностью неправильным. Дебаты по определениям не допускаются! Опровергает аргументы У1 и выдвигает все возможные аргументы отрицающей команды.
4
У3→О1
3 мин.
У3 задает перекрестные вопросы О1
5
У2
5 мин.
Опровергает аргументы О1, восстанавливает аргументы утверждающей команды, представляет доказательства, поддерживающие утверждающую линию. Новые аргументы не приводятся.
6
О1→У2
3 мин.
О1 задает вопросы У2
7
О2
5 мин.
Опровергает аргументы утверждающей команды, усиливает отрицающую линию и представляет доказательства в ее поддержку. Новые аргументы не приводятся.
8
У1→О2
3 мин.
У1 задает вопросы О2
9
У3
5 мин.
Выявляет области столкновения команд, делает сравнительный анализ позиций сторон и объясняет, почему аргументы утверждающей команды более убедительны.
10
О3
5 мин.
Выявляет области столкновения команд, делает сравнительный анализ позиций сторон и объясняет, почему аргументы отрицающей команды более убедительны.
СУДЕЙСКИЙ ПРОТОКОЛ
Судья Место проведения
Тема:
Дата:
Состав утверждающей стороны:
1.
2.
3.
Номер:
Состав отрицающей стороны:
1.
2.
3.
Номер:
Спикер
Содержание
Структура
Способ
Всего
Спикер
Содержание
Структура
Способ
Всего
У1
О1
У2
О2
У3
О3
Итого:
-
-
-
Итого:
-
-
-
Лучший спикер (фам.):
Лучший спикер (фам.):
Команда-победитель (номер, сторона)
Критерии
Можно снимать
У1
У2
У3
О1
О2
О3
Содержание
(максимальная оценка каждого спикера - 10 баллов)
Определения
до 2 баллов
Аспекты и аргументы: - отношение к теме
до 2 баллов
- разнообразие
1 балл
- глубина
1 балл
- доказательность
до 2 баллов
Фактические ошибки
1 балл
Работа с вопросами
до 2 баллов
Особое мнение (может добавляться после вычетов)
+1 балл
Структура
(максимальная оценка каждого спикера - 10 баллов)
Соответствие роли спикера
до 3 баллов
Логика построения речи
до 3 баллов
Структурированность выступления
до 3 баллов
Соблюдение регламента
1 балл
Особое мнение (может добавляться после вычетов)
+1 балл
Способ
(максимальная оценка каждого спикера - 10 баллов)
Культура речи
до 3 баллов
Культура общения
до 3 баллов
Корректность
до 3 баллов
Особое мнение (может добавляться после вычетов)
+1 балл
![]()
Разноуровневый практикум
по решению упражнений и задач по теме «Металлы»
Надибаидзе Ольга Леонидовна заместитель
директора по УВР, учитель химии
МКОУ «Кондровская средняя общеобразовательная школа №4»
Пояснительная записка
Данное занятие может быть проведено с учащимися 9 класса по теме «Металлы» УМК О.С.Габриеляна (2 ч. в неделю)
Проведение занятия построено на применении технологии развивающего обучения, технологии разноуровневой дифференциации и технологии развития критического мышления. Учащимся предлагается система разнохарактерных заданий личностно-значимого содержания. Это способствует развитию интеллектуальных и личностных качеств, саморегуляции процесса обучения повышению мотивации к изучению предмета. Важными в данном уроке являются самоконтроль и самооценка обучающихся, составление индивидуального домашнего задания. Такой подход позволит каждому ученику выстроить индивидуальную образовательную траекторию. Урок сопровождается презентацией, содержащей иллюстративный материал и задания для работы учащихся. Данный урок - заключительное занятие перед проведением контрольной работы по теме «Металлы». Способствует развитию умений учащихся применять свои знания на практике, самоанализу и самооценке, формированию общеучебных умений (структурирование информации, умение выделять главное, тренировка внимания и памяти, решение логических задач).
Планируемые результаты обучения:
Предметные - выявить и оценить степень овладения системой и комплексом навыков и умений, полученных при изучении темы «Металлы», готовность учащихся применить знания о важнейших общих свойствах металлов на практике, позволяющие обеспечить обратную связь и оперативную корректировку учебного процесса;
Метапредметные - развитие критического мышления, самостоятельности и способности к рефлексии, обеспечение системности учения на основе разноуровневой дифференциации; умение определять понятия, делать обобщения, устанавливать аналогии и делать выводы;
Личностные - уметь владеть основами само- и взаимоконтроля, принятия решений и осуществления осознанного выбора в учебной и познавательной деятельности, корректировать свои действия в соответствии с изменяющейся ситуацией.
Оборудование: ПК, на столах учащихся - разноуровневые задания практикума, вопросы для работы в ППС; карточки-номера уровня практикума, учебник О.С. Габриеляна «Химия-9» (ООО «Дрофа» 2013);
лабораторная работа: лаб. штатив, чистые пробирки - 6:
продвинутый уровень - Fe, р-р H2SO4, р-р CuSO4;
общий уровень - р-р Ca(OH)2, р-р HCl, р-р H2SO4;
минимальный уровень - Al, р-р HCl.
Методы и методические приёмы: организация собственной деятельности учащихся по технологии разноуровневой дифференциации и технологии развития критического мышления, решение расчетных, экспериментальных задач, решение упражнений, работа в ППС, творческое домашнее задание, использование презентации к уроку.
Тип урока: урок-практикум - применение знаний по теме.
ХОД УРОКА:
I ОМЭ - стадия ВЫЗОВ
1 задание - Что объединяет изображения и тему, которую мы изучаем? (1 слайд презентации к уроку) 
Правильный ответ - изделия из металлов, мы изучаем тему «Металлы»
2 задание: Прием "Покопаемся в памяти"
1.Что вы уже знаете о металлах?
2.Чего вы ожидали или испытывали потребность узнать при изучении темы?
3.Почему вам это нужно знать?
3 задание: Приём «Работа с ключевыми терминами»
На основе данных слов составить рассказ-подведение итогов какого-либо события. Главное - использовать в тексте все ключевые слова:
-
Металлы
-
Металлическая связь
-
Обобществлённый поток электронов
-
Радиус атома
-
Восстановитель
-
Физические свойства
-
Химические свойства
-
Применение

Обсуждение
II. ОИЭ - стадия УСВОЕНИЯ ЗНАНИЙ:
Т еоретическое изучение темы закончено. Что впереди? Чем нужно заняться?
еоретическое изучение темы закончено. Что впереди? Чем нужно заняться?
Какова тема урока? - обсуждение
(Цель и задачи урока - формулируют учащиеся. Учитель подчёркивает необходимость самооценки и самоконтроля знаний с последующим составлением индивидуальной части домашнего задания)
Д ействительно, Вольфганг Гёте сказал: «Просто знать - ещё не всё. Знания нужно уметь применять!». Сегодня мы проведём Разноуровневый практикум по решению задач и упражнений по теме «Металлы». А высказывание Гёте предлагаю взять девизом к нашему занятию.
ействительно, Вольфганг Гёте сказал: «Просто знать - ещё не всё. Знания нужно уметь применять!». Сегодня мы проведём Разноуровневый практикум по решению задач и упражнений по теме «Металлы». А высказывание Гёте предлагаю взять девизом к нашему занятию. 
Но, прежде чем, применим свои теоретические знания по теме «Металлы», давайте их повторим.
Работая в ППС, ответьте на вопросы 
Обсуждение
Итак, мы выяснили, что многие металлы в свободном виде - восстановители и активно реагируют с простыми и сложными веществами.
Приём «Информационная схема»
Совместное составление схемы с учителем в тетрадях и на доске, беседа по вопросам:
-
С какими простыми веществами реагируют металлы? (с кислородом, серой, галогенами)
-
С какими сложными веществами реагируют металлы? (с водой, кислотами, солями).
-
Каковы особенности и правила взаимодействия металлов с кислородом, водой, солями и кислотами? Проговорите эти правила в ППС, используйте для повторения материал п.11 учебника на с.70 - 72.
В подтверждение химических свойств металлов, выполняем задание I практикума.  Выберите уровень практикума. Запишите в тетрадь (на этом этапе учащиеся определяются с уровнем и выставляют на парте таблички с номером практикума).
Выберите уровень практикума. Запишите в тетрадь (на этом этапе учащиеся определяются с уровнем и выставляют на парте таблички с номером практикума).
Минимальный уровень:
Составьте уравнения химических реакций, при помощи которых можно осуществить превращения:
+O2 +H2O +HCl +H2SO4
Ca CaO Ca(OH)2 CaCl2 CaSO4
1. 2. 3. 4.
Для уравнения - 4 допишите схему реакции в ионном виде. Вместо знака вопроса поставьте нужный коэффициент.
CaCl2 + H2SO4 = CaSO4 +? …
Ca2+ + 2Cl - + 2H+ + … = CaSO4 +?… + ? …
Ca2+ + ... = CaSO4
Общий уровень:
Составьте уравнения химических реакций, при помощи которых можно осуществить превращения:
Al AlCl3 Al(OH)3 AL2O3 Al2(SO4)3
1. 2. 3. 4.
Уравнение 4 представьте в ионном виде.
Продвинутый уровень:
На примере любого изученного металла составьте генетическую цепочку, включающую оксид, гидроксид и не менее 2х солей этого металла. Одно из уравнений представьте в ионном виде.
В ходе выполнения задания учащиеся по желанию выходят и решают его на доске. Обсуждение
Для самопроверки

-
М
 ы изучили, что большинство металлов встречается в природе в виде различных химических соединений. Каков общий способ получения металлов из руд? (процесс восстановления)
ы изучили, что большинство металлов встречается в природе в виде различных химических соединений. Каков общий способ получения металлов из руд? (процесс восстановления)
Работая в ППС, напомните друг другу:
-
Что такое металлургия?
2.Какие методы металлургии вам известны? В чём их особенности?

Примените теоретические знания процессов металлургии, выполнив задание II выбранного уровня. Обсуждение. (учащиеся по желанию выходят с решениями к доске)
-
Н
 ам известно, что перед получением металлов из руды, её предварительно обогащают - отделяют пустую породу и примеси. В ходе изучения темы мы рассмотрели способ освобождения от примесей в массе исходного вещества при вычислении массы продукта реакции. Выполняем задание III.
ам известно, что перед получением металлов из руды, её предварительно обогащают - отделяют пустую породу и примеси. В ходе изучения темы мы рассмотрели способ освобождения от примесей в массе исходного вещества при вычислении массы продукта реакции. Выполняем задание III.
Минимальный уровень:
Задача: Определите массу оксида кальция CaO, полученного при разложении 500 г известняка, содержащего 20% примесей, исходя из уравнения реакции:
t 0C
CaCO3 CaO + CO2
-
Прочитайте задачу.
-
З
 апишите краткое условие -
апишите краткое условие -
Дано: m (известн.) = 500г
(прим.) = 20%
t 0C
CaCO3 CaO + CO2

m (CaO) - ?
-
Решение: 1. Вычислите массу чистого в-ва CaCO3 в известняке, исходя из формул: ω (чист. CaCO3)% = 100% - (прим.)%
ω (чист. CaCO3)% = 100% - … = …%
mч(CaCO3) = mтехн. * ω(чCaCO3) = CaCO3
 100%
100%
Определите количество чистого вещества CaCO3, исходя из его массы, по формуле n = m/M
n(CaCO3) = mч(CaCO3) ;
 M(CaCO3)
M(CaCO3)
M(CaCO3) = Ar(Ca) + Ar(C) + 3*Ar(O) = …….. г/моль
n(CaCO3) = … моль
-
Запишите уравнение реакции, над формулами в-в и искомых в-в
n = ….. моль x моль
 CaCO3CaO + CO2
CaCO3CaO + CO2
n0 = 1 1 моль
4) Составьте пропорцию и решите её, определив тем самым n(CaO) - количество вещества
5) Определите массу оксида кальция, исходя из его количества, по формуле m(CaO) = M(CaO)*n(CaO)
5. M(CaO) = Ar(Ca) + Ar(O) = ……… г/моль
m(CaO) = ……… г/моль * ……… моль = ………? г
Ответ:
ОБЩИЙ УРОВЕНЬ:
Задача: Определите массу соли, полученной действием серной кислоты на 160 г технического железа, содержащего 30% примесей.
F e + H2SO4 ……….
e + H2SO4 ……….
ПРОДВИНУТЫЙ УРОВЕНЬ:
По любому уравнению из задания 1 или 2 вашего уровня практикума составьте условие задачи на вычисление массы продукта реакции по массе исходного в-ва, содержащего примеси, и решите её.
Самопроверка по готовым решениям. Обсуждение
-
А
 теперь решаем экспериментальные задачи. Выполняем 4 ое задание вашего уровня. (Обязательно! Проведение ТБ)
теперь решаем экспериментальные задачи. Выполняем 4 ое задание вашего уровня. (Обязательно! Проведение ТБ)
Продвинутый уровень:
Экспериментальная задача
Получите сульфат железа (II) различными способами, имея железо, раствор серной кислоты и раствор сульфата меди.
Запишите уравнения проведённых химических реакций.
Общий уровень:
Экспериментальная задача
Осуществите превращения:

 Ca(OH)2CaCl2CaSO4
Ca(OH)2CaCl2CaSO4
гидроксид кальция хлорид кальция сульфат кальция
Запишите уравнения проведённых химических реакций.
Минимальный уровень:
Экспериментальная задача
Получите из алюминия Al хлорид алюминия AlCl3, выполняя следующие действия:
1)Осторожно, немного наклонив, опустите в пробирку гранулу алюминия Al
2)Вставив пробирку с Al в штатив для пробирок, прилейте 1 мл раствора хлороводородной кислоты HCl. Что наблюдаете? Какой газ выделяется? Какие изменения постепенно происходят с гранулой цинка?
3)Запишите уравнение проделанной реакции:
Расставьте коэффициенты.
Al + HCl = AlCl3 + …?
-
О
 бсуждение результатов:
бсуждение результатов:
Минимальный уровень:
1. Как можно получить AlСl3 из Al?
Какой газ выделился в результате воздействия HCl на Al?
Общий уровень:
-
Как на опыте осуществить превращение
Ca(OH)2CaCl2CaSO4 ?
Продвинутый уровень:
-
Какими способами получили сульфат железа?
III.РОЭ - СТАДИЯ РЕФЛЕКСИИ
-
И
 так, чем мы занимались на уроке?
так, чем мы занимались на уроке?
(Мы выполнили упражнения и задачи разноуровневого практикума, применив знания по основным вопросам изученной темы)
1. Проверим себя, ответив на вопросы теста:

Самопроверка (взаимопроверка - как вариант)

2.Вернёмся к заданиям и изображениям, показанным в начале урока.
Что из них вам стало понятным в ходе занятия? Какие вопросы мы не рассмотрели? Что вызвало затруднения? (обсуждение)
3.Прием "Синквэйн"
Каждому ученику дается время 5-7 минут на то, чтобы написать синквэйн на тему «Металлы». Правила написания синквэйна (слайд):
-
В первой строчке тема называется одним словом (существительным).
-
Вторая строчка-это описание темы в двух словах (два прилагательных).
-
Третья строка-описание действия в рамках темы тремя глаголами.
-
Четвертая - это фраза из четырех слов, показывающая отношение к теме.
-
Синоним из одного слова, который повторит суть темы.

Затем учащийся повернется к партнеру, и из двух синквэйнов они составят один, с которым оба будут согласны. Это даст им возможность поговорить о том, почему они это написали и еще раз критически рассмотреть данную тему. Кроме того, этот метод потребует, чтобы участники слушали друг друга и извлекали из произведений других те идеи, которые они могут увязать со своими. Затем весь класс может ознакомиться с парными синквэйнами.
4.Что предлагаете сделать дома?
Что впереди? (контрольная работа)
Какие задания, по вашему мнению, должна содержать контрольная работа?
Ну, вот и составьте сами текст контрольной работы для себя и своего товарища. Обязательным условием будет, не только составить текст контрольной работы, но и прорешать свои же задания. Если испытываете затруднения с самостоятельным составлением текста контрольной работы, можете решить задания №2 на с.62, с.79 с.85, с.86, с.96, №4 с.63, №6 с.86 из рабочей тетради О.С.Габриеляна, С.А. Сладкова.

По желанию вы можете выполнить и творческое задание по теме «Металлы»
(текст этого задания вывешивается на стенд «К уроку химии»

5.Само - , взаимооценка, оценка учителя.
Приложение
Разноуровневый практикум
« Решение упражнений и задач по теме «Металлы»».
Общий уровень («4»).
Задание I:
Составьте уравнения химических реакций, при помощи которых можно осуществить превращения:
Al AlCl3 Al(OH)3 AL2O3 Al2(SO4)3
1. 2. 3. 4.
Уравнение 4 представьте в ионном виде.
Задание II:
Приведите уравнения:
-
алюминотермического получения хрома из оксида хрома(III);
-
магнийтермического получения титана из оксида титана (IV)
Задание III:
Задача:
Определите массу соли, полученной действием серной кислоты на 160 г технического железа, содержащего 30% примесей.
F e + H2SO4 …
e + H2SO4 …
Задание IV:
Экспериментальная задача
Осуществите превращения:

 Ca(OH)2CaCl2CaSO4
Ca(OH)2CaCl2CaSO4
Запишите уравнения проведённых химических реакций.
Разноуровневый практикум
« Решение упражнений и задач по теме «Металлы»».
Минимальный уровень («3»).
Задание I:
Составьте уравнения химических реакций, при помощи которых можно осуществить превращения:
+O2 +H2O +HCl +H2SO4
Ca CaO Ca(OH)2 CaCl2 CaSO4
1. 2. 3. 4.
Для уравнения - 4 допишите схему реакции в ионном виде. (Не забудьте вместо знака вопроса поставить нужный коэффициент!)
CaCl2 + H2SO4 = CaSO4 +? …
Ca2+ + 2Cl - + 2H+ + … = CaSO4 +?… + ? …
Ca2+ + ... = CaSO4
Задание II:
Закончите уравнения реакций получения металлов:
1200 C0
-
PbO + CO … + …
1000 C0
-
WO3 + H2 … + …
-
Fe + CuSO4 …+ …
Задание III:
Задача:
Определите массу оксида кальция CaO, полученного при разложении 500 г известняка, содержащего 20% примесей, исходя из уравнения реакции
t 0C
CaCO3 CaO + CO2
-
Прочитайте задачу.
-
З
 апишите краткое условие -
апишите краткое условие -
Дано: m (известн.) = 500г
(прим.) = 20%
t 0C
CaCO3 CaO + CO2

m (CaO) - ?
-
Решение: 1) Вычислите массу чистого в-ва CaCO3 в известняке, исходя из формул: ω (чист. CaCO3)% = 100% - ω(прим.)%
ω (чист. CaCO3)% = 100% - … % = …%
mч(CaCO3) = mизвестн. * ω(чCaCO3) = … г
 100%
100%
2)Определите количество чистого вещества CaCO3, исходя из его массы, по формуле n = m/M
n(CaCO3) = mч(CaCO3)
 M(CaCO3)
M(CaCO3)
M(CaCO3) = Ar(Ca) + Ar(C) + 3*Ar(O) = …….. г/моль
n(CaCO3) = … моль
3)Запишите уравнение реакции, над формулами в-в и искомых в-в
n = ….. моль x моль
 CaCO3CaO + CO2
CaCO3CaO + CO2
n0 = 1 1 моль
4) Составьте пропорцию и решите её, определив тем самым количество вещества n(CaO)
5) Определите массу оксида кальция, исходя из его количества, по формуле m(CaO) = M(CaO)*n(CaO)
M(CaO) = Ar(Ca) + Ar(O) = ……… г/моль
m(CaO) = ……… г/моль * ……… моль = ………? г
4.Ответ:
Задание IV:
Экспериментальная задача
Получите из алюминия Al хлорид алюминия AlCl3, выполняя следующие действия:
1. Осторожно, немного наклонив, опустите в пробирку гранулу алюминия Al
2. Вставив пробирку с Al в штатив для пробирок, прилейте 1 мл раствора хлороводородной кислоты HCl.
Что наблюдаете? Какой газ выделяется? Какие изменения постепенно происходят с гранулой цинка?
3. Запишите уравнение проделанной реакции. Расставьте коэффициенты.
Al + HCl = AlCl3 + …?
Разноуровневый практикум
« Решение упражнений и задач по теме «Металлы»».
Продвинутый уровень («5»).
Задание I:
На примере любого изученного металла составьте генетическую цепочку, включающую оксид, гидроксид и не менее 2х солей этого металла. Одно из уравнений представьте в ионном виде.
Задание II:
Предложите технологическую цепочку производства свинца из минерала галенита PbS. Запишите уравнения реакций.
Задание III:
По любому уравнению из задания 1 или 2 вашего уровня практикума составьте условие задачи на вычисление массы продукта реакции по массе исходного вещества, содержащего примеси и решите её.
Задание IV:
Экспериментальная задача
Получите сульфат железа (II) различными способами, имея железо, раствор серной кислоты и раствор сульфата меди.
Запишите уравнения проведённых химических реакций.
Минимальный уровень: Решение задачи
Задача: Определите массу оксида кальция CaO, полученного при разложении 500 г известняка, содержащего 20% примесей, исходя из уравнения реакции
t 0C
C aCO3 CaO + CO2
aCO3 CaO + CO2
Дано: m (известн.) = 500г
ω (прим.) = 20%
t 0C
CaCO3 CaO + CO2

m (CaO) - ?
Решение: 1. Вычисляем массу чистого в-ва CaCO3 в известняке, исходя из формул:
ω (чист. CaCO3)% = 100% - ω (прим.)%
ω (чист. CaCO3)% = 100% - 20% = 80%

 mч(CaCO3) = mтехн. * ω(чCaCO3) = 500г*80% = 400г
mч(CaCO3) = mтехн. * ω(чCaCO3) = 500г*80% = 400г
100% 100%
mч(CaCO3) = 400г
2. Определяем количество чистого вещества CaCO3, исходя из его массы, по формуле
n = m/M

 n(CaCO3) = mч(CaCO3) = 400г = 4 моль
n(CaCO3) = mч(CaCO3) = 400г = 4 моль
M(CaCO3) 100 г/моль
M(CaCO3) = Ar(Ca) + Ar(C) + 3*Ar(O) = 100 г/моль
n(CaCO3) = 4 моль
2.Записываем уравнение реакции, проставляем количества веществ над формулами исходных в-в и искомых в-в
n = 4 моль x моль
 CaCO3CaO + CO2
CaCO3CaO + CO2
n0 = 1 1 моль
3. Составляем пропорцию и решаем её, определив тем самым n(CaO) количество вещества:
4 моль х моль
----------- = ----------- ;
1 моль 1 моль n (CaO) = 4 моль
4. Определяем массу оксида кальция, исходя из его количества, по формуле m(CaO) = M(CaO)*n(CaO)
M(CaO) = Ar(Ca) + Ar(O) = 56 г/моль
m(CaO) = 56 г/моль * 4 моль = 224 г
Ответ: m(CaO) = 224 г
Урок по теме: «Кислоты, свойства кислот, взаимодействие кислот с металлами». (8 класс)
Антосенкова Ольга Степановна, учитель химии
высшей категории,
МКОУ " Товарковская СОШ№1"
Пояснительная записка к уроку
Данный урок представлен по программе Е.Е. Минченкова, А.А. Журина и др. в 8 классе. Раздел «Важнейшие классы неорганических веществ»
Урок проводится в 8 классе с использованием технологии критического мышления «Чтение текста с пометками», а также с применением информационно - коммуникативных технологий
Урок носит практический характер, что повышает интерес в изучении химии. Учащиеся учатся наблюдать, анализировать, сравнивать. При этом формируются как личностные так и метапредметные результаты обучения: способность к саморазвитию, сформированность, мотивации учащихся к обучению и целенаправленной познавательной деятельности, формирование основ экологической культуры.
Учащиеся учатся соотносить свои действия с планируемыми результатами обучения, осуществлять контроль своей деятельности в процессе достижения результатов при выполнении экспериментов и изучении текстового материала.
( Слайд №1,2 Е.Е. Минченков, А.А. Журин, П.А. Оржековский, Т.В. Смирнова. Химия: 8 класс для общеобразовательных учреждений
Цель урока:
развитие критического мышления учащихся при работе с различными источниками информации,
развитие интеллектуальных способностей учащихся,
развитие интереса к химии, формирование естественно - научного мировоззрения, коммуникативных качеств учащихся, культуры общения.
Планируемые результаты обучения:
Предметные: знать физические и химические свойства кислот, их способности взаимодействовать с некоторыми металлами, о вытеснительном ряде металлов, распознавать кислоты с помощью индикаторов, наблюдать опыты, правила техники безопасности при работе с кислотами.
Метапредметные: уметь делать обобщения, устанавливать аналогии, выдвигать гипотезы о возможности протекания реакции между кислотами и металлами на основании их положения в ряду активности, оксидами металлов и кислотами, фиксировать наблюдения, формулировать выводы.
Личностные уметь прогнозировать возможности протекания химических реакций между металлами и кислотами, уметь определять цели своего обучения, ставить и определять для себя новые задачи познавательной деятельности. Развивать мотивы и интересы своей познавательной деятельности..
Новое содержание: физические свойства кислот, взаимодействие кислот с металлами, вытеснительный ряд металлов, реакции замещения.
Тип урока: урок усвоения новых знаний, освоение практических умений и навыков.
Форма урока: моделирование мышления учащихся с помощью технологии развивающего обучения.
Стратегия: чтение текста с пометками.
Вид урока: урок самостоятельных теоретических и практических работ.
Оборудование: цинк (гранулы), медь (кусочки проволочки), растворы соляной и серной кислот. Пробирки, спиртовка (электропробирконагреватель), спички, пробка с газоотводной трубкой, лабораторный штатив, штатив для пробирок, медиапроектор для демонстрации ЦОР-ов, портрет Н.Н. Бекетова.
План урока:
-
Организация работы учащихся на уроке.
-
Стадия вызова. Подготовка к изучению нового материала через повторение и актуализацию опорных знаний.
-
Стадия осмысления. Изучение нового материала (стратегия «Чтение текста с пометками»).
-
Проведение лабораторных опытов.
-
Рефлексия. Закрепление полученных знаний.
-
Творческое задание.
Эпиграф:
О вы, которых ожидает
Отечество от недр своих
И видеть таковых желает,
Каких зовет из стран чужих,
О, ваши дни благословенны!
Дерзайте ныне ободренны
Раченьем вашим показать,
Что может собственных Платонов
И быстрых разумом Невтонов
Российская земля рождать.
М.В. Ломоносов
( Слайд №3, №4).
-
- Много славных имен оставил наш народ мировой науке.
Образ М.В. Ломоносова вызывает у нас чувство особой гордости и восхищения прежде всего по многогранности своего таланта, по глубине своих знаний. Ломоносов принадлежит к тому кругу немногочисленных ученых в истории мировой науки, чье имя связано с развитием целого ряда наук.
Академик М.В. Келдыш.
«Ломоносов был великий человек…
Он создал первый университет.
Он, лучше сказать, сам был
первым нашим университетом».
А.С. Пушкин
Ход урока
I.Организация работы учащихся на уроке:
Проверка подготовленности учащихся к уроку; организация внимания и внутренней готовности.
II. Стадия вызова. (Слайд№7). Подготовка к изучению нового материала через повторение и актуализацию опорных знаний.
1. Какой класс веществ вы изучили? (оксиды).
2. Что такое оксиды? Какие группы оксидов Вам известны? Приведите примеры.
3. Какие вещества получаются при взаимодействии оксидов неметаллов с водой?
Привести примеры. Подтвердить записью уравнений реакций.
4. Как определить наличие кислоты? (индикатором).
Лабораторный опыт.( Слайд №8).
Действие растворов кислот на индикаторы.
Класс делится на группы. (Работа в парах. Алгоритм проведения эксперимента в Приложении).
Заполнить таблицу: ( Слайд №9).
Индикатор
Цвет при действии кислоты
1 - я группа.
2 -я группа
3 -я группа
4 -я группа.
Соляная кислота
Серная кислота
Азотная кислота
Ортофосфорная кислота
Лакмус
красный
красный
красный
красный
Метиловый оранжевый
розовый
розовый
розовый
розовый
Фенолфталеин
бесцветный
бесцветный
бесцветный
бесцветный
Подумайте: если даны растворы двух веществ, как можно практически доказать , что одно из них является раствором кислоты?
Опираясь на свои наблюдения, дайте определение « индикаторы». ( Слайд №10).
(от лат. Indicator - указатель) 
Учитель: Все закончили проведение эксперимента. ПОДВЕЛИ итоги, и мы разбираемся с первым свойством кислот - действием на индикаторы. ( Анализ таблицы).
Учитель: ( Слайд №11).Путешествие в «Царство кислот».
В славном царстве « Химии жили интересные Кислоты, все разные. Все разные да особенные. Образуются все они по- разному, да всё по своему. А отправляемся мы в путешествие по славному царству кислотному, в гости к Кислотушке, которая о себе так молвит: « Мои бабушка и дедушка были простыми и добрыми. Бабушка была красивой, желтоволосой, когда выходила замуж. Воды не любила, страх! Если её выкупать, то всегда сухой выходила. Дедушка был из старинного рода, сам лёгкий, свежий и прозрачный. Бабушка так его любила, что от любви и сгорела. Здесь и появился мой батюшка - их сын. Он был резкий, прозрачный.
Я родилась от его второго брака. Даже вступив во второй брак, он не изменил своего ядовитого характера, хотя и значительно потяжелел. Моя матушка подвижная, прозрачная, живая.
А кто же я?
Ученики отвечают и составляют генетический ряд:
S → SO2 → SO3 → H2SO4 (Слайд №10).
III.Стадия осмысления.
Учитель: Итак, мы отправляемся в царство Кислот, чтобы ближе с ними познакомиться. По ходу урока вы будете знакомиться с текстом учебника, делать пометки, выполнять необходимые опыты, чтобы узнать свойства кислот.
Портретная Галерея. (Слайд №13).
-
Задание №1. Прочитайте текст о физических свойствах серной и соляной кислот и сделайте пометки на полях:
V - это я знаю.
+ - Новая информация.
- - Информация, противоречащая моим знаниям.
? - Информация, требующая пояснений.
! - Это интересно.
Выписать предложения в таблицу:
v
+
-
?
!
( Слайд №14)
-
Работа в парах. Сравнивают записи, обсуждают согласия и разногласии во мнениях. Работают с дополнительной литературой. ( Крицман. Книга для чтения по химии).
-
Какие свойства характерны для каждой кислоты?
-
Как можно распознать серную и соляную кислоту по внешним признакам?
Задание №2. (Слайд №14).
1.Прочитайте текст, ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ.
2. Обратите внимание на ФАКТЫ.
Сделайте пометки на полях и заполните таблицу.
Выписать предложения в таблицу:
v
+
-
?
!
3. Работа в парах. (Слайд №15, 16). Сравнивают записи, обсуждение.
4. Проверка знаний
Какие правила техники безопасности необходимо соблюдать при работе с концентрированной серной кислотой и соляной кислотой? Почему?
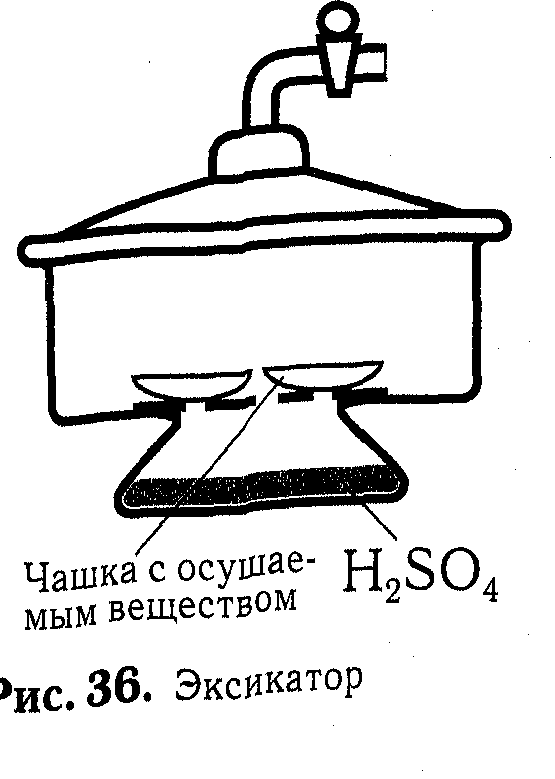
Объясните рис. №36.
Оригинальность:
Демонстрация
( Слайды №17,18,19): обугливания лучинки и фильтровальной бумажки серной кислой.

Обугливание сахарной пудры.(Слайд № 20,21).
Свойства плавиковой кислоты.(Слайд №20 )

Задание № 3.
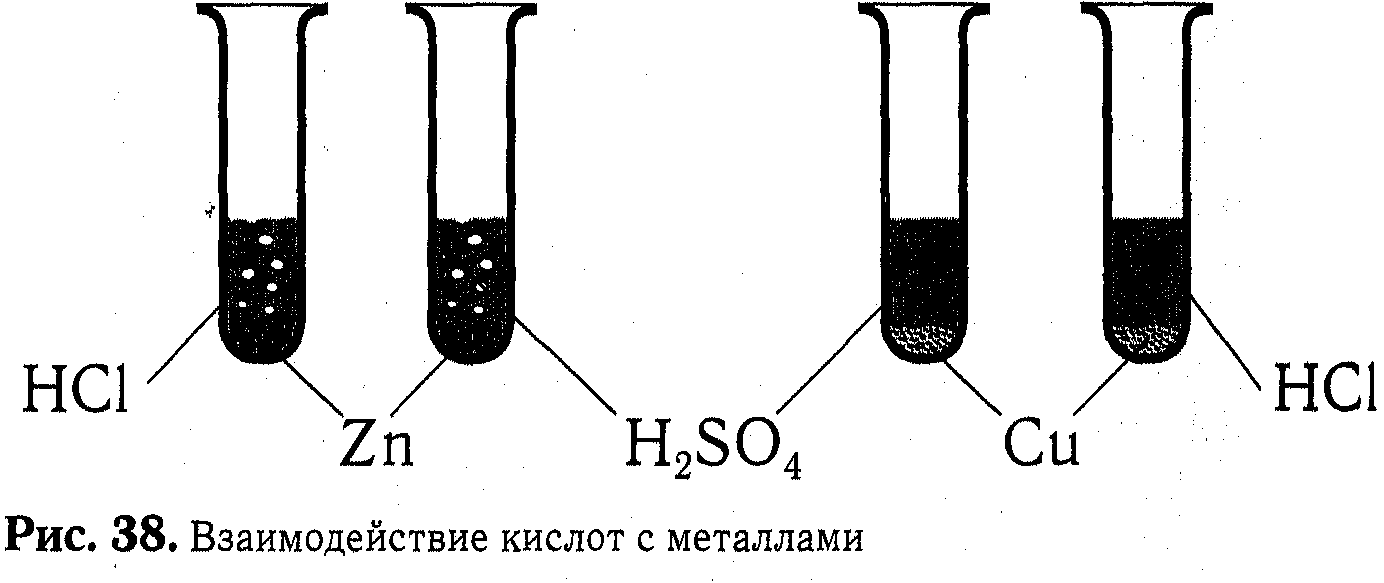
Учитель: ( Слайд №22). А теперь наши группы, продолжая путешествие по владениям Кислот ,въезжают на « Металлический мост».
Мы исследуем взаимодействие кислот с металлами. ( Слайд №23).
-
Прочитайте Лабораторный опыт №6. стр. 81. .
-
Выполните опыты.
Учащиеся выполняют исследование свойств разбавленной серной и соляной кислот с металлами Zn и Cu.В тетрадь фиксируют опыт, зарисовывая его, и записывают наблюдения.
3.Какие признаки химических реакций Вы наблюдаете?
4. В пробирках с цинком через слой жидкости проходят пузырьки какого-то газа. Можно ли его собрать и исследовать?
Задание № 4.
-
Прочитайте Лабораторный опыт № 7, стр.81.
-
Выполните опыты.
Учащиеся выполняют опыты, проводят наблюдения, зарисовывают и фиксируют наблюдения.
Учитель: Что за газ выделяется при взаимодействии кислот с металлами?
Это водород.
В чём же суть химической реакции?
Задание № 5.
1.Прочитайте текст учебника стр.82.
2.Обратите внимание на ОПРЕДЕЛЕНИЕ, ВЫПИШИТЕ ЕГО.
Сделайте пометки на полях и заполните таблицу.
Выписать предложения в таблицу:
v
+
-
+
3. Работа в парах. Сравнивают записи, обсуждение.
4. Проверка знаний.
Запишите уравнения реакций взаимодействия цинка с соляной и серной кислотой.
Zn + H2 SO4 = ZnSO4 + H2↑
Zn + 2HCl = ZnCl 2 + H2↑
Какие реакции называют РЕКЦИЯМИ ЗАМЕЩЕНИЯ? (определение записывают в словарь). В результате реакций образовались соли, это ещё один класс сложных веществ: Zn SO4 - соль серной кислоты;ZnCl 2 - соль соляной кислоты (запись на доске или демонстрация слайдов).
Что такое ВЫТЕСНИТЕЛЬНЫЙ РЯД МЕТАЛЛОВ (Слайд № 23)
Учащиеся анализируют рис. на стр.79.
1) Где располагаются цинк и медь в этом ряду?
2) Почему цинк вытесняет водород из растворов кислот, а медь не вытесняет?
Демонстрация портрета Н.Н. Бекетова.

Учитель: (Слайд №24). Вот и закончилось наше путешествие по «ЦАРСТВУ кислот».
Многое ещё нам предстоит узнать об их свойствах, но сейчас нам нужно ненадолго попрощаться с этим ЦАРСТВОМ, и чтобы его покинуть, нам нужно получить пропуск на выезд.
Тестовые задания (на карточках):
-
Соединение серы, для которого характерны следующие свойства: газ с резким запахом, при растворении в воде образует кислоту, соответствует формуле:
1) H2 SO4; 2) Cu S; 3) SO2; 4) Na2 S.
-
Соединение серы, для которого характерны следующие свойства: обугливает древесину, сахар, растворяется в воде, , имеет формулу:
1) FeS; 2) H2 SO4 3) SO2; 4) H2 S.
-
При прибавлении лакмуса к раствору серной кислоты раствор окрашивается в:
1) синий цвет; 2) красный цвет; 3) жёлтый цвет; 4) малиновый цвет.
-
Раствор серной кислоты взаимодействует с металлами:
1)магнием; 2) медью; 3) золотом; 4) серебром.
Учитель: Заканчиваем тестовую работу и результаты сдаём учителю.
IV. Рефлексия.
В заключении учитель предлагает учащимся зачитать заметки по путешествию в « царство КИСЛОТ».
Продолжите фразу (Слайд №25):
-
Сегодня на уроке…
-
Теперь я знаю…
-
Мне на уроке…
V.Задание на дом:
Минченков Е.Е. А.А. Журин стр. 75-79, составить кластер о свойствах кислот.
-
Литература:
1. Химия. Первое сентября, №3, 2007год, стр. 26-29.Т.В. Сушкова. Технология критического мышления,Стр.40-43.
2. Е.О. Емельянова, А.Г. Иодко, Организация познавательной
деятельности учащихся на уроках химии, ч.2,Москва, «Школьная Пресса», 2002 год.
3. Л.Ю. Аликберова, Занимательная химия, Москва, АСТ- пресс,2002 год.
4. Е.Е. Минченков, А.А. Журин, П.А. Оржековский, Т.В. Смирнова. Химия: 8 класс для общеобразовательных учреждений - М. Мнемозина, 2010
2. Приложение №1
1.Действие кислот на индикаторы.(Запись на доске или демонстрация слайда).
Алгоритм проведения эксперимента.
«Действие растворов кислот на индикаторы».
-
В одну из трёх пробирок с кислотой опустите лакмусовую бумажку и наблюдайте, что с ней происходит. Выберите бумагу соответствующего цвета и вклейте в таблицу.
-
Во вторую пробирку опустите индикаторную бумажку метилового оранжевого. Что произошло? Оформите результат в таблице.
-
В третью пробирку прилейте несколько капель фенолфталеина. Наблюдение оформите в таблице.
-
Опираясь на свои наблюдения, попытайтесь вывести определение « индикаторы».
-
Подумайте: если даны растворы двух веществ, как можно практически доказать, что одно из них является раствором кислоты?
Приложение №2.Кластер по теме
Приложение №3
Факты
Серную кислоту люди знают около 1000 лет. Соляную кислоту получили впервые в ХI в. Уксусная кислота, видимо, первая, с которой познакомилcя человек. Она образуется при скисании виноградного вина. Яблочная, щавелевая, лимонная, молочная, масляная, уксусная и некоторые другие кис- лоты знакомы практически каждому - мы употребляем их с пищей.
Известно более 800 видов растений, вырабатывающих синильную кислоту - сильнейший яд.
КИСЛОТЫ. СВОЙСТВА КИСЛОТ
В природе встречается много различных кис лот: яблочная, лимонная, уксусная и др. Некоторые кислоты используют в химических производствах, их получают в промышленности.
В дальнейшем Вам предстоит изучить химические свойства веществ, принадлежащих к различным классам.
Наиболее важны из них серная Н2SO4 и соляная НСI. Формулы этих кислот Вам уже известны.
ФИЗИЧЕСКИЕ СВОЙСТВА СЕРНОЙ И СОЛЯНОЙ КИСЛОТ
Серная кислота при обычных условиях - жидкость, вязкая, как растительное масло, не имеющая запаха, почти вдвое тяжелее воды. Серная кислота активно поглощает влагу из воздуха. Это ее свойство используют для осушения веществ. С этой целью их помещают в эксикатор специальный сосуд для высушивания и хранения веществ, на дно которого наливают серную кислоту (рис. 36).
Соляная кислота представляет собой водный раствор хлороводорода НСI. Как видно из
формулы, в составе этой кислоты нет атомов кислорода. Таким образом, существуют кислородсодержащие (H2SO4) и бескислородные (нсl) кислоты.
Соляная кислота имеет запах хлороводорода, так как его молекулы постоянно выделяются из раствора. Попадая в воздух, хлороводород соединяется с водой, пары которой всегда присутствуют в воздухе, и над соляной кислотой образуется туман из ее мельчайших капель - кислота «дымит».
Факты.
Соляная кислота - составная часть желУ ДОЧНОГО сока. Она способствует пищеварению. Кроме того, соляная кислота - сильный бактерицид: под ее действием погибают микрооргаНИЗМЫ, попавшие в желудок с пищей.
ХИМИЧЕСКИЕ СВОЙСТВА
СЕРНОЙ И СОЛЯНОЙ КИСЛОТ.
Если в пробирку с серной кисло той опустить лучину, то древесина почернеет: происходит обугливание древесины (из нее выделяется углерод в виде угля). Соляная кислота хотя и не обугливает, но также разрушает кожу, ткани, древесину. Поэтому понятно, как опасно попадание брызг кислот на кожу человека и одежду.
Обращаться с кислотами нужно осторожно (рис. 37). Если кислота попала на руки, то ее необходимо смыть большим количеством воды. После этого руки нужно тщательно вы мыть с мылом.

Рис. 37. Осторожно! Едкие вещества (Кислоты).
Взаимодействие кислот с металлами
ЛАБОРАТОРНЫЙ ОПЫТ б
(І вариант)
Возьмите пластинку с четырьмя ячейками: две - с кусочками цинка и две - с медью. добавьте в одну ячейку с цинком и в одну ячейку с медью немного раствора серной кислоты.
(ІІ вариант)
В две оставшиеся ячейки с теми же металлами добавьте немного соляной кислоты
( рис. 38).
Какие признаки химических реакций Вы наблюдаете?
Рис. 38. Взаимодействие кислот с металлами
В пробирках с цинком через слой жидкости проходят пузырьки газа. Можно ли его собрать и исследовать?
Полученный в опыте горючий газ ЭТО ВОДОРОД Н2. Он легче воздуха (его плотность в 14,5 раза меньше плотности воздуха).
В чем же суть проведенной химической реакции? Атомы металла вытеснили атомы водорода из молекул кислот; атомы водорода соединились в молекулы, и водород выделился в виде газа:
Zn + H2SO4 = ZnSO4 + H2↑
Zn + 2HCl = ZnCl2 + H2↑
(Направленная вверх стрелка, стоящая после формулы образовавшегося вещества, означает, что это вещество при обычных условиях газообразно.)
Химические реакции между простым и сложным веществами, в которых атомы, составляющие простое вещество замещают атомы одного из элементов сложного вещества, называют реакциями замещения.
В рассматриваемых реакциях кроме водорода образуются соли: ZnSO4 - соль серной кислоты; ZnС12 - соль соляной кислоты. Соли - это еще один класс сложных веществ.
Теперь обратите внимание на то, что в пробирках с медью (лабораторный опыт 6) никаких изменений не произошло. Можно сделать вывод, что не все металлы вытесняют водород из кислот.
По способности вытеснять водород из растворов кис лот металлы можно расположить в следующий ряд:

Этот ряд называют вытеснительным рядом металлов, или рядом Н.Н.Бекетова - по имени ученого, в ХIХ в. изучавшего взаимодействие металлов со сложны ми веществами. Металлы, стоящие в ряду до водорода, вытесняют его из растворов кислот (кроме азотной кислоты НNO3). Чем левее в ряду стоит металл, тем активнее он вытесняет водород.
В этот ряд включены металлы, химические знаки которых Вы еще не знаете: Ni
- никель, Sn - олово, РЬ - свинец, Р - платина. Запомните эти новые знаки
(см. табл. 7). 
Тема урока "Основания", 8 класс
Кузнецова Лидия Михайловна, учитель химии и биологии,
МКОУ «Полотняно - Заводская средняя общеобразовательная школа № 1»,
победитель районного конкурса "Учитель года"
Цели урока:
Образовательные:
-
сформировать понятие «основание»;
-
научить давать названия основаниям, классифицировать основания по их растворимости в воде, распознавать основания с помощью качественных реакций.
Развивающие:
-
развивать логическое мышление путем сравнения, обобщения, систематизации;
-
развивать умение осуществлять самостоятельную деятельность на уроке через индивидуальную, парную и групповую работ; развивать умение применять имеющиеся знания в поисках решения проблемных ситуаций в условиях новых учебных задач.
Воспитательные:
-
формировать коммуникативную культуру учащихся;
-
воспитывать положительные мотивы к изучению предмета.
Тип урока - комбинированный
Методы: частично-поисковые, практические, наглядные.
Формы работы: индивидуальная работа, самостоятельная работа, тестирование, беседа, работа в парах и группах, общеклассная, работа с учебником.
Оборудование: компьютер, мультимедийный проектор, экран, колонки, презентация к уроку, раздаточный материал.
Реактивы и лабораторное оборудование: штатив для пробирок, пробирки (3 шт.), раствор - NaOH, твердые NaOH, KOH, Zn(OH)2, 4 стакана, стеклянные палочки (3 шт.), вода, индикатор - фенолфталеин, подъемный столик.
Ход урока
I. Организационный момент
Долгожданный дан звонок,
Начинается урок.
Здравствуйте. Я рада видеть вас на уроке химии. Садитесь. Сегодня у нас необычный урок и для начала давайте, посмотрим друг на друга, подарим хорошее настроение и заряд бодрости. Спасибо.
В начале урока хочу обратить ваше внимание на эпиграф. «Каждый успех наших знаний ставит больше проблем, чем решает». Луи де Бройль.
-
В чем состоит справедливость этого высказывания?
Наш сегодняшний урок поможет разобраться в справедливости этого высказывания.
II. Проверка домашнего задания.
А сейчас я предлагаю вам выполнить задание, материал которого мы будем использовать сегодня на уроке. У вас на партах находятся рабочие листы (приложение 1), с которыми вы будете работать в течение всего урока. В пункте «Проверка домашнего задания» внимательно познакомьтесь с тем, что вы должны сделать, и приступайте к выполнению задания. На работу отводится 3 минуты.
1 вариант. Определите соответствие между названием вещества и его формулой.
Название вещества Формула вещества
1. Оксид натрия А) CO
2. Оксид углерода (IV) Б) CuO
3. Оксид меди (I) В) Na2O
4. Оксид углерода (II) Г) Cu2O
5. Оксид меди (II) Д) CO2
Дополнительное задание. Запишите определение степени окисления.
Правильный ответ: 1 - В, 2 - Д, 3 - Г, 4 - А, 5 - Б.
2 вариант. Определите соответствие между формулой оксида и степенью окисления элемента в нем.
Формула вещества Степень окисления элемента
1. CO А) + 1
2. P2O5 Б) + 2
3. Н2O В) + 3
4. Mn2O7 Г) + 5
5. Cr2O3 Д) + 7
Дополнительное задание. Запишите определение «бинарные соединения».
Правильный ответ: 1 - Б, 2 - Г, 3 - А, 4 - Д, 5 - В.
Критерии оценки:
Нет ошибок - «5»; 1 ошибка - «4»; 2 ошибки - «3»; 3 ошибки и больше - «2».
Самопроверка
Проверьте правильность выполнения задания по слайду и оцените себя по критериям, которые у вас записаны в рабочем листе. Внесите свою отметку в рабочий лист. Вы оценили себя. Обратите внимание на соответствия, в которых вы допустили ошибки.
III. Целеполагание и мотивация
Сегодня мы продолжим изучение веществ. С ними люди сталкивались уже в древности. Даже в таком бытовом действии, как мытье волос.
-
А вы знаете, чем мыли волосы женщины в Древней Руси?
Ответ очень прост, а именно пользовались тем, чего в доме было предостаточно. «Раствором золы».
Рецепт был такой: взять ковш золы, да не простой, а еловой или от подсолнечника, замочить в дубовом ведре ключевой или дождевой водой. Постоит такая смесь сутки, потом ее надо процедить или просто слить верхний слой, развести фильтрат чистой водой, подогреть на камельке в рубленой бане и вымыть косы.
Полученный раствор, мыльный на ощупь - это средство под названием "щелок". Вспомнили мы о нем потому, что реакция среды раствора щелока такая же, как и тех растворов, которые мы начинаем изучать.
Для того, чтобы узнать название этих веществ, вам надо разгадать ребус.
Р
 аботаем в парах.
аботаем в парах.






-
Какие же вещества мы сегодня будем изучать?
Учащиеся формулируют тему урока.
Итак, тема нашего урока «Основания» (слайд).
Запишите тему урока в рабочий лист.
-
Что мы можем узнать и научиться на уроке?
Соотнесите фразы и сформулируйте, чем мы будем заниматься сегодня на уроке.
1. Познакомиться а) состав, номенклатуру, классификацию оснований
2. Рассмотреть б) записывать формулы оснований и давать им названия
3. Научиться в) с новым классом соединений - основаниями
Учащиеся называют, что они хотят получить для себя с урока.
Чтобы добиться наших целей обратимся к древним книгам. В одной из них я встретила такое письмо - обращение от средневекового алхимика к будущим потомкам:
«Дорогой друг! Ты хочешь найти клад? (Уже интригующе!) Что для этого нужно? Твоя сообразительность и моя поддержка. Если ты это имеешь, то в путь! Передаю тебе карту и инструкции по ее применению. Желаю удачи!»
Итак, я приглашаю вас в путешествие по карте древнего алхимика (высвечивается карта на экране). Прочитайте название древней карты.
Интересно, название карты и тема нашего урока одинаковы «Основания».
Ребята, у каждого из вас есть своя «Карта успешности» (приложение 2), где вы на каждом этапе путешествия будете отмечать знаком «+» вопросы, которые вами хорошо понятны и знакомы «?», те, которые требуют доработки. По окончанию урока вы их сдадите, чтобы я могла судить о вашем отношении к уроку и дальнейших пожеланиях.
-
Ну, что, попробуем найти клад? Тогда в путь!
IV. Изучение нового материала
Задание № 1. Готовность к путешествию проверим с помощью блиц - опроса.
Блиц - опрос:
-
На какие группы делятся известные вам вещества?
-
Какие вещества называются простыми?
-
Какие вещества называются сложными?
-
Что такое бинарные соединения?
-
Что такое оксиды?
(Молодцы! Я очень рада, что на все вопросы (большинство вопросов) вы смогли дать правильные ответы.)
На предыдущих уроках вы говорили о бинарных соединениях, сегодня мы поговорим о веществах, состоящих из 3 химических элементов. Подумайте, как они называются? С этим понятием мы уже сегодня встречались (основания).
ПЕРВЫЙ ЭТАП ПУТЕШЕСТВИЯ
Давайте определим, что же это за вещества - основания? Познакомимся с ними более подробно. Это будет первый этап нашего путешествия по карте алхимика, где мы рассмотрим общие признаки оснований. Для этого выполним задание № 2 в рабочем листе.
Закрыть экран проектора.
Задание № 2. Отметьте формулы бинарных соединений знаком «+».
… выполнит задание на доске. Под карточкой со знаком «+» поместит формулы бинарных соединений.
А)
-
СO2
Ca (OH)2
К2O
NaCl
Н3РО4
NaОН
NH3
Fe2O3
H2SO4
HCl
Al(OH)3
HNO3
-
Что надо было сделать в этом задании? Проверьте правильность выполнения задания.
-
Все ли согласны с тем вариантом, который получился на доске?
С этими веществами мы уже знакомы (снять карточки). Рассмотрим формулы оставшихся веществ.
Б) Разделите их и запишите в таблицу под буквой Б.
На доске остаются формулы веществ:
-
Ca (OH)2
Н3РО4
NaОН
H2SO4
Al(OH)3
HNO3
… выполнит задание у доски и распределит эти вещества по группам.
NaОН
H2SO4
Ca (OH)2
Н3РО4
Al(OH)3
HNO3
Проверяем.
-
По какому признаку распределили вещества? Все ли согласны с тем вариантом, который получился на доске?
-
Что общего в составе каждой группы?
По составу вещества делят и объединяют в классы. Те вещества, которые имеют в своем составе группу ОН, относятся к классу оснований. Сегодня они являются объектом изучения.
Вещества, имеющие атом водорода на первом месте относятся к другому классу веществ. Мы их будем изучать на следующем уроке.
Посмотрите на формулы оснований.
-
Атомы каких элементов обязательно присутствуют в каждом из них? (О и Н)
Открыть экран проектора.
Скажу вам по секрету, что кислород и водород образует группу, которая обязательно входит в состав основания называется гидроксильной или гидроксогруппой (слайд).
-
Как вы думаете, почему её назвали гидроксогруппа?
… было задано задание, выяснить происхождение этого слова.
Сообщение учащегося
В этом слове два корня (корни выделяются). Название слова происходит от латинских названий элементов, входящих в её состав: водорода и кислорода. Латинское название водорода гидрогениум, латинское название кислорода.
Выясним, что представляет гидроксогруппа и имеет ли она заряд?
Выполните задание № 3. Работу выполняете в парах.
Задание 3. (работа в парах). Определите степени окисления элементов в гидроксильной группе. Запишите вывод, имеет ли она заряд.
Проверка работы. Ответ: ─ О-2 Н+1 - 2 + 1 = - 1
Вывод: группа ОН - это заряженная частица с зарядом 1-.
-
Какой вывод у вас получился? (Учащиеся читают вывод)
Чтобы отличить заряд иона от степени окисления, заряд 1 не пишут.
-
Все согласны? Есть другие мнения?
-
Как называются заряженные частицы? (Ионы)
-
Какой вывод можно из этого сделать? (Группа ОН - это ион)
-
А какой это ион простой или сложный? (Сложный)
-
Почему? (Потому что в состав входят атомы 2 химических элементов)
-
А как будет называться сложный ион гидроксогруппы? (Гидроксид - ион)
-
А что стоит на первом месте в формулах оснований? (Металлы)
-
Какой вид связи между металлами и гидроксогруппой? (Ионная)
-
То есть из чего состоят основания? (Из ионов)
Признаки оснований:
-
Сложные вещества
-
Состоят из ионов металлов
-
Состоят из гидроксид - ионов
Задание 4. Пользуясь, рассмотренными общими признаками оснований, сформулируйте определение основания.
Учащиеся выдвигают свои версии.
Давайте проверим, так ли это. У вас есть замечательная волшебная книга, открыв которую на с. 98 вы можете проверить - так ли это (Один учащийся читает определение вслух).
Основания - это сложные вещества, состоящие из ионов металлов и связанных с ними гидроксид - ионов.
-
Совпало ли ваше определение с определением, данным в волшебной книге?
Запишите определение в рабочий лист.
Возьмите свою карту успешности и оцените свои знания на пройденном этапе.
ВТОРОЙ ЭТАП ПУТЕШЕСТВИЯ
Наше путешествие продолжается.
Каждое вещество имеет название. Названия оснований складываются как у человека: из фамилии, имени и отчества.
-
Давайте разберемся, как же можно называть основания?
Для выполнения следующего задания вам необходимы знания обозначения химических элементов или, на крайний случай просто сообразительность.
З
Са(ОH)2
гидроксид алюминияадание 5. На слайде будут появляться формулы оснований и их названия. Если пара подобрана верно, то похлопайте (три раза) в знак согласия, если допущена ошибка тихо присесть.
гидроксид железа (III)
Fe(ОH)2
Al(ОH)3
гидроксид натрия(III)
гидроксид железа (II)
Fe(ОH)3
NaОH
гидроксид кальция
(Если неправильно: что не так, как должно быть?)
Поаплодируем друг другу за работу.
На примере данных записей на слайде составьте общую схему названия оснований.
Работа в группе. Объединитесь в группы и на большом листе бумаги запишите схему названия оснований. После выполнения задания разместите их на доске.
слово "гидроксид"
+
+
название металла в родительном падеже
+
(римская цифра, обозначающая числовое значение степени окисления металла)
для металлов с переменной степенью окисления
Проверим правильность выполнения.
Запишите схему названия оснований в рабочий лист.
В карте успешности оцените свою работу на этом этапе путешествия.
А наше путешествие продолжается.
ТРЕТИЙ ЭТАП ПУТЕШЕСТВИЯ
На следующем этапе нашего путешествия мы познакомимся с необычными названиями оснований.
Из данных на слайде названий веществ прочитайте те, которые не соответствуют записанной схеме. (КОН - едкое кали, NаОН - едкий натр, Са(ОН)2 - гашеная известь)
Но их необычность не только в названии.
Проведем опыт. Но прежде хочу обратить внимание на технику безопасности при работе с такими веществами. Их названия говорят сами за себя.
Объясняется это тем, что шерстяные ткани в этих растворах быстро разрушаются, при попадании на кожу человека растворы этих веществ вызывают образование язв. Твердые щелочи руками брать нельзя, только пинцетом, в стеклянной посуде хранить долгое время тоже нельзя, обращаться с ними нужно осторожно, не допускать попадания их в глаза, на кожу и под ногти. Если раствор попал на кожу рук или лица, необходимо быстро промыть данный участок кожи под сильной струёй воды и обработать ватным тампоном, смоченным жидкостью из колбы «При ожоге щёлочью».
Итак, внимание.
Беру три стакана с водой, в каждый из них добавляю основания с необычными названиями и гидроксид цинка (меди): в первый - едкое кали (гидроксид калия), во второй - едкий натр (гидроксид натрия), в третий - гидроксид цинка.
Демонстрационный опыт "Растворимость оснований"
-
Что вы наблюдаете? (В 1 и 2 стаканах вещества растворились, а в 3 - не растворилось)
-
На какие группы делятся основания?
О
 снования
снования
Растворимые Нерастворимые
Растворимые в воде основания, называются щелочами.
Допишите схему в рабочем листе.
Растворимость оснований можно определить по таблице растворимости, которая находится на заднем форзаце учебника.
Знакомство с таблицей растворимости:
Откройте её. Для определения растворимости веществ пользуются следующим алгоритмом.
АЛГОРИТМ РАБОТЫ С ТАБЛИЦЕЙ РАСТВОРИМОСТИ ВЕЩЕСТВ
-
В горизонтальном ряду находим ион металла, входящего в состав основания.
-
В вертикальном ряду гидроксид - ион.
-
Смотрим, какая буква стоит на пересечении. Если буква Р, значит основание растворимое, М - малорастворимое, Н - нерастворимое, ? - нет достоверных сведений о существовании этого соединения, прочерк - в водной среде разлагается.
Задание 6. Пользуясь алгоритмом, определите растворимость следующих оснований: LiOH, Mg(OH)2, Al(OH)3, Ba(OH)2. Запишите их в соответствующие группы в рабочий лист.
-
Прочитайте, какие основания вы отнесли к растворимым. (LiOH, Ba(OH)2)
-
Прочитайте, какие основания вы отнесли к нерастворимым. (Mg(OH)2, Al(OH)3)
Сделайте отметку в карте успешности.
ЧЕТВЕРТЫЙ ЭТАП ПУТЕШЕСТВИЯ
И мы приступаем к самому ответственному заданию. Для следующего этапа я приготовила пробирку с раствором щелочи.
Ой, здесь две пробирки, что же я натворила! Какую пробирку мне взять? Что же делать?
Предложите ваш вариант, как отыскать пробирку с водой и со щелочью (проблемная ситуация). (Учащиеся предлагает варианты обнаружения раствора щелочи)
Чтобы не случилось беды, Алхимик на карте поместил подсказку. В таких ситуациях помогают индикаторы.
-
Ребята, кто из вас знаком с таким понятием?
Узнать химический термин можно в словаре химических понятий и терминов.
Воспользуемся словарем.
… прочитает нам, что такое индикатор.
Вещества, изменяющие окраску в зависимости от среды, называются индикаторы (указатели).
Посмотрим, как индикатор меняет свою окраску в растворе щелочи.
Видеоопыт "Испытание растворов индикаторами".
-
Индикатор
Щелочная среда
Лакмус
Синий
Метиловый оранжевый
Желтый
Фенолфталеин
Малиновый
Изменение окраски индикаторов в щелочи зафиксирована в таблице 4 на с. 101 в нашей волшебной книжке.
Откройте ее и изучите таблицу.
Самым первым появился индикатор лакмус. Лакмус - это водный настой лакмусового лишайника, растущего на скалах в Шотландии. Этот индикатор случайно открыл в 1663 году английский физик и химик Роберт Бойль. Позднее лакмусовым настоем стали пропитывать фильтровальную бумагу; ее высушивали и получали таким образом "лакмусовые бумажки".
А теперь, вернемся к нашей проблеме.
-
Что же надо сделать, чтобы определить, где находится щелочь? (с помощью индикатора)
Я прошу выйти … . Вот тебе индикатор, капни в каждую из пробирок. Спасибо, присаживайтесь.
-
В какой из пробирок находится щелочь? (ответы учащихся)
-
Почему вы так решили? (ответы учащихся)
Пользуясь таблицей, определите какой индикатор использовался. (ответы учащихся)
Проверим действие индикатора на нерастворимые основания. Для этого воспользуемся фенолфталеином.
Демонстрационный опыт «Реакция индикаторов на нерастворимые основания»
Я прошу выйти … Вот тебе индикатор, капни в пробирку с нерастворимым основанием. Спасибо, присаживайтесь.
-
Какой вывод можно сделать? (нерастворимые основания не изменяют окраску индикаторов)
В рабочем листе прочитайте определение реакции, которую мы посмотрели. (Реакция, в ходе которой доказывается наличие данного вещества или иона, называется качественной)
-
А как называются индикатор? (Вещество, с помощью которого доказывают присутствие другого вещества, называют реактивом на распознаваемое вещество).
Реактив может быть не только на одно вещество, но и на группу и целый класс веществ.
Уровень усвоения материала на данном этапе отметьте в карте успешности. Мы продолжаем наше путешествие.
ПЯТЫЙ ЭТАП ПУТЕШЕСТВИЯ
Следующий этап путешествия будет очень сложным. Но я думаю, вы с ним обязательно справитесь. Будьте внимательными.
Еще раз прочитайте название изучаемого сегодня класса неорганических соединений.
Из каких слов состоит название гидроксид? (гидроксиды = "гидра" (вода) + оксид)
Следовательно, каждому гидроксиду соответствует свой оксид.
И сейчас мы познакомимся с составлением формул оксидов, соответствующих данным гидроксидам.
В задании № 7 дан образец составления формул оксидов, соответствующих гидроксидам. Рассмотрите его и выполните задание на файловом планшете (приложение 3).
Задание № 7. Работаем в группах. По данному в таблице образцу, составьте формулы оксидов, соответствующие гидроксидам.
Основание
Оксид
NaОH
Na2O
Са(ОH)2
Fe (ОH)2
Al(ОH)3
Правило: степени окисления элемента в оксиде и соответствующем ему гидроксиде равны.
-
У кого возникли затруднения, поднимите руку. Я подойду и проконсультирую.
(Я вижу, что вы закончили задание, в целом большинство справились с заданием.)
Оцените работу в карте успешности. Отработку данного умения мы продолжим на следующем уроке.
V. Закрепление материала
ШЕСТОЙ ЭТАП ПУТЕШЕСТВИЯ
Наше путешествие подходит к концу. Заключительным его этапом будет игра «Третий лишний».
Работаем в группах. Игра «Третий лишний».
Задание № 8. В каждой строчке по три формулы. Найдите несоответствие и вычеркните «лишнюю» формулу. Объясните, почему вы решили, что он «лишний».
NaOH КОН HNO3
NaOH Zn(OH)2 KOH
Mg(OH)2Zn(OH)2 KOH
Проверим правильность выполнения задания. Назвать лишние формулы, объяснить, почему они «лишние». Молодцы! Вы успешно справились с заданием.
Оцените себя в карте успешности.
Вот и закончилось наше путешествие. Ребята, посмотрите на карту и путь, который мы прошли. Какую цифру он напоминает? (3)
-
Как, число «3» связано с темой нашего урока? (Основания состоят из трех элементов)
Вы успешно справились со всеми заданиями, значит, нашли клад.
Дорогой друг!
А теперь я открою тебе секрет: самый настоящий клад - это знания,
которые ты добыл сам!
VI. Домашнее задание и инструкция по его выполнению
Для закрепления полученных знаний вам необходимо выполнить домашнее задание, которое находится на последней странице рабочего листа. Найдите его. Задание состоит из двух частей: обязательного минимума и творческого задания. В каждой из частей вам достаточно выбрать одно задание. По желанию можно выбрать все. Прочитайте их, какие будут вопросы по заданию.
ВСЕМ: На «3» § 19, упр. 1, 2. На «4» § 19, упр. 3, 6. На «5» § 19, упр. 4, 5.
ТВОРЧЕСКОЕ ЗАДАНИЕ
1. Составить кроссворд по теме «Основания».
2. Минипроект «Значение оснований в жизни человека» (презентация, плакат).
VII. Подведение итогов
А сейчас вернемся к эпиграфу нашего урока: «Каждый успех наших знаний ставит больше проблем, чем решает». Прочитайте его еще раз (один ученик читает вслух).
Так в чем, используя опыт нашего путешествия, объясняется справедливость нашего высказывания. (Узнавая что-то новое, мы решаем проблему)
Каждый из вас, заполняя карту успешности (взять в руки) во время путешествия отметил свои успехи и то, что следует доработать и уточнить. Это поможет вам спланировать свою подготовку к следующему уроку.
VIII. Рефлексия
Завершая наш урок, откройте раздел «Мой урок» и отметьте знаком «+» или «-» на каждое утверждение, записанное в таблице. Ответьте на утверждение знаком "+" или "-" :
-
1. На уроке было над чем подумать.
2. Я понял новую тему.
3. На все возникшие у меня вопросы я получил ответы.
4. По новой теме мне необходима дополнительная консультация учителя.
5. На уроке я поработал добросовестно.
Сегодня мне очень понравилась ваша работа. Особенно хочу отметить …. Отметки за выполнение теста по проверке домашнего задания будут выставлены в журнал. В конце урока сдайте все свои работы.
Спасибо за урок !!!
Приложение
КАРТА УСПЕШНОСТИ
+ понял хорошо
? требуется доработка
ЗАДАНИЯ
+
?
1. Определение понятия
2. Названия оснований
3. Классификация оснований
4. Качественные реакции
5. Составление формул оксидов, соответствующих гидроксидам
6. Игра «Третий лишний»
ЗАДАНИЕ 7
Правило: степени окисления элемента в оксиде и соответствующем ему гидроксиде равны.
Основание
Оксид
NaОH
Na2O
Са(ОH)2
Fe (ОH)2
Al(ОH)3
РАБОЧИЙ ЛИСТ
Ученика(цы) 8 класса ______________________________________
Эпиграф: «Каждый успех наших знаний ставит больше проблем, чем решает».
Луи де Бройль.
Проверка домашнего задания.
2 ВАРИАНТ
Определите соответствие между формулой оксида и степенью окисления элемента в нем.
Формула вещества Степень окисления элемента
1. CO А) + 1
2. P2O5 Б) + 2
3. Н2O В) + 3
4. Mn2O7 Г) + 5
5. Cr2O3 Д) + 7
Критерии оценки:
Н ет ошибок - «5»;
ет ошибок - «5»;
1 ошибка - «4»; Ваша оценка
2 ошибки - «3»;
3 ошибки и больше - «2».
Дополнительное задание: запишите определение бинарные соединения.






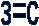
Тема урока _______________________________________
ПЕРВЫЙ ЭТАП ПУТЕШЕСТВИЯ
Задание № 2. Отметьте формулы бинарных соединений знаком «+».
А)
СO2
Ca (OH)2
К2O
NaCl
Н3РО4
NaОН
NH3
Fe2O3
H2SO4
HCl
Al(OH)3
HNO3
Б) Разделите оставшиеся формулы и запишите в таблицу под буквой Б.
Задание 3. Определите степени окисления элементов в гидроксильной группе. Запишите вывод, имеет ли она заряд.
Вывод: группа ОН - это __________________частица с зарядом _____.
Задание 4. Запишите определение основания.
Основания - это _____________________________________________
____________________________________________________________
ВТОРОЙ ЭТАП ПУТЕШЕСТВИЯ
Задание 5.
Запишите схему названия оснований.
+
+
ТРЕТИЙ ЭТАП ПУТЕШЕСТВИЯ
Задание 6: Составьте схему классификации оснований
Основания
Растворимые в воде основания, называются _________________.
ЧЕТВЕРТЫЙ ЭТАП ПУТЕШЕСТВИЯ
Вещества, изменяющие окраску в зависимости от среды, называются ______________________.
Реакция, в ходе которой доказывается наличие данного вещества или иона, называется качественной.
Вещество, с помощью которого доказывают присутствие другого вещества, называют реактивом на распознаваемое вещество.
ПЯТЫЙ ЭТАП ПУТЕШЕСТВИЯ
Задание № 7. Составьте формулы оксидов, соответствующие гидроксидам.
Основание
Оксид
Правило: степени окисления элемента в оксиде и соответствующем ему гидроксиде равны.
NaОH
Na2O
Са(ОH)2
Fe (ОH)2
Al(ОH)3
ШЕСТОЙ ЭТАП ПУТЕШЕСТВИЯ
Задание № 8. Игра «Третий лишний»:
Задание. В каждой строчке по три формулы. Найдите несоответствие и вычеркните «лишнюю» формулу. Объясните, почему вы решили, что он «лишний».
NaOH КОН HNO3
NaOH Zn(OH)2 KOH
Mg(OH)2Zn(OH)2 KOH
ДОМАШНЕЕ ЗАДАНИЕ
ВСЕМ:
На «3» § 19, упр. 1, 2.
На «4» § 19, упр. 3, 6.
На «5» § 19, упр. 4, 5.
ТВОРЧЕСКОЕ ЗАДАНИЕ
1. Составить кроссворд по теме.
2. Значение оснований в жизни.
«МОЙ УРОК»
Ответьте на утверждение знаком "+" или "-" :
1. На уроке было над чем подумать.
2. Я понял новую тему.
3. На все возникшие у меня вопросы я получил ответы.
4. По новой теме мне необходима дополнительная консультация учителя.
5. На уроке я поработал добросовестно.
Тема урока: " Многоликий углерод "(9 класс)
Трошина Галина Васильевна, учитель химии и биологии,
МКОУ «Жилетовская СОШ"
Методическая разработка урока по химии в 9 классе
по технологии развития критического мышления через чтение и письмо
Приёмы технологии развития критического мышления
-
маркировка текста по мере его чтения «ИНСЕРТ»;
«V» ----- информация, которая уже известна ученику.
«+» ----- новая информация.
«-« ------информация, которая идёт вразрез с представлениями ученика (думал иначе);
«?»------сведения, оставшиеся непонятными ученику, требующие дополнительной информации.Во время чтения текста необходимо попросить учащихся делать на полях пометки, а после прочтения текста заполнить таблицу, где значки станут заголовками граф таблицы. В таблицу кратко заносятся сведения из текста.
2) составление концептуальной таблицы(целесообразно использовать, когда требуется сравнить два и более объектов по нескольким параметрам, например при сравнении галогенов)
3) составление таблицы «тонких» и «толстых» вопросов - «тонкие» требуют однозначного, простого, фактического ответа, а «толстые» - дать сравнительную характеристику, отвечают на вопросы : почему, зачем, что произойдет, если.., сделайте прогноз и т.д.
4) составление кластеров - графический приём в систематизации материала. Правила очень простые. Рисуем модель солнечной системы: звезду, планеты и их спутники. В центре - звезда: это наша тема; вокруг неё - планеты, то есть крупные смысловые единицы, соединяем их прямой линией со звездой, у планеты - свои спутники, у спутников - свои. Кластеры помогают учащимся, если во время письменной работы запас мыслей исчерпывается. Система кластеров охватывает большее количество информации, чем вы бы могли получить при обычной письменной работе.
Приём «Составление кластера» может быть использован не только на этапе вызова (для стимулирования мыслительной деятельности учащихся), но и на этапе осмысления (для структурирования учебного материала) и на этапе рефлексии (при подведении итогов изучения материала). Составлять кластер можно в ходе как индивидуальной, так и групповой работы, как в классе, так и дома.
5) написание синквейна:
Первая строка - одно ключевое слово, определяющее содержание синквейна.
Вторая строка - два прилагательных, характеризующих данное понятие.
Третья срока - три глагола, показывающие действие понятия.
Четвёртая строка - короткое предложение, в котором автор кратко высказывает главную идею понятия.
Пятая строка - одно слово, обычно существительное, через которое человек выражает свои чувства, ассоциации связанные с данным понятием.
6) написание эссе. Смысл этого приёма можно выразить следующими словами: «Я пишу для того, чтобы понять, что я думаю». Это свободное изложение мыслей на заданную тему, в котором ценятся самостоятельность, проявление индивидуальности, дискуссионность, оригинальность решения проблемы и аргументации.
7) составление рассказов по ключевым словам (фразам);
8) анализ верных и неверных утверждений
9) составление таблицы «ЗХУ»
-
Знаю
Хочу узнать
Узнал
10) ведение записей «Двухчастный дневник»
-
Что понравилось, запомнилось?
Почему? Ассоциации.
11) «Бортовые журналы». Учащиеся во время изучения темы записывают свои мысли. Когда бортовой журнал применяется в самом простейшем варианте, перед чтением или иной формой изучения материала, учащиеся записывают ответы на следующие вопросы.
-
Что мне известно по данной теме?
Что нового я узнал из текста?
11) «Корзина идей, понятий»
Это приём позволяет выяснить, что знают или думают ученики по обсуждаемой теме урока. На доске можно нарисовать корзину, в которую будет собрано всё то, что учащиеся знают об изучаемой теме.
Каждый учащийся вспоминает и записывает в тетради всё, что знает по этой теме (индивидуальная работа, 1-2 мин), затем проводится обмен информацией в парах, группах, после чего каждая группа по очереди называет какой-то один факт, не повторяя ранее сказанного другими группами (составляется список идей). Учитель кратко, в виде тезисов заносит все сведения в корзину (без комментариев), даже если они ошибочны. В корзину идей можно помещать факты, мнения, имена, проблемы, понятия, имеющие отношение к теме урока. Далее в ходе урока эти разрозненные в сознании учащихся сведения, проблемы или понятия будут связаны в логические цепи, а ошибки исправлены по мере освоения новой информации.
12) «Взаимоопрос»
Двое учащихся читают текст, останавливаясь после каждого абзаца, и по очереди задают друг другу вопросы по прочитанному материалу. Важно, чтобы эти вопросы были не поверхностными, а затрагивающими суть новой информации. Когда вся информация, имеющаяся в абзаце, обсуждена досконально, учащиеся переходят к следующему абзацу.
Этот приём позволяет достигать высокого уровня учебной мотивации, внимания, глубокого понимания материала и хороших результатов обучения.
13) «Перекрёстная дискуссия»
Учитель заранее продумывает один бинарный (требующий либо положительного, либо отрицательного ответа) вопрос, который являлся бы центральным для текста, затем предлагает разделиться на пары и начертить в тетради таблицу из двух колонок с вопросом в центре. В левой колонке - соображения в поддержку отрицательного, а в правой - в поддержку положительного ответа на поставленный вопрос. После того как оба списка аргументов готовы, пары объединяются в четвёрки и обсуждают свои наработки. Далее учитель предлагает учащимся, которые склоняются к положительному ответу, перейти в один конец классной комнаты, а тех, кто склоняется к отрицательному ответу, - в другой. Те же, кто занял промежуточную позицию, могут занять места посередине. Группам предоставляется 10 мин на обсуждение аргументов, затем начинает высказываться одна сторона, другая при этом возражает. Потом стороны меняются ролями.
Рекомендации по проведению дискуссии:
-
В каждой группе право высказываться имеет каждый.
-
Прежде чем говорить, следует внимательно выслушать мнение оппонента из противоположного лагеря. В случае необходимости можно даже ввести правила повторить сказанное оппонентом, прежде чем возражать.
-
Если кого-то из участников дискуссии удалось переубедить, он может перейти в другой конец комнаты.
Каждые 15 мин необходимо делать короткий перерыв для записи наиболее убедительных доводов обеих сторон. В заключение учитель обобщает прозвучавшие в прениях доводы.
Перекрёстная дискуссия демонстрирует учащимся пример культурного спора, даёт повод поработать над соорганизацией в группе, позволяет чётко и динамично организовать обсуждение проблемы, является хорошим фактором мотивации учащихся на дальнейшую разработку вопроса.
14) «Зигзаг - 1»
Приём используют для активизации познавательной деятельности учащихся. Учитель предварительно разбивает текст на смысловые отрывки для взаимообучения. Количество отрывков должно совпадать с числом членов групп. Весь класс делится на экспертные группы, которые изучают текст своего смыслового отрывка и готовят его презентацию (партнёры-эксперты читают и изучают свой материал сообща, планируют эффективные способы его преподнесения).
Затем формируются группы для взаимообучения, в которых эксперты по очереди знакомят всех участников с изученным материалом. Задача группы состоит в том, чтобы каждый овладел всей темой целиком. Отдельным членам группы можно предложить продемонстрировать свои знания самыми разными способами (написать письменную проверочную работу, ответить устно на ряд вопросов, дать презентацию материала и т. д.). Сущность приема : «экспертные группы» → «рабочие группы»
«Зигзаг - 2»
Целью данного приема является изучение и систематизация большого по объему материала. Для этого предстоит сначала разбить текст на смысловые отрывки для взаимообучения. Количество отрывков должно совпадать с количеством членов групп. Например, если текст разбит на 5 смысловых отрывков, то в группах (назовем их условно рабочими) - 5 человек.
1. В данной стратегии может не быть фазы вызова как таковой, так как само задание - организация работы с текстом большого объема - само по себе служит вызовом.
2. Смысловая стадия. Класс делится на группы. Группе выдаются тексты различного содержания. Каждый учащийся работает со своим текстом: выделяя главное, либо составляет опорный конспект, либо использует одну из графических форм (например "кластер"). По окончании работы учащиеся переходят в другие группы - группы экспертов.
3.Стадия размышления: работа в группе "экспертов". Новые группы составляются так, чтобы в каждой оказались «специалисты» по одной теме. В процессе обмена результатами своей работы, составляется общая презентационная схема рассказа по теме. Решается вопрос о том, кто будет проводить итоговую презентацию. Затем учащиеся пересаживаются в свои первоначальные группы. Вернувшись в свою рабочую группу, эксперт знакомит других членов группы со своей темой, пользуясь общей презентационной схемой. В группе происходит обмен информацией всех участников рабочей группы. Таким образом, в каждой рабочей группе, благодаря работе экспертов, складывается общее представление по изучаемой теме.
4. Следующим этапом станет презентация сведений по отдельным темам, которую проводит один из экспертов, другие вносят дополнения, отвечают на вопросы. Таким образом, идет "второе слушание" темы.
Итогом урока может стать исследовательское или творческое задание по изученной теме.
Сущность приема: «рабочие группы» → «экспертные группы»→ «рабочие группы» → «экспертные группы»
Этот прием применяется и на текстах меньшего объема. В этом случае текст изучается всеми учениками, принцип деления на группы - вопросы к данному тексту, их количество должно совпадать с количеством участников группы. В экспертные группы собираются специалисты по одному вопросу: для более детального его изучения, обмена мнениями, подготовки подробного ответа на вопрос, обсуждения формы его представления. Вернувшись в рабочие группы, эксперты последовательно представляют варианты ответов на свои вопрос.
15) «Учебный мозговой штурм»
Используется для развития креативности мышления учащихся, их коммуникативных качеств. Штурм проводится в группах численностью 7-9 человек. В каждой группе выбирают ведущего, следящего за выполнением правил, направляющего деятельность школьников, а также секретаря, фиксирующего предложенные идеи на отдельном листе ватмана.
В процессе проведения мозгового штурма выделяют три этапа.
-
Создание банка идей. Учащиеся стараются предложить максимальное количество вариантов решения (на этом этапе критика не допускается).
-
Анализ идей. Все высказанные идеи группа рассматривает критически, стараясь найти в каждой рациональное зерно.
-
Обработка результатов. Учащиеся отбирают от двух до пяти наиболее интересных решений, готовят на их основе проект ответа.
По окончании мозгового штурма учащиеся защищают и обсуждают предложенные проекты.
16) «Шесть шляп критического мышления»
- «Белая шляпа»- статистическая (констатируются факты без их обсуждения).
- «Желтая шляпа» - положительная (высказываются положительные моменты).
- «Черная шляпа» - негативная (высказываются отрицательные моменты).
- «Синяя шляпа» - аналитическая (проводится анализ, группа отвечает на вопросы: почему? зачем?).
- «Зеленая шляпа» - творческая (можно высказывать самые «бредовые идеи и предложения»).
- «Красная шляпа» - эмоциональная (группа формулирует эмоции, испытанные при работе с материалом).
Урок " Многоликий углерод"
Цель урока: изучение особенностей углерода как химического элемента и простого вещества.
Задачи:
- образовательные - повторить строение атома, формировать научные представления о строении, свойствах и применении алмаза, графита, карбина, фуллерена; характеризовать физические и химические свойства углерода;
- развивающие - развивать логическое, критическое мышления, умения сравнивать, выделять главное, устанавливать причинно-следственные связи;
- воспитательные - воспитывать желание активно, с интересом учиться; способствовать формированию основных компетенций личности; прививать навыки общения.
Девиз урока: «Собраться вместе - это начало.
Держаться вместе - это прогресс.
Работать вместе - это успех»
Генри Форд
Тип урока: изучение нового материала.
Технология: развития критического мышления через чтение и письмо
Оборудование и реактивы:
- на столах уч-ся: активированный уголь, раствор чернил, пробирки.
- на демонстрационном столе: модели кристаллических решеток алмаза, графита, противогаз, футбольный мяч, цепь металлическая, шкала твердости Мооса, периодическая система химических элементов Д.И.Менделеева, ПК, мультимедиаоборудование, презентация к уроку, пластилин и соединительные элементы для шаростержневых моделей.
Схема урока
-
Актуализация знаний - переход к изучению нового материала
-
Стадия Вызова
- запись темы урока «Многоликий углерод»
- углерод - химический элемент (период, группа, подгруппа, строение атома, валентные возможности, степень окисления)
- углерод - простое вещество (аллотропия, физические, химические свойства, применение)
* используется стратегия «ЗХУ»
Знаю
Хочу узнать
Узнал
Индивидуальная работа «я сам» → работа в парах постоянного состава «мы вместе» → предъявление знаний «коллективный рассказ»
3.Стадия Осмысления
Изучение аллотропных модификаций углерода
*используется стратегия «зигзаг».
Создаются 4 рабочие группы, в которых каждый ученик получает индивидуальное задание изучить строение, свойства, применение одной модификации. По ходу изучения учащиеся составляют кластер. Затем все учащиеся с одним и тем же вопросом пересаживаются в экспертные группы, ведется обсуждение в группе, корректировка кластера. После этого возврат в первоначальные рабочие группы. Идет взаимообучение, начиная с ученика №1.Он объясняет всей группе свой вопрос, все слушают и делают краткие, схематичные записи.
4.Стадия Рефлексия
- коллетивный рассказ об аллотропных модификациях с использованием презентации;
- коррертировка кластеров;
-выполнение лабораторного опыта «Адсорбционные свойства активированного угля»
5.Стадия Вызова (подведение к изучению химических свойств)
6. Стадия Осмысления
Изучение химических свойств углерода
*объяснение учителя с применением фронтальной беседы с классом
Запись уравнений реакций учащимися на доске и рассматривание их с точки зрения окислительных и восстановительных свойств углерода.
7. Стадия Рефлексия
* Возврат к стадии Вызова - заполнение в таблице графы «Узнал» по цепочке.
* выполнение самостоятельной работы по вариантам:
1 задание - рассмотрите окислительно-восстановительный процесс (1уравнение)
2 задание - составьте синквейн по ключевым словам на выбор.
8.Домашнее задание.
9. Подведение итогов.
Конспект урока
Деятельность учителя
Деятельность учащихся
-
Актуализация знаний
1.1 Переход к изучению новой темы
*Какую группу химических элементов мы еще не изучали?
Золотая середина - именно так называют эту группу.
Чтение загадки
В чистом виде черный, неплавкий и едва горит,
Бывает, как кристалл прозрачен
В котором блещет солнца луч.
Тот элемент в печной трубе
Находим в виде сажи,
И в простом карандаше
Его встречаем даже.
-
*Как вы думаете, о чем пойдет у нас сегодня разговор?
Итак, как мы назовем тему урока?
Запись темы урока «Многоликий углерод» Сл.№1
Углерод - это особый химический
элемент, известен с древнейших времен. Его элементарная природа была установлена А Лавуазье в XVIII веке. Особенностью атомов углерода является их способность соединяться между собой, образуя длинные цепи.
(демонстрация цепей)
Углерод - рождающий уголь - играет особую роль в природе. Сл.№2
Все живые организмы без исключения построены из углерода. Поэтому можно сказать, что углерод является биогенным элементом.
Перед началом урока соединить 8 столов по 2 для работы четырех групп.
Ответы учащихся
Эмоциональный настрой
Ответы учащихся
Запись темы урока «Многоликий углерод»
-
Стадия Вызова - 1
-
Уч-ся предлагается подумать над вопросами:
-
-углерод - химический элемент
- углерод - простое вещество
2.2 Что вы знаете по этим вопросам и что еще хотели бы узнать?
(стратегия ЗХУ) Сл. №3
Учитель все записывает кратко на
доске: верные и неверные суждения
2.3 Учитель побуждает к предъявлению знаний: Сл.№4
-номер периода, группа, подгруппа
-строение атома
-электронная формула
-конфигурация наружного слоя
-валентные возможности углерода
-возможные степени окисления
2.4 По какому плану мы изучаем простое вещество?
2.5 Давайте вспомним, что такое аллотропия?
2.6.Какие аллотропные модификации образует атом углерода? Сл.№5
Уч-ся в тетради чертят таблицу из 3 колонок
Знаю
Хочу узнать
Узнал
Самостоятельно заполняют первые две графы, затем обсуждают в парах постоянного состава и после этого высказывание своих мнений вслух по 1 ученику от пары по цепочке.
Коллективно составляется характеристика углерода - как химического элемента.
Уч-ся записывают в тетради
Строение, свойства, применение
Ответы учащихся
3. Стадия Осмысления - 1
Стратегия «зигзаг»
Поможет нам ответить на вопросы чтение параграфа 29 и дополнительной информации (уч-ль раздает листы)
3.1 Предлагается изучить информацию и составить краткий конспект в виде кластера по плану:
-особенности строения
- свойства
- применение
Предлагается попробовать смоделировать строение аллотропной модификации.
Наблюдение за работой групп.
Оказание помощи по мере необходимости.
3.2 Динамическая, активная физкультминутка
- индивидуальная работа с текстом в рабочей группе, составление кластера;
- групповая работа с текстом в экспертной группе, корректировка кластеров;
- уч-ся моделируют модели аллотропных модификаций углерода из пластилина и спичек;
- возврат в первоначальные рабочие группы, объяснение изученного материала друг другу (взаимообучение);
- возврат в экспертные группы и подготовка к ответам от группы;
- уч-ся выполняют упражнения.
4.Стадия Рефлексия - 1
4.1 Побуждение к коллективному рассказу об аллотропных модификациях углерода Слайды №6,7,8
4.2 Показ слайдов презентации
4.3 Корректировка кластеров
Сл.№9,10
4.4 Явление адсорбции - способность поглощать пористой поверхностью растворы и газы.
Рассказ об открытии адсорбции Ловицем, о применении этого явления для очистки сахара на рафинадных заводах, для очистки спирта от вредных веществ, для медицинских целей.
Н.Д. Зелинский на основе адсорбционных свойств древесного угля разработал фильтрующий противогаз (демонстрация противогаза)
4.5 Инструктаж по технике безопасности.
Инструкция выполнения работы.
Сл.№11,12
Сл.№13,14
Озвучивание кластеров по аллотропным модификациям:
- алмаз:
-строение (с дем. модели);
-свойства , применение
- графит:
- строение (с дем. модели);
- свойства,применение
- аморфный углерод
Уч-ся находят в тексте учебника о значении открытия противогаза
Выполнение лабораторного опыта «Адсорбционные свойства активированного угля»
- карбин:
- строение (с дем. модели)
- свойства, применение
- фуллерен:
- строение (с дем. модели)
- свойства, применение
5.Стадия Вызова -2
Какие химические свойства может проявлять углерод исходя из его строения?
- восстановительные свойства;
- окислительные
6. Стадия Осмысления -2
6.1 Объяснение учителя с использованием фронтальной беседы. Сл.№15
Запись уравнений реакций на доске и рассматривание их с точки зрения ОВР
6.2 Физкультминутка для глаз
Запись уравнений, рассматривание их с точки зрения ОВР, нахождение окислителя и восстановителя
1.Взаимодействие с простыми веществами:
а) с металлами с образованием карбидов
3C + 4 Al = Al4C3
б) с неметаллами
C + O2 = CO2↑
изб.
2C + O2 = 2CO↑
недост.
2.Взаимодействие со сложными веществами:
а) с оксидами металлов
C + 2CuO = 2Cu + CO2↑
б) с конц. серной и азотной кислотами
C + 2H2SO4 = CO2↑ + 2SO2↑ + 2H2O
Соединения углерода с водородом прямым взаимодействием получить нельзя, их получают при действии воды на карбиды:
Например ацетилен получают из карбида кальция
CaC2 + 2 H2O = C2H2 + Ca(OH)2
Уч-ся выполняют упражнения
7.Стадия Рефлексия -2
7.1 Возврат к первоначальной стадии вызова (ЗХУ)
Уч-ся предлагается заполнить 3-ю графу таблицы. Сл.№3
7.2. Самостоятельная работа по 5вариантам ( разноуровневая): Сл.№16
1задание. Рассмотрите окислительно-восстановительный процесс, определите, какие свойства проявляет углерод (1уравнение)
2задание. Составьте синквейн по ключевым словам на выбор: фуллерен, алмаз, графит, карбин, углерод.
Уч-ся записывают в таблицу то, что они узнали в 3-ю графу, затем предъявление своих знаний по цепочке.
Выполнение самостоятельной работы по 5 вариантам (дополнительно раздается задание на листах)
8. Домашнее задание. Сл.№17
Комментирует, следит за записью в дневник.
Предлагает подумать над высказыванием Л.Н.Толстого. Сл.№18
Раздает высказывание на листочках.
Запись домашнего задания.
1ур.(мин.) -§29 + конспект
2ур.(общ.) - 1 + кластер по применению углерода
3ур.(продв.) - 1+2+ упр. №6
Подумайте над высказыванием Л.Н.Толстого: «Каждый человек - алмаз, который может очистить и не очистить себя. В той мере, в которой он очищен, через него светит вечный свет. Стало быть, дело человека - не стараться светить, а стараться очищать себя»
9.Подведение итогов
Подводит итог работы на уроке, комментирует отметки.
Обращает внимание на название темы урока, девиза урока и подводит к вопросам, которые следует изучить на следующем уроке. Сл.№19
Благодарит за сотрудничество.
Высказывают свои точки зрения по поводу темы и девиза.
Приложение №1 к уроку «Многоликий углерод»
Методические материалы для рабочих групп
Группа №1 Алмаз
Кристаллическая решетка алмаза атомная, тетраэдрическая. Расстояния между атомами одинаковые, ковалентные неполярные связи направлены к вершинам правильного тетраэдра.
Существуют разновидности кристаллических решёток алмаза:
гексагональный алмаз, или лонгсдейлит
(рис. 1) и кубический алмаз (рис. 2).
Историческая справка: Слово «алмаз» происходит от арабского «алмас» - «твердейший», или от греческого «адамас» - «несокрушимый, непреодолимый», что не вполне точно. Сокрушить алмаз можно ударом о какой-нибудь твердый предмет или сжиганием.
Однако в древности думали иначе. Лукреций Кар и Плиний считали, что алмаз не только не горит, но его нельзя расколоть ударом молота.
В легенде о Прометее рассказывается, что похититель огня был прикован к скалам алмазными цепями. В другом известном мифе говорится об алмазном шлеме Геракла.
Интересно, что и в средние века это заблуждение сохранилось.
Почему же это ошибочное мнение держалось так долго? Дело не только в том, что наука тогда была недостаточно развита, но и в том что алмазы ценились очень высоко, добыча их стоила большого труда и пожертвовать алмаз на исследование желающих было мало. Алмаз впервые был сожжен в 1694 году при помощи большого зажигательного стекла. Алмаз, помещенный в фокус этого стекла, тлел, как раскаленный докрасна уголь. В 1814 году английские ученые Дэви и Фарадей также при помощи зажигательного стекла сожгли алмаз в кислороде. Алмаз при этом загорался и продолжал гореть спокойным ослепительным пламенем, даже будучи удален из фокуса зажигательного стекла. При этом единственным продуктом сгорания был углекислый газ.
Это было доказательством того, что алмаз является аллотропным видоизменением углерода
Физические свойства
-
Одно из самых твёрдых и тугоплавких веществ, по шкале Мооса алмазу присвоен самый наивысший балл - 10.
-
Хрупок - довольно легко расколоть на части.
-
Очень высокая теплопроводность - проводит тепло в несколько раз лучше, чем многие металлы (в 4 раза лучше меди). Исключительно высокая теплопроводность алмаза делает его перспективным материалом для полупроводниковой техники в качестве подложек для процессоров.
Не проводит электрический ток. Алмазы имеют разный цвет.
-
Известны алмазы оранжевого, голубого, розового, жёлтого, коричневого, молочно-белого, синего, зелёного, серого и даже чёрного цвета. Окраска связана с дефектами
в кристаллической решётке и замещением части атомов углерода на атомы бора, азота и даже алюминия. Серая и чёрная окраска алмазов обусловлена включениями графита.
Алмаз, благодаря исключительной твердости, незаменимый абразивный материал. Алмазным напылением обладают шлифовальные насадки бормашин.
Кроме этого, ограненные алмазы - бриллианты используются в качестве драгоценных камней в ювелирных украшениях. Массу алмазов измеряют в каратах. 1 карат = 0,2 г.
Историческая справка: А что такое «карат»? В аравийской пустыне растет дерево Caratiiia silikva (каратииа силиква), косточка плодов которого (их также называют царьградскими рожками) весит ровно 0,2 г. Этот точный вес косточки имеют всегда: в любой год и на любом дереве. Поэтому ювелиры древности и применяли для своих весов такие гирьки. Кстати, в некоторых странах проба золота выражается также в каратах: она показывает, сколько каратов (т.е. 0,2 г) золота содержится в 24 каратах сплава.
Искусственно ограненные алмазы называются бриллиантами и являются предметом роскоши. В России бриллиантовый бум пришелся на правление Екатерины II.
Бриллианты украшают короны бывшей Российской Империи, орден святого Андрея Первозванного.
Большая императорская корона сделана к коронации императрицы Екатерины II.
Несмотря на свой большой вес (около 2 кг) корона производит впечатление очень легкого изделия. Общее количество бриллиантов на короне - 4936 штук, весом 2858 каратов.
Скипетр императорский. Его первоначальный вес составлял около 300 каратов. По велению шаха Джахана камень был перегранен, после чего он получил форму современного «Орлова» и вес 189,62 карата. Алмаз «Орлов» является одним из семи исторических камней Алмазного фонда РФ. Согласно легенде этот алмаз вместе с другим, ему подобным, был глазом идола в Серингане, откуда он был выкраден французским солдатом в начале XVIII века.
Затем алмаз был у шаха Надира, после смерти которого был вторично выкраден и наконец куплен графом Г.Г.Орловым у армянского купца Лазарева за 400 тысяч рублей.
Благодаря редкости, высоким декоративным качествам и стечению исторических обстоятельств, бриллиант неизменно является самым дорогим драгоценным камнем. Но относительно высокая цена (около 50 долларов/грамм) и сложность обработки алмаза ограничивают его применение в этой области.
Применение основано на физических свойствах
-
Изготовление бриллиантов - огранённые алмазы сильно преломляют свет.
-
Для резки стекла, металлов, наконечники свёрл («алмазные жала»), буров и резцов - благодаря твёрдости.
-
Алмазный порошок - для полировки и огранки драгоценных камней (рубинов) - твёрдость.

Группа №2 Графит
Графит имеет слоистую структуру. В кристаллической решетке графита атомы углерода, лежащие в одной плоскости, прочно связаны в правильные шестиугольники.
Расстояния между слоями большие, и непрочные связи между слоями приводят к тому, что графит мягок и расслаивается.
А как же все-таки доказать, что алмаз и графит являются аллотропными модификациями углерода?
(Взаимопревращаемость: алмаз при 10000С, без доступа воздуха превращается в графит, а при 1200-16000С, давлении - 104 МПА, в присутствии катализатора из графита получают искусственные алмазы).
Физические свойства
-
Мягкое вещество серого цвета, малая механическая прочность (неравноценные по прочности связи).
-
Электропроводен и имеет металлический блеск (электроны блуждают, как у металлов).
-
Вещество, жирное на ощупь.
-
Теплопроводность в направлении плоскости слоёв больше, чем в перпендикулярном направлении.
-
Электрическое сопротивление в направлении слоёв меньше, чем в перпендикулярном направлении: наблюдается анизотропия (зависимость свойств вещества от направления)
ПРИМЕНЕНИЕ ГРАФИТА
Графитовый порошок - изготовление минеральных красок.
-
Смазочный материал (в смеси с маслом) - между отдельными слоями графита взаимодействие настолько слабо, что возникает скольжение. Чешуйки графита, заполняя неровности поверхности, создают гладкую поверхность.
-
Графитовые стержни - электроды - электропроводность.
-
Тигли, блоки для атомных реакторов - тугоплавкость.
-
Теплозащитный материал для головных частей ракет - термостойкость.
-
Получение карбидов - легко реагирует с металлами
Материалы на основе графита:
-
Графлекс или пенографит - высокопористый материал, заменяет резину и металл.
-
Стеклоуглерод - химически стоек, заменяет платиновую химическую посуду.
-
Пирографит - для изготовления искусственных клапанов сердца.
-
Углеродное волокно - как наполнитель в пластике, для придания большей прочности и электропроводности, лёгкие эластичные электронагреватели.
-
На рисунке: углеродная ткань и углеродное волокно, стаканчик из стеклоуглерода

* Карандаши
Первые графитовые карандаши появились
в XVIII веке. Это было связано с открытием графитового месторождения в Камберленде (Англия).
-
В 1795 г. в Париже по способу Конта изготавливались карандаши из смеси графита и глины, обожжённые в печи. Эта технология используется и по сей день. Чем больше глины - тем твёрже карандаш. В особые мягкие карандаши добавляют воск и сало - ими можно писать на стекле. Особый сорт рыхлых карандашей служит для пастельной живописи.
Группа №3 Карбин
Карбин- линейный полимер углерода с атомной кристаллической решеткой. Это вещество впервые получено в 1975г советскими химиками В.В.Коршаком, А.М.Сладковым, В.И.Касаточкиным и Ю.П.Кудрявцевым в начале 60-х гг. в Институте элементоорганических соединений Академии наук СССР
СТРОЕНИЕ КАРБИНА
-
Карбин состоит из длинных цепочек атомов углерода, уложенных параллельно друг другу.
-
Карбин - линейный полимер углерода.
-
Цепочки могут иметь полииновое строение: -Сº С-Сº С- (карбин)
или поликумуленовое:=С=С=С=С= (поликумулен).
ПРИМЕНЕНИЕ КАРБИНА
Под воздействием света проводимость карбина сильно увеличивается. На этом свойстве основано его первое практическое применение -
в фотоэлементах. Карбин не утрачивает фотопроводимости при температуре до 500°C; это намного больше, чем у других материалов того же назначения.
КАРБИН В ПРИРОДЕ
В 1970 г. геофизики из Института Карнеги обнаружили в метеоритном кратере Рис на территории ФРГ новый минерал, состоящий на 99,99% из углерода. Но это, определенно, не были ни алмаз, ни графит. Исследования показали, что минерал из кратера Рис, скорее всего, представляет собой природную разновидность синтезированного несколькими годами раньше карбина.
Карбин встречается в природе в виде минерала чаоита (белые прожилки и вкрапления в графите) и получен искусственно.
Карбин обладает полупроводниковыми свойствами, причём под воздействием света его проводимость сильно увеличивается. На этом свойстве основано первое практическое применение- в фотоэлементах.

Карбин представляет собой порошок глубокого черного цвета с вкраплением более крупных частиц.
Оказалось, что карбин - самая термодинамически устойчивая форма элементарного углерода. В тех условиях, при которых графит переходит в алмаз за 30 минут, карбин не изменяется и после 15 часов выдержки. Пока еще карбин не нашел такого же широкого применения, как его собратья, но несомненно, что у него большое будущее.
Группа №4 Фуллерены
Получены молекулы углерода состава С60, С70, С36. Фуллерен - форма молекулярная, т.е. минимальный элемент ее структуры не атом, а молекула, представляющая собой замкнутую поверхность в форме сферы.
Фуллерены - аллотропная модификация углерода - были открыты в 1985 году учеными Ричардом Смолли и Робертом Керлом (США) и Гарольдом Крото (Великобритания). За это открытие в 1996 году они были награждены Нобелевской премией
.
Историческая справка:
-
В 1973 году отечественные учёные Бочвар и Гальперн рассчитали теоретически, что должна существовать форма углерода, содержащая 60 атомов углерода. Они предложили форму такой гипотетической молекулы.
-
Их выводы оказались совершенно фантастическими, а работа опередила свое время и была попросту забыта.
-
Нобелевскую премию за открытие фуллерена в 1996 году получили американские учёные Крото, Смолли и Керл. Они выяснили, что в спектрах звезд имеются молекулы С60 и С70 и предложили структуру, которая являлась точным повторением предложенной 12 лет назад Бочваром.
Первооткрыватели назвали новую модификацию углерода фуллереном в честь американского архитектора Ричарда Бакминстера Фуллера, который разработал конструкцию куполообразной крыши из пяти- и шестиугольников наподобие футбольного мяча («геодезический купол»).
Молекулы фуллеренов построены из четного числа атомов углерода. Молекула наименьшего из фуллеренов состоит из 20 атомов, тогда как наибольший синтезированный на сегодняшний день фуллерен состоит из 960 атомов углерода. Наиболее распространенная разновидность, состоящая из 60 атомов углерода, известна как букибол. Молекулы фуллеренов имеют разнообразную форму, подобную, например, футбольному мячу или трубке. Ренгеноструктурные исследования показали, что частицы С60, С70 - полые, причем С60 - это идеальные полые сферы, а С70 по форме напоминает дынеобразный мяч для регби.
Они мягкие и скользкие на ощупь подобно графиту. Следы фуллеренов можно обнаружить в местах удара молний. Молекулы фуллеренов С60 и С70 были выделены из очень редкого минерала шунгита, встречающегося в Сибири. Скальные породы, содержащие шунгит, образовались по меньшей мере 600 миллионов лет назад.
Свойства
-
Кристаллические вещества чёрного цвета с металлическим блеском.
-
Полупроводники.
-
При высоком давлении и комнатной температуре легко превращаются
в алмаз. -
Хорошо растворимы в органических растворителях - это свойство используют для отделения фуллеренов от сажи
Фуллерены легко растворяются в бензоле с образованием красного раствора 
Применение
-
Получение полимерных материалов
и металлофуллеренов. -
Фторированные фуллерены используют как катоды в гальванических элементах.
-
Запоминающие устройства
-
Красители.
-
Электронные и оптические устройства
-
Фотоматериалы и материалы для преобразования электрической энергии в световую
-
Устройства для аккумулирования газов
-
Сверхпроводники
-
Органические магниты
-
Ученые Санкт-Петербурга на основе фуллерена получили антивирусный препарат более эффективный, чем ремантадин, традиционно используемый против вируса гриппа. Новый препарат действует на вирус А и В Лекарства с противоопухолевой активностью
-
Лекарства с противоопухолевой активностью
Фуллерены - молекулы будущего
Нанотрубки из углерода являются сверхпроводниками. Изучение этих интересных объектов только начинается
Однослойные нанотрубки
-
Пористый материал в фильтрах
-
Электрод для электролитических конденсаторов
-
Покрытие для алмазной пленки
-
В электросхемах
Приложение № 2 к уроку «Многоликий углерод»
Самостоятельная работа (2уровень) Вариант №1
Задание №1 Рассмотрите окислительно-восстановительный процесс и определите, какие свойства проявляет углерод
C + Fe2O3 → Fe + CO2 ↑
Задание №2. Составьте синквейн по ключевым словам на выбор:
фуллерен, алмаз, графит, карбин, углерод
Самостоятельная работа (3уровень) Вариант №2
Задание №1 Рассмотрите окислительно-восстановительный процесс и определите, какие свойства проявляет углерод
C + HNO3 → CO2↑ + NO2↑ + H2O
конц.
Задание №2. Составьте синквейн по ключевым словам на выбор:
фуллерен, алмаз, графит, карбин, углерод.
Самостоятельная работа (2уровень) Вариант №3
Задание №1. Рассмотрите окислительно-восстановительный процесс и определите, какие свойства проявляет углерод
C + SnO2 → Sn + CO2↑
Задание №2. Составьте синквейн по ключевым словам на выбор:
фуллерен, алмаз, графит, карбин, углерод.
Самостоятельная работа (2уровень) Вариант №4
Задание №1. Рассмотрите окислительно-восстановительный процесс и определите, какие свойства проявляет углерод
C + S → CS2
Задание №2. Составьте синквейн по ключевым словам на выбор:
фуллерен, алмаз, графит, карбин, углерод.
Самостоятельная работа (1уровень) Вариант №5
Задание №1. Дополните предложение
1.Углерод находится в …. периоде, …….группе, ………подгруппе.
2. Углерод может проявлять ……и ……. свойства.
3. Элемент углерод образует … аллотропных модификации.
4.Способность поглощать своей поверхностью газы и жидкости……………
5. Масса алмазов измеряется в …………
Задание №2. Составьте синквейн по ключевым словам на выбор:
фуллерен, алмаз, графит, карбин, углерод.

Наука - самое важное, самое прекрасное и нужное в жизни человека, она всегда была и будет высшим проявлением любви, только ею одною человек победит природу и себя.
Национальной науки нет, как нет национальной таблицы умножения.
( Антон Павлович Чехов)
Химия - это область чудес, в ней скрыто счастье человечества, величайшие завоевания разума будут сделаны именно в этой области. (М. Горький).
Химик - это лицо физическое. (Георгий Александров).
Кто не понимает ничего, кроме химии, тот и ее понимает недостаточно.



