- Преподавателю
- Химия
- Практикум по подготовке к ЕГЭ по химии
Практикум по подготовке к ЕГЭ по химии
| Раздел | Химия |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Караваева М.Е. |
| Дата | 16.05.2015 |
| Формат | docx |
| Изображения | Есть |
5
Караваева М.Е.
 Некоторые вопросы химии в рамках подготовки к ЕГЭ
Некоторые вопросы химии в рамках подготовки к ЕГЭ
I. Решение задач на получение солей различного типа
Задачи на получение солей, тип которых изначально неопределен, представляет трудность для большинства школьников. Я предлагаю свои наработки по данному вопросу.
Одними из самых проблемных задач являются задачи на получение кислых солей или смеси кислых и средних солей.
Пример №1 Определите массу продуктов реакции, образовавшихся при сливании 100г 9,8% раствора ортофосфорной кислоты и 100г 10% раствора гидроксида натрия.
Проблема состоит в том, что сначала необходимо определить типы образующихся солей. Для этого я сначала записываю (а в дальнейшем просто использую эти записи) все реакции взаимодействия щёлочи с ортофосфорной кислотой.
1)
NaOH
+
H3PO4
=
NaH2PO4
+
H2O
смесь
NaH2PO4иNa2HPO4
1
:
1
2)
2
NaOH
+
H3PO4
=
Na2HPO4
+
2
H2O
2
:
1
смесь
Na2HPO4 и
Na 3PO4
3)
3
NaOH
+
H3PO4
=
Na 3PO4
+
3
H2O
3
:
1
По - первой реакции, когда n(NaOH) : n(H3PO4 )= 1:1, образуется только NaH2PO4 (дигидрофосфат). По - второй реакции, когда n(NaOH) : n(H3PO4 )= 2:1, образуется только Na2HPO4 (гидрофосфат). По - третьей реакции, когда n(NaOH) : n(H3PO4 )= 3:1, образуется только Na3PO4 (фосфат).
Какие соли образуются, если n(NaOH) не принадлежат числам 1,2,3, а имеют промежуточные значения? Частое решение подобных задач позволило мне сделать следующие выводы: Если n(NaOH)≤ 1, то при взаимодействии с H3PO4 (избытком) образуется только дигидрофосфат натрия. Если n(NaOH) лежит в границах 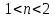 (n ≠ 1,2), то образуется смесь солей: дигидрофосфат и гидрофосфат натрия. Если n(NaOH) лежит в границах
(n ≠ 1,2), то образуется смесь солей: дигидрофосфат и гидрофосфат натрия. Если n(NaOH) лежит в границах 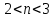 (n ≠ 2,3), то образуется смесь солей: гидрофосфат и фосфат натрия. Если n(NaOH)≥ 3, то образуется только фосфат натрия.
(n ≠ 2,3), то образуется смесь солей: гидрофосфат и фосфат натрия. Если n(NaOH)≥ 3, то образуется только фосфат натрия.
Тогда опираясь на данные рассуждения решить задачу можно следующим образом: 1) определяем массу (H3PO4): m(H3PO4) =100г*0,098=9,8г 2) определяем количество вещества (H3PO4 ): n(H3PO4) = 9,8г /98г/моль = 0,1 моль 3) определяем массу (NaOH ): n(NaOH) :n(Na3PO4 ) (NaOH) = 100г*0.1= 10г 4) определяем количество вещества (NaOH ): n(NaOH) = 10г /40г/моль = 0,25 моль 5) определяем соотношения n(NaOH) и n(H3PO4) : n(NaOH) : n(H3PO4) = 0,25 : 0,1 =2,5:1 =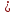 значение n(NaOH) лежит в границах
значение n(NaOH) лежит в границах 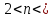 3, следовательно одновременно образуется смесь солей: гидрофосфат и фосфат натрия . 6) Предположим, что мы приливаем щелочь в кислоту. Тогда по реакции №2 рассчитываем количество вещества (Na2HPO4 ): n(NaOH) : n(H3PO4) = 2 :1=0,25:0, 1 =
3, следовательно одновременно образуется смесь солей: гидрофосфат и фосфат натрия . 6) Предположим, что мы приливаем щелочь в кислоту. Тогда по реакции №2 рассчитываем количество вещества (Na2HPO4 ): n(NaOH) : n(H3PO4) = 2 :1=0,25:0, 1 =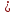 NaOH в избытке 7) расчет количество вещества Na2HPO4 будем вести по H3PO4n(Na2HPO4) : n(H3PO4) = 1:1 =
NaOH в избытке 7) расчет количество вещества Na2HPO4 будем вести по H3PO4n(Na2HPO4) : n(H3PO4) = 1:1 =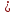 n(Na2HPO4) = n(H3PO4) =0,1 моль 8) Найдем количество непрореагировавшей щелочи. Для этого определяем количество вещества прореагировавшей NaOH : n(NaOH) : n(H3PO4) = 2 :1 =
n(Na2HPO4) = n(H3PO4) =0,1 моль 8) Найдем количество непрореагировавшей щелочи. Для этого определяем количество вещества прореагировавшей NaOH : n(NaOH) : n(H3PO4) = 2 :1 =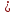 n(NaOH) прореагировавшего =2 n(H3PO4) =0,2 моль, тогда n(NaOH) избытка = 0,25-0,2=0,05 моль 9) Избыток щелочи взаимодействует с полученным гидрофосфатом натрия :
n(NaOH) прореагировавшего =2 n(H3PO4) =0,2 моль, тогда n(NaOH) избытка = 0,25-0,2=0,05 моль 9) Избыток щелочи взаимодействует с полученным гидрофосфатом натрия :
-
NaOH
+
Na2HPO4
=
Na3PO4
+
H2O
Определяем n(Na3PO4 ). Для этого находим избыток - недостаток между NaOH и Na2HPO4 n(NaOH) :n(Na2HPO4) = 1:1 = 0,5 : 0,1 =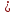 Na2HPO4 в избытке 10)Расчет n(Na3PO4) будем вести по NaOHостатку : n(NaOH) :n(Na3PO4) = 1:1; n(NaOH)= n(Na3PO4) = 0,05 моль; m(Na3PO4)= 0,05моль*164 г/моль = 8,2г 11) Определяем количество вещества непрореагировавшего Na2HPO4. Для этого найдем сколько моль Na2HPO4 вступило в реакцию: n(NaOH) :n(Na2HPO4) = 1:1=
Na2HPO4 в избытке 10)Расчет n(Na3PO4) будем вести по NaOHостатку : n(NaOH) :n(Na3PO4) = 1:1; n(NaOH)= n(Na3PO4) = 0,05 моль; m(Na3PO4)= 0,05моль*164 г/моль = 8,2г 11) Определяем количество вещества непрореагировавшего Na2HPO4. Для этого найдем сколько моль Na2HPO4 вступило в реакцию: n(NaOH) :n(Na2HPO4) = 1:1=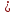 n(Na2HPO4) = n(NaOH)= 0,05 моль. Тогда n(Na2HPO4)избытка =0,1-0,05= 0,05 моль m(Na2HPO4)избытка = 0,05 моль*142г = 7,1 г
n(Na2HPO4) = n(NaOH)= 0,05 моль. Тогда n(Na2HPO4)избытка =0,1-0,05= 0,05 моль m(Na2HPO4)избытка = 0,05 моль*142г = 7,1 г
Ответ: m(Na2HPO4)избытка = 7,1г и m(Na3PO4)= 8,2г
Пример №2 5,68г оксида фосфора (V) растворили в 50,4 20% раствора гидроксида калия. Определите массовые соли солей в образующемся растворе. Проблема: Какие соли образовались в результате взаимодействия данного кислотного оксида и щелочи? Сначала записываю все реакции взаимодействия Р2О5 и КОН
-
1)
6
КОН
+
Р2О5
=
2
К3РО4
+3
Н2О
смесь К3РО4 и К2НРО4
6
:
1
2)
4
КОН
+
Р2О5
=
2
К2 НРО4
+
Н2О
4
:
1
смесь К2НРО4 и КН2РО4
3)
2
КОН
+
Р2О5
+
Н2О
=
2
КН2РО4
2
:
1
Опираясь на свои выводы, сделанные по результатам многочисленного решения подобных задач отмечаю: если n(KOH): n(Р2О5 ) как 6:1 , то образуется только фосфат калия; если n(KOH): n(Р2О5 ) как 4:1, то образуется только гидрофосфат калия; если n(KOH): n(Р2О5 ) как 2:1, то образуется только дигидрофосфат калия. При промежуточных значениях n(KOH), когда n(KOH)≥ 6, то образуется только средняя соль - фосфат калия, если значение n(KOH) лежит в границах  (n ≠ 4,6), образуется смесь фосфата и гидрофосфата калия; если значение n(KOH) лежит в границах
(n ≠ 4,6), образуется смесь фосфата и гидрофосфата калия; если значение n(KOH) лежит в границах 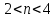 (n ≠2,4), образуется смесь дигидрофосфата и гидрофосфата калия; когда n(КОН) лежит в границах
(n ≠2,4), образуется смесь дигидрофосфата и гидрофосфата калия; когда n(КОН) лежит в границах 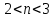 (n ≠ 2,3), то образуется смесь солей: гидрофосфат и дигидрофосфат калия. При значении n(КОН)≤2 образуется только дигидрофосфат калия. Используя данные выводы задачу можно решить так: 1) определяем количество вещества (P2O5): n(Р2О5) = 5,68г /142/моль = 0,04 моль 2) определяем массу (КOH): m (КOH) = 50,4г*0.2= 10,8г 3) определяем количество вещества (КOH): n(КOH) = 10,8/56г/моль=0,18 моль 4) Определяем какие соли образуются: n(КOH): n(Р2О5)= 0,18: 0,04= 18:4=4,5:1 =
(n ≠ 2,3), то образуется смесь солей: гидрофосфат и дигидрофосфат калия. При значении n(КОН)≤2 образуется только дигидрофосфат калия. Используя данные выводы задачу можно решить так: 1) определяем количество вещества (P2O5): n(Р2О5) = 5,68г /142/моль = 0,04 моль 2) определяем массу (КOH): m (КOH) = 50,4г*0.2= 10,8г 3) определяем количество вещества (КOH): n(КOH) = 10,8/56г/моль=0,18 моль 4) Определяем какие соли образуются: n(КOH): n(Р2О5)= 0,18: 0,04= 18:4=4,5:1 =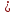 образуется смесь солей гидрофосфат и фосфат калия. 5) Так как по условию задачи изначально щелочь в избытке, то в первую очередь образуется средняя соль, которая затем частично превратится в кислую. По уравнению №1 рассчитываем n(К3PO4) : n(КOH): n(Р2О5)= 0,18: 0,04= 18:4=4,5:1 =
образуется смесь солей гидрофосфат и фосфат калия. 5) Так как по условию задачи изначально щелочь в избытке, то в первую очередь образуется средняя соль, которая затем частично превратится в кислую. По уравнению №1 рассчитываем n(К3PO4) : n(КOH): n(Р2О5)= 0,18: 0,04= 18:4=4,5:1 =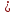 КOH в недостатке. n(К3PO4) считаем по n(КOH): n(К3PO4) : n(КOH)= 2:6 = 1:3; n(К3PO4)=1/3 n(КOH)=0,06 моль 6) определяем количество вещества (P2О5), который не прореагировал. Для этого найдем количество вещества прореагировавшего Р2О5 : n(Р2О5)прореагировавшего = 1/6n(КOH)=0,18моль/6=0,03моль. Тогда n(Р2О5)остатка = 0,04-0,03=0,01 моль 7) Избыток Р2О5 будет взаимодействовать с образовавшимся К3PO4 по уравнению:
КOH в недостатке. n(К3PO4) считаем по n(КOH): n(К3PO4) : n(КOH)= 2:6 = 1:3; n(К3PO4)=1/3 n(КOH)=0,06 моль 6) определяем количество вещества (P2О5), который не прореагировал. Для этого найдем количество вещества прореагировавшего Р2О5 : n(Р2О5)прореагировавшего = 1/6n(КOH)=0,18моль/6=0,03моль. Тогда n(Р2О5)остатка = 0,04-0,03=0,01 моль 7) Избыток Р2О5 будет взаимодействовать с образовавшимся К3PO4 по уравнению:
-
Р2О5
+
4
К3РО4
+
3
Н2О
=
6
К2НРО4
Определяем количество вещества К2НРО4. Для этого определяем избыток-недостаток n(К3PO4) : n(Р2О5)= 4:1=0,06 : 0,01(6:1) =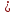 К3PO4 в избытке; К2НРО4 считаем по Р2О5 n(К2НРО4) : n(Р2О5)= 6 :1 ; n(К2НРО4)=6 n(Р2О5)= 0,06 моль ; m (К2НРО4)=0,06*174=10,44г 8) Определяем количество вещества К3РО4 оставшегося. Для этого определяем сколько К3РО4 прореагировало: n(К3PO4) : n(Р2О5)= 4:1; n(К3PO4) =4 n(Р2О5)= 0,01*4 = 0,04 моль; тогда n(К3PO4) оставшегося =0,06-0,04=0,02 моль; m (К3PO4) =0,02*212=4,24г 9) Определяем массовые доли полученных солей. Для этого найдем массу полученного раствора: mполученного раствора= m(Р2О5) + m( растворКOH) = 5,68 + 50,4 = 56,08г
К3PO4 в избытке; К2НРО4 считаем по Р2О5 n(К2НРО4) : n(Р2О5)= 6 :1 ; n(К2НРО4)=6 n(Р2О5)= 0,06 моль ; m (К2НРО4)=0,06*174=10,44г 8) Определяем количество вещества К3РО4 оставшегося. Для этого определяем сколько К3РО4 прореагировало: n(К3PO4) : n(Р2О5)= 4:1; n(К3PO4) =4 n(Р2О5)= 0,01*4 = 0,04 моль; тогда n(К3PO4) оставшегося =0,06-0,04=0,02 моль; m (К3PO4) =0,02*212=4,24г 9) Определяем массовые доли полученных солей. Для этого найдем массу полученного раствора: mполученного раствора= m(Р2О5) + m( растворКOH) = 5,68 + 50,4 = 56,08г 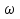 (К3РО4) = 4,24/56,08*100% = 7,56% ;
(К3РО4) = 4,24/56,08*100% = 7,56% ; 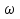 (К2НРО4) = 10,44/56,08*100% = 18,62%
(К2НРО4) = 10,44/56,08*100% = 18,62%
Пример №3 Сероводород, выделившийся в результате взаимодействия 4,4г сульфида железа (II) с избытком соляной кислоты, пропустили через 31,7 г 10,1% раствора гидроксида натрия. Определите массовые доли солей в полученном растворе. Сначала записываю все реакции взаимодействия щелочи с сероводородом
-
NaOH
+
H2S
=
NaHS
+
Н2О
1
:
1
2
NaOH
+
H2S
=
Na2S
+
2
Н2О
2
:
1
При отношении n (NaOH) : n (H2S) = 1:1 образуется только гидросульфид (кислая соль); при отношении n (NaOH) : n (H2S) = 2:1 образуется только сульфид (средняя соль). Если значение n (NaOH)≤ 1, образуется только кислая соль. Если значение n (NaOH) дробное, т.е. лежит в границах 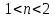 (n ≠1,2), то образуется смесь солей: гидросульфид и сульфид натрия. Если значение n (NaOH)≥ 2 - то образуется только средняя соль.
(n ≠1,2), то образуется смесь солей: гидросульфид и сульфид натрия. Если значение n (NaOH)≥ 2 - то образуется только средняя соль.
1) По реакции : FeS + 2HCL = FeCL2 + H2S находим количество вещества H2S. Для этого определяем n(FeS): n(FeS) =4,4:88= 0,15 моль по уравнению реакции n (H2S) : n(FeS) = 1:1 =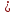 n (H2S) = n(FeS) = 0,05 моль 2) Находим количество вещества NaOH. Для этого определяем массу NaOH: m(NaOH) = 31,7*0,101=3,2г n (NaOH) = 3,2/ 40 = 0,08 моль 3) Определяем через соотношения какие соли образуются: n (NaOH) : n (H2S) = 0,08 : 0,05 = 1,6:1 =
n (H2S) = n(FeS) = 0,05 моль 2) Находим количество вещества NaOH. Для этого определяем массу NaOH: m(NaOH) = 31,7*0,101=3,2г n (NaOH) = 3,2/ 40 = 0,08 моль 3) Определяем через соотношения какие соли образуются: n (NaOH) : n (H2S) = 0,08 : 0,05 = 1,6:1 =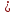 образуется смесь солей: гидросульфид и сульфид натрия. Т.к. изначально щелочь в избытке, то в первую очередь образуется средняя соль:
образуется смесь солей: гидросульфид и сульфид натрия. Т.к. изначально щелочь в избытке, то в первую очередь образуется средняя соль:
-
2
NaOH
+
H2S
=
Na2S
+
2
Н2О
Определяем избыток - недостаток n (NaOH) : n (H2S) = 2:1 = 0,08 : 0,05 =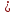 H2S в избытке и n (Na2S) считаем по NaOH : n (Na2S) : n (NaOH) =1:2 =
H2S в избытке и n (Na2S) считаем по NaOH : n (Na2S) : n (NaOH) =1:2 =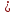 n (Na2S ) = ½ n (NaOH) = 0,04 моль 4) Определяем какое количество вещества H2S не прореагировало. Для этого находим, сколько H2S вступило в реакцию: n (H2S)=1/2 n (NaOH) = 0,04 моль. Тогда n (H2S)остатка = 0,05-0,04 =0,01 моль 5) Остаток H2S реагирует с образовавшейся солью Na2S с образованием кислой соли:
n (Na2S ) = ½ n (NaOH) = 0,04 моль 4) Определяем какое количество вещества H2S не прореагировало. Для этого находим, сколько H2S вступило в реакцию: n (H2S)=1/2 n (NaOH) = 0,04 моль. Тогда n (H2S)остатка = 0,05-0,04 =0,01 моль 5) Остаток H2S реагирует с образовавшейся солью Na2S с образованием кислой соли:
-
Na2S
+ H2S
=
2 NaHS
Определяем избыток - недостаток для расчета NaHS : n (NaHS) : n (H2S) = 1:1 = 0,04 : 0,01 =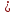 Na2S в избытке. n (NaHS) считаем по H2S : n (NaHS) : n (H2S) = 2:1 =
Na2S в избытке. n (NaHS) считаем по H2S : n (NaHS) : n (H2S) = 2:1 =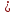 n (NaHS) = 2n (H2S) =0,02 моль 6) Определяем количество вещества Na2S, оставшегося в растворе. Для этого определяем n(Na2S), который вступил в реакцию : n (Na2S)прореагировавшего = n (H2S) =0,01 моль n (Na2S)избыток = 0,04-0,01 = 0,03 моль 7) Определяем массу солей : m(Na2S)избыток =0,03*78 =2,34г; m(NaНS) =0,02*56 = 1,12г 8) Определяем массовые доли солей в полученном растворе. Для этого определяем массу полученного раствора: m (раствора) = m(NaOH раствор) + m (H2S) m (H2S) = 0,05*34 =1,7г ; m (раствора) = 31,7+1,7 = 33,4г
n (NaHS) = 2n (H2S) =0,02 моль 6) Определяем количество вещества Na2S, оставшегося в растворе. Для этого определяем n(Na2S), который вступил в реакцию : n (Na2S)прореагировавшего = n (H2S) =0,01 моль n (Na2S)избыток = 0,04-0,01 = 0,03 моль 7) Определяем массу солей : m(Na2S)избыток =0,03*78 =2,34г; m(NaНS) =0,02*56 = 1,12г 8) Определяем массовые доли солей в полученном растворе. Для этого определяем массу полученного раствора: m (раствора) = m(NaOH раствор) + m (H2S) m (H2S) = 0,05*34 =1,7г ; m (раствора) = 31,7+1,7 = 33,4г 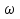 (NaHS) = 1,12/33,4*100% =3,35% ;
(NaHS) = 1,12/33,4*100% =3,35% ; =2,34/33,4*100% = 7%
=2,34/33,4*100% = 7%


