- Преподавателю
- Химия
- Урок по химии по теме «Газ жизни»
Урок по химии по теме «Газ жизни»
| Раздел | Химия |
| Класс | - |
| Тип | Конспекты |
| Автор | Варлакова Л.Г. |
| Дата | 03.04.2013 |
| Формат | doc |
| Изображения | Есть |
Название задачи: «Газ жизни»
Личностно - значимый познавательный вопрос
Это кислород. Ведь человек может десятки дней прожить без пищи, около недели - без вод и не более нескольких минут - без кислорода воздуха. Вы наверное часто слышали такое название как «кислородные подушки». Это емкости наполненные кислородом и их используют в больницах. Но откуда, же берут чистый кислород, чтобы заполнить множество таких «штуковин»? А ведь не только здесь необходим чистый кислород. Большая часть получаемого кислорода расходуется в металлургической промышленности для получения стали из чугуна и металлолома. Кислород используют для сварки и резки металлов. Но давайте не будем забывать и о химической промышленности! Здесь кислород используют для получения самых различных соединений (о некоторых из них мы еще будем говорить на протяжении всего нашего курса). А значит необходимо найти такой источник, в котором имелись огромные запасы кислорода. Как вы думаете, какой соответствующий всем требованиям источник нашли ученые?
Информация по данному вопросу
Кислород и другие газы из атмосферы получают только в промышленности, а значит промышленным способом.
Для этого воздух сначала превращают в жидкость путем охлаждения до такой низкой температуры, при которой все его компоненты переходят в жидкости (например, для кислорода такая температура равна -183°С). Затем эту жидкость медленно нагревают, в результате чего при разных температурах происходит последовательное выкипание веществ, содержавшихся в воздухе. А затем собирают эти выкипающие газы по отдельности.
В условиях школы не под силу получить таким способом кислород, так как оборудование дорогостоящее и этот процесс занимает много времени. А значит давайте рассмотрим другие способы получения кислорода, то есть лабораторные. Впервые получил кислород Дж. Пристли при нагревании такого вещества как HgO. Но влаборатории нельзя использовать такой способ, так как пары ртути ядовиты.
Кислород можно получить в химической лаборатории из вещества, которое имеется в вашей домашней аптечке, и при растворении небольшого его количества мы получаем раствор малинового цвета. Это перманганат калия- марганцовка. Ее химическая формула: KMnO4.
I.Получение кислорода лабораторным путем из KMnO4
Демонстрационный опыт
Получение кислорода лабораторным путем из KMnO4
-
В пробирку насыпаем на 1-2 см порошок KMnO4 , и кладем небольшой комок ваты.
-
Надеваю газоотводную трубку и закрепляем в штативе (см. рисунок ниже часть б).
-
Наливаем в кристаллизатор воду, а также заполняем водой вторую пробирку, которую опрокидываем в кристаллизатор. В кристаллизатор опускаем конец газоотводной трубки.
-
Зажигаем спиртовку спичкой (правила безопасности!) и начинаем греть KMnO4, но в начале прогреваем всю пробирку с KMnO4 (вспомнить с учащимися правила безопасности!).
-
После того, как начнутся выделяться пузырьки из газоотводной трубки (это воздух!!!), газоотводную трубку просовываем в пробирку с водой.
-
После того, как вся пробирка заполнится кислородом, вынимаем ее, при этом закрыв отверстие картонкой.
-
Чтобы доказать, что в пробирке находится кислород, в пробирку опускаем погасшую лучинку, которая вспыхивает с новой силой.
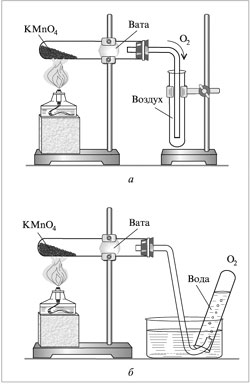
Рис. 1. Собирание кислорода методом вытеснения: а - воздуха; б - воды
А теперь давайте посмотрим какая произойдет реакция, если нагреть данное вещество:
KMnO4 = O2 + K2MnO4 + MnO2
II.Получение кислорода лабораторным путем из пероксида водорода Н2О2
Кислород можно также получить разложением пероксида водорода Н2О2. Но для этого необходимо в пробирку с Н2О2 чуть-чуть добавить особого вещества - катализатора. Для данной реакции катализатором является вещество, формула которого MnO2. При этом протекает следующая реакция:
Н2О2 = 2Н2О + О2.
III. Еще один лабораторный способ получения кислорода - разложением воды
Еще один способ получения кислорода - разложение воды под действием постоянного электрического тока. Этот процесс называется электролизом воды. При этом протекает следующая химическая реакция:
2Н2О = 2Н2 + О2.
Мы рассмотрели промышленные и лабораторные способы получения кислорода, но откуда берется кислород на Земле? И почему его количество остается примерно постоянным, несмотря на его огромный расход при дыхании, гниении, в промышленности и т.п.? В природе единственным источником кислорода являются зеленые растения. В результате фотосинтеза в зеленых частях растений СО2 и Н2О превращаются в глюкозу С6Н12О6 и кислород. Суммарное уравнение реакций, протекающих в процессе фотосинтеза, можно представить следующим образом:
6СО2 + 6Н2ОС6Н12О6 + 6О2.
Установлено, что только около 11% производимого зелеными растениями кислородадают наземные растения, а 89% - водные растения.
Задания на работу с данной информацией
Знание. Прочитайте текст и назовите способы получения кислорода.
Напишите уравнения соответствующих реакций.
Чем отличаются эти способы друг от друга?
Понимание. Объясните смысл участия в некоторых реакциях
катализаторов.
Применение. Соберите и продемонстрируйте прибор для получения
кислорода.
Анализ. Объясните, на каких свойствах кислорода основаны способы его
собирания.
Синтез. Предложите другие вещества для получения кислорода.
Оценка. Установите критерии для отбора способов и веществ, из которых можно получить кислород в лаборатории.


