- Преподавателю
- Химия
- Урок по химии на тему: Химические реакции
Урок по химии на тему: Химические реакции
| Раздел | Химия |
| Класс | 8 класс |
| Тип | Другие методич. материалы |
| Автор | Нагарокова М.Н. |
| Дата | 02.02.2016 |
| Формат | docx |
| Изображения | Есть |
МБОУ СОШ №6 п. Дружба
План-конспект открытого урока по химии
в 8 классе
Тема: «Типы химических реакций».
Учитель химии: Нагарокова Марьяна Нурбиевна
2015-2016 уч.год
Тема урока: «Типы химических реакций»
Цели урока: обеспечение усвоения учащимися понятия классификации химических реакций, деления их на типы.
Задачи урока:
-
Образовательные - развить навыки самостоятельной работы, умения записывать уравнения реакций и расставлять коэффициенты, указывать типы реакций, делать выводы и обобщения.
-
Развивающие - развить речевые навыки, способности к анализу; развитие познавательных способностей, мышления, внимания, умения использовать изученный материал для познания нового.
-
Воспитательные - воспитание самостоятельности, сотрудничества, нравственных качеств - коллективизма, способности к взаимовыручке, адекватной самооценке.
Ход урока.
1. Организационный момент. Мотивация к учебной деятельности учащихся.
Ум заключается не только в знаниях,
но и в умении применять знания в деле…
Аристотель.
Всё, что нас окружает, состоит из веществ. Кажется, что они живут своей жизнью, таинственной и непостижимой. Взаимодействуя, они изменяют свои свойства и состав. И задача человека, изучив этот мир, постараться использовать полученные знания во благо. Сегодня мы продолжим знакомство с этим удивительным и волшебным миром химических реакций. Наша планета, жителями которой являемся и мы с вами, сформирована благодаря протеканию химических процессов. Распределение веществ на Земле обусловлено конкретными химическими реакциями.
2. Промежуточный контроль знаний.
А что такое химическая реакция? (Это явление, при котором из одних веществ образуются другие)
Каковы признаки химических реакций? ( Изменение цвета, выпадение осадка, выделение тепла и света, выделение газа - это признаки химических реакций)
Каковы условия возникновения химических реакций? (Измельчение, нагревание, соприкосновение, растворение и смешивание веществ - это условия проведения реакций)
Как много химических реакций окружает нас в жизни? (Великое множество различных реакций окружает нас в жизни )
Что может помочь нам в изучении многообразия химических реакций? (Классификация химических реакций)
Что такое классификация? (Деление на группы)
Так что же будет являться целью нашего сегодняшнего урока? (Изучение типов химических реакций и их классификация).
3.Основная часть урока.
Классификация химических реакций по различным признакам.
-
По числу и составу исходных веществ (реагентов) и продуктов реакции:
-
Реакции соединения - это реакции, в ходе которых из двух или нескольких веществ образуется одно вещество более сложного состава. А + В + …. = D. Существует большое число реакций соединения простых веществ (металлов с неметаллами, неметаллов с неметаллами).
Например: Fe + S = FeS
S + O2 = SO2
В реакциях соединения могут участвовать и сложные вещества.
Например: Ca + SO3 = CaSO4
K2O + H2O = 2KOH
-
Реакции разложения - это реакции, при протекании которых из одного сложного вещества образуются два или несколько более простых веществ: A = B + C +…..
Продуктами разложения исходного вещества могут быть как простые , так и сложные вещества.
Например: 2 Fe(OH)3 = Fe2O3 +3 H2O
2SiH4 = 2Si+H2
Реакции разложения обычно протекают при нагревании веществ.
-
Реакции замещения- это реакции между простыми и сложными веществами, при протекании которых атомы простого вещества замещают атомы одного из элементов в молекуле сложного вещества. В результате реакции замещения образуются новое простое и новое сложное вещество. А + ВС = АС + В
Например: 3H2SO4 + 2Al = Al2(SO4)3 + 3H2
2HCl + Mg = MgCl2 + H2
-
Реакции обмена - это реакции между двумя сложными веществами, молекулы которых обмениваются своими составными частями. AB + CD = AD + CB
Например: Al2(SO4)3 + 3Ba(NO3)2 = 2Al(NO3)3 + 3BaSO4
BaCl2 + Na2SO4 = BaSO4 +2 NaCl
В результате реакций обмена обычно образуются осадок, или газообразное вещество, или слабый электролит (например, вода).
По программе в 8 классе изучаются только эти типы химических реакций, но мы рассмотрим и другие типы реакции ,которые существуют в химии.
2). По признаку изменения степеней окисления элементов в молекулах реагирующих веществ все реакции делятся на:
-
Окислительно- восстановительные реакции (реакции, идущие с изменением степеней окисления)
-
Не окислительно- восстановительные реакции (реакции, идущие без изменением степеней окисления).
3). По знаку теплового эффекта:
-
Экзотермические (идущие с выделением теплоты).
-
Эндотермические (идущие с поглощением теплоты).
4). По признаку однородности реакционной системы реакции делятся на:
-
Гомогенные(протекающие в однородной системе).
-
Гетерогенные (протекающие в неоднородной системе).
5). В зависимости от присутствия или отсутствия катализатора реакции делятся на:
-
Каталитические (идущие с участием катализатора).
-
Некаталитические (идущие без катализатора).
6). По признаку обратимости химические реакции делятся на:
-
Необратимые(протекающие только в одном направлении).
-
Обратимые(протекающие одновременно в прямом и в обратном направлениях).
4. Закрепление
1).А теперь посмотрите на уравнения реакций на слайде. Расставьте коэффициенты в следующих уравнениях реакций и укажите тип реакции.
Mg + O2 → MgO
Al(OH)3 →Al2O3 + H2O
Na + H2O → NaOH + H2
ZnSO4 + HCl → ZnCl2 + H2SO4
Fe + HCl → FeCl2 + H2
HgO → Hg + O2
HCl + NaOH → NaCl + H2O
Mg + O2 → MgO
C + O2 → CO2
CH4 → C2H2 + H2
Ca + HCl → CaCl2 + H2
K + S → K2S
2). Установить соответствие.
Тест №1
1) Соединение А) Fe + CuCl2 = FeCl2 + Cu
2)Разложение В) Al + 3 O2 = 2 Al2O3
3)Замещение С) 2 KClO3 = 2 KCl + 3O2
4)Обмен D) Al2O3 + 3 H2SO4 = Al2(SO4)2 + 3 H2O
Тест №2
-
Соединение A) Mg + H2O = MgO + H2
-
Разложение B) 3 KOH + H3PO4 = K3PO4 + 3 H2O
-
Замещение C) Ni(OH)2 = NiO + H2O
-
Обмен D) Zn + S = ZnS
Тест №3
-
Соединение A) Fe2O3 + 6HCl
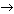 2FeCl3 + 3H2O
2FeCl3 + 3H2O -
Разложение B) H2 + Cl2
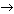 2HCl
2HCl -
Замещение C) 2NH3
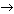 N2 + 3H2
N2 + 3H2 -
Обмен D) Fe2O3 + 2Al
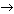 Al2O3 + 2Fe
Al2O3 + 2Fe
5. Домашнее задание : §20, упр.3
6.Итоги урока. Рефлексия.Выставление оценок
-Что нового вы узнали сегодня о типах химических реакций?
- Можно ли считать, что ваши цели на урок
достигнуты?
Оцените свою деятельность на уроке, дайте
оценку полученным знаниям, их значимости в
дальнейшей деятельности.
Я понял, что …
Я научился …
Мне необходимо …
Список литературы
1.Кузнецова Н.Е. Химия: учебник для учащихся общеобразовательных учреждений/ Н. Е. Кузнецова, И.М. Титова, Н.Н. Гара.-4-е изд.,перераб.- М.: Вентана- Граф,2013.
2.Химия. Пособие- репетитор для поступающих в вузы// 5-е изд. - Ростов н/Д: изд- во « Феникс», 2003.
3.Некрасов Б.В. Основы общей химии, т. 1. - М.: «Химия», 1973
4. Химическая энциклопедия, п. ред. Кнунянц И.Л., т. 5. - М.: «Советская энциклопедия», 1988
5. Хомченко Г.П. Пособие по химии для поступающих в вузы. - 3_е изд. испр. и доп. - М.: ООО «Издательство Новая Волна», ЗАО «Издательский Дом ОНИКС», 2000. с. 334
Интернет-ресурсы
-
festival.1september.ru/articles/631769/
-
otherreferats.allbest.ru/chemistry/00058903_0.html
-
nyaski.ru/pages/neorganicheskaya-himiya-v-reakciyah
-
ppt4web.ru/khimija/tipy-khimicheskikh-reakcijj-v-organicheskojj-i-neorganicheskojj-khimii.html
-
hemi.nsu.ru/ucheb188.htm
-
testsoch.info/urok-po-teme-tipy-ximicheskix-reakcij/
-
videouroki.net/filecom.php?fileid=98686158


