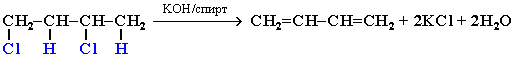- Преподавателю
- Химия
- Подготовка к ЕГЭ по химии. АЛКАДИЕНЫ
Подготовка к ЕГЭ по химии. АЛКАДИЕНЫ
| Раздел | Химия |
| Класс | - |
| Тип | Конспекты |
| Автор | Кисакова О.А. |
| Дата | 05.12.2014 |
| Формат | doc |
| Изображения | Есть |
АЛКАДИЕНЫ.
Это углеводороды, содержащие две двойные связи. Первый член ряда - С3Н4 (пропадиен или аллен). В названии появляется суффикс - ДИЕН.
СН2=СН-СН=СН2
бутадиен-1,3
(дивинил)
СН2=С-СН=СН2
│ 2-метилбутадиен-1,3
СН3 (изопрен)
Типы двойных связей в диенах:
1.Изолированные двойные связи разделены в цепи двумя или более σ-связями:
СН2=СН-СН2-СН=СН2. Диены этого типа проявляют свойства, характерные для алкенов.
2. Кумулированные двойные связи расположены у одного атома углерода: СН2=С=СН2 (аллен)
Подобные диены (аллены) относятся к довольно редкому и неустойчивому типу соединений.
3.Сопряженные двойные связи разделены одной σ-связью: СН2=СН-СН=СН2
Сопряженные диены отличаются характерными свойствами, обусловленными электронным строением молекул, а именно, непрерывной последовательностью четырех sp2-атомов углерода.
Изомерия диенов
1. Изомерия положения двойных связей:

2. Изомерия углеродного скелета:
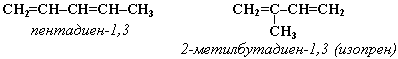
3. Межклассовая изомерия с алкинами и циклоалкенами. Например, формуле С4Н6 соответствуют следующие соединения:
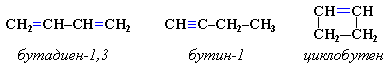
4. Пространственная изомерия
Диены, имеющие различные заместители при углеродных атомах у двойных связей, подобно алкенам, проявляют цис-транс-изомерию.
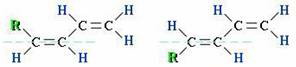
(1)Цис-изомер (2) Транс-изомер
Электронное строение сопряженных диенов.
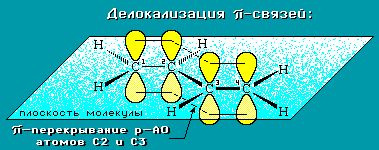 Молекула бутадиена-1,3 СН2=СН-СН=СН2 содержит четыре атома углерода в sp2-гибридизованном состоянии и имеет плоское строение.
Молекула бутадиена-1,3 СН2=СН-СН=СН2 содержит четыре атома углерода в sp2-гибридизованном состоянии и имеет плоское строение.
π-Электроны двойных связей образуют единое π-электронное облако (сопряженную систему) и делокализованы между всеми атомами углерода.
 Кратность связей (число общих электронных пар) между атомами углерода имеет промежуточное значение: нет чисто одинарной и чисто двойных связей. Строение бутадиена более точно отражает формула с делокализованными «полуторными» связями.
Кратность связей (число общих электронных пар) между атомами углерода имеет промежуточное значение: нет чисто одинарной и чисто двойных связей. Строение бутадиена более точно отражает формула с делокализованными «полуторными» связями.
ХИМИЧЕСКИЕ СВОЙСТВА СОПРЯЖЕННЫХ АЛКАДИЕНОВ.
РЕАКЦИИ ПРИСОЕДИНЕНИЯ К СОПРЯЖЕННЫМ ДИЕНАМ.
Присоединение галогенов, галогеноводородов, воды и других полярных реагентов происходит по электрофильному механизму (как в алкенах).
Помимо присоединения по одной из двух двойных связей (1,2-присоединение), для сопряженных диенов характерно так называемое 1,4-присоединение, когда в реакции участвует вся делокализованная системы из двух двойных связей: 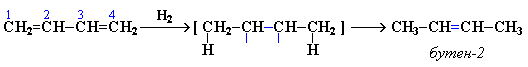
Соотношение продуктов 1,2- и 1,4- присоединения зависит от условий реакции (с повышением температуры обычно увеличивается вероятность 1,4-присоединения).
1. Гидрирование.
 CН3-СН2-СН=СН2 (1,2-продукт)
CН3-СН2-СН=СН2 (1,2-продукт)
С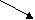 Н2=СН-СН=СН2 + Н2
Н2=СН-СН=СН2 + Н2
СН3-СН=СН-СН3 (1,4-продукт)
В присутствии катализатора Ni получается продукт полного гидрирования:
CH2=CH-CH=CH2 + 2 H2 -(Ni,t) CH3-CH2-CH2-CH3
2. Галогенирование, гидрогалогенирование и гидратация
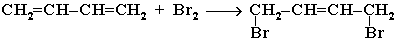
1,4-присоединение.
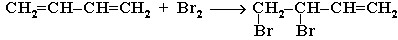
1,2-присоединение.
При избытке брома присоединяется еще одна его молекула по месту оставшейся двойной связи с образованием 1,2,3,4-тетрабромбутана.
3. Реакция полимеризации. Реакция протекает преимущественно по 1,4-механизму, при этом образуется полимер с кратными связями, называемый каучуком:
nСН2=СН-СН=СН2 (-СН2-СН=СН-СН2-)nполимеризация изопрена:
nCH2=C-CH=CH2(-CH2 -C =CH -CH2 -)n
│ │
CH3 CH3 (полиизопрен)
РЕАКЦИИ ОКИСЛЕНИЯ - мягкое, жесткое, а также горение.
Протекают так же, как и в случае алкенов - мягкое окисление приводит к многоатомному спирту, а жесткое окисление - к смеси различных продуктов, зависящих от строения диена:
СН2=СН-СН=СН2 + KMnO4 + H2O СН2 - СН - СН - СН2 +MnO2 + KOH
│ │ │ │
OH OH OH OH
Алкадиены горят - до углекислого газа и воды. С4Н6 + 5,5О2 4СО2 + 3Н2О
ПОЛУЧЕНИЕ АЛКАДИЕНОВ.
1. Каталитическое дегидрирование алканов (через стадию образования алкенов). Этим путем получают в промышленности дивинил из бутана, содержащегося в газах нефтепереработки и в попутных газах:
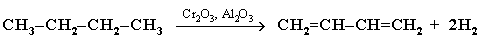
Каталитическим дегидрированием изопентана (2-метилбутана) получают изопрен:
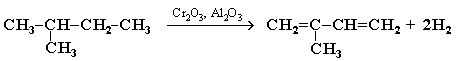
2. Синтез Лебедева:
(катализатор - смесь оксидов Al2O3,MgO,ZnO
2 C2H5OH -( Al2O3,MgO,ZnO, 450˚C) CH2=CH-CH=CH2 + 2H2O + H2
3. Дегидратация двухатомных спиртов:
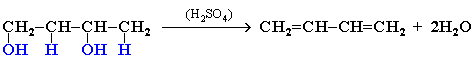
4. Действие спиртового раствора щелочи на дигалогеналканы (дегидрогалогенирование):