- Преподавателю
- Химия
- Конспект урока по теме Отработка практических и расчётных умений по теме Состав и строение веществ (8 класс)
Конспект урока по теме Отработка практических и расчётных умений по теме Состав и строение веществ (8 класс)
| Раздел | Химия |
| Класс | 8 класс |
| Тип | Конспекты |
| Автор | Кузьмина Т.В. |
| Дата | 22.09.2015 |
| Формат | docx |
| Изображения | Есть |
Тема: Отработка практических и расчетных умений по теме « Состав и
строение веществ» к урокам 9-10 по методике Ривина-Баженова (МРБ).
Цели и задачи урока:
Учебно-образовательные:
1. Совершенствовать умения и навыки в решении расчетных задач.
Учебно-воспитательные:
1. Уметь оказывать помощь друг другу в решении расчетных задач.
Научиться контролировать себя в результате самопроверки, пользуясь «карточками-подсказками» и карточками с образцами решенных задач и упражнений.
Учебно-развивающие:
Развивать умения пользоваться уравнениями связи и проводить по ним расчеты.
Оборудование:
Алгоритмы работы по МРБ, 4 блока карточек, карточки-подсказки, карточки с образцами решенных задач и упражнений, чистые листы бумаги, экран учета работы учащихся по МРБ.
ПРО:
В ходе занятия учащиеся должны отработать следующие умения и навыки:
- вычислять по формулам веществ Мr, М и массовую долю химического элемента в веществе;
- составлять химические формулы веществ по известным С.О. элементов;
- определять С.О. элементов по формулам веществ;
- классифицировать сложные вещества.
Ход урока
-
Организационный момент.
-
Сообщение темы, целей и задач урока.
-
Собственно занятие.
3.1. Знакомство с новой методикой коллективных занятий.
3.2. Знакомство с алгоритмом работы по МРБ.
-
Учащиеся сидят как обычно, по 2 человека за партой.
-
Каждый ученик получает одну карточку и выполняет в своей тетради сам или с помощью «карточки-подсказки» оба задания индивидуально.
-
После самопроверки обоих заданий или проверки у учителя ученик находит себе партнера для работы по первому заданию своей карточки.
-
Учащиеся садятся рядом, добровольно решают, кто начнет разъяснять своё задание первым. Тот, кто вызвался быть первым, берет чистый лист бумаги, подписывает его. Читает своему партнеру 1-ое задание и на чистом листе бумаги воспроизводит решение. Его тетрадь при этом должна быть закрыта. Партнёр задаёт вопросы своему соседу, просит уточнить некоторые записи, сравнивает данное решение с записями в тетради соседа и выставляет ему оценку на листе бумаги. (Эти оценки затем переносятся в «Экран учёта»)
-
Теперь партнер воспроизводит решение своего 1-го задания на отдельном листе бумаги. После этого они берут себе на память листки с решениями. Работа в парах закончилась.
-
Второе задание своей карточки каждый ученик отрабатывает с новым партнёром. (При этом карточками партнеры не обмениваются). Отработав с новым партнером второе задание, ученик сдает карточку учителю и получает новую. Если вначале кто-то работал с карточкой, имеющей нечетный номер (1 или 3), то он должен получить карточку с четным номером (2 или 4) и проработать её таким же образом.
-
Учащиеся фиксируют результаты своей работы в «Экране учёта», который может выглядеть следующим образом:
-
Ф.И. уч-ся
№ 1
№ 2
№ 3
№ 4
1-ое
зад.
2-ое
зад.
1-ое
зад.
2-ое
зад.
1-ое
зад.
2-ое
зад.
1-ое
зад.
2-ое
зад.
-
Каждый ученик должен самостоятельно за 45-90 мин урока решить
четыре задачи разных видов и столько же прослушать. За решенные задачи
он может получить две оценки: 1-ую - за индивидуальную работу
(самоввод), 2-ую за работу в паре, причем за одно и то же задание.
За прослушанные задания учащиеся ставят знак « + ».
-
Те учащиеся, которые быстрее других справляются с обязательными
заданиями, получают контрольные задания.
4.В конце занятия подводятся итоги работы и выставляются оценки в журнал (с «экрана учёта».)
5.Домашнее задание: подготовиться к Диагностике - 8.
МРБ 8-3
Состав и строение веществ
Карточка 1.
Решение задач и упражнений.
1. Составьте химические формулы веществ по известным степеням окисления химических элементов:
а) N-3 H+1 б) H+1O-2 в) S+6 O-2 г) C+4 Cl-1 д) N+5 O-2
________________________________________________________________
Какому количеству вещества соответствует:
а) CaO массой 40 г.; б) H2O массой 36 г.; в) NaCl массой 1 кг.
МРБ 8-3
Состав и строение веществ
Карточка 2.
Решение задач и упражнений.
Из перечня формул веществ выпишите: а) оксиды; б) кислоты:
K3PO4, H2SO4, CO2, H2CO3, Fe(OH)3, ZnSO4, HCl, NaNO3, K2O, SO3
__________________________________________________________________
Определите Mr, М фосфата кальция Сa3(PO4)2, использующегося в качестве удобрения. Найдите массовую долю Р в этом удобрении.
МРБ 8-3
Состав и строение веществ
Карточка 3.
Решение задач и упражнений.
Определите степень окисления каждого химического элемента в соединениях: а) CO2, б) Н3PO4, в) SiH4, г) KCl, д) P2O5.
__________________________________________________________________
Какой массе оксида железа Fe2O3 соответствует его количество: а) 0,25 моль,
б) 3 моль, в) 0,1 моль.
МРБ 8-3
Состав и строение веществ
Карточка 4.
Решение задач и упражнений.
Из перечня формул веществ выпишите: а) соли, б) основания:
NO2, CaSO4, Ba(OH)2, НNO3, NaCl, CaO, Fe2 (SO4)3, KOH, Ca3(PO4)2, NaOH.
__________________________________________________________________
___________________
Определите Мr и М гидрофосфата кальция CaHPO4 , использующегося как удобрение. Какова массовая доля Р в этом удобрении?
Карточка - подсказка
к карточке № 1
Чтобы составить химическую формулу вещества по известным степеням окисления химических элементов, нужно:
найти наименьшее общее кратное значений степеней окисления;
наименьшее общее кратное разделить на значение каждой степени окисления;
полученные в результате деления частные записать справа внизу от знака химического элемента.
Например:1) С+4S-2 1) HOК = 4;
2) 4 : 4 = 1(один не пишем);
3) 4 : 2 = 2
индекс 2 пишем справа внизу у химического знака S
Получаем: CS2
Чтобы определить количество вещества (n), содержащееся в определенной массе вещества, нужно:
-
Воспользоваться формулой n =
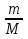 :
: -
Вычислить относительную молекулярную массу (Mr) данного вещества, абсолютное значение которой равно молярной массе (М);
-
Подставить данное значение массы и полученное значение молярной массы в формулу, вычислить n.
Например: какому количеству вещества соответствует 88 г оксида углерода (+4) СО2?
1) n = 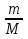 : 2) Мr (CO2) = 12=16 ∙ 2 = 44
: 2) Мr (CO2) = 12=16 ∙ 2 = 44
M(CO2) = 44 г/моль.
3) n =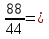 2 моль
2 моль
Ответ: данная масса оксида углерода (+ 4) соответствует 2 моль.
Карточка - подсказка
к карточке № 2
Чтобы из предложенного перечня веществ выписать формулы оксидов и кислот, нужно:
-
Вспомнить определение оксидов.
Оксиды - это сложные вещества, состоящие из 2-х элементов, один из которых кислород;
-
Вспомнить определение кислот.
Кислоты - это сложные вещества, состоящие из атомов водорода и кислотных остатков.
-
Соотнести определения оксидов и кислот с предложенными формулами веществ.
Например: из перечня формул веществ выпишите:
а) оксиды; б) кислоты:
ZnCl2, HCl, CO, NaOH, Br2, H2SO4, CuO, Ca(ОH)2, K2O, HNO3
а) CO; CuO; K2O - оксиды
б) HCl; H2SO4; HNO3 - кислоты
2. Чтобы определить относительную молекулярную массу вещества нужно:
1) сложить относительные атомные массы всех входящих в это вещество
элементов, предварительно умножив их на соответствующие индексы;
2) абсолютное значение относительной молекулярной массы (Мr) равно
абсолютному значению молярной массы (М);
3)массовая доля (w %) элемента в веществе находится по формуле:
w% (Э) =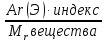
Например: определите Mr, М сульфата алюминия Al2(SO4)3. Найдите массовую долю серы в этом соединении:
1) Mr(Al2(SO4)3) = 27 ∙ 2 + (32 + 16 ∙ 4) ∙ 3 = 342
2) М(Al2 (SO4)3) = 342 г/моль;
3) w%(S) = 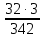 · 100% = 28%.
· 100% = 28%.
Ответ: Mr = 342; M = 342 г/моль; w(S) = 28 %
Карточка - подсказка
к карточке № 3
Чтобы определить степень окисления каждого химического элемента в соединении, нужно:
-
Вначале указать постоянную степень окисления у известного элемента;
-
Найти общее значение степеней окисления этого элемента ( указанное значение степени окисления умножить на индекс);
-
Полученное число разделить на индекс второго элемента;
-
Частное от выполненного только что деления будет являться степенью окисления второго элемента.
Например: определить степень окисления каждого элемента в соединении К2О:
-
К2О-2 ; 2) 2 ∙ 1 =2; 3) 2 : 2 = 1; 4) К2+1О-2.
Чтобы определить массу (m) вещества по его количеству, нужно:
-
Воспользоваться формулой m=М ∙ n;
-
Вычислить относительную молекулярную массу (Mr) данного вещества, абсолютное значение которой равно молярной массе (М);
-
Подставить данное значение молярной массы и значение количества вещества в формулу, вычислить m.
Например: Какой массе оксида углерода (+ 4) соответствует его
количество = 2 моль.
-
m=М ∙ n;
-
Mr(CO2) = 12 + 16 ∙ 2 = 44
М(СО2) = 44 г/моль
-
m(CО2) = 44 г/моль ∙ 2 моль = 88 г.
Ответ: 2 моль оксида углерода (+ 4) соответствуют 88 г.
Карточка - подсказка
к карточке № 4
Чтобы из предложенного перечня веществ выписать формулы солей и оснований, нужно:
-
Вспомнить определение солей.
Соли - это сложные вещества, состоящие из атомов металлов и ионов кислотных остатков.
-
Вспомнить определение оснований.
Основания - это сложные вещества, молекулы которых состоят из атомов металлов и одной или нескольких гидроксогрупп.
-
Соотнести определения солей и оснований с предложенными формулами веществ.
Например: из перечня формул веществ выпишите:
а) соли; б) основания.
ZnCl2, HCl, NaOH, CaSO4, CuO, Ca(OH)2, K2O, HNO3, Na2CO3, KOH.
а) ZnCl2, CaSO4, Na2CO3 - соли
б) NaOH, Ca(OH)2, KOH - основания
2. Чтобы определить относительную молекулярную массу веществ нужно:
1) сложить относительные атомные массы всех входящих в это вещество элементов, предварительно умножив их на соответствующие индексы;
2)абсолютное значение относительной молекулярной массы (Mr) равно
абсолютному значению молярной массы (М);
3)массовая доля (w%) элемента в веществе находится по формуле:
Например: определить Mr, М сульфата алюминия. Al2(SO4)3. Найдите
массовую долю серы в этом соединении:
1) Mr(Al2(SO4)3) = 27 ∙ 2 + (32 + 16 ∙ 4) ∙ 3 = 34
2) М(Al2(SO4)3) = 342 г/моль;
3) w%(S) = 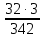 · 100% = 28%.
· 100% = 28%.
Ответ: Mr =342; M = 342 г/моль; w(S) = 28 %
Лист учителя
по теме «Состав и строение веществ» к урокам 9-10 «Отработка практических и расчетных умений по МРБ»
Виды задач и упражнений
Упражнения и задачи
а)
б)
1.Составление химических формул веществ по известным степеням окисления элементов.
2.Проведение расчётов по формулам связи:
М = 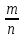 ; m = М ∙ n;
; m = М ∙ n;
n = 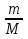
1. Составьте химические формулы веществ по известным степеням окисления элементов и групп атомов
а) N-3H+1; б) H+1 O-2; в)S+6O-2;
г)C+4Cl-1; д) N+5O-2.
2.Какой массе оксида железа Fe2O3 соответствует его количество а) 0,25 моль;
б) 3 моль; в) 0,1 моль.
1.Определение степени окисления элементов по формулам веществ.
2. Проведение расчётов по уравнениям связи:
М = 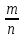 ; m = М ∙ n;
; m = М ∙ n;
n = 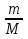
1.Определите степень окисления каждого химического элемента в соединениях.
а)СО2; б)H3PO4; в)SiH4;
г)KCl ; д) P2O5.
2.Какому количеству вещества соответствует:
а) СаО массой 40 г.;
б) Н2О массой 36 г.;
в) NaCl массой 1 кг?
Классифицирование сложных веществ
Из перечня формул веществ: NO2, CaSO4, Ba(OH)2, HNO3, NaCl, Fe2(SO4)3, KOH, Ca3(PO4)2, NaOH, K3PO4, H2SO4, CO2, H2CO3, Fe(OH)3, ZnSO4, HCl, NaNO3, HNО3, K2O, SO3 выпишите:
а) оксиды,
б) кислоты.
Назовите эти вещества
а) соли,
б) основания.
Назовите эти вещества
Вычисление по формулам веществ Mr, М и массовой доли химического элемента
Рассчитайте Mr, М фосфорных удобрений и массовую долю Р (фосфора) в этих удобрениях.
Фосфата кальция
Са3(РО4)2
Гидрофосфата кальция
СаНРО4


