- Преподавателю
- Химия
- Подготовка к ЕГЭ по химии. Амины
Подготовка к ЕГЭ по химии. Амины
| Раздел | Химия |
| Класс | - |
| Тип | Конспекты |
| Автор | Кисакова О.А. |
| Дата | 12.12.2014 |
| Формат | doc |
| Изображения | Есть |
АМИНЫ
Амины - органические производные аммиака NH3, в молекуле которого один, два или три атома водорода замещены на углеводородные радикалы:
R-NH2, R2NH, R3N
Простейший представитель - метиламин:
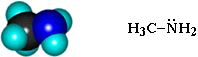
Строение
Атом азота находится в состоянии sp3-гибридизации, поэтому молекула имеет форму тетраэдра.
Также атом азота имеет два неспаренных электрона, что обуславливает свойства аминов как органических оснований.
КЛАССИФИКАЦИЯ АМИНОВ.
По количеству и типу радикалов, связанных с атомом азота:
АМИНЫ
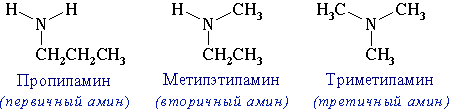
Первичные амины
Вторичные
амины
Третичные амины
Алифатические
CH3- NH2
Метиламин
(CH3)2NH
Диметиламин
(CH3)3N
Триметиламин
Ароматические
(C6H5)2NH
Дифениламин
НОМЕНКЛАТУРА АМИНОВ.
1. В большинстве случаев названия аминов образуют из названий углеводородных радикалов и суффикса амин. Различные радикалы перечисляются в алфавитном порядке. При наличии одинаковых радикалов используют приставки ди и три.
CH3-NH2 Метиламин СH3CH2-NH2 Этиламин
CH3-CH2-NH-CH3 Метилэтиламин (CH3)2NH Диметиламин


2. Первичные амины часто называют как производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на аминогруппы -NH2.
В этом случае аминогруппа указывается в названии приставкой амино-:
CH3-CH2-CH2-NH2 1-аминопропан H2N-CH2-CH2-CH(NH2)-CH3 1,3-диаминобутан
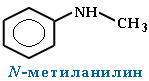 Для смешанных аминов, содержащих алкильные и ароматические радикалы, за основу названия обычно берется название первого представителя ароматических аминов анилин.
Для смешанных аминов, содержащих алкильные и ароматические радикалы, за основу названия обычно берется название первого представителя ароматических аминов анилин.
Символ N- ставится перед названием алкильного радикала, чтобы показать, что этот радикал связан с атомом азота, а не является заместителем в бензольном кольце.
ИЗОМЕРИЯ АМИНОВ
1) углеродного скелета, начиная с С4H9NH2:
СН3-СН2- СН2-СН2 -NH2н-бутиламин (1-аминобутан)
CH3-CH- СН2-NH2 изо-бутиламин (1-амин-2-метилпропан)
│
СН3
2) положения аминогруппы, начиная с С3H7NH2:
СН3-СН2- СН2-СН2 -NH21-аминобутан (н-бутиламин)
CH3-CH- СН2-СH3 2-аминобутан (втор-бутиламин)
│
NН2
3) изомерия между типами аминов - первичный, вторичный, третичный:
ФИЗИЧЕСКИЕ СВОЙСТВА АМИНОВ.
Первичные и вторичные амины образуют слабые межмолекулярные водородные связи:
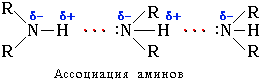
Это объясняет относительно более высокую температуру кипения аминов по сравнению с алканами с близкой молекулярной массой. Например:
Пропиламин (М=59)
t кип = 49оС
Бутан (М=58)
t кип = -0,5оС
Третичные амины не образуют ассоциирующих водородных связей (отсутствует группа N-H). Поэтому их температуры кипения ниже, чем у изомерных первичных и вторичных аминов:
Триэтиламин
t кип = 89 °С
н-Гексиламин
tкип = 133 °С
По сравнению со спиртами алифатические амины имеют более низкие температуры кипения, т.к. в спиртах водородная связь более прочная:
Метиламин
t кип = -6 °С
Метанол
t кип = +64,5 °С
При обычной температуре только низшие алифатические амины CH3NH2, (CH3)2NH и (CH3)3N - газы (с запахом аммиака), средние гомологи - жидкости (с резким рыбным запахом), высшие - твердые вещества без запаха.
Ароматические амины - бесцветные высококипящие жидкости или твердые вещества.
Амины способны к образованию водородных связей с водой:
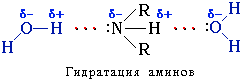
Поэтому низшие амины хорошо растворимы в воде.
С увеличением числа и размеров углеводородных радикалов растворимость аминов в воде уменьшается, т.к. увеличиваются пространственные препятствия образованию водородных связей. Ароматические амины в воде практически не растворяются.
Анилин: С6H5-NH2 - важнейший из ароматических аминов:
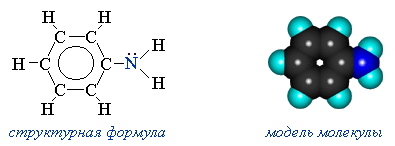
Он находит широкое применение в качестве полупродукта в производстве красителей, взрывчатых веществ и лекарственных средств (сульфаниламидные препараты).
Анилин - бесцветная маслянистая жидкость с характерным запахом. На воздухе окисляется и приобретает красно-бурую окраску. Ядовит.
ПОЛУЧЕНИЕ АМИНОВ.
1. Первичные амины можно получить восстановлением нитросоединений.
а) Гидрирование водородом: R-NO2 + H2 -t R-NH2 + H2O
б) Восстановление: в щелочной и нейтральной среде получаются амины:
R-NO2 + 3(NH4)2S R- NH2 + 3S + 6NH3 +2H2O (реакция Зинина)
R-NO2 + 2Al + 2KOH + 4H2O R- NH2 + 2K[Al(OH)4]
Восстановлением нитробензола получают анилин.
в) в кислой среде (железо, олово или цинк в соляной кислоте) получаются соли аминов: R-NO2 + 3Fe + 7HCl [RNH3+]Cl- + 2H2O + 3FeCl2
Амины из раствора выделяют с помощью щелочи:
[RNH3+]Cl- +КОН = H2O + КCl + R- NH2
2. Алкилирование аммиака и аминов. При взаимодействии аммиака с алкилгалогенидами происходит образование соли первичного амина, из которой действием щелочи можно выделить сам первичный амин. Этот амин способен взаимодействовать с новой порцией галогеналкана с образованием вторичного амина:
СH3Br + NH3 [CH3NH3]Br -(+KOH) CH3-NH2+ KBr + H2O первичный амин
CH3-NH2 + C2H5Br [CH3NH2+]Br- -(+KOH) CH3 - NH + KBr + H2O вторичный амин
│ │
C2H5 C2H5
Возможно дальнейшее алкилирование до третичного амина.
3.Восстановление нитрилов с образованием первичных аминов:
R-C N + 4[H]
N + 4[H] 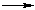 R-CH2NH2
R-CH2NH2
Этим способом в промышленности получают гексаметилендиамин, который используется в производстве полиамидного волокна найлон.
4. Взаимодействие аммиака со спиртами: R-OH + NH3 -(t,p) R -NH2 + H2O
ХИМИЧЕСКИЕ СВОЙСТВА АМИНОВ.
Амины имеют сходное с аммиаком строение и проявляют подобные ему свойства.
Как в аммиаке, так и в аминах атом азота имеет неподеленную пару электронов:

Поэтому амины и аммиак обладают свойствами оснований.
1. Основные свойства. Будучи производными аммиака, все амины обладают основными свойствами.
Алифатические амины являются более сильными основаниями, чем аммиак, а ароматические - более слабыми.
Это объясняется тем, что радикалы СН3-, С2Н5- и др. проявляют положительный индуктивный (+I) эффект и увеличивают электронную плотность на атоме азота:
СН3 → NH2
Это приводит к усилению основных свойств.
Фенильный радикал C6H5- проявляет отрицательный мезомерный (-М) эффект и уменьшает электронную плотность на атоме азота:
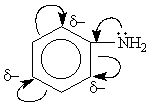
В водном растворе амины обратимо реагируют с водой, при этом среда становится слабощелочная: R-NH2 +H2O ⇄[R-NH3]++ OH-
2. Амины реагируют с кислотами, образуя соли: CH3-NH2 + H2SO4 [CH3NH3]HSO4
C6H5NH2 + HCl [C6H5NH3]Cl
Cоли аминов - твердые вещества без запаха, хорошо растворимые в воде, но не растворимые в органических растворителях (в отличие от аминов).
При действии щелочей на соли аминов выделяются свободные амины:
[CH3NH3]Cl + NaOH -t CH3NH2 + NaCl + H2O
Соли аминов вступают в обменные реакции в растворе:
[CH3NH3]Cl + AgNO3 -t [CH3NH3]NO3+ AgCl ↓
3. Амины способны осаждать гидроксиды тяжелых металлов из водных растворов: 2R-NH2 + FeCl2 + 2H2O Fe(OH)2↓+ 2[RNH3]Cl
4. Горение. Амины сгорают в кислороде, образуя азот, углекислый газ и воду:
4 С2Н5NH2 + 15O2 8CO2 + 2N2 + 14 H2O
5. Реакции с азотистой кислотой.
а) Первичные алифатические амины при действии азотистой кислоты превращаются в спирты: R-NH2 + NaNO2 + HCl R-OH +N2 + NaCl + H2O
б) Вторичные амины (алифатические и ароматические) дают нитрозосоединения - вещества с характерным запахом: R2NH + NaNO2 + HCl R2N-N=O + NaCl + H2O
Особенности свойств анилина:
Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу.
Особенности этих реакций обусловлены взаимным влиянием атомов.
- бензольное кольцо ослабляет основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком.
- бензольное кольцо становится более активным в реакциях замещения, чем бензол.
Аминогруппа - заместитель 1-го рода (активирующий орто-пара-ориентант в реакциях электрофильного замещения в ароматическом ядре).
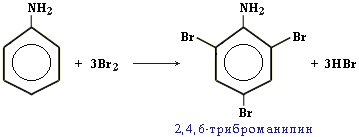
Качественная реакция на анилин: реагирует с бромной водой с образованием 2,4,6-триброманилина (белый осадок ↓).