- Преподавателю
- Химия
- Открытый урок по теме Гидролиз солей
Открытый урок по теме Гидролиз солей
| Раздел | Химия |
| Класс | - |
| Тип | Конспекты |
| Автор | Платонова В.К. |
| Дата | 07.12.2014 |
| Формат | doc |
| Изображения | Есть |

(урок на основе проблемно - исследовательской технологии)
-
Тип урока: Изучение нового материала.
-
Вид урока: Проблемно-исследовательский.
-
Цель урока: Сформировать у учащихся понятие гидролиза солей.
-
Задачи урока:
1. Развивать у школьников умение пользоваться опорными знаниями, закрепить умения и навыки химического эксперимента, умение работать с таблицами, справочными материалами.
2. Развивать мышление, умение делать логические выводы из наблюдений по опыту. Научить составлять ионное уравнение реакции гидролиза солей по первой стадии.
З. Сформировать понимание практического значения гидролиза в природе и жизни человека. -
Оборудование: Таблица сильных и слабых электролитов. Компьютерный терминал, дискета с презентациями поэтапного показа схем проведения опыта по гидролизу солей и анализа его результатов
-
Реактивы: растворы солей: хлорид алюминия, карбонат натрия, хлорид натрия, индикаторы - лакмус, фенолфталеин.
План урока 1. Повторение опорных знаний. -
Электролиты и неэлектролиты. Понятие степени электролитической диссоциации.
-
Таблица сильных и слабых электролитов.
-
Работа индикаторов в различных средах.
2. Подготовка таблицы для заполнения результатов опыта.
З. Эксперимент (изменение цвета индикаторов в растворах солей).
4. Схема эксперимента и выводы из опыта.
5. Доказательство через уравнения реакции.
6. Определение понятия гидролиз солей.
7. Выполнение упражнений.
8. Значение гидролиза в природе и практической деятельности человека.
9. Домашнее задание.
Ход урока:
I этап урока - подготовка к изучению нового материала, актуализация знаний и опыта
Содержание урока
работы учителя
Формы и методы работы учителя
Виды деятельности
учащихся
1.Опорные вопросы:
-
Какие вещества называются электролитами и неэлектролитами?
-
Что показывает степень электролитической диссоциации?
-
Как индикаторы
изменяют свой цвет
в кислой и щелочной среде? -
Какие вы знаете
индикаторы?
Фронтальный опрос в форме беседы
Учащимся предложена таблица сильных и слабых электролитов
На экране терминала показываем цвета индикаторов в разных средах
Устные ответы на вопросы учителя
Объяснение формулы у доски.
Запись на доске и в тетради
Делается вывод о том, какие ноны отвечают за цвет индикаторов
2.Подготовка таблицы для занесения результатов опыта
Таблица заранее нарисована на доске
Построение таблицы в тетради
3.Проведение лабораторного опыта учащимися.
-
Правила техники безопасности при работе с химическими веществами
-
Проведение лабораторного опыта
Занести результаты опытов в таблицу на доске .
При проведении лабораторного опыта учащиеся исследуют изменение цвета выданных индикаторов (фенолфталеина, лакмуса и метилового оранжевого) в водной среде
II этап урока - проблемная задача. Обсуждение в парах. Ответ формулируется учащимися
Учащиеся после проведения опыта заносят результаты в таблицу и делают самостоятельно вывод, что соли имеют кислую и щелочную реакцию.
Учитель задает вопросы:
1. Какие ионы окрашивают лакмус в красный цвет?
2. Какие ноны отвечают за цвет индикатора в щелочной среде?
З. Есть ли эти ионы в солях?
4. Является ли вода электролитом?
5. На какие ионы диссоциирует вода?
Учащиеся должны догадаться, что они исследовали водные растворы солей.
Учащиеся делают вывод, что вода участвует в гидролизе и дает ионы водорода и гидроксогруппы, избыток которых изменяет цвет индикаторов. Записывают в графу «Какие ионы» в следующей таблице:
Формула соли
фенолфталеин
лакмус
Метиловый оранжевый
реакция
Какие ионы
AlCl3
--
кислая
Н+>
Na2CO3
щелочная
OH->
NaCl
--
нейтральная
H+= OH-
III этап урока - самостоятельный поиск информации в таблице, составление упрощенной схемы гидролиза солей, вывод и определение понятия гидролиза по схеме.
На этом этапе урока учитель демонстрирует упрощенную схему на экране компьютера с заранее созданными слайдами.

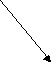 AlCl3
AlCl3
 Al(OH)3 HCl
Al(OH)3 HCl
слабое основание сильная кислота
[ОН]- < [H]+
Учащиеся делают вывод и записывают определение, используя данную схему.
Соль, образованная слабым основанием и сильной кислотой, имеет кислую реакцию, так как в растворе избы ток ионов водорода.
Аналогично составляются схемы по другим солям и делаются соответствующие выводы.

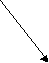
 Na2CO3
Na2CO3
NaOH H2CO3
cильное основание слабая кислота
Соль, образованная сильным основанием и слабой кислотой, имеет щелочную реакцию, так как в растворе избыток гидроксид-ионов.
Далее учитель просит ребят самостоятельно составить аналогичную схему для хлорида натрия.

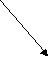 NaCl
NaCl
NaOH HCl
сильное основание сильная кислота
ОН- = Н+
IV этап урока - формирование решения проблемы, обсуждение в группах и фронтальные ответы
Учитель обращает внимание учащихся на то, что взаимодействие ионов соли с ионами воды приводит к наличию в растворах солей избытка ионов водорода или гидроксид-ионов.
Делается вывод, что гидролиз - это реакция обмена между некоторыми солями и водой: «гидро» - вода, «лизис» - разложение.
Затем составляются уравнения диссоциации соли и воды, с помощью которых доказывается получение избытка ионов водорода и гидроксид-ионов.
Избыток инов водорода дает соли кислую реакцию, поэтому лакмус краснеет.
Избыток гидроксид-ионов дает соли щелочную реакцию, поэтому лакмус синеет, а фенолфталеин становится малиновым.
V этап урока - закрепление изученного материала
1. На экран компьютера проецируется задание:
• Какую реакцию будут иметь водные растворы следующих солей:
1 вариант 2 вариант
а) нитрата цинка а) карбоната калия
б) сульфата калия б) сульфита натрия
в) сульфида натрия в) нитрата бария
• Составьте упрощенную схему гидролиза этих солей.
• Составьте ионное уравнение гидролиза этих солей.
2. Затем на экран проецируются правильные ответы на эти вопросы, а учащимся предлагается поменяться с соседом тетрадями, проверить задания и выставить друг другу оценки (или проверить и самим себе поставить оценку).
З. Учитель просит поднять правую руку тех учащихся, которые получили «5» и «4, и левую руку, которые получили «З».
4. Объективность поставленных оценок проверяется учителем после урока при проверке домашнего задания.
VI этап урока - подведение итогов
Беседа учителя с учащимися.
Учитель рассказывает о большом практическом значении гидролиза для человека, касаясь органических веществ: спиртов, сложных эфиров, жиров, мыла, крахмала, целлюлозы, которые учащиеся подробно будут изучать в 10 классе.
Гидролизу подвергаются всем хорошо известные органические вещества. Происходит это под действием биологических катализаторов ферментов. В организме человека под действием следующих ферментов происходит гидролиз: амилаза фермент крахмала
целлюлаза фермент целлюлозы
протеаза фермент белка
Продукты гидролиза жира всасываются ворсинками кишечника, а затем в организме образуется жир, но уже свойственный данному организму. Потоками крови жиры переносятся в другие органы и ткани организма, где накапливаются или снова гидролизуются и постепенно окисляются до углекислого газа и воды.
В промышленности гидролизу подвергаются сложные эфиры и жиры обязательно в щелочной среде. Такая реакция называется омылением. На этой реакции основано производство мыла, однако в настоящее время на производство моющих средств идут главным образом продукты переработки нефти.
В технике крахмал подвергают гидролизу при взаимодействии с разбавленной серной кислотой и превращают в глюкозу (это реакция Кирхгофа, 1811 г). Продукты гидролиза крахмала широко используются в кондитерской промышленности, медицине, для технических целей.
Продукты гидролиза целлюлозы это бумага, хлопчатобумажные ткани. Подводится контроль результатов работы учащихся на уроке с аргументацией поставленных оценок: пояснением активности их работы, правильности ответов и уровня сложности задания.
Домашнее задание.
Пользуясь следующей таблицей, приведите свои примеры солей, которые будут иметь кислую, щелочную и нейтральную реакцию, и напишите к ним ионные уравнения гидролиза.
Основания
Кислоты
Соли
Сильные α > 30%
Гидроксиды щелочных и щелочноземельных металлов: LiOH, KOH, NaOH, RbOH, CsOH, Ca(OH)2, Ba(OH)2, Sr(OH)2
HCl, H2SO4, HNO3, HIO3, HI, HBr, HClO4, HBrO3, HClO3
Все растворимые соли: хлориды, бромиды, Йодиды, сульфаты, сульфиты, сульфиды щелочных металлов и аммония
Средние
3% < α < 30%
H3PO4, H2SO3
Слабые α <3%
NH4OH и все труднорастворимые основания
H2CO3, H2S, HCN, HClO, HClO2, HBO3, H3PO3, H2SiO3, H3AsO4, H2SnO4
![]()