- Преподавателю
- Химия
- МУ и КЗ органическая химия
МУ и КЗ органическая химия
| Раздел | Химия |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Шакирова Р.Х. |
| Дата | 31.12.2015 |
| Формат | doc |
| Изображения | Есть |
МИНОБРНАУКИ РОССИИ
Федеральное государственное бюджетное образовательное учреждение
высшего профессионального образования
«Югорский государственный университет»
НИЖНЕВАРТОВСКИЙ НЕФТЯНОЙ ТЕХНИКУМ (филиал)
Федерального государственного бюджетного образовательного учреждения
высшего профессионального образования
«Югорский государственный университет»
ОП.03
«ОРГАНИЧЕСКАЯ ХИМИЯ»
Методические указания и контрольные задания
для студентов заочной формы обучения образовательных учреждений
среднего профессионального образования
специальности 240134 «Переработка нефти и газа»
Нижневартовск 2014
Рассмотрено
На заседании кафедры ЕиЭД
Протокол № от 2014г.
Председатель
____________Л.В.Рвачева
УТВЕРЖДАЮ
Председатель методического совета ННТ (филиал) ФГБОУ ВПО «ЮГУ»
_____________ Т.А. Дмитриева
«____»__________ 2014г.
Методические указания и контрольные задания для студентов-заочников по ОП.03 «Органическая химия» разработаны в соответствии:
1. Федерального государственного образовательного стандарта (далее - ФГОС) по специальности среднего профессионального образования (далее - СПО) 240134 Переработка нефти и газа; утвержденного 17 ноября 2009 г;
2. Программы общепрофессиональной дисциплины (ОП.03) Органическая химия, утвержденной 12 сентября 2013 г.
Разработчик:
Шакирова Рема Харисовна, высшая квалификационная категория, преподаватель Нижневартовского нефтяного техникума (филиал) ФГБОУ ВПО «ЮГУ».
Рецензенты:
1.Терентьева Е.Н., высшая квалификационная категория, преподаватель Нижневартовский нефтяной техникум (филиал) ФГБОУ ВПО «ЮГУ».
2. Ткаченко Л.А., заслуженный учитель РФ, высшая квалификационная категория, МБОУ «СОШ №14».
Замечания, предложения и пожелания направлять в Нижневартовский нефтяной техникум (филиал) федерального государственного бюджетного образовательного учреждения высшего профессионального образования «Югорский государственный университет» по адресу: 628615, Тюменская обл., Ханты-Мансийский автономный округ, г. Нижневартовск, ул. Мира, 37.
© Нижневартовский нефтяной техникум (филиал) ФГБОУ ВПО «ЮГУ», 2014 г
Нижневартовский нефтяной техникум (филиал) ФГБОУ ВПО «ЮГУ», 2014 г
ВВЕДЕНИЕ
Методические указания и контрольные задания для студентов 3-го курса заочной формы обучения по дисциплине «Органическая химия» разработаны в соответствии с Федеральным государственным образовательным стандартом среднего (полного) общего образования, реализуемого в пределах образовательных программ среднего профессионального образования, с учетом профиля получаемого профессионального образования (п.2. ст.20 Закона «Об образовании» в ред. от 01.12.2007 г. №309 - ФЗ), в соответствии с федеральными базисными учебными планами для образовательных учреждений Российской федерации, реализующих программы общего образования (приказ Минобразования России от 09.03.2004 г. №1312 в редакции приказов Минобрнауки России от 20.08.2008 г. №241 и от 30.08.2010 г. №889) для специальности 240134 «Переработка нефти и газа».
Методические указания и контрольные задания содержат методические указания к выполнению контрольной работы, варианты контрольных работ, методические указания к решению задач с подробным разбором решения примерных задач различными способами.
Цель методической разработки: закрепление полученных теоретических знаний, умение работать с теоретическим материалом, использовать приобретенные знания в практической и профессиональной деятельности.
1 ПАСПОРТ УЧЕБНОЙ ДИСЦИПЛИНЫ
«ОРГАНИЧЕСКАЯ ХИМИЯ»
-
Область применения общепрофессиональной дисциплины
Учебная дисциплина «Органическая химия» для студентов 3-го курса заочной формы обучения специальности 240134 Переработка нефти и газа предназначена для изучения органической химии в учреждениях среднего профессионального образования, реализующих образовательную программу среднего (полного) общего образования, при подготовке специалистов среднего звена.
Методические указания и контрольные задания для студентов 3-го курса заочной формы обучения специальности 240134 Переработка нефти и газа построены с учетом принципов системности, научности, доступности и преемственности, что позволит студентам формировать интерес к профессии, развивать творческие способности и коммуникативные компетенции специалиста.
-
Место учебной дисциплины в структуре основной профессиональной образовательной программы:
П00. Профессиональный цикл. ОП.03. Общепрофессиональные дисциплины
1.3 Цели и задачи учебной дисциплины - требования к результатам освоения учебной дисциплины:
В результате освоения учебной дисциплины «Органическая химия» обучающийся должен обладать общими компетенциями, включающими в себя способность:
- организовывать собственную деятельность, выбирать типовые методы и способы выполнения профессиональных задач, оценивать их эффективность и качество;
- принимать решения в стандартных и нестандартных ситуациях и нести за них ответственность;
- осуществлять поиск и использование информации, необходимой для эффективного выполнения профессиональных задач, профессионального и личностного развития;
- использовать информационно-коммуникационные технологии в профессиональной деятельности;
- работать в коллективе и команде, эффективно общаться с коллегами, руководством, потребителями;
- брать на себя ответственность за работу членов команды (подчиненных), результат выполнения заданий;
- самостоятельно определять задачи профессионального и личностного развития, заниматься самообразованием, осознанно планировать повышение квалификации;
- ориентироваться в условиях частой смены технологий в профессиональной деятельности.
В результате освоения учебной дисциплины «Органическая химия» студент должен
уметь:
- составлять и изображать структурные полные и сокращенные формулы органических веществ и соединений;
- определять свойства органических соединений для выбора методов синтеза углеводородов при разработке технологических процессов;
- описывать механизм химических реакций получения органических соединений;
- составлять качественные химические реакции, характерные для определения различных углеводородных соединений;
- прогнозировать свойства органических соединений в зависимости от строения молекул;
- решать задачи и упражнения по генетической связи между различными классами органических соединений;
- определять качественными реакциями органические вещества, проводить количественные расчеты состава вещества;
- применять безопасные приемы при работе с органическими реактивами и химическими приборами;
- проводить реакции с органическими веществами в лабораторных условиях; проводить химический анализ органических веществ и оценивать его результаты;
знать:
- влияние строения молекул на химические свойства органических веществ;
- влияние функциональных групп на свойства органических веществ;
- изомерию как источник многообразия органических соединений;
- методы получения высокомолекулярных соединений;
- особенности строения органических веществ, их молекулярное строение, валентное состояние атома углерода;
- особенности строения и свойства органических веществ, содержащих в составе молекул атомы серы, азота, галогенов, металлов;
- особенности строения и свойства органических соединений с большой молекулярной массой;
- природные источники, способы получения и области применения органических соединений;
- теоретические основы строения органических веществ, номенклатуру и классификацию органических соединений;
- типы связей в молекулах органических веществ.
-
Рекомендуемое количество часов на освоение программы учебной дисциплины при заочной форме обучения:
Для изучения учебной дисциплины «Органическая химия» на базе среднего профессионального образования, реализующего образовательную программу среднего (полного) общего образования, при подготовке квалифицированных рабочих и специалистов среднего звена выделяется максимальной учебной нагрузки обучающегося 147 часов, в том числе:
- обязательной аудиторной учебной нагрузки студента 28 часов (из них 12 часов - лекционные занятия, 16 часов - лабораторные работы);
- самостоятельной работы обучающегося 119 часов
-
СТРУКТУРА И СОДЕРЖАНИЕ
УЧЕБНОЙ ДИСЦИПЛИНЫ
2.1 Объем учебной дисциплины и виды учебной работы при заочной форме обучения
Вид учебной работы
Объем часов
Максимальная учебная нагрузка (всего)
147
Обязательная аудиторная учебная нагрузка (всего)
28
в том числе:
лекционные занятия
12
лабораторные работы
16
практические занятия
-
контрольные работы
1
Самостоятельная работа студента (всего)
119
в том числе: внеаудиторная самостоятельная работа (работа над материалом учебника, конспектом лекций, выполнение индивидуальных заданий), контрольная работа
Форма контроля: дифференцированный зачет
2.2 Тематический план и содержание учебной дисциплины
ОП.03 «Органическая химия»
Наиме-нование разделов и тем
Содержание учебного материала, лабораторные работы и практические занятия, самостоятельная работа обучающихся, курсовая работа (проект) (если предусмотрены)
Объем часов
Уровень ос-воения
1
2
3
4
Раздел 1
СОСТАВ И СТРОЕНИЕ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Тема 1.1
Общие вопросы теории химического строения органических соединений
1.Теория органического строения органических соединений А.М.Бутлерова. Понятие гибридизации. Изомерия по положению углеродного скелета
2
2
Тема 1.2
Элементарный анализ органических соединений
2. Лабораторная работа №1. Установление качественного состава органических веществ
2
2
3. Элементарный анализ качественного состава органических соединений. (Вывод молекулярных формул органических веществ по массовым долям элементов и по продуктам сгорания органических веществ)
2
2
Раздел 2
УГЛЕВОДОРОДЫ
4. Понятие углеводородов (алканы, алкены, алкины, арены)
2
2
5. Ацетиленовые углеводороды. Лабораторная работа №2. Получение ацетилена и подтверждение опытным путем его непредельности
2
2
6. Ароматические углеводороды. Лабораторная работа №3. Исследование физических и химических свойств аренов (бензола, толуола)
2
2
Раздел 3
МНОГОФУНКЦИОНАЛЬНЫЕ СОЕДИНЕНИЯ
7. Понятие функциональной группы. Спирты: одноатомные, многоатомные, фенолы
2
2
8. Лабораторная работа №4. Исследование свойств одноатомных и многоатомных спиртов. Получение диэтилового эфира
2
2
9. Лабораторная работа №5. Исследование химических свойств фенола
2
2
10. Общая характеристика альдегидов, кетонов, карбоновых кислот
2
2
11. Лабораторная работа №6. Исследование свойств альдегидов и кетонов
2
2
12. Лабораторная работа №7. Исследование свойств карбоновых кислот и их производных
2
2
13. Углеводы. Лабораторная работа №8. Свойства углеводов
2
2
14. Состав, строение, классификация, номенклатура, способы получения и свойства аминоспиртов и аминокислот. Белки
2
2
ИТОГО
28
Внеаудиторная самостоятельная работа
1.
Химические свойства, получение и применение углеводородов алициклического строения, их изомерия и номенклатура
12
1
2.
Циклоалканы. Классификация, номенклатура, изомерия. Свойства циклопарафинов. Получение и применение циклоалканов
6
1,2
3.
Каучуки природные и синтетические (геометрическая изомерия). Резина. Пластмассы
5
1,2
4.
Нефть и продукты ее переработки (бензин, керосин и т.д.)
8
2
5.
Спирты. Классификация, строение, свойства, применение спиртов
12
1
6.
Фенолы. Строение, свойства, получение, применение многоатомных спиртов и фенолов в народном хозяйстве
4
1
7.
Альдегиды и карбоновые кислоты. Строение, свойства, применение
16
1
8.
Сложные эфиры карбоновых кислот. Липиды
4
1
9.
Общая характеристика нитросоединений и аминов
8
1
10.
Органические соединения серы: тиолы, сульфокислоты
8
1
11.
Металлоорганические соединения
8
1
12.
Аминокислоты и их роль в живой природе. Белки, жиры, гормоны, ферменты
10
1,2
13.
Высокомолекулярные соединения
8
2
14.
Нуклеиновые кислоты и их роль в живых организмах
10
1
ИТОГО
119
Для характеристики уровня освоения учебного материала используются следующие обозначения:
1.- ознакомительный (узнавание ранее изученных объектов, свойств);
2. репродуктивный (выполнение деятельности по образцу, инструкции или под руководством);
3. продуктивный (планирование и самостоятельное выполнение деятельности, решение проблемных задач)
2.3 КРАТКИЕ ТЕОРЕТИЧЕСКИЕ СВЕДЕНИЯ
Органическая химия - это химия соединений углерода, изучает состав, строение, превращения углеводородов и их производных. В состав органических веществ, кроме атомов углерода и водорода, могут входить другие элементы - органогены: кислород, азот, сера, фосфор, галогены. Если в составе органических соединений содержатся атомы кислорода, то соединения называют кислородсодержащие. Если содержатся атомы азота, то - азотсодержащие и т.д. Для таких соединений вводят понятие «функциональная группа», т.е. группа атомов, которая определяет характерные признаки класса. К кислородсодержащим относятся: спирты, альдегиды, кетоны, карбоновые кислоты, эфиры, углеводы и т.д. Гетерофункциональные соединения содержат одновременно несколько функциональных групп. Важнейшими представителями таких соединений являются аминокислоты, аминоспирты.
Органические вещества использовались человечеством с глубокой древности. Такие вещества, как уксус, жиры, масла, природные красители, крахмал и другие были известны многим народам мира, которые умели получать их из различных природных соединений. Несмотря на это, наука сформировалась только в начале 19 века, именно тогда (1807 г.) Берцелиус впервые ввел термин «органические вещества» и «органическая химия».
Теория химического строения органических веществ А.М.Бутлерова является определяющей теорией курса органической химии. При изучении теории необходимо обратить внимание на валентные возможности атома углерода, образование простых и кратных связей. Большое значение имеет последовательность соединения атомов в молекуле, т.е. структурные формулы. Необходимо различать понятия «гомологи» и «изомеры».
Многие органические вещества можно получить из природных источников: нефти, газов, угля, что позволяет снизить стоимость органических веществ и сделать применение их более доступным.
2.4. ТРЕБОВАНИЯ К ВЫПОЛНЕНИЮ
КОНТРОЛЬНОЙ РАБОТЫ
После изучения основных ключевых вопросов дисциплины студенты выполняют контрольную работу. Контрольная работа содержит 30 вариантов. Задание на контрольную работу содержит три теоретических вопроса и две задачи. Работа оформляется в ученической тетради в клетку. Следует пронумеровать страницы и оставить поля для замечаний преподавателя. На обложке тетради должен быть приклеен титульный лист установленного образца. Задания своего варианта следует переписать и выполнять по порядку. При решении задач необходимо соблюдать правила оформления. В конце работы указать литературу, которой пользовались, проставить дату выполнения работы и подпись. Если в работе допущены недочеты и ошибки, то студент обязан исправить все указания преподавателя, сделанные в рецензии. Контрольные работы должны быть выполнены в срок. В период сессии работы на проверку не принимаются. Работа, выполненная не по своему варианту, не учитывается и возвращается студенту.
Если в ходе выполнения контрольной работы возникают затруднения, с которыми студент не может справиться самостоятельно, то он может обратиться к преподавателю за получением консультации.
2.5 ТАБЛИЦА ВАРИАНТОВ КОНТРОЛЬНОЙ РАБОТЫ
Каждый студент - заочной формы обучения выполняет вариант контрольной работы, обозначенный двумя последними цифрами в зачетной книжке.
предпоследний №
последний №
0
1
2
3
4
5
6
7
8
9
0
13
10
20
30
13
23
3
13
23
3
1
1
11
21
4
14
24
4
14
24
4
2
2
12
22
5
15
25
5
15
25
5
3
3
13
23
6
16
26
6
16
26
6
4
4
14
24
7
17
27
7
17
27
7
5
5
15
25
8
18
28
8
18
28
8
6
6
16
26
9
19
29
9
19
29
9
7
7
17
27
10
20
30
10
20
30
10
8
8
18
28
11
21
1
11
21
1
11
9
9
19
29
12
22
2
12
22
2
12
2.6 ЗАДАНИЯ ДЛЯ КОНТРОЛЬНОЙ РАБОТЫ
Вариант 1.
1. Теория химического строения А.М. Бутлерова:
а) предпосылки возникновения ТХС;
б) основные положения ТХС, подтвердить примерами;
в) направления развития теории: стереохимическое строение (о пространственном расположении атомов в молекулах) и электронное строение.
-
Природные газы и их использование, подтвердите уравнениями химических реакций.
-
Фенолы. Химические свойства и способы получения фенолов.
-
Задача. Выведите формулу углеводорода, содержащего 82,75% углерода. Относительная плотность этого вещества по воздуху равна 2. Назовите это вещество.
-
Задача. При сгорании органического соединения массой 0,9г получили оксид углерода (4) массой 1,76 г, воду массой 1,76 г и азот. Относительная плотность этого вещества по водороду равна 22,5. Выведите молекулярную формулу вещества и дайте ему название.
Вариант 2.
1. Структуры соединения атомов углерода (разветвленные, циклические), различные функциональные группы в органических веществах (спиртовая, альдегидная, кислотная, простого и сложного эфиров).
2. Нефть. Состав нефти и способы ее переработки.
3. Альдегиды. Строение, изомерия и химические свойства альдегидов. Сравните с кетонами.
4. Задача. Выведите формулу органического вещества, содержащего 81,8% углерода и 18,2% водорода, если относительная плотность по водороду равна 22. Дайте ему название.
5. Задача. При сжигании органического соединения массой 4,2 г получили оксид углерода (4) массой 13,2 г и воду массой 5,4 г. Относительная плотность этого вещества по воздуху равна 2,9. Выведите молекулярную формулу органического соединения и дайте ему название.
Вариант 3.
1. Явления изомерии и гомологии, виды изомерии (примеры). Причины многообразия органических веществ. Значение теории А.М. Бутлерова.
2. Химические свойства и получение одноатомных спиртов. Сравните с многоатомными спиртами.
3. Дать понятия ферментам, сравните с неорганическими катализаторами.
4. Задача. Выведите молекулярную формулу углеводорода, содержащего 85,71% углерода. Относительная плотность паров этого вещества по водороду равна 21. Дайте название углеводороду.
5. Задача. При сжигании 4,3 г углеводорода получили 13,2 г оксида углерода (4). Относительная плотность паров этого вещества по водороду равна 43. Выведите молекулярную формулу вещества и дайте ему название.
Вариант 4.
1. Типы химических реакций в органической химии: реакции присоединения, отщепления, замещения и изомеризации. Разновидности их: реакции гидрирования, гидрогалогенирования, галогенирования, гидратации. Реакции полимеризации и поликонденсации. Реакции дегидрирования, дегидратации, крекинга, гидролиза, этерификации.
2. Карбоновые кислоты. Химические свойства карбоновых кислот, сравните со свойствами неорганических. Отдельные представители карбоновых кислот, их роль в природе.
3. Понятие о гормонах, их роль для живых организмов.
4. Задача. Выведите молекулярную формулу и дайте название углеводороду, содержащему 85,7% углерода. Относительная плотность паров этого вещества по водороду равна 14.
5. Задача. При сгорании 3,6 г углеводорода образовалось 11 г оксида углерода (4) и 5,4 г воды. Относительная плотность этого вещества по водороду равна 36. Выведите молекулярную формулу вещества и дайте ему название.
Вариант 5.
1. Классификация органических соединений по строению углеродного скелета: ациклические углеводороды (алканы, алкены, алкадиены, алкины); карбоциклические углеводороды (циклоалканы, арены) и гетероциклические соединения. Классификация органических веществ по функциональным группам: спирты, фенолы, простые эфиры, альдегиды, кетоны, карбоновые кислоты, сложные эфиры, амины. Гетерофункциональные органические соединения: углеводы, аминокислоты, белки.
2. Изомерия и свойства предельных углеводородов.
3.Общие понятия о лекарственных веществах. Сульфамиды и антибиотики.
4. Задача. Выведите молекулярную формулу углеводорода, содержащего 92,3% углерода. Относительная плотность паров этого вещества по водороду равна 13. Дайте название веществу.
5. Задача. При сжигании 36 г органического соединения получили оксид углерода (4) массой 52,8 г и воду массой 21,6 г. Относительная молекулярная масса вещества равна 180. Выведите молекулярную формулу этого вещества и дайте ему название.
Вариант 6.
1. Предельные углеводороды (алканы). Электронное и пространственное строение молекулы метана, sp3 - гибридизация. Гомологический ряд алканов, изомерия и номенклатура. Природные источники предельных углеводородов, промышленные и лабораторные способы их получения.
2. Получение карбоновых кислот. Важнейшие представители: муравьиная, уксусная, высшие и непредельные карбоновые кислоты.
3. Витамины, классификация, представители и значение.
4. Задача. Определите молекулярную формулу углеводорода, содержащего 80% углерода. Относительная плотность паров этого вещества по водороду равна 15. Дайте название углеводороду.
5. Задача. При сжигании 25,2 г углеводорода образовалось 40,32 л оксида углерода (4) (н.у.) и 32,4 г воды. Плотность этого вещества равна 1,875 г/л. Выведите молекулярную формулу вещества и дайте ему название.
Вариант 7.
1. Физические и химические свойства предельных углеводородов. Реакции замещения, окисления, дегидрирования, ароматизации. Реакции, приводящие к разрушению углеродной цепи: пиролиз, крекинг, изомеризация. Промышленная переработка нефти, природного и попутного нефтяного газов. Применение предельных углеводородов.
2. Свойства и применение непредельных, ароматических, двухосновных карбоновых кислот.
3. Амины. Сравните свойства метиламина и анилина с аммиаком.
4. Задача. Выведите молекулярную формулу углеводорода, содержащего 82,8 % углерода. Плотность этого вещества при н.у. составляет 2,59 г/л. Дайте название веществу.
5. Задача. При сжигании 1,2 г органического соединения получили оксид углерода (4) массой 3,52 г и воду массой 2,16 г. Плотность вещества равна 1,35 г/л. Выведите молекулярную формулу этого вещества и дайте ему название.
Вариант 8.
1. Этиленовые углеводороды (алкены). Электронное и пространственное строение этилена, sp2 - гибридизация. Гомологический ряд алкенов, изомерия и номенклатура. Промышленные и лабораторные способы получения этиленовых углеводородов. Физические и химические свойства олефинов, их использование в промышленности.
2. Изомерия одноатомных спиртов. Получение в лаборатории и промышленности.
3. Аминокислоты как амфотерные органические соединения. Биологические функции аминокислот.
4. Задача. Выведите молекулярную формулу вещества, содержащего 52 % углерода, 35 % кислорода, 13 % водорода. Относительная плотность паров этого вещества по водороду равна 23. Дайте название веществу.
5. Задача. При сгорании 1,8 г органического соединения образовалось 3,96 г оксид углерода (4) и 1,96 г воды. Относительная плотность паров этого вещества по водороду равна 30. Выведите молекулярную формулу вещества и дайте ему название.
Вариант 9.
1. Особенности строения и химических свойств сопряженных диеновых углеводородов. Реакции 1,2 - и 3,4 - присоединения. Реакции полимеризации этиленовых и диеновых углеводородов. Важнейшие полимеры: полиэтилен, полипропилен, поливинилхлорид, полистирол. Природный и синтетический каучуки. Сополимеризация. Резина.
2. Спирты. Отдельные представители одноатомных спиртов, их физиологическое действие. Понятие многоатомных спиртов, их получение и применение.
3. Понятие нуклеиновых кислот, их биологическая роль.
4. Задача. Выведите молекулярную формулу хлорпроизводного предельного углеводорода, содержащего 83,53 % хлора, 2,35 % водорода и 14,12 % углерода. Относительная молекулярная масса этого вещества равна 85. Дайте название веществу.
5. Задача. При сгорании углеводорода массой 2,34 г образовался оксид углерода (4) объемом 4,032 л. Относительная плотность паров этого вещества по водороду равна 39. Выведите молекулярную формулу углеводорода и дайте ему название.
Вариант 10.
1. Ацетиленовые углеводороды (алкины). Электронное и пространственное строение ацетилена, sp - гибридизация. Гомологический ряд алкинов, изомерия и номенклатура. Получение ацетилена карбидным методом и пиролизом углеводородного сырья. Физические и химические свойства алкинов, их применение.
2. Эфиры. Строение, свойства и применение сложных эфиров.
3. Понятие белков, их химические свойства. Пищевая ценность белков.
4. Задача. Относительная плотность паров органического вещества по водороду равна 30. Определите молекулярную формулу этого вещества, если массовая доля углерода в нем равна 40%, водорода - 6,7 %, а кислорода - 53,3 %. Назовите вещество.
5. Задача. При сжигании 2,52 г органического соединения выделилось 7,92 г оксида углерода (4) и 3,24 г воды. Относительная плотность этого вещества по воздуху равна 2,9. Выведите молекулярную формулу вещества и дайте ему название.
Вариант 11.
1. Понятие о циклоалканах. Изомерия и номенклатура циклопарафинов. Особенности строения и химических свойств в зависимости от размера цикла, сравнение циклоалканов с предельными и этиленовыми углеводородами.
2. Полисахариды. Сравните строение, свойства и применение крахмала и целлюлозы.
3. Дать понятия пептидам, их физиологическая роль. Структура белка.
4. Задача. Определите молекулярную формулу вещества, содержащего 37,5 % углерода, 12,5 % водорода, 50 % кислорода. Плотность этого вещества при н.у. 1,4285г/л. Назовите вещество и дайте ему название.
5. Задача. При сжигании 2,24 г углеводорода образовалось 7,04 г оксида углерода (4). Относительная плотность паров этого вещества по водороду равна 57. Выведите молекулярную формулу вещества и дайте ему название.
Вариант 12.
1. Ароматические углеводороды (арены). Электронное и пространственное строение бензола, понятие ароматичности. Физические свойства аренов. Реакции по ароматическому циклу и углеводородному радикалу. Реакции электрофильного замещения как основное свойство аренов. Взаимное влияние атомов в молекуле на примере толуола.
2. Дисахариды. Строение, свойства, применение, получение сахарозы.
3. Аминокислоты. Строение, классификация, номенклатура и изомерия.
4. Задача. Выведите молекулярную формулу вещества, содержащего 54,55% углерода, 9,09% водорода и 36,36% кислорода. Относительная плотность паров этого вещества по водороду равна 22. Дайте название веществу.
5. Задача. При сгорании 3,9 г органического соединения образовалось 13,2г оксида углерода (4) и 2,7 г воды. Относительная плотность этого вещества по водороду равна 39. Выведите молекулярную формулу вещества и дайте ему название.
Вариант 13.
1. Строение, классификация, изомерия и номенклатура спиртов. Анализ физических и химических свойств спиртов на основании их электронного строения (водородная связь, реакции с разрывом «О - Н» и «С-О» связи). Важнейшие представители одноатомных спиртов: метанол и этанол, их физиологическое действие. Применение спиртов.
2. Нафтены. Строение, изомерия, свойства, получение и нахождение в природе циклоалканов.
3. Понятие, применение и классификация углеводов, привести примеры.
4. Задача. Выведите молекулярную формулу органического соединения, содержащего 40 % углерода, 6,7 % водорода, 53,3 % кислорода. Относительная молекулярная масса этого вещества равна 180. Назовите вещество.
5. Задача. При сгорании 2,76 г ароматического углеводорода получили 9,24 г оксида углерода (4) и 2,16 г воды. Относительная плотность вещества по водороду равна 39. Выведите молекулярную формулу этого вещества и дайте ему название.
Вариант 14.
1. Особенности строения и химических свойств многоатомных спиртов. Получение этиленгликоля и глицерина. Качественная реакция на многоатомные спирты. Реакция поликонденсации, получение и свойства полиэтиленгликольтерефтолата. Понятие о синтетических волокнах на примере лавсана.
2. Изомерия. Показать все возможные виды изомерии на примере алкенов.
3. Валентные возможности атома углерода, гибридизация.
4. Задача. Выведите молекулярную формулу органического вещества содержащего 65,75 % углерода, 15,06 % водорода и 19,18 % азота. Относительная плотность паров этого вещества по воздуху равна 2,52. Дайте название веществу.
5. Задача. При полном сжигании 0,7 г газообразного углеводорода получили 1,12 л оксида углерода (4) (н.у.) и 0,9 г воды. Относительная плотность по водороду равна 42. Определите молекулярную формулу этого углеводорода и дайте ему название.
Вариант 15.
1. Гомологический ряд одноатомных фенолов. Промышленное получение фенола, его физические свойства. Химические свойства фенола как следствие взаимного влияния атомов в молекуле. Поликонденсация фенола и формальдегида. Применение фенола и его аналогов.
2. Свойства предельных углеводородов. Промышленные способы получения.
3. Строение и свойства жиров, их роль в природе.
4. Задача. Выведите молекулярную формулу органического соединения, содержащего 38,7 % углерода, 16,2 % водорода и азот. Относительная плотность паров этого вещества по водороду равна 15,5. Назовите вещество.
5. Задача. При сжигании 4,4 г углеводорода получили 6,72 л оксида углерода (4) (н.у) и 7,2 г воды. Плотность этого вещества равна 1,97 г/л. Определите его молекулярную формулу и дайте ему название.
Вариант 16.
1. Понятие о карбонильных соединениях. Получение альдегидов и кетонов в реакциях окисления, гидратации, пиролиза. Полярность карбонильной группы, ее влияние на физические и химические свойства карбонильных соединений. Альдегиды и кетоны в природе и промышленности.
2. Гомологический ряд ацетиленовых углеводородов, изомерия и номенклатура.
3. Важнейшие моносахариды: строение, свойства, применение.
4. Задача. Выведите молекулярную формулу органического вещества, содержащего 53,3 % углерода, 15,6 % водорода и 31,1 % азота. Относительная плотность паров этого вещества по воздуху равна 1,551. Дайте название веществу.
5. Задача. При сгорании 8,4 г газообразного углеводорода получили 26,4 г оксида углерода (4). Плотность этого вещества равна 1,87 г/л. Выведите молекулярную формулу вещества и дайте ему название.
Вариант 17.
1. Карбоновые кислоты и их классификация. Электронное строение карбоксильной группы. Получение и физические свойства карбоновых кислот. Общие химические свойства: кислотность, образование функциональных производных. Особенности химических свойств непредельных, ароматических, дикарбоновых кислот.
2. Получение и химические свойства ацетиленовых углеводородов.
3. Свойства и классификация ферментов, использование в промышленности.
4. Задача. Выведите молекулярную формулу органического вещества, содержащего 64,9 % углерода, 21,6 % кислорода и 13,5 % водорода. Относительная плотность паров этого вещества по воздуху равна 2,55. Дайте название веществу.
5. Задача. При сжигании 3,34 г органического соединения получено 6,6 г оксид углерода (4) и 3,05 г воды. Относительная молекулярная масса этого вещества равна 88. Выведите молекулярную формулу вещества и дайте ему название.
Вариант 18.
1. Сложные эфиры как производные карбоновых кислот. Реакции получения эфиров. Жиры, их строение и свойства. Гидрирование растительных масел, омыление жиров. Жиры в природе и жизни человека. Мыла и синтетические моющие средства.
2.Диеновые углеводороды: классификация, строение, получение.
3. Типы химических реакций в органической химии.
4. Задача. Выведите молекулярную формулу органического вещества, содержащего 40 % углерода, 6,7 % водорода и 53,3 % кислорода. Относительная плотность паров этого вещества по водороду равна 15. Дайте название веществу.
5. Задача. При сжигании 7,8 г ароматического углеводорода получено 26,4 г оксид углерода (4). Относительная плотность вещества по воздуху равна 2,69. Выведите молекулярную формулу этого вещества и дайте ему название.
Вариант 19.
1. Понятие об углеводах, их классификация, распространение и роль в природе. Особенности строения моно-, олиго-, и полисахаридов. Изменение физических и химических свойств углеводов с увеличением молекулярной массы.
2. Получение и химические свойства этиленовых углеводородов.
3. Дать понятия гомологии и изомерии. Виды изомерии, примеры.
4. Задача. Найдите молекулярную формулу углеводорода, массовая доля углерода в котором составляет 83,3% углерода. Относительная плотность паров этого вещества по водороду равна 36. Дайте название веществу.
5. Задача. При сжигании 93г вещества получили 67,2л оксида углерода (4) (н.у.), 135г воды и азот. Относительная плотность вещества по водороду равна 15,5. Выведите молекулярную формулу этого вещества и дайте ему название.
Вариант 20.
1. Моносахариды как полифункциональные соединения. Строение важнейших моносахаридов: глюкозы, фруктозы, рибозы и дезоксирибозы. Химические реакции глюкозы как альдегида и многоатомного спирта. Брожение глюкозы.
2. Ароматические углеводороды: строение, изомерия и номенклатура.
3. Карбоновые кислоты: классификация и номенклатура. Строение карбоксильной группы и физические свойства предельных одноосновных кислот.
4. Задача. Найдите молекулярную формулу органического вещества, если известно, что массовая доля углерода в нем составляет 51,89 %, водорода 9,73 % и хлора 38,38 %. Относительная плотность паров этого вещества по воздуху равна 3,19. Назовите вещество.
5. Задача. Определите молекулярную формулу вещества, при сжигании 3,75 г которого получили 2,25 г водяного пара и 5,5 г оксида углерода (4). Относительная плотность вещества по водороду равна 15.
Вариант 21.
1. Сахароза - важнейший представитель дисахаридов. Полисахариды. Сравнение строения, физических и химических свойств крахмала и целлюлозы. Получение сложных эфиров целлюлозы, понятие об искусственных волокнах. Биологическая роль полисахаридов.
2. Способы получения и химические свойства ароматических углеводородов.
3. Классификация витаминов, их биологическая роль.
4. Задача. Найдите молекулярную формулу углеводорода, массовая доля водорода в котором составляет 15,79 %. Относительная плотность паров этого вещества по воздуху равна 3,93. Назовите вещество.
5. Задача. При сжигании 4,4 г углеводорода получили 13,2 г оксида углерода (4). Относительная плотность вещества по воздуху равна 1,52. Выведите молекулярную формулу этого вещества и дайте ему название.
Вариант 22.
1. Классификация, изомерия и номенклатура аминов. Электронное строение аминов, обусловливающее их основные свойства. Получение аминов. Различие в химических свойствах алифатических и ароматических аминов. Полиамидные синтетические материалы на примере нейлона.
2. Природные источники углеводородов: состав и применение природных газов.
3. Кислородсодержащие органические вещества, их классификация и применение.
4. Задача. Найдите молекулярную формулу углеводорода, массовая доля углерода в котором составляет 81,8 %. Относительная плотность вещества по азоту равна 1,57. Назовите вещество.
5. Задача. При сгорании органического вещества массой 6,2 г образовалось 4,48 л оксида углерода (4) (н.у.), 9 г воды и 2,24 л азота (н.у.). Относительная плотность паров вещества по водороду равна 15,5. Выведите молекулярную формулу этого вещества и дайте ему название.
Вариант 23.
1. Аминокислоты, их классификация и номенклатура. Изомерия положения функциональной группы. Анализ химических свойств аминокислот: основные, кислотные, специфические. Полиамидные синтетические материалы на примере капрона. Применение и биологическая функция аминокислот.
2. Химические свойства и применение ацетиленовых углеводородов.
3. Связь органической химии с медициной: болеутоляющие и противоопухолевые средства, антигистаминные препараты.
4. Задача. Массовая доля углерода в циклопарафине составляет 85,71 %. Относительная плотность его паров по воздуху равна 1,931. Найдите молекулярную формулу вещества и дайте ему название.
5. Задача. При сгорании углеводорода объемом 0,6 л (н.у.) выделился оксид углерода (4) объемом 1,2 л (н.у.). Масса 1 л этого углеводорода равна 1,16 г. Определите молекулярную формулу углеводорода и дайте ему название.
Вариант 24.
1. Понятие о пептидах и пептидной связи. Строение полипептидов и белков, их биологическое значение. Химические свойства белков. Белки как необходимый компонент пищи.
2. Химические свойства диеновых углеводородов, их строение и получение.
3.Связь органической химии с сельским хозяйством: пестициды, гербициды.
4. Задача. Найдите молекулярную формулу углеводорода, массовая доля углерода в котором составляет 75 %. Относительная плотность паров этого вещества по азоту равна 0,572. Назовите вещество.
5. Задача. Выведите молекулярную формулу органического соединения, если относительная плотность его по водороду равна 15.При сгорании 8,96 л (н.у.) этого вещества выделилось 8,96 л оксида углерода (4) (н.у.) и 7,2 г воды.
Вариант 25.
1. Понятие о гетероциклических соединениях. Строение пиррола, пиридина и пиримидина. Ароматический характер азотистых гетероциклов, их кислотно-основные свойства.
2. Предельные углеводороды: гомологический ряд, свойства, получение.
3. Связь органической химии с экологией: Загрязнение атмосферы, воды и почвы.
4. Задача. Найдите молекулярную формулу углеводорода, массовая доля водорода в котором составляет 25%. Относительная плотность паров этого вещества по кислороду равна 0,5. Дайте название веществу.
5. Задача. Сожгли 4,8 г органического вещества, при этом получили 6,6 г оксида углерода (4) и 5,4 г воды. Относительная плотность этого вещества по водороду равна 16. Выведите молекулярную формулу вещества и дайте ему название.
Вариант 26.
1. Нуклеотиды и нуклеиновые кислоты. Различия в строении и биологических функциях рибонуклеиновых и дезоксирибонуклеиновых кислот. Принцип комплементарности в строении ДНК, различные типы РНК. Биологическая функция нуклеиновых кислот.
2. Фенолы: особенности строения, получения и химические свойства.
3. Боевые химические вещества и токсикомания.
4. Задача. Найдите молекулярную формулу углеводорода, массовая доля водорода в котором составляет 20 %. Относительная плотность углеводорода по воздуху равна 1,035. Назовите вещество.
5. При сжигании органического вещества массой 9 г образовалось 17,6 г оксида углерода (4), 12,6 г воды и азот. Относительная плотность вещества по водороду равна 22,5. Найдите молекулярную формулу вещества и напишите структурные формулы изомеров, отвечающих этой молекулярной формуле.
Вариант 27.
1. Понятие о витаминах, их классификация. Группы витаминов, их основная биологическая функция, нахождение в различных продуктах питания. Проблема гиповитаминоза, авитаминоза, гипервитаминоза.
2. Непредельные углеводороды: строение и свойства алкенов, диенов, алкинов.
3. Кислородсодержащие органические вещества: спирты, альдегиды, кислоты, их функциональные группы, изомерия, номенклатура, свойства.
4. Задача. Найдите молекулярную формулу алкена, в котором массовая доля углерода составляет 85,7 %. Относительная плотность вещества по азоту равна 2. Назовите вещество.
5. Задача. При сжигании алкина массой 5,2 г выделилось 8,96 л оксида углерода (4) (н.у.) и 3,6 г воды. Относительная плотность этого вещества по водороду равна 13. Найдите молекулярную формулу алкина и дайте ему название.
Вариант 28.
1. Ферменты как биологические катализаторы, их классификация. Важнейшие особенности ферментов: специфичность и активность. Влияние различных факторов на активность ферментов.
2. Сравните бензол и фенол по строению, свойствам, получению и применению.
3. Циклоалканы: строение, свойства, получение и применение.
4. Задача. Найдите молекулярную формулу алкена, в котором массовая доля водорода равна 14,3 %. Относительная плотность паров этого вещества по водороду равна 21. Назовите вещество.
5. Найдите молекулярную формулу алкадиена, если при сжигании 2 г его образовалось 2,12 г воды и 6,48 г оксида углерода (4). Относительная плотность вещества по водороду равна 34.
Вариант 29.
1. Понятие о гормонах и их биологические функции. Классификация гормонов, характерные свойства. Инсулин и проблема сахарного диабета.
2. Изомерия органических соединений, номенклатура на примере алканов, алкенов и алкинов.
3. Спирты: одноатомные и многоатомные: особенности их строения и свойств.
4. Задача. Найдите молекулярную формулу алкина, массовая доля водорода, в котором составляет 1,11 %. Относительная плотность его по воздуху равна 1,863. Назовите вещество.
5. Задача. При сжигании 11,2 г алкена получили 35,2 г оксида углерода (4) и 14,4 г воды. Относительная плотность алкена по воздуху 1,93. Найдите молекулярную формулу алкена и дайте ему название.
Вариант 30.
1. Классификация органических веществ по структуре углеродного скелета, наличию кратных связей и природе функциональных групп. Номенклатура ИЮПАК и ее использование для названия органических веществ различных классов.
2. Карбоновые кислоты: строение, свойства, получение и применение.
3. Строение бензола. Сравните химические свойства бензола с предельными углеводородами и непредельными.
4. Задача. Найдите молекулярную формулу сложного эфира, содержащего 54,4 % углерода, 36,4 % кислорода и 9,2 % водорода. Относительная плотность его паров по водороду равна 44. Напишите структурные формулы всех сложных эфиров, отвечающих этой молекулярной формуле.
5. Задача. При сжигании углеводорода массой 3,2 г образовалось 9,9 г оксида углерода (4) и 4,5 г воды. Относительная плотность паров этого вещества по водороду равна 64. Найдите молекулярную формулу углеводорода, дайте ему название и напишите для него три изомера. Дайте названия изомерам.
2.7 МЕТОДИЧЕСКИЕ УКАЗАНИЯ К РЕШЕНИЮ ЗАДАЧ
Тема: Нахождение молекулярной формулы органического соединения по его относительной плотности и массовой доле элементов и по массе (объему) продуктов сгорания.
Цель: научиться решать задачи двух типов:
1) вывод молекулярной формулы органического соединения по его относительной плотности и массовой доле элементов в веществе;
2) вывод молекулярной формулы органического соединения по массе (объему) продуктов сгорания.
РЕШЕНИЕ ЗАДАЧ НА НАХОЖДЕНИЕ МОЛЕКУЛЯРНОЙ
ФОРМУЛЫ ОРГАНИЧЕСКОГО СОЕДИНЕНИЯ
I ТИП ЗАДАЧ
Определение молекулярной формулы вещества на основании результатов количественного анализа (массовой доли элементов) и относительной плотности.
Пример.
Найдите молекулярную формулу углеводорода, содержание углерода в котором 80%, а водорода - 20 %, относительная плотность по водороду равна 15.
Дано:
w(C) = 80%
w(H) = 20%
D(H2) = 15
Найти:
молекулярную
формула?
Решение:
1 способ
1. Определяем Mr вещества:
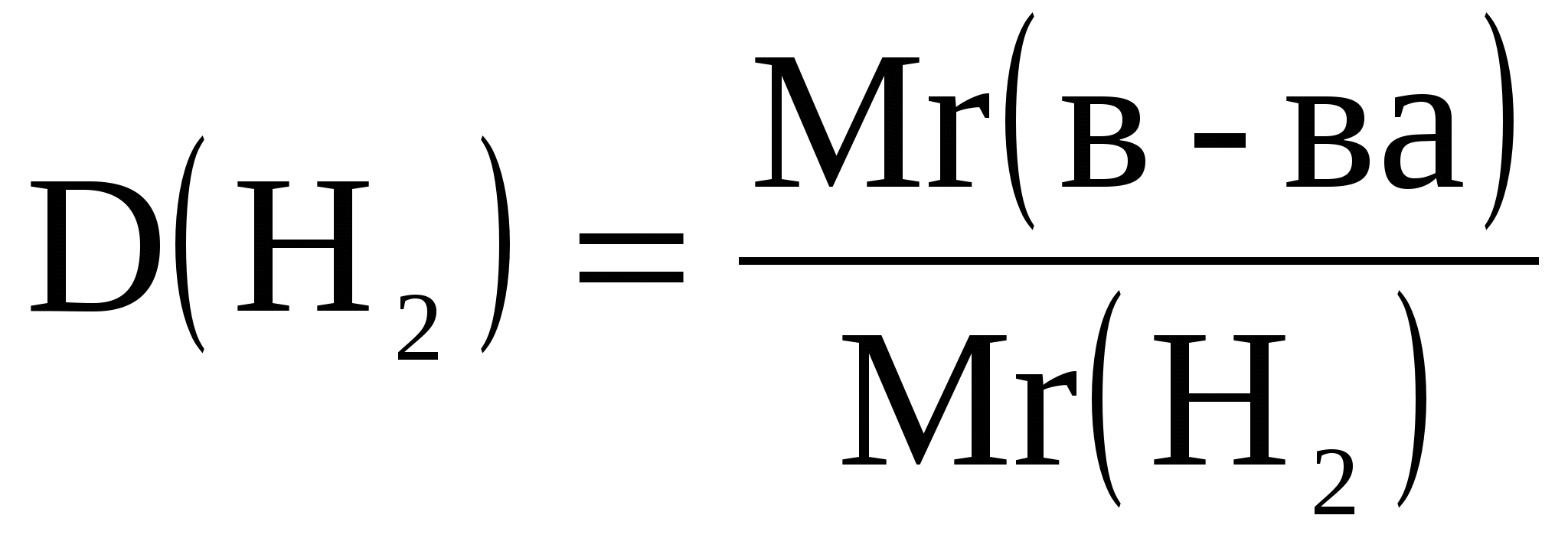 .
.
Mr(вещества) = D(H2)*Mr(H2);
Mr(вещества) = 15*2 = 30.
2. Определяем, сколько по массе приходится на углерод:
30 - 100%
х - 80%
х = 24(С)
3. Определяем, сколько по массе приходится на водород:
m(H) = 30-24 = 6.
4. Определяем число атомов углерода и водорода в данном веществе:
![]() (атома);
(атома);
![]() (атома).
(атома).
Формула вещества: С2Н6.
2 способ
1. Mr(вещества)=15*2=30.
2. Переходим от массовых долей к молярным долям. Для этого массовые доли надо разделить на относительную атомную массу.
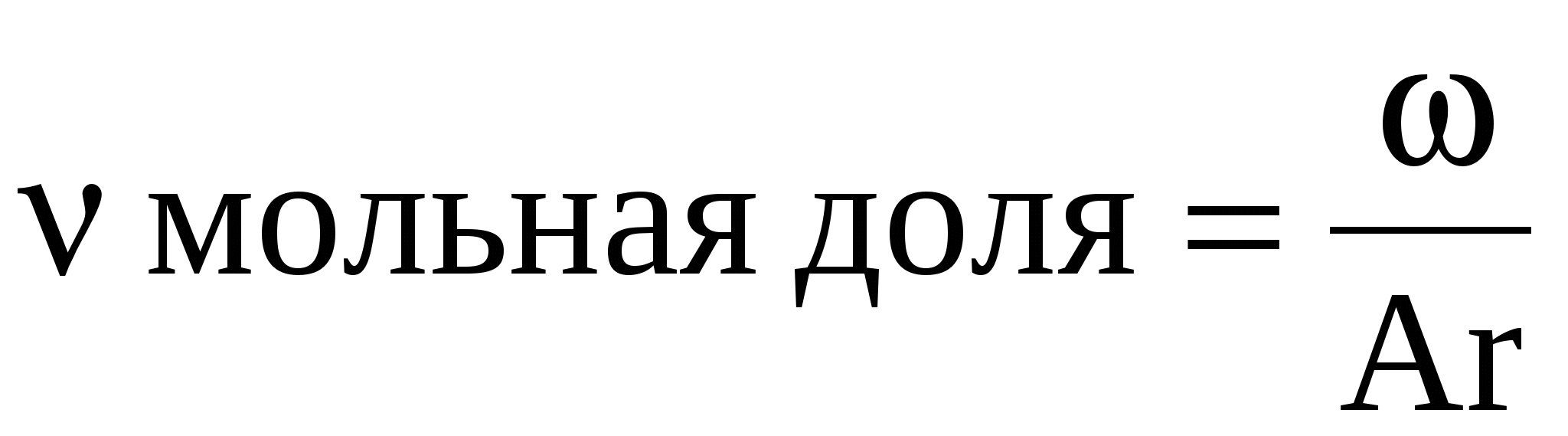
Найдем молярные доли углерода и водорода.
Обозначим:
х - число мольных долей углерода;
y - число мольных долей водорода.
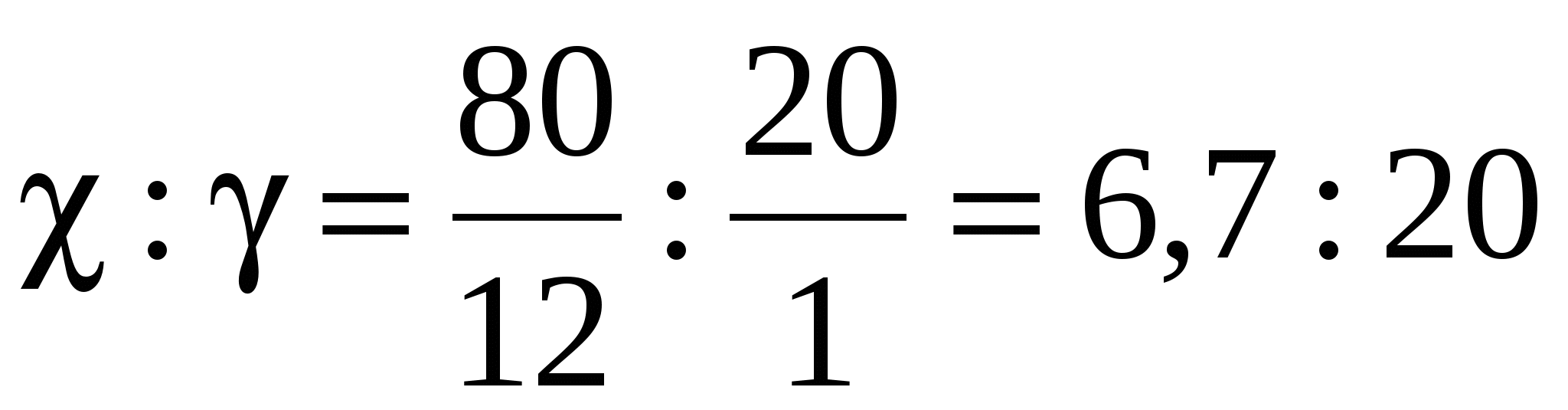 .
.
Наименьшее число принимаем за 1, а остальные числа делим на наименьшее. При этом получается 1 : 3, значит, простейшая формула CH3. составляем уравнение и определяем истинную формулу: 12n+3n = 30, 15n = 30, n = 2. Тогда истинная формула: С2Н6.
3 способ
Можно сразу определить число атомов элементов, входящих в состав вещества по формуле:
![]() ,
,
но при этом должна быть известна Mr вещества
1. Найдем относительную массу вещества:
Mr = 15*2 = 30.
2. Определим число атомов углерода и водорода в соединении:
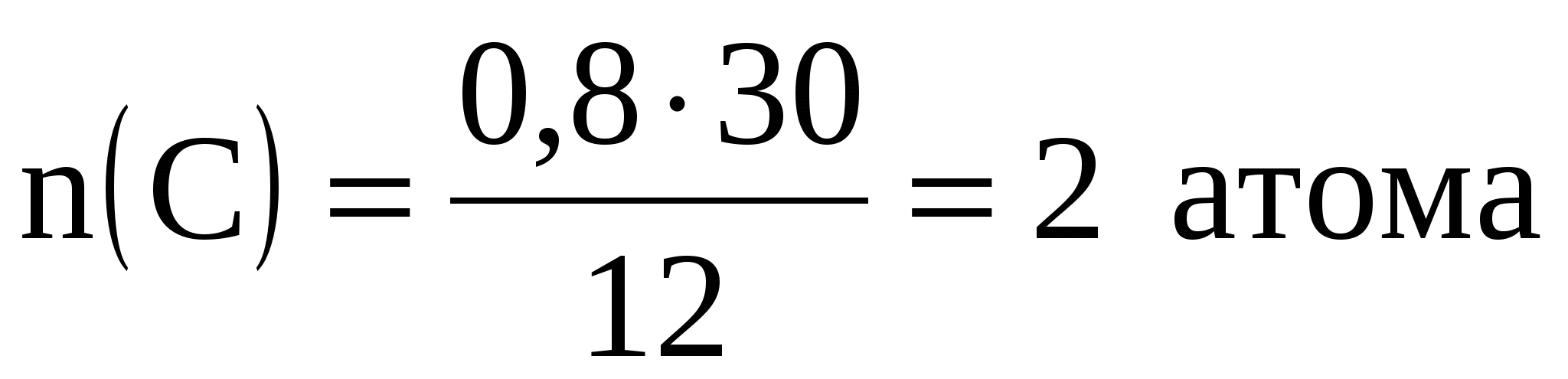 ;
;
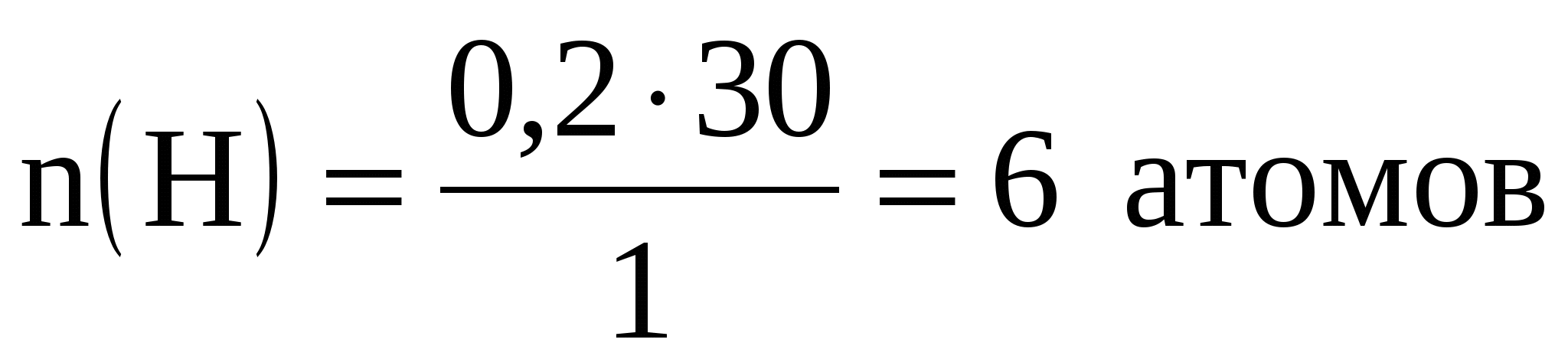 .
.
Значит, формула: С2Н6.
II ТИП ЗАДАЧ
Определение молекулярной формулы вещества на основании продуктов сгорания и относительной плотности
Пример.
При сгорании 1,3 г вещества образуется 4,4 г оксида углерода(4) и 0,9 г воды. Плотность паров этого вещества по водороду равна 39. Определите молекулярную формулу данного вещества.
Дано:
m(в-ва)=1,3 г.
m(CO2)=4,4 г.
m(H2O)=0,9 г.
D(H2)=39
Найти:
формула-?
M(CO2)=44 г/моль
m(CO2)=44 г
М(Н2О)=18г/моль
m(H2O)=18 г
Решение:
1 способ
1. Определяем относительную молекулярную массу вещества:
Mr(в-ва) = ![]() = 78.
= 78.
2. Определяем массу углерода по оксиду углерода (4).
В 44 г (СО2) содержится 12 г (С),
В 4,4 г (СО2) содержится х г (С),
х = 1,2 г (С).
3. Определяем массу водорода по воде.
В 18 г (Н2О) содержится 2 г (Н),
В 0,9 г (Н2О) содержится х г (Н),
х = 0,1г.
4. Определяем, есть ли в веществе кислород.
m(C)+m(H)=1,2+0,1=1,3 (г).
Значит, кислорода нет.
5. Определяем отношение атомов.
Пусть х - число атомов углерода,
y - число атомов водорода
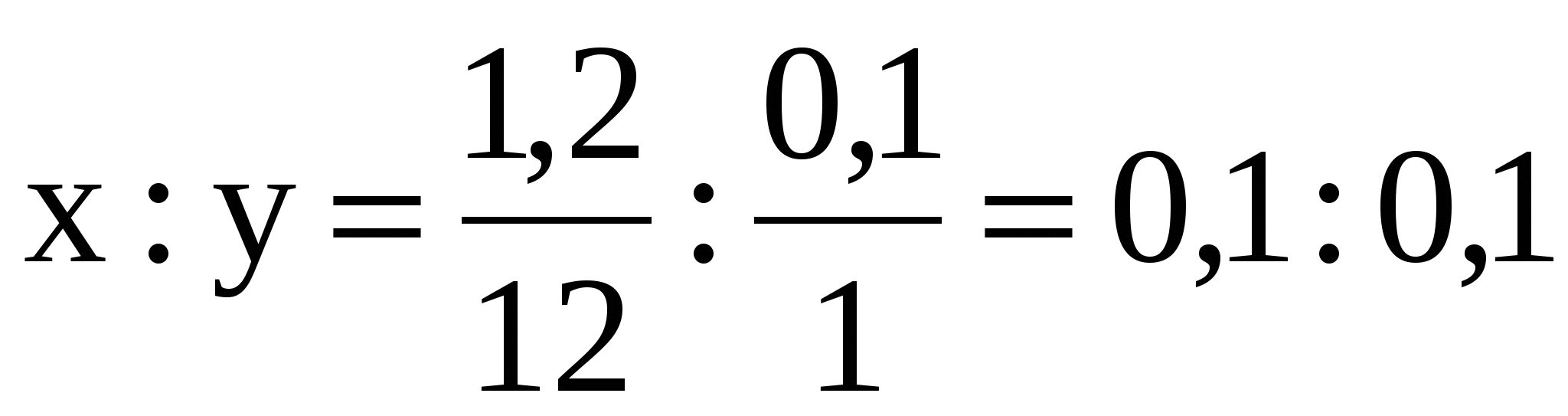 , следовательно, х : y = 1 : 1
, следовательно, х : y = 1 : 1
Простейшая формула СН, но т.к. Mr (вещества)=78, то составляем уравнение:
12*1n+1n=78
13n=78
n=6
Тогда истинная формула вещества: С6Н6.
2 способ
1. Определим относительную молекулярную массу вещества.
Mr(в-ва)= ![]() =78.
=78.
2. Массу углерода определяют по массе оксида углерода (4), а массу водорода - по массе воды.
Для этого определяем количество вещества оксида углерода (4) и количество вещества воды, а по ним ν(С) и ν (Н).
а) ν = 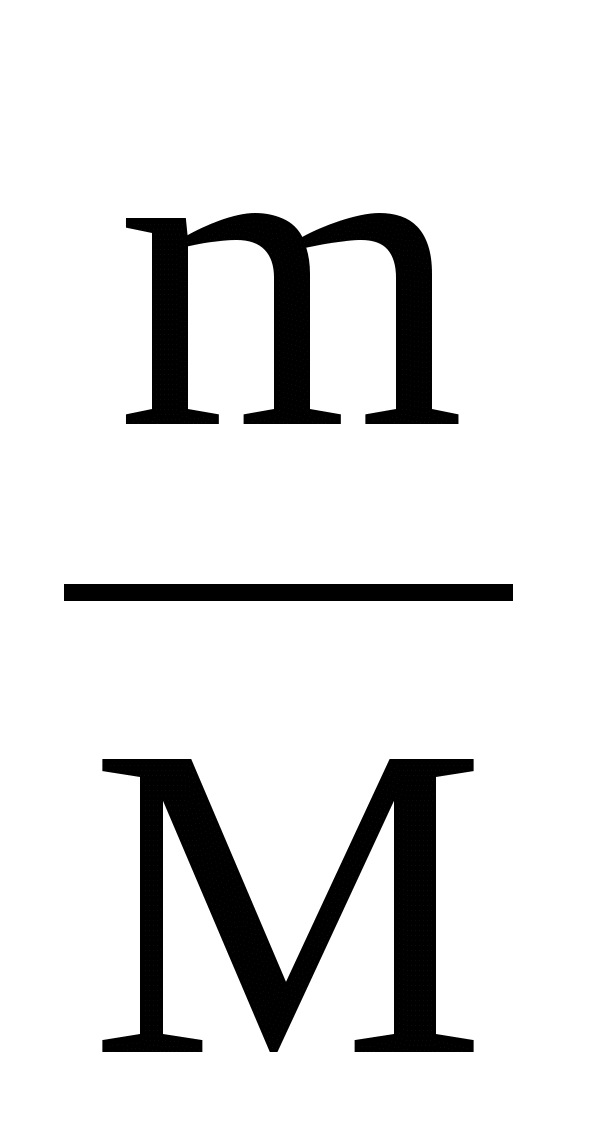 ;
;
ν(C) = ν(CO2) = 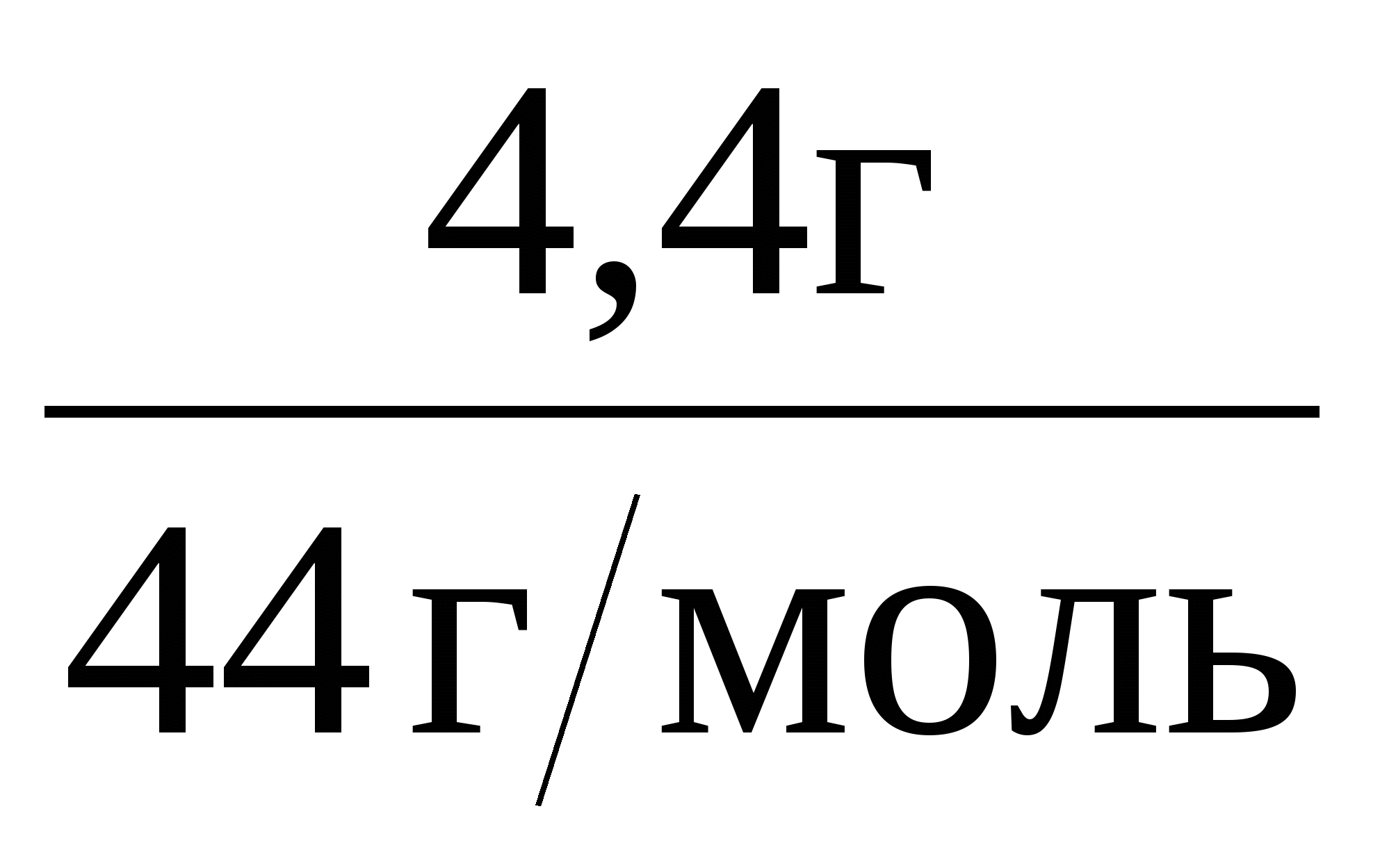 = 0,1 моль;
= 0,1 моль;
ν(Н) = 2ν(Н2О) = 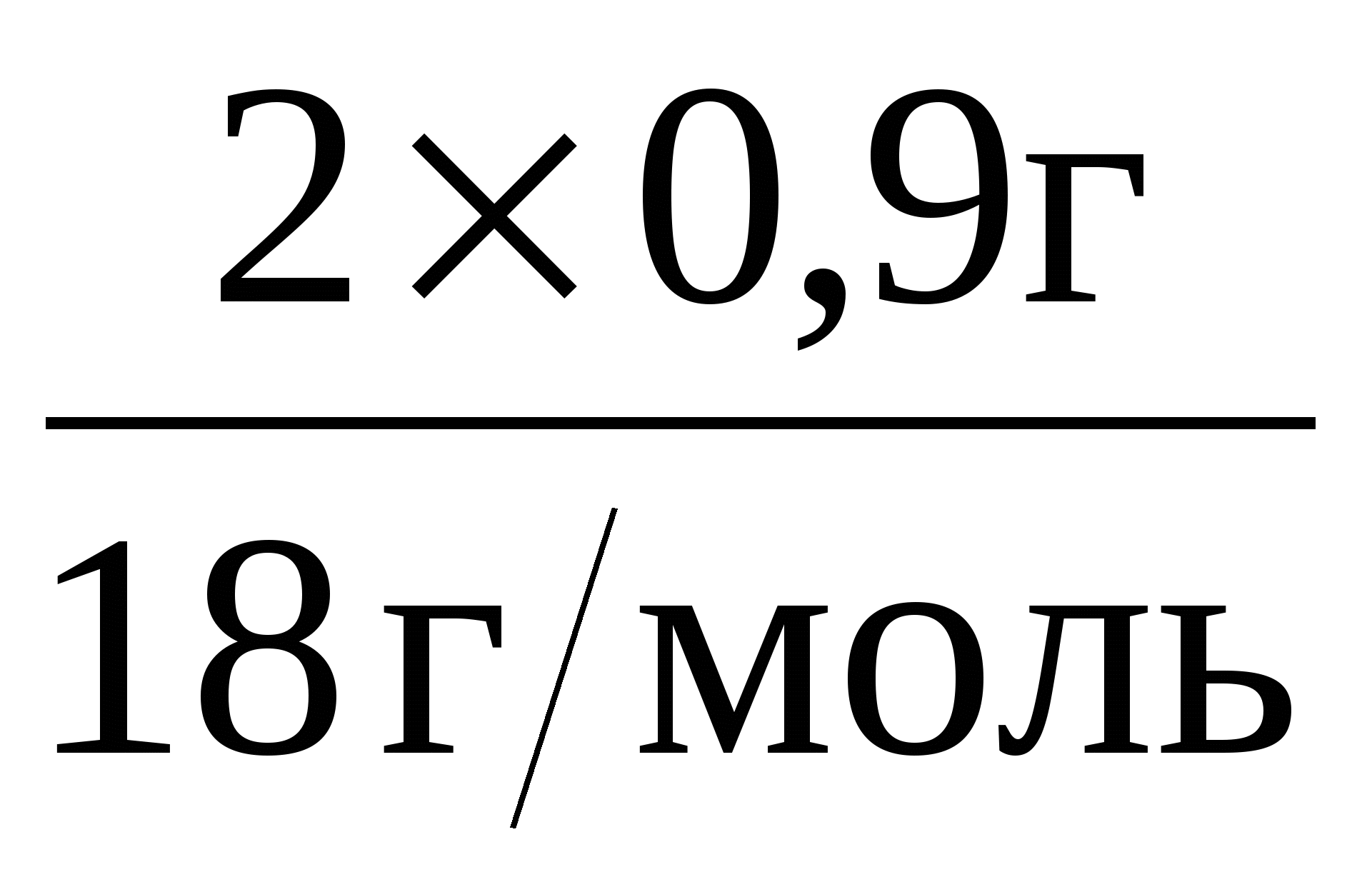 = 0,1 моль.
= 0,1 моль.
б) Определяем массы углерода и водорода:
m=M*ν;
m(C)=12*0,1=1,2 (г);
m(H)=1*0,1=0,1 (г).
3. Определяем, есть ли в веществе кислород:
m(O) = m(в-ва) - (m(C) + m(H)) = 1,3 - (1,2 + 0,1) = 0(г).
Значит, кислорода нет.
4. Находим соотношение атомов углерода и водорода.
ν(С) : ν(Н) = 0,1 : 0,1 = 1 : 1.
Простейшая формула вещества - СН.
5. Определяем истинную формулу вещества.
Mr(в-ва)=78;
Mr(CH)=13,
n =6.
Значит, истинная формула вещества - С6Н6.
3. УСЛОВИЯ РЕАЛИЗАЦИИ УЧЕБНОЙ ДИСЦИПЛИНЫ
3.1 Требования к минимальному материально-техническому
обеспечению
Реализация учебной дисциплины «Органическая химия» требует наличия учебного кабинета и лаборатории
Оборудование учебного кабинета: на занятиях необходимо использовать настенные таблицы «Периодическая система химических элементов Д.И.Менделеева», «Строение атома углерода», «Строение основных классов органических веществ: алканы, алкены, алкины, арены, спирты, фенолы, альдегиды и кислоты»; технические средства обучения; мультимедийный проектор и стационарный экран.
Оборудование лаборатории: шкаф для хранения химической посуды и реактивов; настенные таблицы «Периодическая система химических элементов Д.И.Менделеева», «Техника безопасности при работе в лаборатории»; аптечка первой помощи; средства пожаротушения; вытяжной шкаф; мойки с горячей и холодной водой; электрические плитки с закрытой спиралью, колбонагреватели; спиртовки; водяные и песчаные бани; штативы для пробирок; пробиркодержатели; пробирки для полумикрометода; колбы (круглодонные, плоскодонные и конические); воронки стеклянные разного диаметра (конические, делительные, капельные); стаканы химические на 50 - 150 см3 (стеклянные и фарфоровые); мерная посуда (цилиндры, мензурки, градуированные пипетки); холодильники (водяные и воздушные, нисходящие и обратные, с хлоркальциевыми трубками); стеклянные палочки; склянки для реактивов; набор химических реактивов.
3.2. Информационное обеспечение обучения
Перечень рекомендуемых учебных изданий, Интернет ресурсов, дополнительной литературы
Основные источники:
1. Захарова Т.Н., Головлева Н.А. Органическая химия (учебник для студентов СПО) - М.: Академия, 2012 - 397 с.
2. Артеменко А.И. Органическая химия (учебник для средних специальных учебных заведений) - М.: Высшая школа, 2003 - 536 с.
3. Артеменко А.И. Органическая химия (учебник для строительных спец.вузов) - М.: Высшая школа, 2002 - 559 с.
4. Аверина А.В., Снегирева А.Я. Лабораторный практикум по органической химии - М.: Высшая школа, 1983
5. Ерохин Ю.М. Химия (учебник для студентов ССО), издание 11, стереотипное. М.: Академия, 2008-378 с.
6. Хомченко И Г. Общая химия (учебник для техникума) - М.: Новая волна - ОНИКС, 1999-464 с.
Дополнительные источники
1. Габриелян О.С. Химия в тестах, задачах, упражнениях: учеб. пособие для студ. сред. проф. учебных заведений / О.С. Габриелян, Г.Г. Лысова - М., 2006.
2. Габриелян О.С. Практикум по общей, неорганической и органической химии: учеб. пособие для студ. сред. проф. учеб. заведений / Габриелян О.С., Остроумов И.Г., Дорофеева Н.М. - М., 2007.
3. Потапов В.М. Хомченко Г.П. Химия (учебник для учащихся техникумов нехимических специальностей), издание второе, исправленное. М.; Высшая школа, 1985 . 431с.
Электронные и Internet-ресурсы:
1. ХиМиК..ru - Сайт о химии
2. Chemistry. Ssu. Samara.ru - органическая химия
3. http:/mon.gov. ru - сайт Министерства образования и науки РФ
-
ФОРМЫ КОНТРОЛЯ И ОЦЕНКИ РЕЗУЛЬТАТОВ
ОСВОЕНИЯ УЧЕБНОЙ ДИСЦИПЛИНЫ «ОРГАНИЧЕСКАЯ ХИМИЯ» ПРИ ЗАОЧНОЙ ФОРМЕ ОБУЧЕНИЯ
Контроль и оценка результатов освоения учебной дисциплины осуществляется преподавателем в процессе проведения аудиторных лекционных и лабораторных занятий, тестирования, а также выполнения обучающимися индивидуальных заданий, проектов, исследований, контрольной работы.
Результаты обучения
(освоенные умения, усвоенные знания)
Формы и методы
контроля и оценки
результатов обучения
В результате освоения учебной дисциплины обучающийся должен уметь:
- составлять и изображать структурные полные и сокращенные формулы органических веществ и соединений;
- определять свойства органических соединений для выбора методов синтеза углеводородов при разработке технологических процессов;
- описывать механизм химических реакций получения органических соединений;
- составлять качественные химические реакции, характерные для определения различных углеводородных соединений;
- прогнозировать свойства органических соединений в зависимости от строения молекул;
- решать задачи и упражнения по генетической связи между различными классами органических соединений;
- определять качественными реакциями органические вещества, проводить количественные расчеты состава вещества;
- применять безопасные приемы при работе с органическими реактивами и химическими приборами;
- проводить реакции с органическими веществами в лабораторных условиях;
- проводить химический анализ органических веществ и оценивать его результаты;
В результате освоения учебной дисциплины обучающийся должен знать:
- влияние строения молекул на химические свойства органических веществ;
- влияние функциональных групп на свойства органических веществ;
- изомерию как источник многообразия органических соединений;
- методы получения высокомолекулярных соединений;
- особенности строения органических веществ, их молекулярное строение, валентное состояние атома углерода;
- особенности строения и свойства органических веществ, содержащих в составе молекул атомы серы, азота, галогенов, металлов;
- особенности строения и свойства органических соединений с большой молекулярной массой;
- природные источники, способы получения и области применения органических соединений;
- теоретические основы строения органических веществ, номенклатуру и классификацию органических соединений;
- типы связей в молекулах органических веществ.
Для проверки знаний студентов используются следующие виды контроля:
-вводный (тестирование, беседа, наблюдение);
- текущий (зачет по лабораторным работам;
зачет по практическим работам; тестовые практические задания; тестирование по темам курса;
защита рефератов, сообщений, презентаций;
проверка и оценка домашних и аудиторных письменных работ;
проверка и оценка контрольных работ по темам и разделам).
- итоговый:
дифференцированный зачет
СОДЕРЖАНИЕ
ВВЕДЕНИЕ
3
1 ПАСПОРТ УЧЕБНОЙ ДИСЦИПЛИНЫ «ОРГАНИЧЕСКАЯ ХИМИЯ» ДЛЯ СТУДЕНТОВ ЗАОЧНОЙ ФОРМЫ ОБУЧЕНИЯ
3
1.1 Область применения общепрофессиональной дисциплины
3
1.2 Место учебной дисциплины в структуре основной профессиональной образовательной программы
4
1.3 Цели и задачи учебной дисциплины - требования к результатам освоения учебной дисциплины
4
1.4 Рекомендуемое количество часов на освоение программы учебной дисциплины при заочной форме обучения
5
2.СТРУКТУРА И СОДЕРЖАНИЕ УЧЕБНОЙ ДИСЦИПЛИНЫ
6
-
Объем учебной дисциплины и виды учебной работы при заочной
форме обучения
6
2.2 Тематический план и содержание учебной дисциплины
ОП.03 «Органическая химия»
6
2.3 Краткие теоретические сведения
8
2.4. Требования к выполнению контрольной работы
9
2.5 Таблица вариантов контрольной работы
9
2.6 Задания для контрольной работы
10
2.7 Методические указания к решению задач
21
3. УСЛОВИЯ РЕАЛИЗАЦИИ УЧЕБНОЙ ДИСЦИПЛИНЫ
25
3.1 Требования к минимальному материально-техническому
обеспечению
25
3.2. Информационное обеспечение обучения
25
-
ФОРМЫ КОНТРОЛЯ И ОЦЕНКИ РЕЗУЛЬТАТОВ
ОСВОЕНИЯ УЧЕБНОЙ ДИСЦИПЛИНЫ «ОРГАНИЧЕСКАЯ ХИМИЯ» ПРИ ЗАОЧНОЙ ФОРМЕ ОБУЧЕНИЯ
26
28


