- Преподавателю
- Химия
- Материалы для дифференцированной работы по химии (8 класс)
Материалы для дифференцированной работы по химии (8 класс)
| Раздел | Химия |
| Класс | 8 класс |
| Тип | Тесты |
| Автор | Пестова Т.М. |
| Дата | 19.07.2015 |
| Формат | doc |
| Изображения | Есть |
Материалы для дифференцированной работы с учащимися по химии
(разноуровневые карточки - тесты, по 8 в каждой теме)
Темы
-
Простые вещества. Количественные соотношения.
-
Классы неорганических соединений.
-
Генетическая связь между классами неорганических соединений.
-
Окислительно - восстановительные реакции.
-
Количественные отношения в химии.
-
Итоговая работа по химии.
8 класс
Тема: «Простые вещества. Количественные соотношения»
Карточка 1
Тестовые задания с выбором одного правильного ответа и на соотнесение:
1 (2 балла). Знак элемента, образующего простое вещество - неметалл:
А. Nа. Б. С. В. К. Г. Аl.
2 (2 балла). Простое вещество - металл:
А. Кислород. Б. Медь. В. Фосфор. Г. Сера.
3 (2 балла). Агрегатное состояние простого вещества ртути при обычных условиях:
А. Твердое. Б. Жидкое. В. Газообразное.
4 (2 балла). Химическая связь является ковалентной неполярной в веществе:
А. Железо. Б. Хлор. В. Вода.
5 (2 балла). Аллотропная модификация кислорода:
А. Графит. Б. Белый фосфор. В. Озон.
6 (2 балла). Атому элемента, образующему простое вещество - металл, соответствует электронная схема:
А. +18) ) ) Б. +3) ) В. +15) ) )
2 8 8 2 1 2 8 5
7 (2 балла). Запись 3O2 означает:
А. 2 молекулы кислорода.
Б. 3 молекулы кислорода.
В. 5 атомов кислорода.
Г. 6 атомов кислорода.
8 (2 балла). Масса 3 моль сероводорода Н2S равна:
А. 33 г. Б. 34 г. В. 99 г. Г. 102 г.
9 (2 балла). Объем, который занимает 2 моль газообразного вещества с формулой SО2 (н. у.):
А.22,4л. Б.33,бл. В.44,8л. Г.67,2л.
10 (2 балла). Количество вещества углекислого газа СО2, в котором содержится 36 . 1023 молекул, равно:
А. 0,6 моль. Б. 3 моль. В. 5 моль. Г. 6 моль.
11 (6 баллов). Соотнесите.
Тип химической связи:
1. Ионная.
2. Ковалентная полярная.
3. Металлическая.
Химическая формула вещества:
А. Сl2. Б. К. В. NаС1. Г. Fе. Д. NН3.
8 класс
Тема: «Простые вещества. Количественные соотношения»
Карточка 2
Задания со свободным ответом
1 (5 баллов). Рассчитайте объем для 160 г кислорода O2.
2 (3 балла). Дополните определение: «Аллотропия - это явление...»
3 (6 баллов). Выберите свойства, характеризующие графит.
А. Твердый, режет стекло.
Б. Мягкий, оставляет следы на бумаге.
В. Бесцветный, прозрачный.
Г. Имеет слабый металлический блеск.
Д. Электропроводен.
4 (5 баллов). Расположите вещества с формулами Мg, Nа, Аl в порядке возрастания металлических свойств.
5 (5 баллов). Даны элементы: С, S, Si. Выберите один «лишний» элемент на основании электронного строения его атомов и положения в Периодической системе химических элементов Д. И. Менделеева.
8 класс
Тема: «Простые вещества. Количественные соотношения»
Карточка 3
Тестовые задания с выбором одного правильного ответа и на соотнесение
1 (2 балла). Знак элемента, образующего простое вещество металл:
А. О. Б. Fе. В. Si. Г. N.
2 (2 балла). Простое вещество - неметалл:
А. Алюминий.
Б. Магний.
В. Графит.
Г. Железо.
3 (2 балла). Агрегатное состояние простого вещества красного фосфора при обычных условиях:
А. Газообразное. Б. Жидкое. В. Твердое.
4 (2 балла). При помощи металлической химической связи образовано вещество:
А. Алмаз. Б. Поваренная соль. В. Медь.
5 (2 балла). Аллотропная модификация углерода:
А. Озон. Б. Красный фосфор. В. Алмаз.
6 (2 балла). Атому элемента, образующего простое вещество - неметалл, соответствует электронная схема:
А. +11) ) ) Б. +8) ) В. +12) ) )
2 8 1 2 6 2 8 2
7 (2 балла). Запись 5N2 означает:
А. 2 молекулы азота.
Б. 5 молекул азота.
В. 7 атомов азота.
Г. 10 атомов азота.
8 (2 балла). Масса 2 ммоль углекислого газа СО2 равна:
А. 28 мг. Б. 44 мг. В. 56 мг. Г. 88 мг.
9 (2 балла). З моль кислорода O2 (н. у.) занимают объем:
А. 11,2л. Б. 22,4л. В.44,8л. Г.67,2л.
10 (2 балла). Число молекул в 2 ммоль воды равно:
А. 12 . 1023. Б. 12 . 1020. В. 18 . 1020.
11 (6 баллов). Соотнесите.
Тип химической связи:
1. Ионная.
2. Ковалентная неполярная.
3. Металлическая.
Химическая формула вещества:
А. Н2O. Б. КСl. В. Сu. Г. O2. Д. Аl.
8 класс
Тема: «Простые вещества. Количественные соотношения»
Карточка 4
Задания со свободным ответом
1 (5 баллов). Рассчитайте объем для 140 кг азота N2 (н. у.).
2 (3 балла). Дополните определение: «Молярная масса вещества - это...»
3 (6 баллов). Выберите свойства, характерные для озона O3.
А. При обычных условиях газ.
Б. Имеет запах.
В. Без запаха.
Г. Бесцветен.
Д. Бактерициден.
4 (5 баллов). Расположите вещества с формулами С, F2, O2 в порядке возрастания неметаллических свойств.
5 (5 баллов). Даны элементы: Nа, Мg, Li. Выберите один «лишний» элемент на основании электронного строения его атомов и положения в Периодической системе химических элементов Д. И. Менделеева.
8 класс
Тема: «Простые вещества. Количественные соотношения»
Карточка 5
Тестовые задания с выбором одного правильного ответа и на соотнесение
1 (2 балла). Знак элемента, образующего простое вещество - металл:
А. Н. Б. O. В. Zn. Г. Сl.
2 (2 балла). Простое вещество - неметалл:
А. Медь. Б. Сера. В. Серебро. Г. Натрий.
3 (2 балла). Агрегатное состояние простого вещества серы при обычных условиях:
А. Газообразное. Б. Жидкое. В. Твердое.
4 (2 балла). В каком из веществ химическая связь является металлической?
А. Кислород. Б. Натрий. В. Поваренная соль.
5 (2 балла). Аллотропная модификация химического элемента фосфора:
А. Алмаз. Б. Кислород. В. Красный фосфор.
6 (2 балла). Атому элемента, образующего простое вещество - металл, соответствует электронная схема:
А. +16) ) ) Б. +12) ) ) В. +10) )
2 8 6 2 8 2 2 8
7 (2 балла). Запись 4N означает:
А. 4 атома азота.
Б. 4 молекулы азота.
В. 2 молекулы азота.
8 (2 балла). Масса 3 кмоль воды равна:
А. 27 кг. Б. 54 кг. В. 60 г. Г. 54 г.
9 (2 балла). 4 кмоль хлора Сl2 (н. у.) занимают объем:
А. 44,8 м3. Б. 67,2 л. В. 89,6 м3. Г. 100,8 л.
10 (2 балла). Число молекул в углекислом газе СО2 количеством вещества 1,5 моль равно:
А. 6 . 1023. Б. 9 . 1023. В. 12 . 1023.
11 (б баллов). Соотнесите.
Тип химической связи:
1. Ионная.
2. Ковалентная неполярная.
3. Металлическая.
Химическая формула вещества:
А.SO3. Б. Н2. В. Мg. Г. СаF2. Д. Н2O.
8 класс
Тема: «Простые вещества. Количественные соотношения»
Карточка 6
Задания со свободным ответом
1 (5 баллов). Рассчитайте объем для 20 г водорода (н. у.).
2 (3 балла). Дополните фразу: «Моль вещества - это...»
3 (6 баллов). Выберите свойства, характерные для алмаза.
А. Имеет серый цвет.
Б. Твердый, режет стекло.
В. Электропроводен.
Г. Бесцветен.
Д. Кристаллы сильно преломляют лучи света.
4 (5 баллов). Расположите простые вещества, образованные химическими элементами Р, S, Si, в порядке возрастания неметаллических свойств.
5 (5 баллов). Даны элементы: А1, Мg, Са. Выберите один «лишний» элемент на основании электронного строения его атомов и положения в Периодической системе элементов
Д. И. Менделеева.
8 класс
Тема: «Простые вещества. Количественные соотношения»
Карточка 7
Тестовые задания с выбором одного правильного ответа и на соотнесение
1 (2 балла). Знак элемента, образующего простое вещество - неметалл:
А. Мg. Б. S. В. Са. Г. Сu.
2 (2 балла). Простое вещество - металл:
А. Водород. Б. Натрий. В. Азот. Г. Кремний.
3 (2 балла). Агрегатное состояние простого вещества водорода Н2 при обычных условиях:
А. Газообразное. Б. Жидкое. В. Твердое.
4 (2 балла). Химическая связь является ковалентной полярной в веществе:
А. Вода. Б. Кислород. В. Цинк.
5 (2 балла). Аллотропная модификация олова:
А. Алмаз. Б. Белый фосфор. В. Серое олово.
6 (2 балла). Атому элемента, образующему простое вещество - неметалл, соответствует электронная схема:
А. +3) ) Б. +9) ) В. +13) ) )
2 1 2 7 2 8 3
7 (2 балла). Запись 6Н означает:
А. З молекулы водорода.
Б. 6 молекул водорода.
В. 6 атомов гелия.
Г. б атомов водорода.
8 (2 балла). Масса 5 моль аммиака NН3 равна:
А.50г. Б.68г. В.75г. Г.85г.
9 (2 балла). 2 кмоль газа метана СН4 занимают объем (н. у.):
А.22,4м3. Б.33,6л. В.44,8м3. Г.67,2л.
10 (2 балла). Количество вещества сернистого газа SO2, в котором содержится 3 . 1023 молекул, равно:
А. 0,5 моль. Б. 0,6 моль. В. 1 моль. Г. 2 моль.
11 (6 баллов). Соотнесите.
Тип химической связи;
1. Ионная.
2. Ковалентная неполярная.
3. Металлическая.
Химическая формула вещества;
А. Аg. Б. N2. В. СО2. Г. МgС12. Д. Р2O5.
8 класс
Тема: «Простые вещества. Количественные соотношения»
Карточка 8
Задания со свободным ответом
1 (5 баллов). Рассчитайте объем для 220 г углекислого газа СО2 (н. у.).
2 (3 балла). Дополните фразу: «Молярный объем газа-это...»
3 (6 баллов). Выберите свойства, характерные для кислорода.
А. Имеет запах.
Б. Без запаха.
В. При обычных условиях - газ.
Г. Применяют для обеззараживания воды.
Д. Бесцветен.
4 (5 баллов). Расположите простые вещества, образованные химическими элементами Li, К, Na, в порядке возрастания металлических свойств.
5 (5 баллов). Даны элементы: N, Р, О. Выберите один лишний элемент на основании электронного строения его атомов и положения в Периодической системе элементов
Д. И. Менделеева.
8 класс
Тема: «Классы неорганических соединений»
Карточка 1
Тестовые задания с выбором одного правильного ответа и на соотнесение
1 (2 балла). Группа формул кислот:
А. NН3, НСI, Н2SО4. Б. Н2S, НNО3, НВг. В. НСI, КСI, Н3РO4.
2 (2 балла). Формула сульфата натрия:
А. Nа2S. Б. Nа2SO3. В. Nа2SО4.
3 (2 балла). Группа формул веществ, включающая формулы основания, кислоты, соли и кислотного оксида:
А. СuО, Zn(OН)2, АlСl3, К2S.
Б. Сu(OН)2, НСI, NaNО3, SO3.
В. SO2, Н2SO4, NaС1, СuО.
4 (2 балла). Изменение свойств оксидов от кислотных к основным происходит в ряду веществ
с формулами:
А. Li2О-ВеО-В2О3. Б. Р2О5-SiО2-Аl2O3. В. NО2-СO2-SO2.
5 (2 балла). Пара формул веществ, реагирующих с оксидом серы(IV):
А. Н2O, NaCl. Б. Са(ОН)2, Н2О. В. SО3, Н2SO3.
6 (2 балла). Пара формул металлов, реагирующих с раствором соляной кислоты:
А. Са и Мg. Б. Zn и Сu. В. Аg и Fе.
7 (2 балла). Пара веществ, реагирующих с раствором гидроксида натрия:
А. Соляная кислота и хлорид натрия.
Б. Серная кислота и углекислый газ.
В. Вода и оксид калия.
8 (2 балла). Металл, реагирующий с водным раствором хлорида меди (II):
А. Железо. Б. Ртуть. В. Серебро.
9 (2 балла). Формулы веществ, вступающих в реакцию друг с другом:
А. СuО и Н2O. Б. Nа2О и НСI. В.СО2 и Н2SO3.
10 (2 балла). В уравнении реакции:
X+ НСI = NаС1 + Н2O
веществом Х является вещество с формулой:
А. Nа. Б. NаОН. В. Nа2O.
11 (4 балла). Соотнесите.
Формула оксида:
1. СuО. 2. СО2. 3. А12O3. 4. SО3.
Формула гидроксида:
А. Н2SО4. Б. А1(ОН)3. В. Сu(0Н)2. Г. СuОН. Д. Н2СO3.
8 класс
Тема: «Классы неорганических соединений»
Карточка 2
Задания со свободным ответом
1 (8 баллов). С какими из перечисленных веществ вступает в реакцию раствор серной кислоты: оксид магния, медь, оксид серы (VI), хлорид бария? Составьте уравнения возможных реакций
в молекулярном и ионном виде.
2 (9 баллов). Предложите не менее четырех способов получения сульфата магния. Составьте
уравнения реакций в молекулярном и ионном виде, укажите тип реакций.
3 (6 баллов). Даны вещества, формулы которых: NаОН, SО3, Н2O, СuСl2. Составьте уравнения
возможных реакций между ними.
4 (3 балла). Выберите формулу «третьего лишнего вещества в каждом ряду, используя знания
о классификации веществ:
А. СаСl2, МgО, Аl2O3.
Б. НNО3, НNО2, Н2SO4.
В. СО2, СuО, SО3.
Укажите причину, по которой вы исключили каждое вещество из предложенного списка.
8 класс
Тема: «Классы неорганических соединений»
Карточка 3
Тестовые задания с выбором одного правильного ответа и на соотнесение
1 (2 балла). Группа формул оснований:
А. КОН, НСI, Са(ОН)2. Б. Сu(ОН)2, Н2SO4, СuО. В. NаОН, Сu(ОН)2, Fе(ОН)3.
2 (2 балла). Формула хлорида хрома (III):
А. СгСl2. Б. СгСl3. В. СгОНСl2.
3 (2 балла). Группа формул, в которой содержатся основание, кислота, соль и основный оксид:
А. FеSО4, SО2, Н2СО3, Fе(ОН)2.
Б. ВаО, АlСl3, Н3РO4, Рb(NO3)2.
В. СuО, Н2SО3, КNO3, Ва(ОН)2.
4 (2 балла). Изменение свойств оксидов от основных к кислотным происходит в ряду:
А. МgО-А12О3-SiО2. Б. SО3-МgО-А12О3. В. Р2O5-Li2O-SiO2.
5 (2 балла). Пара формул веществ, реагирующих с оксидом кальция:
А. Н2O, Са(ОН)2. Б. НСl, NаОН. В. НСI, СО2.
6 (2 балла). Пара формул веществ, реагирующих с разбавленной серной кислотой:
А. Zn, NаОН. Б. Ва(ОН)2, Сu. В. СО2, МgО.
7 (2 балла). С раствором гидроксида бария реагируют:
А. Соляная кислота и оксид меди (II).
Б. Серная кислота и оксид серы (IV).
В. Гидроксид калия и оксид углерода (IV).
8 (2 балла). С водным раствором сульфата меди (II) взаимодействует:
А. Цинк. Б. Ртуть. В. Серебро.
9 (2 балла). Формулы веществ, вступающих в реакцию друг с другом:
А. СаО и Н2O. Б. Сu и НСI. В. СuО и NаОН.
10 (2 балла). В уравнении реакции:
Х + 2НNО3 = 2КNО3 + Н2О
веществом Х является вещество с формулой:
А. К. Б. КОН. В. К2О.
11 (4 балла). Соотнесите.
Формула гидроксида:
1. Н3РО4. 2. Ва(ОН)2. 3. Fе(ОН)3. 4. Н2SО4.
Формула оксида:
А. FеО. Б. Fе2О3 . В. ВаО. Г. SО3. Д. Р2О5.
8 класс
Тема: «Классы неорганических соединений»
Карточка 4
Задания со свободным ответом
1 (8 баллов). С какими из перечисленных веществ вступает в реакцию раствор гидроксида натрия: оксид бария, кальций, оксид серы (VI), хлорид меди (II)? Составьте уравнения возможных реакций в молекулярном и ионном виде.
2 (9 баллов). Предложите не менее четырех способов получения хлорида цинка. Составьте урав-
нения реакций в молекулярном виде, укажите типы реакций.
3 (6 баллов). Даны вещества: Nа, СаО, Н2О, Н2SO4. Составьте уравнения возможных реакций между ними.
4 (3 балла). Выберите формулу «третьего лишнего» вещества в каждом ряду, используя знания
о классификации веществ:
А. СаО, СuО, SО3.
Б. NаОН, Сu(ОН)2,Fе(ОН)3.
В. HCl, НNО3, Н2S03.
Укажите причину, по которой вы исключили каждое вещество из предложенного списка.
8 класс
Тема: «Классы неорганических соединений»
Карточка 5
Тестовые задания с выбором одного правильного ответа и на соотнесение
1 (2 балла). Группа формул оксидов:
А. NаОН, К2S04, Н2СO3. Б. Н2O2, СuО, ВаО. В. СаО, SO2, А12O3.
2 (2 балла). Формула хлорида железа (II):
А. FеСl2. Б. FеСl3. В. FеSО4.
3 (2 балла). Группа формул, в которой содержатся основание, кислота, соль и основный оксид:
А. HCl, SO3, NaNO3, Са(ОН)2.
Б. СuСl2, Н3РO4, КОН, СО2.
В. НNО3, FеS, Сu(ОН)2, FеО.
4 (2 балла). Изменение свойств оксидов от кислотных к основным происходит в ряду веществ
с формулами:
А. Р2О5 -А12О3 -МgО. Б. А12О3-SiО2-МgО. В. СаО-СO2-А12O3.
5 (2 балла). Пара формул веществ, реагирующих с оксидом углерода (IV):
А. Н2O, Р2O5. Б. NаОН, Н2O. В. Са(ОН)2, Н2SО4.
6 (2 балла). Пара формул металлов, реагирующих с раствором разбавленной серной кислоты:
А. Мg, А1. Б. Zп, Сu. В. Аg, Fе.
7 (2 балла). Пара формул веществ, реагирующих с раствором гидроксида калия:
А. Серная кислота, нитрат калия.
Б. Соляная кислота, хлорид меди (II).
В. Оксид фосфора (V), оксид железа (II).
8 (2 балла). С водным раствором нитрата серебра взаимодействует:
А. Золото. Б. Медь. В. Платина.
9 (2 балла). Формулы веществ, вступающих в реакцию друг с другом:
А. СаО и NаОН. Б. СuО и Н2O. В. Н2О и Р2O5.
10 (2 балла). В уравнении реакции:
СаО + Х = СаSO4 + Н2O
веществом Х является вещество с формулой:
А. Н2SО4. Б. Н2SО3. В. SO3.
11 (4 балла). Соотнесите.
Формула оксида:
1. Fе2O3. 2. СО2. 3. СаО. 4. Р2О5.
Формула гидроксида:
А. Н2СO3. Б. Fе(ОН)3. В. Fе(ОН)2. Г. Са(ОН)2. Д. Н3РO4.
8 класс
Тема: «Классы неорганических соединений»
Карточка 6
Задания со свободным ответом
1 (8 баллов). С какими из перечисленных веществ вступает в реакцию соляная кислота: оксид цинка, оксид углерода (IV), железо, медь? Составьте уравнения возможных реакций в молекулярном и ионном виде.
2 (9 баллов). Предложите не менее четырех способов получения ортофосфата натрия. Составьте уравнения реакций в молекулярном виде, укажите типы реакций.
3 (6 баллов). Даны вещества: Nа2O, SО3, H2О, СuО. Составьте уравнения возможных реакций между ними.
4 (3 балла). Выберите формулу «третьего лишнего» вещества в каждом ряду, используя знания о классификации веществ:
А. K2О, SО3, H2SO4.
Б. H2SO4, NаОН, Сu(ОН)2.
В. H2S, НNО3, KОН.
Укажите причину, по которой вы исключили каждое вещество из предложенного списка.
8 класс
Тема: «Классы неорганических соединений»
Карточка 7
Тестовые задания с выбором одного правильного ответа и на соотнесение
1 (2 балла). Группа формул солей:
А. РH3, КСl, Nа2SО4. Б. FеСl3, NаNО3, СuSO4. В. МgСl, К2S, Н3РO4.
2 (2 балла). Формула хлорида меди (II):
А. СuS. Б. СuСl. В. СuС12.
3 (2 балла). Группа формул веществ, в которой содержатся представители четырех классов неорганических соединений:
А. HNO3, СаО, Nа2S, КОН. Б. МgО, НСl, Сu(ОН)2, СО2. В. Аl2О3, H2SО4, LiОН, НВг.
4 (2 балла). Изменение свойств оксидов от основных к кислотным происходит в ряду оксидов с формулами:
А. SiO2-MgO-Р2O5. Б. MgO-SiO2-Р2O5. В. Р2O5-MgO-Li2O.
5 (2 балла). Пара формул веществ, реагирующих с оксидом лития:
А. СаО, Н2O. Б. НСI, NаОН. В. Н2SО4, СО2.
6 (2 балла). Пара формул веществ, реагирующих с разбавленной серной кислотой:
А. Нg, СО2. Б. НСI, NаОН. В. Мg, Ва(ОН)2.
7 (2 балла). Пара веществ, реагирующих с водным раствором гидроксида кальция:
А. Вода, оксид серы (VI).
Б. Азотная кислота, углекислый газ.
В. Вода, серная кислота.
8 (2 балла). Металл, вступающий в реакцию с раствором нитрата ртути (II):
А. Платина. Б. Серебро. В. Цинк.
9 (2 балла). Пара формул веществ, вступающих в реакцию друг с другом:
А. Са и Н2O. Б. СuО и Н2O. В. СО2 и Р2O5.
10 (2 балла). В уравнении реакции:
Х + Н2SO4 = Сu2SO4 + Н2O
веществом Х является вещество с формулой:
А. Сu2О. Б. СuО. В. Сu(ОН)2.
11 (4 балла). Соотнесите.
Формула гидроксида:
1. КОН. 2. Сг(ОН)2. 3. Сг(ОН)3. 4. Н2СгО4.
Формула оксида:
А. СrО. Б. СrО3. В. Сг2O3. Г. СuО. Д. К2O.
8 класс
Тема: «Классы неорганических соединений»
Карточка 8
Задания со свободным ответом
1 (8 баллов). С какими из перечисленных веществ взаимодействует раствор гидроксида бария:
хлорид железа (II), медь, оксид углерода (IV), оксид натрия? Составьте уравнения возможных
реакций в молекулярном и ионном виде.
2 (9 баллов). Предложите не менее четырех способов получения хлорида кальция. Составьте
уравнения реакций в молекулярном и ионном виде, укажите тип реакций.
3 (6 баллов). Составьте уравнения возможных реакций между веществами, формулы которых:
НСI, Р2О5, Н2O, КОН.
4 (3 балла). Выберите формулу «третьего лишнего» вещества в каждом ряду:
А. НСl, HNО3, Н2SO4. Б. СО2, Р2O5, ВаО. В. FеСl2, FеСl3, Fе2(SO4)3.
Укажите причину, по которой вы исключили каждое вещество из предложенного списка.
8 класс
Тема: «Генетическая связь между классами неорганических соединений»
Карточка 1
Тестовые задания с выбором одного правильного ответа и на соотнесение
1 (2 балла). Ряд, в котором представлены формулы веществ каждого из четырех классов неорганических соединений:
А. СuО, СО2, Н2SO4, FeS. Б. НNO3, Н2S, Аl2O3, СuСl2. В. Р2O5, NаОН, НСl, Nа2СО3.
2 (2 балла). В генетическом ряду
CuSO4 - Х -. СuО
веществом Х является вещество с формулой:
А. СuОН. Б. Сu(ОН)2. В. СuСl2.
3 (2 балла). Формула гидроксида, соответствующего оксиду серы (VI):
А. Н2S. Б. Н2SO3. В. Н2SO4.
4 (2 балла). Генетическим рядом является ряд, схема которого:
А. Сu(ОН)2 СuО
СuО ![]() Сu. Б. FеSO4
Сu. Б. FеSO4 Ее(ОН)2
Ее(ОН)2 Н2O. В. SО3
Н2O. В. SО3 Н2SО4
Н2SО4 Н2.
Н2.
5 (2 балла). Гидроксид меди (II) можно получить при взаимодействии веществ, формулы которых:
А. Сu и Н2О. Б. СuО и Н2O. В. СuСl2 и NаОН.
6 (2 балла). Пара формул веществ, взаимодействующих друг с другом:
А. Са(ОН)2 и CuO. Б. HCl и Hg. В. H2SO4 и МgО.
7 (2 балла). Гидроксид калия вступает в реакцию:
А. С гидроксидом меди (II). Б. С оксидом углерода (IV).
В. С оксидом кальция.
8 (2 балла). В схеме превращений
+x +Y
СаО  Са(ОН)2
Са(ОН)2 СаСl2
СаСl2
вещества Х и Y имеют формулы:
А. Х - Н2O, Y - НСl. Б.Х-Н2, Y - HNO3. В.Х-O2, Y - НСl.
9 (2 балла). В генетическом ряду
Э  Э2О
Э2О ![]() ЭОН
ЭОН ![]() Э2SO4
Э2SO4
элемент Э - это:
А.Литий. Б. Кальций. В. Сера
10 (2 балла). Ряд формул соединений, в котором каждое из них взаимодействует с водой при
обычных условиях:
А. СО2, SO2, SiO2. Б. ВаО, Р2O5, Li2О. В. К2O, СаО, СuО.
8 класс
Тема: «Генетическая связь между классами неорганических соединений»
Карточка 2
Задания со свободным ответом
1 (8 баллов). Составьте генетический ряд бария, используя необходимые для этого формулы веществ: Ва(ОН)2, Н2SO4, СО2, Ва, МgО, ВаSО4, ВаО.
2 (8 баллов). Напишите молекулярные и там, где это имеет место, ионные уравнения реакций
согласно схеме:
P  P2O5
P2O5 H3PO4
H3PO4 Na3PO4
Na3PO4
Укажите типы реакций по числу и составу исходных веществ и продуктов реакции.
3 (6 баллов). Допишите уравнение реакции:
? + 2НСl ![]() ? + ? + СО2
? + ? + СО2
4 (4 балла). Запишите формулы веществ А и В, пропущенных в генетическом ряду:
СuSO4 А
А ![]() В
В ![]() Cu.
Cu.
5 (4 балла). Какое количество вещества соли можно получить из 0,5 моль натрия при осуществлении перехода Nа -Nа2S?
8 класс
Тема: «Генетическая связь между классами неорганических соединений»
Карточка 3
Тестовые задания с выбором одного правильного ответа и на соотнесение
1 (2 балла). Ряд, в котором представлены формулы веществ каждого из четырех классов неорганических соединений:
А. Р2O5, Н2SО4, Н2SO3, NаОН Б. SO2, Н2SiO3, МgSО4, СuО. В. СО2, Н2S, К2SO3, КОН.
2 (2 балла). В генетическом ряду
Li  Li2O
Li2O  Х
Х ![]() LiCl
LiCl
веществом Х является вещество с формулой:
А.Li. Б.LiОН. В. НСl.
3 (2 балла). Формула гидроксида, соответствующего оксиду фосфора (V):
А. НРО2. Б. Н3РO3. В. Н3РO4.
4 (2 балла). Генетическим рядом является ряд, схема которого:
А. SO3  Н2SO4
Н2SO4  СаSO4. Б. ZnCl2
СаSO4. Б. ZnCl2 Zn(ОН)2
Zn(ОН)2 Н2O. В. Аl
Н2O. В. Аl  AlСl3
AlСl3 АgС1.
АgС1.
5 (2 балла). Хлорид меди (II) можно получить при взаимодействии веществ, формулы которых:
А. Сu и НСl. Б. СuО и НСl. В. СuОН и НСl.
6 (2 балла). Пара формул веществ, взаимодействующих друг с другом:
А. Аg и НСl. Б. SO2 и NаОН. В. СuО и NаОН.
7 (2 балла). Соляная кислота вступает в реакцию:
А. С магнием. Б. С оксидом серы ( IV ) В. С серебром.
8 (2 балла). В схеме превращений
+X +Y
P  Р2O5
Р2O5 Н3РO4
Н3РO4
вещества Х и Y имеют формулы:
А. Х - Н2О, Y - НСl. Б. Х -O2, Y - Н2. В.Х-O2,Y-Н2О.
9 (2 балла). В генетическом ряду
Э  Э2O5
Э2O5 Н3ЭO4
Н3ЭO4 Nа3ЭО4
Nа3ЭО4
элемент Э - это:
А. Калий. Б. Сера. В. Фосфор.
10 (2 балла). Ряд формул оксидов, в котором каждый из них взаимодействует с водой при обычных условиях:
А. СО2, Li2O, SО3. Б. СuО, Р2O5, СаО. В. ВаО, FеО, ZnO.
8 класс
Тема: «Генетическая связь между классами неорганических соединений»
Карточка 4
Задания со свободным ответом
1 (8 баллов). Составьте генетический ряд серы, используя необходимые для этого формулы веществ: Н2О, SO2, Fе2О3, S, СаСО3, Н2SO3, К2SO3.
2 (8 баллов). Напишите молекулярные и там, где это имеет место, - ионные уравнения реакций
согласно схеме:
Ва  ВаО
ВаО ![]() Ва(ОН)2
Ва(ОН)2 ВаSO4.
ВаSO4.
Укажите типы реакций по числу и составу исходных веществ и продуктов реакции.
3 (6 баллов). Допишите уравнение реакции:
? +?  Fе(NО3)3 + 3Н2O.
Fе(NО3)3 + 3Н2O.
4 (4 балла). Запишите формулы веществ А и В, пропущенных в генетическом ряду:
Li  А
А ![]() В
В ![]() Li3РO4.
Li3РO4.
5 (4 балла). Какое количество вещества соли можно получить из 1,5 моль алюминия при осуществлении перехода Al  А12(SO4)3?
А12(SO4)3?
8 класс
Тема: «Генетическая связь между классами неорганических соединений»
Карточка 5
Тестовые задания с выбором одного правильного ответа и на соотнесение
1 (2 балла). Ряд, в котором представлены формулы веществ каждого из четырех классов неорганических соединений:
А. СО2, СuО, НNO3, СuСl2. Б. HCl, NаОН, МgО, Са(NО3)2. В. NаСl, СаСО3, ВаО, H3PO4.
2 (2 балла). В генетическом ряду
Р  Х
Х ![]() Н3РO4
Н3РO4 К3РO4
К3РO4
веществом Х является:
А. Р. Б. P2O5 В. КОН.
3 (2 балла). Формула гидроксида, соответствующего оксиду марганца (VII):
А. Мn(ОН)2. Б. Н2МnО3. В. НМnО4.
4 (2 балла). Генетическим рядом является ряд, схема которого:
А. Ва  ВаО
ВаО ![]() Ва(ОН)2. Б. СuО
Ва(ОН)2. Б. СuО  СuСl2
СuСl2 HСl. В. СuСl2
HСl. В. СuСl2 FеСl2
FеСl2 Ее(ОН)2.
Ее(ОН)2.
5 (2 балла). Карбонат кальция можно получить при взаимодействии веществ, формулы которых:
А. Са и СО2. Б. СаО и СО. В. Са(ОН)2 и СО2.
6 (2 балла). Пара формул веществ, взаимодействующих друг с другом:
А. Н2SO4 и SiO2. Б. СО2 и КОН. В. Сu и Н3РO4.
7 (2 балла). Водный раствор сульфата меди (II) вступает в реакцию:
А. С гидроксидом железа (III).
Б. С гидроксидом калия.
В. С серебром.
8 (2 балла). В схеме превращений
+X +Y
Nа2O  NаОН
NаОН ![]() NaNO3
NaNO3
вещества Х и У имеют формулы:
А. Х - Н2O, У - КNО3. Б. Х - Са(ОН)2, У - HNO3. В. Х - Н2O, У- НNО3.
9 (2 балла). В генетическом ряду
Э  ЭО
ЭО ![]() Э(ОН)2
Э(ОН)2 ЭSO4
ЭSO4
элемент Э это:
А. Кальций. Б. Цинк. В. Медь.
10 (2 балла). Ряд формул оксидов, в котором каждый из них взаимодействует с водой при обычных условиях:
А. СаО, Nа2O, СО2.
Б. Li2О, СuО, Р2O5.
В. SiО, SО2, SО3.
8 класс
Тема: «Генетическая связь между классами неорганических соединений»
Карточка 6
Задания со свободным ответом
1 (8 баллов). Составьте генетический ряд кальция, используя необходимые для этого формулы веществ: СО2, СаSO4, МgО, СаО, АlСl3, Са(ОН)2, Са.
2 (8 баллов). Напишите молекулярные и там, где это имеет место, ионные уравнения реакций
согласно схеме:
Сu  СuО
СuО ![]() СuSO4
СuSO4 Сu(ОН)2.
Сu(ОН)2.
Укажите типы реакций по числу и составу исходных веществ и продуктов реакции.
3 (6 баллов). Допишите уравнение реакции:
? +?  Fе(ОН)3 + 3КСl.
Fе(ОН)3 + 3КСl.
4 (4 балла). Запишите формулы веществ А и В, пропущенных в генетическом ряду:
Fе  А
А ![]() В
В ![]() FеО.
FеО.
5 (4 балла). Какое количество вещества соли можно получить из 0,3 моль оксида меди (II)
при осуществлении перехода СuО  Сu(NO3)2?
Сu(NO3)2?
8 класс
Тема: «Генетическая связь между классами неорганических соединений»
Карточка 7
Тестовые задания с выбором одного правильного ответа и на соотнесение
1 (2 балла). Ряд, в котором представлены формулы веществ каждого из четырех классов неорганических соединений:
А. МgO, NаСl, КОН, Н3РO4. Б. Fе2O3, СО2, NаОН, К3РO4. В. СuО, СаСl2, НСl, Н2SO4.
2 (2 балла). В генетическом ряду
Fе  FеО
FеО ![]() Х
Х ![]() Fе(OН)2
Fе(OН)2
веществом Х является:
А. FеСl2. Б. FеCl3. В. Fе2O3.
3 (2 балла). Формула гидроксида, соответствующего оксиду хрома (VI):
А. Сг(ОН)2. Б. Сг(ОН)3. В. Н2СгО4.
4 (2 балла). Генетическим рядом является ряд, схема которого:
А. МgО  МgСl2
МgСl2 АgСl. Б. Al
АgСl. Б. Al  А1Сl3
А1Сl3
 А1(ОН)3. В P2O5
А1(ОН)3. В P2O5 Н3РO4
Н3РO4 Н2О.
Н2О.
5 (2 балла). Сульфат бария можно получить при взаимодействии веществ, формулы которых:
А. ВаО и SO2. Б. ВаО и SO3. В. Ва(ОН)2 и СО2.
6 (2 балла). Пара формул веществ, взаимодействующих друг с другом:
А. Н3РO4 и SO2. Б. СuSO4 и Fе. В. КОН и СаО.
7 (2 балла). Серная кислота вступает в реакцию:
А. С магнием.
Б. С хлороводородом.
В. С оксидом серы (IV).
8 (2 балла). В схеме превращений
+X +Y
ZnO  ZnCl2
ZnCl2  Zn(OH)2
Zn(OH)2
вещества Х и Y имеют формулы:
А. Х - HСl, Y - Cu(OH)2.
Б. Х - NаСl, Y - NaOH.
в. Х - HСl, Y - KOH.
9 (2 балла). В генетическом ряду
Э  ЭО2
ЭО2![]() Н2ЭO3
Н2ЭO3 СаЭО3
СаЭО3
элемент Э - это:
А. Азот. Б. Сера. В. Фосфор.
10 (2 балла). Ряд, в котором каждое из веществ взаимодействует с водой при обычных условиях:
А. ВаО, ZпO, СаО.
Б. Р2О5, SO2, К2О.
В. СО2, Nа2О, FеО.
8 класс
Тема: «Генетическая связь между классами неорганических соединений»
Карточка 8
Задания со свободным ответом
1 (8 баллов). Составьте генетический ряд фосфора, используя необходимые для этого формулы веществ: Nа3РО4, NаОН, Р2O5, К2SO4, Н3РО4, Са(ОН)2, Р.
2 (8 баллов). Напишите уравнения реакций, соответствующих схеме:
Mg  MgO
MgO ![]() MgCl2
MgCl2 Мg(ОН)2.
Мg(ОН)2.
Укажите типы реакций по числу и составу исходных веществ и продуктов реакции.
3 (6 баллов). Допишите уравнение реакции:
? + ?  СаСО3.
СаСО3.
4 (4 балла). Запишите формулы веществ А и В, пропущенных в генетическом ряду:
Ва  А
А ![]() В
В ![]() ВаSO4.
ВаSO4.
5 (4 балла). Какое количество вещества соли можно получить из 2 ммоль оксида фосфора (V) при осуществлении перехода Р2O5 Са3(РO4)2?
Са3(РO4)2?
8 класс
Тема: «Окислительно - восстановительные реакции»
Карточка 1
Тестовые задания с выбором одного правильного ответа и на соотнесение
1 (2 балла). Формула вещества, в котором фосфор проявляет степень окисления +5:
А. Р4. Б. РН3. В. Р2O5
2 (2 балла). Степень окисления азота в нитрате калия равна:
А. -5. Б. +3. В. +5.
3 (2 балла). Вещество, в котором степень окисления хлора равна нулю:
А. Сl2. Б. NаСl. В. КСlО3.
4 (2 балла). Окислительно - восстановительной является реакция, уравнение которой:
А. СаО + СО2 = СаСО3. Б. Сu(ОН)2 = СuО + Н2O. В. 2Н2 + O2 = 2Н2O.
5 (2 балла). Окислителем в химической реакции, протекающей в водном растворе согласно уравнению Fе + СuСl2 = Сu + FеСl2 является:
0 +2 0 +2
А. Сu. Б. Сu. В. Fе. Г. Fе.
6 (2 балла). Степень окисления водорода возрастает в ряду:
А. СаН2-Н2-Н2O.
Б. НF-Н2-NаН.
В. СН4-Н2-СаН2.
7 (2 балла). Процесс перехода, схема которого:
-2 +4
S  S является
S является
А. Восстановлением.
Б. Окислением.
В. Не окислительно - восстановительным процессом.
8 (2 балла). В уравнении реакции
4Li + O2 - 2Li2O
число электронов, принятых окислителем равно:
А. 1. Б. 2. В. 4.
9 (2 балла). Сера в степени окисления +6 может являться:
А. Только восстановителем
Б. Только окислителем.
В. И окислителем, и восстановителем.
10 (2 балла). Восстановительная способность элементов-металлов уменьшается в ряду:
А. Nа-Сu-Fе.
Б. Fе -Сu -Аg.
В. Мg-Zn-Аl.
8 класс
Тема: «Окислительно - восстановительные реакции»
Карточка 2
Задания со свободным ответом
1 (4 балла). Составьте формулы оксида серы (IV) и оксида серы (VI).
2 (8 баллов). Расставьте коэффициенты в схеме реакции методом электронного баланса:
Мg + НСl ![]() МgС12 + Н2.
МgС12 + Н2.
Назовите процессы окисления и восстановления, укажите окислитель и восстановитель.
3 (6 баллов). Расположите формулы химических соединений: РСl3, РСl5, Мg3Р2 - в порядке возрастания степеней окисления атомов фосфора.
0 _ +2
4 (10 баллов). По схеме Zn - 2е  Zn составьте уравнение химической реакции и рассмотрите ее с точки зрения окислительно-восстановительных реакций.
Zn составьте уравнение химической реакции и рассмотрите ее с точки зрения окислительно-восстановительных реакций.
5 (2 балла). Дополните фразу: «Окисление - это...»
8 класс
Тема: «Окислительно - восстановительные реакции»
Карточка 3
Тестовые задания с выбором одного правильного ответа и на соотнесение
1 (2 балла). Вещество, в котором сера проявляет степень окисления +4:
А. Н2S. Б. SО3. В. Н2SO3.
2 (2 балла). Степень окисления углерода в карбонате кальция равна:
А.-4. Б.+2. В.+4.
3 (2 балла). Вещество, в котором степень окисления фосфора равна нулю:
А. Р4. Б. РН3. В. Р2O5
4 (2 балла). Окислительно - восстановительной является реакция, уравнение которой:
А. 2Аl(ОН)3 = Аl2O3 + 3Н2O. Б. Н2 + Сl2 = 2НСl. В. NаОН + НNO3 = NaNO3 + Н2O.
5 (2 балла). Окислителем в химической реакции:
СuО + Н2 = Сu + Н2O является:
0 +2 -2 0
А. Н2. Б. Сu. В. O. Г. Сu.
6 (2 балла). Степень окисления хлора уменьшается в ряду соединений:
А. Сl2-НСl-НСlО. Б. NаСl-Сl2-КСlО3. В. НСlО4-NаСlО2-ВаСl2
7 (2 балла). Процесс перехода, схема которого
-3 +2
N  N, является:
N, является:
А. Восстановлением.
Б. Окислением.
В. Не окислительно - восстановительным процессом.
8 (2 балла). В уравнении реакции
S + O2 = SO2
число электронов, отданных восстановителем, равно:
А.2. Б.4. В.6.
9 (2 балла). Фосфор в степени окисления 0 может являться:
А. Только восстановителем
Б. Только окислителем
В. И окислителем, и восстановителем.
10 (2 балла). Простое вещество - неметалл, обладающее наиболее сильными окислительными свойствами:
А. Вг2. Б. Сl2. В. F2.
8 класс
Тема: «Окислительно - восстановительные реакции»
Карточка 4
Задания со свободным ответом
1 (4 балла). Составьте формулы оксида азота (III) и оксида азота (V).
2 (8 баллов). Расставьте коэффициенты в схеме реакции методом электронного баланса:
Са + O2 СаО.
СаО.
Укажите процессы окисления и восстановления, укажите окислитель и восстановитель.
3 (6 баллов). Расположите формулы химически соединений: СН4, СО2, СО - в порядке уменьшения степеней окисления атомов углерода.
+2 _ 0
4 (10 баллов). По схеме Сu + 2е  Сu составьте уравнение химической реакции и рассмотрите ее с точки зрения теории окислительно - восстановительных реакций.
Сu составьте уравнение химической реакции и рассмотрите ее с точки зрения теории окислительно - восстановительных реакций.
5 (2 балла). Дополните фразу: «Восстановление - это...»
8 класс
Тема: «Окислительно - восстановительные реакции»
Карточка 5
Тестовые задания с выбором одного правильного ответа и на соотнесение
1 (2 балла). Вещество, в котором степень окисления азота равна -3:
А N2. Б. N2О3. В. NН3.
2 (2 балла). Степень окисления фосфора в фосфорной кислоте равна:
А. -3. Б. +3. В. +5.
3 (2 балла). Вещество, в котором степень окисления углерода равна нулю:
А. Алмаз.
Б. Углекислый газ.
В. Угольная кислота.
4 (2 балла). Окислительно-восстановительной является реакция:
А. СаСО3 = СаО + СО2.
Б. 2Fе + 3Сl2 = 2FеСl3.
В. СаО + Н2O = Са(ОН)2.
5 (2 балла). Окислителем в химической реакции
2АgNО3 + Сu = Сu(NO3)2 + 2Аg является:
0 +1 +2 0
А.Аg. Б.Аg. В.Сu. Г.Сu.
6 (2 балла). Степень окисления водорода увеличивается в ряду соединений:
А. Н2О2-Н2O-СаН2. Б. КН-Н2-Н2O. В. Н2-СН4-MgН2.
7 (2 балла). Процесс перехода, схема которого
0 +2
Сu  Сu, является:
Сu, является:
А. Восстановлением.
Б. Окислением.
В. Не окислительно - восстановительным процессом.
8 (2 балла). В уравнении реакции
Fе2O3 + 2Аl = Аl2O3 + 2Fе
число электронов, принятых окислителем, равно:
А.2. Б.4. В.6.
9 (2 балла). Сера в степени окисления +4 может являться:
А. Только восстановителем.
Б. Только окислителем.
В. И окислителем, и восстановителем.
10 (2 балла). Простое вещество - металл, обладающее наиболее сильными восстановительными свойствами:
А. Железо. Б. Медь. В. Цинк.
8 класс
Тема: «Окислительно - восстановительные реакции»
Карточка 6
Задания со свободным ответом
1 (4 балла). Составьте формулы оксидов хлора (III)и (VII).
2 (8 баллов). Расставьте коэффициенты в схеме реакции методом электронного баланса:
Аl + S  Аl2S3.
Аl2S3.
Назовите процессы окисления и восстановления, укажите окислитель и восстановитель.
3 (6 баллов). Расположите формулы химических соединений: SO2, К2S, Н2SO4 - в порядке увеличения степеней окисления атомов серы.
0 _ -2
4 (10 баллов). По схеме O2 + 4е  2O составьте уравнение химической реакции и рассмотрите ее с точки зрения теории окислительно-восстановительных реакций.
2O составьте уравнение химической реакции и рассмотрите ее с точки зрения теории окислительно-восстановительных реакций.
5 (2 балла). Дополните фразу: «0кислителем называется...»
8 класс
Тема: «Окислительно - восстановительные реакции»
Карточка 7
Тестовые задания с выбором одного правильного ответа и на соотнесение
1 (2 балла). Вещество, в котором степень окисления углерода равна -4:
А. СО. Б. СО2. В. СН4.
2 (2 балла). Степень окисления серы в сернистой кислоте равна:
А. -2. Б. +4. В. +6.
3 (2 балла). Вещество, в котором степень окисления азота равна нулю:
А. Азот.
Б. Азотная кислота.
В. Оксид азота (IV).
4 (2 балла). Окислительно-восстановительной является реакция:
А. S + O2 = SO2. Б. СаО + SO2 = СаSO3. В. КОН + НСl = КСl + Н2O.
5 (2 балла). Окислителем в химической реакции, уравнение которой
СuО + СО = Сu + СО2, является:
+2 +4 +2 0
А.С. Б.С. В.Сu. Г.Сu.
6 (2 балла). Степень окисления азота увеличивается в ряду соединений:
А. NН3-NO2-АlN. Б. N2-NО-NО2. В. Мg3N2-НNО3-N2О.
7 (2 балла). Процесс перехода, схема которого
+1 0
2Н - Н2, является:
А. Восстановлением.
Б. Окислением.
В. Не окислительно - восстановительным процессом.
8 (2 балла). В уравнении реакции
4Аl + 3O2 = 2Аl2O3
число электронов, принятых окислителем, равно:
А.2. Б.6. В.12.
9 (2 балла). Фосфор в степени окисления +5 может являться:
А. Только восстановителем.
Б. Только окислителем.
В. И окислителем, и восстановителем.
10 (2 балла). Простое вещество - неметалл обладающее наиболее сильными окислительными свойствами:
А.Н2. Б.O2. В.F2.
8 класс
Тема: «Окислительно - восстановительные реакции»
Карточка 8
Задания со свободным ответом
1 (4 балла). Составьте формулы оксида марганца (IV) и оксида марганца (VII).
2 (8 баллов). Расставьте коэффициенты в схеме реакции методом электронного баланса:
СuСl2 + Аl  АlСl3 + Сu.
АlСl3 + Сu.
Назовите процессы окисления и восстановления, укажите окислитель и восстановитель.
3 (6 баллов). Расположите формулы химических соединений: Сl2O7, НСl, HСlO3 - в порядке
уменьшения степеней окисления атомов хлора.
+1 _ 0
4 (10 баллов). По схеме 2Н + 2е  Н2 составьте уравнение химической реакции и рассмотрите
Н2 составьте уравнение химической реакции и рассмотрите
ее с точки зрения окислительно-восстановительных реакций.
5 (2 балла). Дополните фразу: «Восстановителем называется...»
8 класс
Тема: «Количественные отношения в химии»
Карточка 1
Тестовые задания с выбором одного правильного ответа и на соотнесение
1 (2 балла). Наименьшую относительную молекулярную массу имеет вещество с формулой:
А. AsН3. Б. NН3. В. РН3.
2 (2 балла). Масса оксида магния количестом вещества 0,5 моль равна:
А. 10 г. Б. 20 г. В. 40 г.
3 (2 балла). Количество вещества гидроксида бария массой 34,2 г равно:
А. 0,1 моль. Б. 0,2 моль. В. 2 моль.
4 (2 балла). Количество вещества воды, содержащее 3 . 1023 молекул, равно:
А. 0,1 моль. Б. 0,5 молы. В. 5 моль.
5 (2 балла). На левой чашке рычажных весов лежит порошок магния массой 10 г, на правой -
такой же порошок количеством вещества 0,4 моль. Определите положение весов.
А. Перетягивает левая чашка.
Б. Перетягивает правая чашка.
в. Весы в состоянии равновесия.
6 (2 балла). 0,25 моль кислорода при нормальных условиях занимают объем:
А. 2,8 л. Б. 5,6 л. В. 11,2 л.
7 (2 балла). Массовая доля меди в оксиде меди (II) равна:
А. 20%. Б. 60%. В. 80%.
8 (2 балла). В 80 г воды растворили 20 г соли. Массовая доля соли в полученном растворе
равна:
А.10%. Б.20%. В.25%.
9 (2 балла). Объем углекислого газа, полученного при сжигании 10 л метана по уравнению реакции СН4 + 2O2 = СО2 + 2Н2O, равен:
А.10л. Б.20л. В.22,4л.
10 (2 балла). Масса серы, вступившей в реакцию с 0,5 моль магния по уравнению химической реакции Мg + S = МgS, равна:
А.16г. Б.32г. В.48г.
8 класс
Тема: «Количественные отношения в химии»
Карточка 2
Задания со свободным ответом
1 (10 баллов). В двух резиновых шариках одинаковых условиях находятся газы: в одном - азот массой 7 г, в другом - кислород количеством вещества 0,2 моль. Объем какого шарика больше? Ответ подтвердите расчетами.
2 (6 баллов). По уравнению реакции
СuО + Н2SO4 = СuSO4 + Н2О
рассчитайте массу соли, полученной при взаимодействии 40 г оксида меди (II) с раствором серной кислоты.
3 (4 балла). Дополните фразу: «Молярным объемом газа называется...»
4 (8 баллов). Расположите газы SO2, N2, NО, CO2, Н2 в порядке увеличения их плотности (массы 1 л) при одинаковых условиях.
8 класс
Тема: «Количественные отношения в химии»
Карточка 3
Тестовые задания с выбором одного правильного ответа и на соотнесение
1 (2 балла). Наибольшую относительную молекулярную массу имеет вещество с формулой:
А. НВг. Б. НF. В. НСl.
2 (2 балла). 0,4 молы воды имеют массу:
А.3,6г. Б. 7,2г. В.9г.
3 (2 балла). Количество вещества гидроксида кальция массой 7,4 г равно:
А. 0,01 моль. Б. 0,1 моль. В. 1 моль.
4 (2 балла). Количество вещества углекислого газа, содержащее 0,6 . 1023 молекул, равно:
А. 0,1 моль. Б. 1 моль. В. 10 моль.
5 (2 балла). На левой чашке рычажных весов лежит порошок цинка массой 26 г, на правой - такой же порошок количеством вещества 0,5 моль. Определите положение весов.
А. Перетягивает левая чашка.
Б. Перетягивает правая чашка.
В. Весы в состоянии равновесия.
6 (2 балла). 0,1 моль газа хлора при нормальных условиях занимают объем:
А. 1,12л. Б.2,24л. В.3,36л.
7 (2 балла). Массовая доля серы в оксиде серы (VI) равна:
А.20%. Б.40%. В.60%.
8 (2 балла). В 240 г воды растворили 60 г соли. Массовая доля соли в полученном растворе равна:
А.20%. Б.25%. В.30%.
9 (2 балла). Объем хлороводорода, полученного при взаимодействии хлора с водородом объемом 2 л по уравнению реакции Н2 + Сl2 = 2НСl, равен:
А.2л. Б.4л. В.5,6л.
10 (2 балла). Масса цинка, необходимого для реакции с 22,4 л хлора по уравнению реакции
Zn + Сl2 = ZnCl2, равна:
А.6,5г. Б.65г. В.130г.
8 класс
Тема: «Количественные отношения в химии»
Карточка 4
Задания со свободным ответом
1 (10 баллов). В двух резиновых шариках при одинаковых условиях находятся газы: в одном - кислород массой 3,2 г, в другом - углекислый газ количеством вещества 0,05 моль. Объем какого шарика больше? Ответ подтвердите расчетами.
2 (6 баллов). По уравнению реакции
Н2SO4 + 2NаОН = Nа2SO4 + 2Н2O
рассчитайте массу гидроксида натрия, необходимого для полной нейтрализации серной кислоты массой 49 г.
3 (4 балла). Дополните фразу: «Моль вещества - это...»
4 (8 баллов). Расположите газы РН3, НСl, F2, Hе, NO2 в порядке увеличения их плотности (массы 1 л) при одинаковых условиях.
8 класс
Тема: «Количественные отношения в химии»
Карточка 5
Тестовые задания с выбором одного правильного ответа и на соотнесение
1 (2 балла). Наименьшую относительную молекулярную массу имеет вещество с формулой:
А. Н2O. Б. Н2S. В. Н2Sе.
2 (2 балла). 0,2 моль оксида меди (II) имеют массу:
А. 16 г. Б. 28,8 г. В. 80 г.
3 (2 балла). Количество вещества гидроксида натрия массой 20 г равно:
А. 0,25 моль. Б. 0,5 моль. В. 0,75 моль.
4 (2 балла). Количество вещества углекислого газа, содержащее 0,3 . 1023 молекул, равно:
А. 0,05 моль. Б. 0,1 моль. В. 0,3 моль.
5 (2 балла). На левой чашке рычажных весов лежит порошок железа массой 11,2 г, на правой - такой же порошок количеством вещества 0,2 моль. Определите положение весов.
А. Перетягивает левая чашка.
Б. Перетягивает правая чашка.
В. Весы в состоянии равновесия.
6 (2 балла). 0,5 моль газа азота при нормальных условиях занимает объем:
А.5,6л. Б.11,2л. В.22,4л.
7 (2 балла). Массовая доля серы в оксиде серы (IV) равна:
А. 25%. Б. 50%. В. 75%.
8 (2 балла). В 175 г воды растворили 25 г соли. Массовая доля соли в полученном растворе равна:
А. 12,5%. Б. 14,3%. В. 25%.
9 (2 балла). Объем кислорода, необходимого для сжигания 1 л водорода по уравнению реакции
2Н2 + O2 = 2Н2O, равен:
А.0,5л. Б.1л. В.2л.
10 (2 балла). Масса железа, необходимого для реакции с 0,1 моль серы по уравнению реакции
Fе + S = FeS, равна:
А. 5,6 г. Б. 11,2 г. В. 56 г.
8 класс
Тема: «Количественные отношения в химии»
Карточка 6
Задания со свободным ответом
1 (10 баллов). В двух резиновых шариках при одинаковых условиях находятся газы: в одном - гелий массой 1 г, в другом - водород количеством вещества 0,25 моль. Объем какого шарика больше? Ответ подтвердите расчетами.
2 (6 баллов). По уравнению реакции
СuSO4 + 2NаОН = Сu(ОН)2 + Na2SO4
рассчитайте массу соли, необходимой для получения гидроксида меди (II) массой 490 г.
3 (4 балла). Дополните фразу: «Молярная масса-это...»
4 (8 баллов). Расположите газы O2, Н2S, NН3, СН4, СО в порядке увеличения их плотности (массы 1 л) при одинаковых условиях.
8 класс
Тема: «Количественные отношения в химии»
Карточка 7
Тестовые задания с выбором одного правильного ответа и на соотнесение
1 (2 балла). Наибольшую относительную молекулярную массу имеет вещество с формулой:
А. NО. Б. N2O. В. NО2.
2 (2 балла). 2 моль оксида кальция имеют массу:
А. 40 г. Б. 56 г. В. 112 г.
3 (2 балла). Количество вещества гидроксида калия массой 14 г равно:
А. 0,1 моль. Б. 0,25 моль. В. 0,5 моль.
4 (2 балла). Количество вещества кислорода, содержащее 12 . 1023 молекул, равно:
А. 0,2 моль. Б. 0,5 моль. В. 2 моль.
5 (2 балла). На левой чашке рычажных весов лежит порошок меди массой 32 г, на правой - такой же порошок количеством вещества 0,5 моль. Определите положение весов.
А. Перетягивает левая чашка.
Б. Перетягивает правая чашка.
В. Весы в состоянии равновесия.
6 (2 балла). 1,5 моль газа водорода при нормальных условиях занимают объем:
А.22,4л. Б.33,6л. В.44,8л.
7 (2 балла). Массовая доля магния в оксиде магния равна:
А.20%. Б.40%. В.60%.
8 (2 балла). В 180 г воды растворили 20 г соли. Массовая доля соли в полученном растворе равна:
А.10%. Б.11,1%. В.20%.
9 (2 балла). Объем водорода, необходимого для получения 100 л сероводорода по уравнению реакции Н2 + S = Н2S, равен:
А.50л. Б.100л. В.200л.
10 (2 балла). Объем хлора (н. у.), необходимого для сжигания в нем 32 г меди по уравнению реакции Сu + Сl2 = СuCl2, равен:
А.11,2л. Б.22,4л. В.44,8л.
8 класс
Тема: «Количественные отношения в химии»
Карточка 8
Задания со свободным ответом
1 (10 баллов). В двух резиновых шариках при одинаковых условиях находятся газы: в одном - водород массой 0,4 г, в другом - газ метан СН4 количеством вещества 0,4 моль. Объем какого шарика больше? Ответ подтвердите расчетами.
2 (6 баллов). По уравнению химической реакции Сu(ОН)2 = СuО + Н2O рассчитайте массу гидроксида меди (II), необходимого для получения оксида меди (II) массой 4 г.
3 (4 балла). Дополните фразу: «Равные объемы разных газов при одинаковых условиях содержат...»
4 (8 баллов). Расположите газы Аг, НВг, Cl2, N2О, SiН4 в порядке увеличения их плотности (массы 1 л) при одинаковых условиях.
8 класс
Тема: «Итоговая работа по химии»
Карточка 1
Тестовые задания с выбором одного правильного ответа и на соотнесение
1 (2 балла). Число атомов всех химических элементов в молекуле серной кислоты:
А. 3. Б. 4. В. 7.
2 (2 балла). Закон сохранения массы веществ впервые сформулировал:
А. Я. Й. Берцелиус. Б. А. М. Бутлеров. В. М. В. Ломоносов.
3 (2 балла). Число протонов, нейтронов и электронов в атоме фтора 199F:
А. p+ - 9; п0 - 10; 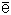 - 19.
- 19.
Б. p+ - 10; п0 - 9; 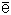 - 10.
- 10.
В. p+ - 9; п0 - 10; 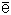 - 9.
- 9.
4 (2 балла). Группа формул веществ с ковалентным типом связи:
А. Н2S, Р4, СО2. Б. НСl, NаСl, Н2O. В. СаО, SO2, СН4.
5 (2 балла). В 180 г воды растворили 20 г соли. Массовая доля соли в полученном растворе:
А. 9%. Б. 10%. В. 20%.
6 (2 балла). Химическая реакция, уравнение которой Nа2O + Н2O = 2NaOH является реакцией:
А. Соединения, окислительно - восстановительной.
Б. Соединения, не окислительно - восстановительной.
В. Обмена, не окислительно - восстановительной.
7 (2 балла). Вещество, не вступающее в реакцию с раствором разбавленной серной кислоты:
А. Гидроксид магния. Б. Медь. В. Оксид цинка.
8 (2 балла). Вещество, при растворении которого в воде электролитической диссоциации практически не происходит:
А. Гидроксид натрия.
Б. Сульфат калия.
В. Хлорид серебра.
9 (2 балла). Одновременно могут находиться в растворе ионы:
А. Nа+, Н+, Ва2+, ОН-.
Б. Mg2+, K+, NO3-, SO42-.
В. Fe2+, Na+, OH-, SO42-.
10 (2 балла). Среди веществ, формулы которых ВаСl2, СаО, СаСО3, NаОН, Мg(ОН)2, SiO2, нет представителя класса:
А. Кислот. Б. Оксидов В. Оснований.
8 класс
Тема: «Итоговая работа по химии»
Карточка 2
Задания со свободным ответом
1 (6 баллов). Назовите вещества, формулы которых МgО, S, Р2O5, Н2SO4, Fе(ОН)3, Nа, КОН, НF, Ва(NО3)2, и укажите класс, к которому они относятся.
2 (10 баллов). Изобразите схемы электронного строения атомов химических элементов серы
и углерода. Запишите формулы соединений, в которых эти атомы проявляют максимальную
и минимальную степени окисления (не менее четырех формул).
3 (10 баллов). Составьте уравнения химических реакций согласно схеме
Fе  FеСl2
FеСl2 Fе(ОН)2
Fе(ОН)2 FеО
FеО ![]() Fе.
Fе.
Дайте краткую характеристику химических реакций по известным вам признакам.
4 (4 балла). По уравнению реакции Н2SO4 + 2NаОН = Nа2SO4 + 2Н2O рассчитайте массу гидроксида натрия, необходимого для полной нейтрализации раствора, содержащего 24,5 г серной кислоты.
8 класс
Тема: «Итоговая работа по химии»
Карточка 3
Тестовые задания с выбором одного правильного ответа и на соотнесение
1 (2 балла). Число атомов всех химических элементов в молекуле фосфорной кислоты равно:
А.3. Б.6. В.8.
2 (2 балла). Зависимость скорости химических реакций от температуры установил:
А. Авогадро. Б. Вант-Гофф. В. Парацельс.
3 (2 балла). Число протонов, нейтронов и электронов в атоме изотопа хлора 3517Cl:
А. p+ - 17; п0 - 18; 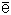 - 17.
- 17.
Б. p+ - 18; п0 - 18; 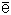 - 18.
- 18.
В. p+ - 17; п0 - 18; 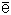 - 18.
- 18.
4 (2 балла). Группа формул веществ с ионным типом химической связи:
А. КСI, НF, Nа2S. Б. К2O, NаН, NаF. В. СО2, ВаСl2, NаОН.
5 (2 балла). Масса соли, содержащейся в 150 г 5%-ного раствора соли, равна:
А. 5 г. Б. 7,5 г. В. 30 г.
6 (2 балла). Химическая реакция, уравнение которой 2КСlO3 = 2КСl + 3O2, является реакцией:
А. Разложения, окислительно - восстановительной.
Б. Разложения, не окислительно - восстановительной.
В. Замещения, окислительно - восстановительной.
7 (2 балла). Вещество, вступающее в реакцию с раствором гидроксида натрия:
А. Оксид фосфора (V).
Б. Оксид меди (II).
В. Хлорид серебра.
8 (2 балла). Вещество, которое в водном растворе полностью диссоциирует:
А. Оксид меди (II).
Б. Нитрат калия.
В. Сульфат бария.
9 (2 балла). Одновременно не могут находиться в растворе ионы:
А.Н+, Ва2+, ОН-, NО3-.
Б. К+, Zn2+, С1- , SО42- .
В. Na+, Fe2+, NО3-, SО42- .
10 (2 балла). Среди веществ, формулы которых H2O, NН3, СО2, К2O, Ва(ОН)2, НСl, нет представителя класса:
А. Кислот.
Б. Оксидов.
В. Оснований.
Г. Солей.
8 класс
Тема: «Итоговая работа по химии»
Карточка 4
Задания со свободным ответом
1 (6 баллов). Назовите вещества, формулы которых Н3РO4, Мg, СО2, Н2S, ВаО, NаОН, O2,
К2СO3, Сu(ОН)2, и укажите класс, к которому они относятся.
2 (10 баллов). Изобразите схемы электронного строения атомов химических элементов фосфора и хлора. Запишите формулы соединений, в которых эти атомы проявляют максимальную и минимальную степени окисления (не менее четырех формул).
3 (10 баллов). Запишите уравнения химических реакций согласно схеме
Fе(ОН)3 Fе2O3
Fе2O3 Fе
Fе ![]() FеSО4
FеSО4 Fе(ОН)2.
Fе(ОН)2.
Дайте краткую характеристику химических реакций по известным вам признакам.
4 (4 балла). По уравнению реакции
Н3РО4 + 3КОН = К3РO4 + 3Н2O
рассчитайте массу гидроксида калия, необходимого для полной нейтрализации раствора, содержащего 4,9 г фосфорной кислоты.
8 класс
Тема: «Итоговая работа по химии»
Карточка 5
Тестовые задания с выбором одного правильного ответа и на соотнесение
1 (2 балла). Число атомов всех химических элементов в молекуле азотной кислоты равно:
А.3. Б.4. В.5.
2 (2 балла). Основные положения теории электролитической диссоциации сформулировал:
А. Аррениус. Б. Вант-Гофф. В. Ле Шателье.
3 (2 балла). Число протонов, нейтронов и электронов в атоме изотопа калия 3919K
А. p+ - 19; п0 - 20; 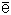 - 19.
- 19.
Б. p+ - 19; п0 - 20; 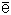 - 39.
- 39.
В. p+ - 20; п0 - 19; 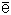 - 20.
- 20.
4 (2 балла). Группа формул веществ с ковалентным типом связи:
А. ВаСl2, Сl2, SO3. Б. N2, Н2O, SО2. В. NаОН, NН3, НF.
5 (2 балла). В 450 г воды растворили 50 г соли. Массовая доля соли в полученном растворе равна:
А. 9%. Б. 10%. В. 11,1%.
6 (2 балла). Химическая реакция, уравнение которой
Сu(ОН)2 + 2НСl = СuСl2 + 2Н2O,
является реакцией:
А. Соединения, окислительно - восстановительная.
Б. Замещения, окислительно - восстановительная.
В. Обмена, не окислительно - восстановительная.
7 (2 балла). Вещество, не вступающее в реакцию с раствором соляной кислоты:
А. Барий. Б. Оксид магния. В. Оксид серы (IV).
8 (2 балла). Вещество, при растворении которого в воде электролитической диссоциации практически не происходит:
А. Гидроксид меди (II). Б. Нитрат цинка. В. Серная кислота.
9 (2 балла). Одновременно могут находиться в растворе ноны:
А. K+, Ca2+, Cl-, CO32-.
Б. H+, Mg2+, NO3-, CO32-.
В. Na+, Al3+, NO3-, SO42-.
10 (2 балла). Среди веществ, формулы которых Н3РO4, Fе(ОН)2, NаОН, СаСl2, К2СO3, НF, нет представителя класса:
А. Кислот.
Б. Оксидов.
В. Оснований.
Г. Солей.
8 класс
Тема: «Итоговая работа по химии»
Карточка 6
Задания со свободным ответом
1 (6 баллов). Назовите вещества, формулы которых НNО3, Zn, SО2, Fе2О3, Р, HСl, LiОН, СаСО3, Fе(ОН)2, и укажите класс, в которому они относятся.
2 (10 баллов). Изобразите схемы электронного строения атомов химических элементов азота
и кремния. Запишите формулы соединений, в которых эти атомы проявляют максимальную и минимальную степени окисления (не менее четырех формул).
3 (10 баллов). Запишите уравнения химических реакций согласно схеме:
Nа  NаОН
NаОН ![]() Сu(ОН)2
Сu(ОН)2 СuО
СuО ![]() Сu.
Сu.
Дайте краткую характеристику реакций по известным вам признакам.
4 (4 балла). По уравнению реакции
2НNО3 + Са(ОН)2 = Са(NO3)2 + 2Н2O
рассчитайте массу гидроксида кальция, необходимого для полной нейтрализации раствора, содержащего 12,6 г азотной кислоты.
8 класс
Тема: «Итоговая работа по химии»
Карточка 7
Тестовые задания с выбором одного правильного ответа и на соотнесение
1 (2 балла). Число атомов всех химических элементов в молекуле сернистой кислоты Н2SО3:
А.3. Б.5. В.6.
2 (2 балла). Буквенное обозначение символов химических элементов ввел:
А. Я. Берцелиус. Б. М. В. Ломоносов. В. Д. И. Менделеев.
3 (2 балла). Число протонов, нейтронов и электронов в атоме изотопа натрия 2311Na:
А. p+ - 11; п0 - 12; 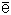 - 23.
- 23.
Б. p+ - 12; п0 - 11; 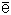 - 12.
- 12.
В. p+ - 11; п0 - 12; 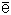 - 11.
- 11.
4 (2 балла). Группа формул веществ с ионным типом химической связи:
А. ВаО, Nа2S, МgСl2. Б. Nа2O, NаСl, НСl. В. ВаS, SО2, СаF2.
5 (2 балла). Масса соли, содержащейся в 300 г 3%-ного раствора соли, равна:
А. 9 г. Б. 10 г. В. 100 г.
6 (2 балла). Химическая реакция, уравнение которой
Cu(OH)2 = CuO + H2O,
является реакцией:
А. Разложения, окислительно - восстановительной.
Б. Разложения, не окислительно - восстановительной.
В. Соединения, окислительно - восстановительной.
7 (2 балла). Вещество, вступающее в реакцию с раствором гидроксида калия:
А. Гидроксид меди (II).
Б. Оксид меди (II).
В. Хлорид меди (II).
8 (2 балла). Вещество, при растворении которого в воде практически не происходит электролитическая диссоциация:
А. Глюкоза. Б. Серная кислота. В. Хлорид серебра.
9 (2 балла). Одновременно не могут находиться в растворе ионы:
А. K+, Al3+, Cl-, NO3-.
Б. Na+, Ba2+, Cl-, CO32-.
В. H+, Mg2+, NO3-, SO42-.
10 (2 балла). Среди веществ, формулы которых СuО, Н2S, СН4, Р2O5, МgСl2, СuS, нет представителя класса:
А. Кислот.
Б. Оксидов.
В. Оснований.
Г. Солей.
8 класс
Тема: «Итоговая работа по химии»
Карточка 8
Задания со свободным ответом
1 (6 баллов). Назовите вещества, формулы которых Zn(ОН)2, Н2SО3, NаСl, Аl, Ва(ОН)2, SO3, N2, НВг, СаО, и укажите класс, к которому они относятся.
2 (10 баллов). Изобразите схемы электронного строения атомов химических элементов водорода и хлора. Запишите формулы соединений, в которых эти атомы проявляют максимальную и минимальную степени окисления (не менее четырех формул).
3 (10 баллов). Запишите уравнения химических реакций согласно схеме:
НСl  ZnСl2
ZnСl2 Zn(ОН)2
Zn(ОН)2 Zn(NО3)2
Zn(NО3)2
ZnO
Дайте краткую характеристику реакций по известным вам признакам.
4 (4 балла). По уравнению реакции
2НСl + Ва(ОН)2 = ВаСl2 + 2Н2О
рассчитайте массу гидроксида бария, необходимого для полной нейтрализации раствора, содержащего 29,2 г хлороводорода.


