- Преподавателю
- Химия
- Рабочая тетрадь по интегрированному курсу химии и металловедения Химические основы металловедения для студентов 1 курса обучающихся по профессиям, связанным с металлообработкой
Рабочая тетрадь по интегрированному курсу химии и металловедения Химические основы металловедения для студентов 1 курса обучающихся по профессиям, связанным с металлообработкой
| Раздел | Химия |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Малкова С.Л. |
| Дата | 26.11.2015 |
| Формат | doc |
| Изображения | Есть |
ДЕПАРТАМЕНТ ОБРАЗОВАНИЯ ВОЛОГОДСКОЙ ОБЛАСТИ
БПОУ ВО «ВОЛОГОДСКИЙ СТРОИТЕЛЬНЫЙ КОЛЛЕДЖ»

Рабочая тетрадь
по
интегрированному курсу химии и металловедения
"Химические основы металловедения"
для студентов 1 курса
обучающихся по профессиям, связанным с металлообработкой

Вологда
2015
Рассмотрено на заседании предметно-цикловой комиссии преподавателей специальных дисциплин и мастеров производственного обучения от 10.11.2014 протокол № 3.
Председатель комиссии : Крюкова Т.А.
Назначение рабочей тетради
Рабочая тетрадь разработана для интегрированного курса "Химические основы металловедения".
Данная рабочая тетрадь позволяет раскрыть химические закономерности, лежащие в основе строения, свойств, обработки, производства металлов на примере железа, предназначена для совершенствования теоретических знаний и формирования практических умений и навыков по программам дисциплин «Основы материаловедения» и "Химии" для профессии связанных с металлообработкой.
В тетради содержится большое количество заданий, которые могут быть использованы для изучения нового материала, отработки и проверки знаний, умений и навыков, закрепления основных понятий по темам:
- Строение химических веществ и материалов
- Вещество
- Химические реакции и их классификация
- Простые вещества металлы
Содержание рабочей тетради учитывает профиль и специфику подготовки специалистов по профессии "Сварщик" и способствует реализации главной цели - обеспечить студентам общепрофессиональный уровень подготовки по дисциплине.
Предназначено для внутреннего пользования при организации лабораторных и практических работ для студентов БПОУ ВО "Вологодский строительный колледж".
Автор: Малкова С.Л., преподаватель материаловедения, высшая категория.
Рецензент: Цикина Т.И., преподаватель общепрофессиональных и профессиональных дисциплин, АОУ ВО СПО «Вологодский колледж связи информационных технологий».
Строение химических веществ и материалов
БЛОК "ХИМИЯ"
Тема: Химическая связь и ее виды
Цель: дать определение химической связи, познакомиться с основными типами химической связи, проанализировать взаимосвязь между строением и свойствами веществ и материалов.
Источник информации: О.С.Габриелян, Химия - 11 класс", стр.44 - 52
Задание для студентов:
1.прочитайте информацию в учебнике
2. выпишите определение "Химическая связь"
3. заполните таблицу "Основные типы химической связи", используя материал учебника.
Химическая связь________________________________________________________________________
_________________________________________________________________________________________
Таб. 1. Основные типы химической связи
Тип связи
Определение
Примеры веществ
Свойства веществ
Механизм образования
Ионная
Ковалентная
А)полярная
Б)неполярная
Металлическая
Водородная
Контрольные вопросы:
1.Какой тип кристаллической решетки у веществ с ионной связью?_______________________________
2. Какие типы кристаллических решеток у веществ с ковалентной связью?__________________________________________________________________________________
3. Какой тип кристаллической решетки у веществ с металлической связью?________________________
4. Какой тип кристаллической решетки у веществ с водородной связью?___________________________
5. Какие свойства металлов обусловлены металлической химической связью?______________________
________________________________________________________________________________
БЛОК "МАТЕРИАЛОВЕДЕНИЕ"
Тема "Типы кристаллических решеток"
Цель: познакомиться с разными типами строения веществ, изучить основные понятия темы, изучить основные типы кристаллических решеток, проанализировать влияние строения металлической кристаллической решетки на свойства металлов.
Источник информации: Адаскин А.М. Материаловедение, 2004, стр. 5,8- 10.
Задание для студентов:
1. Прочитайте в учебнике материал: "Металлическая связь" на стр. 5,
"Атомно - кристаллическое строение металлов" на стр. 8 -10.
2. Найдите и выпишите определения основных понятий темы.
1. Основные понятия темы.
1. Металлическая химическая связь (особенности)________________________________________________
___________________________________________________________________________________________
2. Электронный газ (определение)______________________________________________________________
___________________________________________________________________________________________
3. Свойства металла, определяемые электронным газом___________________________________________
___________________________________________________________________________________________
4. Кристаллическая решетка___________________________________________________________________
___________________________________________________________________________________________
5. Минимальная кристаллическая ячейка________________________________________________________
___________________________________________________________________________________________
6. Узел_____________________________________________________________________________________
7. Координационное число____________________________________________________________________
___________________________________________________________________________________________
8. Период решетки___________________________________________________________________________
___________________________________________________________________________________________
9. Базис решетки____________________________________________________________________________
___________________________________________________________________________________________
10. Коэффициент компактности________________________________________________________________
___________________________________________________________________________________________
11. Полиморфизм____________________________________________________________________________
___________________________________________________________________________________________
12. Анизотропия_____________________________________________________________________________
___________________________________________________________________________________________
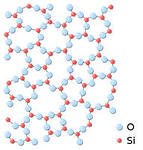
Таб. 1. Строение материалов
Признак
Кристаллические материалы
Аморфные материалы
Строение
Определение
имеют упорядоченную структуру, температуры плавления и кипения строго определенная.
не имеют упорядоченной структуры, температуры плавления и кипения изменяются в широком диапазоне.
Примеры материалов
металлы, сплавы, соли, минералы.
стекло, пластмасса, каучук.3. Типы кристаллических решеток
Задание для студентов: начертите в тетради таблицу "Типы кристаллических решеток" , заполните ее , используя материал предыдущего урока и учебник (Адаскин А.М. Материаловедение, 2004, стр. 4 - 5)
Таб.2 Типы кристаллических решеток
Тип химической связи
Тип кристаллической решетки
Пример материала
Ионная
Ковалентная
Металлическая
Водородная
Задание для студентов: ознакомьтесь с моделями кристаллических решеток, заполните в таблице вторую графу, используя учебник.
Источник информации: Адаскин А.М., Материаловедение , стр. 9 - 10
Модель кристаллической решетки
Характеристика

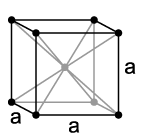
Кубическая объемноцентированная
ОЦК
Координационное число _____________
Примеры:__________________________
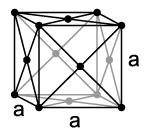
Кубическая гранецентрированная
ГЦК
Координационное число_______________
Примеры: ___________________________
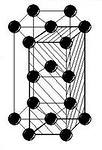
Гексагональная плотноупакованная
ГПУ
Координационное число_________________
Примеры:_____________________________
Контрольные вопросы
1.Какие свойства металлов определяет наличие электронного газа?______________________
_______________________________________________________________________________
2. Какая особенность строения металлов определяет пластичность металлов?_______________________________________________________________________
________________________________________________________________________________
3. Какие методы изготовления металлопродукции применяют в машиностроении?_________
________________________________________________________________________________
Тема: Кристаллизация металлов.
Цель: познакомиться процессами кристаллизации в металлах и сплавах, строением металлического слитка.
Источник информации: Адаскин А.М. Материаловедение, 2004, стр. 14 - 18.
Задание для студентов: прочитайте материал в учебнике и заполни тетрадь.
Первичная кристаллизация - это_____________________________________________________________
_________________________________________________________________________________________
Характеристики кристаллизации:
1. Равновесная температура-________________________________________________________________
_________________________________________________________________________________________
2.Фактическая температура кристализации-___________________________________________________
_________________________________________________________________________________________
3.Степень переохлаждения-_________________________________________________________________
_________________________________________________________________________________________
4. Скрытая теплота кристаллизации-__________________________________________________________
_________________________________________________________________________________________
_________________________________________________________________________________________
Схематическое описание кристаллизации_____________________________________________________
_________________________________________________________________________________________
_________________________________________________________________________________________
_________________________________________________________________________________________
_________________________________________________________________________________________
_________________________________________________________________________________________
_________________________________________________________________________________________
Величины, определяющие скорость процесса кристаллизации:
1. Скорость зарождения центров кристаллизации_______________________________________________
_________________________________________________________________________________________
_________________________________________________________________________________________
2. Скорость роста кристаллов________________________________________________________________
_________________________________________________________________________________________
_________________________________________________________________________________________
3. Величина зарна_________________________________________________________________________
_________________________________________________________________________________________
Влияние величины зерна металла на механические свойства_____________________________________
_________________________________________________________________________________________
_________________________________________________________________________________________
Строение слитка
Дендрит-_________________________________________________________________________________
_________________________________________________________________________________________
Строение слитка (зарисуйте строение слитка из учебника стр. 17 рис 19. и подпишите основные части и усадочную раковину).
Проверь себя
ТРЕБОВАНИЯ К УРОВНЮ ПОДГОТОВКИ
Знать и понимать
1. определение химической связи, основные типы химической связи, анализировать взаимосвязь между строением и свойствами веществ и материалов,
2. разные типы строения веществ, основные типы кристаллических решеток, анализировать влияние строения металлической кристаллической решетки на свойства металлов.
Уметь
определять тип кристаллической решетки по модели, тип химической связи по химической формуле.
Задание: Часть А. Выбери один правильный ответ из предлагаемых вариантов
1. Связь, образованная путем образования общих электронных пар.
а) ионная, б) ковалентная, в) металлическая, г) водородная.
2. Частицы, принимающие участие в образовании ионной химической связи.
а) ионы, б) молекулы, в) атомы, г) протоны.
3. Определить вещество с ковалентным полярным типом химической связи по химической формуле.
а) Сr, б) Аr2, в) 3 ВаСl2, г) 5 СН4, д) NН3.
4. Свойства, характерные для веществ с металлическим типом химической связи.
а)твердые с высокими температурами плавления, пластичные, ковкие, тепло- и электропроводные.,
б) твердые с высокими температурами плавления, прочные.
в) легкосжижающиеся газы и жидкости.
5. Определить по чертежу тип кристаллической решетки
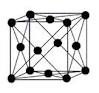
А. кубическая гранецентрированная
Б. кубическая обьемноцентированная
В. гексагональная плотноупакованная
Г. ионная
6. Тип химической связи в чугунах:
А. ионная Б. ковалентная В.металлическая Г. водородная
7. Электронный газ - это…
А. все атомы в кристаллической решетке
Б. все ионы в кристаллической решетке
В.все электроны в кристаллической решетке
Г.свободно передвигающиеся электроны в кристаллической решетке
8. Узлы в кристаллической решетке - это…
А. все атомы в кристаллической решетке
Б. все ионы в кристаллической решетке
В.все электроны в кристаллической решетке
Г. все атомы и ионы в кристаллической решетке
Часть Б. Выбрать из перечня кристаллические материалы(3 балла).
А. сталь, Б. стекло, В. железо Г. древесина, Д. резина, Е. алюминий
Часть В. Выберите 3 правильных ответа.
1. Пластичность металлов определяет наличие металлической химической связи.
2. Электронный газ - это химическое вещество.
3. В металлах атомная кристаллическая решетка.
4. Многие металлы имеют разные кристаллические решетки при разных температурах, это явление называется полиморфизм.
5. У перечисленных материалов металлический тип химической связи: цинк, железо, сталь
6. Атомы и электроны в металлах удерживают силы взаимного отталкивания.
Ответ: ____________________________________________________________
Вещество
БЛОК "ХИМИЯ"
Тема: Растворы
Цель работы: познакомиться с особенностями растворов и их классификацией, с типом растворов при кристаллизации железа с углеродом
Источник информации: учебник О.С.Габриелян «Химия - 11 класс», стр. 70 - 71.
Задание для студентов: прочитайте материал в учебнике и заполните рабочую тетрадь.
Раствор - это____________________________________________________________________
________________________________________________________________________________
Растворы всегда однофазны, т.е. представляют собой однородный газ, жидкость или твердое вещество.
Это связано с тем, что_____________________________________________________________
________________________________________________________________________________
Растворитель - это________________________________________________________________
________________________________________________________________________________
Примеры: а) жидкий - вода в растворе _______________________________________________
б) газообразный - воздух это раствор_______________________________________________
в) твердые растворы- образуются при кристаллизации железа и углерода (сталь, чугун).
Теория растворов
Автор ________________________________ Год открытия______________________________
Сущность теории_________________________________________________________________
________________________________________________________________________________
БЛОК "МАТЕРИАЛОВЕДЕНИЕ"
Тема: Основы теории сплавов
Цель работы: познакомиться с основными понятиями темы, изучить типы соединений , образующихся при кристаллизации железоуглеродистых сплавов, построить диаграмму состояния железо - углеродистых сплавов, научиться наносить на нее критические точки.
Источник информации: Адаскин А.М., Материаловедение , стр. 18 -19, 54-55
Задание для студентов: прочитайте материал в учебнике и заполните рабочую тетрадь.
Сплав - это_______________________________________________________________________
Компоненты - это__________________________________________________________________
Типы соединений, образующиеся при кристаллизации сплава:
а) рис13 г) ______________________________________________(пример: перлит, ледебурит)
б) рис 13 б) ______________________________________________(пример: феррит, цементит)
в) рис 13 в) ____________________________________________________ (пример: цементит)
г) рис 13 ж) жидкий раствор сахара в воде__________________________ (пример: чай)
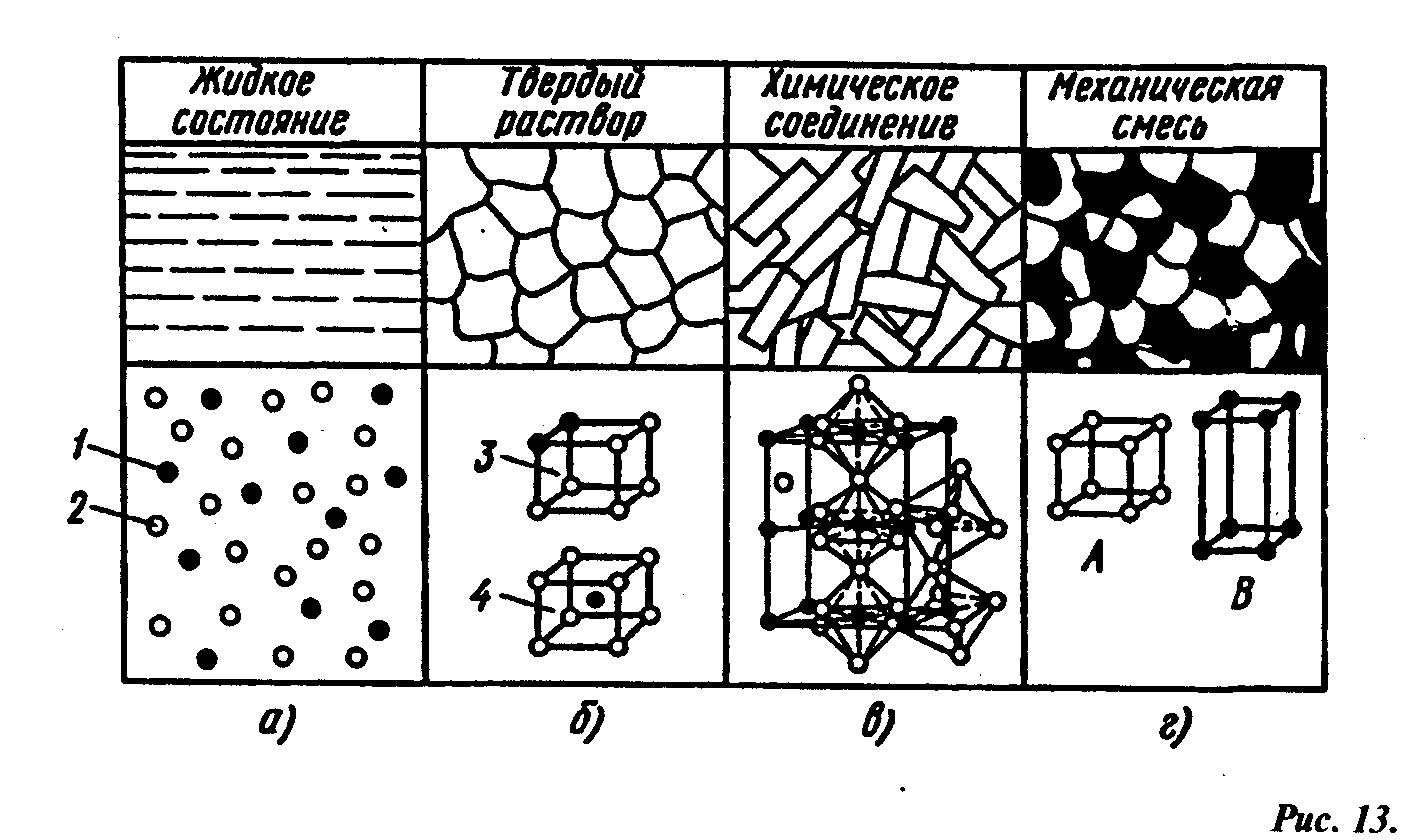
Условные обозначения
1. атом одного элемента, 2 атом другого элемента, 3. твердый раствор замещения, 4. твердый раствор внедрения
Справка: Диаграмма состояния «Железо - цементит» - график отражающий, состояние составляющих компонентов в системе «железо - углерод»
Критические точки - точки в которых изменяется состояние системы «железо - углерод»
Эвте́ктика (греч. éutektos - легкоплавящийся) - нонвариантная (при постоянном давлении) точка в системе из нескольких компонентов, в которой находятся в равновесии твердые фаз и жидкие фазы.
Ликвидус - линия на фазовых диаграммах полного плавления твёрдых фаз. ( ABCD)
Солидус (лат. solidus «твёрдый») - линия на фазовых диаграммах, температура, при которой плавится самый легкоплавкий компонент. (AHIECF)
Сталь - стр.54_________________________________________________________________
_______________________________________________________________________________
Чугун - стр.54_________________________________________________________________
_______________________________________________________________________________
-
Состав железо - углеродистых сплавов.
Задание для студентов: заполните таблицы, используя материал учебника стр. 53 -54
Растворитель- железо. Растворяемое вещество - углерод.
Таблица 1. Однофазные составляющие
Название
Состав
Кристаллическая решетка
Свойства
Феррит
Аустенит
Цементит
Таблица 2. Двухфазные составляющие
Двухфазные составляющие
Состав
Свойства
Перлит
Ледебурит
-
Построение диаграммы «Железо - цементит».
а ) Отложите в тетради для построения графика два луча по вертикали и по горизонтали.
) Отложите в тетради для построения графика два луча по вертикали и по горизонтали.

б) подпишите лучи: по горизонтали "Температура" - Т,
по вертикали - "Концентрация углерода" - С%
в) используя шаблон в учебнике на стр. 54, начертите диаграмму.
г) обозначите на ней основные точки: А, В,С, Д, Е, F, O, R, L, S.
Контрольные вопросы
1. Какие типы соединений могут образовываться при кристаллизации сплавов?
2. Что называют графитизацией?
3. Чем отличается сталь и чугун?
Проверь себя
ТРЕБОВАНИЯ К УРОВНЮ ПОДГОТОВКИ
Знать и понимать
особенности растворов и их классификацию, типы образующихся растворов при кристаллизации железа с углеродом,
Уметь
строить диаграмму состояния железо - углеродистых сплавов, наносить на нее критические точки и определять их координаты.
Задание: Часть А. Выбери один вариант ответа
1. Координаты точки «С» по Диаграмме состояния системы "железо - цементит"
А. Т - 1200о, С% - 2, Б. Т - 1500о, С% - 5
В. Т - 1500о, С% - 0,8 Г. Т - 1147о, С% - 4,3
2. Сталь это - ......продолжи фразу
А. Сплав железа с углеродом, содержащий более 2% углерода
Б. Сплав железа с углеродом, содержащий менее 2% углерода
В. Сплав железа с водородом, содержащий более 2% углерода
Г. Чистое железо
3. Выбери однофазную составляющую железо-углеродистых сплава
А. Перлит Б. феррит В. ледебурит Г. сталактит
4. Вещество - растворитель в чугунах.
А. железо Б. углерод В. вода Г. кислород
5. Раствор - это..... продолжи фразу
а. гомогенная система из 2 и более компонентов
б. гетерогенная система из 2 и более компонентов
в. однокомпонентная система
Часть Б.
Б 1. При кристаллизации железа образуются следующие типы соединений...(выбери 3 ответа)
А. химические соединения
Б. жидкие растворы
В. механические смеси
Г. твердые растворы
Д. неметаллические соединения
Е. газообразные растворы
Б 2. Найди соответствие
Тип раствора
Пример раствора
1
Газообразный
А
Чугун
2
Жидкий
Б
Воздух
3
Твердый
В
Сахарный сироп
Г
Сталь
Д
Прпан-бутановая смесь
Е
Чай
Б3. Выберите 3 правильных ответа.
1. Критические точки - точки в которых изменяется состояние системы «железо - углерод»
2. Эвте́ктика - точка в системе из нескольких компонентов, в которой твердые и жидкие фазы выходят из равновесия
3. Перлит - это однофазная составляющая системы"железо- углерод"
4. Феррит - твердый раствор углерода в α - железе
5. Диаграмма состояния железо - углеродистых сплавов это график отражающий состояние компонентов в зависимости от изменения давления.
6. Растворы всегда однофазны.
ХИМИЧЕСКИЕ РЕАКЦИИ И ИХ КЛАССИФИКАЦИЯ
БЛОК "ХИМИЯ" и "МАТЕРИАЛОВЕДЕНИЕ"
Цель работы: познакомиться с основными понятиями темы, изучить классификацию химических реакций, объяснить закономерности химических процессов протекающих при сварке металла.
Источник информации: учебник О.С.Габриелян «Химия - 11 класс», стр. 100
Задание для студентов: прочитайте материал в учебнике и выпишите определения в рабочую тетрадь.
Химические реакции это___________________________________________________________
__________________________________________________________________________________________________________________________________________________________________
Таб.1 Классификация химических реакций
Признак реакции
По числу и составу реагирующих веществ
Тип реакции
Определение
Химическое уравнение
Пример применения в металлообработке
При ручной дуговой сварке электродами с толстым слоем покрытия химические реакции между металлом, шлаком и газами дуги протекают в момент перехода капель расплавленного металла электрода и покрытия через дуговой промежуток при температуре 2100-2300° С. Дальнейшие химические и физические процессы протекают в сварочной ванне. При сварке под флюсом основные химические реакции происходят только в сварочной ванне под слоем расплавленного флюса.
Реакции соединения
Cтр. 102
2Fe + O2 = 2 FeO
2Fe +1,5 O2 = Fe2O3
Окисление. Кислород является наиболее вредной примесью в зоне сварки, так как окисляет элементы, входящие в состав металла шва, и ухудшает его качество, образуя химические соединения - окислы. Окисление элементов в основном происходит за счет кислорода, содержащегося в газах, шлаках сварочной зоны и окружающем воздухе.
4Fe + N2 = 2Fe2N
Азот в зону сварки попадает из воздуха и в зоне сварки находится как в молекулярном, так и в атомарном состоянии. Атомарный азот более активно растворяется в расплавленном металле сварочной ванны, чем молекулярный, образуя при этом нитриды железа (Fe2N, Fe4N), которые, в свою очередь, снижают пластичность и повышают твердость наплавленного металла.
Fe + Н2= Fe Н2
Водород в зоне сварки образуется во время диссоциации водяных паров при высокой температуре дуги. Водяные пары поступают в зону сварки из атмосферной влаги, а также из влаги, содержащейся в покрытии электродов, флюсах, ржавчине на кромках заготовок, вызывая при этом значительные внутренние напряжения и, как следствие, образование флокенов. Гидриды и флокены снижают прочность и пластичность металла шва, что, в свою очередь, приводит к водородной хрупкости и образованию трещин
Реакции разложения
Стр.103
Fe3C = 3 Fe + C
Свободный углерод в чугуне может выделяться непосредственно из жидкости при очень медленном охлаждении или в результате распада цементита
Реакции замещения
Стр. 104
Fe + CO = FeO + C
Fe + H2O = FeO + H2
При сварке стали окисление железа может происходить также под действием кислорода газов: СО, С02 и паров воды Н20
Раскисление кремнием и марганцем происходит в ходе реакций
2 FeO+Si=SiO2 +2Fe
FeO+ Mn=MnO+Fe
Присутствие кислорода в металле шва в виде твердого раствора или включений окислов сказывается на ухудшении механических свойств наплавленного металла: понижаются временное сопротивление, предел текучести, относительное удлинение, ударная вязкость, кислород снижает стойкость металла против коррозии, повышает склонность к старению, делает металл хладноломким и красноломким. Главным условием получения наплавленного металла высокого качества является защита его от окисления кислородом окружающей среды. Это достигается созданием вокруг расплавленного металла защитной среды из газов и шлаков, а также раскислением металла шва.
Раскисление - процесс удаления кислорода из наплавленного металла с целью повышения его качества.
Раскисление осуществляется:
А) взаимодействием между наплавленным металлом и шлаком,
Б) путем введения в сварочную ванну элементов - раскислителей(кремний и марганец)
Реакции
Обмена
Стр. 105
Удалению серы способствует также окись кальция; при этом происходит реакция
FeS + СаО = FeO + CaS
Влияние серы. Сера является вредной примесью в стали. Она образует сернистое железо (сульфид железа FeS), которое имеет температуру плавления 1193° С, т. е. более низкую, чем сталь. Поэтому при кристаллизации стали сернистое железо остается еще в жидком виде в прослойках между кристаллами сплава и является одной из причин образования горячих трещин при сварке.
Проверь себя
ТРЕБОВАНИЯ К УРОВНЮ ПОДГОТОВКИ
Знать и понимать
особенности химических реакций и их классификацию, химические реакции протекающие при сварке металла.
Уметь
характеризовать реакцию по определенным признакам.
Задание 1.Дайте физико - химическую характеристику реакции, использую алгоритм классификаии рекаций. (подсказка: стр. 115 , учебник О.С.Габриелян «Химия - 11 класс)
2200оС
2 Fe0 + O02 2 Fe+2O-2 - Q
Fe0 + O02 2 Fe+2O-2 - Q
тв газ тв
1. По составу веществ:________________________________________________________
2. По изменению степени окисления веществ: ____________________________________
3. По тепловому эффекту реакции: ______________________________________________
4. По агрегатному состоянию веществ:___________________________________________
5. По участию катализатора: ___________________________________________________
6. По направлению протекания реакции: _________________________________________
7. По механизму протекания реакции: ___________________________________________
8. По виду энергии: ___________________________________________________________
9. Применение в сварке:________________________________________________________
Задание 2. Продолжи фразу.
1.В процессе сварки вредными примесями являются________________________________
________________________________________________________________________________
________________________________________________________________________________
2. Для улучшения качества сварного соединения применяют элементы - _____________
________________________________________________________________________________
Задание 3. Заполни таблицу "Влияние примесей на качество сварного соединения"
Элемент
Примесь:
вредная -полезная
Влияние на качество шва
ПРОСТЫЕ ВЕЕЩЕСТВА - МЕТАЛЛЫ
БЛОК "ХИМИЯ"
Тема урока "МЕТАЛЛЫ - простые вещества и химические элементы"
Источник информации: учебник О.С.Габриелян «Химия - 11 класс», стр. 190 - 214
Цель работы: изучить особенности металлов как химических элементов и простых веществ на примере железа, основного металла, используемого для производства чугуна и стали.
Задание для студентов: Познакомьтесь с материалом учебника по заданной теме. Рассмотрите коллекции и образцы предложенных металлов. Составьте на основе изученного материала развернутый конспект по теме.
1.Металлы - химические элементы (стр. 190)
а) Число металлов в Периодической системе__________________________________________
б) Металлы - это_________________________________________________________________
________________________________________________________________________________
в) Положение металлов в Периодической системе (в каких группах и подгруппах расположены)___________________________________________________________________
г) Роль химических элементов - металлов в природе( стр. 192)__________________________
железо - ________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
2. Металлы - простые вещества.
Справка: Металлическая связь - связь в металлах и сплавах между атомами -ионами металлов, расположенными в узлах кристаллической решетки, которая осуществляется обобществленными валентными электронами.
Некоторые металлы кристаллизуются в двух и более кристаллических формах. Это свойство веществ - существовать в нескольких кристаллических модификациях - называется полиморфизмом. Полиморфизм для простых веществ называется аллотропия.
Источник информации: учебник О.С.Габриелян «Химия - 11 класс», стр. 196
Задание для студентов: заполните таблицу, используя учебник.
Табл.1. Кристаллические модификации железа
Модификация железа
Температурный интервал устойчивости
Свойства
α
ß
γ
δ
Свойства металлов
Источник информации:
Адаскин А.М., "Материаловедение", 41 - 45, 53
О.С.Габриелян «Химия - 11 класс», стр. 197
Физические свойства металлов на примере железа(выпишите примеры свойств из учебника химии стр. 197 и материаловедения стр. 41 - 45, 53.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________
Объяснение причин , определяющих физические свойства железа
Задание для студентов: заполните таблицу, используя материал учебника стр. 197 - 199
Свойство металла
Объяснение свойства
пластичность
металлический блеск
электро- и теплопроводность
3. Общие химические свойства металлов на примере железа.
Задание для студентов: напишите уравнения реакций стр. 202-205
А. Взаимодействие с простыми веществами
Взаимодействие с галогенами______________________________________________________
Взаимодействие с серой___________________________________________________________
Взаимодействие с кислородом: Fe + O2 =___________________________________________
Б. Взаимодействие со сложными веществами
Взаимодействие с водой___________________________________________________________
Взаимодействие с кислотами Fe + HCL =_____________________________________________
Взаимодействие с солями__________________________________________________________
4. Способы получения металлов ( стр. 214)
а) Из недр земли в чистом виде-____________________________________________________
из соединений (руды) - ___________________________________________________________
Руда - __________________________________________________________________________
________________________________________________________________________________
б) Способы извлечения металлов из руд.
Металлургия____________________________________________________________________
Пирометаллургия - ______________________________________________________________
Гидрометаллургия - ______________________________________________________________
Электрометаллургия - ____________________________________________________________
Контрольные вопросы:
1. Каким способом добывают железо?_______________________________________________
________________________________________________________________________________
2. Какие руды используют для добычи железа?________________________________________
________________________________________________________________________________
3. Перечислите месторождения железных руд________________________________________
________________________________________________________________________________
________________________________________________________________________________
БЛОК "МАТЕРИАЛОВЕДЕНИЕ"
Лабораторная работа "Свойства железа"
Цель работы: познакомиться с свойствами железа,
Оборудование: электронный учебник "Материаловедение", образцы железа, магнит, справочные таблицы "Классификация свойств материалов".
Литература: Адаскин А.М. Материаловедение (металлообработка): Учебник для нач. проф. образования - М.: Издательский центр. «Академия», 2004.
Ход работы:
1. Повторите свойства металлов по таблице "Классификация свойств материалов".
2. Познакомьтесь со свойствами железа.
2.1. Рассмотрите образцы железа и результаты своих наблюдений запишите в таблицу №1 (цвет, металлический блеск, магнитные свойства)
2.2. Посмотрите видеоопыты в электронном учебнике "Материаловедение" и результаты своих наблюдений запишите в таблицу(электропроводность, теплопроводность, твердость, плотность, ковкость, коррозия).
2.3. В учебнике Адаскина А.М. стр. 53 найдите температуру плавления железа и впишите в таблицу.
3. В первой графе напишите группу свойств(физические, механические, технологические, химические), в третьей графе - свойства железа.
Таблица №1.
Группа свойств
Свойства
Показатель для железа
Цвет
Металлический блеск
Температура плавления
Твердость
Плотность
Электропроводность
Теплопроводность
Ковкость
Пластичность
Коррозия
Контрольные вопросы:
1. Какие аллотропные модификации есть у железа.___________________________________
2. Что представляет собой точка Кюри?____________________________________________
______________________________________________________________________________
3. При какой температуре железо теряет свои магнитные свойства?______________________
Тема "Коррозия металлов"
Цель работы: Изучить материал по теме и составить письменный отчет по плану.
Источник информации: компьютерная презентация, О.С.Габриелян «Химия - 11 класс», стр.
План изучения.
1) Определение "Коррозия металлов"_______________________________________________
_______________________________________________________________________________
2) Вред, наносимый коррозией____________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
3) Виды коррозии.
Вид коррозии
определение
схема процесса
Химическая
Электрохимическая
4. Способы защиты металлов от коррозии (выпишите пять способов)
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Проверь себя
ТРЕБОВАНИЯ К УРОВНЮ ПОДГОТОВКИ
Знать и понимать
особенности металлов как химических элементов и простых веществ, физические и химические свойства металлов, способы получения металлов, коррозию металлов и способы защиты металлов от коррозии
Уметь
составлять уравнения химических реакций
Задание 1. Выбери один правильный ответ
1. На Земле химически чистое железо:
а) не встречается; б) встречается самородное; в) содержится в морской воде;
г) встречается метеоритного происхождения.
2. Металлические свойства атомов - это способность атомов:
1) отдавать электроны; 2) присоединять электроны 3) оставаться неизменным
3. Железо, в отличие от алюминия, магния обладает особым свойством:
а) электропроводностью; б) теплопроводностью;
в) магнитными свойствами; г) ковкостью.
4. Как называется способ получения железа с помощью высоких температур:
1) алюминотермия; 2) гидрометаллургия; 3) электрометаллургия; 4) пирометаллургия
5. Разрушение металла, находящегося в контакте с другим металлом в присутствии водного раствора электролита:
А. газовая коррозия;
Б. химическая коррозия;
В. сплошная коррозия;
Г. электрохимическая коррозия
Задание 2. Выберите правильные ответы.
1. Железо - это активный щелочной металл.
2. Чугун легко куется.
3. Сталь обладает способностью намагничиваться.
4. Железо имеет несколько аллотропных модификаций.
5. Температура плавления железа - 15390С.
6. Близ г. Дели в Индии стоит железная колонна без малейшего пятнышка ржавчины, хотя ее возраст почти 2800 лет.
7. Чистое железо подвергается коррозии.
8. Железо не обладает способностью намагничиваться.
Задание 3. Допиши уравнение химической реакции и расставь коэффициенты
Fe + H2 SO4 =____________________________________________________________________
Fe + CO = _______________________________________________________________________
Fe O + C = ______________________________________________________________________
КOH +Fe SO4→__________________________________________________________________
Fe Cl3 + NaOH = _________________________________________________________________
Задание 4. Найди соответствие между левой и правой частями таблицы
1) Fe Cl2+AgNO3→
А)Fe(OH)↓+NaCl
2) Fe SO4+BaCl2→
Б)Cu↓+FeCl2
3) Fe+CuCl2→
В) FeO + H2
4) NaOH+FeCl2→
Г) Fe (NO3)2+AgCl
5) Fe + H2O →
Д) Fe Cl2+BaSO4↓
Овет:__________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Список литературы:
1. Адаскин А.М. Материаловедение (металлообработка): Учебник для нач. проф. образования - М.: Издательский центр. «Академия», 2004.
2. О.С.Габриелян, Химия - 11 класс
18


