- Преподавателю
- Химия
- Конспект урока Способы выражения концентрации растворов
Конспект урока Способы выражения концентрации растворов
| Раздел | Химия |
| Класс | - |
| Тип | Конспекты |
| Автор | Арсеньева Е.Н. |
| Дата | 21.10.2014 |
| Формат | docx |
| Изображения | Есть |
МКОУ «Новогуровская средняя общеобразовательная школа»
Тема урока:
«Способы выражения концентрации растворов»
11 класс
Урок подготовила и провела:
учитель химии
Арсеньева Е.Н.
рпгт Новогуровский
2011 - 2012 учебный год
Способы выражения концентраций растворов.
Тип урока: Изучение нового материала.
Вид урока: Комбинированный, решение задач, практическая работа.
Цели урока:
-
расширить и систематизировать представления о способах выражения концентрации растворов;
-
изучить новые способы выражения концентраций растворов;
-
учиться применять полученные теоретические знания при решении задач;
-
развивать интеллектуальные умения и навыки.
Оборудование: компьютер, проектор, экран, периодическая система Д.И.Менделеева, карточки с заданиями для учащихся.
Лабораторное оборудование и вещества: На столах учащихся -
Мерный цилиндр,
лабораторные весы с разновесами,
стеклянная палочка,
химический стакан,
колба с водой,
пробирка с солью (по вариантам).
План урока
I.Организация класса к учебной работе.
1. Приветствие.
2. Организационный момент.
3. Создание комфортной доброжелательной обстановки в классе.
II. Объяснение нового материала.
Учитель: -Тема сегодняшнего урока «Способы выражения концентраций растворов» (слайд №1)
И сегодня вы должны
• расширить и систематизировать представления о способах выражения
концентрации растворов;
• изучить новые способы выражения концентраций растворов;
• учиться применять полученные теоретические знания при решении задач;
• развивать интеллектуальные умения и навыки. (слайд №2)
- Концентрация - величина, характеризующая количественный состав раствора.
Согласно правилам ИЮПАК, концентрацией растворённого вещества (не раствора) называют отношение количества растворённого вещества или его массы к объёму раствора (моль/л, г/л), то есть это соотношение неоднородных величин. Те величины, которые являются отношением однотипных величин (отношение массы растворённого
вещества к массе раствора, отношение объёма растворённого вещества к объёму раствора) правильно называть долями.
Однако на практике для обоих видов выражения состава применяют термин концентрация и говорят о концентрации растворов. (слайд №3)
- Существуют несколько способов выражения концентраций растворов:
1 Массовая доля (весовые проценты, процентная концентрация)
2 Объёмная доля
3 Молярность (молярная концентрация)
4 Мольная доля
5 Моляльность (моляльная концентрация)
6 Титр раствора
7 Нормальность (молярная концентрация эквивалента)
8 Растворимость вещества (слайд №4)
- Мы с вами рассмотрим массовую долю растворенного вещества в растворе и молярную концентрацию.
Понятие массовой доли растворенного вещества в растворе вы изучали в крсе химии 8 класса и решали задачи. Вспомните определение массовой доли и формулу ее расчета.
Учащиеся: - Массовая доля растворённого вещества - это отношение массы растворённого вещества к массе раствора.
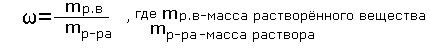 (слайд №5)
(слайд №5)
Учитель: - В бинарных растворах часто существует однозначная зависимость между плотностью раствора и его концентрацией (при данной температуре). Это даёт возможность определять на практике концентрации важных растворов с помощью денсиметра (спиртометра, сахариметра, лактометра). Некоторые ареометры проградуированы не в значениях плотности, а непосредственно концентрации раствора (спирта, жира в молоке, сахара). Часто для выражения концентрации (например, серной кислоты в аккумуляторах) пользуются просто их плотностью. Распространены ареометры предназначенные для определения концентрации растворов веществ. (слайд №6)
- Решим задачу: задача №1 стр. 42 учебника Г.Е.Рудзитиса, Ф.Г.Фельдмана «Химия.11 класс. (Задачу у доски решает ученик)
- Следующий вид выражения концентрации раствора - это молярность или молярная концентрация.
Молярность - число молей растворённого вещества в единице объёма раствора.
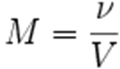
где ν- количество растворённого вещества, моль; V- объём раствора, л
Молярность чаще выражают в моль/л или ммоль/л. Возможны следующие обозначения молярной концентрации - С, См, М.
Так, раствор с концентрацией 1,0 моль/л называют одномолярным, можно записать - 1М,
0,1 моль/л - децимолярным - 0,1М, 0,01 моль/л - сантимолярным - 0,01М (слайд №7)
- Решим задачу: задача № 4 стр.2 учебника.
III. Закрепление изученного - выполнение практической работы «Приготовление растворов с заданной молярной концентрацией».
- А теперь выполним практическую работу №1 «Приготовление растворов с заданной молярной концентрацией» стр.42 учебника.
Для этого решите задачу по вариантам. Задания даны на карточках-инструктажах.(слайд10)
Затем приготовьте раствор заданной концентрацией взвесив рассчитанную массу на весах и отмерьте нужный объем воды мерным цилиндром.
Вспомним правила работы с лабораторными весами (слайд №8) и правила измерения объёма жидкости с помощью измерительного цилиндра. (слайд №9)
Составьте отчет о работе в произвольной форме. (слайд №11)
После выполнения работы сдайте тетради на проверку, уберите свое рабочее место (слайд №12) и запишите домашнее задание (слайд №13).
IV. Домашнее задание: §10, вопр. 10-13 стр.41, решить задачи № 2, 3 стр.42.


