- Преподавателю
- Химия
- Справочный материал по неорганической химии
Справочный материал по неорганической химии
| Раздел | Химия |
| Класс | - |
| Тип | Конспекты |
| Автор | Исангулова Ф.Ф. |
| Дата | 06.11.2014 |
| Формат | docx |
| Изображения | Есть |
 Справочный материал по неорганической химии
Справочный материал по неорганической химии
сост. учитель химии МБОУ СОШ №2 с.Толбазы Исангулова Ф.Ф. 2014г.
Электронная конфигурация - формула расположения электронов по различным электронным оболочкам атома химического элемента или молекулы.
Электронная конфигурация обычно записывается для атомов в их основном состоянии. Для определения электронной конфигурации элемента существуют следующие правила:
-
Принцип заполнения. Согласно принципу заполнения, электроны в основном состоянии атома заполняют орбитали в последовательности повышения орбитальных энергетических уровней. Низшие по энергии орбитали всегда заполняются первыми.
-
Принцип запрета Паули. Согласно этому принципу, на любой орбитали может находиться не более двух электронов и то лишь в том случае, если они имеют противоположные спины (неодинаковые спиновые числа).
-
Правило Хунда. Согласно этому правилу, заполнение орбиталей одной подоболочки начинается одиночными электронами с параллельными (одинаковыми по знаку) спинами, и лишь после того, как одиночные электроны займут все орбитали, может происходить окончательное заполнение орбиталей парами электронов с противоположными спинами.
С точки зрения квантовой механики электронная конфигурация - это полный перечень одноэлектронных волновых функций, из которых с достаточной степенью точности можно составить полную волновую функцию атома (в приближении самосогласованного поля).
Если говорить в общем, атом, как составную систему, можно полностью описать только полной волновой функцией. Однако такое описание практически невозможно для атомов сложнее атома водорода - самого простого из всех атомов химических элементов. Удобное приближённое описание - метод самосогласованного поля. В этом методе вводится понятие о волновой функции каждого электрона. Волновая функция всей системы записывается как надлежащим образом симметризованое произведение одноэлектронных волновых функций. При вычислении волновой функции каждого электрона поле всех остальных электронов учитывается как внешний потенциал, зависящий в свою очередь от волновых функций этих остальных электронов.
В результате применения метода самосогласованного поля получается сложная система нелинейных интегродифференциальных уравнений, которая всё ещё сложна для решения. Однако уравнения самосогласованного поля имеют вращательную симметрию исходной задачи (то есть они сферически симметричны). Это позволяет полностью классифицировать одноэлектронные волновые функции, из которых составляется полная волновая функция атома.
Для начала, как в любом центрально симметричном потенциале, волновую функцию в самосогласованном поле можно охарактеризовать квантовым числом полного углового момента ![]() и квантовым числом проекции углового момента на какую-нибудь ось
и квантовым числом проекции углового момента на какую-нибудь ось ![]() . Волновые функции с разными значениями
. Волновые функции с разными значениями ![]() соответствуют одному и тому же уровню энергии, т. е. вырождены. Также одному уровню энергии соответствуют состояния с разной проекцией спинаэлектрона на какую-либо ось. Всего для данного уровня энергии
соответствуют одному и тому же уровню энергии, т. е. вырождены. Также одному уровню энергии соответствуют состояния с разной проекцией спинаэлектрона на какую-либо ось. Всего для данного уровня энергии 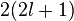 волновых функций. Далее, при данном значении углового момента можно перенумеровать уровни энергии. По аналогии с атомом водорода принято нумеровать уровни энергии для данного
волновых функций. Далее, при данном значении углового момента можно перенумеровать уровни энергии. По аналогии с атомом водорода принято нумеровать уровни энергии для данного ![]() начиная с
начиная с 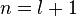 . Полный перечень квантовых чисел одноэлектронных волновых функций из которых можно составить волновую функцию атома и называется электронной конфигурацией. Поскольку всё вырождено по квантовому числу
. Полный перечень квантовых чисел одноэлектронных волновых функций из которых можно составить волновую функцию атома и называется электронной конфигурацией. Поскольку всё вырождено по квантовому числу ![]() и по спину, достаточно только указывать полное количество электронов, находящихся в состоянии с данными
и по спину, достаточно только указывать полное количество электронов, находящихся в состоянии с данными
Перехо́дные мета́ллы (перехо́дные элеме́нты) - элементы побочных подгрупп Периодической системы химических элементов Д. И. Менделеева, ватомах которых появляются электроны на d- и f-орбиталях.[1] В общем виде электронное строение переходных элементов можно представить следующим образом: 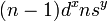 . На ns-орбитали содержится один или два электрона, остальные валентные электроны находятся на
. На ns-орбитали содержится один или два электрона, остальные валентные электроны находятся на 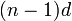 -орбитали. Поскольку число валентных электронов заметно меньше числа орбиталей, то простые вещества, образованные переходными элементами, являются металлами.
-орбитали. Поскольку число валентных электронов заметно меньше числа орбиталей, то простые вещества, образованные переходными элементами, являются металлами.
Таблица переходных металлов
Группа →
Период ↓
III
IV
V
VI
VII
VIII
I
II
4
21
Sc
22
Ti
23
V
24
Cr
25
Mn
26
Fe
27
Co
28
Ni
29
Cu
30
Zn
5
39
Y
40
Zr
41
Nb
42
Mo
43
Tc
44
Ru
45
Rh
46
Pd
47
Ag
48
Cd
6
*
72
Hf
73
Ta
74
W
75
Re
76
Os
77
Ir
78
Pt
79
Au
80
Hg
7
**
104
Rf
105
Db
106
Sg
107
Bh
108
Hs
109
Mt
110
Ds
111
Rg
112
Cn
Лантаноиды *
57
La
58
Ce
59
Pr
60
Nd
61
Pm
62
Sm
63
Eu
64
Gd
65
Tb
66
Dy
67
Ho
68
Er
69
Tm
70
Yb
71
Lu
Актиноиды **
89
Ac
90
Th
91
Pa
92
U
93
Np
94
Pu
95
Am
96
Cm
97
Bk
98
Cf
99
Es
100
Fm
101
Md
102
No
103
Lr
Общая характеристика переходных элементов
Все переходные элементы имеют следующие общие свойства:
-
Небольшие значения электроотрицательности.
-
Переменные степени окисления. Почти для всех d-элементов, в атомах которых на внешнем ns-подуровне находятся 2 валентных электрона, известна степень окисления +2.
-
Начиная с d-элементов III группы Периодической системы химических элементов Д. И. Менделеева, элементы в низшей степени окисления образуют соединения, которые проявляют основные свойства, в высшей - кислотные, в промежуточной - амфотерные. Например:
Формула соединения
Характер соединения
Mn(OH)2
Основание средней силы
Mn(OH)3
Слабое основание
Mn(OH)4
Амфотерный гидроксид
H2MnO4
Сильная кислота
HMnO4
Очень сильная кислота
-
Для всех переходных элементов характерно образование комплексных соединений.
Подгруппа меди
Подгруппа меди, или побочная подгруппа I группы Периодической системы химических элементов Д. И. Менделеева, включает в себя элементы: медь Cu,серебро Ag и золото Au.
Свойства металлов подгруппы меди
Атомный
номер
Название,
символ
Электронная
конфигурация
Степени
окисления
p,
г/см³
tпл,
°C
tкип,
°C
29
Медь Cu
[Ar] 3d104s1
0, +1, +2
8,96
1083
2543
47
Серебро Ag
[Kr] 4d105s1
0, +1, +3
10,5
960,8
2167
79
Золото Au
[Xe] 4f145d106s1
0, +1, +3
19,3
1063,4
2880[7]
Для всех металлов характерны высокие значения плотности, температур плавления и кипения, высокая тепло- и электропроводность.
Особенностью элементов подгруппы меди является наличие заполненного предвнешнего 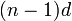 -подуровня, достигаемое за счёт перескока электрона с ns-подуровня. Причина такого явления заключается в высокой устойчивости полностью заполненного d-подуровня. Эта особенность обусловливает химическую инертность простых веществ, их химическую неактивность, поэтому золото и серебро называют благородными металлами.
-подуровня, достигаемое за счёт перескока электрона с ns-подуровня. Причина такого явления заключается в высокой устойчивости полностью заполненного d-подуровня. Эта особенность обусловливает химическую инертность простых веществ, их химическую неактивность, поэтому золото и серебро называют благородными металлами.
Лантано́иды (лантани́ды) - семейство из 14 химических элементов III группы 6-го периода периодической таблицы. Семейство состоит из церия,празеодима, неодима, прометия, самария, европия, гадолиния, тербия, диспрозия, гольмия, эрбия, тулия, иттербия и лютеция. Лантан часто рассматривается вместе с этими элементами для удобства сравнения, хотя к лантаноидам он не относится.
Все лантаниды вместе с лантаном, скандием и иттрием входят в состав группы редкоземельных элементов (РЗЭ).
Термин «лантаноиды», как и «актиноиды», предложен в 1948 году
*
La
Ce
Pr
Nd
Pm
Sm
Eu
Gd
Tb
Dy
Ho
Er
Tm
Yb
Lu
профессором ЛГУ С. А. Щукаревым.
Актино́иды (актини́ды) - семейство, состоящее из 14 радиоактивных химических элементов III группы 7-го периода периодической системы с атомными номерами 90-103.
Данная группа состоит из тория, протактиния, урана, нептуния, плутония, америция, кюрия,берклия, калифорния, эйнштейния, фермия, менделевия, нобелия и лоуренсия. Актиний часто для удобства сравнения рассматривается вместе с этими элементами, однако к актиноидам он не относится. Термин «актиноиды» был предложен Виктором Гольдшмидтом в 1937 году
**
Ac
Th
Pa
U
Np
Pu
Am
Cm
Bk
Cf
Es
Fm
Md
No
Lr
Закономерности в периодической таблице
Эле́ктроотрица́тельность (χ) (относительная электроотрицательность) - фундаментальное химическое свойство атома, количественная характеристика способности атома в молекуле смещать к себе общие электронные пары, то есть способность атомов оттягивать к себе электроны других атомов. Самая высокая степень электроотрицательности у галогенов и сильных окислителей (p-элементов VII-группы, O, Kr, Xe), а низкая - у активных металлов (s-элементов I группы).
Эне́ргией сродства́ а́тома к электро́ну, или просто его сродством к электрону (ε), называют энергию, выделяющуюся в процессе присоединения электрона к свободному атому Э в его основном состоянии с превращением его в отрицательный ион Э− (сродство атома к электрону численно равно, но противоположно по знаку энергии ионизации соответствующего изолированного однозарядного аниона).
Э + e− = Э− + ε
Сродство к электрону выражают в килоджоулях на моль (кДж/моль) или в электронвольтах на атом (эВ/атом).
В отличие от ионизационного потенциала атома, имеющего всегда эндоэнергетическое значение, сродство атома к электрону описывается как экзоэнергетическими, так и эндоэнергетическими значениями
-
Таблица 1
Элемент
ε
Элемент
ε
Элемент
ε
H
-0,75
Na
-0,78
K
-0,92
He
0,30
Mg
0,32
Ca
0,40
Li
-0,58
Al
-0,52
Sc
0,14
Be
0,19
Si
-1,39
Ti
-0,40
-0,33
P
-0,78
V
-0,94
C
-1,12
S
-2,07
Cr
-0,98
N
0,27
Cl
-3,61
Mn
1,07
О
-1,47
-3,36
Fe
-0,58
F
-3,45
I
-3,06
Co
-0,94
Ne
0,55
Ni
-1,28
Cu
-1,80
Наибольшим сродством к электрону обладают p-элементы VII группы. Наименьшее сродство к электрону у атомов с конфигурацией s2 (Be, Mg, Zn) и s2p6(Ne, Ar) или с наполовину заполненными p-орбиталями (N, P, As):
Таблица 2
Li
Be
B
C
N
O
F
Ne
Электронная конфигурация
s1
s2
s2p1
s2p2
s2p3
s2p4
s2p5
s2p6
ε, эВ
-0,59
0,19
-0,30
-1,27
0,21
-1,47
-3,45
0,22
Сте́пень окисле́ния (окислительное число, формальный заряд) - вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций. Она указывает на состояние окисления отдельного атома молекулы и представляет собой лишь удобный метод учёта переноса электронов: она не является истинным зарядом атома в молекуле (см. #Условность).
Представления о степени окисления элементов положены в основу и используются при классификации химических веществ, описании их свойств, составлении формул соединений и их международных названий (номенклатуры). Но особенно широко оно применяется при изучении окислительно-восстановительных реакций.
Понятие степень окисления часто используют в неорганической химии вместо понятия валентность.
Закономерность в физических свойствах
Температу́ра кипе́ния, точка кипения - температура, при которой происходит кипение жидкости, находящейся под постоянным давлением. Температура кипения соответствует температуре насыщенного пара над плоской поверхностью кипящей жидкости, так как сама жидкость всегда несколько перегрета относительно температуры кипения.
Согласно уравнению Клапейрона - Клаузиуса с ростом давления температура кипения увеличивается, а с уменьшением давления температура кипения соответственно уменьшается:
Tboil=(1Tboil.atm−R⋅ln(P/Patm)ΔHboil⋅M)−1,
где Tboil.atm - температура кипения при атмосферном давлении, K,
ΔHboil - удельная теплота испарения, Дж/кг,
M - молярная масса, кг/моль,
R - универсальная газовая постоянная.
Предельной температурой кипения является критическая температура вещества. Так температура кипения воды будет изменяться на Земле в зависимости от высоты: от 100 °C на уровне моря до 69 °C на вершине Эвереста. А при ещё большем увеличении высоты возникнет точка, в которой будет уже невозможно получить жидкую воду: лёд и пар будут переходить непосредственно друг в друга минуя жидкую фазу.
Температура кипения воды в зависимости от давления может быть достаточно точно вычислена по формуле:
Tboil=179,47P0,2391, (R2=0,9983),
где давление P берется в МПа (в пределах от 0,1 МПа до 22 МПа).
Температу́ра плавле́ния и отвердева́ния - температура, при которой твёрдое кристаллическое тело совершает переход в жидкое состояние и наоборот. При температуре плавления вещество может находиться как в жидком, так и в твёрдом состоянии. При подведении дополнительного тепла вещество перейдёт в жидкое состояние, а температура не будет меняться, пока всё вещество в рассматриваемой системе не расплавится. При отведении лишнего тепла (охлаждении) вещество будет переходить в твёрдое состояние (застывать) и, пока оно не застынет полностью, температура не изменится.
Закон Дюлонга - Пти (Закон постоянства теплоёмкости) - эмпирический закон, согласно которому молярная теплоёмкость твёрдых тел при комнатной температуре близка к 3R:
Cv=3R,
где R - универсальная газовая постоянная.
Уде́льная теплоёмкость - отношение теплоёмкости к массе, теплоёмкость единичной массы вещества (разная для различных веществ); физическая величина, численно равная количеству теплоты, которое необходимо передать единичной массе данного вещества для того, чтобы его температураизменилась на единицу.
В Международной системе единиц (СИ) удельная теплоёмкость измеряется в джоулях на килограмм на кельвин, Дж/(кг·К)[2]. Иногда используются и внесистемные единицы: калория/(кг·К) и т.д.
Формула расчёта удельной теплоёмкости: c=Q/mΔT, где c - удельная теплоёмкость, Q - количество теплоты, полученное веществом при нагреве (или выделившееся при охлаждении), m - масса нагреваемого (охлаждающегося) вещества, ΔT - разность конечной и начальной температур вещества. Удельная теплоёмкость может зависеть (и в принципе, строго говоря, всегда - более или менее сильно - зависит) от температуры, поэтому более корректной является следующая формула с малыми (формально бесконечно малыми) δT и δQ:
c(T)=(δQ/mδT)
Структуры
Правило октета (октетная теория) - предложено Г. Н. Льюисом для объяснения причин образования ковалентных химических связей. Согласно этому правилу при образовании молекул атомы удовлетворяют свою потребность в достижении 8 электронной валентной оболочки, подобной электронной конфигурации благородных газов за счет попарного обобществления своих валентных электронов. По своей важности это фундаментальное открытие Льюиса стоит в одном ряду с такими открытиями, как Периодический закон элементов и теория строения органических соединений. Широко распространенное мнение, что правило октета выполняется лишь в ограниченном числе случаев также ошибочно, как и утверждение того, что Периодический закон элементов не имеет всеобщего характера. Все примеры «невыполнения» правила октетов можно подразделить на следующие три группы:
1. Сумма валентных электронов атомов, образующих молекулу, нечётна. Пример - молекула оксида азота NO.
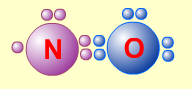
В данном случае сумма валентных электронов атома азота (5) и кислорода (6) равна 11, поэтому в этой молекуле атом кислорода достигает восьмиэлектронной оболочки, а атом азота - нет. В данном случае изначально невозможно достижение обоими атомами восьмиэлектронной оболочки. Стремление атома азота заполнить свою электронную оболочку объясняет химическую реакционную способность этой молекулы.
2. Молекула образуется за счет трехцентровых связей, например KI3. В этой молекуле анион иода связан с молекулой иода трехцентровой четырехэлектронной связью. Аналогичные трехцентровые, но двухэлектронные связи присутствуют в молекуле B2H6.
3. В образовании химических связей принимают участие d-орбитали. В этом случае правило октетов (в пределе, то есть в случае участия всех пяти d-орбиталей) преобразуется в правило 18-электронов. Поскольку в целом ряде случаев участие d-орбиталей в образовании химических связей у некоторых элементов остается спорным вопросом, возникает иллюзия невыполнения правила октетов. Классическими примерами выполнения правила 18-электронов являются молекулы Fe(CO)5, Ni(CO)4, Co2(СО)8, Fe(C5H5)2 (ферроцен)и многие другие.
Таким образом, главным в правиле октетов Льюиса является не цифра 8 (или 18), а обобществление электронов как основа образования ковалентной химической связи, и приближение за счет этого к электронной конфигурации инертного газа - восьмиэлектронной или восемнадцатиэлектронной.
Ио́нные криста́ллы представляют собой кристаллы, состоящие из ионов, связанных между собойэлектростатическим притяжением. Примерами таких кристаллов являются галогениды щелочных металлов, в том числе фторид калия, хлорид калия, бромид калия, иодид калия, фторид натрия и другие комбинации ионов натрия,цезия, рубидия и лития с ионами фтора, брома, хлора и иода.
NaCl имеет расположение ионов по системе 6:6. Свойства NaCl отражают сильные взаимодействия, которые существуют между ионами. В расплавленном виде это хороший проводник электричества, но в твёрдом состоянии проводит ток плохо. При расплавлении подвижные ионы хорошо переносят заряд через жидкость.
Ионные кристаллы характеризуются сильным поглощением инфракрасного излучения, и у них есть плоскости, вдоль которых они легко расщепляются. Точное расположение ионов в ионной решётке зависит от размера ионов в твердом состоянии.
Ионные кристаллы обычно имеют высокую температуру плавления и хорошо растворимы в полярных растворителях (в частности в воде).
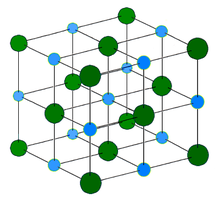
Кристаллическая структура хлорида натрия (каменной соли). Каждый атом имеет шесть ближайших соседей, как в геометрии октаэдра. Этот механизм известен как кубическая плотная упаковка(КПУ).
Светло-голубой = Na+
Тёмно-зелёный = Cl-
Кристаллическая структура металлов
Существуют тела аморфные и кристаллические. Структура аморфных тел состоит из хаотически расположенных атомов. К таким телам относятся, например, стекло, янтарь, смолы и т. п. Кристаллические тела отличаются от аморфных тем, что атомы в них располагаются в геометрически правильном порядке. Металлы и металлические сплавы относятся к типичным кристаллическим телам. Атомы, располагаясь в металлах в строго определенном геометрическом порядке, образуют кристаллическую решетку (рис. 11). В зависимости от расположения атомов образуются различные виды кристаллических решеток.
В металлах чаще всего встречаются кристаллические решетки в виде центрированного куба, гранецентрированного куба и гексагональной призмы.
Такие, например, металлы как хром, ванадий, вольфрам, молибден и ряд других, имеют кристаллическую решетку в виде центрированного куба (рис. 12, а), в которой восемь атомов располагаются в углах куба и один - в центре куба.
Алюминий, медь, свинец, никель, серебро и др. имеют кристаллическую решетку - гранецентрированную, т. е. в виде куба с центрированными гранями (рис. 12,6). В такой решетке в каждом углу куба находится по одному атому и по одному атому в центре каждой грани. Всего, следовательно, 14 атомов.
Кристаллическую решетку в виде гексагональной призмы (рис. 12, е) имеют такие металлы, как, например, цинк, титан, марганец. Расположение атомов в кристаллической решетке типа гексагональной призмы следующее: в каждом углу призмы находится по одному атому, в центре верхнего основания один атом, в центре нижнего основания один атом и три атома в среднем сечении.
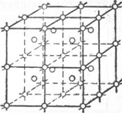
Рис. 11. Кристаллическая решетка
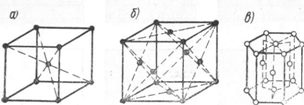
Рис. 12. Виды кристаллических решеток:
а - куб центрированный; б - куб гранецентрированный; в - гексагональная призма
Стереохимия (от греч. στερεός - твёрдый, пространственный), Структурная химия - раздел химии о пространственном строении молекул и влиянии его на химические свойства (статическая стереохимия) и на направление и скорость реакций (динамическая стереохимия). Особенности пространственного строения обнаруживаются в появлении стереоизомеров; эти особенности влияют на скорость и направление химических превращений, на физические свойства веществ, на характер их физиологического действия и др.
Номенклатура
НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
Комплексные соединения часто имеют довольно сложный состав и строение; к настоящему времени разработаны специальные системы составления их химического названия (номенклатуры).
Существуют три основных подхода к номенклатуре комплексных соединений металлов.
1. Традиционные специфические вненоменклатурные названия, по которым различным комплексным соединениям присваивались те или иные наименования (например, K4[Fe(CN)6] - желтая кровяная соль, ферроцианид калия; K3[Fe(CN)6] - красная кровяная соль, феррицианид калия; [Pt(NH3)4](OH)2 - первое основание Рейзе; транс-[Pt(OH)2(NH3)2] - второе основание Рейзе; цис-[PtCl2(NH3)2] - хлорид Пейроне; K[Co(NO2)4(NH3)2] - соль Эрдмана и т.д.).
2. Номенклатура, предложенная основателем координационой теории швейцарским химиком Альфредом Вернером, принятая в несколько измененном виде его последователями.
3. Номенклатура, рекомендованная в 1960 г. комиссией по номенклатуре неорганических соединений Международного союза по чистой и прикладной химии (ИЮПАК).
В современной научной, учебной, медицинской литературе используются все три подхода, хотя можно отметить тенденции к преимущественному применению номенклатуры, рекомендованной ИЮПАК, как наиболее логически обоснованной. В русском языке эта номенклатура несколько модифицирована, адаптирована к правилам русского языка.
Номенклатура, предложенная А. Вернером
Комплексные катионы. Вначале называют отрицательно заряженные лиганды внутренней сферы с окончанием "о" (хлоро-, бромо-, нитро-, родано- и т.д.). Если их число больше одного, то перед названиями лигандов добавляют числительные ди-, три-, тетра-, пента-, гекса- и т.д. Затем называют нейтральные лиганды, причем молекулу воды называют "акво", молекулу аммиака - "аммин". Если число нейтральных лигандов больше одного, то добавляют числительные ди-, три-, тетра- и т.д.
После нейтральных лигандов называют атом металла-комплексообразователя и в последнюю очередь - внешнесферные анионы. При этом наименование атома металла составляют из корня его латинского названия с характерным окончанием, зависящим от степени окисления центрального атома металла-комплексообразователя. Окончания эти следующие:
Примеры (для наглядности здесь и далее указана степень (состояние) окисления центрального металла, хотя обычно это не делается):
[PtII(NH3)4]Cl2 - тетрамминплатохлорид;
[PtIV(NH3)4Cl2]Cl2 - дихлоротетрамминплатехлорид;
[CoIII(NH3)5Cl]SO4 - хлоропентамминкобальтисульфат.
Комплексные анионы. Вначале называют отрицательно заряженные лиганды с соответствующими числительными (ди-, три-, тетра-, и т.д.). Затем называют нейтральные молекулы, после чего идет название металла с соответствующим окончанием, характеризующим его степень окисления, к которому добавляют еще суффикс "ат". В заключение в родительном падеже называют внешнесферные катионы.
Примеры
K[AgI(CN)2] - дицианоаргентаат калия;
K2[PtIVCl6] - гексахлороплатеат калия;
K4[FeII(CN)6] - гексацианоферроат калия;
Na3[FeIII(CN)6] - гексацианоферриат натрия.
Нейтральные комплексы. Названия строят аналогично предыдущему, за исключением того, что к наименованию металла-комплексообразователя не прибавляют никаких окончаний.
Примеры
[PtII(NH3)2Cl2] - дихлородиамминплатина;
[CoIII(NH3)3(NO2)3] - тринитротриамминкобальт;
[CrIII(NH3)3(SCN)3] - трироданотриамминхром;
[RhIIIPy3(C2O4)Cl] - хлорооксалатотрипиридинродий.
Номенклатура, рекомендованная Международным союзом по чистой и прикладной химии
Эту номенклатуру можно рассматривать как усовершенствованную и модернизированную номенклатуру А. Вернера. Лиганды называются так же, как и в вернеровской номенклатуре, т.е. отрицательно заряженные лиганды оканчиваются на "о", а нейтральные имеют обычные наименования.
Одноядерные комплексы. Вначале называют катион, затем - анион. При перечислении лигандов сначала называют отрицательно заряженные, затем - нейтральные с соответствующими числительными (ди-, три-, тетра- и т.д.). После этого называют атом металла-комплексообразователя, указывая после названия металла его степень окисления римскими цифрами в круглых скобках. Символ (0) используют для обозначения нулевой степени окисления. Если комплекс представляет собой анион, то к названию центрального атома добавляют суффикс "ат". Если лиганды представляют собой сложные многоатомные молекулы, то вместо числительных ди-, три-, тетра- и т.д. используют числительные бис-, трис-, тетракис-, пентакис-, гексакис-.
Примеры
[Pt(NH3)4]Cl2 - тетрамминплатина(II)хлорид;
[Pt(NH3)4Cl2]Cl2 - дихлоротетрамминплатина(IV)хлорид;
[Co(NH3)5Cl]SO4 - хлоропентамминкобальт(III)сульфат.
Если катион называют в родительном падеже (что в русском языке допускается), то наименования катиона и аниона пишут раздельно:
[Co(NH3)6]Cl2 - гексамминкобальт(III)хлорид или гексамминкобальта(III) хлорид.
Многоядерные комплексы. В многоядерных комплексах мостиковые лиганды обозначают символом "m" (мю) перед их наименованием.
Пример : бис(этилендиамин)кобальт(III)-m-имидогидроксобис(этилендиамин)-кобальт
Химические расчеты
На основе закона сохранения массы и закона постоянства состава для необратимой (полностью протекающей в одном направлении) реакции можно расчитать по известному значению массы одного из веществ (реагента или продукта) значения массы всех остальных веществ принимающих участие в реакции. Уравнение реакции должно быть точно известно. Такие расчеты являются предметом раздела химии, называемого стехиометрия.
Стехиометрические расчеты по уравнениям реакций основаны на соотношении:
mA
=
nA·MA
-----
-----
mB
nB·MB
где
А - формула вещества в реакции;
mA - известная масса вещества А;
В - формула любого другого вещества (реагента, продукта) в реакции;
mВ - значение массы вещества В которую необходимо найти;
nA и nB - количества веществ, численно равные стехиометрическим коэффициентам при формулах соответствующих веществ в уравнении реакции.
Искомую величину mВ расчитывают по уравнению:
mВ
=
mA·nВ·MВ
-----------
nА·MА
Решение типовой задачи по нахождению массы одного из реагентов (или продуктов) включает следующие этапы.
-
Составляют и проверяют уравнение химической реакции
3Fe3O4 + 8Al = 9Fe + 4Al2O3
-
По условию задачи устанавливают, масса какого вещества задана и массу каких веществ требуется определить. Например, для приведенной реакции, необходимо определить массу реагентов (Fe3O4 и Al), если известна масса одного из продуктов - железа (500 г).
-
Расчитывают значения молярной массы веществ, участвующих в реакции.
M(Al) = 26.98 г/моль; M(Fe3O4) = 231.54 г/моль; M(Fe) = 55.85 г/моль
-
Устанавливают значения стехиометрических количеств тех же веществ.
n(Al) = 8 моль; n(Fe3O4) = 3 моль; n(Fe) = 9 моль
-
Записывают расчетные формулы, подставляют значения известных величин и находят значения искомых величин
m(Al)
=
m(Fe)·n(Al)·M(Al)
=
500 г · 8 моль · 26,8 г/моль
=
214,7 г
---------------------
-------------------------------
n(Fe)·M(Fe)
9 моль · 55,85 г/моль
-
m(Fe3O4)
=
m(Fe)·n(Fe3O4)·M(Fe3O4)
=
500 г · 3 моль · 231,54 г/моль
=
691,0 г
-----------------------
-------------------------------
n(Fe)·M(Fe)
9 моль · 55,85 г/моль
-
Формулируют ответ задачи. В данном примере для получения 500 г железа в соответствии со стехиометрией данной реакции необходимо взять 214,7 г Al и 691,0 г Fe3O4).
Если участниками раекции являются газы, то для упрощения стехиометрических расчетов (при заданном или искомом значении объема газа) используют значение молярного объема газа VM вместо его молярной массы.
Массовая доля
Массовая доля - отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в долях единицы или в процентах:
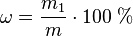
где:
-
m1 - масса растворённого вещества, г;
-
m - общая масса раствора, г.
Массовое процентное содержание компонента, m%
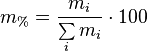
Объёмная доля - отношение объёма растворённого вещества к объёму раствора. Объёмная доля измеряется в долях единицы или в процентах.
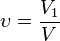 ,
,
где:
-
V1 - объём растворённого вещества, л;
-
V - общий объём раствора, л.
Молярность (молярная объёмная концентрация)
Молярная концентрация - количество растворённого вещества (число молей) в единице объёма раствора. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л. Также распространено выражение в «молярности». Возможно другое обозначение молярной концентрации ![]() , которое принято обозначать М. Так, раствор с концентрацией 0,5 моль/л называют 0,5-молярным.
, которое принято обозначать М. Так, раствор с концентрацией 0,5 моль/л называют 0,5-молярным.
Примечание: После числа пишут «моль», подобно тому, как после числа пишут «см», «кг» и т. п., не склоняя по падежам.
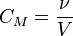 ,
,
где:
-
ν - количество растворённого вещества, моль;
-
V - общий объём раствора, л.
Моляльность (молярная весовая концентрация, моляльная концентрация)
Моляльность - количество растворённого вещества (число моль) в 1000 г растворителя. Измеряется в молях на кг, также распространено выражение в «моляльности». Так, раствор с концентрацией 0,5 моль/кг называют 0,5-мольным.
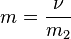 ,
,
где:
-
ν - количество растворённого вещества, моль;
-
m2 - масса растворителя, кг.
Титр раствора - масса растворённого вещества в 1 мл раствора.
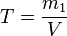 ,
,
где:
-
m1 - масса растворённого вещества, г;
-
V - общий объём раствора, мл;
Нормальная концентрация (мольная концентрация эквивалента, «нормальность»)
Нормальная концентрация - количество эквивалентов данного вещества в 1 литре раствора. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов). Для записи концентрации таких растворов используют сокращения «н» или «N». Например, раствор, содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н.
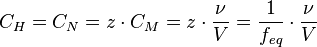 ,
,
где:
-
ν - количество растворённого вещества, моль;
-
V - общий объём раствора, литров;
-
z - число эквивалентности (фактор эквивалентности
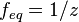 ).
).
Изото́пы (от др.-греч. ισος - «равный», «одинаковый», и τόπος - «место») - разновидности атомов (и ядер) какого-либо химического элемента, которые имеют одинаковый атомный (порядковый) номер, но при этом разные массовые числа. Название связано с тем, что все изотопы одного атома помещаются в одно и то же место (в одну клетку) таблицы Менделеева. Химические свойства атома зависят от строения электронной оболочки, которая, в свою очередь, определяется в основном зарядом ядра Z (то есть количеством протонов в нём), и почти не зависят от его массового числа A (то есть суммарного числа протонов Z и нейтронов N). Все изотопы одного элемента имеют одинаковый заряд ядра, отличаясь лишь числом нейтронов. Обычно изотоп обозначается символом химического элемента, к которому он относится, с добавлением верхнего левого индекса, означающего массовое число (например, 12C, 222Rn). Можно также написать название элемента с добавлением через дефис массового числа (например, углерод-12, радон-222). Некоторые изотопы имеют традиционные собственные названия (например, дейтерий, актинон).
Пример изотопов: 168O, 178O, 188O - три стабильных изотопа кислорода.
Подсчет числа нуклонов
Атомное ядро состоит из нуклонов - положительно заряженных протонов и нейтральных нейтронов, которые связаны между собой при помощи сильного взаимодействия. Протон и нейтрон обладают собственным моментом количества движения (спином), равным 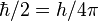 и связанным с ним магнитным моментом. Единственный стабильный атом, не содержащий нейтрон в ядре - лёгкий водород (протий). Единственный нестабильный атом без нейтронов - Гелий-2 (дипротон).
и связанным с ним магнитным моментом. Единственный стабильный атом, не содержащий нейтрон в ядре - лёгкий водород (протий). Единственный нестабильный атом без нейтронов - Гелий-2 (дипротон).
Атомное ядро, рассматриваемое как класс частиц с определённым числом протонов и нейтронов, принято называть нуклидом.
В некоторых редких случаях могут образовываться короткоживущие экзотические атомы у которых вместо нуклона ядром служат иные частицы.
Количество протонов в ядре называется его зарядовым числом ![]() - это число равно порядковому номеру элемента, к которому относится атом, в таблице (Периодической системе элементов) Менделеева. Количество протонов в ядре определяет структуру электронной оболочки нейтрального атома и, таким образом, химические свойства соответствующего элемента. Количество нейтронов в ядре называется его изотопическим числом
- это число равно порядковому номеру элемента, к которому относится атом, в таблице (Периодической системе элементов) Менделеева. Количество протонов в ядре определяет структуру электронной оболочки нейтрального атома и, таким образом, химические свойства соответствующего элемента. Количество нейтронов в ядре называется его изотопическим числом ![]() . Ядра с одинаковым числом протонов и разным числом нейтронов называются изотопами. Ядра с одинаковым числом нейтронов, но разным числом протонов - называются изотонами. Термины изотоп и изотон используются также применительно к атомам, содержащим указанные ядра, а также для характеристики нехимических разновидностей одного химического элемента. Полное количество нуклонов в ядре называется его массовым числом
. Ядра с одинаковым числом протонов и разным числом нейтронов называются изотопами. Ядра с одинаковым числом нейтронов, но разным числом протонов - называются изотонами. Термины изотоп и изотон используются также применительно к атомам, содержащим указанные ядра, а также для характеристики нехимических разновидностей одного химического элемента. Полное количество нуклонов в ядре называется его массовым числом ![]() (
(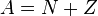 ) и приблизительно равно средней массе атома, указанной в таблице Менделеева. Нуклиды с одинаковым массовым числом, но разным протон-нейтронным составом принято называть изобарами.
) и приблизительно равно средней массе атома, указанной в таблице Менделеева. Нуклиды с одинаковым массовым числом, но разным протон-нейтронным составом принято называть изобарами.
Как и любая квантовая система, ядра могут находиться в метастабильном возбуждённом состоянии, причём в отдельных случаях время жизни такого состояния исчисляется годами. Такие возбуждённые состояния ядер называются ядерными изомерами
Радиоакти́вный распа́д (от лат. radius «луч» и āctīvus «действенный») - спонтанное изменение состава (заряда Z,массового числа A) или внутреннего строения нестабильных атомных ядер путём испускания элементарных частиц, гамма-квантов и/или ядерных фрагментов[1]. Процесс радиоактивного распада также называют радиоакти́вностью, а соответствующие ядра (нуклиды, изотопы и химические элементы) радиоактивными. Радиоактивными называют также вещества, содержащие радиоактивные ядра.
Установлено, что радиоактивны все химические элементы с порядковым номером, большим 82 (то есть начиная свисмута), и некоторые более лёгкие элементы (прометий и технеций не имеют стабильных изотопов, а у некоторых элементов, например индия, калия, рубидия или кальция, одни природные изотопы стабильны, другие же радиоактивны).
Естественная радиоактивность - самопроизвольный распад атомных ядер, встречающихся в природе.
Искусственная радиоактивность - самопроизвольный распад атомных ядер, полученных искусственным путем через соответствующие ядерные реакции.
Ядро, испытывающее радиоактивный распад, и ядро, возникающее в результате этого распада, называют соответственно материнским и дочерним ядрами. Изменение массового числа и заряда дочернего ядра по отношению к материнскому описывается правилом смещения Содди.
Распад, сопровождающийся испусканием альфа-частиц, назвали альфа-распадом; распад, сопровождающийся испусканием бета-частиц, был назван бета-распадом (в настоящее время известно, что существуют типы бета-распада без испускания бета-частиц, однако бета-распад всегда сопровождается испусканием нейтрино или антинейтрино). Термин «гамма-распад» применяется редко; испускание ядром гамма-квантов называют обычно изомерным переходом. Гамма-излучение часто сопровождает другие типы распада, когда в результате первого этапа распада возникает дочернее ядро в возбуждённом состоянии, затем испытывающее переход в основное состояние с испусканием гамма-квантов.
Закон радиоактивного распада - закон, открытый Фредериком Содди и Эрнестом Резерфордом экспериментальным путём и сформулированный в 1903 году. Современная формулировка закона:
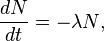
что означает, что число распадов за интервал времени t в произвольном веществе пропорционально числу N имеющихся в образце радиоактивных атомов данного типа.
В этом математическом выражении λ - постоянная распада, которая характеризует вероятность радиоактивного распада за единицу времени и имеет размерность с−1. Знак минус указывает на убыль числа радиоактивных ядер со временем. Закон выражает независимость распада радиоактивных ядер друг от друга и от времени: вероятность распада данного ядра в каждую следующую единицу времени не зависит от времени, прошедшего с начала эксперимента, и от количества ядер, оставшихся в образце.
Альфа-распадом называют самопроизвольный распад атомного ядра на дочернее ядро и α-частицу (ядро атома 4He).
Альфа-распад, как правило, происходит в тяжёлых ядрах с массовым числом А ≥ 140 (хотя есть несколько исключений). Внутри тяжёлых ядер за счёт свойства насыщения ядерных сил образуются обособленные α-частицы, состоящие из двух протонов и двух нейтронов. Образовавшаяся α-частица подвержена большему действию кулоновских сил отталкивания от протонов ядра, чем отдельные протоны. Одновременно α-частица испытывает меньшее ядерное притяжение к нуклонам ядра, чем остальные нуклоны. Образовавшаяся альфа-частица на границе ядра отражается от потенциального барьера внутрь, однако с некоторой вероятностью она может преодолеть его (см. Туннельный эффект) и вылететь наружу. С уменьшением энергии альфа-частицы проницаемость потенциального барьера очень быстро (экспоненциально) уменьшается, поэтому время жизниядер с меньшей доступной энергией альфа-распада при прочих равных условиях больше.
Правило смещения Содди для α-распада:
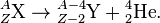
Пример (альфа-распад урана-238 в торий-234):
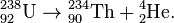
В результате α-распада атом смещается на 2 клетки к началу таблицы Менделеева (то есть заряд ядра Z уменьшается на 2), массовое число дочернего ядра уменьшается на 4.
Бе́та-распа́д (β-распад) - тип радиоактивного распада, обусловленный слабым взаимодействием и изменяющий заряд ядра на единицу, без изменения массового числа. При этом ядро излучает бета-частицу (электрон или позитрон), а также нейтральную фундаментальную частицу с полуцелым спином (электронное антинейтрино или электронное нейтрино, соответственно). Если распад происходит с испусканием электрона и антинейтрино, он называется «бета-минус-распадом» (β−). В случае распада с испусканием позитрона и нейтрино - «бета-плюс-распадом» (β+). Кроме β−и β+-распадов, к бета-распадам относят также электронный захват, когда ядро захватывает атомный электрон и испускает электронное нейтрино. Нейтрино (антинейтрино), в отличие от электронов и позитронов, крайне слабо взаимодействует с веществом и покидает точку распада, унося с собой часть выделившейся при распаде энергии.
Когда протон и нейтрон являются частями атомного ядра, процессы бета-распада превращают один химический элемент в другой, соседний по таблице Менделеева. Например:
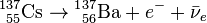 (
(![]() -распад),
-распад),
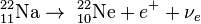 (
(![]() -распад),
-распад),
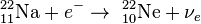 (электронный захват).
(электронный захват).
Гамма-распад (изомерный переход)
Почти все ядра имеют, кроме основного квантового состояния, дискретный набор возбуждённых состояний с большей энергией (исключением являются ядра 1H, 2H, 3H и 3He). Возбуждённые состояния могут заселяться при ядерных реакциях либо радиоактивном распаде других ядер. Большинство возбуждённых состояний имеют очень малые времена жизни (менее наносекунды). Однако существуют и достаточно долгоживущие состояния (чьи времена жизни измеряются микросекундами, сутками или годами), которые называются изомерными, хотя граница между ними и короткоживущими состояниями весьма условна. Изомерные состояния ядер, как правило, распадаются в основное состояние (иногда через несколько промежуточных состояний). При этом излучаются один или несколько гамма-квантов; возбуждение ядра может сниматься также посредством вылета конверсионных электронов из атомной оболочки. Изомерные состояния могут распадаться также и посредством обычных бета- и альфа-распадов.
Круговорот элементов
Круговорот азота - биогеохимический цикл азота. Большая его часть обусловлена действием живых существ. Очень большую роль в круговороте играют почвенные микроорганизмы, обеспечивающие азотистый обмен почвы - круговорот в почве азота, который присутствует там в виде простого вещества (газа - N2) и ионов: нитритов (NO2-), нитратов (NO3-) и аммония(NH4+). Концентрации этих ионов отражают состояние почвенных сообществ, поскольку на эти показатели влияет состояние биоты (растений, микрофлоры), состояние атмосферы, вымывание из почвы различных веществ. Они способны снижать концентрации азотсодержащих веществ, губительные для других живых организмов. Они могут переводить токсичный для живых существ аммиак в менее токсичные нитраты и в биологически инертный атмосферный азот. Таким образом, микрофлора почвы способствует поддержанию стабильности её химических показателей.
Факторы, влияющие на круговорот азота в антропогенных биоценозах
В отсутствие деятельности человека процессы связывания азота и нитрификации практически полностью уравновешены противоположными реакциями денитрификации. Часть азота поступает в атмосферу из мантии с извержениями вулканов, часть прочно фиксируется в почвах и глинистых минералах, кроме того, постоянно идёт утечка азота из верхних слоёв атмосферы в межпланетное пространство. Но в настоящее время на круговорот азота влияют много факторов, вызванных человеком. Во-первых, это кислотные дожди - явление, при котором наблюдается понижение pH дождевых осадков и снега из-за загрязнений воздуха кислотными оксидами (например, оксидами азота). Химизм этого явления состоит в следующем. Для сжигания органического топлива в двигатели внутреннего сгорания и котлы подается воздух или смесь топлива с воздухом. Почти на 4/5 воздух состоит из газа азота и на 1/5 - из кислорода. При высоких температурах, создаваемых внутри установок, неизбежно происходит реакция азота с кислородом и образуется оксид азота:
N2+ O2 = 2NO - Q
Эта реакция эндотермическая и в естественных условиях происходит при грозовых разрядах, а также сопутствует другим подобным магнитным явлениях в атмосфере. В наши дни человек в результате своей деятельности сильно увеличивает накопление оксида азота (II) на планете. Оксид азота (II) легко окисляется до оксида азота (IV) уже при нормальных условиях:
2NO + O2 = 2NO2
Далее оксид азота реагирует с атмосферной водой с образованием кислот :
2NO2 + H2O = HNO3 + HNO2
образуются азотная и азотистая кислоты. В капельках атмосферной воды эти кислоты диссоциируют с образованием, соответственно нитрат- и нитрит-ионов, а ионы попадают с кислотными дождями в почву. Вторая группа антропогенных факторов, влияющих на азотистый обмен почв, - это технологические выбросы. Оксиды азота- одни из самых распространенных загрязнителей воздуха. А неуклонный рост производства аммиака, серной иазотной кислоты напрямую связан с увеличением объёма отходящих газов, а следовательно, с увеличением количества выбрасываемых в атмосферу оксидов азота. Третья группа факторов - переудобрение почв нитритами, нитратами (селитрой) и органическими удобрениями. И наконец, на азотистый обмен почв отрицательно влияет повышенный уровень биологического загрязнения. Возможные его причины: сброс сточных вод, несоблюдение санитарных норм (выгул собак, неконтролируемые свалки органических отходов, плохое функционирование канализационных систем и др.). Как следствие почва загрязняется аммиаком, солями аммония, мочевиной, индолом, меркаптанами и другими продуктами разложения органики. В почве образуется дополнительное количество аммиака, который затем перерабатывается бактериями в нитраты.
Круговорот кислорода в природе
Кислород - наиболее активный газ. В пределах биосферы происходит быстрый обмен кислорода среды с живыми организмами или их остатками после гибели. В составе земной атмосферы кислород занимает второе место после азота. Господствующей формой нахождения кислорода в атмосфере является молекула О2. Круговорот кислорода в биосфере весьма сложен, поскольку он вступает во множество химических соединений минерального и органического миров. Свободный кислород современной земной атмосферы является побочным продуктом процесса фотосинтеза зеленых растений и его общее количество отражает баланс между продуцированием кислорода и процессами окисления и гниения различных веществ. В истории биосферы Земли наступило такое время, когда количество свободного кислорода достигло определенного уровня и оказалось сбалансированным таким образом, что количество выделяемого кислорода стало равным количеству поглощаемого кислорода.
Механизм круговорота кислорода достаточно прост. Полагают, что молекула кислорода (О2) , образующаяся при фотосинтезе, получает один свой атом от диоксида углерода, а другой - от воды; молекула кислорода, потребляемая при дыхании, отдает один свой атом диоксиду углерода, а другой - воде. Таким образом, круговорот кислорода завязан на процессы фотосинтеза и дыхания.
Фотосинтез. 6СО2 + 6Н20 (свет, хлорофилл)= С6Н1206 + 602.
Дыхание. С6Н1206 + 602 = 6СО2 + 6Н20 + энергия.
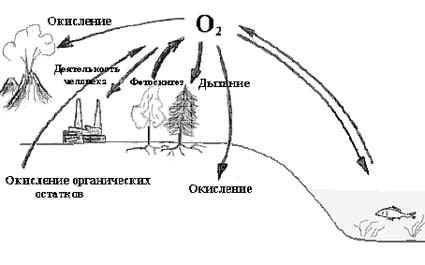
КРУГОВОРОТ УГЛЕРОДА
КРУГОВОРОТ УГЛЕРОДА, циркуляция углерода в биосфере. Представляет собою сложную цепь событий. Наиболее важными звеньями ее являются усвоение углекислого газа из воздуха зелеными растениями в процессе ФОТОСИНТЕЗА и возвращение углекислого газа в атмосферу при дыхании, а также при разложении тел животных, питающихся растениями.
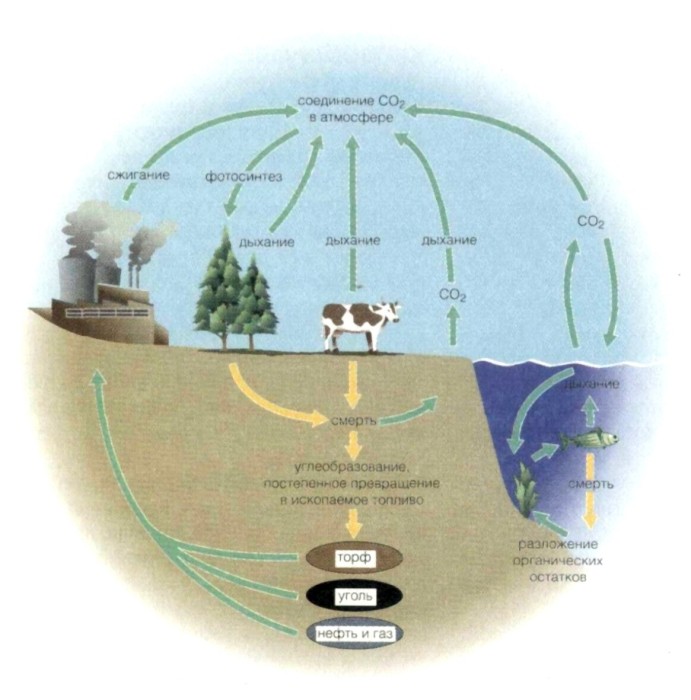
Элементарный углерод нахо дится в постоянном движении. Газообразный диоксид углерода (С02) сперва превращается в простые сахара путем фотосинтеза в зеленых растениях. Они расщепляются (при дыхании) и поставляют организму энергию, причем С02 снова возвращается в атмосферу Животные, питающиеся растениями, при метаболизме также преобразуют сахара и выделяют С02. Геологические процессы оказывают влияние на баланс углерода в масштабах земного шара: углерод исключается из кругооборота, когда накапливается в таких ископаемых, как уголь, нефть и газ. И наоборот, большие количества диоксида углерода выделяются в атмосферу при сжигании этих горючих материалов.
S-Элементы
ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С ВОДОЙ
Вода является очень слабым электролитом, однако в процессе диссоциации ее молекул, хоть и в небольшом количестве, образуются ионы водорода:
H2O 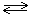 H+ + OH-
H+ + OH-
Образующиеся ионы Н+ способны окислять атомы металлов, расположенных в ряду активности до водорода, восстанавливаясь до молекулярного водорода:
2H+ + 2e- → H2
Следовательно, продуктом восстановления при взаимодействии любого металла (если он стоит в ряду активности левее водорода) с водой будет газообразный водород. Состав же продукта окисления зависит от активности металла и условий протекания реакции.
Активные металлы энергично взаимодействуют с водой при обычных условиях по схеме:
2Me + 2nH2O → 2Me(OH)n + nH2
Продуктом окисления металла является его гидроксид - Me(OH)n (где n-степень окисления металла).
Например:
Ca + 2H2O → Ca(OH)2 + H2↑
Металлы средней активности взаимодействуют с водой при нагревании по схеме:
2Me + nH2O 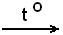 Me2On + nH2
Me2On + nH2
Продукт окисления в таких реакциях - оксид металла Me2On (где n-степень окисления металла).
Например:
3Fe + 4H2Oпар 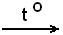 Fe2O3·FeO + 4H2
Fe2O3·FeO + 4H2
Взаимодействие металлов с кислородом
Продукты горения щелочных металлов на воздухе имеют разный состав в зависимости от активности металла.
Только литий сгорает на воздухе с образованием оксида стехиометрического состава:
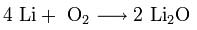
При горении натрия в основном образуется пероксид Na2O2 с небольшой примесью надпероксида NaO2:

В продуктах горения калия, рубидия и цезия содержатся в основном надпероксиды:
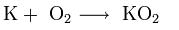
Взаимодействие металлов с галогенами
Свободные галогены проявляют чрезвычайно высокую химическую активность. Они вступают во взаимодействие почти со всеми простыми веществами. Особенно быстро и с выделением большого количества теплоты протекают реакции соединения галогенов с металлами. Так, расплавленный металлический натрий в атмосфере хлора сгорает с ослепительной вспышкой, а на стенках сосуда появляется белый налет хлорида натрия:
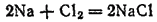
Медь, железо, олово и многие другие металлы сгорают в хлоре, образуя соответствующие соли. Подобным же образом взаимодействуют с металлами бром и иод. Во всех этих случаях атомы металла отдают электроны, т. е. окисляются, а атомы галогенов присоединяют электроны, т. е. восстанавливаются. Эта способность присоединять электроны, резко выраженная у атомов галогенов, является их характерным химическим свойством. Следовательно, галогены - очень энергичные окислители.
Нитрид лития
Реакция взаимодействия лития с азотом протекает медленно при комнатной температуре, а при нагревании выше 450° С проходит с воспламенением.
6Li + N2 = 2Li3N.
Гидрид лития получают реакцией синтеза непосредственно из элементов лития и водорода:
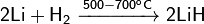
P -элементы
Гидриды неметаллов. Соединения неметаллических элементов с водородом, в которых степень окисления водорода -I, называют гидридами неметаллов. Гидриды многих неметаллов газообразны, имеют ковалентный тип связей в молекулах. В подгруппах периодической системы с увеличением порядкового номера элемента стандартная энергия Гиббса образования гидридов неметаллов возрастает Следовательно, уменьшаются химическое сродство между водородом и неметаллическими элементами и устойчивость молекул гидридов. Из гидридов галогенов -галогеноводородов - наиболее устойчивы молекулы HF .
Гидриды металлов
Известны многочисленные методы получения гидридов металлов. Основным методом является синтез из металла и газообразного водорода. Поскольку в реакции участвует газообразный компонент, то процесс подчиняется всем правилам гетерогенного равновесия. Кроме основныхфакторов, таких как давление, температура, время, на процесс синтеза влияет множество других, чувствительность к которым и составляет особенность реакционной способности водорода как элемента.
Изменение кислотно-основных свойств CH4 , NH3 , H2O , H2S и галогеноводородов HX
В периодах кислотные свойства летучих водородных соединений усиливаются слева направо. В группах кислотные свойства летучих водородных соединений усиливаются сверху вниз. Это связано с тем, что в группах радиус атомов увеличивается сверху вниз, и следовательно увеличивается радиус отрицательно заряженных ионов. Чем больше радиус отрицательно заряженных ионов, тем слабее они притягивают к себе ионы водорода. Следовательно, чем больше радиус атома, тем легче отщепляется ион Н+, то есть тем больше сила кислоты.
Реакция NO и O2 с образованием NO2
Оксид азота(II) - единственный из оксидов азота, который можно получить непосредственно из свободных элементов соединением азота с кислородом при высоких температурах (1200-1300 °C) или в электрическом разряде. В природе он образуется в атмосфере при грозовых разрядах (тепловой эффект реакции −180,9 кДж):
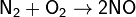
и тотчас же реагирует с кислородом:
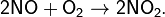
При понижении температуры оксид азота(II) разлагается на азот и кислород, но если температура падает резко, то не успевший разложиться оксид существует достаточно долго: при низкой температуре скорость распада невелика. Такое резкое охлаждение называется «закалкой» и используется при одном из способов получения азотной кислоты
Равновесие между NO2 и N2O4
Оксид азота 4 (NO2) представляет собой легко сжижаемый бурый газ (tкип. = 21оС). Жидкий NO2 при охлаждении ниже -11оС превращается в бесцветную кристаллическую массу.
Молекулы NO2 парамагнитны, т.к. атом азота в них содержит неспаренный электрон. В связи с этим они склонны к димеризации:
2 NO2 -- N2O4 или (NO2)2
В интервале температур от 140оС до -11оС одновременно присутствуют обе формы оксида азота. При охлаждении процесс димеризации усиливается. Кристаллический азот(IV)-оксид состоит уже полностью из димерных молекул N2O4. Выше 140оС присутствуют только молекулы NO2.
При нагревании оксид азота 4 (NO2) обратимо разлагается на NO и O2. Но уже при температуре больше 600оС и атмосферном давлении процесс разложения становится необратимым и в таких условиях NO2 существовать не может.
Растворение NO2 (или N2O4) в H2O сопровождается образованием азотной и азотистой кислот:
2NO2 + H2O = НNO3 + НNO2
Так как азотистая кислота при этом легко распадается по обратимой реакции:
2НNO2 -- H2O + N2O3 -- H2O + NO + NO2
то взаимодействие NO2 с водой практически идет по уравнению:
3NO2 + H2O = 2НNO3 + NO
Если растворение оксида азота 4 (NO2) вести в присутствии избытка кислорода, то выделяющийся NO будет окисляться до NO2. В таких условиях можно полностью перевести NO2 в азотную кислоту по суммарной схеме:
4NO2 + 2H2O + O2 = 4НNO3 + Q
При этом выделяется энергия и образующийся раствор кислоты нагревается. Данный процесс можно ускорить, если его проводить при повышенном давлении.
Если растворять NO2 в растворе щелочи, то образуется смесь солей азотной и азотистой кислот (соли НNO2 (нитриты) в отличие от самой кислоты в растворе устойчивы):
2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
Гидрази́н (диамид) H2N-NH2 - бесцветная, сильно гигроскопическая жидкость с неприятным запахом.
Молекула N2H4 состоит из двух групп NH2, повёрнутых друг относительно друга, что обусловливает полярность молекулы гидразина, μ = 0,62·10−29 Кл · м. Смешивается в любых соотношениях с водой, жидким аммиаком,этанолом; в неполярных растворителях растворяется плохо.
Гидразин и большинство его производных токсичны.
Гидразин - энергичный восстановитель. В растворах гидразин обычно также окисляется до азота:
4KMnO4 + 5N2H4 + 6 H2SO4 → 5N2 + 4MnSO4 + 2K2SO4 + 16H2O
Восстановить гидразин до аммиака можно только сильными восстановителями, такими, как Sn2+, Ti3+, водородом в момент выделения(Zn + HCl):
N2H4 + Zn + 4HCl → 2NH4Cl + ZnCl2
Окисляется кислородом воздуха до азота, аммиака и воды. Известны многие органические производные гидразина. Гидразин, а также гидразин-гидрат, гидразин-сульфат, гидразин-хлорид, широко применяются в качестве восстановителей золота, серебра, платиновых металлов из разбавленных растворов их солей. Медь в аналогичных условиях восстанавливается до закиси.
В органическом синтезе гидразин применяется для восстановления карбонильной группы альдегидов и кетонов до метиленовой по Кижнеру-Вольфу (реакция Кижнера-Вольфа), реакция идёт через образование гидразонов, расщепляющихся затем под действием сильных оснований.
АЗОТНОВАТИСТАЯ КИСЛОТА - H2N2O4 - слабая, неустойчивая неорганическая кислота. Образует соли - гипонитриты.
Строение и свойства
Молекула азотноватистой кислоты имеет строение HO-N=N-OH. Гидроксогруппы находятся в транс-положении кдвойной связи. Растворима в воде, этаноле и диэтиловом эфире.
Получение
Реакцией сухого хлороводорода в диэтиловом эфире с гипонитритом серебра.
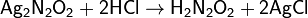
Описана реакция азотистой кислоты с гидроксиламином, которая с низким выходом даёт азотноватистую кислоту:
Свойства азотноватистой кислоты
Разлагается при нагревании до оксида азота(I) и воды. Разложение может протекать со взрывом.
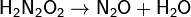
Слабая кислота (pKa (1) = 7, pKa (2) = 11). С щелочами даёт соли, называемые гипонитритами. Жёлтый гипонитрит серебра мало растворим в воде. Водные растворы неустойчивы в диапазоне рН 4-14 из-за катализируемого основанием разложения до закиси азота. В более кислых средах разложение происходит медленнее (период полураспада дни и недели).
Взрывоопасна.
Окисляется на воздухе или подействием иода до азотистой и азотной кислот, поддействием перманганата калия - до азотной кислоты. Реагирует с азотистой кислотой с образованием азотной кислоты и азота. Водородом в момент выделения с трудом восстанавливается до гидразина.
Азотная кислота с металлами.
- не выделяется водород, образуются продукты восстановления азота.
Чем активнее металл и чем меньше концентрация кислоты, тем дальше восстанавливается азот
![]()
![]()
![]()
![]()
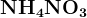
Неактивные металлы (правее железа) + конц. кислота
Неметаллы + конц. кислота
Неактивные металлы (правее железа) + разб. кислота
Активные металлы (щелочные, щелочноземельные, цинк) + конц. кислота
Активные металлы (щелочные, щелочноземельные, цинк) + кислота среднего разбавления
Активные металлы (щелочные, щелочноземельные, цинк) + очень разб. кислота
Пассивация: с холодной концентрированной азотной кислотой не реагируют:
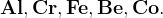
Не реагируют с азотной кислотой ни при какой концентрации:
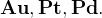
Йодометрия
Метод основан на окислительно-восстановительной реакции тиосульфата натрия с йодом: I2 + 2 Na2S2O3 → 2 NaI + NaS4O6 Процесс происходит в присутствии KI, при этом I2 образует сначала комплекс KI3, который затем взаимодействует с тиосульфатом натрия. Индикатор - крахмал.
Кислотные оксиды
Кислотные оксиды - это оксиды, которым в качестве гидроксидов соответствуют кислоты.
Кислотные оксиды образуют все неметаллы любой степени окисления (исключение - несолеобразующие оксиды CO, NO, N2O, SiO) и металлы в степени окисления +5 и выше.
SO3 ⇒ H2SO4
При взаимодействии кислотного оксида с водой образуется кислота, например, при взаимодействии оксида серы(VI) с водой образуется серная кислота, а оксид кремния(IV) с водой не реагирует, т.к. кремниевая кислота нерастворима в воде.
Взаимодействие галогенов с водой. Галогены реагируют со многими сложными веществами. С водой фтор и остальные галогены реагируют по-разному:
F2 + H2O = 2HF + O или
3F2 + 3H2O = OF2 + 4HF + H2O2;
Hal + H2O = HHal + HHalO.
Эта реакции является реакцией диспропорционирования, где галоген одновременно является окислителем и восстановителем.
Уменьшение реакционной способности от F2 до I2
Все галогены проявляют высокую окислительную активность, которая уменьшается при переходе от фтора к йоду. Фтор - самый активный из галогенов, реагирует со всеми металлами без исключения, многие из них в атмосфере фтора самовоспламеняются, выделяя большое количество теплоты, например:
2Аl + 3F2 = 2АlF3 + 2989 кДж,
2Fе + 3F2 = 2FеF3 + 1974 кДж.
Без нагревания фтор реагирует и со многими неметаллами (H2, S, С, Si, Р) - все реакции при этом сильно экзотермические, например:
Н2 + F2 = 2НF + 547 кДж,
Si + 2F2 = SiF4(г) + 1615 кДж.
При нагревании фтор окисляет все другие галогены по схеме
Hal2 + F2 = 2НаlF
где Наl = Сl, Вr, I, причем в соединениях НаlF степени окисления хлора, брома и иода равны +1.
Наконец, при облучении фтор реагирует даже с инертными (благородными) газами:
Хе + F2 = ХеF2 + 152 кДж.
Взаимодействие фтора со сложными веществами также протекает очень энергично. Так, он окисляет воду, при этом реакция носит взрывной характер:
3F2 + ЗН2О = F2О↑ + 4НF + Н2О2.
Свободный хлор также очень реакционноспособен, хотя его активность и меньше, чем у фтора. Он непосредственно реагирует со всеми простыми веществами, за исключением кислорода, азота и благородных газов. Для сравнения приведем уравнения реакций хлора с теми же простыми веществами, что и для фтора:
2Аl + ЗСl2 = 2АlСl3(кр) + 1405 кДж,
2Fе + ЗСl2 = 2FeСl3(кр) + 804 кДж,
Si + 2Сl2 = SiCl4(Ж) + 662 кДж,
Н2 + Сl2 = 2НСl(г)+185кДж.
Особый интерес представляет реакция с водородом. Так, при комнатной температуре, без освещения хлор практически не реагирует с водородом, тогда как при нагревании или при освещении (например, на прямом солнечном свету) эта реакция протекает со взрывом по приведенному ниже цепному механизму:
Cl2 + hν → 2Сl,
Сl + Н2 → НСl + Н,
Н + Cl2 → НСl + Сl,
Сl + Н2 → НCl + Н и т.д.
Возбуждение этой реакции происходит под действием фотонов (hv), которые вызывают диссоциацию молекул Сl2 на атомы - при этом возникает цепь последовательных реакций, в каждой из которых появляется частица, инициирующая начало последующей стадии.
Реакция между Н2 и Сl2 послужила одним из первых объектов исследования цепных фотохимических реакций. Наибольший вклад в развитие представлений о цепных реакциях внес русский ученый, лауреат Нобелевской премии (1956 г) Н.Н. Семенов.
Хлор вступает в реакцию со многими сложными веществами, например замещения и присоединения с углеводородами:
СН3-СН3 + Сl2 → СН3-СН2Сl + НСl,
СН2=СН2 + Сl2 → СН2Cl - СН2Сl.
Хлор способен при нагревании вытеснять бром или иод из их соединений с водородом или металлами:
Сl2 + 2НВr = 2НСl + Вr2,
Сl2 + 2НI = 2НСl + I2,
Сl2 + 2КВr = 2КСl + Вr2,
а также обратимо реагирует с водой:
Сl2 + Н2О = НСl + НСlO - 25 кДж.
Хлор, растворяясь в воде и частично реагируя с ней, как это показано выше, образует равновесную смесь веществ, называемую хлорной водой.
Заметим также, что хлор в левой части последнего уравнения имеет степень окисления 0. В результате реакции у одних атомов хлора степень окисления стала -1 (в НСl), у других +1 (в хлорноватистой кислоте НОСl). Такая реакция - пример реакции самоокисления-самовосстановления, или диспропорционирования.
Хлор может таким же образом реагировать (диспропорционировать) с щелочами:
Сl2 + 2NаОН = NаСl + NаСlO + Н2О (на холоде),
ЗСl2 + 6КОН = 2КСl + КClO3 + ЗН2О (при нагревании).
Химическая активность брома меньше, чем у фтора и хлора, но все же достаточно велика в связи с тем, что бром обычно используют в жидком состоянии и поэтому его исходные концентрации при прочих равных условиях больше, чем у хлора.
Для примера приведем реакции взаимодействия брома с кремнием и водородом:
Si +2Вr2 = SiBr4(ж) + 433 кДж,
Н2 + Вr2 = 2НВr(г) + 73 кДж.
Являясь более «мягким» реагентом, бром находит широкое применение в органической химии.
Отметим, что бром, так же, как и хлор, растворяется в воде, и, частично реагируя с ней, образует так называемую «бромную воду», тогда как йод практически в воде не растворим и не способен ее окислять даже при нагревании; по этой причине не существует «йодной воды».
Йод существенно отличается по химической активности от остальных галогенов. Он не реагирует с большинством неметаллов, а с металлами медленно реагирует только при нагревании. Взаимодействие же иода с водородом происходит только при сильном нагревании, реакция является эндотермической и сильно обратимой:
Н2 + I2 = 2НI - 53 кДж.
Таким образом, химическая активность галогенов последовательно уменьшается от фтора к йоду. Каждый галоген в ряду F - I может вытеснять последующий из его соединений с водородом или металлами, т.е. каждый галоген в виде простого вещества способен окислять галогенид-ион любого из последующих галогенов
D - элементы
Характерные степени окисления хрома
Для хрома характерны степени окисления +2, +3 и +6. (см. табл.) Практически все соединения хрома окрашены.
Степень окисления
Оксид
Гидроксид
Характер
Преобладающие формы в растворах
Примечания
+2
CrO (чёрный)
Cr(OH)2(желтый)
Основный
Cr2+ (соли голубого цвета)
Очень сильный восстановитель
+3
Cr2O3(зелёный)
Cr(OH)3 (серо-зеленый)
Амфотерный
Cr3+ (зеленые или лиловые соли)
[Cr(OH)4]- (зелёный)
+4
CrO2
не существует
Несолеобразующий
-
Встречается редко, малохарактерна
+6
CrO3(красный)
H2CrO4
H2Cr2O7
Кислотный
CrO42- (хроматы, желтые)
Cr2O72- (дихроматы, оранжевые)
Переход зависит от рН среды. Сильнейший окислитель, гигроскопичен, очень ядовит.
Соединения марганца
Ион марганца Мn2+ не обладает окраской в водном растворе. Кристаллы МnSO4 или МnСОз бесцветны (иногда МnСОз светло-розовый), но оксид МnО серо-зеленый, МnСl2 и Mn(NO3)2 розовые.
Степени окисления марганца +3 соответствует бурый цвет Мn2Оз или черно-коричневый у Мn3O4. Правда, последнее соединение содержит не только Мn3+, но и Мn4+, который и углубляет цвет. В обычных условиях МnO2 - черные кристаллы. Ион Мn6+ может присутствовать только в составе аниона MnO42-, окрашенного в зеленый цвет. Кислота Н2МnO4, соответствующая этому аниону, в свободном виде не выделена, а образующаяся из солей при подкислении растворов манганатов:
К2МnО4 + 2СН3СООН → Н2МnО4 + 2СН3СООК
самопроизвольно распадается на темно-коричневый МnО2 и перманганат КМnO4:
ЗК2МnО4 + 4СН3СООН → МnО2 + 2КМпО4 ++ 4СН3СООК + 2Н2O
Аниону МnО4-, где степень окисления марганца самая высокая + 7, соответствует уже иной - фиолетово-малиновый цвет. Каждый его наверняка видел - это цвет раствора «марганцовки».
Такое разнообразие цветов соединений марганца различных степеней окисления и их одновременное сочетание в растворе позволило К. Шееле назвать К2МnO4 минеральным хамелеоном. В 1774 г. этот исследователь получил манганат калия сплавлением:
МnO2 + 2КОН + KNO3 → K2MnO4 + KNO2 + Н2О
Продукт реакции дал с водой раствор зеленого цвета, но постепенно при стоянии на воздухе (под действием кислорода) стал превращаться сначала в синий, затем в фиолетовый и под конец стал малиновым (окраска МnО4-)
Такое разнообразие цветов объясняется изменением характера ионов марганца. Чем выше степень окисления, тем больше поляризующее действие марганца. Дело доходит до того, что Мn+6 и Мn+7 являются одними из сильных окислителей.
У воды они отбирают ион кислорода, создавая себе окружение из четырех ионов O-2. Разница в состоянии лишь одного электрона определяет цвет - зеленый или фиолетово-малиновый, но кроме этого - окислительные способности.
Характерные степени окисления железа
Степень окисления
Оксид
Гидроксид
Характер
Примечания
+2
FeO
Fe(OH)2
Слабоосновный
Слабый восстановитель
+3
Fe2O3
Fe(OH)3
Очень слабое основание, иногда - амфотерный
Слабый окислитель
+6
Не получен
2FeO4>*
Кислотный
Сильный окислитель
* Кислота в свободном виде не существует - получены только её соли.
Для железа характерны степени окисления - +2 и +3.
Степени окисления +2 соответствует чёрный оксид FeO и зелёный гидроксид Fe(OH)2. Они имеют основный характер. В солях Fe(+2) присутствует в виде катиона. Fe(+2) - слабый восстановитель.
Степени окисления +3 соответствуют красно-коричневый оксид Fe2O3 и коричневый гидроксид Fe(OH)3. Они носят амфотерный характер, хотя и кислотные, и основные свойства у них выражены слабо. Так, ионы Fe3+ нацелогидролизуются даже в кислой среде. Fe(OH)3 растворяется (и то не полностью), только в концентрированных щелочах. Fe2O3 реагирует со щелочами только при сплавлении, давая ферриты (формальные соли несуществующей в свободном виде кислоты HFeO2):
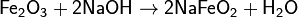
Железо (+3) чаще всего проявляет слабые окислительные свойства.
Степени окисления +2 и +3 легко переходят между собой при изменении окислительно-восстановительных условий.
Кроме того, существует оксид Fe3O4, формальная степень окисления железа в котором +8/3. Однако этот оксид можно также рассматривать как феррит железа (II) Fe+2(Fe+3O2)2.
Также существует степень окисления +6. Соответствующего оксида и гидроксида в свободном виде не существует, но получены соли - ферраты (например, K2FeO4). Железо (+6) находится в них в виде аниона. Ферраты являются сильными окислителями.
Соединения кобальта
-
При нагревании, кобальт реагирует с галогенами, причём соединения кобальта (III) образуются только с фтором.
2Co+3F2→2CoF3
Co+Cl2→CoCl2
-
С серой кобальт образует 2 различных модификации CoS. Серебристо-серую α-форму (при сплавлении порошков) и чёрную β-форму (выпадает в осадок из растворов).
-
При нагревании CoS в атмосфере сероводорода получается сложный сульфид Со9S8
-
С другими окисляющими элементами, такими как углерод, фосфор, азот, селен, кремний, бор. кобальт тоже образует сложные соединения, являющиеся смесями где присутствует кобальт со степенями окисления 1, 2, 3.
-
Кобальт способен растворять водород, не образуя химических соединений. Косвенным путем синтезированы два стехиометрических гидрида кобальта СоН2 и СоН.
-
Растворы солей кобальта CoSO4, CoCl2, Со(NO3)2 придают воде бледно-розовую окраску. Растворы солей кобальта в спиртах темно-синие. Многие соли кобальта нерастворимы.
-
Кобальт создаёт комплексные соединения. Чаще всего на основе аммиака.
Наиболее устойчивыми комплексами являются лутеосоли [Co(NH3)6]3+ жёлтого цвета и розеосоли [Co(NH3)5H2O]3+ красного или розового цвета.
-
Также кобальт создаёт комплексы на основе CN−, NO2− и многих других.
Соединения никеля
Никель характеризуется высокой коррозионной стойкостью - устойчив на воздухе, в воде, в щелочах, в ряде кислот. Химическая стойкость обусловлена его склонностью к пассивированию - образованию на его поверхности плотной оксидной плёнки, обладающей защитным действием. Никель активно растворяется в разбавленной азотной кислоте:
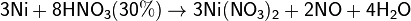
и в горячей концентрированной серной:
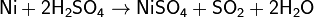
С соляной и с разбавленной серной кислотами реакция протекает медленно. Концентрированная азотная кислота пассивирует никель, однако при нагревании реакция всё же протекает (основной продукт восстановления азота - NO2).
С оксидом углерода CO никель легко образует летучий и очень ядовитый карбонил Ni(CO)4.
Тонкодисперсный порошок никеля пирофорный (самовоспламеняется на воздухе).
Никель горит только в виде порошка. Образует два оксида NiO и Ni2O3 и соответственно два гидроксида Ni(OH)2 и Ni(OH)3. Важнейшие растворимые соли никеля - ацетат, хлорид, нитрат и сульфат. Водные растворы солей окрашены обычно в зелёный цвет, а безводные соли - жёлтые или коричнево-жёлтые. К нерастворимым солям относятся оксалат и фосфат (зелёные), три сульфида: NiS (черный), Ni3S2 (желтовато-бронзовый) и Ni3S4 (серебристо-белый). Никель также образует многочисленные координационные и комплексные соединения. Например, диметилглиоксимат никеля Ni(C4H6N2O2)2, дающий чёткую красную окраску в кислой среде, широко используется в качественном анализе для обнаружения никеля.
Соединения меди
В соединениях медь проявляет две степени окисления: +1 и +2. Первая из них склонна к диспропорционированию и устойчива только в нерастворимых соединениях (Cu2O, CuCl, CuI и т. п.) или комплексах (например, [Cu(NH3)2]+). Её соединения бесцветны. Более устойчива степень окисления +2, которая даёт соли синего и сине-зелёного цвета. В необычных условиях можно получить соединения со степенью окисления +3 и даже +5. Последняя встречается в солях купраборанового аниона Cu(B11H11)23−, полученных в 1994 году.
Соединения серебра
Наиболее устойчивой степенью окисления серебра в соединениях является +1. В присутствии аммиака соединения серебра (I) дают легко растворимый в воде комплекс [Ag(NH3)2]+. Серебро образует комплексы так же с цианидами, тиосульфатами. Комплексообразование используют для растворения малорастворимых соединений серебра, для извлечения серебра из руд. Более высокие степени окисления (+2, +3) серебро проявляет только в соединении с кислородом (AgO, Ag2O3) и фтором (AgF2, AgF3), такие соединения гораздо менее устойчивы, чем соединения серебра (I).
Соли серебра (I), за редким исключением (нитрат, перхлорат, фторид), нерастворимы в воде, что часто используется для определения ионов галогенов (хлора, брома, йода) в водном растворов.
Соединения цинка
Степень окисления цинка в соединениях +2. Нормальный окислительно-восстановительный потенциал, равный 0,76 в, характеризует Ц. как активный металл и энергичный восстановитель. На воздухе при температуре до 100 °C Ц. быстро тускнеет, покрываясь поверхностной плёнкой основных карбонатов. Во влажном воздухе, особенно в присутствии СО2, происходит разрушение металла даже при обычных температурах. При сильном нагревании на воздухе или в кислороде Ц. интенсивно сгорает голубоватым пламенем с образованием белого дыма цинка окиси ZnO. Сухие фтор, хлор и бром не взаимодействуют с Ц. на холоду, но в присутствии паров воды металл может воспламениться, образуя, например, ZnCl2. Нагретая смесь порошка Ц. с серой даёт сульфид Ц. ZnS. Сульфид Ц. выпадает в осадок при действии сероводорода на слабокислые или аммиачные водные растворы солей Zn. Гидрид ZnH2 получается при взаимодействии LiAIH4 с Zn (CH3)2 и др. соединениями Ц.; металлоподобное вещество, разлагающееся при нагревании на элементы. Нитрид Zn3N2 - чёрный порошок, образуется при нагревании до 600 °C в токе аммиака; на воз духе устойчив до 750 °C, вода его разлагает. Карбид Ц. ZnC2 получен при нагревании Ц. в токе ацетилена. Сильные минеральные кислоты энергично растворяют Ц., особенно при нагревании, с образованием соответствующих солей. При взаимодействии с разбавленными HCl и H2SO4 выделяется H2, а с HNO3 - кроме того, NO, NO2, NH3. С концентрированными HCl, H2SO4 и HNO3 Ц. реагирует, выделяя соответственно H2, SO2, NO и NO2. Растворы и расплавы щелочей окисляют Ц. с выделением Н2 и образованием растворимых в воде цинкатов.
Интенсивность действия кислот и щелочей на Ц. зависит от наличия в нём примесей. Чистый Ц. менее реакционноспособен по отношению к этим реагентам из-за высокого перенапряжения на нём водорода. В воде соли Ц. при нагревании гидролизуются, выделяя белый осадок гидроокиси Zn(OH)2 . Известны комплексные соединения, содержащие Ц., например [Zn (NH3)4] SO4 и
Соединения ртути
Степень окисления
Оксид
Гидроксид
Характер
Примечания
+1
Hg2O
Слабоосновный
Склонность к диспропорционированию
+2
HgO
2>**
Очень слабое основание, иногда - амфотерный
'*Гидроксид не получен, существуют только соответствующие соли
'**Гидроксид существует только в очень разбавленных (<10−4моль/л) растворах.
Для ртути характерны две степени окисления: +1 и +2. В степени окисления +1 ртуть представляет собой двухъядерный катион Hg22+ со связью металл-металл. Ртуть - один из немногих металлов, способных формировать такие катионы, и у ртути они - самые устойчивые.
В степени окисления +1 ртуть склонна к диспропорционированию. Оно протекает при нагревании:
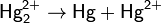
подщелачивании:
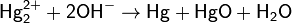
добавлении лигандов, стабилизирующих степень окисления ртути +2.
Из-за диспропорционирования и гидролиза гидроксид ртути (I) получить не удаётся.
На холоде ртуть +2 и металлическая ртуть, наоборот, конпропорционируют. Поэтому, в частности, при реакциинитрата ртути (II) со ртутью получается нитрат ртути (I):
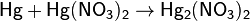
В степени окисления +2 ртуть образует катионы Hg2+, которые очень легко гидролизуются. При этом гидроксид ртути Hg(OH)2 существует только в очень разбавленных (<10−4моль/л) растворах. В более концентрированных растворах он дегидратируется:
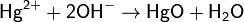
В очень концентрированной щелочи оксид ртути частично растворяется с образованием гидроксокомплекса:
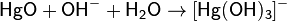
Ртуть в степени окисления +2 образует уникально прочные комплексы со многими лигандами, причём как жёсткими, так и мягкими по теории ЖМКО. С йодом (-1), серой (-2) и углеродом она образует очень прочные ковалентные связи. По устойчивости связей металл-углерод ртути нет равных среди других металлов, поэтому получено огромное количество ртуть органических соединений.
Cr , Mn ,Fe ,Co, Ni растворяются в разбавленной HCI, т.к. находятся в ряду напряжений до водорода. Hаходясь в pяду напpяжения после водоpода, медь не вытесняет его из кислот. Поэтому соляная и pазбавленная сеpная кислоты на медь не действуют. Однако в пpисутствии кислоpода медь pас-твоpяется в этих кислотах с обpазованием соответствующих солей:
2Cu + 4HCl + O2 -> 2CuCl2 + 2H2O
Пассивирование металлов
Концентрированная азотная и серная кислота пассивируют такие металлы как хром, железо и алюминий, образуя на их поверхности защитную оксидную пленку. Но при нагревании происходит химическая реакция.
Амфотерные гидроксиды и оксиды
Амфотерность (двойственность свойств) гидроксидов и оксидов многих элементов проявляется в образовании ими двух типов солей. Например, для гидроксида и оксида алюминия:
а) 2Al(OH)3 + 3SO3 = Al2(SO4)3 + 3H2O
Al2О3 + 3H2SO4 = Al2(SO4)3 + 3H2O
б) 2Al(OH)3 + Na2O = 2NaAlO2 + 3H2O (в расплаве)
Al2О3 + 2NaOH(тв) = 2NaAlO2 + H2O (в расплаве)
В реакциях (а) Al(OH)3 и Al2О3 проявляют свойства оснóвных гидроксидов и оксидов, то есть они подобно щелочам реагируют с кислотами и кислотными оксидами, образуя соль, в которой алюминий является катионом Al3+. Напротив, в реакциях (б) Al(OH)3 и Al2О3 выполняют функцию кислотных гидроксидов и оксидов, образуя соль, в которой атом алюминия Al III входит в состав аниона (кислотного остатка) AlО2−.
Сам элемент алюминий проявляет в этих соединениях свойства металла и неметалла. Следовательно, алюминий - амфотерный элемент.
Подобные свойства имеют также элементы А-групп - Be, Ga, Ge, Sn, Pb, Sb, Bi и другие, а также большинство элементов Б-групп - Cr, Mn, Fe, Zn, Cd и другие.
Например, амфотерность цинка доказывают такие реакции:
а) Zn(OH)2 + N2O5 = Zn(NO3)2 + H2O
ZnO + 2HNO3 = Zn(NO3)2 + H2O
б) Zn(OH)2 + Na2O = Na2ZnO2 + H2O
ZnO + 2NaOH(тв) = Na2ZnO2 + H2O
Если амфотерный элемент имеет в соединениях несколько степеней окисления, то амфотерные свойства наиболее ярко проявляются для промежуточной степени окисления.
Например, у хрома известны три степени окисления: +II, +III и +VI. В случае CrIII кислотные и оснóвные свойства выражены примерно в равной степени, тогда как у CrII наблюдается преобладание оснóвных свойств, а у CrVI - кислотных свойств:
CrII → CrO, Cr(OH)2 → CrSO4
CrIII → Cr2O3, Cr(OH)3 → Cr2(SO4)3 или KCrO2
CrVI → CrO3, H2CrO4 → K2CrO4
Очень часто амфотерные гидроксиды элементов в степени окисления +III существуют также в мета-форме, например:
AlO(OH) - метагидроксид алюминия
FeO(OH) - метагидроксид железа (орто-форма "Fe(OH)3" не существует) .
Амфотерные гидроксиды практически нерастворимы в воде, наиболее удобный способ их получения - осаждение из водного раствора с помощью слабого основания - гидрата аммиака:
Al(NO3)3 + 3(NH3 · H2O) = Al(OH)3↓ + 3NH4NO3 (20 °C)
Al(NO3)3 + 3(NH3 · H2O) = AlO(OH)↓ + 3NH4NO3 + H2O (80 °C)
В случае использования избытка щелочей в обменной реакции подобного типа гидроксид алюминия осаждаться не будет, поскольку алюминий в силу своей амфотерности переходит в анион:
Al(OH)3(т) + OH− = [Al(OH)4]−
Примеры молекулярных уравнений реакций этого типа:
Al(NO3)3 + 4NaOH(избыток) = Na[Al(OH)4] + 3NaNO3
ZnSO4 + 4NaOH(избыток) = Na2[Zn(OH)4] + Na2SO4
Образующиеся соли относятся к числу комплексных соединений (комплексных солей) : они включают комплексные анионы [Al(OH)4]− и [Zn(OH)4]2−. Названия этих солей таковы:
Na[Al(OH)4] - тетрагидроксоалюминат натрия
Na2[Zn(OH)4] - тетрагидроксоцинкат натрия
Продукты взаимодействия оксидов алюминия или цинка с твердой щелочью называются по-другому:
NaAlO2 - диоксоалюминат (III) натрия
Na2ZnO2 - диоксоцинкат (II) натрия
Подкисление растворов комплексных солей этого типа приводит к разрушению комплексных анионов:
H+ H+
[Al(OH)4]− → Al(OH)3 → Al3+
Например: 2Na[Al(OH)4] + CO2 = 2Al(OH)3↓ + NaHCO3
Для многих амфотерных элементов точные формулы гидроксидов низвестны, поскольку из водного раствора вместо гидроксидов выпадают гидратированные оксиды, например MnO2 · nH2O, Sb2O5 · nH2O.
Амфотерные элементы в свободном виде взаимодействуют как с типичными кислотами, так и со щелочами:
2Al + 3H2SO4(разб. ) = Al2(SO4)3 + H2↑
2Al + 6H2O + 4NaOH(конц. ) = 2Na[Al(OH)4] + 3H2↑
В обеих реакциях образуются соли, причем рассматриваемый элемент в одном случае входит в состав катиона, а во втором - в состав аниона.
Перманганат калия как окислитель.
KMnO4 + восстановители ![]()
в кислой среде 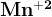
в нейтральной среде 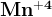
в щелочной среде 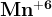
(соль той кислоты, которая участвует в реакции)
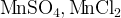
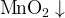
Манганат 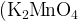 или
или 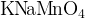 ,
, 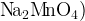 -
-
Дихромат и хромат как окислители.
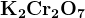 (кислая и нейтральная среда),
(кислая и нейтральная среда), 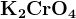 (щелочная среда) + восстановители
(щелочная среда) + восстановители ![]() всегда получается
всегда получается ![]()
кислая среда
нейтральная среда
щелочная среда
Соли тех кислот, которые участвуют в реакции: 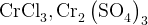
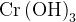
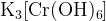 в растворе,
в растворе, 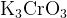 или
или 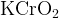 в расплаве
в расплаве
Производство серной кислоты
Контактный метод получения H2SO4 Основные стадии получения серной кислоты контактным методом включают:
-
Сжигание или обжиг сырья в кислороде с получением SO2
-
Очистка от примесей газа
-
Окисление SO2 в SO3
-
Абсорбция SO3 водой.
Ниже приведены реакции по производству серной кислоты из минерала пирита на катализаторе - оксиде ванадия (V) (V2O5)
-
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
-
2SO2 + O2 → 2SO3
-
SO3 + H2O → H2SO4
Нитрозный метод получения серной кислоты
-
SO2 + NO2 → SO3 + NO↑.
-
2NO+O2 → 2NO2
При реакции SO3 с водой выделяется огромное количество теплоты, и серная кислота начинает закипать с образованием "туманов" SO3 + H2O = H2SO4 + Q. Поэтому SO3 смешивается с H2SO4, образуя раствор SO3 в 91% H2SO4 - олеум.
Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота:
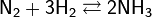 + 91,84 кДж
+ 91,84 кДж
Это так называемый процесс Габера (немецкий физик, разработал физико-химические основы метода).
Реакция происходит с выделением тепла и понижением объёма. Следовательно, исходя из принципа Ле-Шателье, реакцию следует проводить при возможно низких температурах и при высоких давлениях - тогда равновесие будет смещено вправо.
Производство Na2CO3
Промышленный аммиачный способ (способ Сольве)
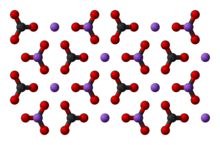
Карбонат натрия
В 1861 году бельгийский инженер-химик Эрнест Сольве запатентовал метод производства соды, который используется и по сей день.
В насыщенный раствор хлорида натрия пропускают эквимолярные количества газообразных аммиака и диоксида углерода, то есть как бы вводят гидрокарбонат аммония NH4HCO3:
NH3 + CO2 + H2O + NaCl → NaHCO3 + NH4Cl.
Выпавший остаток малорастворимого (9,6 г на 100 г воды при 20 °C) гидрокарбоната натрия отфильтровывают и кальцинируют (обезвоживают) нагреванием до 140-160 °C, при этом он переходит в карбонат натрия:
2NaHCO3 →(t) Na2CO3 + CO2↑ + H2O.
Образовавшийся CO2 возвращают в производственный цикл. Хлорид аммония NH4Cl обрабатывают гидроксидом кальция Ca(OH)2:
2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3↑ + 2H2O,
и полученный NH3 также возвращают в производственный цикл.
Таким образом, единственным отходом производства является хлорид кальция, не имеющий широкого промышленного применения, кроме использования в качестве противообледеняющего реагента для посыпания улиц.
Первый содовый завод такого типа в мире был открыт в 1863 в Бельгии; первый завод такого типа в России был основан в районе уральского города Березники фирмой «Любимов, Сольве и Ко» в 1883 году. Его производительность составляла 20 тысяч тонн соды в год. В 2010 году ФАС России отказала фирме Solvay в покупке этого завода, разрешив покупку группе Башкирская химия (ей также принадлежит завод Сода).
До сих пор этот способ остаётся основным способом получения соды во всех странах.
Производство натрия
Первым промышленным способом получения натрия стала карботермическая реакция восстановления карбоната натрия углем при нагревании тесной смеси этих веществ в железной ёмкости до 1000 °C (способ Девилля)
Na2CO3+2C 10000c 2Na+3CO.
Аналогично, могут быть использованы карбид кальция, алюминий, кремний, ферросилиций, силикоалюминий.
С появлением электроэнергетики стал более практичен другой способ получения натрия - электролиз расплава едкого натра или хлорида натрия. В настоящее время электролиз - основной способ получения натрия.
Натрий также можно получить цирконие-термическим методом, а также термическим разложением азида натрия.
Производство хлора
Первоначально промышленный способ получения хлора основывался на методе Шееле, то есть реакции пиролюзита с соляной кислотой. В 1867 г. Диконом был разработан метод получения хлора каталитическим окислением хлороводорода кислородом воздуха.
В настоящее время основным методом промышленного производства хлора является электролиз хлоридов щелочных и щёлочноземельных металлов - в первую очередь водных растворов (более 90 % производства), некоторое количество - расплавов.
Производство NaOH
В промышленном масштабе гидроксид натрия получают электролизом растворов галита (каменная соль NaCl) с одновременным получением водорода и хлора:
2NaCl + 2H2О = H2↑ + Cl2↑ + 2NaOH
В настоящее время едкая щёлочь и хлор вырабатываются тремя электрохимическими методами. Два из них - электролиз с твёрдым асбестовым или полимерным катодом (диафрагменный и мембранный методы производства), третий - электролиз с жидким ртутным катодом (ртутный метод производства).
В ряду электрохимических методов производства самым лёгким и удобным способом является электролиз с ртутным катодом, но этот метод наносит значительный вред окружающей среде в результате испарения и утечек металлической ртути.
Мембранный метод производства самый эффективный, наименее энергоёмкий и наиболее экологичный, но и самый капризный, в частности, требует сырьё более высокой чистоты.
Благоро́дные газы (также инертные или редкие газы) - химические элементы 18-й группы периодической таблицы химических элементов (поустаревшей классификации - элементы главной подгруппы VIII группы). К благородным газам относятся гелий, неон, аргон, криптон, ксенон, радон и, возможно, унуноктий.
Инертные газы отличаются химической неактивностью (отсюда и название). Тем не менее, в 1962 году Нил Барлетт показал, что все они при определённых условиях могут образовывать соединения (особенно охотно со фтором). Наиболее «инертны» неон и гелий: чтобы заставить их вступить в реакцию, нужно применить много усилий, искусственно ионизируя каждый атом. Ксенон же, наоборот, слишком активен (для инертных газов) и реагирует даже при нормальных условиях, демонстрируя чуть ли не все возможные степени окисления (+1, +2, +4, +6, +8). Радон тоже имеет высокую химическую активность, но он радиоактивен и быстро распадается, поэтому подробное изучение его химических свойств осложнено, в отличие от ксенона.
Унуноктий, несмотря на его принадлежность к 18-ой группе периодической таблицы, может не являться инертным газом, так как предполагается, что при нормальных условиях в силу релятивистских эффектов, влияющих на движение электронов вблизи его ядра с высоким зарядом, он будет находиться в твердом состоянии.
Инертные газы бесцветны и не имеют запаха. В небольшом количестве они присутствуют в воздухе и некоторых горных породах, а также в атмосферах некоторых планет-гигантов.