- Преподавателю
- Химия
- Конспект урока
Конспект урока
| Раздел | Химия |
| Класс | - |
| Тип | Конспекты |
| Автор | Петроченко А.В. |
| Дата | 08.03.2014 |
| Формат | doc |
| Изображения | Есть |
Урок по теме: «Водород». 9 класс
Цель урока: систематизация и развитие знаний учащихся о водороде как химическом элементе и простом веществе, о свойствах водорода, способах его получения, роли в природной среде на основе сформированной предметной понятийно-теоретической базы.
Методические задачи урока:
-
Продолжить формирование понимания зависимости между составом, строением, свойствами и применением веществ на примере водорода.
-
Продолжить формирование таких понятий, ковалентная связь, степень окисления, окислительно-восстановительные реакции.
-
Сформировать знания о способах получения водорода, химических свойствах, его применении.
Тип урока: комбинированный.
Методы: словесный (рассказ, объяснение, с элементами дискуссии, постановка и решение проблемных вопросов); наглядный (презентация); практический (составление уравнений).
Оборудование: прибор для получения газа, цинк, раствор соляной кислоты, натрий, вода, пробирки.
Ход урока
-
Оргмомент.
-
Химический диктант.
Выбрать свойства, характерные для:
I вариант - металлов II вариант - неметаллов
-
Ковкость
-
Металлический блеск
-
Газообразное агрегатное состояние
-
Пластичность
-
Различная окраска
-
Обычно высокая температура кипения
-
Обычно низкая температура кипения
-
Плохая электропроводность
-
Твердое агрегатное состояние
-
Хорошая электропроводность
Ответы:
1
2
3
4
5
6
7
8
9
10
I в
+
+
-
+
-
+
-
-
+
+
II в
-
-
+
-
+
-
+
+
+
-
-
Изучение новой темы.
-
Подготовка учащихся к восприятию знаний.
В день, когда его запасы иссякнут, жизнь во Вселенной прекратится. Погаснут солнца, не станет воды... Вещество, без которого жизнь невозможна, «сидит» в самом центре нашей планеты - в ядре и вокруг него, и оттуда «мигрирует» наружу. Этот газ - начало всех начал. Его название - «водород».
-
Водород в природе (сообщения учащихся) - презентация
Много ли в природе водорода? Смотря где. В космосе водород - главный элемент. На его долю приходится около половины массы Солнца и большинства других звезд. Он содержится в газовых туманностях, в межзвездном газе, входит в состав звезд. В недрах звезд происходит превращение ядер атомов водорода в ядра атомов гелия. Этот процесс протекает с выделением энергии; для многих звезд, в том числе для Солнца, он служит главным источником энергии.
Например, ближайшая к нам звезда Галактики, которую мы знаем под именем «Солнце», на 70 % своей массы состоит из водорода. Атомов водорода во вселенной в несколько десятков тысяч раз больше, чем всех атомов всех металлов, вместе взятых.
Водород широко распространен в природе, его содержание в земной коре (литосфера и гидросфера) составляет по массе 1%, а по числу атомов 16%. Водород входит в состав самого распространенного вещества на Земле - воды (11,19% водорода по массе), в состав соединений, слагающих угли, нефть, природные газы, глины, а также организмы животных и растений (то есть в состав белков, нуклеиновых кислот, жиров, углеводов и других). В свободном состоянии Водород встречается крайне редко, в небольших количествах он содержится в вулканических и других природных газах. Ничтожные количества свободного Водорода (0,0001% по числу атомов) присутствуют в атмосфере.
-
Открытие водорода. (сообщения учащихся) презентация
Водород был открыт в первой половине XVI века немецким врачом и естествоиспытателем Парацельсом. В трудах химиков XVI-XVIII вв. упоминался «горючий газ» или «воспламеняемый воздух», который в сочетании с обычным давал взрывчатые смеси. Получали его, действуя на некоторые металлы (железо, цинк, олово) разбавленными растворами кислот - серной и соляной.
Первым ученым, описавшим свойства этого газа, был английский ученый Генри Кавендиш. Он определил его плотность и изучил горение на воздухе, однако приверженность теории флогистона помешала исследователю разобраться в сути происходящих процессов.
В 1779 г. Антуан Лавуазье получил водород при разложении воды, пропуская ее пары через раскаленную докрасна железную трубку. Лавуазье также доказал, что при взаимодействии «горючего воздуха» с кислородом образуется вода, причем газы реагируют в объемном соотношении 2:1. Это позволило ученому определить состав воды - Н2О. Название элемента - Hydrogenium - Лавуазье и его коллеги образовали от греческих слов «гидро» - вода и «геннио» - рождаю. Русское наименование «водород» предложил химик М. Ф. Соловьев в 1824 году - по аналогии с ломоносовским «кислородом».
-
Водород как химический элемент - презентация
-
Положение водорода в ПСХИ Д.И.Менделеева. слайд 3-4
Задание: Определите положение водорода в периодической системе. Двойственность положения водорода.
-
Строение атома. Слайд 5
Задание: Определите строение атома водорода по положению в ПСХЭ.
-
Водород- простое вещество
-
Состав. Строение.Физические свойства. Слайд 7 (работа с учебником)
Водород - бесцветный газ без вкуса и запаха, слабо растворимый в воде. Он в 14,5 раз легче воздуха - самый легкий из газов. Поэтому водородом раньше наполняли аэростаты и дирижабли. При температуре -253° С он сжижается. Эта бесцветная жидкость - самая легкая из всех известных: 1 мл ее весит меньше десятой доли грамма. При - 259°С жидкий водород замерзает, превращаясь в бесцветные кристаллы.
С кислородом воздуха водород образует взрывчатую смесь -- гремучий газ. Поэтому при работе с ним необходимо соблюдать особую осторожность. Чистый водород сгорает почти бесшумно, а в смеси с воздухом издает характерный громкий хлопок. Взрыв гремучего газа в пробирке не представляет опасности для экспериментатора, однако при использовании плоскодонной колбы или посуды из толстого стекла можно серьезно пострадать.
Вот какая история произошла с французским химиком, директором Парижского музея науки Пилатром де Розьером (1756-1785). Как-то он решил проверить, что будет, если вдохнуть водород; до него никто такого эксперимента не проводил. Не заметив никакого эффекта, ученый решил убедиться, проник ли водород в легкие. Он еще раз глубоко вдохнул этот газ, а затем выдохнул его на огонь свечи, ожидая увидеть вспышку пламени. Однако водород в легких экспериментатора смешался с воздухом, и произошел сильный взрыв. «Я думал, что у меня вылетели все зубы вместе с корнями», - так Розье характеризовал испытанные ощущения. Впрочем, он остался очень доволен опытом, который чуть не стоил ему жизни.
2.Получение водорода. Слайд 8
Задание: Как получают водород в лаборатории? Напишите уравнения реакции.
-
Действие разбавленных кислот на металлы. Для проведения такой реакции чаще всего используют цинк и разбавленную серную кислоту:
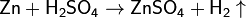
-
Взаимодействие кальция с водой:
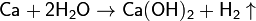
-
Гидролиз гидридов:
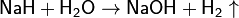
Один из способов получения водорода в промышленности основан на пропускании водяного пара через раскаленный уголь. Напишите уравнение реакции, если кроме водорода, при этом образуется оксид углерода (II).
H2O + C → CO + H2↑
Лабораторный опыт: «Получение водорода» (повторить правила работы с кислотами)
В пробирку положите гранулу цинка и долейте раствор соляной кислоты.
-
Химические свойства. Слайд 9 -13
Водород вступает в реакции с простыми и сложными веществами:
Взаимодействие с веществами
Уравнения реакций
Продукт реакции
С металлами
Н2 + 2Li = 2LiH
Гидриды
С кислородом
2Н2 + О2 = 2Н2О
Вода
С галогенами (с фтором взрывается, с хлором и бромом реагирует при освещении или нагревании, в йодом - только при нагревании
Н2 + Сl2 = 2HCl
Хлороводород
С азотом (при нагревании и давлении)
3Н2 + N2 = 2NH3
Аммиак
С серой (при нагревании)
Н2 + S = H2S
Сероводород
С углеродом
2Н2 + С = СН4
Метан
С оксидами металлов
Н2 + СuO = H2O + Cu
Рассмотрите 2-3 реакции по выбору, с точки зрения ОВР.
-
Применение Слайд 14 (сообщения учащихся)
В настоящее время водород получают в огромных количествах. Очень большую часть его используют при синтезе аммиака, гидрогенизации жиров и при гидрировании угля, масел и углеводородов. Кроме того, водород применяют для синтеза соляной кислоты, метилового спирта, синильной кислоты, при сварке и ковке металлов, а также при изготовлении ламп накаливания и драгоценных камней. В продажу водород поступает в баллонах под давлением свыше 150 атм. Они окрашены в тёмно-зелёный цвет и снабжаются красной надписью "Водород".
Водород используется для превращения жидких жиров в твердые (гидрогенизация), производства жидкого топлива гидрогенизацией углей и мазута. В металлургии водород используют как восстановитель оксидов или хлоридов для получения металлов и неметаллов (германия, кремния, галлия, циркония, гафния, молибдена, вольфрама и др.).
Практическое применение водорода многообразно: им обычно заполняют шары-зонды, в химической промышленности он служит сырьём для получения многих весьма важных продуктов (аммиака и др.), в пищевой - для выработки из растительных масел твёрдых жиров и т. д. Высокая температура (до 2600 °С), получающаяся при горении водорода в кислороде, используется для плавления тугоплавких металлов, кварца и т. п. Жидкий водород является одним из наиболее эффективных реактивных топлив. Ежегодное мировое потребление водорода превышает 1 млн. т.
6.Закрепление. Тест (слайд 14)
7.Домашнее задание. §17 упр.4
Использованные источники:
-
niikm.ru/articles/element_articles/hydrogen/
-
fxyz.ru/%D1%84%D0%BE%
-
festival.1september.ru/articles/413578/image3038.gif
-
chem100.ru/elem.php?n=1
-
sites.google.com/site/himulacom/_/rsrc/1327411896712/zvonok-na-urok/8-klass/urok-no25-himiceskie-svojstva-vodoroda-primenenie/%D0%92%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4%20.jpg?height=171&widt
-
files.school-collection.edu.ru/dlrstore/08d3a964-383d-9411-dba5-7fd6dc3bb676/index.htm
-
Л.Ю. Аликберова. Занимательная химия: Книга для учащихся, учителей и родителей. - М.: АСТ-ПРЕСС, 1999
-
О.С.Габриелян. « Химия 9 класс» - М «Дрофа» 2008 -2012
-
Уроки химии с применением информационных технологий. Неметаллы. Серия «Современная школа» . - М. «Планета 2011»
4


