- Преподавателю
- Химия
- Методика решения расчетных задач по теме «Растворы»
Методика решения расчетных задач по теме «Растворы»
| Раздел | Химия |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Исхакова Р.У. |
| Дата | 05.04.2014 |
| Формат | doc |
| Изображения | Есть |

 ИСХАКОВА Р.У.
ИСХАКОВА Р.У.
В ПОМОЩЬ УЧИТЕЛЮ ПРИ ПОДГОТОВКЕ ЕГЭ


"Уча других, мы учимся сами"
 Сенека
Сенека


ПРЕДИСЛОВИЕ
В учебном пособии предложена методика решения задач на образование и разложение растворов без протекания химической реакции. Задачи на растворы есть простые и более сложные, многоходовые, с участием кристаллогидратов, газов и т.п. Не слишком сложные задачи этого типа обычно представлены в заданиях А26 ЕГЭ по химии. При решении таких задач большинство учащихся сталкиваются с определенными трудностями в осмыслении текста задачи и выборе способа ее решения.
Поэтому целью пособия является:
-
объяснить методику решения таких задач, путем постепенного усложнения.
-
выработать у обучающихся правильные навыки оформления задачи;
-
показать логическую последовательность, используемую в ходе решения задач, выработать навыки её применения;
-
формировать умение обучать учащихся решению химических задач.
В пособии предложены способы решения задач, приводятся примеры решения задач, которые разбиты по типам и расположены в порядке усложнения. Задания могут быть использованы учителями не только при подготовке к ЕГЭ, но и при проведении уроков, учениками - для закрепления материала. Каждый учитель должен помнить, что умение решать задачи развивается в процессе обучения, поэтому чтобы развить это умение нужно постоянно и систематически их решать.
Желаю удачи!
В ИДЫ ДЕЯТЕЛЬНОСТИ ПРИ РЕШЕНИИ ЗАДАЧИ
ИДЫ ДЕЯТЕЛЬНОСТИ ПРИ РЕШЕНИИ ЗАДАЧИ
Анализ условия задачи. Его можно условно разбить на две составляющие - анализ химической стороны задачи и анализ ее количественных характеристик. При анализе химической стороны задачи ученик должен понять, какие вещества и процессы описаны в условии, отобразить их формулами и уравнениями реакций. При анализе количественной стороны задачи ученик должен понять, какие именно величины характеризуются числами в условии задачи, ввести нужные обозначения, правильно указать принадлежность величины. Анализ количественной стороны задачи должен быть отражен в краткой записи условия.
План решения задачи. На этом этапе ученик должен или отнести задачу к одному из известных ему типов задач и восстановить в памяти алгоритм ее решения, или самостоятельно построить алгоритм решения незнакомой задачи.
Выполнение решения задачи. На этом этапе от ученика требуется определенный уровень математических навыков, умение преобразовывать формулы, проводить вычисления, округлять, в отдельных случаях - составлять и решать алгебраические уравнения.
Осмысление результата.
Завершение решения обычно заключается в формулировке ответа.
ЭТО НАДО ЗНАТЬ
-
Раствор - это тоже самое, что гомогенная смесь.
-
Растворителем называют жидкость, растворяющую вещество.
-
«Подобное растворяется в подобном».
-
Существует много способов выражение концентрации вещества в растворе.
-
На растворимость влияют площадь поверхности растворяемого вещества, давление и температура.
-
Разбавлением называют процесс добавления дополнительного количества растворителя в раствор, чтобы уменьшить его концентрации.
-
При выпаривании воды из раствора масса растворенного вещества не изменяется, а масса раствора уменьшается на массу выпаренной воды.
-
При разбавлении раствора водой масса растворенного вещества не изменяется, а масса раствора увеличивается на массу добавленной воды.
-
При сливании двух растворов их массы, а также массы растворенного вещества складываются.
-
При выпадении кристаллов масса растворенного вещества и масса раствора уменьшается на массу выпавших кристаллов, а масса воды не изменяется (если из раствора выделяется безводное вещество)
ОБОЗНАЧЕНИЕ РАЗНОЙ КОНЦЕНТРАЦИИ РАСТВОРОВ
- массовая доля раствора (в долях от единицы), а % - это процентное содержание вещества в растворе;
- объемная доля;
- растворимость (понятие о насыщенных растворах, расчет на чистый растворитель);
С моль/л - молярная концентрация (число молей вещества в 1 л раствора).
КОЛИЧЕСТВЕННАЯ ХАРАКТЕРИСТИКА СОСТАВА РАСТВОРОВ
Для качественной характеристики растворов используют понятия «разбавленный раствор» (содержит мало растворенного вещества) и «концентрированный раствор» (содержит много растворенного вещества). При работе с растворами необходимо знать их количественный состав. Количественный состав выражается различными способами.
Способы

Массовая доля растворенного Молярная концентрация
вещества
Массовая доля растворенного вещества
Массовой долей растворенного вещества называется отношение массы растворенного вещества к массе раствора:
масса компонента mв-ва
массовая доля = ----------------- , т.е. ω= -----
масса целого m(р-ра)
где ω - массовая доля растворенного вещества, г; mв-ва - масса растворенного вещества, г; m(р-ра) - масса раствора, г.
Массовую долю растворенного вещества можно выражать также в процентах:
mв-ва
ω= ----- ∙100%
m(р-ра)
Массовую долю растворенного вещества, выраженную в процентах, часто называют процентной концентрацией раствора.
Пример. В водном растворе хлорида натрия NaCI его массовая доля равна 10%, или 0,1. Это значит, что в растворе массой 100 г содержится 10 г хлорида натрия и 90 г воды. Массу раствора можно рассчитать по формулам:
m(р-ра)= m(растворитля) + m(в-ва);
m(р-ра)= •V
где V- объем раствора, мл; плотность раствора, г/мл.
Масса растворенного вещества равна произведению массы раствора на массовую долю растворенного вещества:
mв-ва = m • ω
При сливании растворов складываются как массы растворов:
 m1 + m2 = m3
m1 + m2 = m3
так и массы растворенных веществ:
m(в-ва1) + m(в-ва2)= m(в-ва3)
Молярная концентрация
Молярная концентрация показывает число молей растворенного вещества в одном литре раствора.
Молярную концентрацию можно рассчитать по формуле: C = n/V,
Где C - молярная концентрация, моль/л; n- количество растворенного вещества, моль,
V- объем раствора, л.
Молярная концентрация С, моль/л
Обозначение молярности
Название раствора
1
1М
Одномолярный
(молярный)
0,5
0,5М
Полумолярный
0,1
0,1М
Децимолярный
0,01
0,01М
Сантимолярный
0,001
0,001М
Миллимолярный
На практике часто переходят от одного способа выражения концентрации к другому по известной плотности раствора, применяя формулу: m(р-ра)= •V
ТИПЫ ЗАДАЧ

-
Задачи на определение массы веществ в растворе
-
З
 адачи на определение массы веществ, необходимой для получения раствора нужной концентрации
адачи на определение массы веществ, необходимой для получения раствора нужной концентрации

-
Задачи на определение массовой доли веществ в растворе

-
Задачи на определение процентного содержания веществ в растворе

-
Задачи с использованием понятия растворимости

-
Задачи на определение массы или объема вещества при добавлении его в раствор для изменения концентрации

-
Задачи на определение процентного содержания или массовой доли веществ в растворе, полученном при смешивании растворов разной концентрации

-
Задачи на молярную концентрацию

-
Усложненные задачи
I ТИП. ЗАДАЧИ НА ОПРЕДЕЛЕНИЕ МАССЫ ВЕЩЕСТВ В РАСТВОРЕ
ТИП. ЗАДАЧИ НА ОПРЕДЕЛЕНИЕ МАССЫ ВЕЩЕСТВ В РАСТВОРЕ
Типовая задача.
Какую массу соли и объем воды необходимо взять для приготовления 50 г
0,5 %-ного раствора
Д ано: Решение
ано: Решение
m (р-ра) = 50 г m (соли) = 50 г · 0,005 = 0,25 г соли
(соли) = 0,005 m (H2O) = 50 г - 0,25 г = 49,75 г
 V (H2O) = 49,75 г × 1 г/мл = 49,75л
V (H2O) = 49,75 г × 1 г/мл = 49,75л
m (соли) = ? Ответ: m (соли) = 0,25 г, V (H2O) = 49,75 л

З адачи для самостоятельной работы
адачи для самостоятельной работы
Какую массу соли и объем воды необходимо взять для приготовления:
-
60 г 1 %-ного раствора
-
70 г 2 %-ного раствора
-
40 г 0,4 %-ного раствора
-
80 г 0,2 %-ного раствора
-
90г раствора с массовой долей соли 0,001
-
60 г раствора с массовой долей соли 0,002
-
50 г раствора с массовой долей соли 0,05
-
70 г раствора с массовой долей соли 0,01
-
120 г 10 %-ного раствора
-
90 г раствора с массовой долей соли 0,06
-
150 г 2 %-ного раствора
-
150 г раствора с массовой долей соли 0,004
-
200 г раствора с массовой долей соли 0,06
-
140 г раствора с массовой долей соли 0,03
-
Какие массы йода и спирта необходимы для приготовления 300 г раствора с массовой долей йода 5%?
I I ТИП. ЗАДАЧИ НА ОПРЕДЕЛЕНИЕ МАССЫ ВЕЩЕСТВ, НЕОБХОДИМОЙ ДЛЯ ПОЛУЧЕНИЯ РАСТВОРА НУЖНОЙ КОНЦЕНТРАЦИИ
I ТИП. ЗАДАЧИ НА ОПРЕДЕЛЕНИЕ МАССЫ ВЕЩЕСТВ, НЕОБХОДИМОЙ ДЛЯ ПОЛУЧЕНИЯ РАСТВОРА НУЖНОЙ КОНЦЕНТРАЦИИ
Типовая задача№1. Какой объем воды надо прилить к 0,5 г сахара, чтобы получить 1 %-ный раствор?
Д ано: Решение:
ано: Решение:
m (сахара) = 0,5 г 1) m (р-ра) В 100 г р-ра - 1 г сахара
(сахара) = 0,5 г 1) m (р-ра) В 100 г р-ра - 1 г сахара
(cах.) = 0,01 (1 %) х - 0,5 г сахара
2) m (H2O) = 50 - 0,5 = 45,5 г
V(Н2О) = ?
3) V(Н2О) = 45,5 г / 1 г/мл = 45,5 мл
Ответ: V(Н2О) = 45,5 мл
Типовая задача№2. Какую массу соли надо добавить к 200 мл воды, чтобы получить 3 %-ный раствор? Ответ:
Дано: Решение:
V (Н2О) = 200 мл 1) 3 %-ный раствор - это на 100 г р-ра - 3 г соли
(Н2О) = 200 мл 1) 3 %-ный раствор - это на 100 г р-ра - 3 г соли
(соли) = 0,03 (3 %) и 97 г воды

 2) m (200 мл Н2О) = 200 мл · 1 г/мл = 200 г
2) m (200 мл Н2О) = 200 мл · 1 г/мл = 200 г
m (соли) = ? 3) m (соли) = ?
3 г соли - на 97 г Н2О
х - 200 г Н2О
х = 3 ∙200/ 97 = 6,2 г.
Ответ: m (соли) = 6,2 г

Задачи для самостоятельной работы
-
Какой объем воды надо прилить к 8 г соли, чтобы получить 2 %-ный раствор?
-
Какую массу соли надо добавить к 120 мл воды, чтобы получить 1 %-ный раствор?
-
Какую массу нитрата натрия, которую необходимо растворить в 200 г воды для получения раствора с массовой долей 20%
-
Вычислите массу воды, в которой нужно растворить25 г сахара, чтобы получить раствор с массовой долей растворенного вещества 10 %.
-
Рассчитайте, какую массу воды необходимо взять для приготовления раствора с массовой долей вещества 20%, если нужно растворить 100г соли?
-
Определите массу хлорида калия, который нужно растворить в 100 г воды, чтобы получить раствор с массовой долей KCI 5%.
-
Имеется соль массой 200 г. Рассчитайте массу воды, которую надо взять, чтобы получить раствор с массовой долей соли 12,5%
I II ТИП. ЗАДАЧИ НА ОПРЕДЕЛЕНИЕ МАССОВОЙ ДОЛИ ВЕЩЕСТВ В РАСТВОРЕ
II ТИП. ЗАДАЧИ НА ОПРЕДЕЛЕНИЕ МАССОВОЙ ДОЛИ ВЕЩЕСТВ В РАСТВОРЕ
Типовая задача№1. Смешали 0,4 г соли и 200 мл воды. Какова массовая доля соли в полученном растворе?
Дано: Решение:
m (соли) = 0,4 г 1) m (H2O) = 200 мл ∙1 г/мл = 200 г
(соли) = 0,4 г 1) m (H2O) = 200 мл ∙1 г/мл = 200 г
 V(Н2О) = 200 мл m (р-ра) = 200 г ∙0,4 г = 200,4 г
V(Н2О) = 200 мл m (р-ра) = 200 г ∙0,4 г = 200,4 г
2) m (H2O) = 50 - 0,5 = 45,5
(соли) = ? (cоли) = 0,4 г/ 200,4 г = 0,002 (0,2 %-ный)
Ответ: (соли) = 0,002 (0,2 %-ный)
Типовая задача№2. Смешали гидроксид натрия NaOH в количестве 1 моль с
1 л воды. Какова массовая доля гидроксида натрия в полученном растворе?
Дано: Решение:
 (NaOH) = 1 моль 1) m(NaOH) = 1 моль ∙ 40 г/моль = 40 г
(NaOH) = 1 моль 1) m(NaOH) = 1 моль ∙ 40 г/моль = 40 г
V(Н2О) = 1 л 2) m (H2O) = 1000 мл ∙ 1 г/мл = 1000 г
3) m (р-ра) = 1000 г + 40 г = 1040г
(NaOH) = ? 4)(NaOH) = 40 г/1040 г = 0,038 (3,8 %)
Ответ: (NaOH) = 0,038 (3,8 %)
Типовая задача№3. Рассчитайте массовую долю вещества в растворе, полученном при смешивании 200 г воды и 30 г вещества.
Наглядно-логический метод:
Р1
+
Р2
=
Р3
mp = 30/1=30г
mp = 200 г
mp = 230 г
ɷ = 1
т.к. вещество сухое
ɷ = 0
т.к. это вода
ɷ = 30/230 = 0,1304
или 13,04%.
mв =30г
mв =0г (200 · 0=0)
mв = 30г (30+0 =0)
Решение алгебраическим методом:
ɷ= mв/ mp = (mв1 + mв2) / (mp1 + mр2) = (30· 1 +200·0) / (30 +200) = 30/230 = 0,1304 (13, 04%).
Ответ: (вещества)= 0,13.

Задачи для самостоятельной работы

-
Смешали 20 г сахара и 250 мл воды. Какова массовая доля сахара в полученном растворе?
-
Смешали 5 г сахара и 150 мл воды. Какова массовая доля сахара в полученном растворе?
-
Смешали 2 г соли и 140 мл воды. Какова массовая доля соли в полученном растворе?
-
Смешали 0,5 г соли и 300 мл воды. Какова массовая доля соли в полученном растворе?
-
Смешали гидроксид натрия NaOH в количестве 1 моль с 1 л воды. Какова массовая доля гидроксида натрия в полученном растворе?
-
Смешали нитрат натрия NaNO3 в количестве 0,1 моль с 0,5 л воды. Какова массовая доля нитрата натрия в полученном растворе?
-
В 105 г воды растворили 35 г соли. Вычислите массовую долю растворенного вещества.
-
Сахар массой 5 г растворили в воде массой 20 г. Какова массовая доля сахара в растворе?
-
В 200 г воды растворили 67,2 л газообразного хлороводорода HCI (н.у.). Определите массовую долю хлороводорода в полученном растворе.
-
Хлорид бария массой 6 г растворили в 250 мл воды (плотность воды 1 г/мл). Чему равна массовая доля соли в полученном растворе?
-
В 1000 г воды растворили 2 моль сульфата калия. Рассчитайте массовую долю растворенного вещества
-
В 200 г воды растворили 50 г хлорида натрия. Вычислите массовую долю NaCI в полученном растворе.
-
В 1 л раствора серной кислоты содержится 2,1 моль H2SO4. Рассчитайте массовую долю растворенного вещества, учитывая, что плотность раствора равна 1,13г/мл.
-
Массовая доля соляной кислоты, выраженная в процентах, в растворе, полученном при растворении 11,2 л (н.у.) хлороводорода в 1 л воды, равна (с точностью до десятых)___
I VТИП. ЗАДАЧИ НА ОПРЕДЕЛЕНИЕ ПРОЦЕНТНОГО СОДЕРЖАНИЯ ВЕЩЕСТВ В РАСТВОРЕ
VТИП. ЗАДАЧИ НА ОПРЕДЕЛЕНИЕ ПРОЦЕНТНОГО СОДЕРЖАНИЯ ВЕЩЕСТВ В РАСТВОРЕ
Типовая задача№1. К 150 г 20 %-ного раствора соляной кислоты прилили 200 мл воды. Каково процентное содержание соляной кислоты во вновь полученном растворе?
Дано: Решение:
m
 (p. HCl) = 150 г 1) m (HCl) = 150 г ∙ 0,2 = 30 г
(p. HCl) = 150 г 1) m (HCl) = 150 г ∙ 0,2 = 30 г
(HCl) = 0,2 (20 %) 2) m (p-ра) = 150 г + 200 г = 350 г
V(Н2О) = 200 мл m (H2O) = 200 мл ∙ 1 г/мл = 200 г
(HCl) = ? (HCl) =30 г /350 г = 0,086 (8,6 %)
Ответ: (HCl) = 0,086 (8,6 %).
Типовая задача№2. К 120 г 1 %-ного раствора сахара прибавили 4 г сахара. Каково процентное содержание сахара во вновь полученном растворе?
Д ано: Решение:
ано: Решение:
m (p. сахара) = 120 г 1)m(сахара) = 120 г ∙ 0,01 = 1,2 г
= 0,01 (1 %) 2) m(всего сахара) = 1,2 + 4 г = 5,2 г
m(сахара) = 4 г 3) m (р-ра) = 120 г + 4 г = 124 г
 (сахара) =? (cахара)= 5,2 г/124 г = 0,042 (4,2 %)
(сахара) =? (cахара)= 5,2 г/124 г = 0,042 (4,2 %)
Ответ: 0,042 (4,2 %).

Задачи для самостоятельной работы
-
К
 200 г 40 %-ного раствора серной кислоты прилили 80 мл воды. Каково процентное содержание серной кислоты во вновь полученном растворе?
200 г 40 %-ного раствора серной кислоты прилили 80 мл воды. Каково процентное содержание серной кислоты во вновь полученном растворе? -
К 90 г 6 %-ного раствора поваренной соли прилили 200 мл воды. Каково процентное содержание поваренной соли во вновь полученном растворе?
-
К 140 г 15 %-ного раствора сахара долили 160 мл воды. Каково процентное содержание сахара во вновь полученном растворе?
-
К 200 г 40 %-ного раствора уксусной кислоты долили 300 мл воды. Каково процентное содержание уксусной кислоты во вновь полученном растворе?
-
К 80 г 30 %-ного раствора щелочи долили 420 мл воды. Каково процентное содержание щелочи во вновь полученном растворе?
-
К раствору хлорида кальция массой 90 г с массовой долей 5% добавили 10 г этой же соли. Каково процентное содержание соли во вновь полученном растворе?
-
К раствору нитрата кальция массой 80 г с массовой долей 4% добавили 1,8 г этой же соли. Каково процентное содержание соли в полученном растворе равна (с точностью до десятых)___
-
К 300 г раствора нитрата калия с массовой долей 20% добавили 100 г той же соли. Какова массовая доля нитрата калия в полученном растворе?
-
Массовая доля азотной кислоты в растворе, полученном после добавления 20 г воды к 160 г её 5%-ного раствора, равна___
-
К раствору хлорида кальция массой 140 г с массовой долей 5% добавили 10 г этой же соли. Массовая доля соли в полученном растворе равна (с точностью до десятых___
-
К 150 г раствора с массовой долей K2SO4 10% добавили 100г воды. Вычислите массовую долю сульфата калия в полученном растворе.

V ТИП. ЗАДАЧИ С ИСПОЛЬЗОВАНИЕМ ПОНЯТИЯ - РАСТВОРИМОСТЬ
Типовая задача№1. Какую массу сульфата натрия можно получить при выпаривании 50г насыщенного раствора при t 35 0С, если его растворимость 50 (на 100 г воды)?
Д ано: Решение:
ано: Решение:
m (p. Na2SO4) = 50 г В 150 г р-ра - 50 г Na2SO4
(p. Na2SO4) = 50 г В 150 г р-ра - 50 г Na2SO4
Р(Na2SO4) = 50 г в 50 г - х
m (Na2SO4) = ? х =50 г∙50 г/150 г = 16,7 г
Ответ: 16,7 г Na2SO4
Типовая задача№1. Сколько грамм воды необходимо для растворения 30 г нитрата свинца, чтобы получился насыщенный раствор при t 60 0С (растворимость его 105)?
 Дано: Решение:
Дано: Решение:
m [Pb(NO3)2] = 30 г 105 г Pb(NO3)2 - 100 г H2O
[Pb(NO3)2] = 30 г 105 г Pb(NO3)2 - 100 г H2O
Р(60О С) = 105 г 30 г - х
х =30 г ∙ 100 г / 105 г = 28,57 г
m (H2O) = ?
Ответ: 28,57 г H2O
Типовая задача№3. В 300 г насыщенного при t 55 0С сульфата магния содержится 100 г сульфата магния. Определить его растворимость (коэффициент растворимости).
 Дано: Решение:
Дано: Решение:
 m (p. MgSO4) = 300 г 1) m (H2O) = 300 г - 100 г = 200 г
m (p. MgSO4) = 300 г 1) m (H2O) = 300 г - 100 г = 200 г
m (MgSO4) = 100 г 2) в 200 г H2O - 100 г MgSO4
Р(MgSO4)= ? в 100 г - х
х=50 г
Ответ: Р(MgSO4) = 50 г
Типовая задача№4. В 200 г раствора KСlO3 при t 30 0С содержится 20 г KСlO3. Будет ли его раствор насыщенным, если его растворимость при t 30О С - равна 10?
 Дано: Решение:
Дано: Решение:
m (p. KClO3) = 200 г 1) m (H2O) = 200 г - 20 г = 180 г
(p. KClO3) = 200 г 1) m (H2O) = 200 г - 20 г = 180 г
m (KClO3) = 20 г 2) В 100 г H2O - 10 г KClO3
m (KClO3) = 20 г в 180 г H2O - х
Будет ли раствор 3) х =180 х 10 г/100 г = 18 г
насыщенным? А в растворе 20 г KClO3, следовательно, раствор
насыщенный.
Типовая задача№5. В 100 г воды при t 60 0С растворяется 110 г нитрата калия, образуя насыщенный раствор. Какова массовая доля нитрата калия в таком растворе?
Д ано: Решение:
ано: Решение:
m (H2O) = 100 г 1) m (р-ра) = 100 г + 110 г = 210 г
(H2O) = 100 г 1) m (р-ра) = 100 г + 110 г = 210 г
m (KNO3) = 110 г 2) = 110/210 г = 0,524 (52,4 %)
(KNO3) = ? Ответ: 0,524 (52,4 %)
Типовая задача №6. Какая масса хлорида бария выкристаллизуется при выпаривании из 300 г насыщенного при t 90 0С раствора, если его растворимость 55?
Д ано: Решение:
ано: Решение:
m (p. BaCl2) = 300 г 1) В 155 г р-ра - 55 г BaCl2
(p. BaCl2) = 300 г 1) В 155 г р-ра - 55 г BaCl2
Р(BaCl2) = 55 г в 300 г - х
2) х =300 г ∙ 55 г/155 г= 106,45 г
m (BaCl2 выкр.) ? Ответ: 106,45 г.

Задачи для самостоятельной работы

-
Имеется 300 г насыщенного при t 15О С раствора нитрата калия. Сколько грамм нитрата калия здесь содержится, если его растворимость 25?
-
Растворимость некоторой соли при температуре 25 0С составляет 185г/л. Какую массу соли можно получить, если упарить 200 мл ее раствора, насыщенного при температуре 250?
-
В 100 г воды при 20 0С растворяется 74,5 г хлорида кальция, а при 800С - 147,0г. Каким будет при этих температурах 42,3%-ный раствор хлорида кальция (насыщенным, ненасыщенным, перенасыщенным)?
-
Воду объемом 100 мл насыщают нитратом калия KNO3 при 700С. Раствор охлаждают до 20 0С. Какая масса соли выпадет в осадок?
-
Растворимость бромида натрия при 20 0С равна 90,5 г. Какую массу этой соли следует растворить в воде массой 900 г при 200С для получения насыщенного раствора?
-
При выпаривании насыщенного при 200С водного раствора хлорида натрия массой 200 г получена соль, масса которой 52,64г. Какова растворимость в воде хлорида натрия при 200С?
-
В какой массе воды надо растворить KNO3 массой 120 г, чтобы получить раствор, насыщенный при 300С?
-
Растворимость хлорида натрия при 20 0С равна 36,0 г в 100г воды, а растворимость фторида натрия при этой же температуре - 4,3 в 100г воды. Определите массовые доли солей в насыщенном водном растворе при этой температуре (в %). Можно ли считать обе соли хорошо растворимыми? Концентрированными или разбавленными являются их насыщенные растворы?

 VI ТИП. ЗАДАЧИ НА ОПРЕДЕЛЕНИЕ МАССЫ ИЛИ ОБЪЕМА ВЕЩЕСТВА ПРИ ДОБАВЛЕНИИ ЕГО В РАСТВОР ДЛЯ ИЗМЕНЕНИЯ КОНЦЕНТРАЦИИ.
VI ТИП. ЗАДАЧИ НА ОПРЕДЕЛЕНИЕ МАССЫ ИЛИ ОБЪЕМА ВЕЩЕСТВА ПРИ ДОБАВЛЕНИИ ЕГО В РАСТВОР ДЛЯ ИЗМЕНЕНИЯ КОНЦЕНТРАЦИИ.
Типовая задача №1. Сколько миллилитров воды надо прилить к 80 г 5 %-ного раствора соли, чтобы получить 2 %-ный раствор?
Д ано: Решение:
ано: Решение:
m (p. соли) = 80 г 1) m (соли) = 80 г ∙0,005 = 4 г
(p. соли) = 80 г 1) m (соли) = 80 г ∙0,005 = 4 г
(с) = 0,05 (5 %) 2) m(Н2О) = 80 г - 4 г = 76 г
пол.(с) = 0,02 (2 %) 3) На 98 г Н2О - 2 г соли
V(Н2О) = ? х г Н2О - 4 г соли
х = 196 г Н2О
4)Долить надо 196 г - 76 г = 120 г
V(Н2О) = 120 г /1 г/мл = 120 мл
Ответ: 120 мл.
Типовая задача №2. Сколько грамм соли надо добавить к 150 г 0,5 %-ного раствора этой соли, чтобы получить 6 %-ный раствор? Ответ: 8,78 г.;
Д ано: Решение:
ано: Решение:
m (p-ра соли) = 150 г 1) m (соли) = 150 г ∙0,005 = 0,75 г
(p-ра соли) = 150 г 1) m (соли) = 150 г ∙0,005 = 0,75 г
(с) = 0,005 (5 %) 2) m(Н2О) = 150 г - 0,75 г = 149,25 г
(с) = 0,06 (6 %) 3) на 94 г Н2О - 6 г соли
m(соли) = ? на 149,25 г - х г соли х = 9,53 г
4)m(соли добав.) = 9,53 г - 0,75 г = 8,78 г
Ответ: 8,78 г.
Типовая задача №2Сколько надо добавить воды к 450 г 23%-го раствора сахара, чтобы получить 18%-й раствор?
Наглядно-логический метод:
В этой задачи следует рассуждать так: поскольку масса взятого вещества (сахара в растворе) не изменится после приливания воды, мы можем найти массу полученного раствора:
mp2 = mв1/ ɷ = 450 · 0,23/0,18= 103,5/0,18 = 575 г
Р1
+
Р2
=
Р3
mp1 = 450 г
mp2 = Х г
mp3 = 450+Х г
ɷ =0.23(23%)
ɷ = 0
ɷ = 0,18 (18%)
mв1 = 450· 0,23 = 103,5г
mв2 = 0г
mв3 = 103,5г
m Н2О - разница масс полученного и исходного растворов (на схеме это Хг).
m Н2О = 575 - 450 = 125 г.
Ответ: надо добавить 125 г воды.
З адачи для самостоятельной работы
адачи для самостоятельной работы
-
Сколько миллилитров воды надо прилить к 200 г 6 %-ного раствора сахара, чтобы получить 1,5 %-ный раствор сахара?
-
Сколько воды надо прилить к 80 г 10 %-ного раствора гидроксида натрия, чтобы получить 3 %-ный раствор?
-
Сколько грамм сахара надо добавить к 300 г 2 %-ного раствора, чтобы получить 5 %-ный раствор?
-
Сколько миллилитров воды надо добавить к 70 г 20 %-ного раствора серной кислоты, чтобы получить 3 %-ный раствор?
-
Как сделать, чтобы 50 г 10 %-ного раствора поваренной соли превратить в 1 %-ный?
-
Масса воды, которую надо испарить из 800 г 15%-го раствора вещества, чтобы увеличить его массовую долю на 5% равна____
-
Масса воды, которую надо добавить к 20 г раствора уксусной кислоты с массовой долей 70% для получения раствора уксуса с массовой долей 3%, равна (с точностью до целых)___
-
К 1150 г 10%-ного раствора сульфата натрия добавили 115 г воды. Масса воды в полученном растворе равна___
-
Масса спирта, которую необходимо добавить к 120 г 20%-го раствора, чтобы получить раствор с массовой долей 25%, равна ______г. (Запишите ответ с точностью до целых.)
-
Масса воды, которую необходимо добавить к 120 г 40%-го раствора формальдегида, чтобы получить раствор с массовой долей 25%, равна 72
-
Из 600 г 10%-го раствора соли необходимо приготовить 12%-й раствор. Для этого потребуется выпарить ______________г воды. (Ответ укажите с точностью до целых.)
-
Из 200 г 10%-го раствора соли необходимо приготовить 8%-й раствор. Для этого потребуется добавить ______________г воды. (Ответ укажите с точностью до целых.)
-
Сколько граммов воды надо добавить к 200 г 25%-го раствора вещества, чтобы получить 20%-й раствор?
V II ТИП. ЗАДАЧИ НА ОПРЕДЕЛЕНИЕ ПРОЦЕНТНОГО СОДЕРЖАНИЯ ИЛИ МАССОВОЙ ДОЛИ ВЕЩЕСТВ В РАСТВОРЕ, ПОЛУЧЕННОМ ПРИ СМЕШИВАНИИ РАСТВОРОВ РАЗНОЙ КОНЦЕНТРАЦИИ
II ТИП. ЗАДАЧИ НА ОПРЕДЕЛЕНИЕ ПРОЦЕНТНОГО СОДЕРЖАНИЯ ИЛИ МАССОВОЙ ДОЛИ ВЕЩЕСТВ В РАСТВОРЕ, ПОЛУЧЕННОМ ПРИ СМЕШИВАНИИ РАСТВОРОВ РАЗНОЙ КОНЦЕНТРАЦИИ
Типовая задача№1. Смешали 140 г 0,5 %-ного раствора соляной кислоты с 200 г 3 %-ного раствора соляной кислоты. Каково процентное содержание соляной кислоты во вновь полученном растворе?
Д ано: Решение:
ано: Решение:
m (p) = 140 г 1) m (HCl) в 1ом р-ре
(p) = 140 г 1) m (HCl) в 1ом р-ре
(HCl) = 0,005 (0,5 %) m (HCl) = 140 г ∙ 0,005 = 0,7 г
m (p. HCl) = 200 г 2) m (HCl) во 2ом р-ре
щ(HCl) = 0,03 (3 %) m (HCl) = 200 г ∙ 0,03 = 6 г
(HCl) = ? 3) Общая m (HCl) = 6 г + 0,7 г = 6,7 г
4) m (p-ра полученного) = 140 г + 200 г = 340 г
5) Новая ?(HCl)
(HCl) =6,7 г/340 г = 0,0197 (1,97 %)
Ответ: (HCl) = 0,0197 (1,97 %)
Типовая задача №2. Какой будет массовая доля вещества в растворе, полученном при сливании 30 г 24%-го и 75 г 12%-го растворов серной кислоты?
Наглядно-логический метод:
Р1
+
Р2
=
Р3
mp1 = 30 г
mp2 = 75 г
mp3 = 30+75=105 г
ɷ =0.24(24%)
ɷ = 0,12 (12%)
ɷ = 16, 2/105 = 0, 154
mв1 = 30· 0, 24= 7,2г
mв2 = 75· 0, 12=9 г
mв3 = 7,2+9 = 16,2 г
Ответ: массовая доля вещества в растворе составляет 15, 4%.


Задачи для самостоятельной работы
-
Смешали 50 г 5 %-ного раствора серной кислоты с 80 г 20 %-ного раствора серной кислоты. Каково процентное содержание серной кислоты во вновь полученном растворе?
-
Смешали 70 г 10 %-ного раствора азотной кислоты с 80 г 25 %-ного раствора азотной кислоты. Каково процентное содержание азотной кислоты во вновь полученном растворе?
-
Смешали 60 г 2 %-ного раствора поваренной соли с 80 г 4 %-ного раствора поваренной соли. Каково процентное содержание поваренной соли во вновь полученном растворе?
-
Смешали 20 г 0,5 %-ного раствора сахара с 20 г 1 %-ного раствора сахара. Какова массовая доля сахара во вновь полученном растворе?
-
Какова массовая доля нитрата калия в растворе, полученном после смешивания 90 г 2 %-ного раствора и 110 г 5 %-ного раствора нитрата калия.
-
Вычислите массовую долю хлорида алюминия в растворе, полученном при смешивании 25г 10%-ного и 750г 25%-ного растворов

 VIII ТИП. ЗАДАЧИ НА МОЛЯРНУЮ КОНЦЕНТРАЦИЮ
VIII ТИП. ЗАДАЧИ НА МОЛЯРНУЮ КОНЦЕНТРАЦИЮ
Типовая задача №1. Определить молярную концентрацию раствора серной кислоты, полученного при смешивании 25 мл 10-молярного раствора серной кислоты и 225 мл воды.
Д ано: Решение:
ано: Решение:
V (p. H2SO4) = 25 мл n (H2SO4) - ? В 1000 мл - 10 моль
(p. H2SO4) = 25 мл n (H2SO4) - ? В 1000 мл - 10 моль
C(H2SO4) = 10 моль/л в 25 мл - х моль
V(H2O) = 225мл х = 0,25 моль
C(H2SO4) = ? 2) V(р-ра) = 225 мл + 25 мл = 250 мл
3) C(H2SO4) - ? В 250 мл - 0,25 моль
в 1000 мл - х моль
х = 1 моль/л
Ответ: С = 1 моль/л.
Типовая задача №2. Определить молярную концентрацию 73,8 %-ного раствора серной кислоты, плотность которого 1,655 г/мл.
 Дано: Решение:
Дано: Решение:
 (H2SO4) = 0,738 (73,8%) 1)V(р) = 100 г /1,655 г/мл = 60,42 мл
(H2SO4) = 0,738 (73,8%) 1)V(р) = 100 г /1,655 г/мл = 60,42 мл
(p) = 1,655 г/мл 2)В 60,42 мл р. - 73,8 г H2SO4
С=? в 1000 мл - х
х = 1221,45 г
3)n = 1221,45 г /98 г/мл = 12,46 моль
С = 12,45 моль/л
Ответ: С = 12,45 моль/л
Типовая задача №3. Какой объем 36,5 %-ного раствора соляной кислоты (пл. 1,18 г/мл) необходимо взять для приготовления 1000 мл 0,1 молярного раствора?
Д ано: Решение:
ано: Решение:
 (HCl) = 0,365 ( 36,5 %) 1) В 1000 мл р-ра - 0,1 моль HCl (3,65 г)
(HCl) = 0,365 ( 36,5 %) 1) В 1000 мл р-ра - 0,1 моль HCl (3,65 г)
(p-ра) = 1,18 г/мл 2) В 100 г р-ра - 36,5 г HCl
V(р) = 1000 мл х - 3,65 г
С(HCl) = 0,1 моль/л х = 10 г (р-ра)
V(36,5 % р-ра) = ? 3)V(р-ра) = 10 г /1,18 г/мл = 8,4745 мл
Ответ: V = 8,4745 мл
Типовая задача №4. Определить массовую долю азотной кислоты в 4,97 молярном ее растворе, плотность которого 1,16 г/мл. Ответ: 27 %.;
 Дано: Решение:
Дано: Решение:
С (HNO3) = 4,97 моль/л 1) m (р) = 1000 мл х 1,16 г/мл = 1160 г
(HNO3) = 4,97 моль/л 1) m (р) = 1000 мл х 1,16 г/мл = 1160 г
(p) = 1,16 г/мл 2) m (HNO3) = 4,97 моль х 63 г/моль = 313,11 г
(HNO3) = ?= 313,11 г/1160 г = 0,27 (27 %)
Ответ: = 0,27 (27 %).
З
 адачи для самостоятельной работы
адачи для самостоятельной работы
-
Определить молярную концентрацию 56,68 %-ного раствора азотной кислоты, плотность которого равна 1,356 г/мл.
-
Определить молярную концентрацию 18 %-ного раствора соляной кислоты, плотность которого равна 1,089 г/мл.
-
Вычислите молярную концентрацию 10 %-ного раствора серной кислоты (пл. 1,07 г/мл).
-
Вычислите молярную концентрацию 16 %-ного раствора сульфата меди II, плотностью 1,18 г/мл.

IX ТИП. УСЛОЖНЕННЫЕ ЗАДАЧИ.
Типовая задача №1. Из раствора хлорида алюминия массой 110 г и массовой долей соли 10% выпарили 10 г воды и добавили 5 г той же соли. Массовая доля соли в полученном растворе равна _____%.
Решение:
ω=m (вещества)/m (раствора)
Найдем массу хлорида алюминия из первого раствора
m (вещества)= m (раствора)∙ω
m (вещества)= 110г ∙0,1 = 11 г
m (воды) = m (раствора)- m (вещества)= 110-11 = 99 г
По условию выпарили 10 г воды.
Далее в раствор добавляют 5 г соли
Таким образом, в итоговом растворе будет содержаться:
воды 99-10 = 89 г
хлорида алюминия = 11 + 5 = 16 г
суммарная масса = 89 + 16 = 105 г
Подставим значения в формулу ω= 16∙100%/105 =15,2 %
Типовая задача №2. При смешивании 50%-ного и 10%-ного растворов одного и того же вещества получили 15%-ный раствор. Во сколько раз взяли больше по массе 10%-ного раствора, чем 50%-ного? Ответ запишите в виде целого числа.
Решение:
Пусть масса 10%-ного раствора в n раз больше, тогда
m - масса 50%-ного раствора, а n∙m - масса 10%-ного раствора, тогда
0,5m + 0,1∙(n∙m) = 0,15∙(m + n∙m)
0,5 + 0,1n = 0,15 + 0,15n
0,05n = 0,35
n=7 Ответ: 7
Типовая задача №3. Сколько граммов 10%-го раствора соли надо добавить к 300 г 30%-го раствора этой же соли, чтобы получить 14%-ный раствор? Ответ запишите в виде целого числа.
Решение:
Пусть m - масса добавляемого 10%-го раствора в граммах, тогда
m∙0,1+300∙0,3 = (m+300)∙0,14
0,1m+90=0,14m+42
0,04m=48
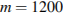 (г)
(г)
Ответ: 1200г
Типовая задача №4. Определите массы 10%-ного и 50%-ного (по массе) растворов, необходимые для получения 200 г 20%-ного раствора.
Решение:
ω1 = 10%, ω2 = 50%, ω3= 20%, m3 = 200 г, m2 = 200 - m1
Составляем уравнение:
m1∙ 10 + (200 - m1) ∙50 = 200 ∙20
40∙m1 = 6000
m1 = 150 (г),
m2 = 200 - m1 = 200 - 150 = 50 (г)
Ответ: 150 г, 50 г.
Типовая задача №5. Определите массы 25%-ного (по массе) раствора и воды, необходимые для получения 200 г 10%-ного раствора.
Решение:
ω1 = 25%, ω2 = 0%, ω3= 10%, m3 = 200 г
Составляем уравнение:
m1∙ 25 + m2 ∙ 0 = 200∙10
25 ∙m1 = 2000
m1 = 80 (г),
m2 = 200 - m1 = 200 - 80 =120 (г)
Ответ: 80 г, 120 г.
Типовая задача №6. Какую массу оксида серы (VI) следует добавить к 500 г 20%-ного раствора серной кислоты, чтобы увеличить её массовую долю до 40%?
Решение:
1) Составить уравнение химической реакции
SO3+H2O=H2SO4
2) Рассчитать массу серной кислоты, находившейся в исходном растворе и получившейся из х моль оксида серы (VI):
m1 (H2SO4)= m1(р-ра) ∙ ω1 (H2SO4)= 500 • 0,2 = 100 г
m (SO3)=n(SO3)∙M(SO3) = 80x (где х - число молей оксида серы)
m2 (H2SO4)= n(H2SO4) ∙M(H2SO4) = 98x
3) Рассчитать массу раствора и суммарную массу серной кислоты в нём:
m2(р-ра) = m2(р-ра) +m (SO3)= 500 + 80Х
m3 (H2SO4)= m1(H2SO4) + m2 (H2SO4) = 100 + 98x
4) Найти массу SO3, необходимую для растворения:
ω2 (H2SO4) = m3 (H2SO4)/ m2(р-ра)
0,4 = 100+98х/500+80х
откуда х = 1,52 моль, m(SO3) =1,52 · 80 = 121,6 г.
Ответ: 121,6г

Задачи для самостоятельной работы

-
Сколько граммов надо взять 10 %-ного раствора и 35 %-ного раствора соляной кислоты, чтобы получить 300 г 20 %-ного раствора соляной кислоты?
-
Сколько граммов 20 %-ного и 50 %-ного раствора сахара надо взять, чтобы получить 150 г 30 %-ного раствора сахара?
-
Определить массовую долю бромоводорода в растворе, полученном при растворении 280 л (н. у.) бромоводорода в 1 л воды.
-
Определить массу воды, в которой нужно растворить 44,8 л хлороводорода (н. у.), чтобы получить 14,6 %-ный раствор соляной кислоты.
-
При упаривании 76,336 л 28 %-ного раствора гидроксида натрия (пл. 1,31г/мл) получено 70 кг раствора. Какова массовая доля гидроксида натрия в оставшемся растворе?
-
Какой объем 15 %-ного раствора гидроксида натрия плотностью 1,16 г/мл можно приготовить из 2 л его 33 %-ного раствора плотностью 1,36 г/мл?
-
Сколько граммов 20%-го раствора кислоты надо добавить к 200 г 5%-го раствора этой же кислоты, чтобы получить 8%-ый раствор? Ответ запишите в виде целого числа.
-
При смешивании 40%-ного и 15%-ного растворов одного и того же вещества получили 20%-ный раствор. Во сколько раз взяли больше по массе 15%-ного раствора, чем 40%-ного? Ответ запишите в виде целого числа.
-
Какую массу оксида хрома (VI) следует добавить к 275 г 10%-го раствора хромовой кислоты, чтобы увеличить ее массовую долю в полтора раза?
-
При нагревании гидрокарбонат калия превращается в карбонат. Рассчитайте массовую долю гидрокарбоната калия в исходном растворе, нагреванием которого можно получить 8%-ный раствор карбоната калия.
 Ответы на задачи для самостоятельной работы
Ответы на задачи для самостоятельной работы

-
Тип. Задачи на определение массы веществ в растворе
-
m (соли) 0,6 г, V (H2O) 59,4 мл
-
m (соли) 1,4 г, V (H2O) 68,6 мл
-
m (соли) 0,16 г, V (H2O) 39,84 мл
-
m (соли) 0,16 г, V (H2O) 79,84 мл
-
m (соли) 0,09 г, V (H2O) 89,91мл
-
m (соли) 0,12 г, V (H2O) 59,88мл
-
m (соли) 0,25 г, V (H2O) 49,75мл
-
m (соли) 0,7 г, V (H2O) 69,3мл
-
m (соли) 12 г, V (H2O) 108мл
-
m (соли) 5,4 г, V (H2O) 84,6мл
-
m (соли) 3 г, V (H2O) 147мл)
-
m (соли) 0,6 г, V (H2O) 149,4мл
-
m (соли) 12 г, V (H2O) 188мл
-
m (соли) 4,2 г, V (H2O) 135,8мл
-
m (йода) 15г, m (спирта) 285г
II тип. Задачи на определение массы веществ, необходимой для получения раствора нужной концентрации
-
392 мл
-
1,21 г
-
50г
-
225г
-
400г
-
5,26г
-
1400г
III тип. Задачи на определение массовой доли веществ в растворе
-
0,074(7,4%)
-
0,032 (3,2)
-
0,014 (1,4%)
-
0,00166 (0,16%)
-
0,038 (3,8%)
-
0,0167 (1,67%)
-
0,25 (25%)
-
0,2 (20%)
-
0,35 (35%)
-
0,0234 (2,34%)
-
0,2582 (25,82%)
-
0,2 (20%)
-
0,182 (18,2%)
-
1,8%
IV тип. Задачи на определение процентного содержания веществ в растворе
-
0,286 (28,6 %)
-
0,0186 (1,86 %).
-
0,07(7 %)
-
0,16 (16 %)
-
0,048 (4,8 %)
-
0,145(14,5%)
-
061 (6,1%)
-
0,4 (40%)
-
0,044 (4,4%)
-
0,112 (11,2%)
-
0,06 (6%)
V тип. Задачи с использованием понятия растворимости
-
60 г
-
37 г
-
Раствор будет ненасыщенным.
-
80г
-
814,5 г
-
35,7г/100гH2O
-
300г
-
ω (NaCI) = 26,5% ω(NaF)=4,1%
VI тип. Задачи на определение массы или объема вещества при добавлении его в раствор для изменения концентрации
-
600 мл
-
186,7 мл
-
9,47 г
-
396,7 мл
-
долить 450 мл H2O
-
200г
-
447г
-
1150г
-
8г
-
72г
-
100г
-
50г
-
50г
VII тип. Задачи на определение процентного содержания или массовой доли веществ в растворе, полученном при смешивании растворов разной концентрации
-
0,142 (14,2 %)
-
0,18 (18%)
-
0,00314 (3,14 %)
-
0,0075 (0,75 %)
-
0,0365 (3,65 %)
-
0,245 (24,5%)
VIII тип. Задачи на молярную концентрацию
-
12,2 моль/л
-
5,37 моль/л
-
1,09 моль/л
-
1,18 моль/л
IX тип. Усложненные задачи.
-
120 г (35 %) и 180 г (10 %)
-
100 г (20 %) и 50 г (50 %)
-
50,31 %
-
427 г
-
40 %
-
5,16 л
-
50г
-
4
-
13,35г
-
11,3г

Используемая литература
-
Егоров А.С. репетитор по химии. Ростов- на-Дону. «Феникс», 2014г.
-
Н.И. Берман. Решение типовых задач. Москва. «Слово», 1997г.
-
КаверинаА.А.ЕГЭ-2013. Химия: типовые экзаменационные варианты. Москва. «Национальное образование», 2013 г
-
Радецкий А.М.,Горшкова В.П. Дидактический материал по химии. Москва. «Просвещение», 2005г.
-
Савинкова Е.В., Логинова Г.П.Химия.Сборник задач. 8-9 классы. Москва. «Аст-пресс», 2001г.
-
Хомченко Г.П. Пособие по химии для поступающих в вузы. Москва. «Оникс», 2003 г.
-
Хомченко Г.П., Хомченко И.Г. Задачи по химии для поступающих в вузы. Москва. «Оникс», 2004 г.
-
Хомченко И.Г. Сборник задач и упражнений по химии. Для средней школы. Москва. «Оникс»,2005 г.
.