- Преподавателю
- Химия
- Сабак жоспарыСа және оның қосылыстары
Сабак жоспарыСа және оның қосылыстары
| Раздел | Химия |
| Класс | - |
| Тип | Рабочие программы |
| Автор | Куанганова Ш.И. |
| Дата | 10.11.2015 |
| Формат | doc |
| Изображения | Есть |
Күні: 11.08.15 Аудандық тамыз конференциясы (химия секциясы)
Сабақтың тақырыбы: Кальций және оның қосылыстары.
Сабақтың мақсаты:
Білімділік: Кальций жөнінде білімдерін кеңейту. Оқушылардың білімдерін жүйелендіру, пәнге деген біртұтас көзқарас қалыптастыру. Оқушының өздік жұмыс орындауы. Ізденгіштік қабілетін ескере отырып, оқушыға тапсырма беру. Кальций элементін жан - жақты зерттеу арқылы оның қосылыстары, қолданылуы, маңызы жөнінде білімдерін кеңейту.
Дамытушылық: Оқушылардың ойлау, қорытындылау, жүйелеу қабілеттерін дамыту.
Тәрбиелік: Оқушылардың шығармашылық мүмкіндігін дамыту, қабілетін арттыру, қосымша материалдар
арқылы экологиялық тәрбие беру.
Күтілетін нәтиже: Кальций және оның қосылыстары туралы толық мағлұмат ала отырып, олардың
алыну әдістері мен қасиеттерін химиялық реакция теңдеулері арқылы жазып, дәлелдей алады.
Сабақтың көрнекілігі: Периодтық кесте,слайдтар,сызбанұсқа.
Сабақтың түрі: аралас
Сабақтың типі: «Ажурная пила» тәсілі бойынша оқыту
Сабақтың әдісі:сұрақ-жауап, ізденіс, өздік жұмыс, топпен жұмыс .
Сабақ жоспары:
І. Ұйымдастыру.
ІІ. Үй тапсырмасын пысықтау сұрақтары
ІІІ. Сабақтың мақсатымен таныстыру.
ІҮ. Топқа бөлу.
Ү.Сабақты бекіту сұрақтары
ҮІ.Қорытындылау.
Сабақтың барысы:
Ұйымдастыру кезеңінде сыныпты 5 топқа бөлу. Әр топта 5 адамнан болады.
Бағалау парағын таратып беру.
№
Сұрақтар
А
Ә
Б
1
1.металдар периодтық жүйеде қалай орналасқан?
Сол жағы төменгі бөлігінде
Оң жағы жоғары бөлігінде
Оң жағы төменгі бөлігінде
2.
Металдар арасындағы химиялық байланыс пен кристалл торы
Металдық байланыс металдық кр.торы
Металдық байланыс иондық кр.торы
Иондық байланыс металдық кр.торы
3
Металдар қандай қасиет көрсетеді
Тотықтырғыш
Тотықсыздандырғыш
Екеуінде
4
Қосымша топшада тек ... орналасқан
Металдар
Бейметалдар
Металдар, бейметалдар
5
Металдардың сыртқы энергетикалық деңгейінде .... -ке дейін электрон ғана болады
4 - 8
1-8
1-3
6
Электрохимиялық кернеу қатарында тотықсыздандырғыш тық қасиеті
Кемиді
Артады
Артады, сосын кемиді
7
Металдардың активтік қатарын жасаған ғалым
Бекетов Н.Н.
Ломоносов М.В.
Менделеев Д.И.
8
Металдардың активтің қатары қай жылы ашылды
1785
1682
1865 ж
9
Сумен әрекеттеспейтін металдар
Алтын, күміс, сынап
Калий, нарий, литий
Алюминий, мырыш,темір
10
Табиғатта қосылыс түрінде де, бос күйінде де кездеседі
Калий, нарий, литий
Алтын, күміс, сынап
Алюминий, мырыш,темір
11
Қыздырғанда тотығады
Алтын, күміс, сынап
Калий, нарий, литий
Алюминий, мырыш,темір
12
Сумен қыздырғанда әрекеттеседі
Калий, нарий, литий
Алтын, күміс, сынап
Алюминий, мырыш,темір
-Периодтық жүйеде ІІ топтың негізгі топшасында, ІҮ периодта орналасқан қай элемент?
- Иә , бұл кальций. .Ендеше бүгінгі сабағымызда «Кальций және оның қосылыстары» туралы әңгімелейтін боламыз.
«Кальций және оның қосылыстары» тақырыбы бойынша әр топқа тақырыптар бөліп беру.
І топ. «Кальцийдің жалпы сипаттамасы және табиғатта таралуы » .
Химиялық элементтердің периодтық жүйесінде ІҮ периодта, ІІ топтың негізгі топшасында орналасқан элемент. Таңбасы - Са. Реттік нөмірі - 20. Салыстырмалы атомдық массасы - 40. Валенттілігі тұрақты - ІІ. Тотығу дәрежесі - +2, 0.
Ондағы электрондардың орналасуы +20 Са 2е- 8е- 8е- 2е-.
Кальций атомының электрондық формуласы 1s2 2s22p63s23p64s2. Кальций атомының сыртқы энергетикалық деңгейінде 2 электроны бар. Кальций атомының радиусы біршама үлкен болады, себебі оның электрондары ядродадан қашықтау орналасады.
Табиғатта таралуы бойынша
 Бос күйінде Қосылыс түрінде
Бос күйінде Қосылыс түрінде

Оксид және тұздар,қышқылдар түрінде
Карбонаттар,фосфориттер,
апатиттер түрінде
ІІ топ. «Кальцийдің алынуы және фзикалық қасиеттері»
А
 лынуы
лынуы
 Зертханада Өнеркәсіпте
Зертханада Өнеркәсіпте
(тұздарынан электролиздеу арқылы)
 СаСІ2электр тогы Cа + СІ2
СаСІ2электр тогы Cа + СІ2
Физикалық қасиеті
Күміс түстес, ақ, жеңіл металл. Тығыздығы 1,54 г/см. Ауамен тез әрекеттесіп, тотығу өнімдерінен тұратын кеуектеу жұқа ақ қабықшамен қапталады. Сондықтан оны сілтілік металдар сияқты керосин қабатының астында сақтайды. Кальций - қатты металл, балқу температурасы 851С.
ІІІ топ. «Кальцийдің химиялық қасиеттері»
Кальций атомдары металдық байланыс түзеді. Кристалл торы - металдық. Кәдімгі жағдайда химиялық белсенді элемент болып келеді. Күшті тотықсыздандырғыш.
С а0 - 2е- Са+2
а0 - 2е- Са+2
-
Б
 ейметалдармен әрекеттеседі: Са0 + S0 Са+2 S-2
ейметалдармен әрекеттеседі: Са0 + S0 Са+2 S-2 -
А
 уада қыздырғанда тұтанады, ал таза оттекте ашық жалынмен жанады: 2Са0 + О2 2 Са+2 О-2
уада қыздырғанда тұтанады, ал таза оттекте ашық жалынмен жанады: 2Са0 + О2 2 Са+2 О-2 -
Б
 елсенді металл ретінде күрделі заттармен де реакцияға түседі. Сумен қуатты әрекеттесіп, одан сутекті ығыстырып шығарады: Са0 + Н+2О Са+2(ОН)2 + Н20
елсенді металл ретінде күрделі заттармен де реакцияға түседі. Сумен қуатты әрекеттесіп, одан сутекті ығыстырып шығарады: Са0 + Н+2О Са+2(ОН)2 + Н20
ІҮ топ. «Кальций оксиді , ф/х қасиеттері»
Кальций оксиді -ақ түсті, қиын балқитын зат. Техникада оны «сөндірілмеген әк» депте атайды. Оны әктасты жоғары температурада қатты қыздыру арқылы алады:
С аСО3 СаО + СО2
аСО3 СаО + СО2
Кальций оксиді - негіздік оксид. Ол сілтілік жер металл болғандықтан, оның оксиді сумен оңай әрекеттесіп, кальций гироксидін түзеді.
 СаО + Н2О Са(ОН)2
СаО + Н2О Са(ОН)2
Бұл реакция өте тез және қуатты жүреді. Нәтижесінде сөндірілген әк деп аталатын көпсіген кеуек - ақ ұнтақ алынады.
Ү топ. «Кальций гидроксиді, химиялық қасиеттері және қолданылуы»
Кальций гидроксиді суда аз ериді. Оның қанық ерітіндісі зертханада әк суы деп аталады. Ол ерітіндіде толық иондарға диссоциацияланады:
С а(ОН)2 Са+2 + 2ОН-
а(ОН)2 Са+2 + 2ОН-
Индикатор түсін өзгертеді. Фенолфталейннің түсін таңқурай түске бояйды. Кальций гидроксиді қышқылдармен және қышқылдық оксидтермен әрекеттеседі.бұл реакция зертханада көмірқышқыл газын анықтау үшін қолданылады.
Жаңа сабақты бекіту.
1 - тапсырма.

2 - тапсырма.

3 - тапсырма.
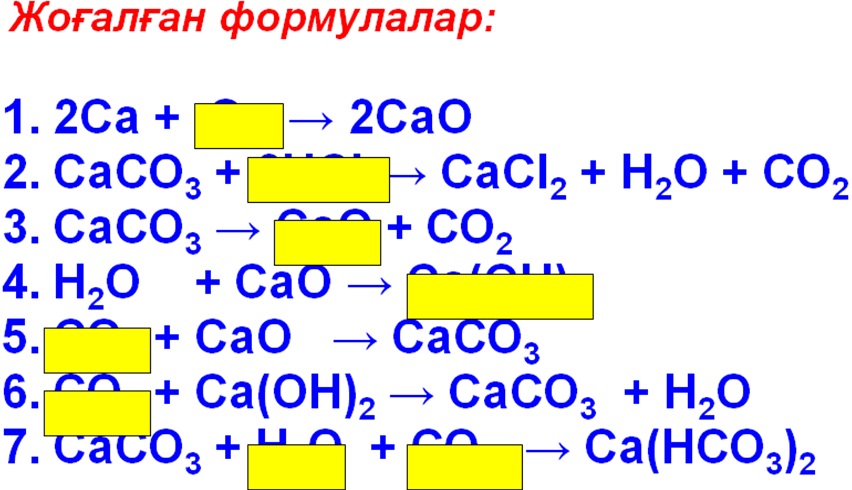
4 - тапсырма.

Қорытындылау.
Бағалау.



