- Преподавателю
- Химия
- Методическое пособие по органической химии
Методическое пособие по органической химии
| Раздел | Химия |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Коряковская М.В. |
| Дата | 16.10.2015 |
| Формат | doc |
| Изображения | Есть |
ГОСУДАРСТВЕННОЕ АВТОНОМНОЕ ПРОФЕССИОНАЛЬНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ САМАРСКОЙ ОБЛАСТИ
«Новокуйбышевский нефтехимический техникум»
УТВЕРЖДАЮ
Заместитель директора по УР
_________________В. Б. Семисаженова
«________»________________ 2015 г.
ОРГАНИЧЕСКАЯ ХИМИЯ
Методическое пособие по изучению дисциплины и задания для контрольных работ
Новокуйбышевск
2015 г.
Методическое пособие имеет практическую значимость для преподавателей, мастеров п/о и обучающихся по специальностям 18.02.09 Переработка нефти и газа и 18.02.06 Химическая технология органических веществ.
Предназначено для самостоятельной работы студентов ГАПОУ СО «ННХТ».
СОГЛАСОВАНО
Предметно - цикловой комиссией
Председатель ___________ М. В. Коряковская
Протокол № ____ от «_____» __________ 2015 г.
Составитель: Коряковская М. В. - преподаватель спец. дисциплин ГАПОУ СО «ННХТ» г. Новокуйбышевска
Эксперты:
Внутренняя экспертиза:
Техническая экспертиза: Ю. Н. Федотенкова - преподаватель спец. дисциплин ГАПОУ СО «ННХТ»
Содержательная экспертиза: О. Д. Щелкова - зам. директора по НМР ГАПОУ СО «ННХТ»
ОБЩИЕ МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Курс органической химии включает в себя материал, необходимый для подготовки техников - технологов нефтехимического производства.
Предмет органической химии формирует у учащихся диалектико-материалистическое понимание явлений окружающего мира.
В результате усвоения материала общетеоретической части учащийся должен приобрести тот минимальный запас знаний, который необходим для восприятия важных сведений специальной части курса на современном научном уровне. В специальной части курса на основе очень кратких сведений и отдельных элементов изложены необходимые данные о веществах и процессах, важных для нефтехимического производства, причем основное внимание обращается на химическую сторону явлений.
Контрольная работа. Каждый учащийся должен выполнить две контрольных работы. Контрольную работу нужно писать аккуратно, разборчиво, только чернилами. Уравнения химических реакций выносятся на отдельную строку. Ход решения задач и все расчеты должны быть доведены до конца и изложены ясно, так, чтобы преподаватель мог все проверить без затруднений. Неряшливо или не полностью выполненные контрольные работы могут быть возвращены.
Вопросы и задачи контрольной работы следует переписывать полностью и указывать номера задач в соответствии с контрольным заданием. В конце работы указываются учебники и пособия, которыми пользовался учащийся, и дата выполнения работы. Для замечаний необходимо оставлять слева от текста поля не менее 4 см.
Если при самостоятельном изучении дисциплины возникают затруднения, то можно получить устную консультацию у преподавателя.
После полного усвоения учебного материала дисциплины можно приступить к написанию контрольной работы.
Следует иметь в виду, что лекции, читаемые во время семестра, так же, как и лабораторные занятия, рассчитаны на то, что материал курса уже усвоен.
Ученики, получившие оценку по контрольной работе, посетившие все лекции и лабораторные занятия, допускаются к экзамену.
МЕТОДИЧЕСКИЕ СОВЕТЫ
ПО ИЗУЧЕНИЮ ОТДЕЛЬНЫХ ТЕМ ДИСЦИПЛИНЫ
И ВОПРОСЫ ДЛЯ САМОСТОЯТЕЛЬНОЙ ПРОВЕРКИ ЗНАНИЙ
I. ОБЩАЯ ЧАСТЬ
1.1. Теоретические основы органической химии
Органическая химия - химия соединений углерода. В связи с этим следует вспомнить из курса неорганической химии строение атома углерода и его валентные состояния с различными типами гибридизации (sp3, sp2, sp), особенности - и - связей, которые встречаются в органических соединениях. Уяснить основные понятия органической химии: гомологический ряд, гомолог, углеводородный радикал, функциональная группа, изомерия.
Необходимо разобраться в номенклатуре органических соединений (тривиальной, рациональной, международной) и уметь давать названия различным веществам по международной номенклатуре.
В целях облегчения и глубокого изучения курса органической химии следует обратить серьезное внимание на основные положения теории строения органических соединений А.М.Бутлерова:
1. В молекулах соединений существует определенный порядок связи атомов, который и носит название строения.
2. Химические свойства соединения определяются составом и строением его молекул.
3. Различное строение при одном и том же составе и молекулярной массе вещества обусловливает явление изомерии.
4. Химический характер атомов, входящих в молекулу, меняется в зависимости от того, с какими атомами они связаны в данной молекуле. Это изменение химического характера обусловливается главным образом взаимным влиянием непосредственно связанных атомов.
Все химические превращения могут осуществляться в строго определенных условиях (температура, давление, катализатор, растворитель), в значительной мере зависящих от механизма реакции. Под механизмом реакции подразумевают способ разрыва имеющихся валентных связей и образование новых, а также совокупность состояний, через которые проходят реагирующие вещества.
ОРГАНИЧЕСКАЯ ХИМИЯ
Органическая химия изучает соединения углерода - углеводороды и их производные, а также законы, которым подчиняются превращения этих веществ. В состав производных углеводородов могут входить почти все элементы периодической системы. Почему же изучение соединений только одного элемента - углерода - составляет содержание целой науки? Для этого имеется несколько причин:
1. Многочисленность и многообразие соединений углерода.
2. Специфика их строения, свойств и реакционной способности.
3. Их исключительно важное значение в жизни человека.
В разделе органической химии показано многообразие соединений углерода и их взаимосвязь, зависимость свойств веществ от взаимного влияния атомов в молекулах.
Большое значение имеют при обучении последовательность изучения материала, равномерное введение нового и закрепление пройденного.
Контроль качества знаний учащихся осуществляется путем проведения контрольных работ.
Предлагаемые задачи требуют не только соответствующих теоретических знаний, но и химического мышления, умения применять знания из различных разделов органической химии.
1. УГЛЕВОДОРОДЫ
Изучение курса органической химии необходимо начинать с самого простейшего класса органических соединений - углеводородов. Углеводороды имеют самое простое строение, они являются исходными веществами для получения всех других классов органических соединений.
Важнейшими природными источниками углеводородов являются газ, нефть, уголь, торф. В результате химической переработки природного сырья получают самые разнообразные вещества, имеющие большое народнохозяйственное значение (см. схему).
При изучении курса органической химии надо помнить, что одной эмпирической формуле (формуле, показывающей, сколько атомов углерода, водорода и других элементов содержит молекула вещества) может соответствовать несколько структурных формул - изомеров. Изомеры - это вещества, молекулы которых имеют одинаковый состав, но разное строение.
Эмпирическая формула соединений выводится на основе данных элементного анализа и молекулярной массы. Структурную формулу можно вывести, только изучив свойства вещества.
По характеру строения углеводородного скелета углеводороды делятся на ациклические (алифатические) и циклические. Ациклические углеводороды имеют открытую неразветвленную или разветвленную цепь:
 CH3
CH3
Н
 3С - СН2 - СН2 - СН2 - СН3 Н3С - СН - СН2 - СН3 Н3С - С - СН3
3С - СН2 - СН2 - СН2 - СН3 Н3С - СН - СН2 - СН3 Н3С - С - СН3
пентан CH3 СН3
изопентан неопентан
В зависимости от наличия в молекуле алифатических углеводородов одинарных и кратных углерод - углеродных связей они делятся на насыщенные (алканы) и ненасыщенные (алкены, алкины и др.)
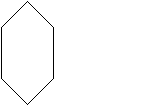
Циклические углеводороды в зависимости от строения циклов делятся на алициклические (насыщенные и ненасыщенные) и ароматические
 CH3
CH3
СH2 CH2 CH C



 H2C CH2 H2C CH2 HC CH HC CH
H2C CH2 H2C CH2 HC CH HC CH
 H2C CH2 H2C CH HC CH HC CH
H2C CH2 H2C CH HC CH HC CH
CH2 CH CH CH
циклогексан циклогексен бензол толуол
При написании циклических формул атомы углерода и водорода можно опускать.
CH3






циклогексан циклогексен бензол толуол
Представители всех классов органических соединений образуют гомологические ряды. В каждом гомологическом ряду последующий член ряда отличается от предыдущего на группу СН2 (гомологическая разница). Все члены одного гомологического ряда имеют сходное строение и близкие химические свойства.
-
Алканы (предельные углеводороды, парафины)
Характерной особенностью алканов является то, что они имеют открытые цепи и атомы углерода в их молекуле связаны между собой только -связями.
Общая формула алканов - СnН2n+2. Первые углеводороды их гомологического ряда получили случайные названия (исторические, тривиальные): СН4 - метан; СН3 - СН3 - этан; СН3 - СН2 - СН3 - пропан; СН3 - (СН2)2 - СН3 - бутан. В основу названий следующих неразветвленных гомологов были положены греческие числительные, соответствующие числу атомов углерода, и суффикс - ан: пентан, гексан, гептан и т.д.
Если от молекулы предельного углеводорода отнять атом водорода, то остаток называется алкильным радикалом R*: СН3 - метил; С2Н5 - этил и т.д.
Начиная с бутана, проявляет себя скелетная изомерия: СН3СН2 - СН2 - СН3 - бутан,
С Н3 - СН - СН3 - изобутан. С увеличением числа атомов углерода в молекуле количество
Н3 - СН - СН3 - изобутан. С увеличением числа атомов углерода в молекуле количество
СН3 изомеров быстро возрастает, что вызывает затруднения в запоминании тривиальных названий. Тривиальные названия с приставкой "изо-" применимы для соединений, имеющих одно разветвление - две метильные группы в конце цепи:
Н 3С - СН - СН2 - СН3
3С - СН - СН2 - СН3
СН3
изопентан
Соединения, имеющие разветвление из трех метильных группы в конце цепи, называются с приставкой "нео-":
С Н3
Н3
СН3 - С - СН2 - СН3

СН3
неогексан
-
Если атом углерода соединен с одним атомом углерода, он называется первичным, с двумя - вторичным, с тремя - третичным, с четырьмя - четвертичным.
I - первичный атом.
II - вторичный атом I II III IV I
I II - третичный атом. CH3 - CH2 - CH - C - CH3
II - третичный атом. CH3 - CH2 - CH - C - CH3
I
 V - четвертичный атом.
V - четвертичный атом.
CH3CH3CH3
I I I
С конца прошлого столетия начала разрабатываться международная научная систематическая номенклатура, которая претерпела ряд преобразований и в конечном варианте получила название номенклатура ИЮПАК (международный союз теоретической и прикладной химии). Согласно этой номенклатуре все органические вещества рассматриваются как производные нормально (неразветвленно) построенных углеводородов. За основу выбирается самая длинная и самая сложная углеродная цепь. Нумерацию начинают с того конца, от которого ближе разветвление. Если разные алкилы находятся на равном расстоянии от обоих концов цепи, то нумерацию начинают с того конца к которому ближе радикал (алкил) с меньшим числом атомов углерода. Несколько одинаковых заместителей обозначают приставками от греческих числительных: ди-, три-, тетра-, пента- и т.д. Цифрами показывается положение этих заместителей. В заключение называется нормальная углеводородная цепь:
1 2 3 4 5 6 7
С
 Н3 - СН2 - СН - СН2 - СН2 - СН2 - СН3 2-метил, 3-этилгептан
Н3 - СН2 - СН - СН2 - СН2 - СН2 - СН3 2-метил, 3-этилгептан
СН3 СН2 - СН3
1 2 3 4 5 6 7
С

 Н3 - СН2 - СН - СН2 - СН - СН2 - СН3 3-метил, 5-этилгептан
Н3 - СН2 - СН - СН2 - СН - СН2 - СН3 3-метил, 5-этилгептан

СН3 СН2 - СН3
СН3

СН3 - С - СН2 - СН3 2,2-диметилбутан

CН3
Приступая к изучению химических свойств, следует иметь в виду, что алканы, являясь малополярными соединениями, химически сравнительно мало активны. Они не вступают в реакции присоединения, так как валентности их полностью насыщены. Алканы устойчивы к действию кислот, щелочей и даже сильных окислителей, как хромовая кислота и марганцово-кислый калий при невысоких температурах. При высокой температуре предельные углеводороды сгорают до конечных продуктов - углекислого газа и воды:
СН4 + 2О2 СО2 + 2Н2О
Для предельных углеводородов характерными реакциями являются реакции радикального замещения (галогенирование, нитрование, сульфирование), которые проводят обычно или при облучении реакционной смеси светом, или при нагревании.
Вопросы для самопроверки
-
В чем заключается основные положения теории строения органических соединений?
-
Что такое гомологические ряды и их значение в органической химии?
-
Что такое изомерия? Напишите изомеры гексана.
-
Что называется первичным, вторичным, третичным и четвертичным углеводородными атомами?
-
Какие реакции свойственны предельным углеводородам?
-
Алкены (этиленовые)
Характерной особенностью алкенов является то, что два атома углерода в их молекулах на связь друг с другом затрачивают по два электрона, образуя одну - и одну - связь: С = С. Их общая формула СnH2n.
В гомологическом ряду алкенов благодаря наличию двойной связи появляется уже несколько видов изомерии:
А. Изомерия цепи углеродных атомов (скелетная изомерия).
Б. Изомерия положения двойной связи.
В. Пространственная - геометрическая или цис- и транс-изомерия.
Геометрические изомеры различаются пространственным расположением заместителей по отношению к двойной связи. Если одинаковые заместители расположены по одну сторону плоскости двойной связи, то изомеры называются цис-, если по разные стороны, то трансизомерами:
Н Н Н СН3


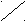
 С = С C = C
С = С C = C


Н3C СН3 СН3 Н
цисбутен -2 трансбутен-2
В ыведение структурных формул изомерных алкенов начинают с построения всех возможных цепей углеродного скелета. Так, для алкенов общей формулы С4Н8 можно построить 2 цепи (С - С - С - С и С - С - С). Затем в каждую углеродную цепь вставляют двойные связи
ыведение структурных формул изомерных алкенов начинают с построения всех возможных цепей углеродного скелета. Так, для алкенов общей формулы С4Н8 можно построить 2 цепи (С - С - С - С и С - С - С). Затем в каждую углеродную цепь вставляют двойные связи
С
в разные положения (С = С - С - С и С - С = С - С. После этого к атомам углерода приписывают атомы водорода. Если оба атома углерода, участвующие в образовании двойной связи, имеют разные заместители, изображают цис - и трансизомеры.
В соответствии с правилами ИЮПАК при построении названий алкенов наиболее длинная углеродная цепь, содержащая двойную связь, получает название соответствующего алкана, в котором суффикс -ан заменен на -ен. Нумерация начинается с конца цепи, ближе к которому находится двойная связь.
В рамках ИЮПАК разрешается применение ряда тривиальных названий: этилен, пропилен, изобутилен, винил и другие.
Изучая алкены, нужно знать, что их химические свойства определяются прежде всего наличием -связи. Эти соединения проявляют непредельный характер, то есть легко вступают в реакции присоединения с разрывом -связи.
Вопросы для самопроверки
-
Какие углеводороды называются этиленовыми?
-
Напишите структурные формулы 2-метилбутен-1, 2-метилбутен-2, 3-метилбутен-1. Изомерами какого углеводорода они являются?
-
В чем заключается правило Марковникова? Напишите уравнение реакции взаимодействия пропена с НСl.
-
Особенности окисления алкенов в нейтральной и кислой средах? Напишите уравнение реакции окисления пропена в нейтральной и кислой средах.
-
Какие промышленные методы получения полиэтилена вы знаете?
3. Алкины.
4. Алкадиены
Эти углеводороды изомерны друг другу. Их общая формула СnH2n-2. Алкадиены содержат в углеродной цепи две двойные связи, а алкины - одну тройную связь (- и две -). Их названия по системе ИЮПАК строятся по тем же правилам, что и для алкенов, за исключением того, что в случае алкадиенов приписывается к названию углеводорода окончание "диен", а в случае алкинов - "ин" (обозначает название тройной связи).
С Н2 = С - СН = СН2 2-метилбутадиен-1,3 (изопрен)
Н2 = С - СН = СН2 2-метилбутадиен-1,3 (изопрен)
СН3
С

 Н = СН этин (ацетилен) СН = С - СН - СН3 3-метилбутин-1
Н = СН этин (ацетилен) СН = С - СН - СН3 3-метилбутин-1
СН3
Если в молекуле есть и двойная и тройная связи, и они расположены на равных расстояниях от концов цепи, то начало нумерации определяет двойная связь:
С
 Н = С - СН - СН2 - СН = СН2 4-метилгексен-1-ин-5
Н = С - СН - СН2 - СН = СН2 4-метилгексен-1-ин-5
СН3
Для алкадиенов и для алкинов характерны, также как и для алкенов, прежде всего реакции присоединения по кратным связям.
Вопросы для самопроверки
-
Какие углеводороды называются алкинами?
-
Напишите формулы следующих соединений: 3-метилбутин-1, 3-метилпентин-1.
-
Напишите уравнения реакций присоединения водорода, хлора, хлористого водорода к ацетилену. В каком случае нужно использовать правило Марковникова?
-
Напишите уравнение реакции взаимодействия ацетилена с водой. Как называется эта реакция?
-
Напишите уравнение реакции димеризации ацетилена.
-
Какие углеводороды называются диеновыми углеводородами?
-
Напишите формулы изомеров пентадиена и укажите типы связи (кумулированные, сопряженные, изолированные).
-
Напишите уравнения реакций взаимодействия бутадиена-1,3 с хлором и хлористым водородом.
-
Напишите уравнение реакции полимеризации изопрена. Как используется полученный полимер в народном хозяйстве?
-
Напишите схему синтеза каучука по Лебедеву.
-
Арены (ароматические углеводороды)
Х


 арактерной особенностью ароматических углеводородов является то, что их молекулы представляют собой плоские циклы, содержащие (4n + 2) р-электронов, принадлежащих всем атомам цикла (правило Хюккеля, 1931 г.), где n может принимать значения 0,1, 2, 3 и так далее. Согласно этому правилу системы, содержащие 2, 6, 10, 14 и так далее обобщенных р-электронов, являются ароматическими. Важнейшими представителями ароматических углеводородов являются бензол и его гомологи, образующиеся в результате замещения атома
арактерной особенностью ароматических углеводородов является то, что их молекулы представляют собой плоские циклы, содержащие (4n + 2) р-электронов, принадлежащих всем атомам цикла (правило Хюккеля, 1931 г.), где n может принимать значения 0,1, 2, 3 и так далее. Согласно этому правилу системы, содержащие 2, 6, 10, 14 и так далее обобщенных р-электронов, являются ароматическими. Важнейшими представителями ароматических углеводородов являются бензол и его гомологи, образующиеся в результате замещения атома
в одорода бензольного кольца алифатическими радикалами, например, толуол СН3
одорода бензольного кольца алифатическими радикалами, например, толуол СН3
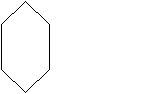


Второй гомолог может существовать в виде четырех изомеров:
СН2 - СН3 СН3 СН3 Н3C
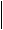
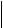
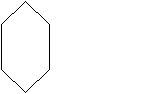


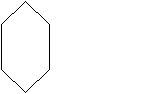
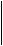


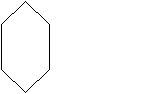


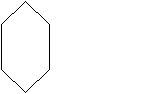


 СH3
СH3
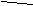 CH3
CH3

CH3
этилбензол ортоксилол метаксилол параксилол
(1,2-диметилбензол) (1,3-диметилбензол) (1,4-диметилбензол)
Согласно номенклатуре ИЮПАК для ароматических углеводородов разрешается использовать тривиальные названия: бензол, толуол, ксилол и так далее. Для названий замещенных аренов цикл нумеруют таким образом, чтобы сумма цифр номеров заместителей
была наименьшей. Более короткие цепи всегда называют в
п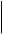 ервую очередь. Например, диметилэтилбензол следует CH2 - CH3
ервую очередь. Например, диметилэтилбензол следует CH2 - CH3
назвать 1,4-диметил, 2-этилбензол (сумма цифр равна 7), а
н
 е 1,4-диметил, 3-этилбензол (сумма цифр равна 8). H3C 2
е 1,4-диметил, 3-этилбензол (сумма цифр равна 8). H3C 2
В случае дизамещенных можно применять приставки: 1 3
случае дизамещенных можно применять приставки: 1 3
орто- (1,2), мета- (1,3-), пара- (1,4-). Радикал (остаток)
б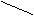 ензола С6Н5 - носит название фенил. 6 4
ензола С6Н5 - носит название фенил. 6 4
5 CH3
В молекуле бензола все атомы углерода равноценны, поэтому электрофильной атаке может подвергаться любой из них. В реакции замещения производных бензола следует учитывать, что каждый заместитель в бензольном ядре обладает определенным направляющим действием. Все заместители делятся на две группы:
1. Заместители первого рода, или орто -параориентанты.
К заместителям этого рода относятся -NH2, -OH, алкилы (-CH3, - C2H5 и т.п.), галогены (-F, -Cl, -Br, -J). Эти заместители, обладая положительным индуктивным и мезомерным эффектом, увеличивают электронную плотность бензольного кольца (за исключением галогенов) и особенно в орто- и параположениях, в которые и направляются электрофильные реагенты.
2. Заместители второго рода, или метаориентанты, направляют вступающий заместитель в метаположение. К ним относятся заместители, обладающие отрицательным индуктивным или мезомерным эффектами:
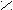
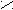
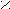
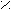
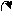
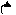
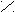
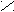
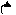
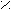
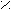
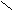

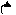 + O δ+O δ+ О δ+ О
+ O δ+O δ+ О δ+ О
N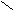


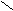
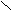
 _ S = O C С
_ S = O C С
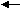 O ΟΗ H О Н
O ΟΗ H О Н
Они оттягивают электронную плотность от бензольного кольца и дезактивируют его. Реакции протекают трудней, чем в бензоле. В наибольшей степени обедняются электронной плотностью орто- и параположения; в метаположениях она несколько выше, что и обусловливает большую реакционную способность метаположения.
Вопросы для самопроверки
-
Классификация ароматических углеводородов.
-
Напишите формулы изомеров ксилола.
-
Какие типы реакций характерны для ароматических углеводородов?
-
На какие группы делятся заместители по характеру своего направляющего действия?
-
Напишите уравнения реакций нитрования и бромирования бензола.
-
Что такое гексахлоран, как он получается и где применяется?
2. КИСЛОРОДОСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
К числу кислородосодержащих органических соединений, состоящих из атомов углерода, водорода и кислорода, относятся спирты, фенолы, альдегиды, простые и сложные эфиры, карбоновые кислоты и др. Их химические свойства определяются наличием функциональных групп.
Для каждого класса соединений необходимо знать функциональную группу, номенклатуру, изомерию, основные способы получения, химические свойства. Понимать взаимное влияние атомов в молекуле, генетическую связь между органическими соединениями.
1. Спирты и фенолы
Эти классы соединений имеют одинаковую функциональную группу - ОН (гидроксил). Если гидроксил замещает атом водорода в любом углеводороде, кроме ароматического, соединения называются спиртами. Если гидроксильная группа связана непосредственно с атомом углерода ароматического кольца, то такие соединения называются фенолами.
По количеству групп - ОН спирты и фенолы делятся на одно-, двух-, трех-, и многоатомные. В зависимости от характера атома углерода, с которым связан гидроксил, спирты относятся к первичным, вторичным или третичным.
П о системе ИЮПАК спирты называют, добавляя суффикс "ол" к названию углеводорода. Нумеруют самую длинную цепь с того конца, ближе к которому гидроксил. Если спирт ненасыщен, то в эту цепь включают и двойную связь. Гидроксил имеет преимущество в нумерации перед галогеном и двойной связью. Часто используют тривиальные названия. СН3ОН - метанол (древесный или метиловый спирт), СН3СН2ОН - этанол (винный, или этиловый спирт), СН3 - СН2 -СН2 -ОН - пропанол-1 (первичный пропиловый спирт), СН3 - СН - СН3 - пропанол-2 (вторичный пропиловый спирт), ОН
о системе ИЮПАК спирты называют, добавляя суффикс "ол" к названию углеводорода. Нумеруют самую длинную цепь с того конца, ближе к которому гидроксил. Если спирт ненасыщен, то в эту цепь включают и двойную связь. Гидроксил имеет преимущество в нумерации перед галогеном и двойной связью. Часто используют тривиальные названия. СН3ОН - метанол (древесный или метиловый спирт), СН3СН2ОН - этанол (винный, или этиловый спирт), СН3 - СН2 -СН2 -ОН - пропанол-1 (первичный пропиловый спирт), СН3 - СН - СН3 - пропанол-2 (вторичный пропиловый спирт), ОН
Н
 2С = СН - СН2 - ОН Сl - СН2 - СН2 - ОН Н2С - СН2
2С = СН - СН2 - ОН Сl - СН2 - СН2 - ОН Н2С - СН2
пропен-2-ол-1 2-хлорэтанол
НО ОН
(аллиловый спирт) этандиол (этиленгликоль)
 ОН СН2 ОН
ОН СН2 ОН
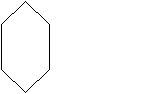


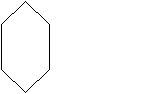


фенол бензиловый спирт
Вопросы для самопроверки
-
Что такое спирт? Укажите, какие бывают спирты в зависимости от количества гидроксильных групп.
-
Напишите гомологический ряд предельных одноатомных спиртов, назовите их и укажите, с какого представителя начинается изомерия.
-
Приведите примеры первичных, вторичных, третичных спиртов и объясните, чем они отличаются друг от друга.
-
Напишите формулы бутанол-1, бутанол-2.
-
Напишите реакцию окисления первичных и вторичных спиртов.
-
Написать уравнения реакций образования эфиров из пропанол-2 и бутанол-1.
-
Напишите уравнения реакций получения алкоголята, гликолята, глицерата.
-
Напишите уравнение реакции взаимодействия уксусной кислоты с этиловым спиртом.
-
В чем различие в строении и химических свойствах фенолов и ароматических спиртов?
-
Напишите все изомеры двухатомных фенолов и уравнение реакции восстановления хинона в гидрохинон.
-
Какие химические реакции свойственны одноатомным фенолам?
-
Напишите все изомеры трехатомных фенолов.
-
Какие производные фенола применя.тся в сельском хозяйстве как гербициды и стимуляторы роста растений?
-
Альдегиды и кетоны
Это производные углеводородов, содержащие группу СО карбонил. В альдегидах карбонильная группа связана с одним атомом водорода и радикалом ( а в простейшем альдегиде

 О
О
Н - С с двумя атомами водорода), в кетонах - с двумя радикалами. Называют
- С с двумя атомами водорода), в кетонах - с двумя радикалами. Называют
Н
эти соединения по международной номенклатуре ИЮПАК, добавляя к названиюуглеводорода окончание «аль» для альдегидов и «он» для кетонов.
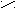
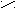
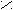
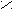 О О
О О
Н

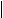
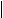 - С СН3 - СН - С СН3 - С - СН3
- С СН3 - СН - С СН3 - С - СН3
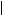 Н Н
Н Н
СН3 О
метаналь 2-метилпропаналь пропанон
(формальдегид) (изомасляный альдегид) (ацетон)
Среди альдегидов и кетонов много природных продуктов, они играют важную роль в физиологических процессах и являются очень реакционноспособными соединениями.
Вопросы для самопроверки
-
Напишите уравнения реакций получения из соответствующих спиртов альдегида и
кетона.
2. Назовите по международной номенклатуре уксусный альдегид и ацетон.
-
Какие общие и отличительные признаки имеют альдегиды и кетоны в строении и химических свойствах?
-
Приведите примеры реакций полимеризации и конденсации альдегидов.
-
Напишите уравнения реакций присоединения у альдегидов и кетонов.
-
Напишите уравнения реакций окисления капронового альдегида и диэтилкетона до соответствующих кислот.
-
Почему реакция окисления аммиачным раствором оксида серебра является качественной реакцией на выявление альдегидов?
3. Карбоновые кислоты
К классу карбоновых кислот относятся производные углеводородов, содержащие
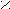
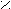 О
О
к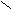 арбоксильную группу - С
арбоксильную группу - С
ОН
В зависимости от количества карбоксильных групп в молекуле, кислоты делятся на одноосновные, двухосновные и многоосновные.
Карбоновые кислоты широко распространены в природе, играют важную роль в физиологических процессах.
По системе ИЮПАК алифатические кислоты называют, прибавляя к названию соответствующего углеводорода окончание -овая ( или -диовая, -триовая и т.п.) кислота.
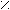
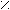 О
О
Н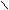 умерацию начинают с карбоксильной группы. Группу - С можно обозначать
умерацию начинают с карбоксильной группы. Группу - С можно обозначать
ОН
П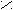
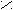 риставкой карбокси- или в окончании называть «карбоновая кислота»: О
риставкой карбокси- или в окончании называть «карбоновая кислота»: О
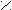
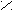
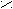
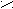
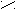
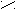

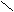 О О О С
О О О С
Н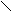
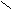

 - С СН3 - С СН2 = СН - С ОН
- С СН3 - С СН2 = СН - С ОН
ОН ОН ОН
муравьиная уксусная акриловая, бензойная
(метановая) (этановая) (пропеновая) кислота
кислота кислота кислота
При изучении свойств кислот обратите внимание на то, что формально карбоксильная группа состоит из карбонила и гидроксила, однако она не проявляет свойств ни спиртов, ни альдегидов, ни кетонов. Взаимное влияние карбонила и гидроксила друг на друга приводит к появлению качественно новых свойств карбоновых кислот.
Необходимо хорошо уяснить, что химические свойства карбоновых кислот определяются свойствами карбоксильной группы и соответствующего радикала. Уметь писать диссоциацию, реакции взаимодействия кислот с металлами, основаниями, солями, спиртами, галогенами.
На примере отдельных кислот (муравьиной, уксусной и др.) закрепить материал о свойствах карбоновых кислот.
В разделе «Сложные эфиры. Жиры» на примере этерификации дать понятие о классе сложных эфиров. Сложный эфир глицерина и высокомолекулярных жирных кислот (стеариновая, пальмитиновая, олеиновая) представляет собой жир. Следует освоить омыление и гидрогенизацию жиров. Рассмотреть состав и получение мыла.
По числу карбоксильных групп карбоновые кислоты классифицируют:
А. Одноосновные предельные (насыщенные) кислоты.
У одноосновных карбоновых кислот имеется одна карбоксильная группа.
При рассмотрении химических свойств карбоновых кислот следует обратить внимание на: диссоциацию кислот, образование солей (взаимодействие с металлами или основаниями), образование сложных эфиров, ангидридов, амидов, галогенангидридов, нитрилов.
Важнейшими представителями одноосновных предельных карбоновых кислот являются: муравьиная, уксусная, пропионовая, масляная, валериановая, капроновая, пальмитиновая, стеариновая.
Вопросы для самопроверки
-
Дайте определение одноосновным предельным карбоновым кислотам.
-
Напишите уравнение диссоциации пропионовой кислоты.
-
Напишите уравнения реакций образования: а) ацетата натрия; б) хлорангидрида уксусной кислоты; в) амида уксусной кислоты.
-
Напишите уравнение реакции образования сложного эфира из пропионовой кислоты и пропанол-2.
-
Напишите уравнение реакции взаимодействия глицерина с тремя молекулами пальмитиновой кислоты
Б. Одноосновные непредельные (ненасыщенные) кислоты
Одноосновные непредельные карбоновые кислоты содержат в своем составе одну карбоксильную группу, а в радикале имеется одна или несколько кратных (ненасыщенных) связей.
По карбоксильной группе эти кислоты проявляют те же свойства, что и предельные одноосновные карбоновые кислоты: диссоциируют, образуют соли, амиды, галогенангидриды, ангидриды, сложные эфиры.
Вопросы для самопроверки
-
Какие соединения называются непредельными одноосновными карбоновыми кислотами?
-
Напишите уравнение диссоциации акриловой кислоты.
-
Напишите уравнение реакции гидрирования олеиновой кислоты.
-
Напишите уравнение реакции образования сложного эфира из акриловой кислоты и пропанол-2.
-
Напишите уравнение реакции взаимодействия глицерина с тремя молекулями олеиновой кислоты.
В. Двухосновные предельные (насыщенные) кислоты
Двухосновными предельными карбоновыми кислотами называются соединения, в молекуле которых содержится две карбокисльные группы.
Двухосновными предельными карбоновыми кислотами называются соединения, в молекуле которых содержится две карбоксильные группы.
При изучении химических свойств двухосновных кислот следует уяснить, что они проявляют все реакции карбоксильной группы, но в отличие от одноосновных кислот они могут образовывать два вида производных - полные, когда в реакцию вступают обе карбоксильные группы, и неполные, когда только одна карбоксильная группа вступает в реакцию. Обратите внимание на то, что двухосновные кислоты неодинаково отностятся к нагреванию в зависимости от расположения карбоксильных групп относительно друг друга.
Важнейшие представители двухосновных предельных карбоновых кислот: щавелевая, малоновая, янтарная, глутаровая, адипиновая.
Вопросы для самопроверки
-
Напишите уравнение ступенчатой диссоциации щавелевой кислоты.
-
Напишите уравнение реакции образования ангидрида янтарной кислоты.
-
Напишите уравнение реакции декарбоксилирования малоновой кислоты.
-
Напишите уравнения реакций образования кислого и среднего эфира из янтарной кислоты и этанола.
-
Напишите уравнение реакции образования амида глутаминовой кислоты.
Г. Двухосновные непредельные (ненасыщенные) кислоты
Двухосновными непредельными карбоновыми кислотами называются соединения, в молекуле которых имеется две карбоксильные группы, а в радикале одна или несколько ненасыщенных связей.
Основным представителем этой группы кислот является бутендиовая кислота
НООС - СН = СН - СООН. Для этой кислоты возможны две пространственные конфигурации ( см. этиленовые углеводороды):
 Н - С - СООН Н - С - СООН
Н - С - СООН Н - С - СООН
Н - С - СООН НООС - С
Цис-форма малеиновая Транс-форма фумаровая
Вопросы для самопроверки
-
Чем отличаются цис- и транс-изомеры бутен-2-диовой кислоты по строению?
-
Напишите уравнение реакции образования малеинового ангидрида.
-
Напишите уравнение реакции образования кислого и среднего эфира с фумаровой кислотой и этанолом.
-
Напишите уравнение реакции присоединения воды к фумаровой кислоте.
Д. Ароматические кислоты
Ароматическими карбоновыми кислотами называют производные бензола, содержащие карбоксильные группы, непосредственно связанные с углеродными атомами бензольного ядра. Кислоты, содержащие карбоксильные группы в боковой цепи, рассматриваются как жирноароматические.
Важнейшими представителями ароматических кислот являются: бензойная и фталевые кислоты.
У бензойной кислоты изомеров нет, а фталевая кислота имеет три изомера в зависимости от положения карбоксильных групп.
 COOH
COOH
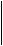


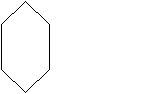


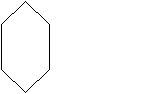


 COOH COOH
COOH COOH
 COOH
COOH


COOH СOOH
фталевая изофталевая изофталевая
(орто) (мета) (пара)
Ароматические кислоты вступают во все те реакции, которые свойственны и кислотам жирного ряда: диссоциация, образование солей, ангидридов, амидов, галогенангидридов, сложных эфиров, декарбоксилирование. Но у ароматических кислот большая степень диссоциации, т.к. бензольное кольцо обладает электрофильным характером и оттягивая электронную плотность на себя, ослабляет связь водорода с карбоксильной группой.
Вопросы для самопроверки
-
Какие кислоты называются ароматическими?
-
Напишите уравнение реакции диссоциации бензойной кислоты.
-
Напишите уравнение реакции декарбоксилирования бензойной кислоты.
-
Напишите уравнение реакции получения ангидрида из фталевой кислоты.
4. Липиды
Изучая этот раздел, обратите внимание на состав жиров, распространение в природе, классификации. Жиров, отличие жидких жиров от твердых и превращение первых во вторые.
Мыла и детергенты, искусственные моющие средства и проблема уничтожения их отходов.
Уясните строение восков и их биологическое значение.
Сложные липиды. Особенно обратите внимание на фосфатиды.
Вопросы для самопроверки
-
Классификация липидов.
-
Перечислите основные высокомолекулярные жирные кислоты, входящие в состав жиров.
-
Напишите уравнение реакции получения тристеарида.
-
Охарактеризуйте физические свойства жиров
-
Дайте аналитическую характеристику жиров.
-
Мыла, их состав, твердые и жидкие мыла.
-
Строение сложных липидов. Напишите уравнение реакции образования лецитина (фосфатидилхолин) и кефалина (фосфатидилэтаноламин).
-
Окси-, альдегидо-, кетокислоты
К полифункциональным производным углеводородов относятся органические соединения, в молекулах которых содержатся две и более различных функциональных групп. Например, оксикислоты содержат одновременно гидроксильную и карбоксильную группы, альдегидокислоты - альдегидную и карбоксильную, кетокислоты - кето- и карбоксильную и т.д.
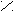
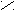
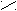
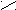 O O
O O
С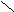
 Н3 - СН - С СН3 - С - С
Н3 - СН - С СН3 - С - С


 OH OH
OH OH
OН О
молочная (2-оксипропановая) пировиноградная (2-оксипропановая)
кислота кислота
Эти соединения чрезвычайно распространены в природе и принимают активное участие в биохимических процессах.
А. Оксикислоты.
Оксикислоты относятся к соединениям со смешанными функциями: в молекуле оксикислот имеется карбоксильная группа, характерная для кислот, и гидроксильная группа, характерная для спиртов. Общая формула всех оксикислот:
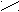 (СООН)n
(СООН)n
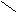 R
R
(ОН)m
где n - число карбоксильных групп;
m - число спиртовых гидроксилов.
В связи с тем, что в составе молекул оксикислот имеются спиртовая и карбоксильная группы, введены понятия основности и атомности. Основность оксикислоты определяется числом карбоксильных групп, атомность - общим числом гидроокислов, т.е. совбодных и входящих в карбоксил. Например: СН3 - СНОН - СООН - молочная кислота является одноосновной и двухатомной кислотой.
Изучение оксикислот тесно связано со спиртами и карбоновыми кислотами. При этом необходимо запомнить определение, классификацию, номенклатуру, способы получения и химические свойства.
У оксикислот отмечается как структурная изомерия: изомерия углеводородной цепи, изомерия положения оксигруппы (-, -, γ- и т.д. оксикислоты), так и стереоизомерия. Стереоизомерия проявляется при наличии в молекуле асимметрического атома углерода ( у которого все четры валентности связаны с различными атомами или группами атомов).
Являясь одновременно кислотами и спиртами, оксикислоты дают реакции как по карбоксильной группе (диссоциация, образование солей, амидов, ангидридов, галогенангидридов, сложных эфиров), так и по спиртовой группе (алкоголяты, окисление, простые эфиры, сложные эфиры). Но кроме того во всех превращениях оксикислот следует учитывать взаимное влияние гидроксильной и карбоксильной групп (например реакция отщепления воды позволяет отличить (-, -, γ- и т.д. оксикислоты).
Основные представители оксикислот: гликолевая, молочная, оксимасляные, глицериновая, яблочная, винные, лимонная.
Основныеми представителями фенолкислот являются салициловая и галловая кислоты.
Вопросы для самопроверки
-
Какие соединения называются оксикислотами и как они классифицируются?
-
Напишите формулы всех изомеров оксимасляной кислоты.
-
Напишите уравнения реакций, характерные для спиртовой группы молочной кислоты.
-
Напишите уравнения реакций с гликолевой кислотой, характерные для карбоксильной группы
-
Какие соединения называются фенолокислотами?
-
Напишите формулы всех изомеров оксибензойной кислоты
-
Напишите уравнение реакции образования сложного эфира из салициловой кислоты и этанола.
Б. Оксокислоты (альдегидокислоты и кетокислты)
Оксикислотами называются органические соединения, в молекуле которых имеется карбоксильная группа и оксогруппа (альдегидная или кетонная).
Необходимо разобраться в изомерии оксокислот и знать формулы основных представителей: глиоксалевой кислоты, пировиноградной, щавелевоуксусной, -кетоглутаровой, ацетоуксусной. Изучая химические свойства оксикислот, уясните реакции, обусловленные наличием карбоксильной и карбонильной групп.
Вопросы для самопроверки
-
В чем отличие альдегидо - кислот и кетокислот по строению?
-
Напишите уравнения реакций с пировиноградной кислотой, характерные для карбоксильной группы.
-
Напишите уравнения реакций с глиоксалевой кислотой по альдегидной группе.
6. Оптическая изомерия
Явление оптической активности широко распространено среди органических соединения. К оптически активным веществам относятся многие важные природные вещества: белки, углеводы, нуклеиновые кислоты. Это явление имеет глубокое биологическое значение, т.к. оно связано с асимметрией живого вещества и явлением жизни.
Оптическая активность большинства органических соединений связана со строением их молекул. Молекула органического соединения, в которой атом углерода связан с четырьмя различными атомами или группами атомов, асимметрична, поэтому она вращает плоскость симметрии. Структурным признаком асимметричного соединения является присутствие асимметричного атома углерода, обозначаемого обычно звездочкой.
Асимметричные молекулы образуют стереоизомеры, различающиеся расположением в пространстве заместителей у асимметричных атомов углерода. Стереоизомеры, относящиеся друг к другу как предмет и его зеркальное отоброжение, называются оптическими антиподами.
Ассиметричной молекуле соответствует ее стереоизомер. Он имеет иное расположение заместителей в пространстве и является зеркальным изображением первого изомера. Оба изомера относятся как предмет и его изображение в зеркале.
Необходимо уяснить вклад ученых (Ж.Б.Био, Л.Пастер, Я.Г.Вант-Гофф, Ж.А.Ле-Бель, М.А.Розанов) в изучение оптически активных веществ, а также такие понятия как: энантиомеры, рацематы, асимметрический синтез.
Вопросы для самопроверки
-
Какой атом углерода называется асимметрическим?
-
Напишите формулы оптических изомеров глицеринового альдегида.
-
Какие изомеры называются анантиомерами?
-
Что называется рацематом?
-
В чем суть асимметрического синтеза?
7. Углеводы
Углеводы или сахара, - это группа органических соединений, имеющих большое биологическое значение в жизни животных растений. Это самая распространенная группа природных органических соединений, составляющих 80% сухого веса растений и 2% - животных организмов.
Углеводы образуются в растениях из углекислого газа и воды в процессе реакций фотосинтеза, осуществляемых за счет солнечной энергии с участием зеленого пигмента растений - хлорофилла.
Углеводы (сахара) подразделяются на две большие группы:
-
моносахариды (простые углеводы), или монозы, не способные гидролизоваться;
-
полисахариды (сложные углеводы), или полиозы, состоящие из различного числа остатков простых углеводов (крахмал, клетчатка и др.), подвергающиеся гидролизу.
Моносахариды. По числу атомов углерода в молекуле их делят на триозы (3С), тетрозы (4С), пентозы (5С), гексозы (6С) и так далее. Моносахариды - полифункциональные соединения, являются оксиальдегидами (альдозы) или оксикетонами (кетозы). Наиболее распространены гексозы О
С



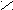
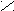
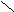 Н2 -*СН - *СН - *СН - *СН - С
Н2 -*СН - *СН - *СН - *СН - С
 Н
Н
ОН ОН ОН ОН ОН
Альдогексоза




 СН2 - *СН - *СН - *СН - С - СН2ОН
СН2 - *СН - *СН - *СН - С - СН2ОН

ОН ОН ОН ОН О
Кетогексоза
Для них известно большое число стереоизомеров (2n, где n - число асимметрических атомов). Так, для альдогексоз 24 = 16, для кетогексоз 23 = 8, то есть, для альдоз существует 16 оптически активных изомеров, или 8 пар антиподов, для кетоз - соответственно 8 и 4. Каждая пара имеет свое название: глюкоза, галактоза, фруктоза и так далее.
Для определения принадлежности к D- или L-генетическому ряду каждого изомера из пары (рацемата) сравнивают конфигурацию последнего асимметрического атома углерода этого изомера с конфигурацией D- или L-глицеринового альдегида. При этом записывают проекционные формулы молекул так, чтобы, карбонильная группа находилась сверху:
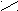
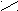
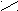
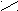








 O O
O O


 C H C H
C H C H
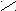
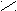
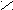
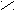 O O
O O






 C H C H H C OH HO C H
C H C H H C OH HO C H










 H C OH HO C H HO C H H C OH
H C OH HO C H HO C H H C OH



 СН2ОН СН2ОН H C OH HO C H
СН2ОН СН2ОН H C OH HO C H


 H C OH HO C H
H C OH HO C H

СН2ОН СН2ОН
D-глицериновый L-глицериновый D-глюкоза L-глюкоза
альдегид альдегид
В глюкозе положение гидроксила при 3-м, а в галактозе при 3-м и 4-м углеродных атомах противоположны положению при 5-углеродном атоме. Фруктоза, начиная с 3-го атома углерода, имеет такое же строение, как и глюкоза.

 O O
O O
С Н С Н CH2OH

Н ОН Н ОН С = О

 НО Н НО Н НО Н
НО Н НО Н НО Н
 Н ОН НО Н Н ОН
Н ОН НО Н Н ОН
 Н ОН Н ОН Н ОН
Н ОН Н ОН Н ОН
СН2ОН СН2ОН СН2ОН
D - глюкоза D - галактоза D - фруктоза
Для углеводов характерен еще один вид структурной изомерии, называемый циклоцепной таутомерией. Это явление вызывается внутримолекулярным взаимодействием окси- (-ОН) и оксо- (С=О) групп углеводорода:
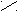
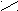 O
O
Н




 О С Н С H Н С ОН
О С Н С H Н С ОН

 Н OH H OH H OH
Н OH H OH H OH
Н

 O Н HO H НO Н
O Н HO H НO Н
O O

 Н OН H OH H OН
Н OН H OH H OН

 Н H OH Н
Н H OH Н
СH2OH CH2OH CH2OH
-D - глюкоза D - глюкоза α- D - глюкоза
Появившийся в циклической формуле у атома С1 гидроксил, возникающий из карбонильной группы открытой формы, называется полуацетальным, или гликозидным. Он существенно отличается по свойствам от спиртовых гидроксилов. Если он расположен также, как гидроксил, определяющий принадлежность к D или L ряду, то такая форма называется - формой, если с противоположной стороны, то - формой.
При изучении углеводов и их производных обратите внимание, что именно за счет этого гликозидного гидроксила идет образование сложных углеводов, глюкопротеидов, нуклеиновых кислот и других природных соединений.
Более наглядно строение молекулы углевода можно представить, используя так называемые перспективные формулы. Плоскость кольца изображают перпендикулярно плоскости листа бумаги, атом кислорода расположен в правом заднем углу. Заместители, которые были слева или справа в проекционных формулах, пишут соответственно сверху или снизу по отношению к плоскости кольца, изменяя положение заместителей у атома углерода, за счет которого осуществляется циклизация. Шестичленные циклы называют пиранозами, а пятичленные - фуранозами по аналогии с названиями веществ:

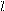 CH2OH O
CH2OH O



 H H
H H

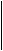
 H
H
 OH H
OH H

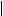
 HO HO
HO HO
О О H HO
пиран фуран α-D- гдюкопираноза

 H OH O
H OH O

H

H OH H

 OH
OH
H OH
-D - глюкофураноза
Из сложных сахаров необходимо знать : а) дисахариды - мальтозу (состоит из двух молекул - D - глюкозы), целлобиозу (состоит из двух молекул - D - глюкозы), лактозу (состоит из - D - глюкозы и - D - галактозы), сахарозу (состоит из - D - глюкозы и - D - фруктозы); б) полисахариды - крахмал, гликоген, клетчатку и пентозаны.
При изучении химических свойств сахаров следует исходить из химических свойств функциональных групп, входящих в молекулу. Так, если молекула углевода содержит свободный гликозидный гидроксил, то в водном растворе она будет находиться в равновесии с открытой формой и давать реакции карбонильной группы, например окисление. Следует учесть, что именно наличие или отсутствие свободного гликозидного гидроксила определяет отношение дисахаридов к восстанавливающим (целлобиоза) и невосстанавливающим (сахароза).
В процессе изучения сахаров обратите внимание на образование сложных эфиров, ибо они играют важную биохимическую роль (фосфорные эфиры в синтезе и распаде углеводов) и имеют большое народнохозяйственное значение (нитроклетчатка, ацетатное волокно и т.п.) Ознакомтесь с вопросами химической переработки древесины.
Вопросы для самопроверки
-
Напишите карбонильные формулы D - глюкозы, D - фрукозы, D - галактозы. Укажите, что есть общего в их строении.
-
Что такое L - и D - , - - формы сахара? Укажите на конкретных примерах моносахаридов.
-
Напишите циклические и открытые оксоформы глюкозы.
-
Мутаротация. Объясните это явление на примере глюкозы.
-
Что такое гликозидный гидроксил? Какие реакции свойственны сахарам по этому гидроксилу?
-
Напишите уравнения реакций образования сложных эфиров глюкозы и фруктозы с фосфорной кислотой.
-
Напишите формулы рибозы и дезоксирибозы в карбонильной и циклической формах.
-
Напишите уравнения реакций образования мальтозы и целлобиозы. Чем отличаются структурные формулы этих дисахаридов?
-
Укажите, какие дисахариды относятся к восстанавливающему и невосстанавливающему типу. Приведите примеры восстанавливающих и невосстанавливающих дисахаридов.
-
Гидролиз крахмала и клетчатки. Какие промежуточные и конечные продукты при этом образуются?
-
Строение гликогена и его биологическая роль.
-
Аминокислоты и белки
Аминокислотами называются соединения, содержащие в молекуле одновременно амино- и карбоксильные группы. Они имеют неоценимое значение в жизнедеятельности организмов, так как из их остатков построены белки (22 аминокислоты). Аминокислоты, из которых построены белки, являются -аминокислотами и относятся L-ряду. О
С - ОН

H2N - C - H

Различаются природные аминокислоты по характеру углеводородного радикала, R, содержащего разные углеводородные остатки и функциональные группы, такие как окси
(-ОН), тиогруппы ( - S - H, - S - CH3) и другие.
Для природных аминокислот используют в основном тривиальные названия.
Все аминокислоты, входящие в состав белков, делятся на заменимые и незаменимые (не синтезируются в организме животных и человека).
При изучении свойств аминокислот надо помнить, что наличие в их молекуле кислотных и основных групп определяет амфотерный характер этих соединений. Они могут давать соли как с кислотами так и с основаниями, проявляя при этом и другие свойства аминов и кислот.
Аминокислоты имеют солеобразное строение, образуя внутренние соли:
R - CH - COOH R - CH COO -,
I I
NH2NH3
Что в значительной мере определяет их физические свойства: кристаллическая структура, высокие температуры плавления, хорошая растворимость в воде.
Как бифункциональные соединения, аминокислоты способны вступать в реакцию конденсации, образуя ди-, три- и полипептиды, связанные между собой пептидной связью (С-N).
Пептиды - это основа белков. Название полипептидов образуют из названий соответствующих -аминокислот, причем аминокислоты, участвующие карбоксильной группой в образовании полипептида, получают суффикс «ил».
Вопросы для самопроверки
-
Как подразделяются аминокислоты в зависимости от углеродного радикала, количества карбокисльных и аминных групп, входящих в молекулы аминокислот?
-
Напишите реакции диссоциации аминокислот. Объясните, почему они обладают амфотерными свойствами.
-
Напишите, какие аминокислоты имеют нейтральную, кислую и основную среду, чем объясняется характер среды.
-
Напишите уравнение реакции взаимодействия глутаминовой кислоты с NaOH и HCl.
-
Какие соединения называются полипептидами?
-
Номенклатура полипептидов.
-
Напишите уравнение реакции получения трипептида из серина, аланина и цистеина.
-
Строение глутатиона и его биологическая роль.
-
Классификация белков. Какие белки называются простыми, сложными, полноценными, неполноценными?
-
Строение белковой молекулы: первичная, вторичная, третичная и четвертичная структура белка.
-
Назовите основные качественные реакции на белки.
-
Гетероциклические соединения
Гетероциклические соединения - это соединения, содержащие в циклах, кроме атомов углерода другие элементы - гетероатомы: кислород, азо, серу. Необходимость изучения гетероциклов связана с тем, что они входят в состав многих органических соединений, играющих важную роль в жизнедеятельности растений и животных. Они являются составными компонентами сложных белков, нуклеиновых кислот, ферментов, витаминов, хлорофилла, гемоглабина и так далее. Наибольшее значение имеют ароматические герероциклы.
При изучении гетероциклов надо помнить, что правило Хюккеля, выведенное для ароматических систем , распространяется и на гетероциклические соединения. Устойчивая электронная оболочка, принадлежащая всем атомам цикла, содержащая (4n + 2) р-электронов, которая часто достраивается за счет свободных электронных пар гетероатома, приводит к особым свойствам ароматических систем: способности к реакциям электрофильного замещения, устойчивости к нагреванию, окислению. Реакции присоединения протекают в более жестких условиях, чем для этиленовых углеводородов.
Если атом азота отдает свою электронную пару в ароматический цикл, он теряет основные свойства. Например пиррол основных свойств не проявляет
так как электронная пара атома азота достраивает электронную оболочку
гетероцикла до шести. В том случае, когда атом азота находится при
двойной связи в цикле, он, являясь акдептором электроно, понижает
электронную плотность на атомах углерода ароматического гетероцикла,
уменьшает способность к реакциям электрофильного замещения. При этом основные свойства сохраняются. Так,пиридин является устойчивой ароматической системой с наибольшей электронной плотностью в положения 3 и 5, в которые направляются электрофильные реакции в жестких условиях:
Br + Br- __ - Br
Al Br3, t = 3000 + HBr
Вопросы для самопроверки
-
Какие соединения называются гетероциклическими?
-
Классификация гетероциклических соединений.
-
В чем выражается ароматичность гетероциклических соединений?
-
Напишите формулы герероциклов, входящих в состав аминокислот.
-
Биологическая роль пурина и пиримидина.
-
Нуклеиновые кислоты
Нуклеиновые кислоты входят в состав растительных и животных клеток, принимают участие в передаче наследственных признаков и синтезе белка. Разберитесь в классификации нуклеиновых кислот. Уясните, чем отличаются по строению ДНК и РНК, нуклеозиды и нуклеотиды. Нуклеозиды являются N - гликозидами с агликоном - остатком определенных гетероциклических соединений (аденина, гуанина, тимина, цитозина, урацила).
Нуклеотиды образуются за счет присоединения фосфорной кислоты к нуклеозиду через гироксил у пятого углеродного атома пентозы.
-
Биологически активные органические соединения и сельское хозяйство
Многие органические вещества являются биологически активными и используются в сельском хозяйстве. Разберитесь в понятиях: инсектициды, фунгициды, гербициды, пестициды.
Большое значение имеют регуляторы роста: индолилкарбоновые кислоты, кинины, гиббереллины. Изучите строение и фукции инсекторепеллентов, инсектоаттрактантов, хемостерилизаторов.
Вопросы для самопроверки
-
Пестициды и их классификация.
-
Инсектициды, их классификация по типу действия.
-
Гербициды, представители, классификация по действию.
-
ТМТД, гексахлоран, 2,4-D - их строение и применение в сельском хозяйстве.
-
Регуляторы роста растений, представители и их биологическое действие.
II. ЗАДАНИЯ И МЕТОДИЧЕСКИЕ УКАЗАНИЯ ПО ВЫПОЛНЕНИЮ КОНТРОЛЬНОЙ РАБОТЫ
В соответствии с учебным планом по органической химии следует выполнить две контрольных работы. К написанию контрольной работы надо приступать после полного изучения курса в соответствии с программой и методическими указаниями.
При оформлении работы вопросы контрольного задания переписываются полностью в тетрадь. После каждого вопроса дается четкий и ясный ответ. Уравнения реакций писать структурными формулами и подписывать наименования всех веществ по международной номенклатуре.
Учащийся выполняет контрольную работу, состоящую из 10 задач, каждая из которых относится к одному из разделов органической химии.
Для выбора варианта задания используется таблица 1.
Номера вопросов контрольной работы находятся на пересечении строки вертикали, соответствующей последней цифре номера зачетной книжки, со строкой по горизонтали, соответствующей первой букве фамилии ученика.
Таблица 1 - Номера вопросов контрольной работы
Первая буква фамилии студента
Последняя цифра шифра
0
1
2
3
4
5
6
7
8
9
А
1, 27
52, 69
82, 103
117,137
155, 177
2, 28
53, 70
83, 104
118, 138
156 ,178
3, 29
54, 71
84, 105
119, 139
158, 179
4, 30
55, 72
85, 106
120, 140
158, 180
5, 31
56, 73
86, 107
121,141159, 181
6, 32
57, 74
87, 108
122, 142
160, 182
7, 33
58, 75
88, 109
123, 143
161, 183
8, 34
59, 76
89, 110
124, 144
162, 184
9, 35
60, 77
90, 111
125, 145
163, 185
10, 36
61, 78
91, 112
126, 146
164, 186
Б
11, 37
62, 79
92, 113
127, 147
165, 187
12, 38
63, 80
93, 114
128, 148
166, 188
13, 39
64, 81
94, 115
129, 150
167, 189
14, 40
65, 69
95, 116
130, 151
168, 190
15, 41
66, 70
96, 103
131, 152
169, 177
16, 42
67, 71
97, 104
132, 153
170, 178
17, 43
68, 72
98, 105
133, 154
171, 179
18, 44
52, 73
99, 106
134, 153
172, 180
19, 45
53, 74
100, 107
135, 152
173, 181
20, 46
54, 75
101, 108
136, 151
174, 182
В
21, 47
55, 76
102, 109
117, 150
175, 183
22, 48
56, 77
82, 110
118, 149
176, 184
23, 49
57, 78
83, 111
119, 148
155, 185
24, 50
58, 79
84, 112
120, 147
156, 186
25, 51
59, 80
85, 113
121, 146
157, 187
26, 50
60, 81
86, 114
122, 145
158, 188
25, 49
61, 69
87, 115
123, 144
159, 189
24, 48
62, 70
88, 116
124, 143
160, 190
23, 47, 63, 71
89, 103
125, 142
161, 177
22, 46
64, 72
90, 104
126, 141
162, 178
Г
21, 45
65, 73
91, 105
127, 140
163, 179
20, 44
66, 74
92, 106
128, 139
164, 180
19, 43
67, 75
93, 107
129, 138
165, 181
18, 42
68, 76
94, 108
130, 137
166, 182
17, 41
52, 77
95, 109
131, 137
167, 183
16, 40
53, 78
96, 110
132, 138
168, 184
15, 39
54, 79
97, 111
133, 139
169, 185
14, 38
55, 80
98, 112
134, 140
170, 186
13, 37
56, 81
99, 113
135, 141
181, 187
12, 36
57, 69
100, 114
136, 142
172, 188
|
| 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| Д | 11, 35 58, 70, 101, 115 120, 143 173, 189 | 10, 34 59, 71 102, 116 121, 144 174, 160 | 9, 33 60, 72 82, 103 122, 145 175, 177 | 8, 32 61, 73 83, 104 123, 146 176, 178 | 7, 31 62, 74 84, 105 124, 147 155, 179 | 6, 30 63, 75 85, 106 125, 148 156, 180 | 5, 29 64, 76 86, 107 126, 149 157, 181 | 4, 28 65, 77 87, 108 127, 150 158, 182 | 3, 27 67, 78 88, 110 128, 151 159, 183 | 2, 28 68, 79 89,111 129, 152 160,184 |
| Е | 26, 29 52, 80 90, 112 117, 153 161, 185 | 25, 30 53, 81 91, 113 118, 154 162, 186 | 24, 31 54, 69 92, 114 119, 137 163, 187 | 23, 32 55, 70 93, 115 120, 138 164, 188 | 22, 33 56, 71 94, 116 121, 139 165, 189 | 21, 34 57, 72 95, 103 122, 140 166, 190 | 20, 35 58, 73 96, 104 123, 141 167, 177 | 19, 36 59, 74 97, 105 124, 142 168, 178 | 18, 37 60, 75 98, 106 125, 143 169, 179 | 17, 38 61, 76 99, 107 126, 144 170, 180 |
| Ж | 16, 39 62, 77 100, 108 127, 145 171, 181 | 15, 40 63, 78 101, 109 128, 146 172, 182 | 14, 41 64, 79 102, 110 129, 147 173, 183 | 13, 42 65, 80 82, 111 130, 148 174, 184 | 12, 43 66, 81 83, 112 131, 149 175, 185 | 11, 44 67, 69 84, 113 132, 150 176, 186 | 10, 45 68, 69 85, 114 133, 151 155, 188 | 9, 46 52, 70 86, 115 134, 152 156, 189 | 8, 47 53, 71 87, 116 135, 153 157, 190 | 7, 48 54, 72 88, 103 136, 154 158, 177 |
| З | 6, 49 55, 73 89, 104 117, 137 159, 178 | 5, 50 56, 74 90, 105 118, 138 160, 179 | 4,51 57, 75 91, 106 119, 139 161, 180 | 3, 27 58, 76 92, 107 120, 140 162, 181 | 2, 28 59, 77 93, 108 121, 141 163, 182 | 1, 29 60, 78 94, 109 122, 142 164, 183 | 25, 30 61, 79 95, 110 123, 143 165, 184 | 24, 31 62, 80 96, 111 124, 144 166, 185 | 23, 32 63,81 97, 112 125, 145 167, 186 | 22, 33 64, 69 98,113 126, 146 168, 187 |
| И | 21, 34 65, 70 99, 114 127, 147 169, 188 | 20, 35 66, 71 100, 115 128, 148 170, 189 | 19, 36 67, 72 101, 116 129, 149 171, 190 | 18, 37 68, 73 102, 103 130, 150 172, 177 | 17, 38 52, 74 82, 104 131, 151 173, 178 | 16, 39 53, 75 83, 105 132, 152 174, 179 | 15, 40 54, 76 84, 106 133, 153 175, 180 | 14 ,41 55, 77 85, 107 134, 154 176, 181 | 13, 42 56, 80 86, 108 135, 137 155, 182 | 12, 43 57, 81 87, 109 136, 138 156, 183 |
| К | 11, 44 58, 78 88, 110 136, 139 157, 184 | 10, 45 59, 79 89, 111 135, 140 158, 185 | 9, 46 60, 69 90, 112 134, 141 159, 186 | 8, 47 61, 70 91, 113 132, 142 160, 187 | 7, 48 62, 71 92, 114 131, 143 161, 188 | 6, 49 63, 72 93, 115 130, 144 162, 189 | 5, 50 64, 73 94, 116 129, 145 163, 190 | 4, 51 65, 74 95, 03 128, 146 164, 177 | 3, 27 66, 75 96. 104 127, 147 165, 178 | 2, 28 67, 76 97, 105 126, 148 166, 179 |
| Л | 1, 27 62, 79 102, 109 127, 140 173, 189 | 2, 28 63, 80 82, 110 128, 139 174, 190 | 3, 29 64, 81 83, 111 129, 138 175, 177 | 4, 30 65, 69 84, 112 130, 137 176, 178 | 5, 31 66, 70 85, 113 131, 137 155, 179 | 6, 32 67,71 86, 114 132, 138 156,180 | 7, 33 68, 72 87, 115 133, 139 157, 181 | 8, 34 52, 73 88, 116 134, 140 158, 152 | 9, 35 53, 73 89, 103 135, 141 159, 183 | 10, 36 54, 75 90, 104 136, 142 160, 184 |
| М | 26, 29 62, 77 89, 104 127, 147 157, 184 | 25, 30 63, 78 90, 105 128, 148 158, 185 | 24, 31 64, 79 91, 106 129, 149 159, 186 | 23, 32 65, 80 92, 107 130, 150 160, 187 | 22, 33 66, 81 93, 108 131, 151 161, 188 | 21, 34 67, 69 94, 109 132, 152 162, 189 | 20, 35 68, 69 95, 110 133, 153 163, 190 | 19, 36 52, 70 96, 111 134, 154 164, 177 | 18, 37 53, 71 97, 112 135, 137 165, 178 | 17, 38 54, 72 98, 113 136, 138 166, 179 |
| Н | 11, 44 65, 70 89, 104 127, 145 161, 185 | 10, 45 66, 71 90, 105 128, 146 162, 186 | 9, 46 67, 72 91, 106 129, 147 163, 187 | 8, 47 68, 73 92, 107 130, 148 164, 188 | 7, 48 52, 74 93,108 131,149 165,189 | 6,49 53,75 94,109 132,150 166,190 | 5,50 54,76 95,110 133,151 167,177 | 4,51 55,77 96,111 134,152 168,178 | 3,27 56,80 97,112 135,153 169,179 | 2,28 57,81 98,113 136,154 170,180 |
| О | 21,34 55,73 100,108 117,153 163,179 | 20,35 56,74 101,109 118,154 164,180 | 19,36 57,75 102,110 119,137 165,181 | 18,37 58,76 82,111 120,138 166,182 | 17,38 59,77 83,112 21,139 167,183 | 16,39 60,78 84,113 122,140 168,184 | 15,40 61,79 85,114 123,141 169,185 | 14,41 62,80 86,115 124,142 170,186 | 13,42 63,81 87,116 125,143 171,187 | 12,43 64,69 88,103 126,144 172,188 |
|
| 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| П | 6,49 65,70 90,112 136,139 169,188 | 5,50 66,71 91,113 135,140 170,189 | 4,51 67,72 92,114 134,141 171,190 | 3,27 68,73 93,115 132,142 172,177 | 2,28 52,74 94,116 131,143 173,178 | 1,29 53,75 95,103 130,144 174,179 | 25,30 54.76 96,104 129,145 175,180 | 24,31 55,77 97,105 128,146 176,181 | 23,32 56,80 98,106 127,147 155,182 | 22,33 57,81 99,107 126,148 156,183 |
| Р | 11,37 52,69 92,113 117,150 155,177 | 12,38 53,70 93,114 118,149 156,178 | 13,39 54,71 94,115 119,148 157,179 | 14,40 55,72 95,116 120,147 158,180 | 15,41 56,73 96,103 121,146 159,181 | 16,42 57,74 97,104 122,145 160,182 | 17,43 58,75 98,105 123,144 161,183 | 18,44 59,76 99,106 124,143 162,184 | 19,45 60,77 100,107 125,142 163,185 | 20,46 6178 101,108 126,141,164,186 |
| С | 21,47 65,73 101,115 117,137 165,187 | 22,48 66,74 102,116 118,138 166,188 | 23,49 67,75 82,103 119,139 167,189 | 24,50 68,76 83,104 120,140 168,190 | 25,51 52,77 84,105 121,141 169,177 | 26,50 53,78 85,105 121,141 169,177 | 25,49 54,79 86,107 123,143 171,179 | 24,48 55,80 87,108 124,144 172,180 | 23,47 56,81 88,110 125,145 173,181 | 22,46 57,69 89,111 126,146 174,182 |
| Т | 21,45 58,70 82,103 120,143 171,181 | 20,44 59,71 83,104 121,144 172,182 | 19,43 60,72 84,105 122,145 173,183 | 18,42 61,73 85,106 123,146 174,184 | 17,41 62,74 86,107 124,147 175,185 | 16,40 63,75 87,108 125,148 176,186 | 15,39 64,76 88,109 126,149 155,188 | 14,38 65,77 89,110 127,150 156,189 | 13,37 64,78 90,111 128,151 157,190 | 12,36 68,79 91,11 129,152 158,077 |
| У | 11,35 52,80 99,114 117,137 159,178 | 10,34 53,81 100,115 118,138 160,179 | 9,33 54,69 101,116 119,139 161,180 | 8,32 55,70 102,102 120,140 162,181 | 7,31 56,71 82,104 121,141 163,182 | 6,30 57,72 83,105 122,142 164,183 | 5,29 58,73 84,106 123,143 166,184 | 4,28 59,74 85,107 124,144 166,185 | 3,27 66,75 86,108 125,145 167,186 | 2,28 61,76 87,109 126,146 168,187 |
| Ф | 1,27 62,77 89,104 117,153 169,188 | 2,28 63,78 90,105 118,154 170,189 | 3,29 64,79 91,106 119,137 171,190 | 4,30 65,80 92,107 120,138 172,177 | 5,31 66,81 93,108 121,139 173,178 | 6,32 67,69 94,109 122,140 174,179 | 7,33 68,69 95,110 123,141 175,180 | 8,34 52,70 96,11 124,142 176,181 | 9,35 53,71 97,112 125,143 155,182 | 10,36 54,72 98,113 126,144 156,183 |
| Х | 26,29 62,79 100,108 136,139,173,189 | 25,30 63,80 101,109 135,140 174,190 | 24,31 64,81 102,110 134,141 175,177 | 23,32 65,69 82,111 132,142 176,178 | 22,33 66,70 83,112 131,143 155,179 | 21,34 67,71 84,113 130,144 156,180 | 20,35 68,72 85,114 129,145 157,181 | 19,36 52,73 86,115 128,146 158,182 | 18,37 53,73 87,116 127,147 159,183 | 17,38 54,75 88,103 126,148 160,184 |
| Ц | 11,44 55,73 102,109 127,140 155,177 | 10,45 56,74 82,110 128,139 156,178 | 9,46 57,75 83,111 129,138 157,179 | 8,47 58,76 84,112 130,137 158,180 | 7,48 59,77 85,113 131,137 159,181 | 6,49 60,78 86,114 132,138 160,182 | 5,50 61,79 87,115 133,139 161,183 | 4,51 62,80 88,116 134,140 162,184 | 3,27 63,81 89,103 135,141 163,185 | 2,28 64,69 90,104 136,142 164,186 |
| Ч | 21,34 65,70 90,112 127,147 157,184 | 20,35 66,71 91,113 128,148 158,185 | 19,36 67,72 92,114 129,149 159,186 | 18,37 68,73 93,115 130,150 160,187 | 17,38 52,74 94,116 131,151 161,188 | 16,39 53,75 95,103 132,152 162,189 | 15,40 54,76 96,104 133,153 163,190 | 14,41 55,77 97,105 134,154 164,177 | 13,42 56,80 98,106 135,137 165,178 | 12,43 57,81 99,107 136,138 166,179 |
| Ш | 6,49 52,69 101,115 127,145 171,181 | 5,50 53,70 102,116 128,146 172,182 | 4,51 54,71 82,103 129,147 173,183 | 3,27 55,72 83,104 130,148 174,184 | 2,28 56,73 84,105 131,149 175,185 | 1,29 57,74 85,106 132,150 176,186 | 25,30 58,75 86,107 133,151 155,188 | 24,31 59,76 87,108 134,152 156,189 | 23,32 60,77 88,110 135,153 157,160 | 22,23 61,78 89,111 136,154 158,177 |
ЗАДАНИЕ ДЛЯ КОНТРОЛЬНОЙ РАБОТЫ
-
Сколько структурных изомеров отвечает эмпирической формуле С6Н14? Напишите и назовите их по номенклатуре ИЮПАК. На примере углеводорода с двумя третичными атомами углерода рассмотрите реакции, характерные для предельных углеводородов.
-
В пчелином воске обнаружен алкан состава С31Н64 (гентриаконтан). Каково его строение, если в его молекуле остутствуют третичные и четвертичные атомы углерода? Сколько изомеров монохлорпроизводных гентриаконтана можно получить? Какие реакции характерны для этого углеводорода?
-
Сколько структурных изомеров соответствует эмпирической формуле С5Н12? Напишите и назовите их по номенклатуре ИЮПАК. На примере углеводорода с третичным атомом углеводорода рассмотрите реакции, характерные для предельных углеводородов.
-
Напишите все изомеры состава С8Н18, содержащие четвертичные атомы углерода. Сколько монохлорпроизводных будет иметь изомер, содержащий два четвертичных атома углерода? Напишите уравнения реакции монохлорирования этого изомера.
-
Напишите структурную формулу 2-метил-4-этил-4-пропилгептана и уравнение реакции его бромирования.
-
Изложите основные положения теории химического строения А.М.Бутлерова. Напишите все изомеры гептана и назовите их по номенклатуре ИЮПАК.
-
Какие хлорпроизводные могут быть получены при замещении одного атома водорода на хлор в 3,3-диметилгептане? Напишите уравнение реакций.
-
Что такое радикалы? Чем объяснить их химическую активность? Чем они отличаются от катионов и анионов? Напишите структурные формулы и названия одновалентных радикалов, соответствующих углеводороду 2,2-диметилпропану (неопентану).
-
Напишите структурные формулы всех изомерных углеводородов состава С5Н12 и дайте им названия по международной номенклатуре ИЮПАК. Выведите формулы одновалентных радикалов, соответствующих указанным углеводородам, содержащих третичный атом углерода.
-
Чем характеризуется антидетонационная устойчивость бензина? Как зависит это свойство от состава бензина и как повысить его антидетонационную устойчивость?
-
Напишите уравнение реакции нитрования 2-метилгексана и сульфохлорирования н-октана. К какому типу реакций относятся эти превращения?
-
На изобутан подействуйте бромом (в мольном соотношении 1:1). Приведите механизм этой реакции. Полученный продукт введите в реакцию с металлическим натрием. Назовите образующийся углеводород.
-
Напишите уравнение реакции взаимодействия бутана и 2-метилбутана с бромом и с азотной кислотой. Укажите условия проведения этих превращений.
-
Какой из углеводородов будет легче реагировать с разбавленной азотной кислотой в условиях реакции Коновалова: а) 3-метилпентан; б)н-гексан. Написать уравнение реакции.
-
Нефть, ее состав и основные способы переработки. Значение для народного хозяйства. Крекинг нефтепродуктов.
-
Напишите структурные формулы изомерных углеводородов состава С8Н18, содержащих самую длинную цепь из 5 атомов углерода, назовите их. Как синтезировать один из них по реакции Вюрца. Выведите для него одновалентные радикалы.
-
Напишите структурные формулы изомеров С6Н14, назовите их по номенклатуре ИЮПАК. Получите 2,3-диметилбутан по реакции Вюрца, выведите для него одновалентные радикалы.
-
По реакции Вюрца получите октан в качестве единственного продукта. Напишите соответствующие ему радикалы. Какие реакции характерны для этого углеводорода? Приведите примеры.
-
Получите 2-метилпентан из 2-метилпентин-1. Напишите соответствующие ему вторичные радикалы. Какие реакции характерны для этого углеводорода? Приведите примеры.
-
На примере 2,3-диметилбутана покажите химические свойства предельных углеводородов. Укажите тип реакции и условия, в которых возможны химические превращения.
-
Сколько монохлорпроизводных получится при хлорировании 2-метилпентана? Напишите их структурные формулы и назовите.
-
Сколько монохлорпроизводных получится при хлорировании смеси изомеров общей формулы С5Н12? Напишите их структурные формулы и назовите.
-
Сколько продуктов нитрования по Коновалову получится из 2,3-диметилгексана? Напишите уравнение реакции, назовите продукты.
-
Сколько изомеров получится при нитровании по Коновалову 2,2,3,4-тетраметилпентана? Напишите уравнения реакции, продукты назовите.
-
Цетан (С16Н34) - стандарт для реактивного топлива, содержит только первичные и вторичные атомы углерода. Сколько изомеров монохлорирования можно из него получить? Напишите уравнение реакции для получения одного из этих изомеров.
-
Парафин - смесь твердых углеводородов состава С19Н40 и С37Н76. Опишите его свойства с кислотами и щелочами.
-
В скипидаре из сосны обыкновенной находится терпен мирцен
СН3 СН2
│ │
СН3 - С = СН -СН2 -СН2-С - СН = СН2 . Напишите уравнения реакций этого
углеводорода в мольном отношении один к трем с: а) хлористым водородом;
б) водой;
в) водородом.
-
В некоторых видах скипидара найден углеводород 3,7-диметилоктатриен-1, 3, 6. Опишите свойства этого углеводорода, напишите уравнение реакции его с:
а) хлористым водородом;
б) водородом (в мольном отношении 1:3);
в) водой (в мольном отношении 1:3).
-
В смоле хвойных деревьев найден терпен лимонен. Напишите уравнение реакции этого углеводорода с: а) бромистым водородом;
б) водой;
в) водородом (в мольном отношении 1:2)
-
В
 эфирном масле хвои содержится углеводород - - терпинен СН3 . Напишите уравнения реакций этого углеводорода с:
эфирном масле хвои содержится углеводород - - терпинен СН3 . Напишите уравнения реакций этого углеводорода с:
а


 ) водой;
) водой;
б

 ) хлористым водородом;
) хлористым водородом;
в) водородом (в мольном отношении один к двум).
 СН3
СН3

Н3С СН3
-
Напишите структурные формулы возможных изомеров углеводорода С5Н10 и дайте названия по номенклатуре ИЮПАК.
-
Объясните сущность механизма реакции электрофильного присоединения по кратной связи. Напишите уравнения реакций гидратации бутена-1 и
2-метилбутена-2. Назовите образующиеся продукты.
-
Из какого олефина можно получить бутандиол-2,3? Напишите уравнения этой реакции, укажите условия ее проведения.
-
Как из 2-метилбутена-1, используя реакцию электрофильного присоединения, получить 2-метилбутен-2?
-
В эфирных маслах хмеля содержатся терпены:
СН3 - С = СН - СН2 - СН2 - С - СН = СН2 и
│ │
СН3 СН2
СН2 = С - СН2 - СН2 - СН = С - СН = СН2
│ │
СН3 СН3
Назовите их по номенклатуре ИЮПАК. Какой из этих углеводородов будет существовать в двух геометрических формах, почему?
-
Получите пентен-1 и пентен-2 из соответствующих моногалогенопроизводных. Укажите условия проведения указанных реакций.
-
Опишите возможные способы полимеризации алкенов. Напишите схему реакции полимеризации пропилена в присутствии кислотных катализаторов.
-
Напишите структурные формулы изомеров С5Н10 и дайте им названия. Как превратить 2-метилбутен-1, используя реакцию электрофильного присоединения, в 2-метилбутен-2?
-
Какие кислородосодержащие соединения можно получить при окислении метана? Напишите уравнения соответствующих реакций и укажите условия их проведения.
-
Из какого этиленового углеводорода можно получить бутандиол-2,3? Напишите уравнение реакции окисления этого олефина перманганатом калия в кислой среде.
-
Напишите изомеры диеновых углеводородов состава С5Н8. Назовите их по системе ИЮПАК. Выделите измеры с сопряженными двойными связями, напишите уравнения реакций их полимеризации и гидрирования.
-
Напишите структурные формулы алкинов и диенов, имеющих формулу С4Н5, назовите их и предложите метод удаления из их смеси бутина-1. Опишите его свойства.
-
Выведите все изомерные ацетиленовые углеводороды состава С5Н8, назовите их, напишите уравнения реакций взаимодействия 3-метилбутина-1 с водой. Укажите тип этой реакции.
-
Напишите структурную формулу 6-метилгептина-3. Сколько алкинов соответствует его углеродному скелету? Приведите уравнения реакций взаимодействия 6-метилгептина-1 с водой, хлором.
-
Каким способом можно получить 3-метилбутин-1? Напишите уравнение реакции взаимодействия его с водой.
-
Напишите схемы реакции ступенчатого гидрирования 2,5-диметилгексина-3. Возможна ли геометрическая изомерия для алкена, полученного на первой стадии гидрирования?
-
Напишите уравнения реакций присоединения к изопрену брома, бромистого водорода, если углеводород и реагенты взяты в соотношении 1:2..
-
Каким образом можно получить изопрен? Напишите схему полимеризации изопрена. Какое строение имеет природный каучук? Каково его применение?
-
В чем сущность кетоенольной таутомерии? Напишите уравнения реакций гидратации бутина-1 и бутена-1. Объясните особенности этих реакций.
-
Напишите схему реакции димеризации ацетилена в присутствии кислотных катализаторов. В чем основное различие в свойствах алкенов и алкинов?
-
Напишите уравнения реакций, обеспечивающих получение хлоропрена и ацетилена. Какое применение находит хлоропрен?
-
Укажите на сходство и различие в механизмах электрофильного присоединения к -связи этиленовых углеводородов и электрофильного замещения в бензольном ядре. Напишите реакцию алкилирования толуола хлористым этилом и укажите на условия, при которых она протекает.
-
Напишите все изомеры ароматического соединения С9Н10 и дайте им названия по номенклатуре ИЮПАК.
-
Какое строение имеет углеводород ароматического ряда общей формулы С8Н10, если при его окислении хромовой смесью была получена терефталевая кислота, а при окислении в более мягких условиях образуется п-толуиловая кислота?
-
Напишите уравнения реакций нитрования бензола, толуола, хлорбензола и нитробензола. Сравните реакционную способность этих соединения.
-
Как из бензола можно получить бензойную кислоту? Напишите уравнения соответствующих реакций.
-
Напишите три возможные направления реакции
С6Н5-СН3 + С12 и условия их реализации.
-
Напишите структурные формулы всех изомерных углеводородов ряда бензола, состава С8Н10. Назовите их. Осуществите реакцию сульфирования этилбензола с получением соответствующей моноарилсульфокислоты. Объясните ориентирующее действие заместителя. Каков тип этой реакции?
-
Выведите формулы изомерных диэтилбензолов. Сколько изомеров получится при мононитровании 1,4-диэтилбензола? Напишите уравнение реакции. В каких условиях она протекает?
-
Сколько изомеров ряда бензола соответствует составу С9Н12? Напишите их структурные формулы, назовите. Осуществите реакцию радикального и электрофильного монохлорирования изопропилбензола.
-
Напишите структурную формулу этилбензола. Сколько изомеров мононитропроизводного из него можно получить? В каких условиях протекает реакция нитрования?
-
Установите строение углеводорода С8Н6, обеспечивающего бромную воду, образующего осадок с аммиачным раствором оксида серебра, а при окислении дающего бензойную кислоту. Напишите уравнения соответствующих реакций.
-
Действием каких реагентов и в каких условиях можно осуществить следующие превращения?
С6Н5-СН2СН3 → Вг -СН2СН3 → С6Н5 - СН (Вг) - СН3
Приведите типы соответствующих реакций.
-
Какие соединения легче нитруются до тринитропроизводного: мета-динитробензол или 2,4-динитротолуол? Объясните почему, напишите уравнения реакций.
-
Установите строение вещества состава С7Н8, если оно легко нитруется, образуя два изомера состава С7Н7-NО2, а при окислении образует бензойную кислоту. Приведите уравнения реакций.


 СН = СН2
СН = СН2
-
С

 тирол (фенилэтилен) - продукт многотоннажного промышленного производства. Опишите его свойства. Напишите для него уравнения реакций: а) с хлористым водородом;
тирол (фенилэтилен) - продукт многотоннажного промышленного производства. Опишите его свойства. Напишите для него уравнения реакций: а) с хлористым водородом;
б) с хлором;
в) исчерпывающего гидрирования;
г) полимеризации.
-
На примере этилбензола рассмотрите химические свойства ароматических углеводородов. Напишите уравнения реакций, назовите продукты.
-
Из бензола получите бромбензол и объясните, почему он не взаимодействует со щелочами подобно бромистому этилу?
-
Напишите уравнения реакций получения из 2-бромбутана 2-аминобутана и бутанола-2. В каких условиях протекают эти реакции? Сравните активность 2-бромбутана с активностью 1-бромбутана. Дайте объяснения.
-
Напишите схему превращения хлористого аллила в глицерин.
-
Для хлористого метила напишите уравнения реакций нуклеофильного замещения со следующими реагентами: а) этилат натрия; б) уксуснокислый натрий; в) диметиламин. Какие реакции называются нуклеофильными?
-
Для 2-хлорпропана напишите реакции нуклеофильного замещения со следующими реагентами: а) натриевая соль муравьиной кислоты; б) этиламин; в) нитрит натрия. Какие реагенты называются нуклеофильными?
-
Напишите уравнение реакции получения изопропилового эфира уксусной кислоты, используя соответствующее галогенопроизводное углеводорода.
-
Опишите свойства галогенопроизводных углеводородов. Какое галогенопроизводное (1-бромбутан или 2-метил, 2-бромпропан) легче подвергается гидролизу?
-
Опишите свойства галогенопроизводных углеводородов. Почему хлорбензол не вступает в реакцию нуклеофильного замещения в обычных условиях?
-
Напишите изомеры с нормальным строением углеводородного скелета С4Н9Вг и сравните их реакционную способность в реакциях нуклеофильного замещения.
-
Напишите изомеры состава С4Н7Сl. Какой изомер более реакционноспособен в реакции замещения? Осуществите для него все известные вам реакции нуклеофильного замещения.
-
Опишите химические свойства хлорбензола и хлористого бензила. Как объяснить наблюдаемое различие свойств этих веществ в реакциях нуклеофильного замещения?
-
Какие из известных вам галогенопроизводных имеют практическое применение в сельском хозяйстве? Напишите уравнения реакций получения на основе фенола, 2,4 D-кислоты и ее эфиров.
-
Напишите формулу дигалогенопроизводного и реакции его превращений, если после отщепления от него двух молекул хлорводорода в спиртовом растворе щелочи образуется соединению, гидратация которого по Кучерову приводит к образованию бутанона-2.
-
Напишите уравнения реакций, при помощи которых можно из 1-бромбутана получить 2-бромбутан.
-
В чем заключается основное различие химических свойств одноатомных и многоатомных спиртов? Напишите соответствующие уравнения реакций. Как можно, исходя из пропилена, получить глицерин?
-
На пропанол-2 подействуйте последовательно:
СН3 - СН - ОН + НВг А + КСN В + Н2О + КОН С + СН3СН2С1 D
│
СН3
Напишите уравнения соответствующих реакций.
-
Какой тип изомерии возможен для бутантриола-1, 2, 3? Напишите уравнения реакций взаимодействия этого спирта в соотношении 1: 3 с азотной кислотой; линолевой кислотой; бромистым водородом.
-
Напишите уравнения реакций взаимодействия 3-метилбатнола-2 с РС15; с уксусной кислотой; бромистым водородом; хлорангидридом уксусной кислоты. К какому типу реакций принадлежат указанные превращения?
-
Дайте название веществу: ОН


СН3 - С - С = С - СН3

СН3
Напишите уравнение реакции его получения с использованием ацетона и одного из
гомологов ацетилена.
-
Напишите уравнения реакций последовательных превращений:
O
║
СН3СН2ОН + РС15 А + СН3NН2 В + NаОН С + СН3С - С1 D
Назовите полученные вещества.
-
Какие из пропанол-1 получить пропиловый эфир изомасляной кислоты? Напишите уравнение соответствующей реакции. К какому типу относится эта реакция?
-
Напишите изомеры вторичных и третичных спиртов, которые соответствуют общей формуле С5Н11ОН. Какими реакциями можно отличить первичные спирты от вторичных? Проиллюстрируйте примерами.
-
Какие соединения называются кислотами по классификации Бренстеда?
-
Напишите схему образования сложного эфира из масляной кислоты и спирта, полученного в результате щелочного гидролиза 1-бромбутана. Какие катализаторы используются в реакции этерификации?
-
Напишите уравнение реакции образования сложного эфира (тристеарина) из стеариновой кислоты и спирта, полученного в результате щелочного гидролиза 1, 2, 3-трихлорпропана. Какова биологическая роль глицероидов?
-
Напишите уравнения реакции образования сложного эфира из олеиновой кислоты (триолеин) и спирта, полученного в результате щелочного гидролиза 1, 2, 3-трихлорпропана. Как используются такие соединения в промышленности?
-
Напишите схемы реакций получения различными способами этилтребутилового эфира.
-
Напишите уравнения реакций взаимодействия пропанола-2 с: 1) уксусным альдегидом; 2) хлорангидридом пропионовой кислоты; 3) пятихлористым фосфором.
-
Выделяемый из хвойной смолы терпен - лимонен при обработке 60% серной кислотой превращается в двухатомный спирт терпин, который находит применение в медицине и парфюмерии. Напишите реакцию образования этого спирта и получите от него сложный эфир (диацетат) с уксусной кислотой.
-
Опишите химические свойства фенолов. Какие реакции отличают их от спиртов? Объясните, почему пропанол-2 при нагревании с концентрированной азотной кислотой превращается в ацетон, а фенол дает тринитрофенол? Приведите уравнения реакций.
-
Как изменяются кислотные свойства фенола при введении в ядро нитрогруппы? Объясните причину этих изменений.
-
Напишите структурные формулы и назовите двух и трехатомные фенолы. Укажите их применение.
100.Напишите уравнения реакций трех способов получения фенола из бензола.
101.Напишите уравнения реакций взаимодействия фенола со щелочью, бромной водой, хлорангидридом уксусной кислоты. Назовите образующиеся соединения.
102.Какие соединения образуются при взаимодействии n-крезола с : а) азотной кислотой, б) бромом, в) уксусным ангидридом. Напишите соответствующие уравнения реакций и назовите продукты.
103.Вещество С4Н8О взаимодействует с гидроксиламином, цианистым водородом, но не дает реакции серебряного зеркала. Определите строение вещества С4Н8О.
104.Вещество С3Н6О взаимодействует с цианистым водородом, гидразином, но не дает реакции серебряного зеркала. Каково его строение?
105.Вещество С4Н8О взаимодействует с цианистым водородом, гидразином, дает реакцию серебряного зеркала, превращаясь в изомасляную кислоту. Определите его строение.
106.Вещество С3Н6О взаимодействует с цианистым водородом, гидразином, полимеризуется при нагревании. Определите его строение.
107.Напишите структурные формулы изомерных альдегидов и кетонов состава С5Н10О. Назовите их по номенклатуре ИЮПАК. Для одного из изомеров напишите уравнение реакции альдольной конденсации.
108.Получите 2-метилгексаналь окислением соответствующего спирта. Напишите для него уравнения реакций с хлором, пятихлористым фосфором, гидроксиламином, цианистым водородом.
109.Расположите соединения в ряд по уменьшению активности в нуклеофильных реакциях:
О О О О
СН3СН2С ; СН3СНС ; СН3СС12С ; СН3 - СН - С
Н Н Н Н
С1 СН3
110.Напишите уравнения реакций: а)полимеризации формальдегида; б)конденсации формальдегида с диэтилкетоном (пентанон-3); в)гидрирования формальдегида.
111.Опишите свойства кетонов. Получите из метилэтилкетона (бутанон-2): а) батан,
б) бутанол-2; в) гидразон.
112. Получите ацетон окислением соответствующего спирта. Напишите для него уравнения соответствующих реакций с гидразином, цианистым водородом, хлором, пятихлористым фосфором.
113.Напишите формулу оксосоединений С5Н10О и дайте им названия. Какое из указанных соединений при окислении может давать смесь уксусной и пропионовой кислот?
114.Напишите реакцию альдольной конденсации, ведущей к образованию коричного альдегида. Какие условия необходимы для ее протекания?
115.Напишите уравнения реакций, позволяющих выделить из смеси н-пропилового спирта, пропионового альдегида и пропионовой кислоты пропионовый альдегид. К какому типу относятся эти реакции?
116.Напишите уравнения реакций между: 2-метилпентанон-3 и фенилгидразином; изомасляным альдегидом и гидразином (в щелочной среде); пропионовым альдегидом и метилацетиленом (пропином).
117.Напишите структурные формулы всех изомерных монохлорвалериановых кислот. Назовите их, расположите в ряд по увеличению кислотности.
118.Какие соединения называются карбоновыми кислотами? Какие особенности строения обуславливают их кислые свойства и почему? Расположите в ряд по возрастанию силы следующие кислоты: пропионовую, -нитропропионовую, -нитропропионовую и нитроуксусную.
119.В ряду производных карбоновых кислот реакционная способность в нуклеофильных реакциях падает: хлорангидрид ангидрид сложный эфир амид анион кислоты. С чем это связано? Приведите примеры.
120.Напишите формулы этандиовой, пропандиовой-1,3, бутандиовой-1,4, пентандиовой-1,5 кислот и приведите их тривиальные названия. Для каких из указанных кислот характерны реакции внутримолекулярной дегидратации? Приведите примеры.
О О О
121.Осуществите следующие превращения: СН3С СН3С СН3С
О О О Н ОН С1
СН3С СН3С СН3С
О ОС3Н7NH2
CН3С
О
122.Молочная кислота, ее строение, изомерия. Напишите реакции взаимодействия молочной кислоты с: металлом, хлорангидридом уксусной кислоты, пятихлористым фосфором.
123.Напишите проекционные формулы оптических антиподов яблочной кислоты. Напишите уравнения реакций: 1) окисления яблочной кислоты, 2) взаимодействия с метанолом, хлорангидридом уксусной кислоты, пятихлористым фосфором.
124.Выведите проекционные формулы стериоизомеров, входящих в состав виноградной кислоты. Напишите уравнения реакций взаимодействия одного из стериоизомеров с едким кали, этанолом, хлорангидридом пропионовой кислоты.
125.Изомерия и химические свойства фталевых кислот. Получите фталевый ангидрид, подействуйте на него избытком метанола. Каково химическое строение полученного репеллента (средства, отпугивающего насекомых)?
126.Напишите цис- и трансизомеры и бутен-2-диовой кислоты и уравнения реакций взаимодействия этих изомеров с хлористым водородом, водородом в присутствии никелевого катализатора, избытком метилового спирта.
127.Объясните, почему реакции нуклеофильного присоединения к карбонилу, характерные для альдегидов и кетонов, не протекают по карбонилу карбоксильной группы.приведите примеры реакций нуклеофильного замещения, характерные для карбоновых кислот и их производных.
128.Стереоизомерия оксикислот. Напишите проекционные формулы стереоизомеров молочной и яблочной кислот. Какое биологическое значение они имеют?
129.Предложите схему синтеза малоновой кислоты из уксусной.
130.Какие соединения образуются при нагревании каждой из нижеперечисленных кислот выше температуры их плавления: щавелевой, малоновой, метилмалоновой, янтарной и глутаровой. Напишите соответствующие уравнения реакций.
131.Напишите уравнения реакций взаимодействия масляной кислоты с аммиаком,хлором, пятихлористым фософором, этиленгликолем.
132.Напишите уравнения реакций взаимодействия: а) бензойной кислоты с изопропиловым спиртом; б) салициловой кислоты с уксусным ангидридом; в)молочной кислоты с хлорангидридом уксусной кислоты. Укажите условия проведения реакций.
133.Что такое мыла? Напишите реакции получения мыла из жиров и из парафинов.
134.Что такое «высыхающие» и «невысыхающие» масла? Какие химические реакции протекают при «высыхании» натуральной олифы?
135.Напишите реакции: омыление триолеата глицерина; гидрогенизации триолеата глицерина. Укажите условия протекания указанных реакций.
136.Что такое сложные липиды? Их функции в живых организмах. Напишите уравнение реакции гидролиза кефалина (фосфатидидилэтаноламина).
137.Рассмотрите вопрос о циклоцепной таутомерии углеводов на примере D-фрктозы. Напишите уравнение реакции взаимодействияметанола с -D-фруктопиранозой. Назовите образовавшийся продукт.
138.Как из альдогексозы получить кетогексозу? Объясните механизм этого превращения на примере D-галактозы.
139.Напишите уравнения реакций окисления и восстановления D-рибозы. Назовите полученные продукты.
140.Напишите уравнения реакций гидролиза мальтозы и сахарозы. Возможна ли мутаротация этих дисахаридов? Для дисахарида обладающего мутаротацией, напишите схему перехода -формы в -форму.
141.Напишите структурные формулы лактозы и сахарозы и объясните, почему лактоза восстанавливает жидкость Фелинга, а сахароза не восстанавливает.
142.Напишите схемы гидролиза крахмала и целлюлозы. Какие моносахара получаются при полном гидролизе? Каково практическое значение указанных полисахаридов?
143.Гликозиды, их строение и роль в природе. Напишите уравнения реакций образования метил--D-рибофуранозида, фенил--D-глюкопиранозида, бензил--D-фруктофуранозида.
144.Напишите уравнения реакций взаимодействия фруктозы с гидроксиламином, фенилгидразином, ангидридом уксусной кислоты, водородом в присутствии никеля.
145.Целлюлоза, ее строение, химическая переработка, биологическая роль. Эфиры на основе целлюлозы и их применение.
146.Целлобиоза, строение и свойства. Гидролиз, циклоцепная таутомерия.
147.Пентозаны, нахождение в природе, строение, гидролиз, циклоцепная таутомерия пентоз.
148.Сахароза, ее получение, строение. Инверсия сахарозы.
149.Мальтоза, ее строение, свойства, гидролиз. Циклоцепная таутомерия.
150.Глюкоза, нахождение в природе, строение, мутаротация, взаимодействие с метанолом в присутствии хлористого водорода.
151.Крахмал, его строение и гидролиз, биологическая роль. Различия между амилозой и амилопектином.
152.Глюкоза, строение. Восстановление и окисление глюкозы, взаимодействие с этиловым спиртом (в присутствии хлористого водорода) и уксусным ангидридом.
153.Ксилоза, нахождение в природе, строение. Напишите уравнения реакций, подтверждающих наличие в ксилозе карбонильной группы, гликозидного и спиртовых гидроксилов.
154.Рибоза и дезоксирибоза, их биологическая роль, строение, свойства.
155.Какие соединения называются аминами? Напишите уравнения реакций взаимодействия этиламина с соляной кислотой, азотистой кислотой, хлорангидридом уксуной кислоты, хлористым этилом.
156.Ароматические амины. Напишите уравнения реакций взаимодействия анилина: а) с серной кислотой с образованием кислой соли; б) водородом в присутствии никеля.
157.При действии азотистой кислоты на амин состава С4Н11N образовался спирт и выделился азот. Написать структурные формулы возможных изомеров исходного амина и дать им названия.
158.Напишите формулы всех аминов, которые могут получиться при действии аммиака на йодистый этил, и назовите их.
159.Из каких альдегидов и кетонов и каким образом можно получить: изопропиламин; 2-аминобутан? Напишите уравнение соответствующих реакций.
160.Из каких альдегидов и кетонов можно получить следующие амины:2-аминопентан; 2-амино, 3-метилбутан? Напишите уравнения соответствующих реакций.
161.Напишите уравнения реакций взаимодействия изопропиламина с йодистым этилом, хлористым ацетилом, уксусным ангидридом.
162.Влияние строения молекулы на основные свойства аминов. Напишите перечисленные ниже соединения в порядке усиления их основных свойств: метиламин, триметиламин, анилин.
163.Мочевина, ее применение в народном хозяйстве, получение, свойства. Напишите уравнение реакции гидролиза мочевины.
164.Амфотерные свойства аминокислот. Напишите уравнения реакций взаимодействия глицина с NаОН, НС1, хлорангидридом уксусной кислоты.
165.Аспарагиновая кислота, ее свойства и значение. Напишите уравнения реакций взаимодействия аспарагиновой кислоты со щелочью, соляной кислотой, хлорангидридом уксусной кислоты.
166.Аминокислоты и их биологическая роль. Напишите уравнения реакций взаимодействия серина со щелочью, соляной кислотой, азотистой кислотой, хлорангидридом уксусной кислоты.
167.Приведите примеры аминокислот. Содержащих ароматические циклы. Напишите уравнение реакции образования дипептида из триптофана и глицина.
168.Напишите уравнение реакции образования трипептида из глицина, алаина и фенилаланина.
169.Напишите уравнение реакции взаимодействия аланина с азотистой кислотой, ангидридом уксусной кислоты, гидроксидом натрия в водном растворе..
170.Напишите реакцию межмолекулярной дегидратации двух молекул глицина с выделением двух молекул воды.
171.Напишите структурные формулы и дайте названия изомерным аминокислотам состава С5Н11О2N. Для каких изомеров возможна стереоизомерия?
172.Диамины. Их биологическая роль. Напишите уравнение реакции ферментативного декарбоксилирования диаминокислоты. Назовите продукты реакции.
173.Напишите уравнения реакций взаимодействия -аминопропионовой кислоты (аланина) с водным растворов КОН (при комнатной температуре); с соляной кислотой; йодистым метилом; уксусным ангидридом.
174.Белки. Первичная, вторичная и третичная структуры белковых молекул. Напишите уравнения реакций гидролиза глицилвалилаланина.
175.Пептиды, их биологическая роль. Напишите уравнение реакции гидролиза цистеилсерилаланилглицина.
176.Белки, их биологическая роль, строение. Напишите формулу тетрапептида глицилаланилсерилглицина и проведите его гидролиз.
177.Пиррол, нахождение в природе, строение, свойства.
178.Хлорофилл. Его строение и роль в жизни растений.
179.Пиримидин и его природные производные. Их биологическое значение.
180.Понятие и гетероциклических соединениях. Индол и его природные производные, их биологическое значение.
181.Получите из фурана: а) пиррол; б) пирролидин. Напишите уравнения реакций, укажите условия их проведения.
182.Сопоставьте основные свойства пиридина и пиперидина; пиррола и пиридина. Проиллюстрируйте соответствующими реакциями.
183.Напишите схемы образования и формулы рибонуклеозидов: а) уридина; б)цитидина; в)аденозина.
184.Производные индола, их биологическое значение и основные химические реакции: гетероаукусин, триптофан, серотонин.
185.Нуклеиновые кислоты и их биологическая роль. Напишите уравнения реакции образования нуклеотида из урацила, -D-рибозы и фосфорной кислоты.
186.Рибонуклеиновые кислоты, их биологическая роль. Напишите уравнение реакции образования нуклеотида из аденина, -D-рибозы и фосфорной кислоты.
187.Дезоксирибонуклеиновые кислоты, их биологическая роль. Напишите уравнение реакции образования нуклеотида из гуанина, -D-дезоксирибозы и фосфорной кислоты.
188.Какие продукты образуются при гидролизе сложных белков нуклеопротеидов? Напишите уравнение реакции гидролиза нуклеотида, состоящего из урацила, рибозы и фосфорной кислоты.
189.Биологическая роль нуклеиновых кислот. Напишите уравнение реакции образования нуклеотида из цитозина, -D-рибозы и фосфорной кислоты.
190.Строение пиримидина, его свойства и производные. Напишите уравнение реакции образования нуклеотида из тимина, -D-дезоксирибозы и фосфорной кислоты.
Приложение 1
Название важнейших радикалов
Радикал
Название
Радикал
Название
СН3 -
СН3-СН2-
СН3СН2СН2-
СН3СНСН3
СН3СН2СН2СН2-
СН3СН2СНСН3
СН3СНСН2-
СН3
СН3
СН3-С-
СН3
СН3
СН3-С-СН2
СН3
СН3
СН3-СН2-С-
СН3
СН2=
СН=
СН3СН=
-СН2СН2-
-СН2СН2СН2-
СН2=СН-
НС=С-
СН2=С=
СН3СН=СН-
СН2=СНСН2-
О
СН3С-
О
С6Н5С-
О
СН3С-NH -
- NH-
СН3- NH-
СН3NH-
CН2СН2-
Метил
Этил
Н-Пропил
Изопропил
Н-Бутил
втор-Бутил
Изобутил
трет-Бутил
Неопентил
трет-Пентил
Метилен
Метилидин(метин)
Этиледен
Этилен
Триметилен
Винил
Этинил
Винилиден
Пропенил
Аллил
Ацетил (аналогично «пропионил», «бутирил», «изобутерил»)
Бензоил
Ацетиламино (аналогично и для других кислотных остатков)
Анилино-
Толуидино- (приведен п-изомер)
Фенэтил
СН2=С- СН3
СН3СН2СН=СН-
CН2= С -СН2
I
CН3
СН3-
-СН2-
-СН=
-СН=СН-
(С6Н5)2СН-
(С6Н5)3С-
С6Н5-
-СН2-
S
СН3SO2
О
С
О
С
СН3О-
-О-СН2-О-
СН3- -SО2-
NH2- C- NH-
O
NH=C-
NH2
Изопропенил
I-Бутенил
Метилаллил (металлил)
Фенил
Толил (приведен п-изомер)
Бензил
Бензилиден
Стирил
Бензгидрил (можно называть и дефинилметил)
Тритил
Бифенил (приведен п-изомер)
1-Нафтил
2-Фурил
Фурфурил (но не «фурилметил» и только для 2-изомера)
Тенил (приведен 2-изомер)
Мезил
Фуроил (приведен 3-изомер)
Никотиноил
Метокси (аналогично «этокси» и вообще «алкокси», «фенокси» и т.д.)
Метилендиокси
Тозил (только для n-изомеров)
Уреидо
Амидимо
Приложение 2
Названия некоторых кислот и их радикалов
Название кислоты
Название радикала
Формула радикала
систематическое
тривиальное
Предельные алифатические монокарбоновые кислоты
Метановая
Этановая
Пропановая
Бутановая
Пентановая
Гептановая
Октадекановая
Гексадекановая
Муравьиная
Уксусная
Пропионовая
Масляная
Валериановая
Энантовая
Стеариновая
Пальмитиновая
Формил
Ацетил
Пропионил
Бутирил
Валерил
Энантоил
Стеароил
Пальмитоил
НСО-
СН3-СО-
СН3-СН2-СО-
СН3-(СН2)2-СО
СН3(СН2)3-СО-
СН3(СН2)5-СО-
СН3(СН2)10-СО-
СН3(СН2)14- СО-
Предельные алифатические дикарбоновые кислоты
Этандиовая
Пропандиовая
Бутандиовая
Пентандиовая
Гександиовая
Щавелевая
Малоновая
Янтарная
Глутаровая
Адипионовая
Оксалил
Малонил
Сукцинил
Глутарил
Адипоил
-ОС-СО-
-ОС-СН2-СО-
-ОС-(СН2)2-СО-
-ОС-(СН2)3-СО-
-ОС-(СН2)4-СО-
Непредельные алифатические кислоты
Пропеновая
2-Метилпропеновая
транс-Бутен-2-овая
цис-Октадецен-2-овая
цис-Бутен-2-диовая
трас-Бутен-2-диовая
Акриловая
Метакриловая
Кротоновая
Олеиновая
Малеиновая
Фумаровая
Акрилоил
Метакрилоил
Кротоноил
Олеиол
Малеолил
Фумароил
СН2=СН-СО-
СН2=С(СН3)-СО-
СН3СН=СНСО-
С15Н29СО-
ОС-СН=СН-СО-
Карбоциклические кислоты
Бензолкарбоновая
Метилбензолкарбоновая
1,2-Бензол-дикарбоновая
Бензойная
Толуиловая
Фталевая
Бензоил
Толуил (о-, м-, п-)
Фталоил
С6Н5-СО-
СН3-С6Н4-СО-
СО-
СО-
Приложение 3
Основные классы органических соединений
Углеводороды
Предельные
Непредельные
этиленовые
ацетиленовые
диеновые
Ароматические
1
2
3
4
5
6
Общая формула
СnH2n+ 2
CnH2n
CnH2n-2
CnH2n-2
CnHn
Тип связи
-С-С-
С=С
-С=С-
-С=С=С-
окончание
АН
ЕН
ИН
ДИЕН
Основные типы реакций
1.Замещение водорода
а) на галогены
б) на нитрогруппу (реакция Коновалова)
-
Присоединение
а) водорода
б) галогенов
в) галогеноводородов
г) воды (для ацетиленовых это реакция Кучерова)
-
Окисление в присутствии Н2О
-
Полимеризация
1.Замещение водорода
а) на галоген
б) на нитрогруппу
2.Присоединение
а)водорода
б)галогена
Образование эфиров и ангидридов
R - OH + HO - R R - O - R
Cпирт спирт простой эфир
O
R - C О
OH + HO - R C - O -R
Кислота спирт сложный эфир
O O O O
R - C - OH + HO - C - R R - C - O - C - R
Кислота кислота ангидрид
Спирты
Альдегиды
Кетоны
Карбоновые кислоты
Амины
7
8
9
10
11
Общая формула
R - (OH)n
O
R - C
H
R - C - R
O
R - COOH
R - NH2
Тип связи
Окончание
ОЛ
АЛЬ
ОН
ОВАЯ
АМИН
Основные типы реакций
1.Замещение
а) водорода гидроксила на щелочной металл (алкоголята)
б) всего гидроксила на галоген (с РС15)
в) всего гидроксила на аминогруппу
(с NН3)
2.Окисление
а) первичные спирты в альдегиды
б) вторичные спирты в кетоны
3.Образование эфиров
а) простых
б) сложных
4.Для многоатомных спиртов с Сu(OH)2
5.Фенолы с NaOH
1.Окисление
а) кислородом воздуха
б) Ag2О (реакция серебряного
зеркала)
в) Сu(ОН)2
качественные реакции на альдегиды
2.Замещение кислорода на галоген (с РС15)
3.Присоединение
а) водорода
б) НСN
в) NaHSO3
г) спирта
к кислороду присоединяется всегда водород, а вся остальная часть молекулы к углероду
4.Полимеризация
5.Поликонденсация
1.Диссоциация
2.Замещение
а) водорода карбоксила на металл (соли)
б) гидроксила карбоксила на галоген (с РС15)
в) гидроксила карбоксила на аминогруппу (амиды)
3.Образование ангидридов
4.Образование сложных эфиров
-
С Н2О (гидроксиды)
2. С кислотами (соли)
Образование дисахаридов
-
-глюкоза + -глюкоза, связь -1,4----мальтоза
-
-глюкоза + -глюкоза, связь -1,4----целлобиоза восстанавливающие сахара
-
-глюкоза + галактоза, связь -1,4---лактоза
-
-глюкоза + -фруктоза, связь , -1,2---сахароза } невосстанавливающий сахар
Приложение 4
Перечень необходимых приборов, посуды и реактивов
Занятие № 1
Тема занятия: «Знакомство с лабораторным оборудованием и техникой безопасности»
-
Журнал по технике безопасности.
-
Столы, полочки, табуреты (не менее 25 шт.), доска, медиапроектор.
-
Химическая посуда:
-
Стеклянная посуда: биологические пробирки для опытов, химические стаканы, плоскодонные колбы, колбы Вюрца, конические колбы (на 250, 100 мл), бюксы, часовые стекла пипетки, бюретки.
-
Мерная посуда: мерные колбы на 100 мл, пипетки, бюретки, мерные цилиндры, мензурки.
-
Фарфоровая посуда: чашка для выпаривания, тигель для прокаливания, воронка Бюхнера для фильтрования под давлением, ступка с пестиком.
-
4. Штатив для пробирок, штатив металлический.
5. Спиртовка.
-
6. Щипцы для тиглей.
-
7. Ерши для мытья посуды (пробирок)
Занятие № 2
Тема занятия: «Эквивалент»
-
Оборудование: прибор для определения эквивалента, штатив металлический, колба Вюрца, колба Эрленмейера на 1л, пробки, стеклянные газоотводные трубки, зажимы, стакан-приемник на о,5 л или конические колбы на 250 мл, цилиндры на 250 мл, барометр, термометр, склянки для соляной кислоты (1:1) на 500 мл.
-
Реактивы: цинк гранулированный металлический (мелкий), соляная кислота (1:1)
Занятие № 3
Тема занятия «Кинетика и химическое равновесие»
1. Оборудование: металлический штатив (17 шт), бюретки (32 шт), склянки под КIO3 и Na2SO3 пробирки (по 8 шт. в штатив), штативы для пробирок (15 шт.), фарфоровые стаканы для NH4C1 капельницы для насыщенных растворов FeC13, NH4CNS, секундомеры, термометр, плитки электрические фарфоровые,. Баня для нагревания пробирок, снег, миллиметровка, стаканчики на 50 или 100 мл для получения Fe(CNS)3.
2.Реактивы: KIO3 - 3,9 г на 1 л воды дистиллированной
Na2SO3 - 1г Na2SO3 + крахмал + 1 мл H2SO4(конц.) на 1 л дист. воды
FeC13 - концентрированный раствор (капельница)
NH4CNS - концентрированный раствор (капельница)
NH4C1 - кристаллический
Дистиллированная вода в бюретки.


