- Преподавателю
- Химия
- Календарно-тематическое планирование по подготовке к ГИА 2014 по химии
Календарно-тематическое планирование по подготовке к ГИА 2014 по химии
| Раздел | Химия |
| Класс | - |
| Тип | Рабочие программы |
| Автор | Потапова Т.Ю. |
| Дата | 13.11.2013 |
| Формат | doc |
| Изображения | Есть |
МОУ РУССКО-БЕКТЯШКИНСКАЯ СОШ
ПРОГРАММА
Подготовка к государственной итоговой аттестации по химии
9 класс

учитель химии
высшей категории
ПОТАПОВА
ТАТЬЯНА ЮРЬЕВНА
2013-2014г
2014
Пояснительная записка
Данный курс предназначен для учащихся 9 классов, выбравших химию, как предмет для сдачи экзамена в форме ГИА. Он также может быть использован для расширения и углубления знаний учащихся, проявляющих интерес к науке. Курс построен таким образом, что позволяет расширить и углубить знания учащихся по всем основным разделам школьного курса химии основной школы, а также ликвидировать возможные пробелы. Содержание курса предназначено для овладения теоретическим материалом и отработки практических навыков решения заданий частей А, В, С контрольно-измерительных материалов.
Цель курса: создать условия для подготовки учащихся к государственной итоговой аттестации, для творческой самореализации и удовлетворения познавательного интереса к химии.
Основные задачи курса:
-
Закрепить, систематизировать и расширить знания учащихся по всем основным разделам курса химии основной школы.
-
Формировать навыки аналитической деятельности, прогнозирования результатов для различных вариативных ситуаций.
-
Ознакомить учащихся с алгоритмами решения типовых расчетных задач, закрепить знания и расчетные навыки учащихся при их решении.
-
Развивать познавательный интерес, интеллектуальные способности в процессе поиска решений.
Формы контроля:
1.Многовариантное разноуровневое тематическое и комбинированное тестирование
2.Самостоятельная работа учащихся на уроке и дома.
3.Тестирование онлайн-обучения 100ege.ru , ege.yandex.ru/chemistry-gia/
Курс рассчитан на 34 часа. Занятия проводятся после уроков 1 раз в неделю.
Предмет: Химия
Учитель: Потапова Татьяна Юрьевна
День проведения занятий: понедельник
Время проведения занятий: 13.30 - 14.30
Количество часов на год: 34 часа
Формы контроля: Работа с тестами ГИА, проведение диагностических и тренировочных работ
Учащиеся должны знать.
-
Определения понятий: «химическая реакция», «окислитель», «восстановитель», «окисление», «восстановление», «электролит», «неэлектролит», «электролитическая диссоциация», «сильный электролит», «слабый электролит». Понимать сущность процесса электролитической диссоциации.
-
Основные положения теории электролитической диссоциации.
-
Определения кислот, щелочей и солей в свете теории электролитической диссоциации.
-
Химические свойства кислот, оснований, оксидов и солей.
-
Основные приемы решения расчетных задач различных типов.
Учащиеся должны уметь.
-
Пользоваться таблицей растворимости.
-
Составлять уравнения электролитической диссоциации кислот, щелочей и солей.
-
Составлять уравнения реакций иного обмена, понимать их сущность. Определять возможность протекания реакции иного обмена.
-
Составлять уравнения реакций, характеризующих химические свойства кислот, оснований, оксидов и средних солей в молекулярном и ионном виде.
-
Определять окислители и восстановители, отличать окислительно-восстановительные реакции от других типов реакций, расставлять коэффициенты в окислительно-восстановительных реакциях методом электронного баланса.
-
Отличать ионы и атомы.
-
Решать типовые расчетные задачи.
Используемые пособия:
1) Учебники: Химия 8, авт. Габриелян О.С.
2). Химия 9, авт. Габриелян О.С.
3) ГИА. Химия. Тематические тесты для подготовки к ГИА В.Н. Доронькин, А.Г. Бережная, Т.В. Сажнева, В.А Февралева, Легион, Ростов-на-Дону, 2013
ИНФОРМАЦИЯ
О двух экзаменационных моделях проведения ГИА по химии 2014 года
В 2014 году на выбор органов управления образованием субъектов РФ
предложены две модели экзаменационной работы по химии,
принципиальное различие которых заключается только в способах
предъявления практико-ориентированных заданий части 3:
*модель 1 без изменений повторяет экзаменационные модели
предыдущих лет;
*модель 2 предусматривает выполнение реального химического
эксперимента (задания С3 и С4).
Представление об особенностях построения этих моделей
экзаменационной работы и формах предъявления в них указанных выше
заданий дают Спецификация и Демонстрационные варианты №1 и №2
контрольных измерительных материалов для проведения в 2014 году
государственной (итоговой) аттестации (в новой форме) по ХИМИИ
обучающихся, освоивших основные общеобразовательные программы
основного общего образования
Обращаем внимание на то, что организация ГИА по химии в
соответствии с экзаменационной моделью 2 предполагает проведение
большой подготовительной работы, как с точки зрения подготовки
специалистов, принимающих участие в проведении экспериментальной части
экзамена, так и с позиции обеспечения аудиторий-лабораторий в ППЭ
необходимым лабораторным оборудованием и реактивами.
Поэтапный план подготовки к ГИА по химии
2013 - 2014 учебный год
9 класс
№
Место данного
вопроса в системе уроков
Тема урока
Код контролируемого элемента
Результативность
Дата
1
Новая структура ГИА по химии в 2014 году
01.10.2013
2
8 класс (тема 1, 1-3 уроки)
Строение атома. Строение
электронных оболочек
атомов первых 20 элементов
Периодической системы
Изотопы как разновидности атомов химического элемента.
Электроны. Строение электронных оболочек атомов химических элементов.
А1
Учащиеся выполняют задания А1
08.10.2013
3
8 класс (тема 1,
4 урок)
Периодический закон и периодическая система химических элементов Д.И.Менделеева
А2
Учащиеся выполняют задания А2
15.10.2013
4
8 класс (тема 1,
5-8 уроки)
Строение молекул. Ионная связь.
Ковалентная неполярная химическая связь.
Ковалентная полярная химическая связь.
Металлическая связь.
А3
Учащиеся выполняют задания А3
22.10.2013
5
8 класс (тема 3,
1 урок)
Валентность химических
элементов. Степень
окисления химических
А4
Учащиеся находят степень окисления элементов в веществе
29.10.2013
6
8 класс (тема 3,
2-7урок)
Простые и сложные
вещества. Основные классы
неорганических веществ.
Номенклатура
неорганических соединений
А5
Учащиеся выполняют задания А5
05.11.2013
7
8 класс (тема 4,
1, 5-8 урок)
Химическая реакция. Условия
и признаки протекания
химических реакций.
Химические уравнения.
Сохранение массы веществ
при химических реакциях.
Классификация химических
реакций по различным
признакам: числу и составу
исходных и полученных
веществ, изменению степеней
окисления химических
элементов, поглощению и
выделению энергии :
Реакции разложения.
Реакции соединения.
Реакции замещения.
Реакции обмена. Термохимические реакции
А6
Учащиеся выполняют задания А6
12.11.2013
8
8 класс (тема 6, 2,3 урок)
Электролиты и неэлектролиты. Катионы и анионы.
Основные положения теории электролитической диссоциации.
А7
Учащиеся выполняют задания А7
19.11.2013
9
8 класс (тема 6,
4 урок)
Ионные уравнения реакций и
условия их осуществления
А8
Учащиеся выполняют задания А8
26.11.2013
10-12
8 класс (тема 6,
14,15 урок)
9 класс (тема 1, 3,4 урок)
9 класс (тема 3, 2 урок)
9 класс (тема 3, 3 урок)
9 класс (тема 3, 6 урок)
9 класс (тема 3, 7 урок)
9 класс (тема 3, 10 урок)
9 класс (тема 3, 15 урок)
9 класс (тема 3, 17 урок)
9 класс (тема 3, 19 урок)
Свойства простых веществ - металлов и неметаллов,
Химические свойства металлов.
Электрохимический ряд напряжений металлов.
Водород.
Галогены.
Кислород.
Сера и ее соединения.
Азот.
Фосфор и его соединения.
Углерод.
Кремний и его соединения.
А9, В4
Учащиеся выполняют задания А9, В4
03.12.2013
10.12.2013
17.12.2013
13
8 класс (тема 6,
9 урок)
Химические свойства оксидов:
оснόвных, амфотерных,
кислотных.
А10
Учащиеся выполняют задания А10
24.12.2013
14
8 класс (тема 6,
5,6, 7,8 урок,)
Химические свойства
оснований. Химические
свойства кислот
А11
Учащиеся выполняют задания А11
07.01.2014
15
8 класс (тема 6,
10 урок)
Соли в свете ТЭД, их свойства.
А12
Учащиеся выполняют задания А12
14.01.2014
16
8 класс (тема 3,
9-10 урок)
Чистые вещества и смеси.
Правила безопасной работы в
школьной лаборатории.
Лабораторная посуда и
оборудование. Человек в мире
веществ, материалов и
химических реакций.
Проблемы безопасного
использования веществ и
химических реакций в
повседневной жизни.
Разделение смесей и очистка
веществ. Приготовление
растворов. Химическое
загрязнение окружающей
среды и его последствия.
А13
Учащиеся выполняют задания А13
21.01.2014
17
8 класс (тема 3 урок 1,тема 6,
13 урок)
Степень окисления химических
элементов.
Окислитель и восстановитель.
Окислительно-
восстановительные реакции.
А14
Учащиеся выполняют задания А14
28.01.2014
18
8 класс
Введение (4 урок)
Вычисление массовой доли
химического элемента
в веществе.
А15
Учащиеся решают задачи на нахождение массовой доли элемента в веществе
04.02.2014
19
8 класс (тема 1,
4 урок)
Периодический закон
Д.И. Менделеева.
Закономерности изменения
свойств элементов и их
соединений в связи с
положением в Периодической
системе химических элементов.
В1
Учащиеся выполняют задания В1
11.02.2014
20-22
9 класс (тема 5, 2-9 урок
Первоначальные сведения об
органических веществах:
предельных и непредельных
углеводородах (метане, этане,
этилене, ацетилене) и
кислородсодержащих
веществах: спиртах (метаноле,
этаноле, глицерине),
карбоновых кислотах
(уксусной и стеариновой).
Биологически важные
вещества: белки, жиры,
углеводы
В2
Учащиеся выполняют задания В2
18.02.2014
25.02.2014
04.03.2014
23-24
8 класс (тема 6,
12,13 урок)
Определение характера среды
раствора кислот и щелочей с
помощью индикаторов.
Качественные реакции на ионы
в растворе (хлорид-, сульфат-,
карбонат-ионы, ион аммония).
Получение газообразных
веществ. Качественные
реакции на газообразные
вещества (кислород, водород,
углекислый газ, аммиак)
В3
Учащиеся выполняют задания В3
11.03.2014
18.03.2014
25-27
8 класс (тема 6,
14,15 урок)
9 класс (тема 1, 3,4 урок)
9 класс (тема 3, 2 урок)
9 класс (тема 3, 3 урок)
9 класс (тема 3, 6 урок)
9 класс (тема 3, 7 урок)
9 класс (тема 3, 10 урок)
9 класс (тема 3, 15 урок)
9 класс (тема 3, 17 урок)
9 класс (тема 3, 19 урок)
Свойства простых веществ - металлов и неметаллов, кислот и солей в свете ОВР.
Химические свойства металлов.
Электрохимический ряд напряжений металлов.
Водород.
Галогены.
Кислород.
Сера и ее соединения.
Азот.
Фосфор и его соединения.
Углерод.
Кремний и его соединения.
А9, В4
Учащиеся выполняют задания А9, В4
25.03.2014
01.04.2014
08.04.2014
28-29
8 класс (тема 3 урок 1,тема 6,
13 урок)
Степень окисления химических
элементов.
Окислитель и восстановитель.
Окислительно-
восстановительные реакции
С1
Учащиеся выполняют задания С1
15.04.2014
22.04.2014
29-30
8 класс (тема 3,
11 урок)
Вычисление массовой доли
растворенного вещества в
растворе. Вычисление
количества вещества, массы
или объема вещества по
количеству вещества, массе
или объему одного из
реагентов или продуктов
реакции.
С2
Учащиеся составляют уравнения реакций, вычисляют массу вещества и находят массу или объем неизвестного вещества.Учащиеся составляют уравнения реакций
Учащиеся выполняют задания С2
29.04.2014
06.05.2014
31-32
8 класс (тема 6,
урок 4,5-11)
Химические свойства простых
веществ. Химические свойства
сложных веществ.
Взаимосвязь различных
классов неорганических
веществ. Реакции ионного
обмена и условия их
осуществления.
Модель 1С3
Учащиеся составляют уравнения реакций
Учащиеся выполняют задания С3
13.05.2014
20.05.2014
31-32
8 класс (тема 6,
урок 4,5-11)
Химические свойства простых
веществ. Химические свойства
сложных веществ.
Взаимосвязь различных
классов неорганических
веществ. Реакции ионного
обмена и условия их
осуществления.
Модель 2С3
Учащиеся составляют уравнения реакций Учащиеся выполняют задания С3
13.05.2014
20.05.2014
33-34
8 класс (тема 5,
Правила безопасной работы в
школьной лаборатории.
Лабораторная посуда и
оборудование. Получение и
изучение свойств основных
классов неорганических
веществ.
Учащиеся выполняют задания С4
35-36
Все темы
Все части
Решение КИМов
37
Все темы
Все части
Проведение пробного тестирования
А1. Строение атома
Выберите один правильный ответ
1.Чем отличаются изотопы одного и того же химического элемента?
1) Числом протонов
2) Числом электронов
3) Зарядом ядра
4) Массовым числом
2. Число нейтронов в атоме 39К равно числу нейтронов в атоме
1) 39Аr 2) 40Ca 3) 35С1 4) 40Ar
3. Выберите атом, в котором число протонов равно числу нейтронов:
1) 2H 2)11В 3) 19F 4)40Аr
4. Число нейтронов в изотопе цинка с относительной атомной массой 70 равно:
1) 40 2) 30 3) 35 4) 65
5. 30 нейтронов содержится в изотопе:
1)55Мп 2)65Sn 3)30Si 4)35Сl 5)36S
6. Элемент, в ядре изотопа которого 71Х находится 40 нейтронов, -
1) лютеций 2) цирконий 3) стронций 4) галлий
7. Чему равен заряд ядра атома натрия?
1) 0 2) +1 3)+11 4) +23
8.У атома серы число электронов на внешнем энергетическом уровне и заряд ядра равны соответственно:
1) 4 и +16 2) 6 и +32 3) 6 и +16 4) 4 и + 32
9. Атом какого элемента в основном состоянии содержит 2 электрона на первом уровне, 8 - на втором, 14 - на третьем и 2 - на четвертом:
1)Сr; 2) Мn; 3)Со; 4)Fe;
10. Относительная атомная масса изотопа, содержащего на третьем энергетическом уровне 11 электронов, на четвертом - 2 электрона, а в ядре - 27 нейтронов, равна:
1) 40 2) 14 3) 38 4) 29 5) 50
11. Распределение электронов по энергетическим уровням атома марганца
1) 2; 8; 8; 7 2) 2; 8; 13; 2 3) 2; 8; 10 4) 2; 8; 8; 10; 5
12.Одинаковую электронную конфигурацию внешнего энергетического уровня имеют атомы углерода и
1) Si 2)N 3) S 4) Be
13.Электронную конфигурацию внешнего энергетического уровня 4s24p5 имеет атом:
1)As 2) Mn 3) Cl 4) Br
14. Три неспаренных электрона на внешнем уровне в основном состоянии содержит атом
1) титана 2) кремния 3) магния 4) фосфора
15. Конфигурация валентных электронов некоторого элемента - 3d64s2. Каково положение этого элемента в Периодической системе?
1)3 период, VI группа, главная подгруппа
2) 3 период, VI группа, побочная подгруппа
3) 4 период, VIII группа, главная подгруппа
4) 4 период, VIII группа, побочная подгруппа
16. На внешнем уровне атома- элемента 2-го периода находятся 4 электрона. Этот элемент -
1) бериллий 2) углерод 3)бор 4)азот
17. Укажите атом, в котором больше всего электронов:
1) 2Н 2) 40Аr 3) 41Ar 4) 39К
18. Укажите символ металла, который содержит на внешнем энергетическом p-подуровне три электрона:
1) Тантал 2) Висмут 3) Таллий 4) Мышьяк
19. В четвёртом электронном слое содержит пять электронов атом
1) V 2) Аs 3) Sn 4) Zr
20. В атоме титана число полностью заполненных энергетических подуровней равно:
1) 6 2) 5 3) 3 4)
21.Какое количество энергетических подуровней полностью заполнено в атоме алюминия в основном состоянии:
1) 2 2) 3 3) 4 4) 5
22. Число неспаренных электронов атома углерода в возбуждённом состоянии:
1) 1 2) 2 3) 3 4) 4
23. Укажите число неспаренных электронов в основном состоянии атома железа:
1) 1 2) 2 3) 3 4) 4
24. Элемент проявляет в соединениях максимальную степень окисления +7. Какую конфигурацию валентных электронов может иметь этот элемент в основном состоянии?
1) 3d7 2) 2s2 2р5 3) 3s23p5 4) 3s14d5
25. Какая из электронных конфигураций соответствует возбуждённому состоянию?
1)…2s2 2)…3s23p1 3)…4s23d2 4) …3s13p2
26. Электронная формула атома фосфора, находящегося в возбужденном состоянии:
1) 1s22s22p63s23p3
2) 1s22s22p63s13p33d1
3) 1s22s22p63s23p5
4) 1s22s22p63s13p34s1
27. Атом никеля находится в основном состоянии. Число неспаренных электронов в этом атоме равно
1)1 2) 2 3) 3 4) 4 5) 5
28. Какую электронную конфигурацию имеет атом наиболее активного металла?
1) 1s22s22p1
2) 1s22s22p63sl
3) 1s22s2
4) 1s22s22p63s23pl
29. Количество энергетических уровней, на которых находятся электроны в катионе калия К+:
1) 1 2) 2 3) 3 4) 4
30. Электронная конфигурация ls22s22p63s23p6 отвечает
1) атому аргона и атому хлора
2) атому аргона и атому калия
3) сульфид-иону и катиону лития
4) атому аргона и хлорид-иону
31. Электронная конфигурация катиона, образующегося при диссоциации бромида кальция
1) 1s22s22p63s23p64s1
2) 1s22s22p63s23p6
3) 1s22s22p63s23p64s2
4) 1s22s22p63s23p64s24p6
32. Символ химического элемента, электронная формула которого соответствует электронной формуле иона P3-
1) Mg 2) Ar 3) S 4) Si
33.Электронная конфигурация 1s22s22p63s23p6 соответствует иону:
1) Fe2+ 2) S2- 3) Al3+ 4) N3-
34. Электронная конфигурация иона Fe3+:
1)1s22s22p63s23p63d54s0
2)1s22s22p63s23p63d34s2
3)1s22s22p63s23p63d94s2
4)1s22s22p63s23p64s24p3
35. Неспаренные электроны содержит катион
-
Zn2+ 2) Be 2+ 3) Ca 2+ 4) Co 2+
А2. Периодический закон и Периодическая система химических элементов им. Д.И.Менделеева
Выберите один правильный ответ
1. Номер периода, в котором расположен химический элемент, характеризует
1) число заполненных энергетических уровней
2) число валентных электронов
3) формулу высшего оксида
4) высшую валентность
2. Номер группы элемента в периодической системе соответствует
1) заряду ядра атома этого элемента
2) числу электронов на валентной оболочке атома
3) числу электронных уровней атома этого элемента
4) среднему значению массовых чисел изотопов этого элемента.
3. У соединений элементов 3 периода слева направо возрастают
1) основные свойства высших гидроксидов
2) восстановительные свойства водородных соединений;
3) кислотные свойства высших гидроксидов
4) основные свойства высших оксидов.
4. Среди всех элементов 3-го периода элемент натрий обладает...
1) самой высокой электроотрицательностью
2) наиболее выраженными металлическими свойствами
3) самым маленьким радиусом атома
4) самой большой плотностью
5. Элемент IV периода, который с кислородом образует высший оксид ЭО3, а с водородом не образует летучих соединений - это
1) селен
2) свинец
3)германий
4) хром
6. Верны ли следующие суждения о свойствах соединений элемента, электронная конфигурация атома которого 1s22s22р63з23р4
А. Этот элемент образует гидроксид с ярко выраженными кислотными свойствами.
Б. Степень окисления этого элемента в высшем гидроксиде равна +4. .
1)верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
7. Элемент четвертого периода, высший оксид которого имеет формулу ЭО и который с водородом образует солеобразное соединение состава ЭН2 - это…
1) кальций 2) цинк 3) бериллий 4) селен
8. Формула высшего оксида элемента - Э2О. Какая конфигурация валентных электронов возможна у этого атома?
1) 3s1 2) 3d14s2 3) 2s22p1 4) 2s22p5
9.Формула высшего оксида некоторого элемента - ЭО3. Какую конфигурацию валентных электронов может иметь этот элемент в основном состоянии?
1) 4d6 2) 3s2 Зр4 3) 2s22р4 4) 3s1 3d5
10. Формула высшего оксида элемента с электронной конфигурацией атома 1s22s22p63s23p63d34s2
1) ЭО 2) Э2О 3) Э2О3 4) Э2О5
11. Какое летучее водородное соединение характерно для элемента, высший оксид которого имеет формулу Э2О7:
1) НЭ 2) Н2Э 3) ЭН3 4) ЭН7
12. Формулы высшего оксида и высшего гидроксида элемента, имеющего
электронную конфигурацию 1s22s22p63s23p64s2
1) SrO и Sr(OH)2 2) СаО и Са(ОН)2 3) К2О и КОН 4) Rb2O и RbOН
13. В ряду натрий - магний - алюминий элементы расположены в порядке увеличения
1) атомного радиуса 2) электроотрицательности
3) металлических свойств 4) числа электронных слоев
14. Наиболее электроотрицательным элементом является
1) кремний 2) азот 3) фосфор 4) калий
15. Из перечисленных элементов наиболее электроотрицательным является
1) азот 2) кислород 3) хлор 4) фтор
16. Наибольшей электроотрицательностью обладает элемент, который в Периодической системе находится в:
1) 2 периоде, III группе 2) 2 периоде, VI группе 3) 3 периоде, III группе 4) 3 периоде, VI группе
17. Атом какого химического элемента, из числа приведенных ниже, имеет наименьший радиус?
1)K 2)Al 3)Sn 4)C
18. В каком ряду химические элементы расположены в порядке уменьшения их атомного радиуса?
1) Li -Be -B -C 2) Ar -Cl- S- P 3) Si -Al -Mg -Na 4) Ne -F -O -N
19. Какой из приведенных ниже рядов химических элементов характеризуется возрастанием атомных радиусов?
1) Te, Se, S, O 2) Na, Mg, Al, Si 3) C, B, Be, Li 4) Ba, Al, Ga, Ge
20. Какие из приведенных ниже рядов ионов характеризуются уменьшением ионных радиусов?
1)S2- , Cl - , K+ , Ca2+
2)As5+ , V5+ , Cl5+ , I5+
3)Rb+ , K+ , Ag+ , Cu+
4)F- , Si4+ , Mg2+ , Na+
21. Наименьшую энергию нужно затратить на отрыв электрона от атома
1) Аs 2) Sе 3) S 4) Р
22. Притяжение электронов внешнего слоя к ядру ослабевает в ряду:
1) Al - Mg - Ca
2) Al - Si - C
3) Na - Mg - Be
4) Se - S - Cl
23. В ряду Be - B - C - N происходит
-
увеличение радиуса атомов
-
увеличение электроотрицательности
-
увеличение силы притяжения валентных электронов к ядру
-
уменьшение числа неспаренных электронов в основном состоянии атома
24. У К и Rb одинаковы...
1) атомные радиусы
2) значения относительной электроотрицательности
3) заряды ядер
4) высшие степени окисления
25. У Rb и Sr одинаковы...
1) атомные радиусы
2) значения относительной электроотрицательности
3) степени окисления
4) количества электронных слоев
Тест А 4
1. Наибольшую электроотрицательность имеет элемент
1) N 2) S 3) Вг 4) O
2. Степень окисления -3, фосфор проявляет в соединении:
1) Р2O3 2) Р2O5 3) Са3Р2 4) Са(Н2РO4)2
3. Степень окисления азота в ионе NH4+ равна:
1) +5 2)+3 3)-3 4) +1
4. Валентность III характерна для
1) Са 2) Р 3)O 4)Si
5. Все элементы в каком ряду могут проявлять степени окисления -1 и +5?
1) Rb, Са, Li 2) Н, Si, Р 3) Сl, i, Вг 4) Аs, N, Те
6. Наибольшую степень окисления хром проявляет в соединении:
1) К2Cr2О7, 2) Сг2О3 3) Сг(ОН)2 4) NaСO2
7. Верны ли следующие утверждения?
А. Высшая валентность элемента определяется номером группы.
Б. Высшая валентность элемента определяется номером периода.
1) верно только А 3) верны оба утверждения
2) верно только Б 4) оба утверждения неверны
8. Среди элементов IIIА группы наиболее электроотрицательным является:
1) Аl 2) В 3) In 4) Gа
9.Степень окисления хрома в ионе СгО22+ равн:
1) +3 2) +4 3) -2 4) +6
10. Валентность III характерна для:
1)O 2) P 3) Мg 4) Sе
Ответы: 1-4, 2-3, 3-3, 4-2, 5-3, 6-1, 7-1, 8-2, 9-4,10-2
Решение расчетных задач.
1. Вычисление массовой доли и массы вещества в растворе.
Массовая доля растворимого вещества в растворе, как и массовая доля элемента в веществе, представляет собой отношение части(доли) к целому. Так как раствор состоит из 2х компонентов - растворенного вещества и растворителя, то его масса равна сумме масс растворенного вещества и растворителя: m (р-ра)=m (р. в-ва) + m (р-ля)
Массовая доля вещества в растворе определяется как отношение массы растворенного вещества к массе раствора:

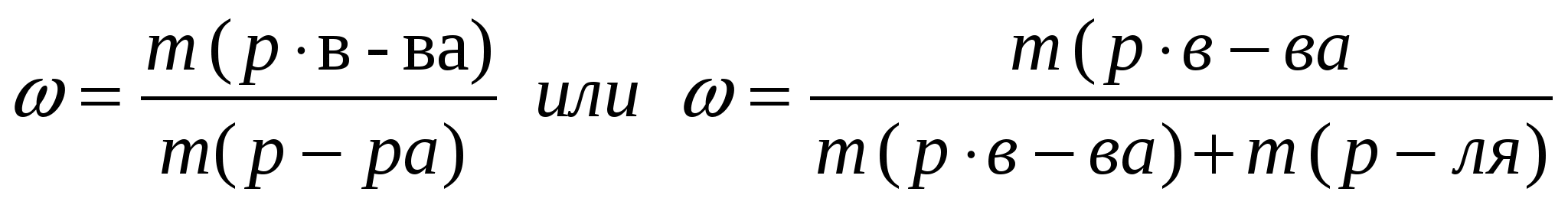
Задача 1. Вычислите массовую долю растворенного вещества, если в 68г воды растворили 12г соли.
Дано

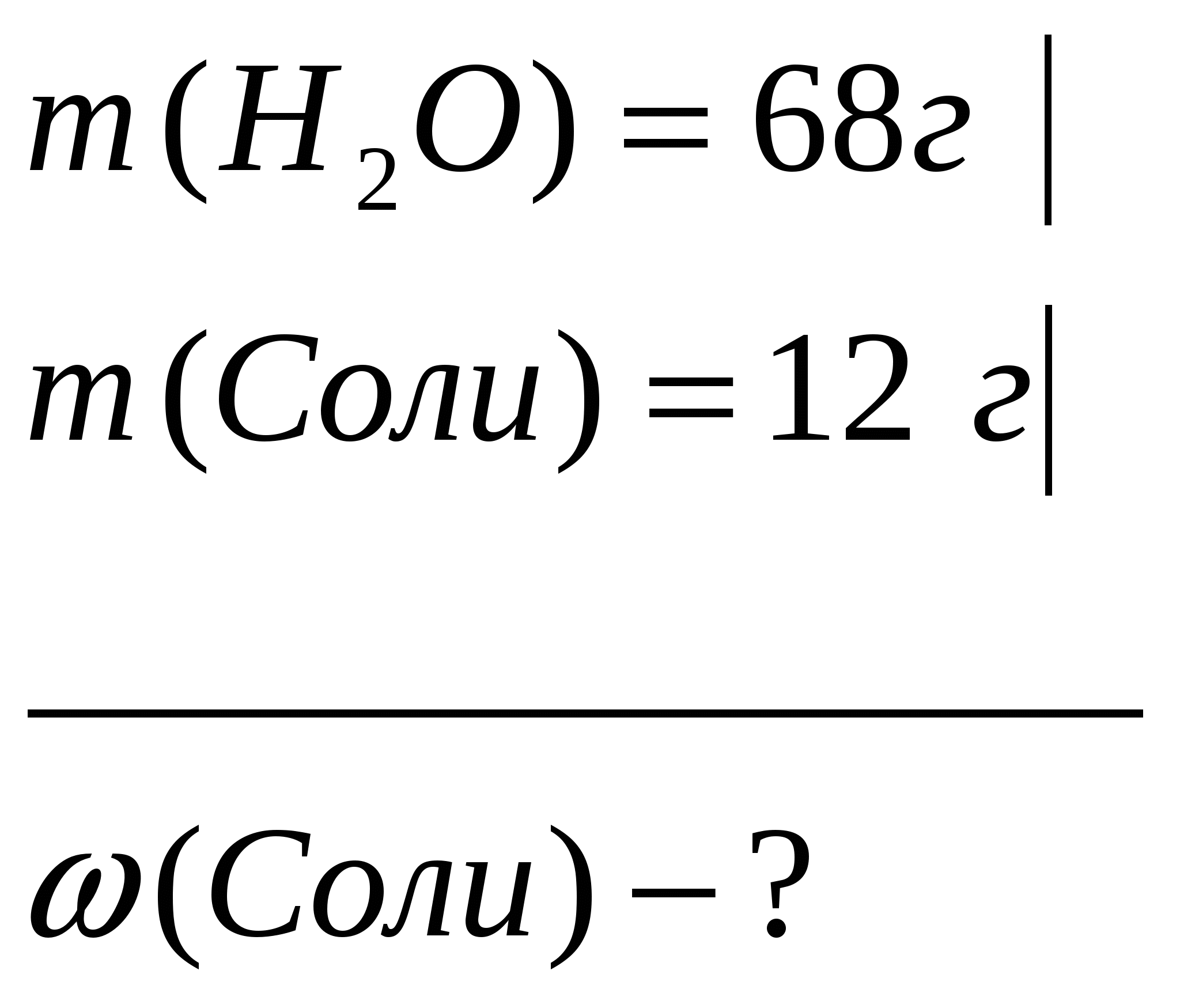
Решение:
1. Находим массу полученного раствора
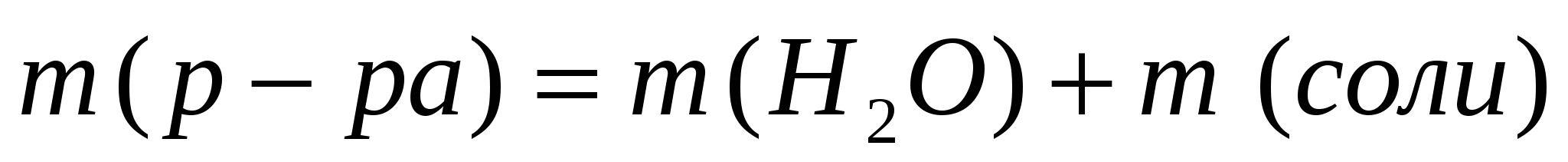

2.Вычислим массовую долю растворенного вещества по формуле:
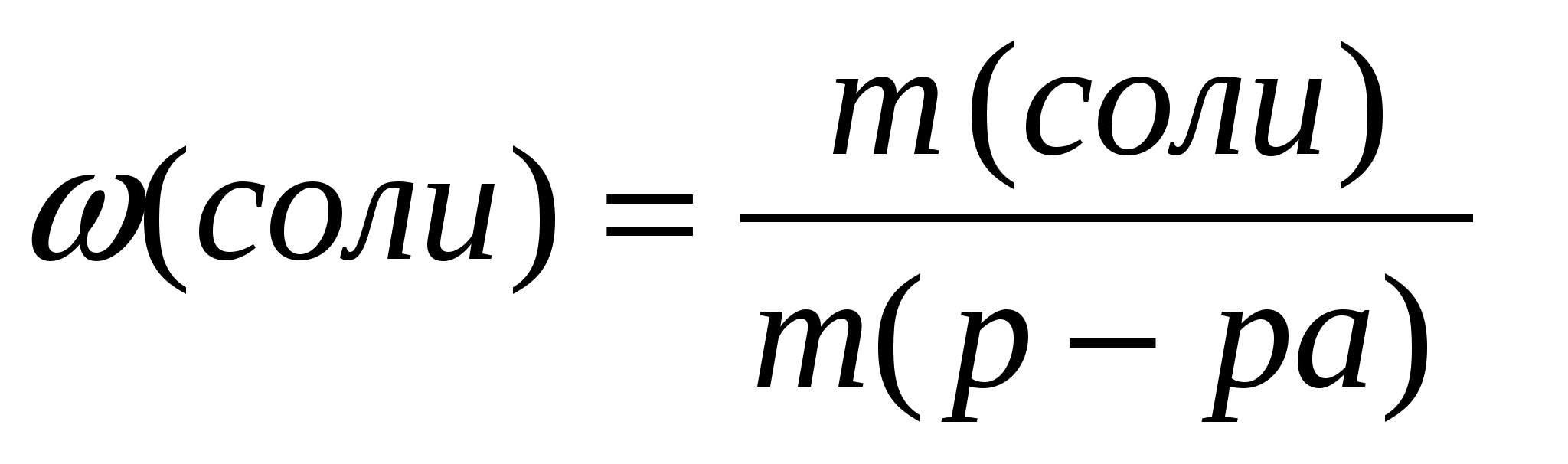
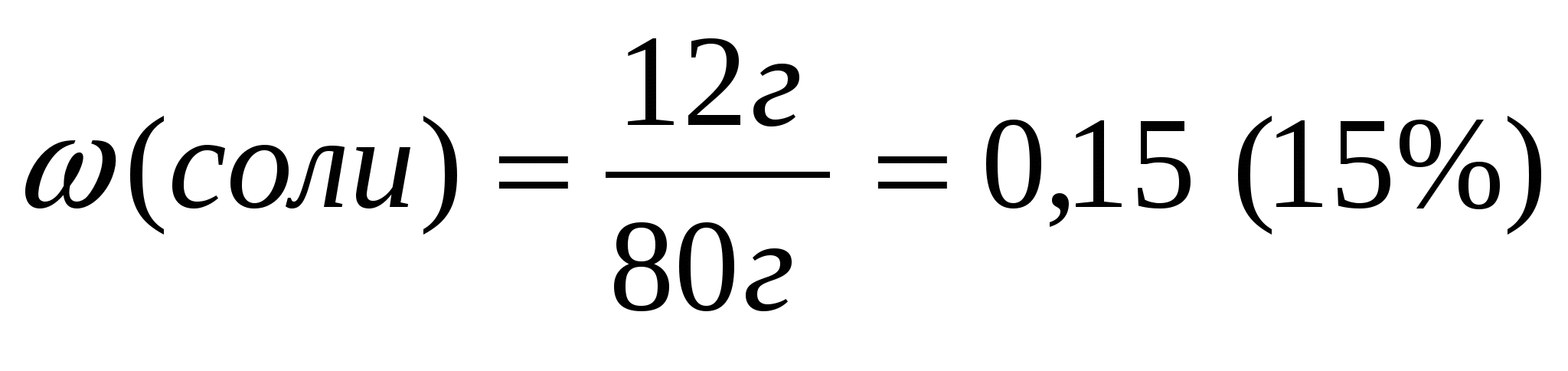
Ответ: 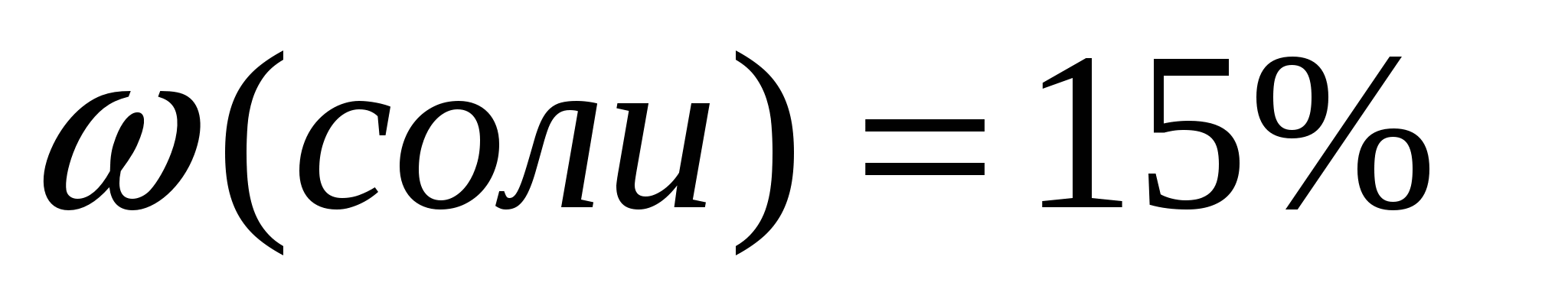
Задача 2. Какова масса карбоната кальция, выпавшего в осадок при пропускании оксида углерода (IV) через раствор массой 20г с массой долей гидроксида кальция 10%?
Дано

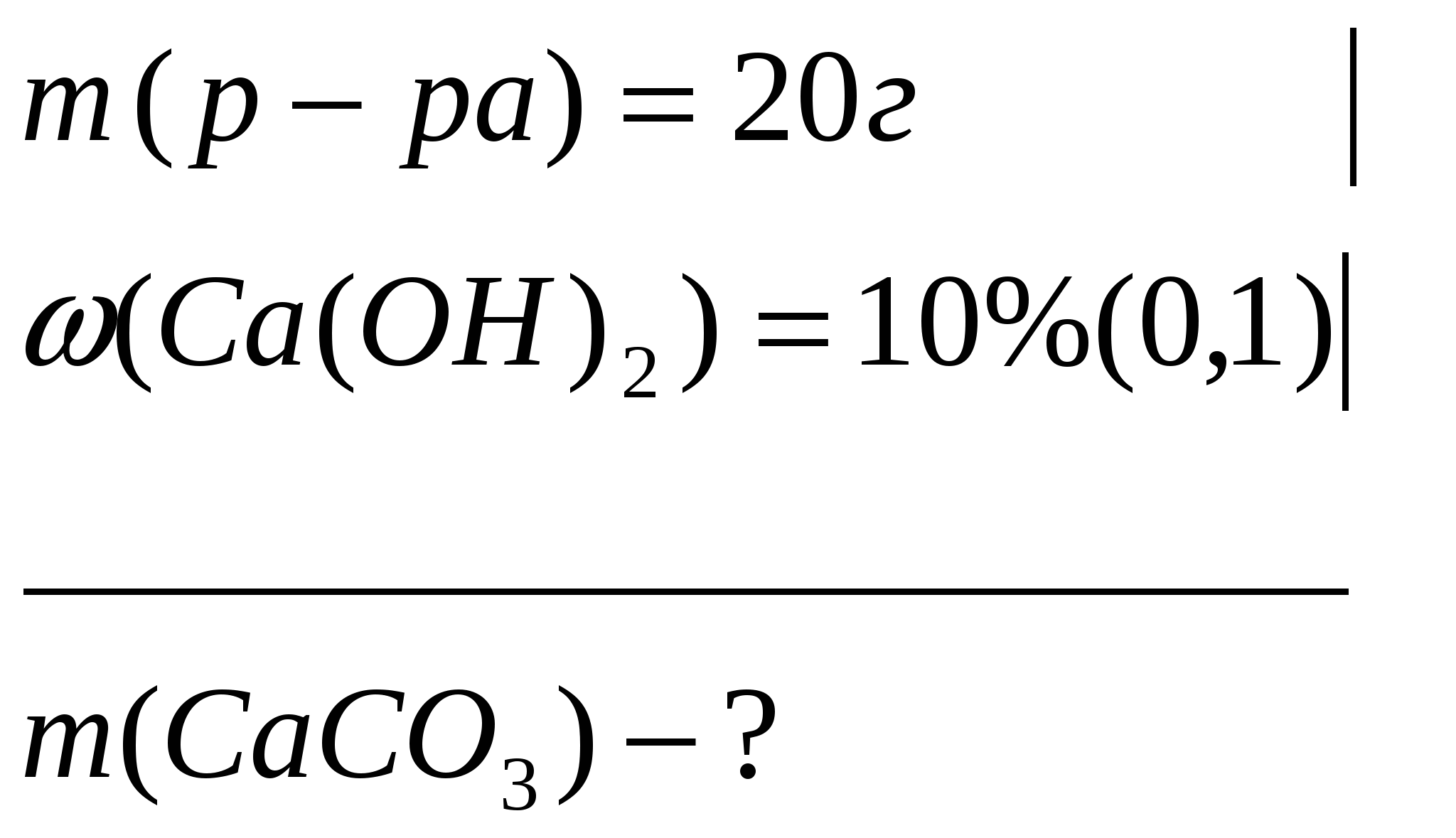
Решение:
1. Находим массу гидроксида кальция в растворе по формуле:

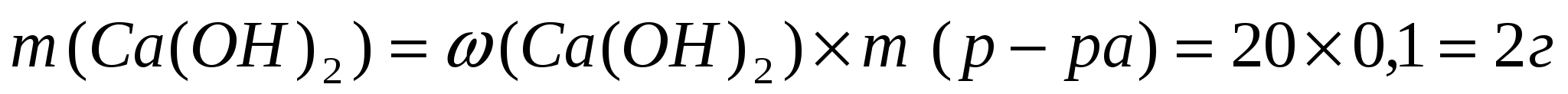
2. Запишем уравнение реакции
2г 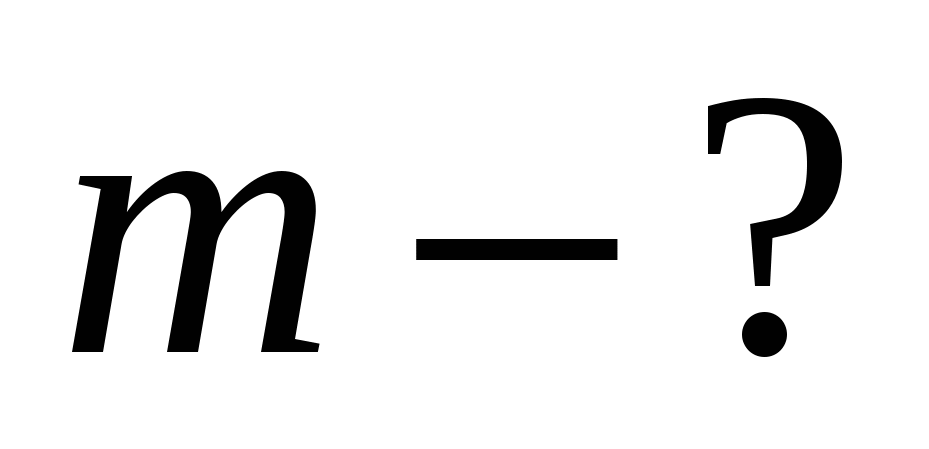


3.Составим и решим пропорцию: 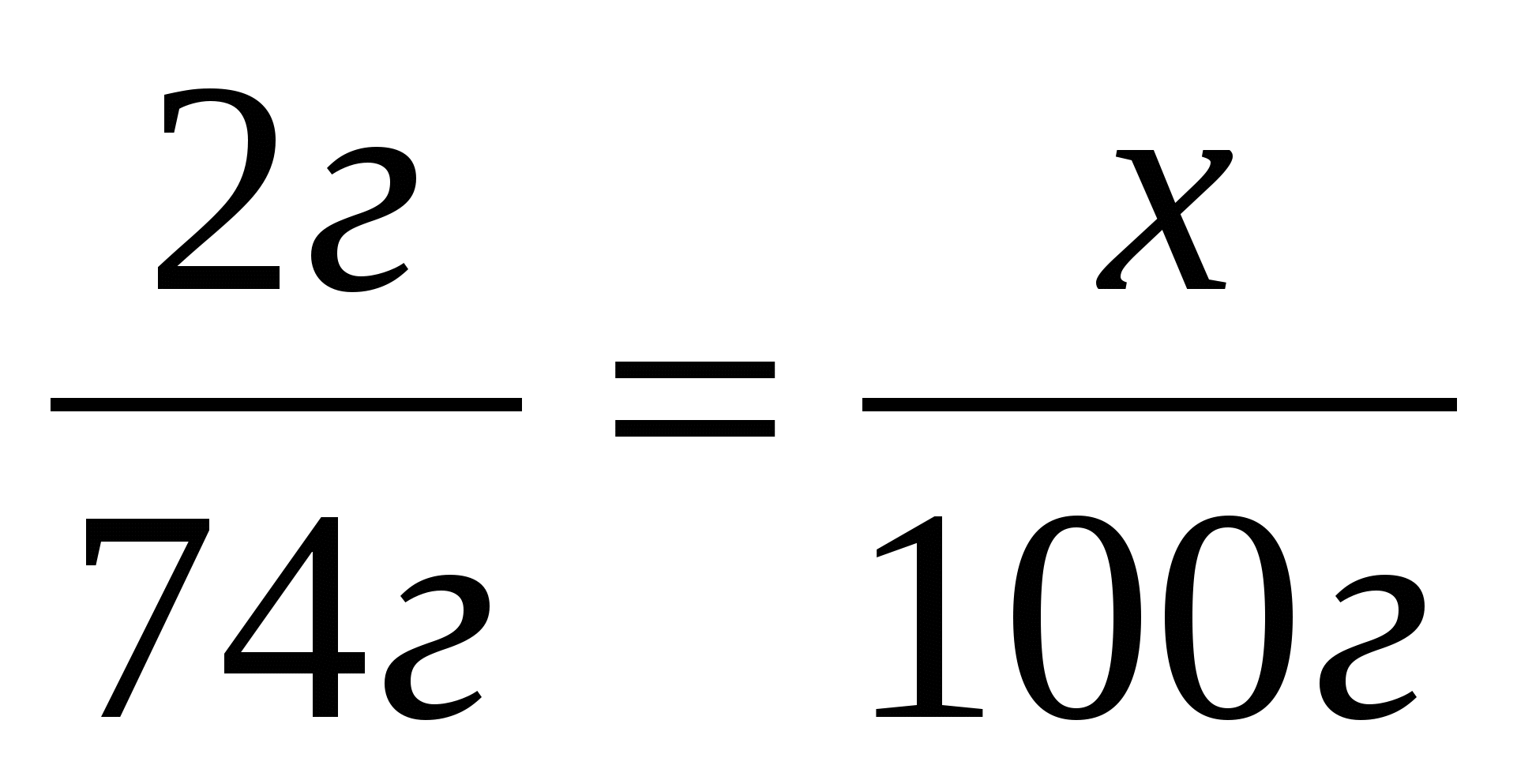

Ответ: 2,7г карбоната кальция выпадет в осадок.
Задачи для самостоятельного решения
Задача 1. Какая масса осадка образуется при взаимодействии избытка раствора хлорида кальция с 65,6г раствора фосфата натрия с массовой долей растворенного вещества 10%?
Задача 2. Какая масса осадка образуется при взаимодействии избытка раствора хлорида бария с 21,2г раствора фосфата калия с массовой долей растворенного вещества 20%?
Задача 3. Какая масса осадка образуется при взаимодействии избытка раствора нитрата бария с196,0г раствора серной кислоты с массовой долей растворенного вещества 5%?
В задачах такого типа указаны массы двух реагирующих веществ, одно из которых дается в избытке. При проведении реакции часть этого вещества остается неизрасходованной, так как полностью не прореагирует. Расчет получающихся продуктов производят по тому веществу, которое вступает в реакцию полностью. Поэтому сначала определяют, какое вещество дано в избытке, затем решают базовую задачу, применяя рациональные способы вычисления.
Задача 1. Рассчитайте массу осадка, который образуется при сливании растворов, один из которых содержит 260г нитрата бария, а второй 220г сульфата калия.
Дано

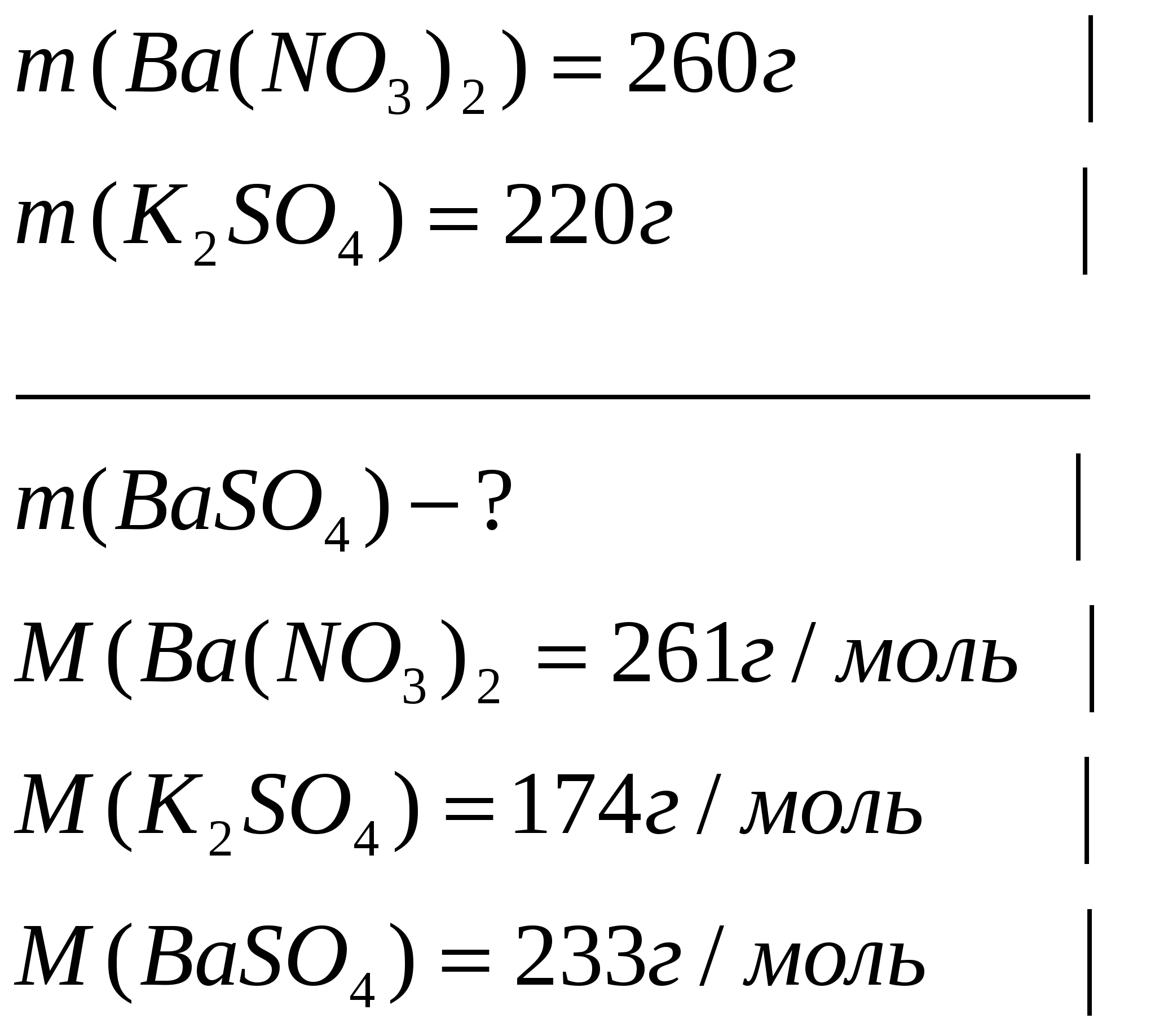
Решение:
1. Определим, какое вещество находится в избытке.
Для этого: а) Найдем количества веществ по формуле: 
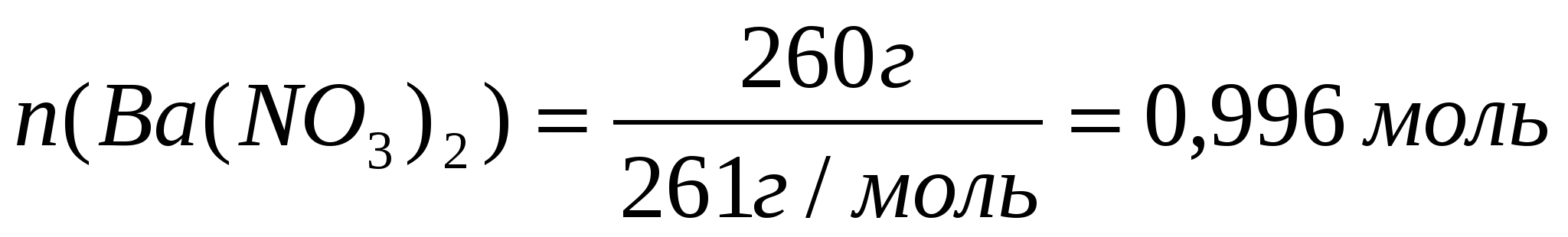
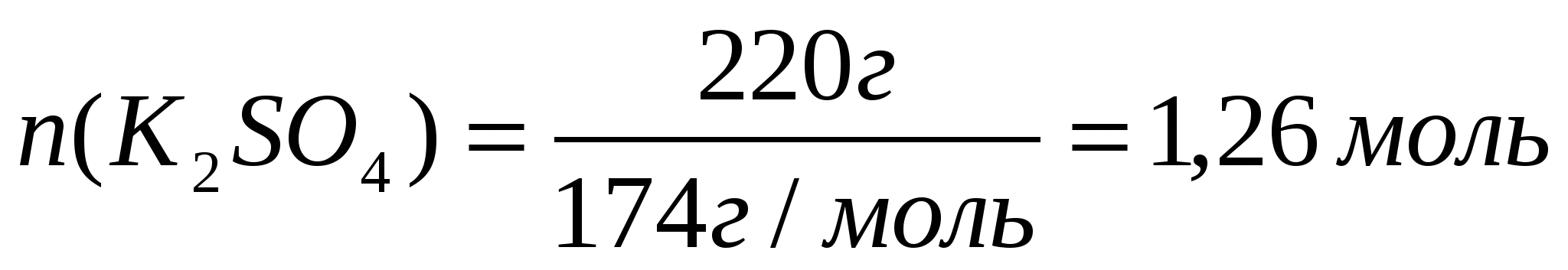
б) Составим уравнение реакции
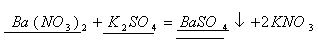
n=1моль n=1моль
По уравнению 1 моль нитрата бария 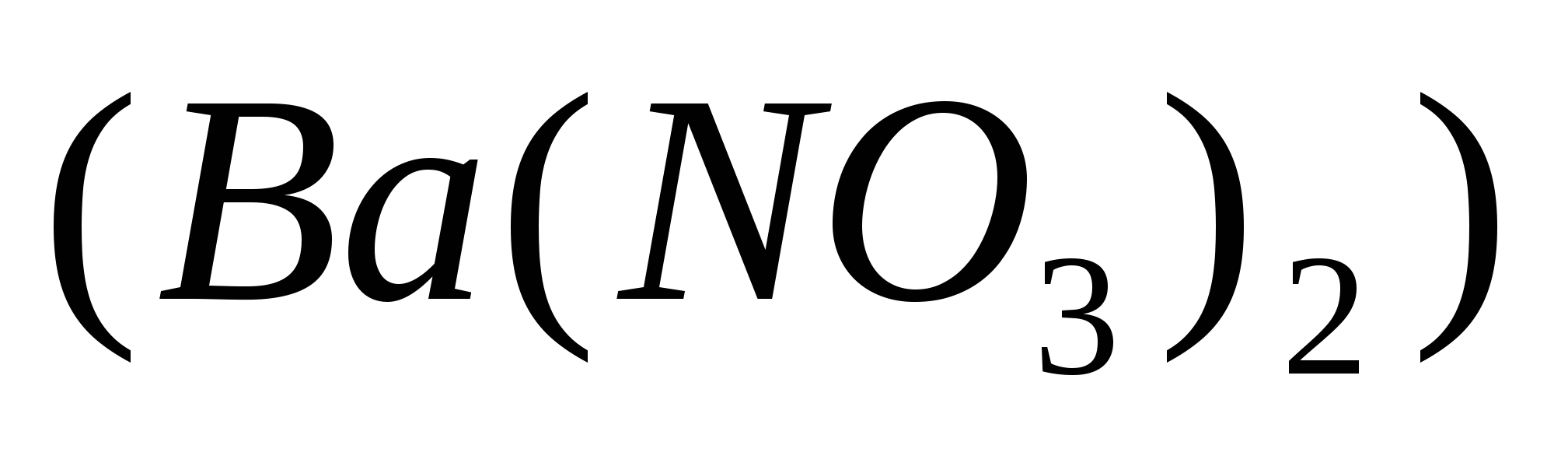 реагирует с 1моль сульфата калия
реагирует с 1моль сульфата калия 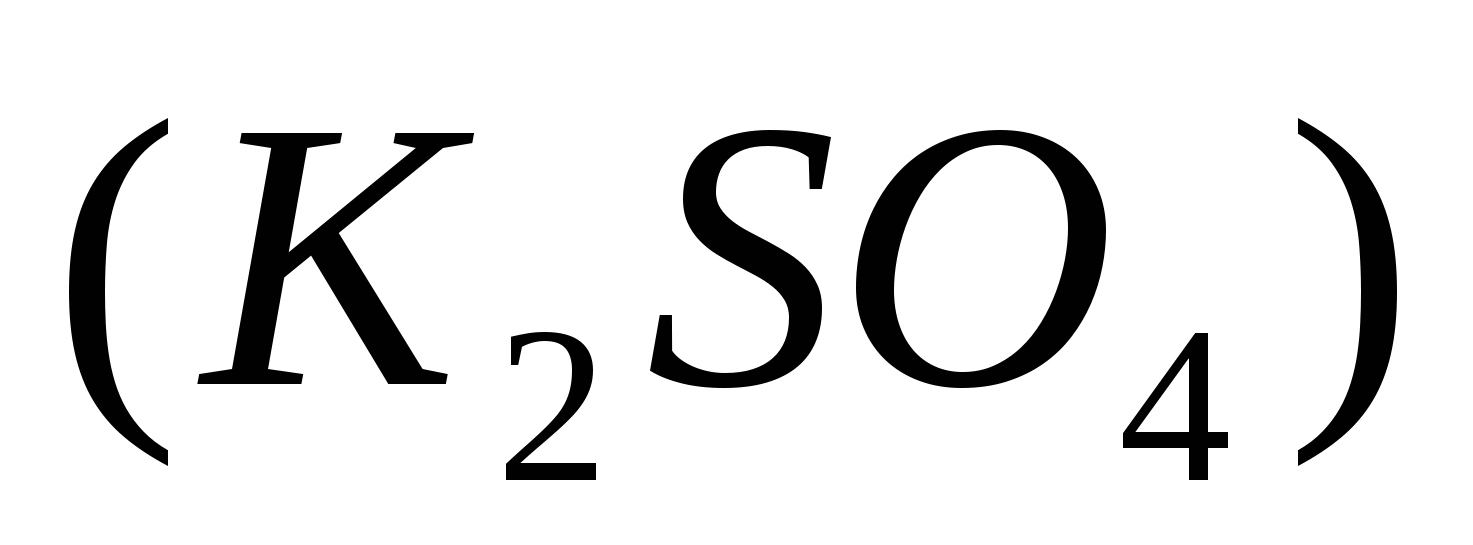 , значит, чтобы прореагировало 0,966 моль нитрата бария, потребуется столько же моль сульфата калия, а по условию задачи его дано 1,26 моль. Следовательно, сульфат калия
, значит, чтобы прореагировало 0,966 моль нитрата бария, потребуется столько же моль сульфата калия, а по условию задачи его дано 1,26 моль. Следовательно, сульфат калия 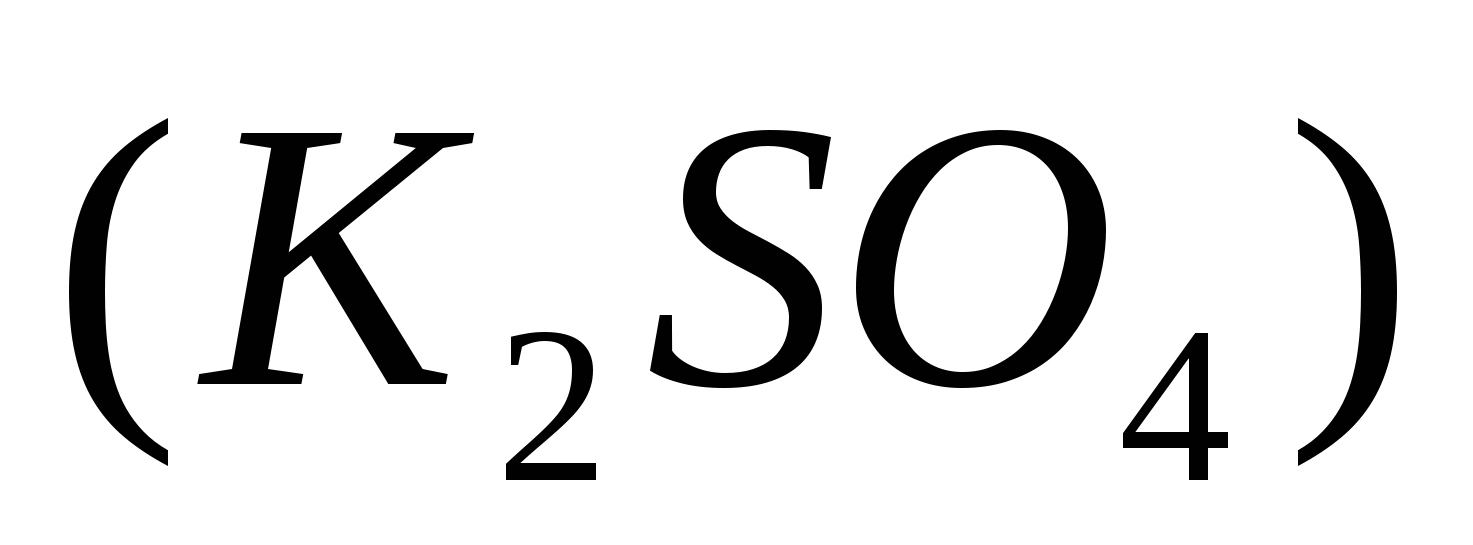 дан в избытке, нитрат бария
дан в избытке, нитрат бария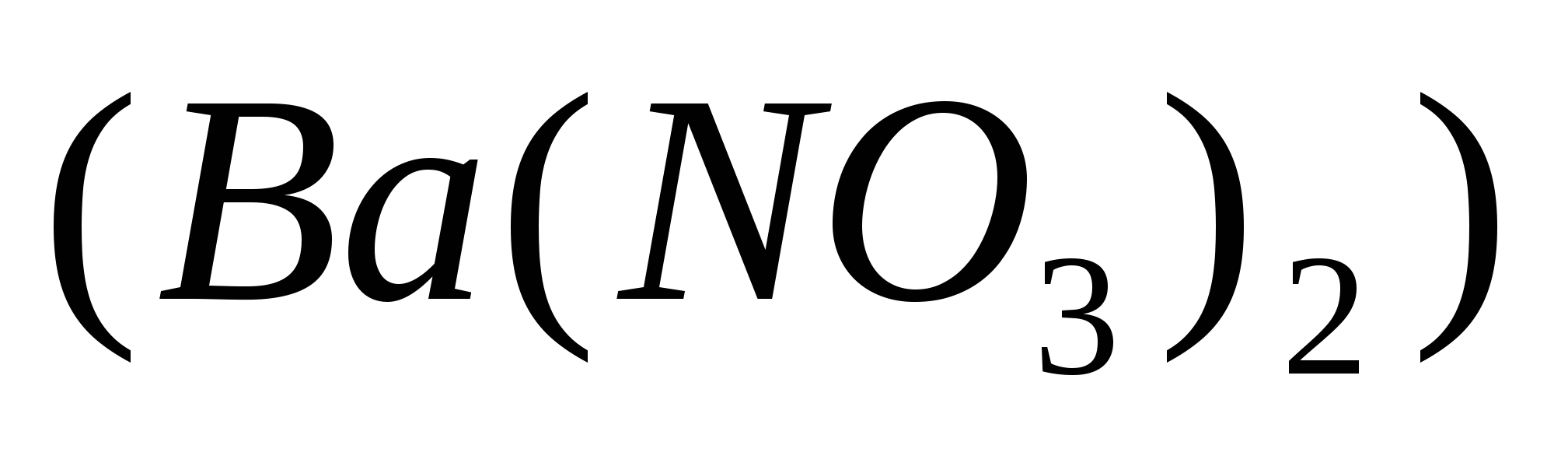 прореагирует полностью.
прореагирует полностью.
2. По массе нитрата бария вычислим массу выпавшего в осадок сульфата бария
Согласно уравнению
260г 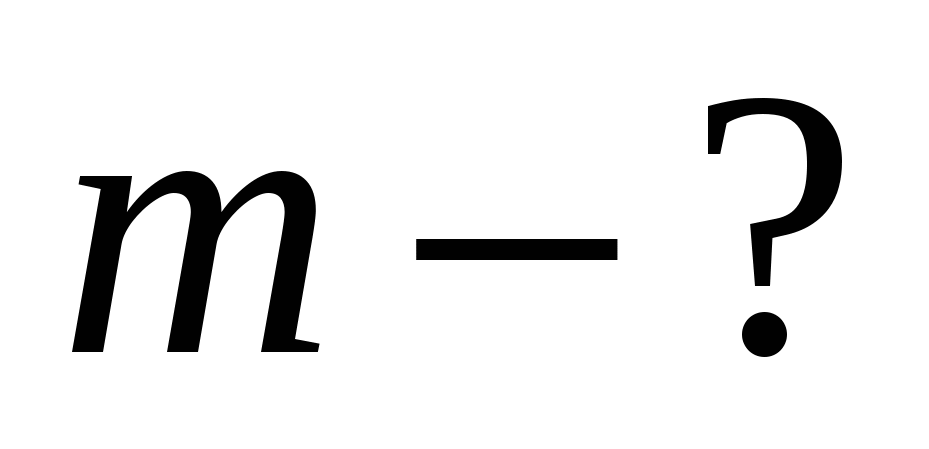
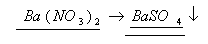
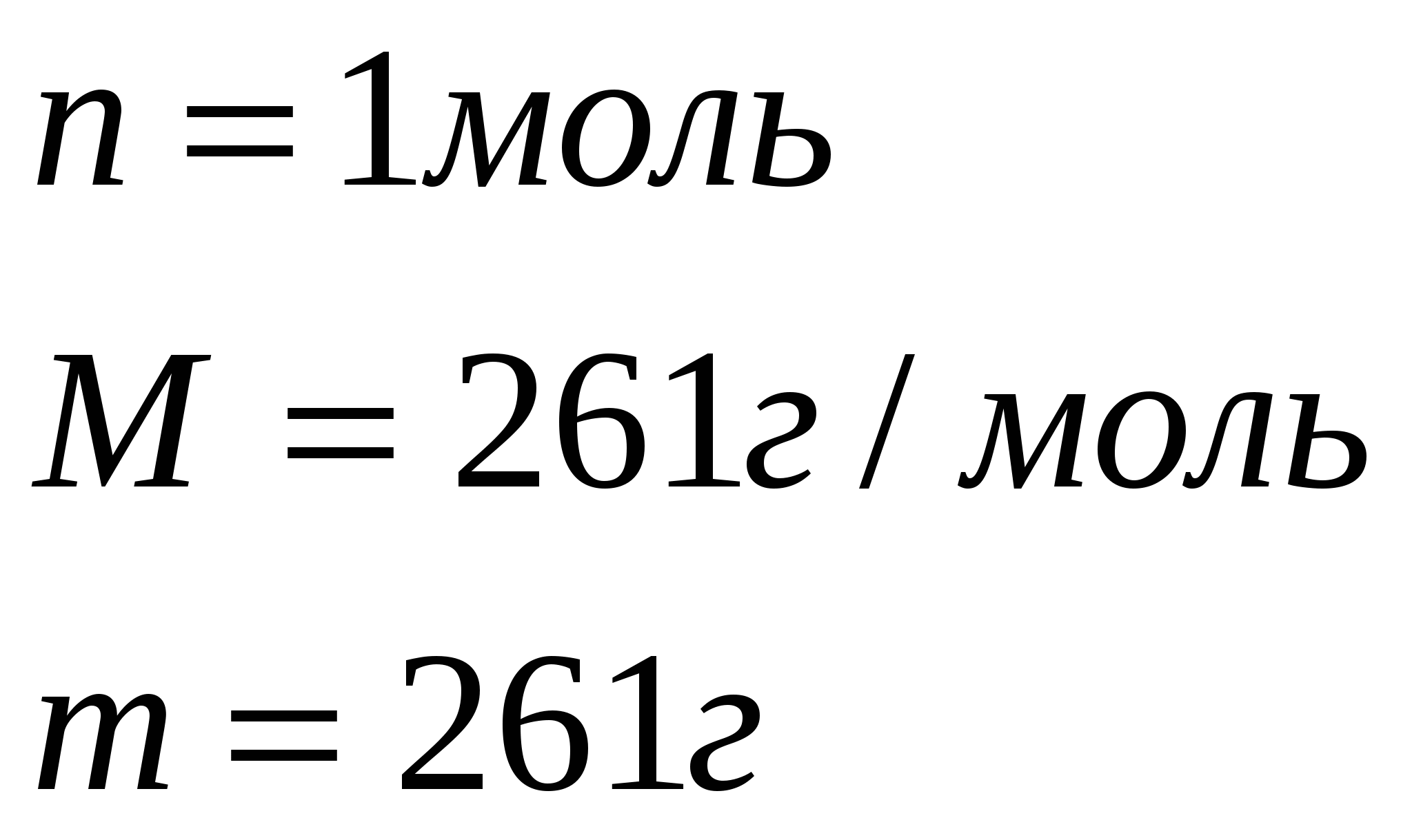
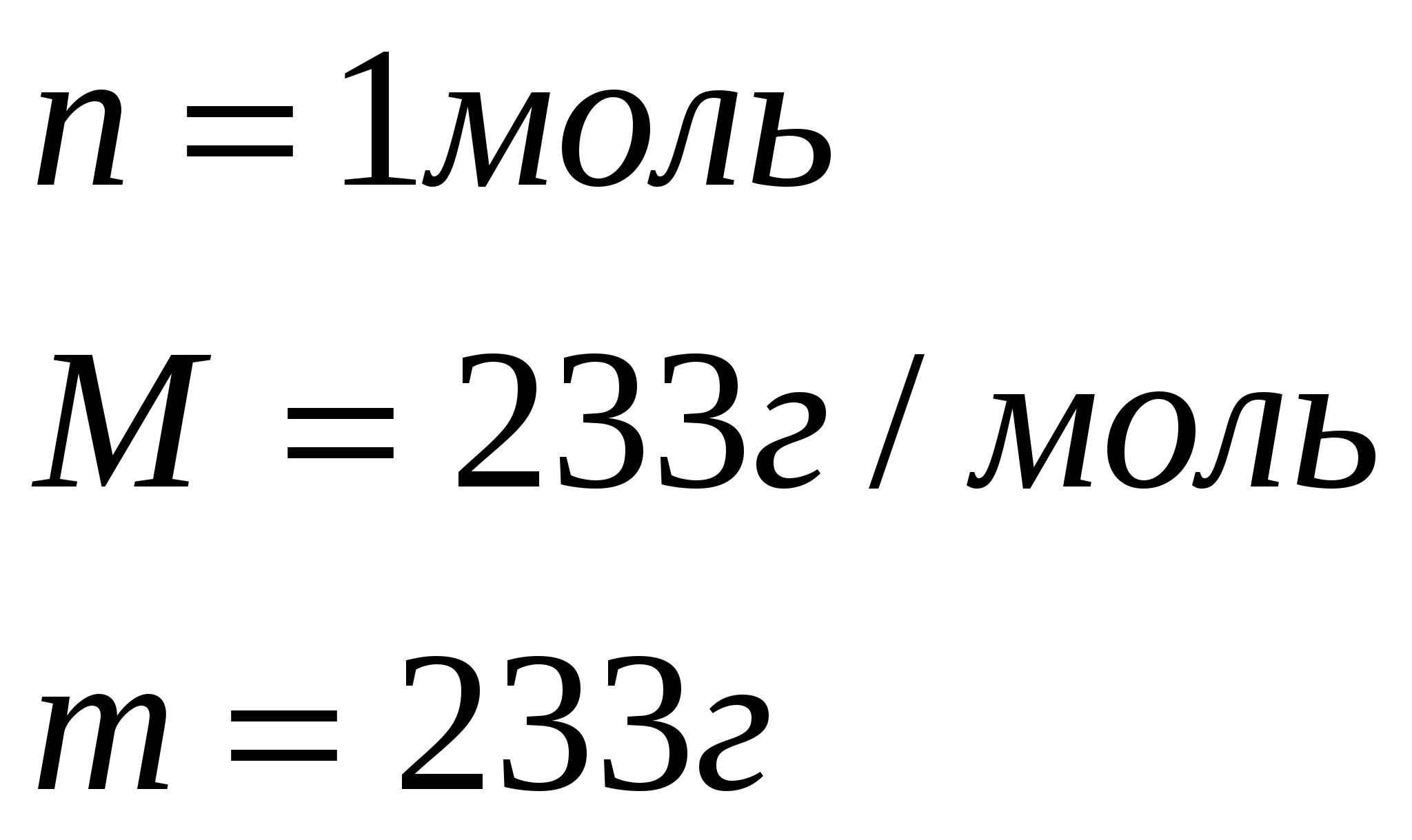
Составим и решим пропорцию

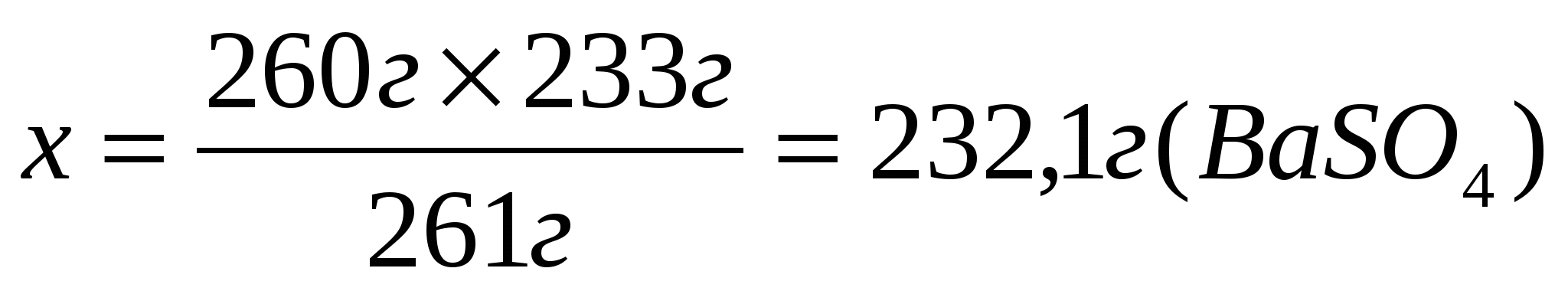
Ответ: 232,1г сульфата бария выпадет в осадок.
Задача 2. К 400г 5%-ного раствора сульфата железа(III) прилили 200г 3%-ного раствора гидроксида натрия. Вычислите массу образовавшегося осадка.
Дано

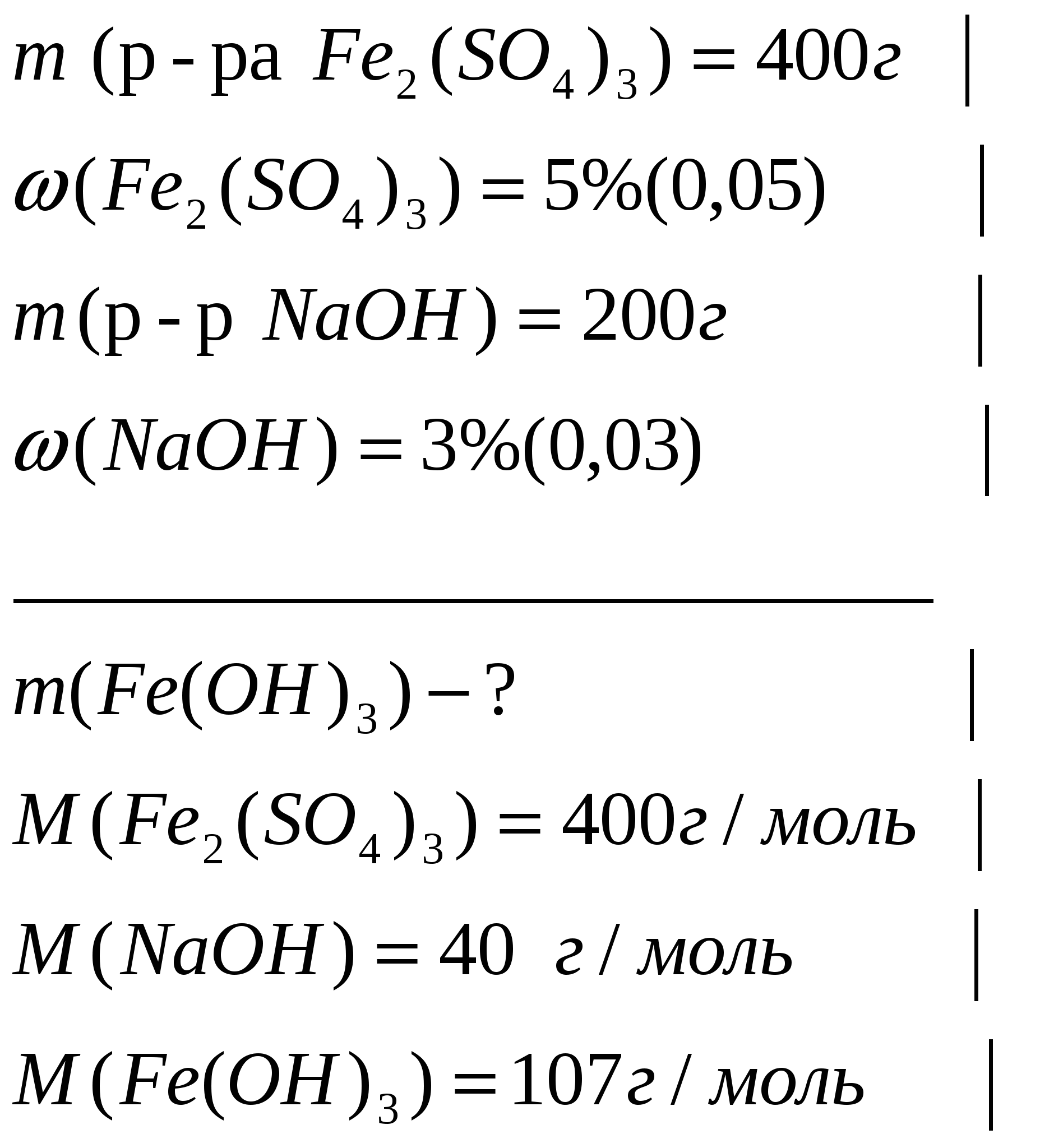
Решение:
1. Найдем массы растворенных веществ по формуле:
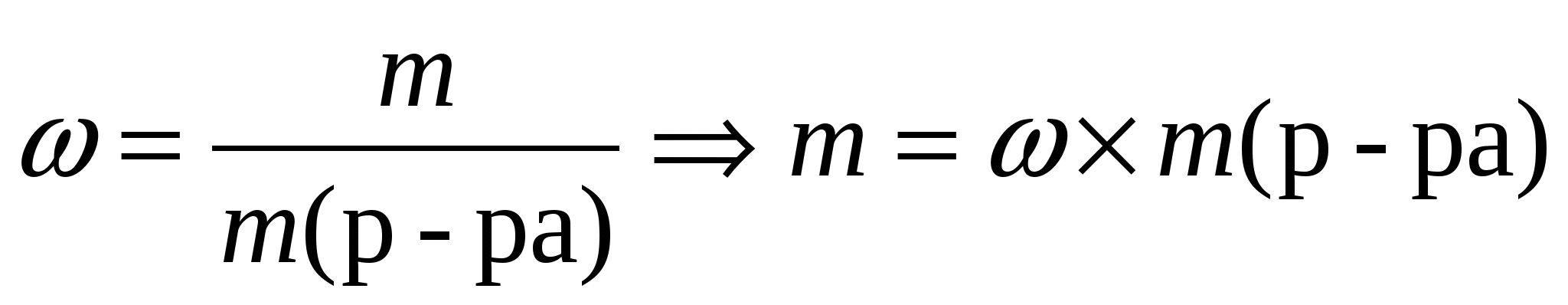
а) массу сульфата железа (III) 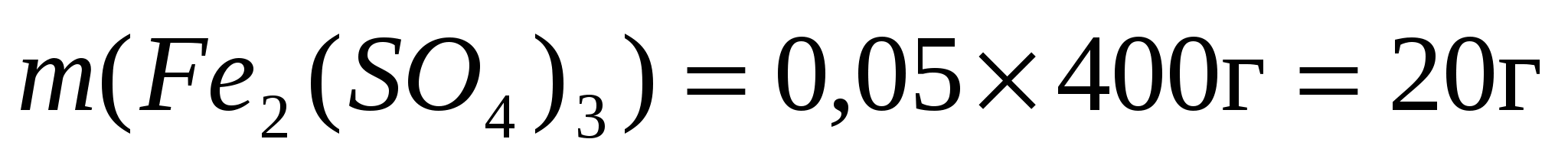
б) массу гидроксида натрия

2. Определим, какое вещество находится в избытке.
Для этого: а) Найдем количества веществ по формуле: 
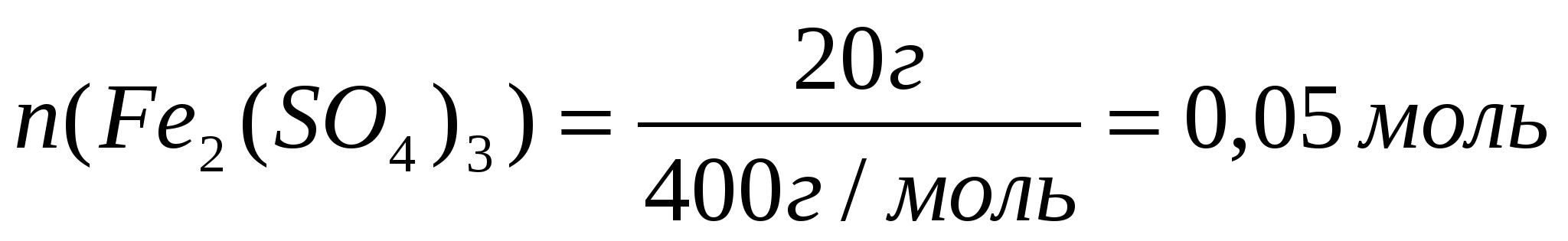
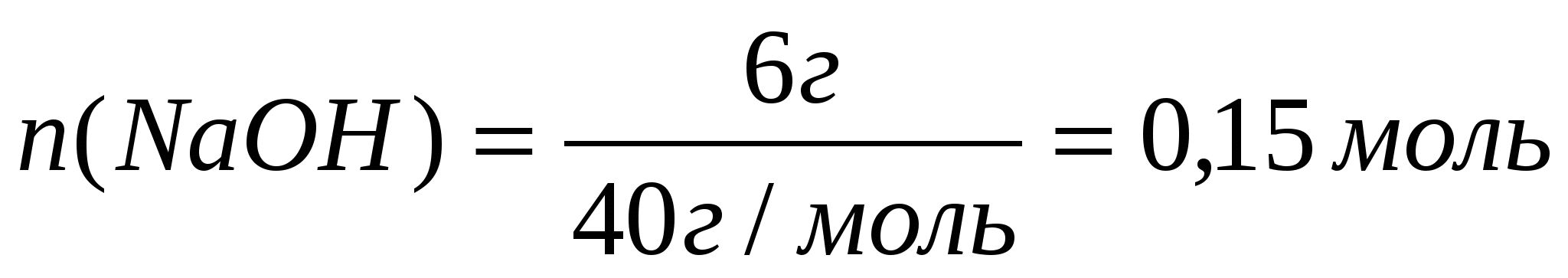
б) Составим уравнение реакции
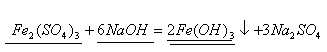
По уравнению 1 моль сульфата железа (III) реагирует с 6 моль гидроксида натрия, значит, чтобы прореагировало 0,05 моль сульфата железа, потребуется щелочи в 6 раз больше, т.е. 0,9 моль, а по условию задачи её дали 0,15 моль. Следовательно, сульфат железа (III) дан в избытке. Поэтому по массе гидроксида натрия вычислим массу выпавшего в осадок гидроксида железа (III)
вычислим массу выпавшего в осадок гидроксида железа (III)
2. Согласно уравнению
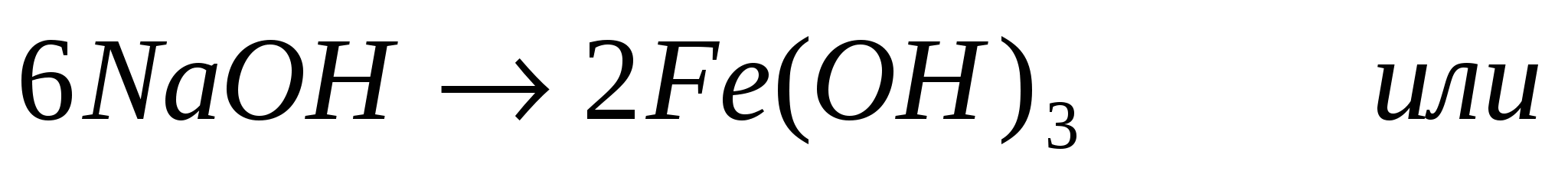
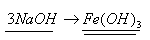
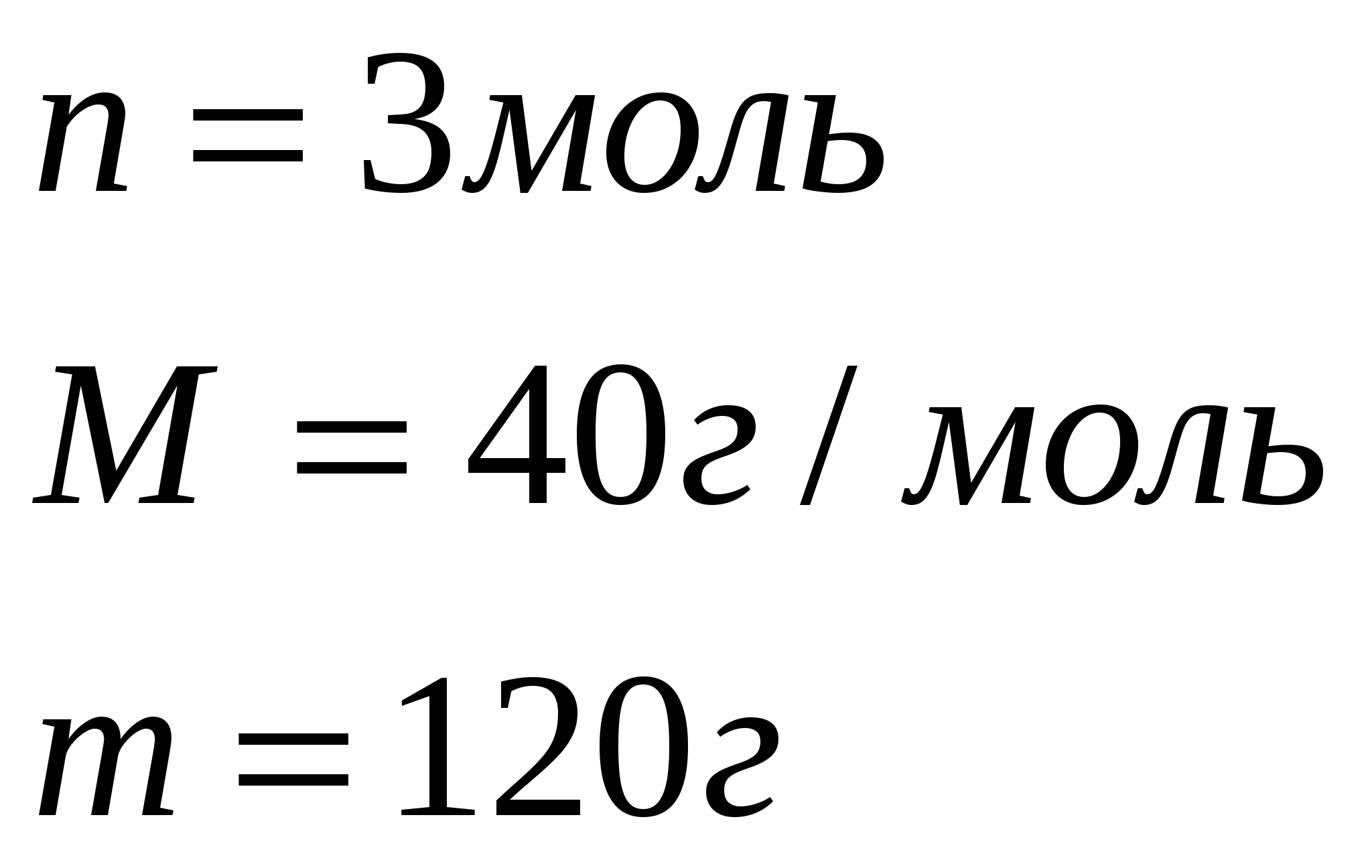
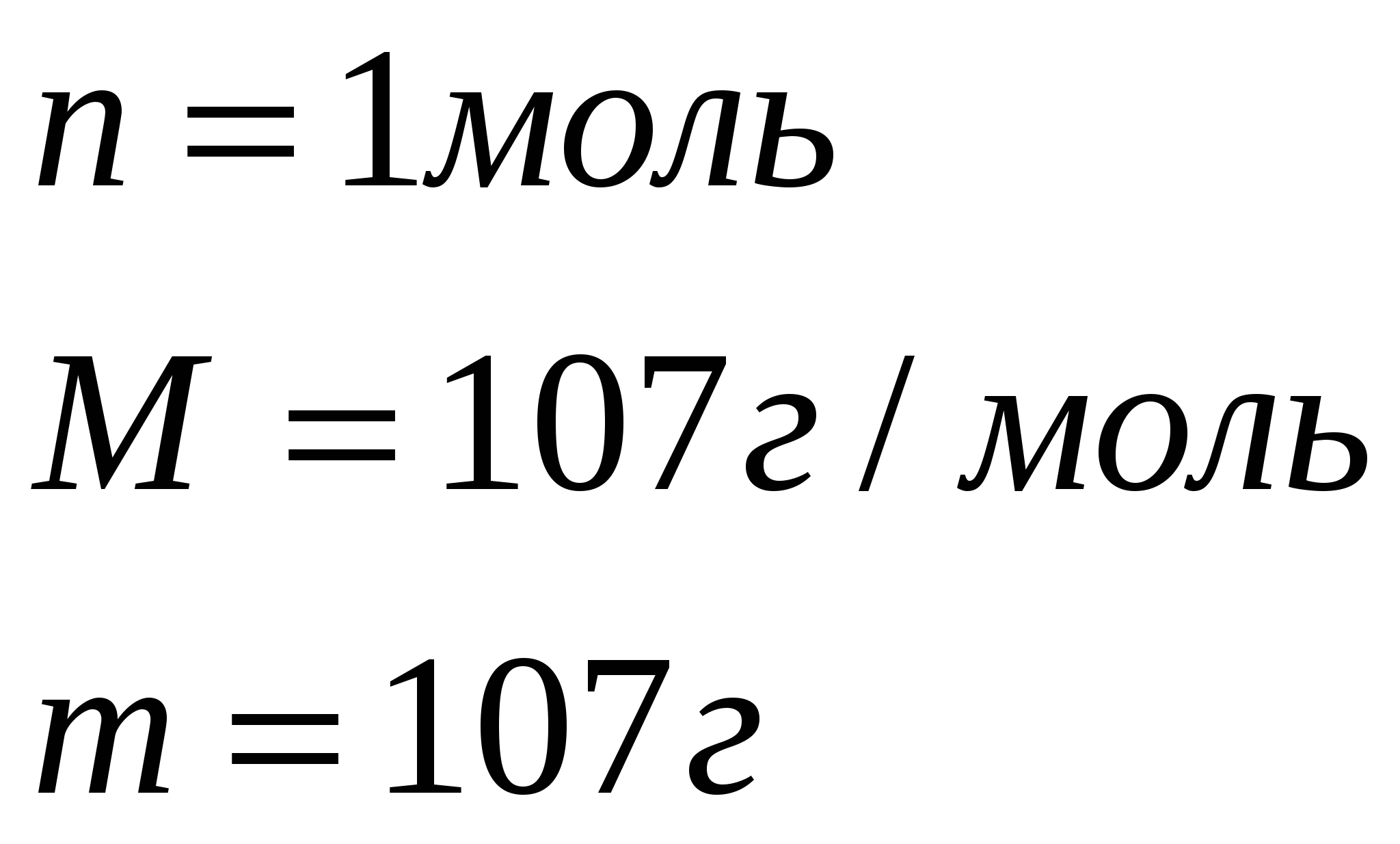
Составим и решим пропорцию

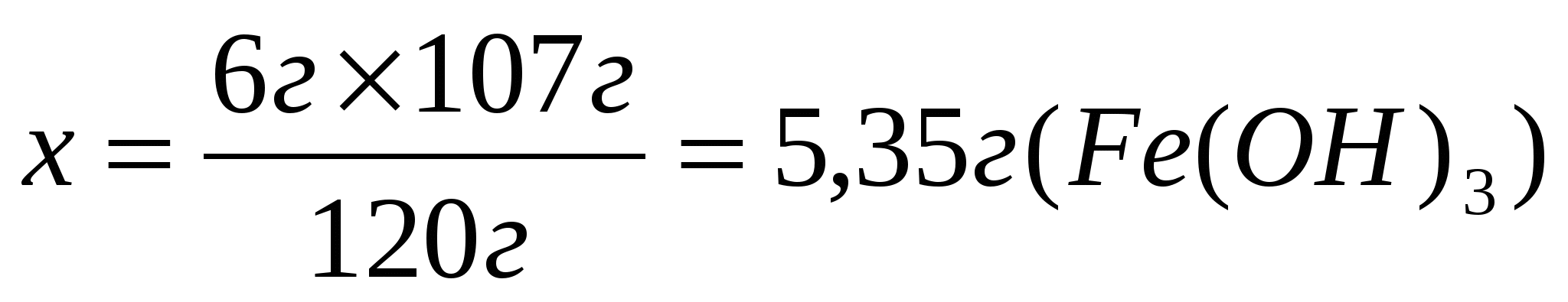
Ответ: 5,35г гидроксида железа (III)выпадет в осадок.
Задачи для самостоятельного решения
Задача 1. К раствору, в котором находится 42,6г нитрата алюминия, прилили раствор, содержащий 16г гидроксида натрия. Рассчитайте массу образовавшегося осадка.
Задача 2. Определите массу осадка, который образуется при сливании 15г 5%-ного раствора хлорида бария и 10г 8%-ного раствора сульфата натрия.
Задача 3. Рассчитайте массу сульфата бария, образующегося при взаимодействии 200г 7%-ного раствора серной кислоты с раствором хлорида бария, содержащим 2 моль этой соли.
3. Расчеты по определению массовой или объемной доли выхода продукта реакции от теоретически возможного (и обратные задачи).
При решении задач такого типа следует помнить, что выход теоретический - это весь выход чистого продукта реакции (масса, объем, количество вещества), который мы стремимся иметь и имели бы, если бы не было производственных потерь. А поскольку они есть, то выход практический всегда меньше100%.
Отношение массы практически полученного продукта к массе вещества, которое должно получиться теоретически, называют массовой долей выхода продукта ( 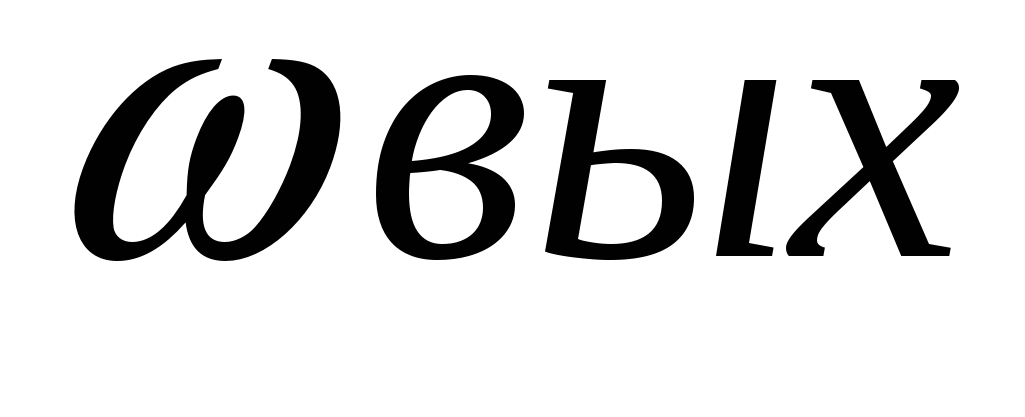 ):
):
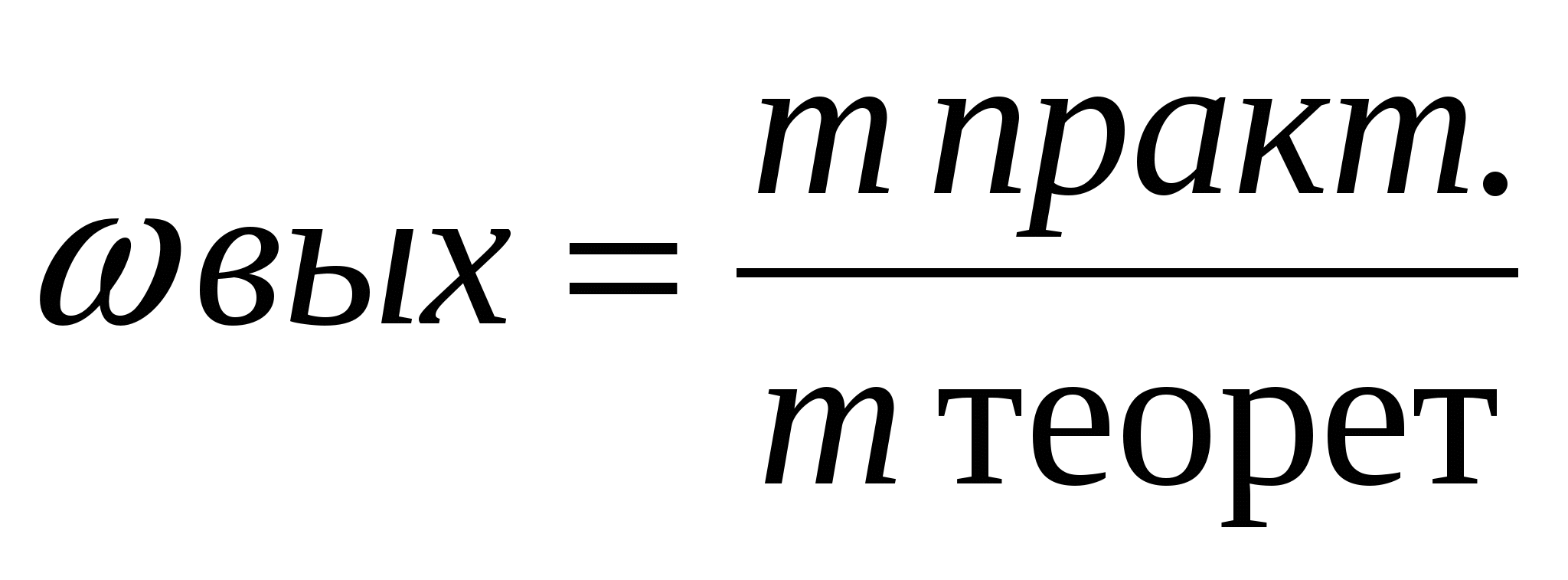
При получении продукта в газообразном состоянии часто определяют отношения их объемов. В этом случае вычисляют объемную долю выхода продукта(φ вых.)

Массовую долю выхода продукта выражают в процентах или в долях единицы.
Задача 1. На гидроксид натрия, взятый в необходимом количестве, подействовали раствором, содержащим 252г азотной кислоты. Вычислите массу полученной соли, если практический выход составляет 90% от теоретического.
Дано

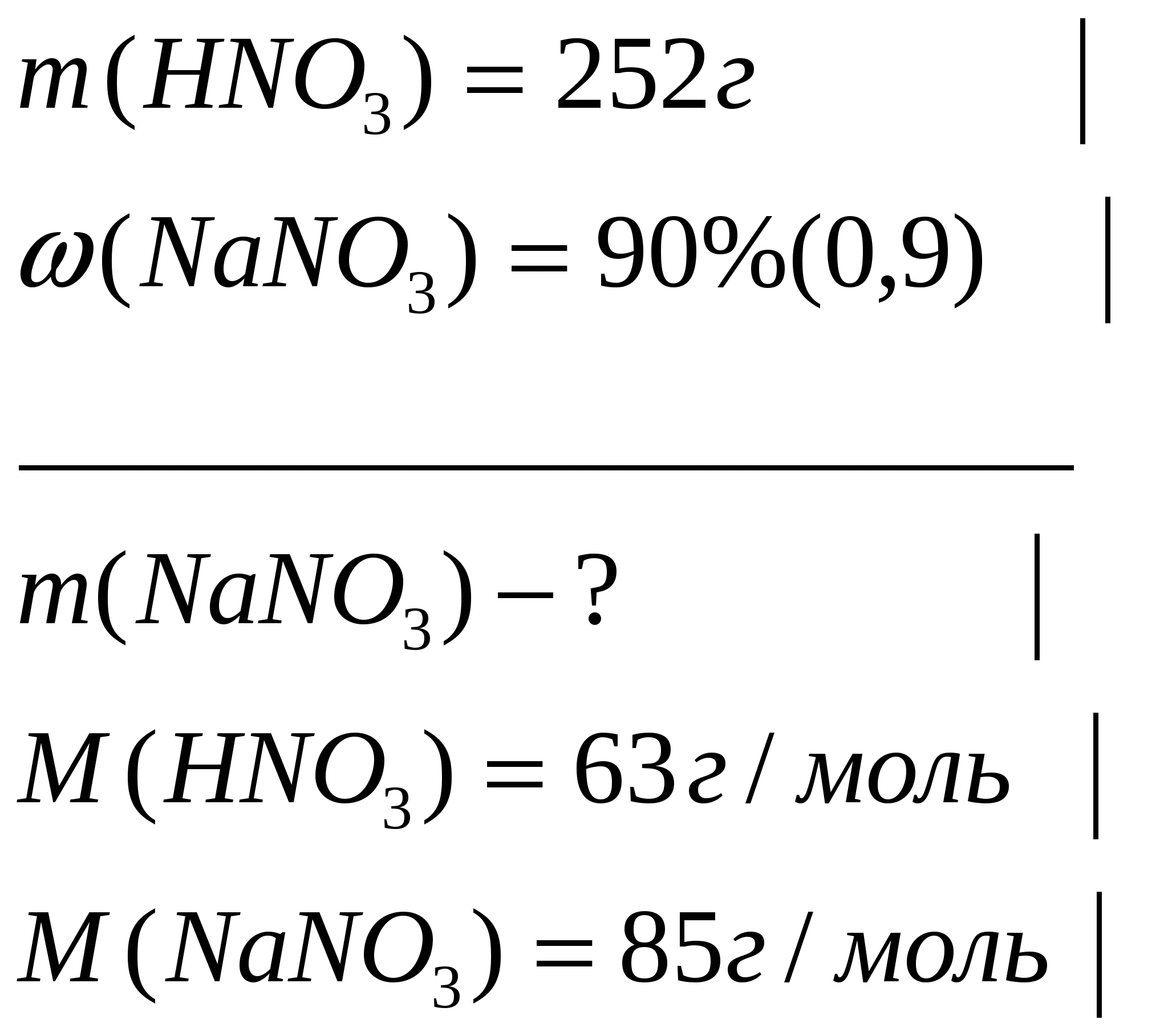
Решение: Из формулы 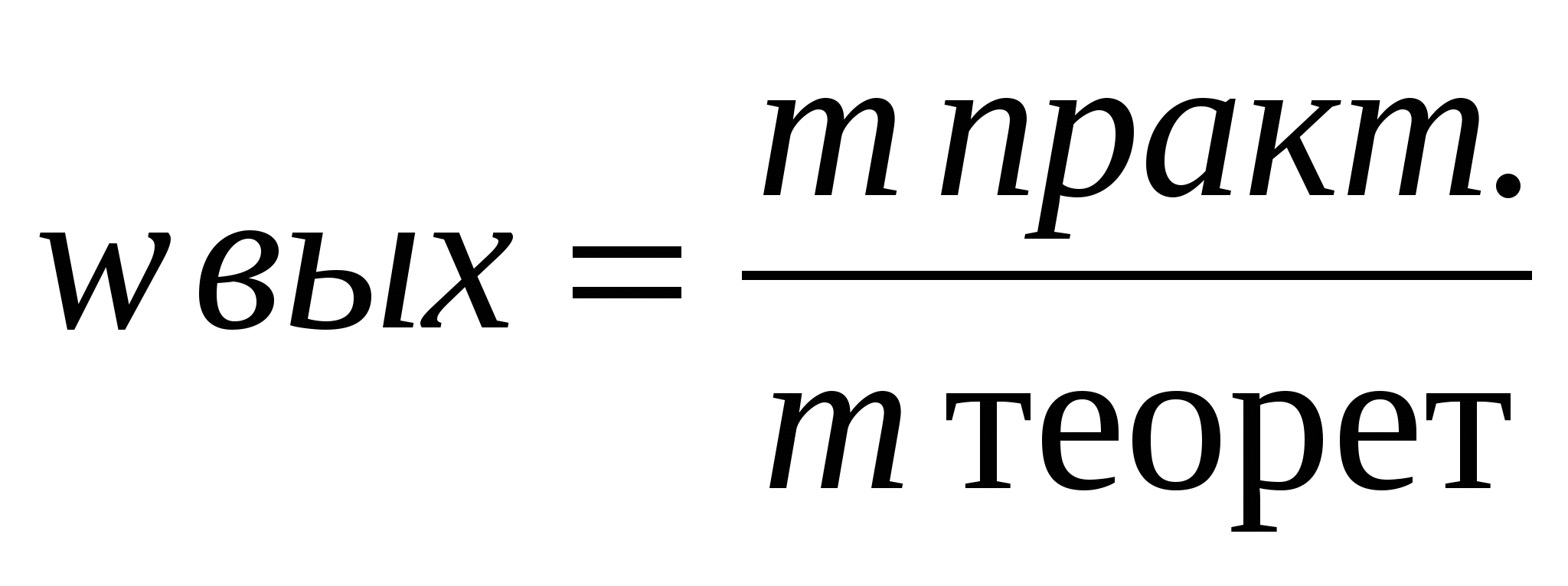 видно, что для расчета массовой доли выхода продукта нужно знать массу теоретическую (
видно, что для расчета массовой доли выхода продукта нужно знать массу теоретическую (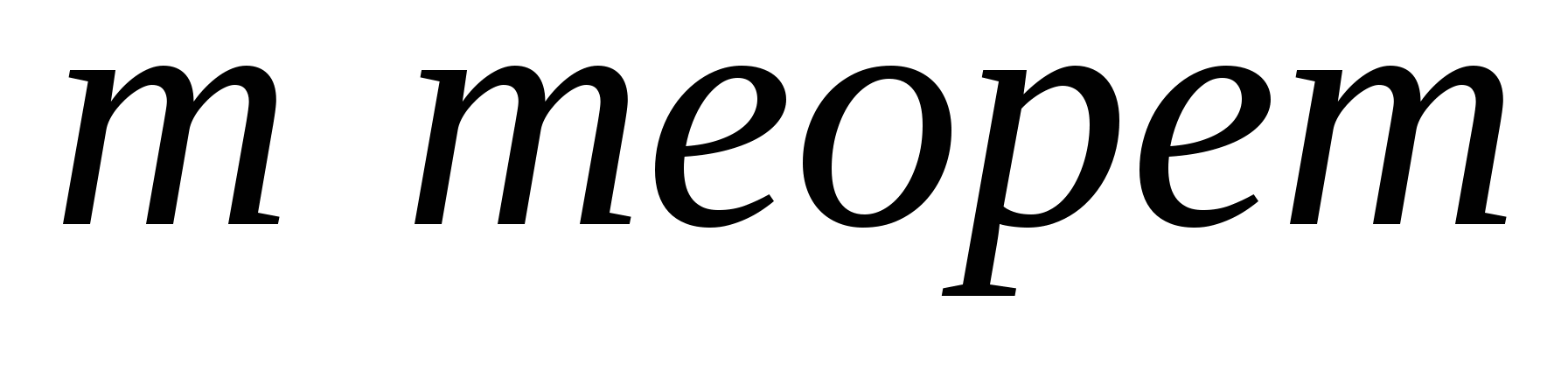 .) и массу практическую (
.) и массу практическую (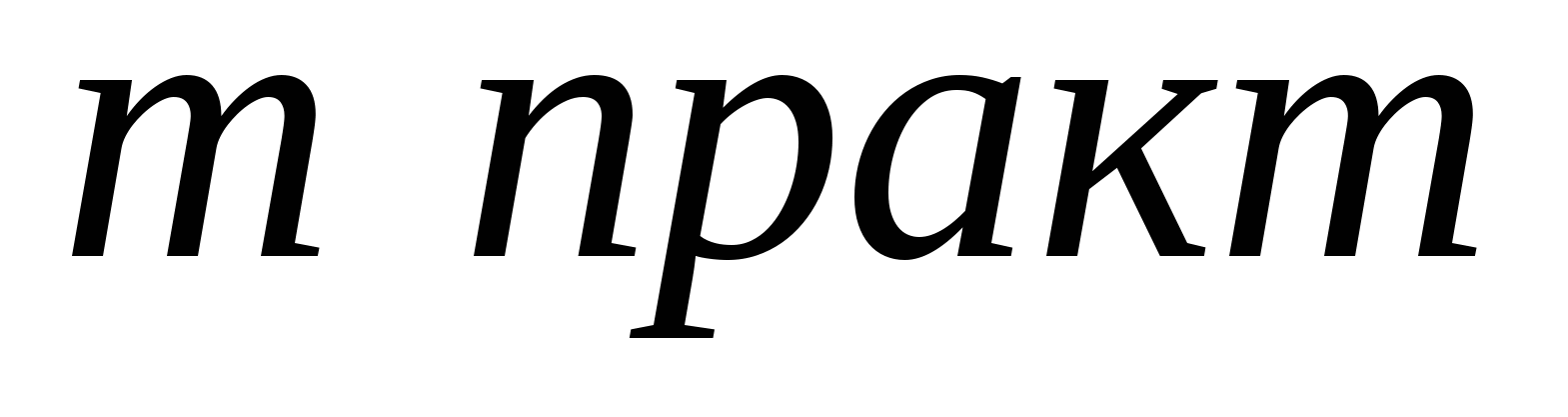 ) полученной соли
) полученной соли
1. Найдем теоретический выход соли по уравнению реакции.
252г 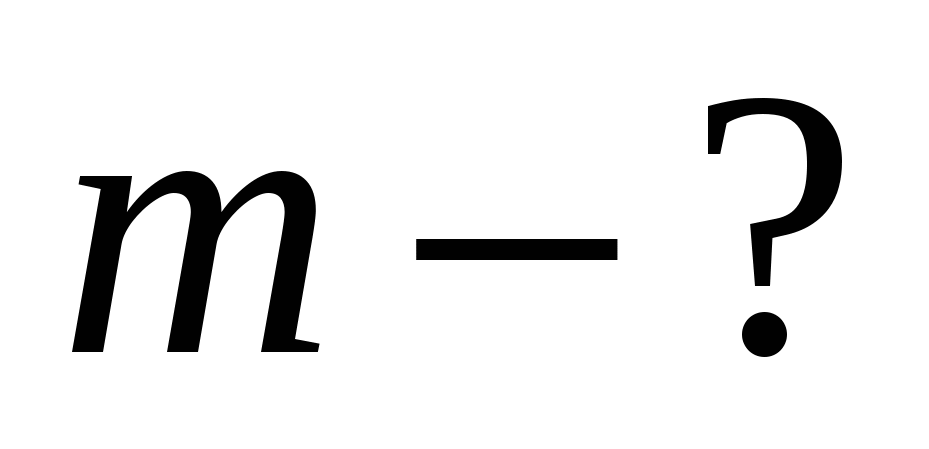
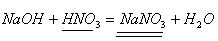
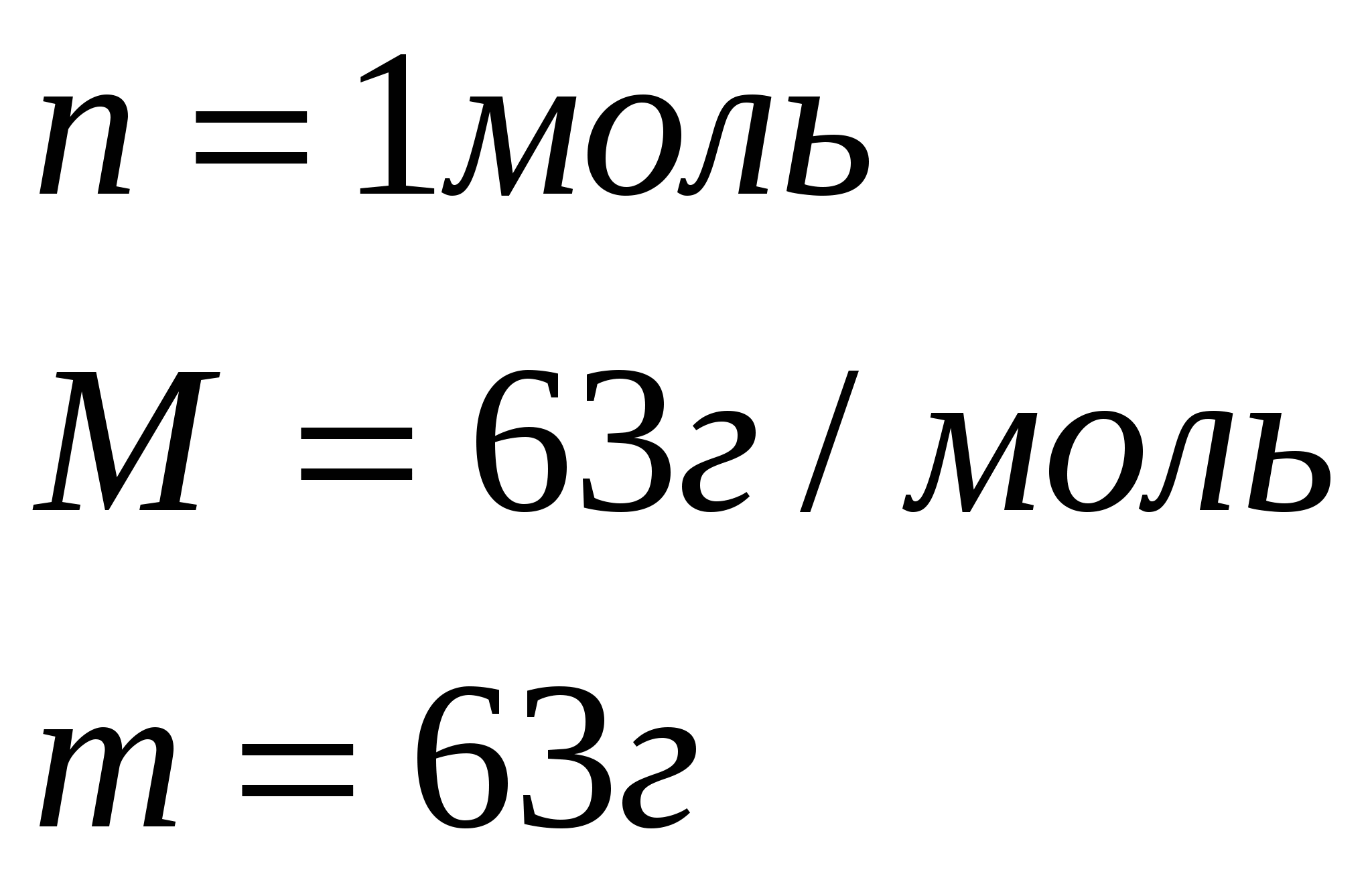
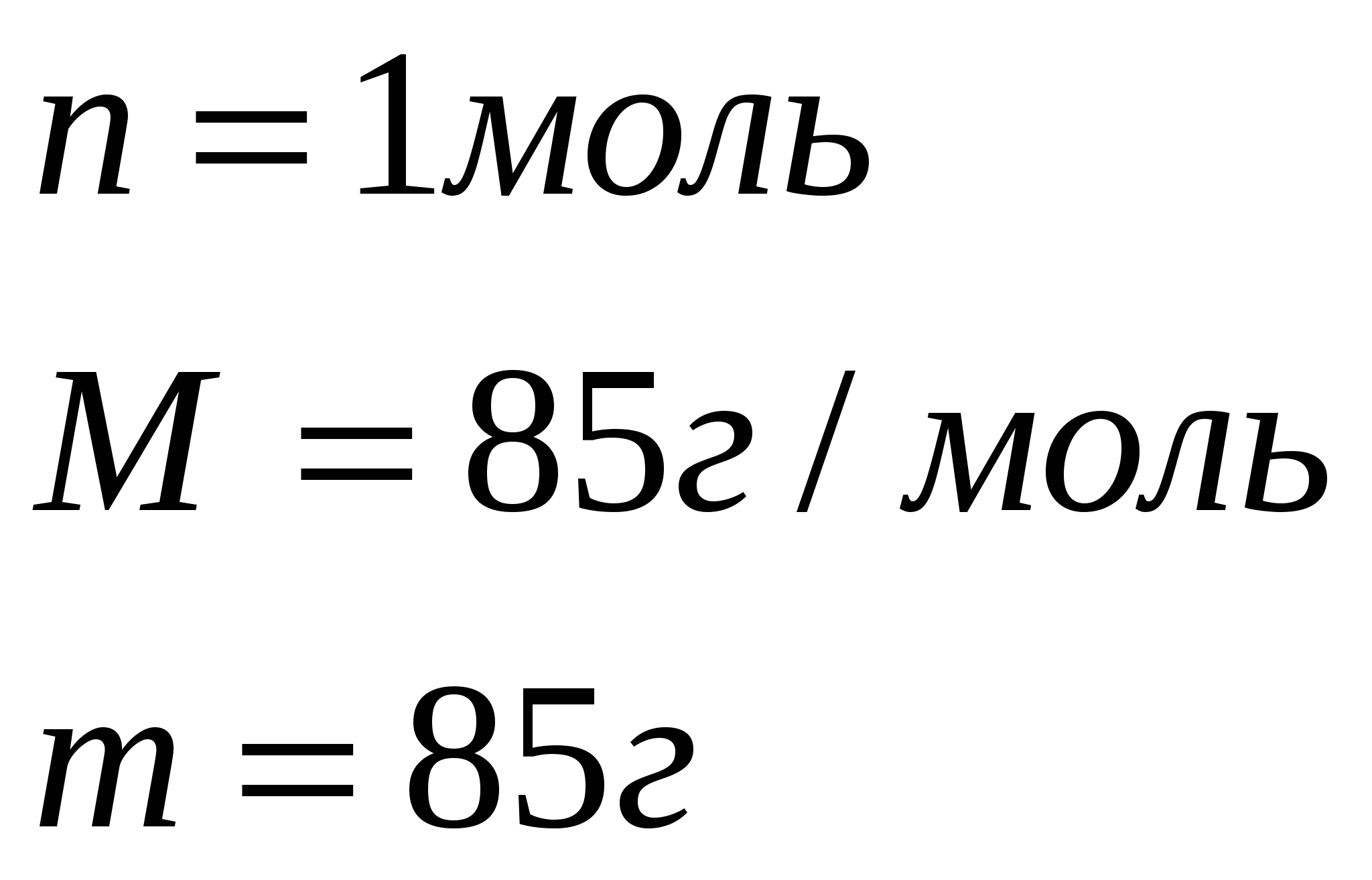
Составим и решим пропорцию
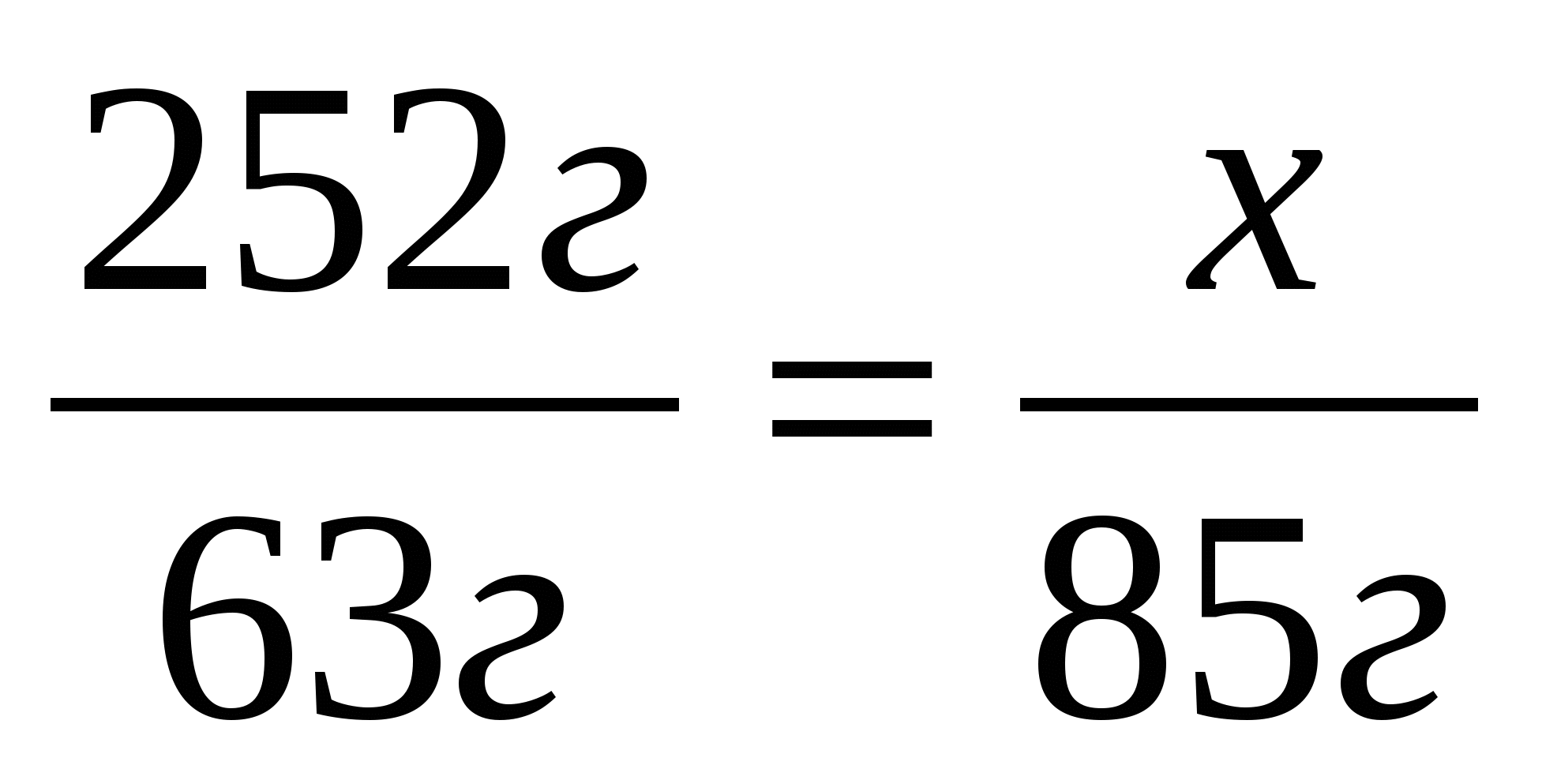
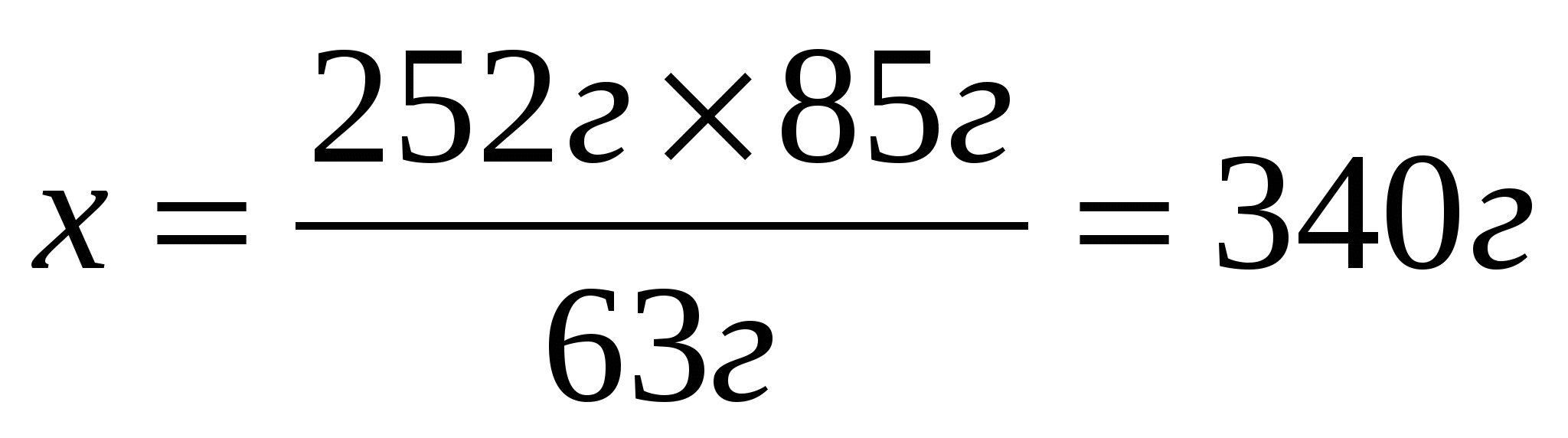
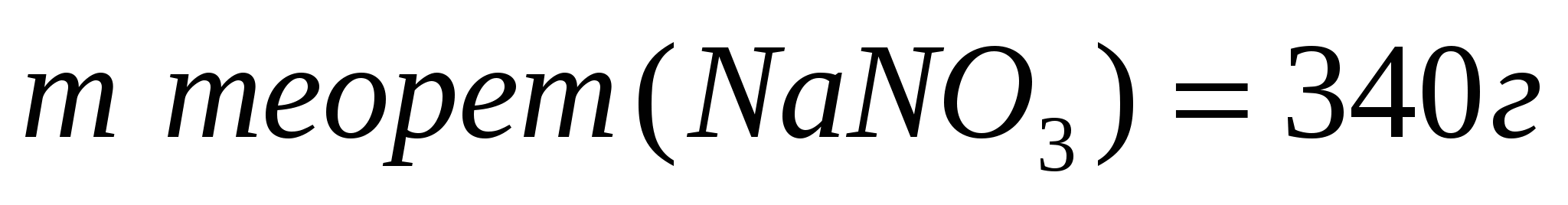
2. Определим массу полученной соли, учитывая, что практический выход составляет 90%(0,9)
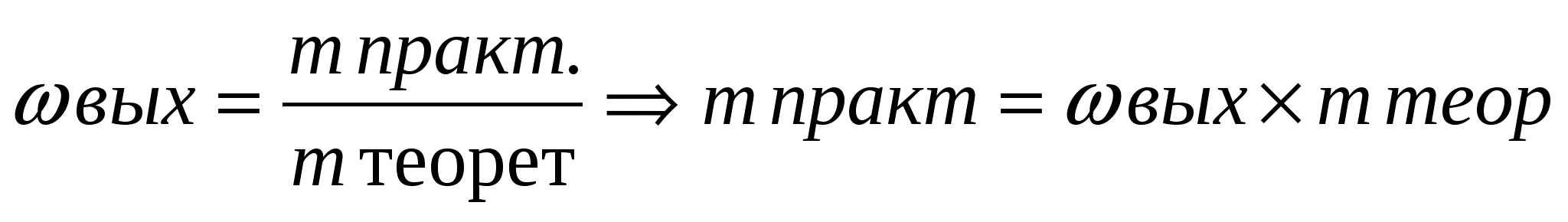
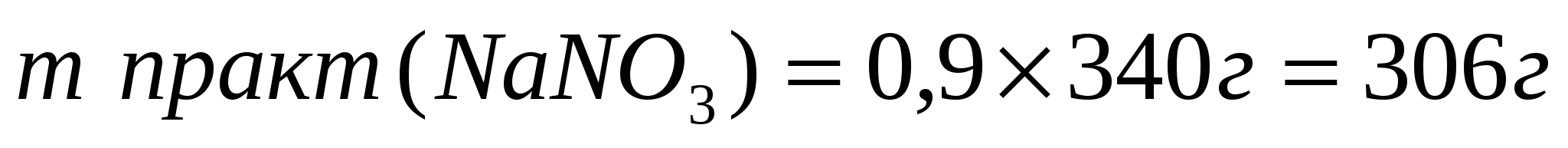
Ответ: практический выход нитрата натрия 306г
Задача 2. Какой объем аммиака (н.у.) можно получить, нагревая смесь 33г сульфата аммония с избытком гидроксида кальция, если объемная доля выхода составляет 85%.
Дано


Решение:
1. Найдем теоретический выход аммиака по уравнению реакции.
33г 
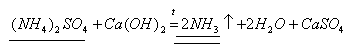
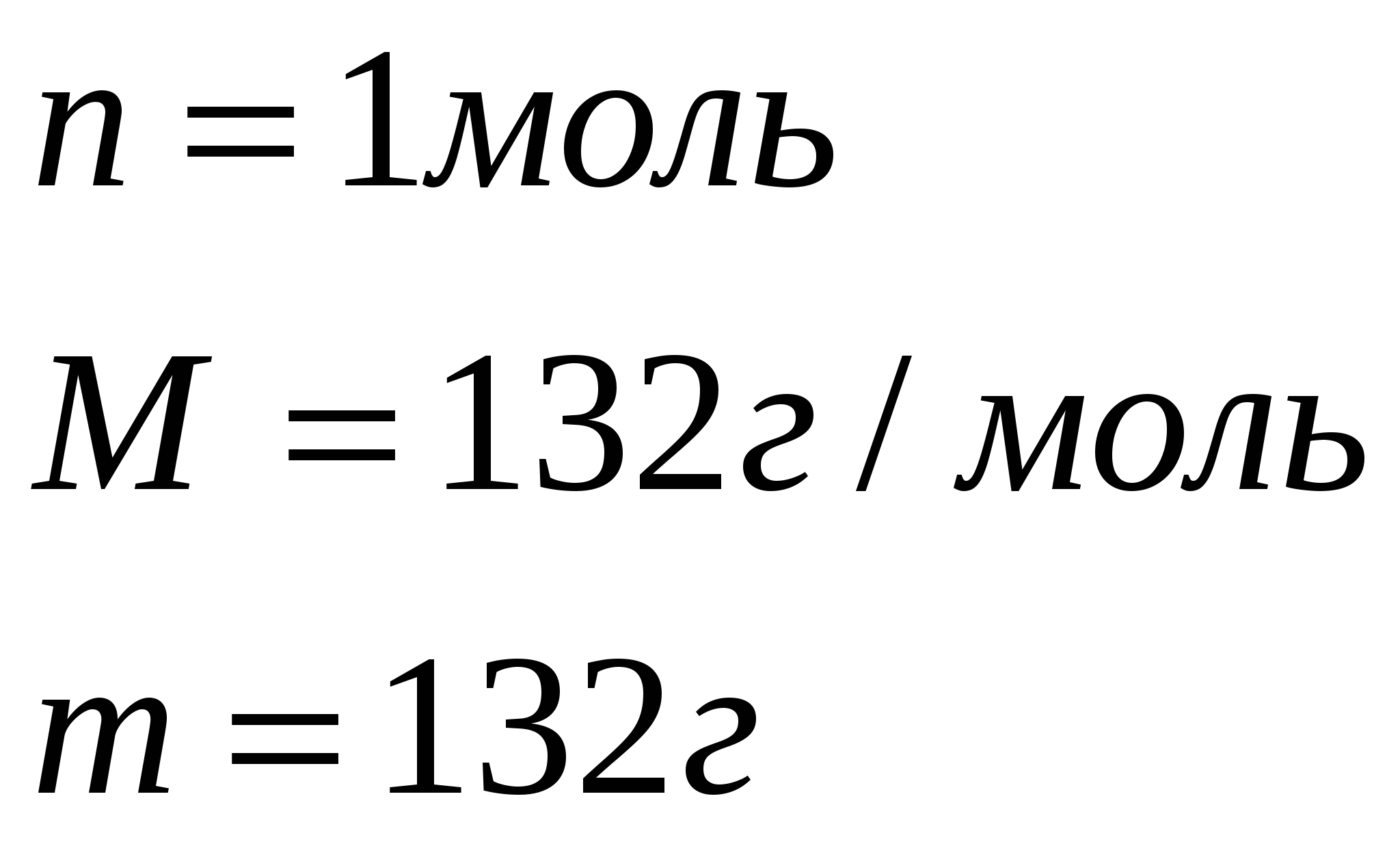
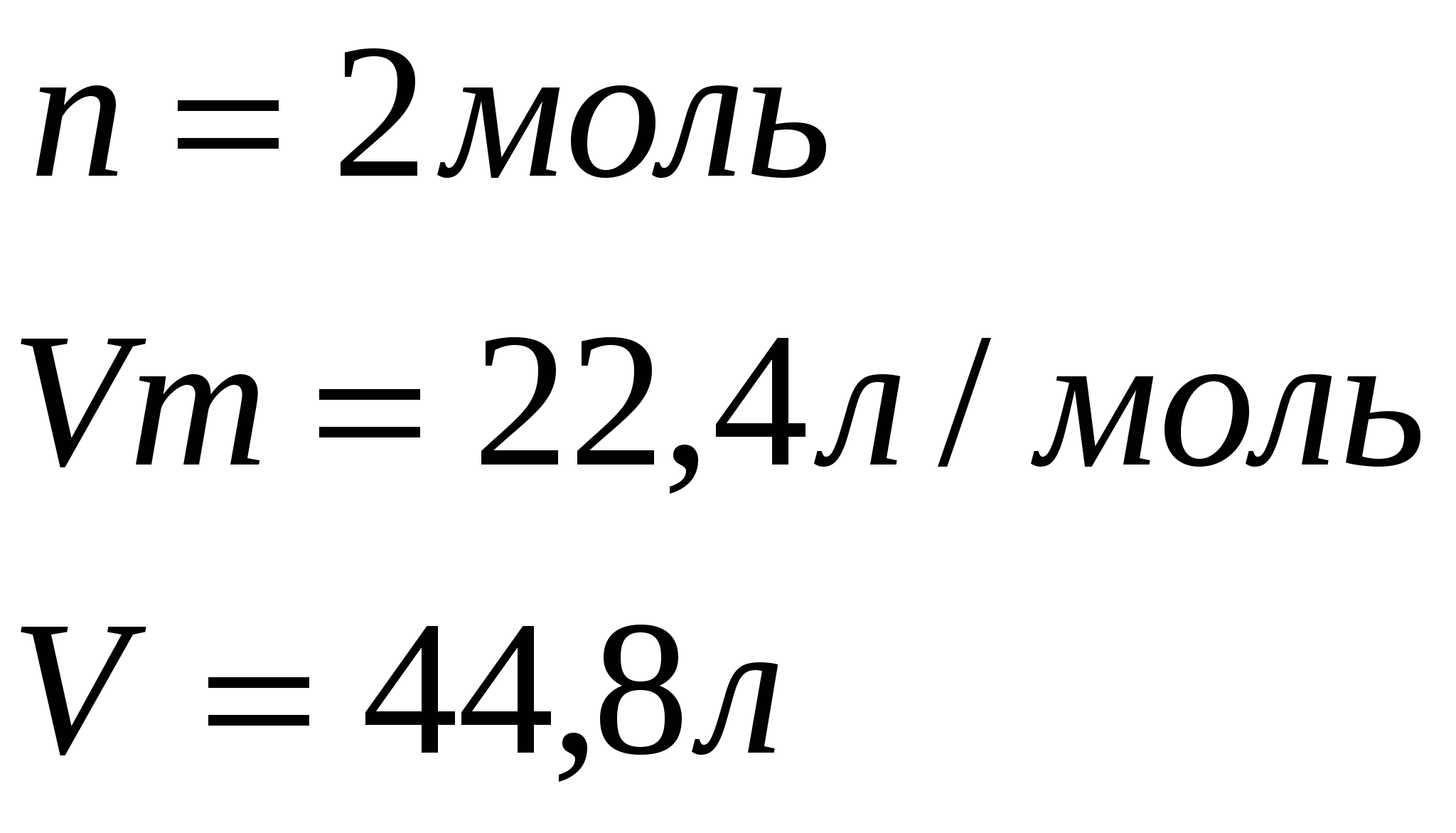
Составим и решим пропорцию
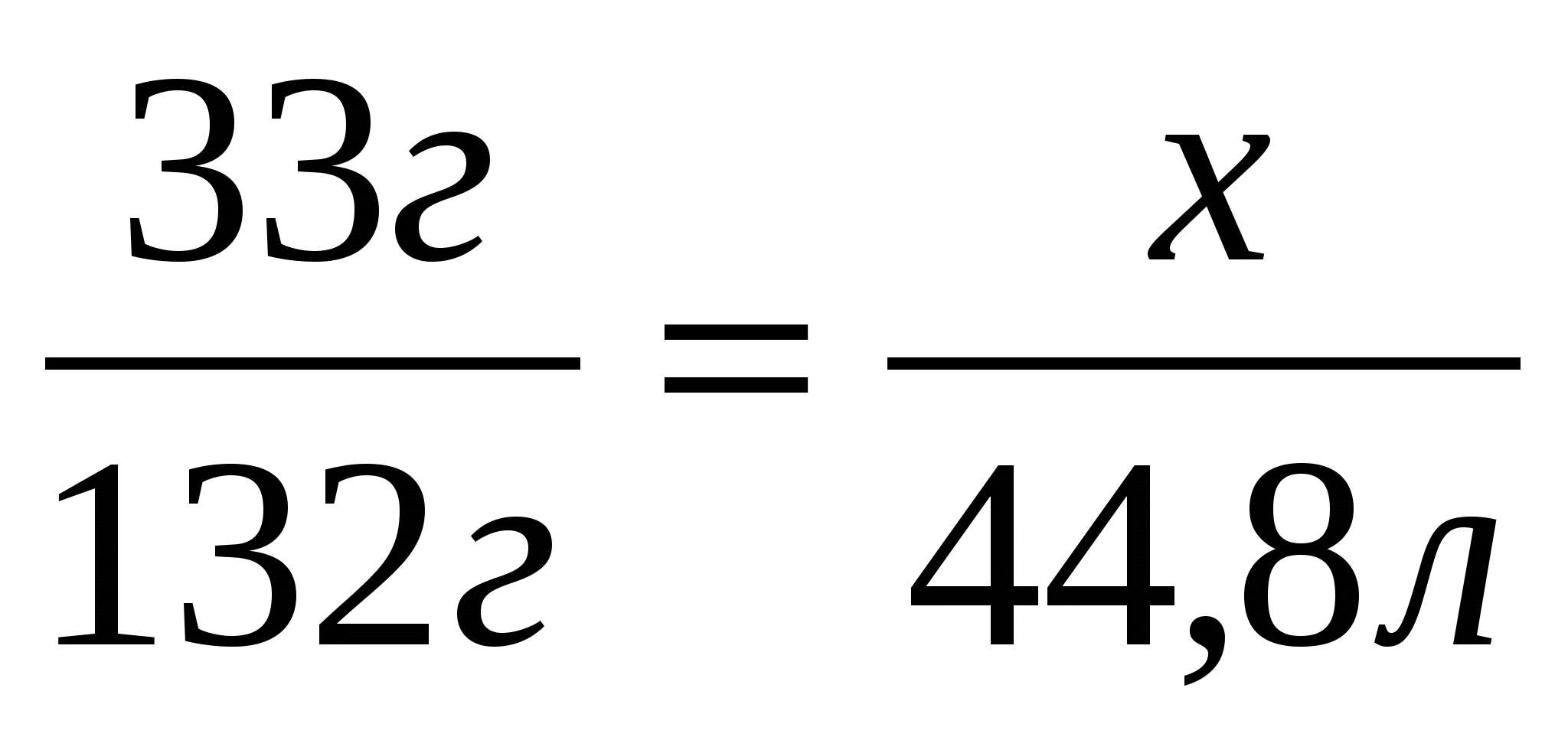
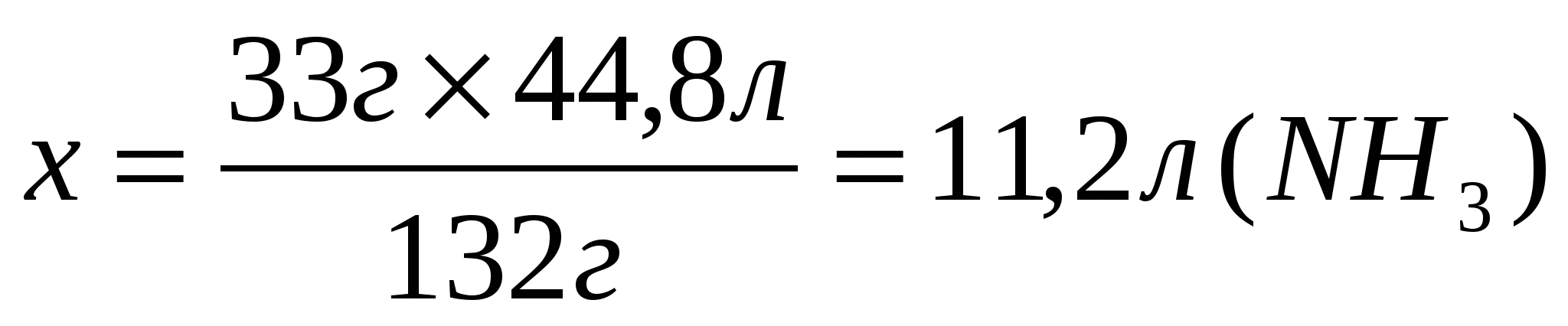

2. Определим объем аммиака, учитывая, что практический выход составляет 85%(0,85)

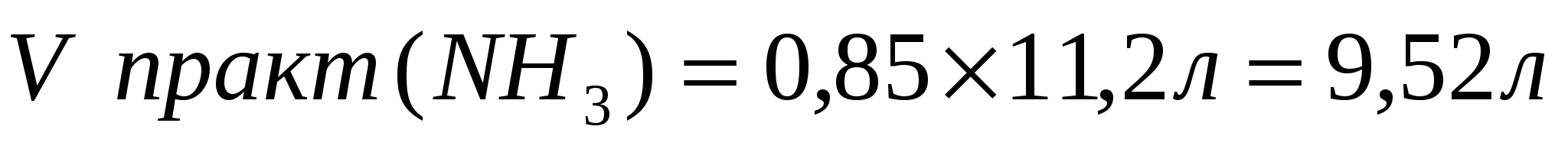
Ответ: практический выход аммиака 9,52л
Задачи для самостоятельного решения
Задача 1. Вычислите объем аммиака (н.у.), который можно получить, нагревая 30г хлорида аммония с избытком гидроксида кальция, приняв, что объемная доля выхода аммиака составляет 94%.
Задача 2. Вычислите массу азотной кислоты, которую можно получить из 20,2г нитрата калия при его взаимодействии с концентрированной серной кислотой, если массовая доля выхода кислоты составляет 0,98.
Задача 3. Какая масса серы потребуется для получения 122,5кг серной кислоты, если суммарный выход составляет 80%?
4. Вычисление массы или объема продукта реакции по известной массе или объему исходного вещества, содержащего примеси.
В процессе разнообразных химических производств для получения того или иного продукта используют исходные вещества (сырье), которые не всегда являются чистыми, а могут содержать различные примеси. Эти примеси не будут образовывать в процессе производства нужные продукты, поэтому чтобы определить массу или объем получаемого продукта, необходимо вначале рассчитать массу или объем вступающего в реакцию чистого вещества, которое содержится в исходной смеси, а уже потом решать основную (базовую) задачу по уравнению реакции.
Содержание примеси обычно выражают в процентах. Это величина показывает массовую долю чистого вещества или массовую долю примеси в образце. Для вычисления массы чистого вещества или примеси, содержащихся в смеси, используют формулу:
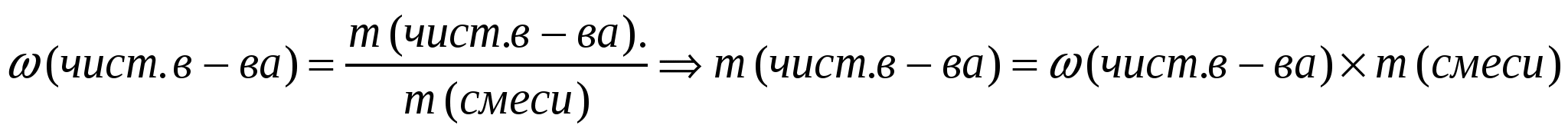
Массу чистого вещества, или его объем, можно найти по- другому. В начале, определяют массу примеси, а затем вычитают ее из массы смеси.
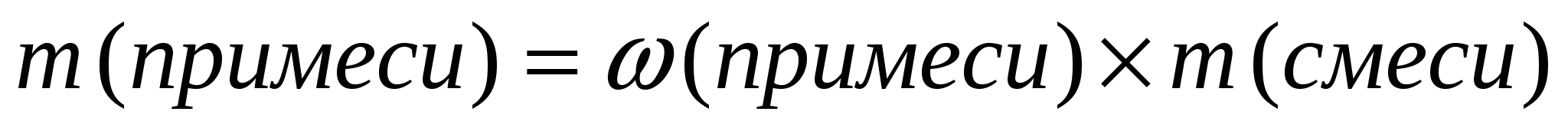

Задача 1. Какую массу оксида кальция можно получить при термическом разложении 600г известняка, содержащего 10% примесей
Дано

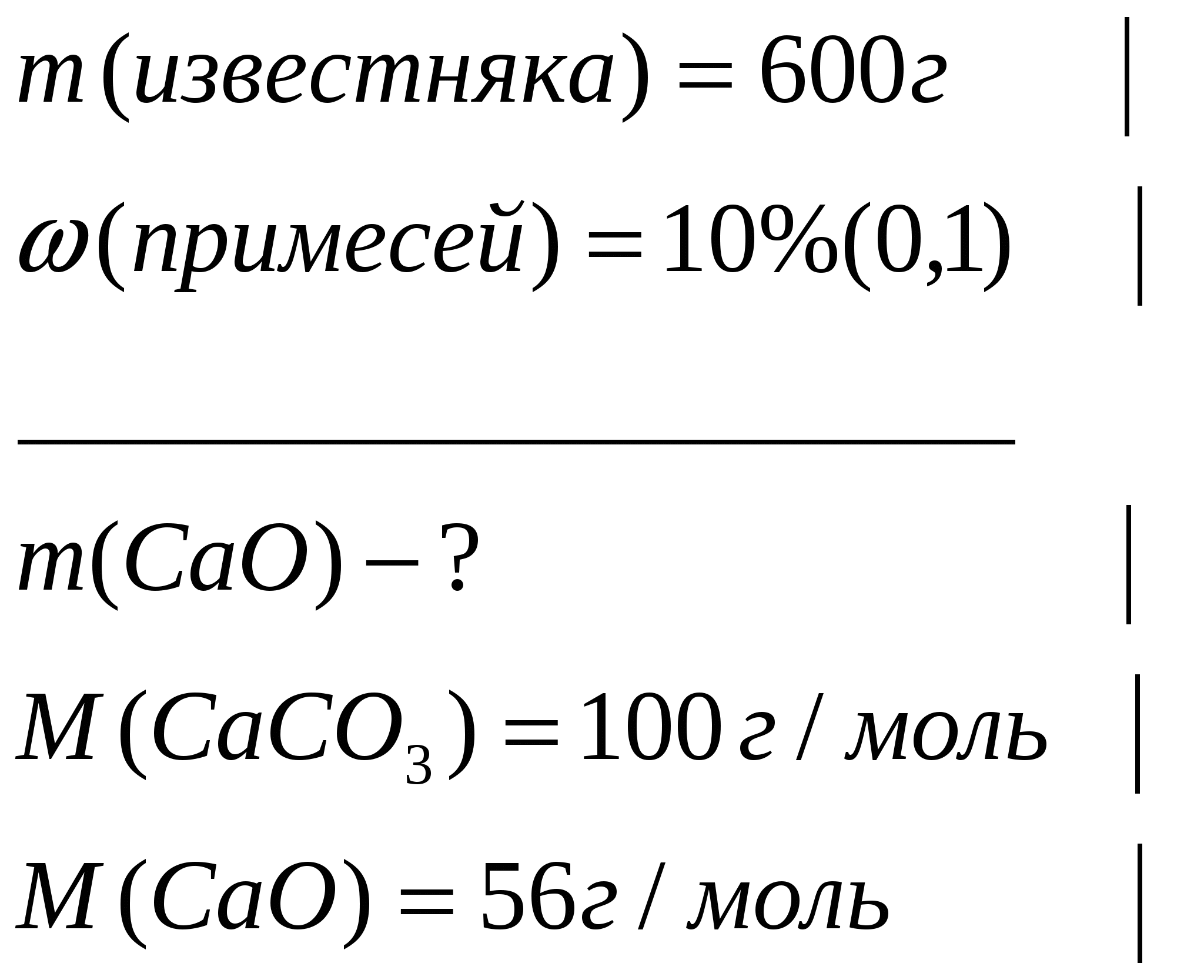
Решение:
Основным компонентом известняка является карбонат кальция 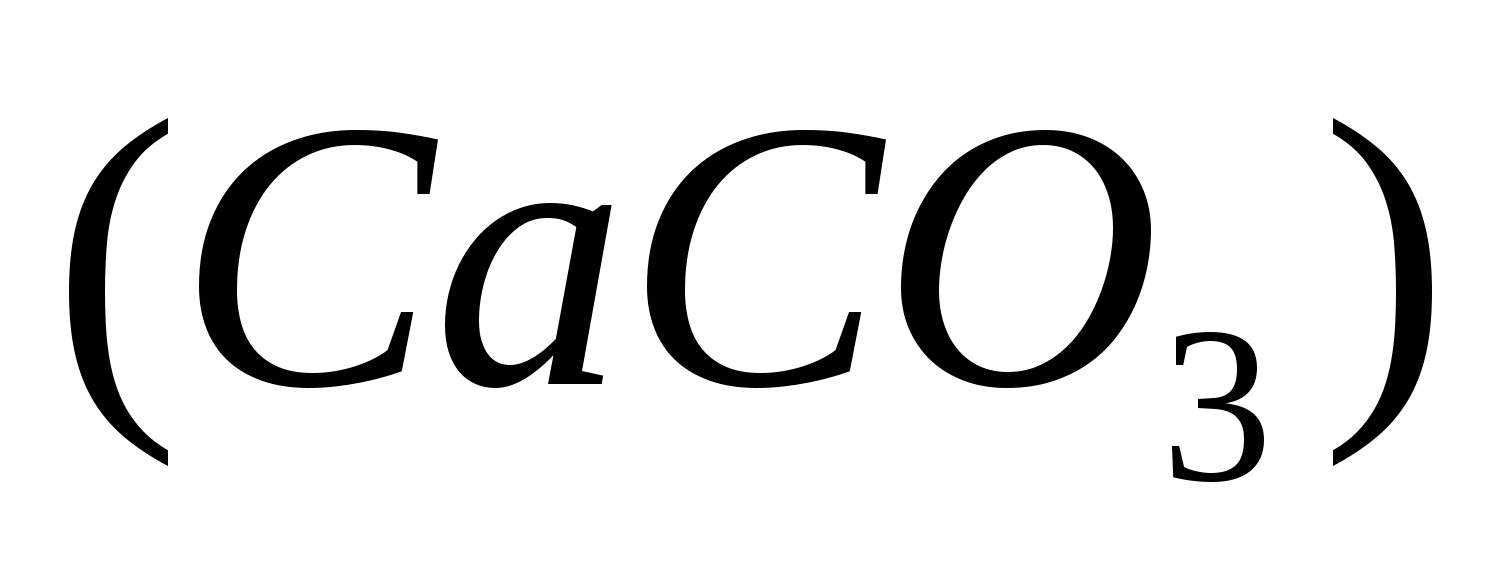
1. Вычислим массу чистого карбоната кальция.
1ый способ
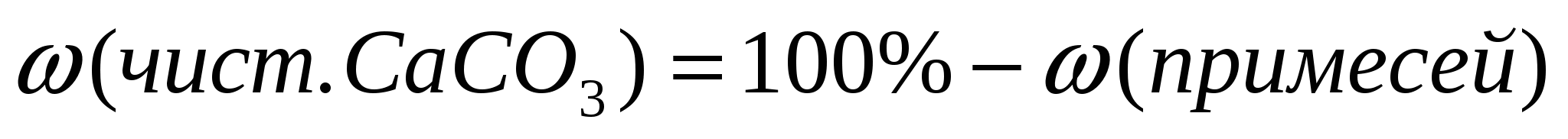
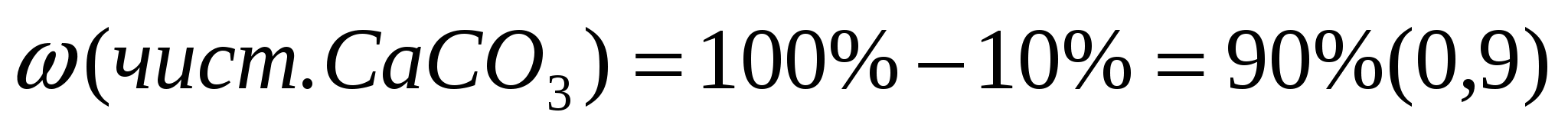
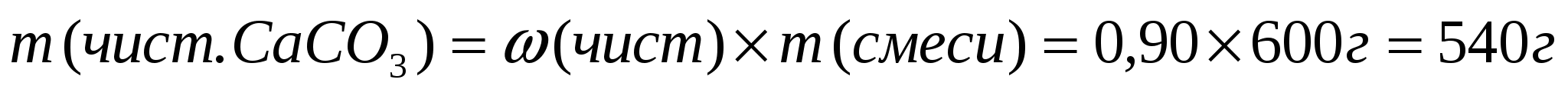
2ой способ
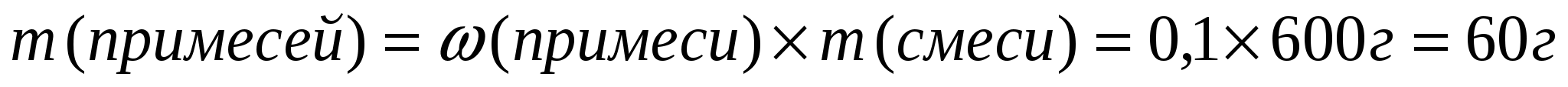
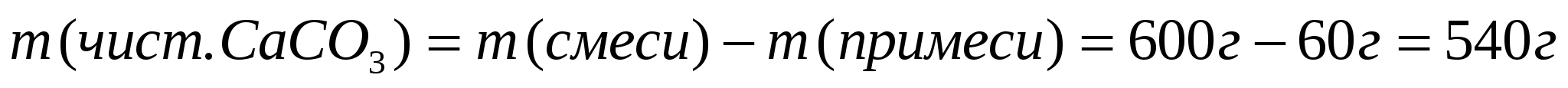
2. Найдем массу образовавшегося оксида кальция
540г 
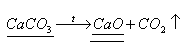

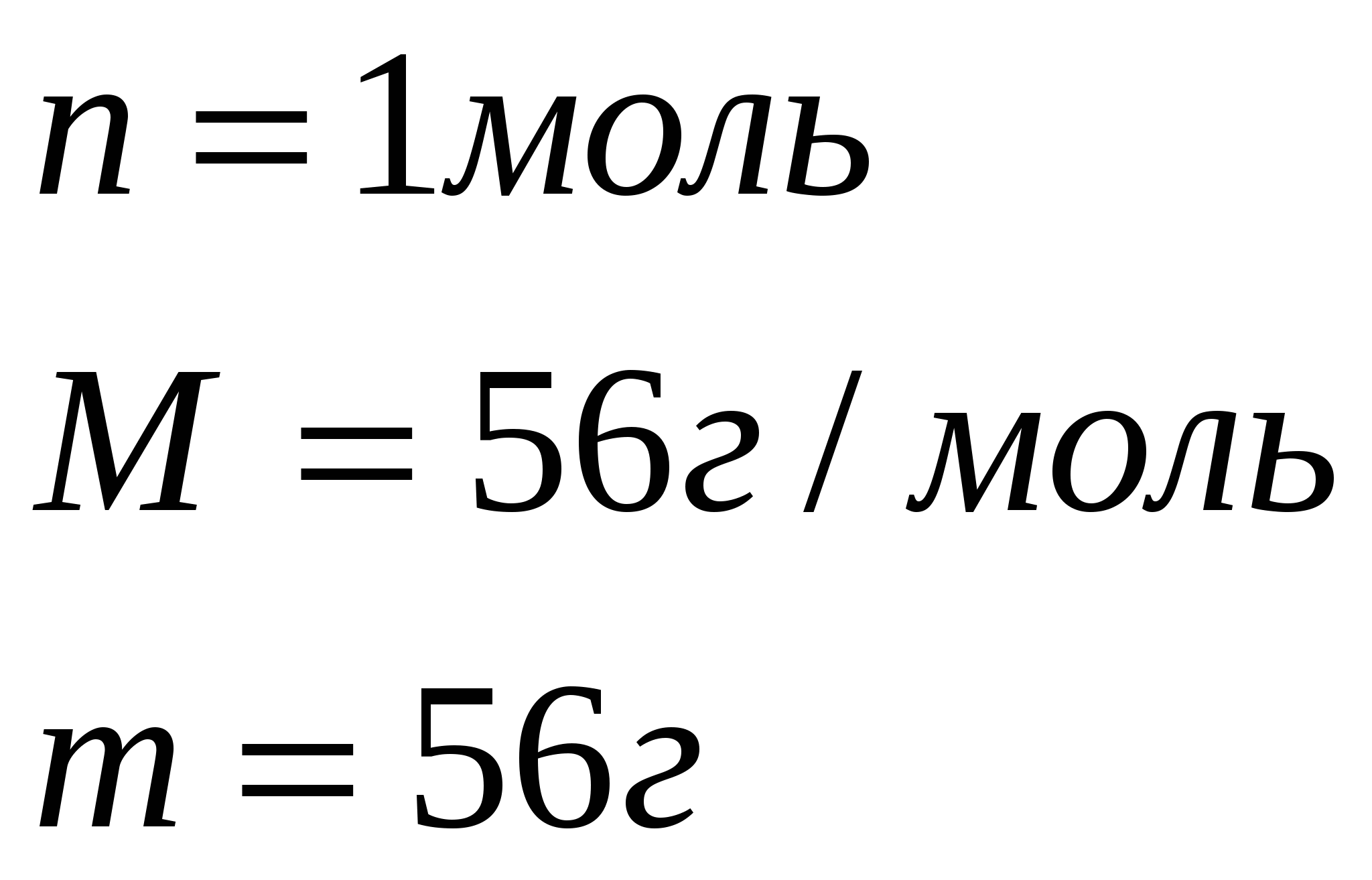
3. Составим и решим пропорцию

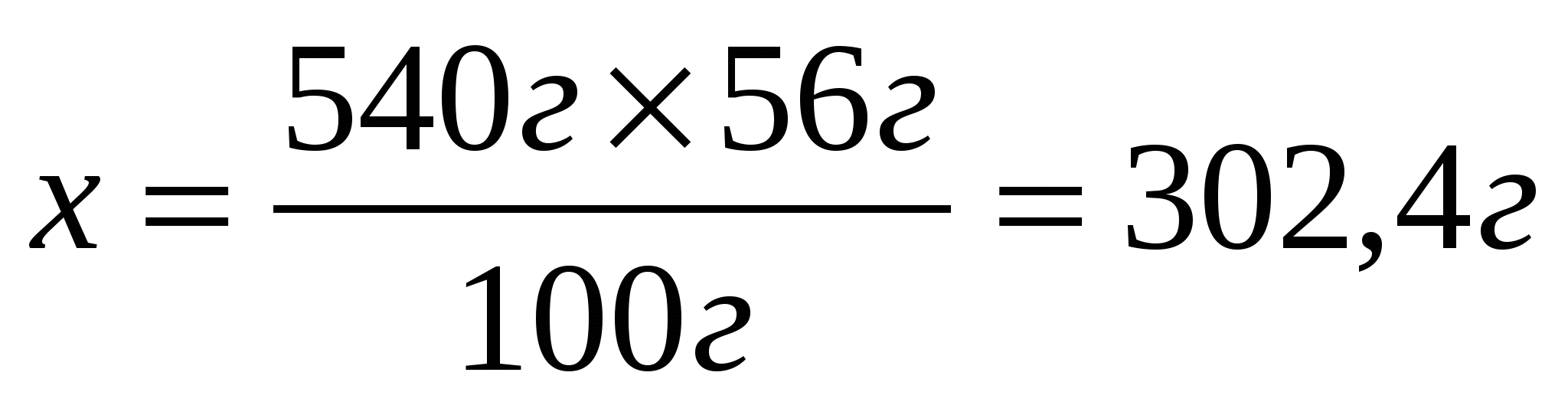
Ответ: 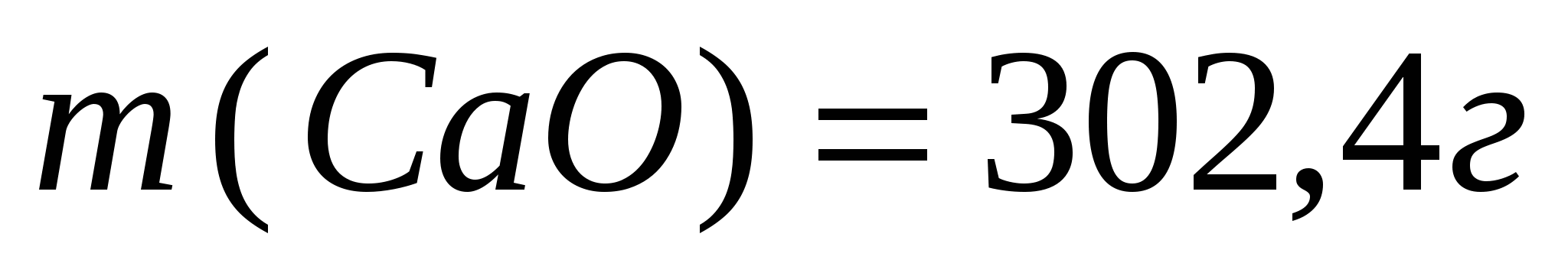
Задача 2. Какой объем (н.у.) углекислого газа можно получить при термическом разложении 200г известняка, содержащего 20% примесей?
Дано

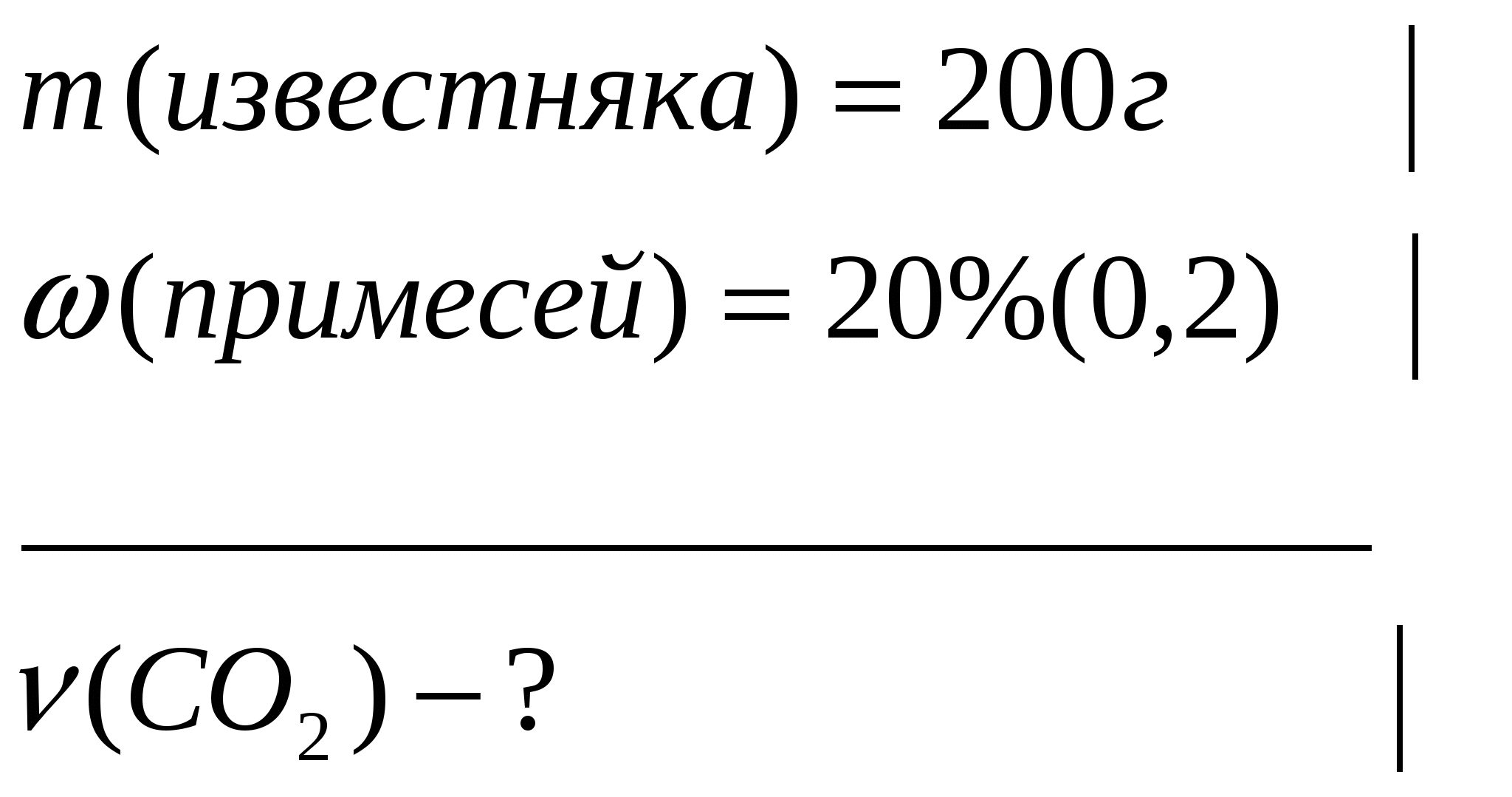
Решение:
1. Вычислим массу чистого карбоната кальция. 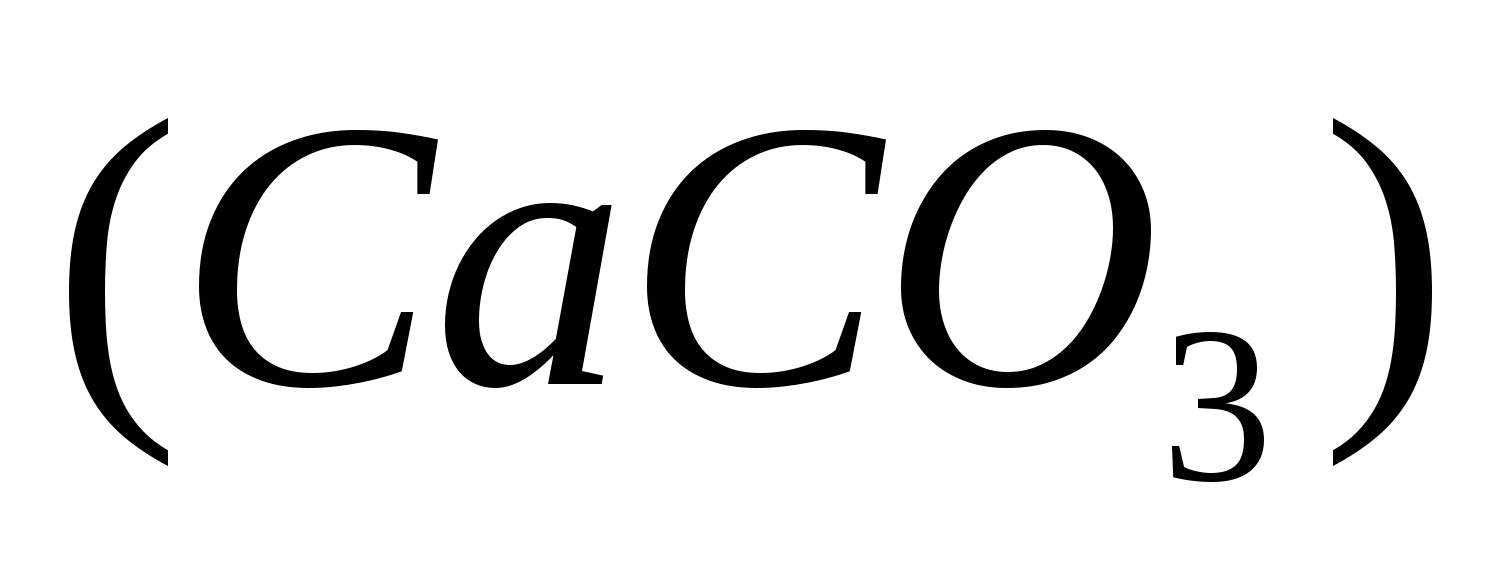
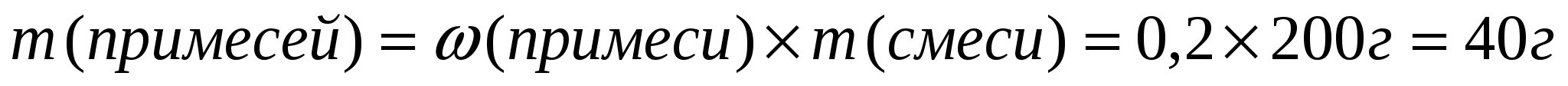
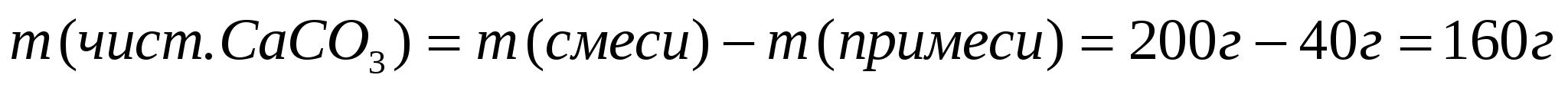
2. Найдем объем образовавшегося оксида углерода (IV)
160г 



3. Составим и решим пропорцию
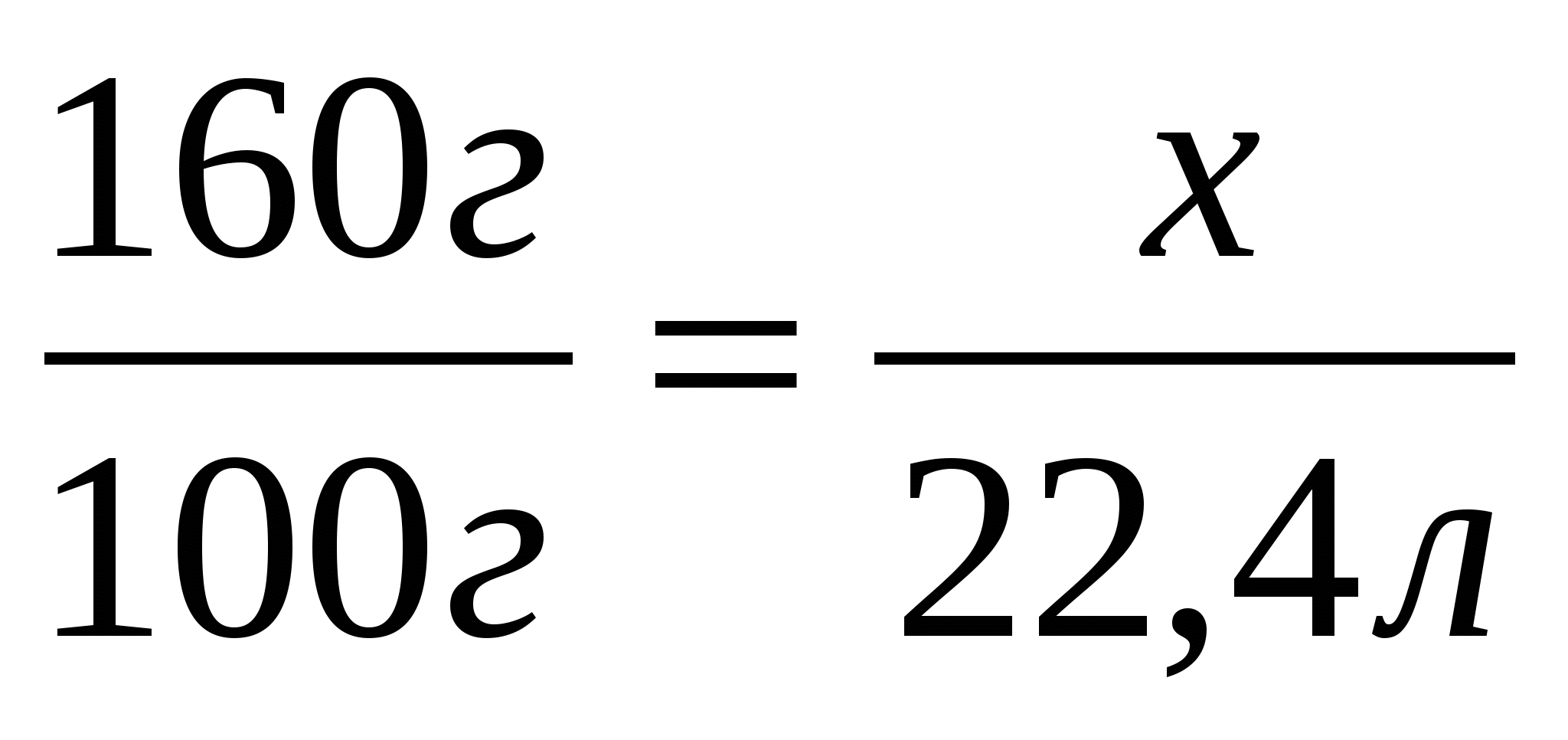
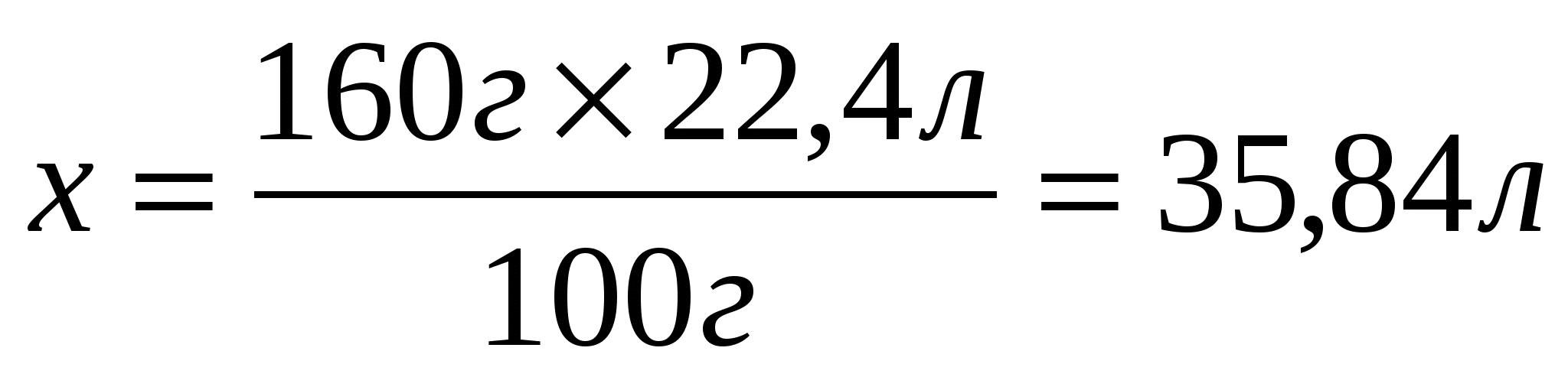
Ответ: 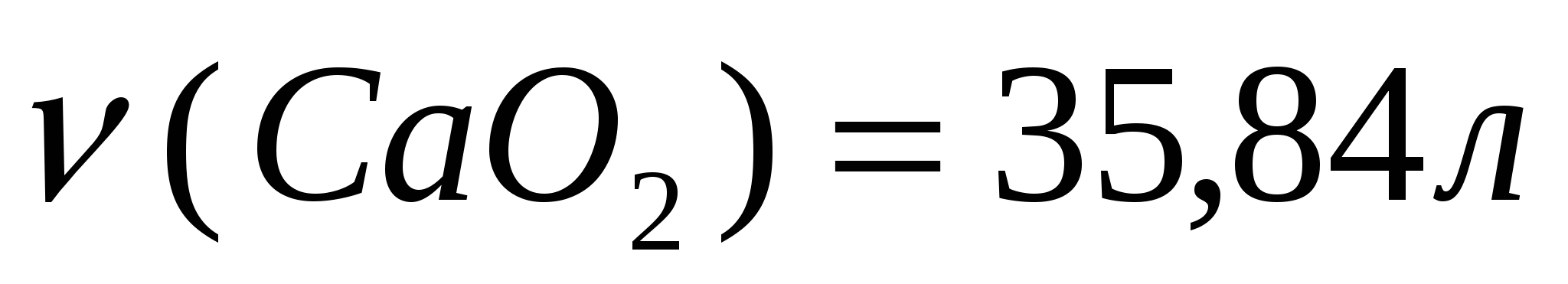
Задачи для самостоятельного решения
Задача 1. Рассчитайте массу и количество вещества (моль) оксида бария, образующего при разложении 80г карбоната бария, содержащего 3% примесей.
Задача 2. Какая масса кремния должна образоваться при восстановлении углем 60г оксида кремния (IV), содержащего 5% примесей?
Задача 3. Определите объем (в л.) и количества вещества (моль) оксида углерода (IV), которые можно получить при разложении 0,6 кг известняка, содержащего 5% примесей (н.у.)


