- Преподавателю
- Химия
- Конспект урока Типы химических реакций
Конспект урока Типы химических реакций
| Раздел | Химия |
| Класс | - |
| Тип | Конспекты |
| Автор | Кондратова М.А. |
| Дата | 11.11.2015 |
| Формат | docx |
| Изображения | Есть |


Цели:
повторить и закрепить знания о типах химических реакций и принципах их классификации, развивать умения определять типы реакций, писать уравнения реакций, проводить по ним расчеты; опытным путем подтверждать свои знания;
продолжать развивать научно-познавательную и коммуникативную компетенции, логическое мышление, эрудицию.
Перед уроком группа делится на 4 команды по 4 - 6 человек.
Ход урока
Преподаватель: Любой человек, не взирая на возраст, любит путешествовать. Вот и вас я приглашаю совершить вместе со мной путешествие в Страну химических реакций.
1 этап. Собери рюкзак
Преподаватель: Перед тем как отправится в путешествие мы должны собрать рюкзак. В него мы положим знания, которые нам пригодятся в нашем путешествии.
На столе Преподавателя карточки в виде компаса, спичек и т. д. За каждый ответ на вопрос команда получает карточку-снаряжение.
-
Что такое химические реакции? ( Это процессы, в которых из одних веществ образуются другие, отличающиеся по составу и свойствам.)
-
Перечислите признаки химических реакций. ( выпадение осадка, выделение газа, выделение тепла)
-
По каким признакам классифицируют химические реакции? ( по составу, по тепловому эффекту, по действию катализатора, по направлению)
-
Дайте определение экзотермическим реакциям.( Это реакции идущие с выделением тепла)
-
Дайте определение эндотермическим реакциям. .( Это реакции идущие с поглощением тепла)
-
Дайте определение реакциям соединения. ? ( Это процессы, в которых из простых веществ образуются сложные)
-
Дайте определение реакциям разложения. ( Это процессы, в которых из сложных веществ образуются простые)
-
Дайте определение реакциям замещения. ( Это процессы, в которых атомы простого вещества замещают атомы в сложном веществе)
-
Дайте определение реакциям обмена. ( Это процессы, в которых сложные вещества обмениваются составными частями)
-
На основании какого закона мы расставляем коэффициенты в уравнениях химических реакций? (Закон Авогадро)
Итоги I конкурса (за каждое определение дается 1 карточка-снаряжение).
2 этап. Наскальные рисунки
Преподаватель : Сейчас мы подошли к гористой местности. Перед нами четыре горы с наскальными рисунками. . Ваша задача разгадать эти надписи, записать примеры химических реакций и подтвердить их опытным путем.
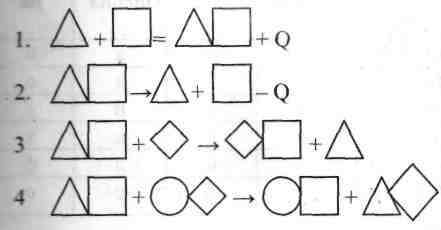
1.Соединение : NH3 + HCl = NH4Cl
2.Разложение: C12H22CaO14 = 11C + CO2 + CaO + 11H2O
3.Замещение 2HCl + Zn = ZnCl2 + H2
4. Обмен: 2KOH + CuSO4 = Cu(OH)2 + K2SO4
3 этап. Река уравнений реакций
Преподаватель: А сейчас нам предстоит преодолеть реку уравнений химических реакций.
Каждая команда получает карточку с уравнениями реакций. Ваша задача дописать уравнения реакций , расставить коэффициенты и определить тип химической реакции
1 карточка
CuS04 + КОН
H2S + CuCl2
Cu(OH)2 + HN03
2 карточка
Fe2(S04)3 + NaOH
CuS04 + KC1
СаСО, + НС1
3 карточка
FeCl3 + КОН
КОН + ВаС12
MgO + H2S04
4 карточка
CuS043 + NaOH
NaOH+ HN03
СаСО, + H2S04
Команда получает по 1 баллу за каждое правильно решенное уравнение реакции.
4 этап. Привал
Преподаватель: Перед тем как идти дальше нам необходимо отдохнуть. Поэтому сейчас у нас будет привал. Двое учеников отправляются на химическую рыбалку.( по одному от каждой команды)
Из плотного листа бумаги вырезают карточки. Одна половина карточек выполнена в форме головы рыбы и передней части ее туловища, а другая половина - в виде задней части туловища рыбы и хвоста. На карточках первого вида написаны начала химических реакций, а на карточках второго вида- окончание химических реакций. . Карточки крепятся на доске с помощью магнитов. «Рыболов» должен выловить «голову» и »хвост» рыбы и сразу же на доске из «пойманных» карточек - частей рыб составить уравнение реакций.
Победителем будет тот «рыболов», который поймал больше рыб-карточек и составил из них больше химических уравнений.. Задание на время.
Учитель: А чтобы нам не
Си
Al
Mn
Fe
Zn
Mg
Ag
Hg
Pt
Au
Zn
Mg
Ni
Fe
Hg
Al
Mn
Pt
Na
S02
Si02
Zn
Na20
C02
CuO
Ag
N205
S02
Na20
FeO
CuO
C02
P205
ZnO
S03
N205
Преподаватель: Чтобы вам не было скучно поиграем в крестики - нолики.
Выигрышный путь - металлы, вступающие в реакцию с кислотами
Выигрышный путь - металлы, вытесняющие медь из хлорида меди (II)
Выигрышный путь - вещества, взаимодействующие с водой
Выигрышный путь - вещества, которые при взаимодействии с водой образуют кислоты
5 этап. Водопад реакций
Преподаватель: Сообразительность - качество, нужное всегда и везде, в том числе и в путешествии. Вот и сейчас вам очень пригодится сообразительность.
Каждая команда получает инструкцию к заданию.
-
Расположите перед собой основное игровое поле. Внимательно изучите на нем незаконченные уравнения реакций.
-
Возьмите из конверта рабочие карточки.
-
Соотнесите формулу вещества на карточке и незаконченные уравнения химических реакций.
-
Положите рабочую карточку на клетку игрового поля в том месте, где формула вещества на карточке логически вписывается в уравнение химической реакции.
-
Закройте карточками все клетки игрового поля в заданной последовательности.
-
Прочтите слово-код на обратной стороне карточек.
-
Подготовьтесь к проверке учителя.
CaO + … = Ca(OH)2
... + HCl= CuCl2+H2O
Mg + … = MgCl2
… + H2 = Cu + H2O
2KOH + … = K2CO3 + 2H2O
Zn + … = ZnCl2 + H2
H2SO4 + … = FeSO4 + H2O
… + H2SO4 = FeSO4 + H2
H2O
Cu(OH)2
Cl2
CuO
CO2
HCl
FeO
Fe
.6 этап. Путь домой
Каждому учащемуся дается тест по повторенной теме Правильные ответы написаны на доске.
Вариант 1
1) Реакции, протекающие с поглощением теплоты, называются:
а) эндотермическими;
б) термическими;
в) экзотермическими.
2) Из нескольких простых или сложных веществ образуется одно более сложное вещество в реакции:
а) замещения;
б) соединения;
в) разложения.
3) Уравнение реакции обмена:
а) СаО + Si02 = CaSi03;
б) 2КС103 = 2КС1+302;
в) FeS + 2HC1 = FeCl2 + H2S.
4) Сумма всех коэффициентов в уравнении реакции, схема которой
А1 + С12 = А1С13, равна:
а) 4
6)7;
в) 5.
5) Схема химической реакции, в которой правильно расставлены коэффициенты:
а) Н2 + С12= 2НС1;
б) Са + 02-= 2СаО;
в) Zn + НС1-= ZnCl2 + Н2.
Вариант 2
1) Реакции, в результате которых образуются простые вещества называются:
а) соединения;
б) термическими;
в) разложения.
2) В результате обратимых реакций наступает::
а) выделение газа;
б) химическое равновесие;
в) разложение веществ..
3) Уравнение реакции соединения
а) 2Na + H2 =2 NaH
б) 2KNO3 + MgCl2 = Mg(NO3)2 + 2KCl
в) CaCO3 = CaO + CO2
4 Сумма всех коэффициентов в уравнении реакции, схема которой
СаСО3 + H2S04 = CaSO4 + H2CO3 равна:
а) 4
6)2
в) 5.
5)Схема химической реакции, в которой правильно расставлены коэффициенты:
а) 2Na + С12= 2NaС1
б) Zn + НС1-= ZnCl2 + Н2.
в) Са +H3PO4 = Ca PO4 + 3H2
Вариант 3
1) Реакции, протекающие с выделением теплоты, называются:
а) эндотермическими;
б) термическими;
в) экзотермическими.
2) Из нескольких сложных веществ образуются другие вещества в реакции:
а) замещения;
б) соединения;
в) обмена.
3) Уравнение реакции разложения
а) 4 Li + O2 = 2 Li2O
б) 2КС103 = 2КС1+302;
в) CaS + 2HC1 = CaCl2 + H2S.
4) Сумма всех коэффициентов в уравнении реакции, схема которой
Fe + С12 = FeС13, равна:
а) 4
6)7;
в) 5.
5) Схема химической реакции, в которой правильно расставлены коэффициенты:
а) Н2 + O2= 2Н2O;
б) СаO +CO2-= 2СаCО3;
в) Zn +2 НС1-= ZnCl2 + Н2.
Вариант 4
1) Реакции, протекающие с образованием осадка, называются:
а) эндотермическими;
б) необратимые
в)соединения.
2) Из нескольких простых или сложных веществ образуется одно более сложное вещество в реакции:
а) замещения;
б) соединения;
в) разложения.
3) Уравнение реакции замещения:
а) MgО + Si02 = MgSi03;
б) 2КС103 = 2КС1+302;
в) Fe+ 2HC1 = FeCl2 + H2
4) Сумма всех коэффициентов в уравнении реакции, схема которой
КС103 = КС1+02, равна:
а) 4
6)7;
в) 5.
5) Схема химической реакции, в которой правильно расставлены коэффициенты:
а) 2Н2 + С12= 2НС1;
б) СаO +H2O-= 2Са(ОH);
в) ZnO +2НС1-= ZnCl2 + Н2.O
7 этап. Путевые заметки
Преподаватель : Уважаемые туристы наше путешествие подошло к концу. Спасибо вам за то, что вы помогли осуществить мне это путешествие. И если оно вам понравилось, то подумайте о том, куда бы вы хотели отправиться в следующий раз. Подводятся итоги, выставляются оценки ученикам
Урок - путешествие


