- Преподавателю
- Химия
- Картотека по химии (Лабораторная работа)
Картотека по химии (Лабораторная работа)
| Раздел | Химия |
| Класс | 8 класс |
| Тип | Другие методич. материалы |
| Автор | Фадеева М.В. |
| Дата | 30.12.2015 |
| Формат | docx |
| Изображения | Есть |
Картотека по ТБ и ХЭ
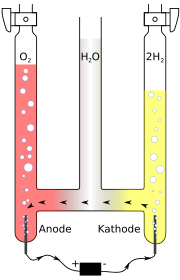
1) Разложение воды электрическим током:
Цель: доказать опытным путём, что при разложении воды электрическим током выделяется кислород и водород.
Оборудование:
1) вода;
2) чаша;
3) источник тока;
4) поваренная соль (NaCl);
5) провода.
Ход работы:
1) Собрать прибор для разложения воды электрическим током.
2) Дистиллированная вода электрический ток не проводит, но при добавлении поваренной соли (NaCl) - отличный проводник электричества. Наблюдения:
При разложении воды электрическим током, я заметил, что на проводе с отрицательным зарядом бурно выделялись пузырьки газа, а на проводе с положительным зарядом они только скапливались у их кончиков. Так как в молекуле воды (Н2О) на два атома водорода приходится один атом кислорода то, тот газ, который бурно выделялся, будет водородом, а тот, который только скапливался на концах проводов - кислородом. Вскоре провод с выделяющимся кислородом начал окислятся - он почернел и распался, а на проводе, на котором выделялся водород, образовался белый «налёт». Через некоторое время разлагающаяся вода приобрела голубоватый оттенок.
Уравнение реакции:
2Н2О = 2Н2↑ + О2↑
2) Разложение малахита:
Цель опыта: Изучить пример реакции разложения
Оборудование: пробирка лабораторная 2 шт, трубка газоотводная полимерная, стакан, лабораторный штатив с лапкой, спиртовка, спички.
Реактивы: раствор гидроксида кальция (известковая вода) Ca(OH)2
Дополнительные реактивы: основной карбонат меди(II) (малахит) CuCO3∙Cu(OH)2.
Опыт проводят для иллюстрации состава сложных веществ или как пример реакции разложения. Его можно проводить демонстрационно.
Ход работы
1. Пробирку с основным карбонатом меди(II) (малахитом) CuCO3∙Cu(OH)2.закрываем пробкой с газоотводной полимерной трубкой.

2. Собранный прибор проверяем на герметичность. Наконечник газоотводной трубки опускаем в стакан с водой, зажав пробирку в руке. Выходящие пузырьки воздуха свидетельствуют о том, что прибор собран герметично.

3. Закрепляем прибор в лабораторном штативе.

4. В пробирку наливаем известковой воды Ca(OH)2 на 1/3 объема.

5. Опускаем наконечник газоотводной трубки в пробирку с известковой водой.

6. Нагреваем пробирку с малахитом на спиртовке.

7. Наблюдаем изменение цвета малахита (из зеленого он становится черным). На стенках пробирки появляются капельки воды, а известковый раствор мутнеет. 
Уравнение реакции:
(CuOH)2CO3->2CuO↓+CO2↑+H2O
Вывод.
При разложении малахита образуются три вещества - вода, углекислый газ и оксид меди(II).
3) Взаимодействие оксида меди (II) с раствором серной кислоты:
Цель: Доказать свойства меди в ходе химических превращений.
Оборудование: спиртовка, 3 стаканчик 50мл, серная кислота, спички, щипцы.
Ход работы:
-
Обработать оксид меди серной кислотой, получить голубой раствор. Черный порошок оксида двухвалентной меди CuO и помещают в пробирку. Добавляют немного разбавленной серной кислоты. Для начала реакции одного соприкосновения веществ недостаточно, нужно нагревание. Слегка нагревают пробирку с веществами, не доводя раствор до кипения. В результате реакции наблюдается постепенное исчезновение черного порошка оксида меди и образование раствора голубого цвета.
Подготовка эксперимента: заранее подготовить порошок оксида меди.
Техника безопасности: не допускать попадания на кожу кислоты, при нагревании держать пластину щипцами
Утилизация отходов: нейтрализовать раствор и кислоты и вылить в раковину.
Уравнение реакции:
CuO + H2SO4 = CuSO4 + H2O

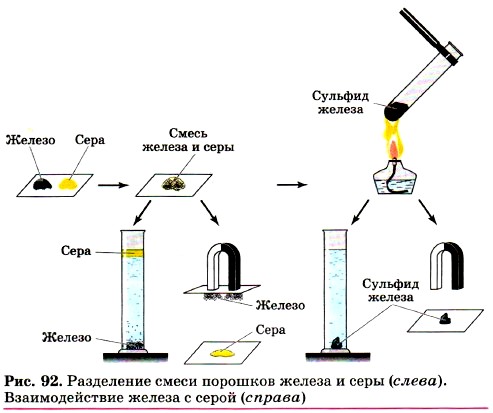
4) Взаимодействие железа с серой:
Цель: Доказать, что сложные вещества образуются из простых при химических явлениях. Показать, что образуя химическую связь вещества не сохраняют свои свойства, а приобретают новые.
Оборудование: фарфоровая ступка с пестиком, пробирка, обвязанная у горлышка нитью, магнит, кристаллическая сера, порошок железа.
Ход работы:
1. Растереть кристаллики серы в порошок, обратить внимание на цвет, попробовать магнитом.
2. Рассмотреть железный порошок, всыпать его в пробирку с ниткой, попробовать магнитом, обратить внимание на отклонение пробирки в сторону магнита.
3. Всыпать в пробирку порошок серы, перемешать, несколько раз встряхнув пробирку, попробовать магнитом, обратить внимание на отклонение пробирки в сторону магнита.
4. Нагреть пробирку до саморазогревания смеси, после окончания реакции проверить магнитом.
Уравнение реакции:
Fe + S = FeS
5) Состав воздуха:
Цель: сформировать знания о составе и свойствах воздуха.
Оборудование:
-
Свеча, спички, стеклянный колпак, пробирки с известковой водой, стеклянные трубочки, резиновая груша;
Ход работы:
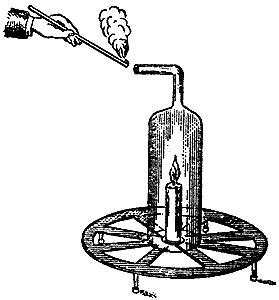
1) Экспериментальное доказательство наличия кислорода в воздухе.
Демонстрация опыта зажечь свечу и накрыть стеклянным колпаком.
2) Экспериментальное доказательство наличия углекислого газа в атмосферном воздухе.
Чтобы доказать наличие углекислого газа нам понадобится известковая вода. Это прозрачный раствор. При её взаимодействии с углекислым газом образуется белое вещество, поэтому происходит помутнение известковой воды.
Демонстрация опыта: при помощи резиновой груши пропустить несколько раз воздух через известковую воду (наблюдается помутнение).
3) Экспериментальное доказательство наличия углекислого газа в выдыхаемом воздухе.
Перед вами пробирки с известковой водой. Предлагаю вам сделать глубокий вдох и медленно через трубочку выдохнуть воздух в пробирку. При этом необходимо соблюдать правила техники безопасности - вдыхать через трубочку нельзя!
Вывод: во вдыхаемом воздухе углекислого газа меньше чем в выдыхаемом.
- Почему необходимо проветривать кабинет во время перемен?
6) Реакции ионного обмена:
Цель: Доказать суть реакций ионного обмена
Оборудование: пробирки, реактивы, штатив.
Ход эксперимента:
Опыт 1. К раствору хлорида натрия прилейте раствор нитрата серебра. Запишите наблюдения.

Опыт 2. К раствору карбоната натрия прилейте раствор соляной кислоты. Запишите наблюдения.

Опыт 3. В раствор гидроксида натрия капните 1 - 2 капли фенолфталеина. Прилейте раствор соляной кислоты до исчезновения окраски. Запишите наблюдения.

Уравнения реакций:
-
NaCl+AgNO3→NaNO3+AgCl↓
-
Na2CO3+ 2HCl=2NaCl+H2O+ CO2↑
-
NaOH+ фенолфталеин = малиновое окрашивание, после приливания кислот обесцвечивание
Список используемой литературы
-
Глинка Н.Л. Общая химия. Л.: Химия, 1988;
-
Макареня А.А. Повторим химию. М.: Высшая школа, 1989;
-
Рудзитис Г.Е., Фельдман Ф.Г. Химия-8, 9. М.: Просвещение, 1990;


