- Преподавателю
- Химия
- Интегрированная программа факультативного курса по химии и биологии
Интегрированная программа факультативного курса по химии и биологии
| Раздел | Химия |
| Класс | - |
| Тип | Рабочие программы |
| Автор | Зуева М.В. |
| Дата | 16.12.2014 |
| Формат | doc |
| Изображения | Есть |
«Интегрированная программа факультативного курса
по биологии и химии «Химия и биология вокруг нас»».
Зуева Марина Васильевна
МКОУ «Кардойская ООШ»
СОДЕРЖАНИЕ
ВВЕДЕНИЕ………………………………………………………………………….….3
1 Основные концепции программы………………………...…………...6
-
Основные требования к знаниям и умениям……………………………...…..9
-
Критерии и нормы оценки знаний обучающихся……………………..……..11
-
Методическое обеспечение программы…………………………………...….15
-
Условия реализации программы………………………………………………18
-
Результаты программы…………………………………………………....……19
ГЛАВА 2. СОДЕРЖАНИЕ КУРСА………………………………………..………...22
2.1.Тематический план……………………………………………………..………....22
2.2.Содержание курса…………………………………………………………...…….22
2.3.Календарно-тематическое планирование…………………………………..……24
ЗАКЛЮЧЕНИЕ………………………………………………………………...…...…34
Список использованной литературы…………………………..………36
ПРИЛОЖЕНИЯ МЕТОДИЧЕСКИХ РАЗРАБОТОК ...............................................37
Приложение 1 Тест по правилам техники безопасности………………………….37
Приложение 2 Интегрированный урок по химии и биологии «Органические и неорганические соединения в клетке»……………………………………..………..38
Приложение 3 Практическая работа Тема: Решение экспериментальных задач по теме: «Гидролиз солей»……………………………………………………...……….50
Приложение 4 Урок путешествие «Химия в быту». …………….………………..62
Приложение 5 Практические работы с исследованием «Лекарственных препаратов и средств бытовой химии »……………………………………..………62
Приложение 6 Практическая работа «Определение влияние моющих средств.»..66
Приложение 7 Интегрированный урок «Подгруппа кислорода и экология»…..…68
Приложение 8 Доклад « Разрушение озонового слоя атмосферы»……………….76
ВВЕДЕНИЕ
Истинный химик должен быть
теоретиком и практиком
М.В. Ломоносов
Уже со времен глубокой древности люди были знакомы со многими химическими процессами, лежащими в основе различных производств: хлебопечения, сыроварения, виноделия, выделки кожи. Стремление повысить урожайность полей и использовать различные природные вещества для изготовления пищи, лекарств, красок, тканей, дубильных веществ, пряностей приводило к необходимости изучать растения и животных и влияние различных соединений на их рост и развитие. Борьба с болезнями приводила к необходимости изучать процессы, происходящие в теле здорового и больного человека, влияние на организм различных целебных средств.
Изучение химии в школьном курсе позволяет учащимся составить полную современную научную картину мира. В научную картину мира химия вносит представление о веществах, составляющих организмы растений, животных и человека, об образовании этих веществ. Именно химия дает возможность познать многообразие форм вещества в природе, усмотреть материальное единство органического и неорганического, понять, что в основе жизни лежат вполне материальные процессы, происходящие с атомами и молекулами. Несомненно, значение химии в жизни человека, в жизни общества сейчас все в большей степени раскрывается именно через изучение химии.
У учителя возникает проблема: как правильно осуществить отбор материала? Усилия ученых сейчас сконцентрированы на изучении химических процессов, протекающих в живой клетке и составляющих основу её жизнедеятельности. В этой связи возрастает роль биохимических знаний современного человека.
Актуальность программы: воспитание поколения, которое сможет отвечать за свои поступки, которое будет себя чувствовать не только крохотной частички нашей галактики, но и центром всей Вселенной, которое будет знать, что каждое неосторожное движение его тела, руки, мысли несет за собой необратимые экологические последствия.
Цель программы: с целью развития личности ребёнка способствовать углублению знаний обучающихся в данных областях, формирование и развитие у обучающихся интеллектуальных и практических умений, позволяющие применять полученные знания, способствовать воспитанию экологической культуры.
Задачи программы:
Углубление, расширение и систематизация знаний о строении, свойствах и применении веществ и их соединений;
Совершенствование умения обращаться с химическими веществами, химическими приборами и оборудованием
Развитие познавательную активность и творческие способности учащихся в процессе углубленного изучения экологии и химии.
Формирование у детей наблюдательность, логическое мышление, умение сравнивать и анализировать, умение делать выводы на основании полученных результатов, вести дискуссию
Пропаганда здорового образа жизни;
Знакомство учащихся с процессами, происходящими в организме человека, с действием химических веществ на организм человека, с историей важнейших открытий медицины.
Программа включает теоретический материал, касающийся наиболее важных и значимых в жизни современного человека вопросов, а также предусматривает ведущую роль эксперимента при изучении химии.
Максимальное внимание уделено познавательно-развивающей функции эксперимента, поэтому приоритет отдан постановке проблемных и исследовательских опытов. Дидактическая функция выражается в совершенствовании и контроле знаний и практических умений. Систематическое использование экспериментальных задач помогает совершенствовать знания и умения учащихся, развивать их мышление, так как им приходится постоянно прибегать к логическим приемам сравнение, аналогия, обобщение. Теоретическая и практическая часть данной программы позволяют более основательно рассмотреть вопросы физиологии человека, биологические функции некоторых веществ, заглянуть в мир живого на атомно-молекулярном уровне.
Данная работа состоит из 78 страниц, двух глав теоретическая и практическая часть введения, заключения и списка используемой литературы и приложений.
1 Основные концепции программы
Настоящая программа разработана в соответствии с современными тенденциями развития образования, опирается на ряд нормативных документов:
1.Концепция духовно-нравственного развития и воспитания личности гражданина России.
Программа факультативного курса «Химия и биология вокруг нас» рассчитана на 34 часа, для обучающих 9 класса ориентирована на перспективу выбора профессии. В процессе изучения учащимся предоставляется возможность расширить представления о веществах, их влиянии на живые организмы, развитии знаний о природных материалах и их свойствах, прогрессе цивилизации.
При традиционном изучении химии и биологии существует разрыв этих предметов и затрудняет установлению межпредметных связей. Поэтому данный курс объединяет две науки, рассматривает биологические функции неорганических и органических веществ с учетом их строения и свойств. Дает акцент на повторение, обобщение, углубление имеющихся знаний. Программа содержит знания по химии, вызывающие познавательный интерес учащихся и представляющий ценность для определения профессии. Многие ребята выбирают медицинские профессии. Поэтому курс содержит информацию о профессиях, связанных с химическими знаниями, в которых востребован предлагаемый материал.
Программа носит последовательный, логически связанный, целостный характер, способствует лучшему пониманию изученного материала. Материал подобран с опорой на те знания, которые были получены на уроках химии и биологии, но на более высоком теоретическом уровне, расширено и обобщено.
Программа является целостным интегрированным курсом, включает основы, химии и биологии и экологии, учитывает психологические закономерности формирования специальных знаний и умений, а также возрастные особенности учащихся среднего школьного возраста.
Межпредметная направленность. Данный курс призван вооружить учащихся основами химических и биологических знаний, необходимых для повседневной жизни в теме «Химия в быту». Изучается состав, строение, получение веществ по уходу за волосами, кожей, влияние химических красок. Можно заинтересовать химией, если предложить для обсуждения роли химии в решении жизненно важных вопросов, позволяющих более глубоко осознать процессы, Происходящие в человеческом организме, увидеть некоторые пути решения проблем. Эти вопросы можно изучить в темах «Биохимический состав клетки», «Химия и медицина». Теоретический материал позволяет учащимся более осознанно и глубоко изучить химию элементов и их соединений, химической организации клетки и процессами обмена веществ. Знакомятся с лекарственными препаратами, химиотерапией, с наиболее часто встречающимися в повседневной жизни фармакологическими терминами, рассматривают безопасные способы применения некоторых лекарственных препаратов, учатся исследовать их. Позволяет погрузиться в систему вопросов: химические и биологические свойства металлов и неметаллов.
Здорвьесберегающая направленность. Формируется понятие о здоровье, лекарствах, их воздействие на организм и правильном их употреблении. Особое внимание уделено составу, фармакологическим свойствам препаратов, общей культуре обращения с лекарственными средствами. При этом учащиеся усваивают, что здоровый образ жизни позволяет надолго сохранить активность и поможет избежать многих болезней и проблем. Показать взаимосвязь между содержанием в организме химических соединений и развитием таких болезней, как раковые и сердечно - сосудистые заболевания. Предупреждать, а не лечить болезни - вот основная задача врачей будущего поколения.
Экологическая направленность курса. Большую роль химия играет в воспитании экологической культуры, поскольку экологические проблемы имеют в своей основе химическую природу, а решение многих из них используют химические средства и эти вопросы рассмотрены в теме «Химия и окружающая Среда», например влияние дезодорантов на окружающую среду. Рассматриваются вопросы об одинаковом вреде тяжелых и легких наркотиков.
Практическая направленность. Интерес к химии возникает в том случае, если учащиеся получают возможность самостоятельно выполнять химический эксперимент, проводить лабораторные исследования, приобретая навыки и умения пользоваться химической посудой, приборами, реактивами. Химический эксперимент открывает возможность формировать у учащихся умения работать с веществами, научить правильному обращению с лабораторным оборудованием, развивать практические навыки. Учащиеся экспериментальным путем знакомятся с составом вещества, готовить растворы заданной концентрации. Большое внимание уделяется технике безопасности выполняемых работ и получению результатов. Время, отводимое на выполнение практических работ 1,2 часа в каждой теме. Необходимо шире использовать возможности компьютерные, Интернета.
Проверка и оценка качества знаний. Чтобы оценить динамику усвоения учениками теоретического материала и поставить учащегося перед необходимостью постоянно заниматься, предусмотрены индивидуальные задания учащимся и групповые задания, выполнение рефератов, защита проектов. Предусмотрены тестовые задания и итоговая контрольная работа.
Основные методы: проведение химических опытов, чтение химической научно - популярной литературы, подготовка презентаций, выполнение экспериментальных работ.
Основные формы работы: лекции, беседы, экскурсии, лабораторные работы, викторины, игры, химические вечера.
1.1 Основные требования к знаниям и умениям.
Учащиеся должны знать:
-
Знать особенности строения кожных покровов, волос, ногтей, уметь определять тип кожи, уметь применять косметические средства;
-
Роль металлов и неметаллов в обменных процессах и их влияние на здоровье человека;
-
Влияние нарушения обмена микроэлементов в организме человека на протекание различных заболеваний;
-
Правила обращения со средствами бытовой химии;
-
Правила применения лекарственных препаратов, основные виды лекарственных растений нашей местности и их использование;
-
Влияние на состояние здоровья человека вредных веществ;
-
Химический состав и энергетическую ценность пищевых продуктов;
-
Правила техники безопасности при выполнении химического эксперимента.
Учащиеся должны уметь:
-
Обращаться с химической посудой и лабораторным оборудованием и реактивами;
-
Соблюдать правила безопасности при обращении с лекарственными препаратами, препаратами бытовой химии;
-
Распознавать опытным путем растворы солей и кислот;
-
Решать задачи различной степени сложности: по формулам и уравнениям;
-
Самостоятельно работать с дополнительной литературой, аргументировать свои выводы, работать с Интернет - ресурсами;
-
Проводить расчеты по формулам и уравнениям;
Формой оценки учебной деятельности являются сообщения, отчет - конференция, где каждый учащийся представляет разработанную им тему в виде доклада, презентации, информационного бюллетеня. Контроль знаний обучающихся отслеживается в форме зачёта, тестов и итоговой контрольной работы.
Темы проектных работ и сообщений:
-
Биологическая активность микроэлементов.
-
Экологически безопасная посуда.
-
О вкусной и здоровой пище.
-
Лекарства на грядке, в лесу и на лугу.
-
Влияние хозяйственной деятельности на природу.
-
Практические советы: химчистка на дому
Обучающие умения, навыки и способы деятельности.
Программа предусматривает формирование у учащихся общеучебных умений и навыков, универсальных способов деятельности и ключевых компетенции. В этом направлении приоритетами для факультативного курса «Химия и биология вокруг нас» на ступени основного общего образования являются: использование для познания окружающего мира различных методов (наблюдение, измерение, опыты, эксперимент); проведение практических и лабораторных работ, несложных экспериментов и описание их результатов; использование для решения познавательных задач различных источников информации; соблюдение норм и правил поведения в химических лабораториях, в окружающей среде, а также правил здорового образа жизни.
Механизм отслеживания получаемых результатов.
Формы и методы учебной деятельности направлены на достижение следующих умений и навыков:
1) на развитие самостоятельной когнитивной деятельности учащихся (зачет и семинар с игровыми элементами, реферат);
2) на развитие внимания (ребус), памяти (проверочные карточки, кроссворд, тест, викторина);
3) на развитие воображения (аукцион);
4) на развитие аналитических способностей (кроссворд, тест, ребус);
5) на развитие речи учащихся (культурологическая игра, зачет и семинар с игровыми элементами);
6) на проверку знаний фактического материала (зачет, олимпиада, тест, викторина, проверочные карточки);
7) на проверку умений оперировать фактическим материалом (викторина, тест, кроссворд, реферат).
Практически все задания имеют творческий характер и варьируемый уровень сложности. Их можно использовать на разных этапах занятия: в начале занятия, в ходе изложения нового материала, для закрепления. Начать занятия можно с отгадывания кроссворда, при изложении нового материала включить "кусочек" игры, а для закрепления подойдут тест, викторина, ребус. Это удобно и для учителя, и для учащихся - разряжается напряженный ритм работы, выпадает несколько минут интеллектуального отдыха, повышается активность учащихся.
Все задания пробуждают интерес к учебному труду и развивают интеллект учащихся.
1.2 Критерии и нормы оценки знаний обучающихся
1. Оценка устного ответа.
Отметка «5»:
- ответ полный и правильный на основании изученных теорий;
- материал изложен в определенной логической последовательности, литературным языком;
- ответ самостоятельный.
Ответ «4»:
- ответ полный и правильный на сновании изученных теорий;
- материал изложен в определенной логической последовательности, при этом допущены две-три несущественные ошибки, исправленные по требованию учителя.
Отметка «З»:
- ответ полный, но при этом допущена существенная ошибка или ответ неполный, несвязный.
Отметка «2»:
- при ответе обнаружено непонимание учащимся основного содержания учебного материала или допущены существенные ошибки, которые учащийся не может исправить при наводящих вопросах учителя, отсутствие ответа.
2. Оценка экспериментальных умений.
- Оценка ставится на основании наблюдения за учащимися и письменного отчета за работу.
Отметка «5»:
- работа выполнена полностью и правильно, сделаны правильные наблюдения и выводы;
- эксперимент осуществлен по плану с учетом техники безопасности и правил работы с веществами и оборудованием;
- проявлены организационно - трудовые умения, поддерживаются чистота рабочего места и порядок (на столе, экономно используются реактивы).
Отметка «4»:
- работа выполнена правильно, сделаны правильные наблюдения и выводы, но при этом эксперимент проведен не полностью или допущены несущественные ошибки в работе с веществами и оборудованием.
Отметка «3»:
- работа выполнена правильно не менее чем наполовину или допущена существенная ошибка в ходе эксперимента в объяснении, в оформлении работы, в соблюдении правил техники безопасности на работе с веществами и оборудованием, которая исправляется по требованию учителя.
Отметка «2»:
- допущены две и более существенные ошибки в ходе: эксперимента, в объяснении, в оформлении работы, в соблюдении правил техники безопасности при работе с веществами и оборудованием, которые учащийся не может исправить даже по требованию учителя;
- работа не выполнена, у учащегося отсутствует экспериментальные умения.
3. Оценка умений решать расчетные задачи.
Отметка «5»:
- в логическом рассуждении и решении нет ошибок, задача решена рациональным способом;
Отметка «4»:
- в логическом рассуждении и решения нет существенных ошибок, но задача решена нерациональным способом, или допущено не более двух несущественных ошибок.
Отметка «3»:
- в логическом рассуждении нет существенных ошибок, но допущена существенная ошибка в математических расчетах.
Отметка «2»:
- имеется существенные ошибки в логическом рассуждении и в решении.
- отсутствие ответа на задание.
4. Оценка письменных контрольных работ.
Отметка «5»:
- ответ полный и правильный, возможна несущественная ошибка.
Отметка «4»:
- ответ неполный или допущено не более двух несущественных ошибок.
Отметка «3»:
- работа выполнена не менее чем наполовину, допущена одна существенная ошибка и при этом две-три несущественные.
Отметка «2»:
- работа выполнена меньше чем наполовину или содержит несколько существенных ошибок.
- работа не выполнена.
При оценке выполнения письменной контрольной работы необходимо учитывать требования единого орфографического режима.
5. Оценка тестовых работ.
Тесты, состоящие из пяти вопросов можно использовать после изучения каждого материала (урока). Тест из 10-15 вопросов используется для периодического контроля. Тест из 20-30 вопросов необходимо использовать для итогового контроля.
При оценивании используется следующая шкала: для теста из пяти вопросов
-
нет ошибок - оценка «5»;
-
одна ошибка - оценка «4»;
-
две ошибки - оценка «З»;
-
три ошибки - оценка «2».
Для теста из 30 вопросов:
-
25-З0 правильных ответов - оценка «5»;
-
19-24 правильных ответов - оценка «4»;
-
13-18 правильных ответов - оценка «З»;
-
меньше 12 правильных ответов - оценка «2».
6. Оценка реферата.
Реферат оценивается по следующим критериям:
-
соблюдение требований к его оформлению;
-
необходимость и достаточность для раскрытия темы приведенной в тексте реферата информации;
-
умение обучающегося свободно излагать основные идеи, отраженные в реферате;
-
способность обучающегося понять суть задаваемых членами аттестационной комиссии вопросов и сформулировать точные ответы на них.
1.3. Методическое обеспечение программы
I. Общие положения
1. Соблюдение требований настоящей инструкции обязательно для всех учащихся, работающих в кабинете химии.
2. К работе в лаборатории допускаются только учащиеся, правильно ответившие на вопросы по технике безопасности в кабинете химии.
3. Учащиеся могут находиться в кабинете только в присутствии учителя, не допускается нахождение учащихся в кабинете химии во время его проветривания; пребывание учащихся в помещении лаборантской не допускается.
4. Присутствие посторонних лиц в кабинете химии во время эксперимента допускается только с разрешения учителя.
5. Учащимся запрещается выносить из кабинета и вносить в него любые вещества без разрешения учителя.
6. Не допускается загромождение проходов портфелями и сумками, они должны помещаться на специальное место.
7. В кабинете химии запрещается принимать пищу и напитки, бегать по кабинету, шуметь и устраивать игры.
8. Во время работы в кабинете химии учащиеся должны быть максимально внимательными, дисциплинированными, строго следовать указаниям учителя, соблюдать тишину, поддерживать чистоту и порядок на рабочем месте.
9. Учащиеся, присутствующие на лабораторной или практической работе без халата, непосредственно к проведению эксперимента не допускаются.
II. Обеспечение безопасности перед началом работы
1. Перед проведением экспериментальной работы каждый учащийся должен надеть халат; учащиеся, имеющие длинные волосы, должны собрать их, чтобы исключить возможность соприкосновения с лабораторным оборудованием, реактивами и тем более - с открытым огнем.
2. Прежде чем приступить к выполнению эксперимента, учащиеся должны по учебнику или инструктивной карточке изучить и уяснить порядок выполнения предстоящей работы.
3. Учащиеся обязаны внимательно выслушать инструктаж учителя по технике безопасности в соответствии с особенностями предстоящей работы. Текущий инструктаж по технике безопасности перед практической работой регистрируется собственноручно учащимися в тетрадях для практических работ.
4. Приступать к проведению эксперимента учащиеся могут только с разрешения учителя.
III. Обеспечение безопасности во время работы
1. Во время демонстрационных опытов учащиеся должны находиться на своих рабочих местах или пересесть по указанию учителя на другое, более безопасное место.
2. При выполнении лабораторных и практических работ учащиеся должны неукоснительно соблюдать правила техники безопасности, следить, чтобы вещества не попадали на кожу лица и рук, т.к. многие из них вызывают раздражение кожи и слизистых оболочек.
3. Никакие вещества в лаборатории нельзя пробовать на вкус! Нюхать вещества можно, лишь осторожно направляя на себя их пары или газы легким движением ладони, нельзя наклоняться к сосуду и вдыхать полной грудью.
4. При выполнении лабораторных работ учащиеся должны точно повторять действия учителя, показывающего, как нужно правильно проводить эксперимент.
5. Подготовленный к работе прибор учащиеся должны показать учителю или лаборанту.
6. Реактивами необходимо пользоваться следующим образом: сухое вещество брать шпателем, жидкие реактивы - капельницей или наливая раствор из склянки; держать склянку этикеткой к ладони Избыток взятого вещества нельзя ссыпать и сливать обратно в склянку с реактивом, для этой цели служат санитарные склянки. Все работы с вредными веществами проводятся в вытяжном шкафу.
7. По первому требованию учителя учащиеся обязаны немедленно прекратить выполнение работы эксперимента. Возобновление работы возможно только с разрешения учителя.
8. Для нагревания жидкостей разрешается использовать только тонкостенную посуду. Пробирки для нагревания жидкостей запрещается наполнять более чем на одну треть их объема. Отверстие пробирки при нагревании нельзя направлять в сторону учащихся и на себя.
9. Учащимся запрещается самостоятельно проводить любые опыты, не предусмотренные в данной работе.
10. Учащимся запрещается выливать в канализацию растворы и органические жидкости.
11. О разлитых и рассыпанных реактивах учащиеся должны немедленно сообщить учителю или лаборанту. Учащимся запрещается самостоятельно убирать любые вещества.
12. Обо всех неполадках в работе оборудования, водопровода, электросети и т.п. учащиеся обязаны сообщить учителю или лаборанту. Учащимся запрещается самостоятельно устранять неисправности.
13. При получении травм порезы, ожоги, а также при плохом самочувствии учащиеся должны немедленно сообщить об этом учителю или лаборанту.
14. Во время работы учащимся запрещается переходить на другое рабочее место без разрешения учителя.
15. Учащимся запрещается брать вещества и какое-либо оборудование с не задействованных на данный момент рабочих мест.
16. Недопустимо во время работы перебрасывать друг другу какие-либо вещи учебники, тетради, ручки.
17. Запрещается оставлять без присмотра включенные нагревательные приборы, а также зажигать спиртовки без надобности.
IV. Обеспечение безопасности по окончании работы
1. Уборка рабочих мест по окончании работы производится в соответствии с указаниями учителя.
2. Учащиеся должны привести в порядок свое рабочее место, сдать учителю или лаборанту дополнительные реактивы и оборудование, выданные в лотке.
3. По окончании лабораторной и практической работ учащиеся обязаны вымыть руки с мылом.
V. Аварийные ситуации
При возникновении аварийных ситуаций во время занятий в кабинете химии пожар, появление посторонних запахов не допускать паники и подчиняться только указаниям учителя.
Обязательно сообщите о месте пожара охрану, администрацию, милицию, спасателям. Единый телефонный номер: 01, с мобильного телефона: 112. Виновные в нарушении этих правил несут дисциплинарную, административную и уголовную ответственность
1.4 Условия реализации программы
Материально-технические условия:
Для успешной реализации программы необходимо материально-техническая база, включающая:
- кабинет для проведения занятий;
- набор лабораторной посуды;
- медицинские тонометры;
- наглядное оборудование согласно теме;
- ТСО, видеофильмы;
- таблицы, плакаты, опросники;
- научно-популярная литература;
Внешние условия.
Работа по программе предполагает сотрудничество педагогов и учащихся:
- с медицинскими работниками; школьным фельдшером.
1.5 Результативность программы.
Ожидаемые результаты.
В составе основных видов универсальных учебных действий, диктуемом ключевыми целями общего образования, можно выделить четыре блока:
1) личностный;
2) регулятивный (включающий также действия саморегуляции);
3) познавательный;
4) коммуникативный.
Развитие системы универсальных учебных действий в составе личностных, регулятивных, познавательных и коммуникативных действий осуществляется в рамках нормативно-возрастного развития личностной и познавательной сфер ребенка. Процесс обучения задает содержание и характеристики учебной деятельности ребенка и тем самым определяет зону ближайшего развития универсальных учебных действий.
При разработке интегрированного факультативного курса «Химия и биология вокруг нас», «От действия к мысли» нами принимался во внимание кризис перехода из основной школы в среднюю, требующий высокой степени проявления самостоятельности учебной деятельности учащихся 9 классов.
Возрастной период у обучающих 14-15 лет характерен переходом от юношеского школьного возраста к старшему школьному возрасту. Как и любой переходный период, он имеет свои особенности и связан с определенными трудностями как для учащихся и их родителей, так и для учителей
Учебная деятельность дополняется другими видами деятельности, и все вместе теперь они влияют на психическое развитие учащихся, учебная деятельность при этом остается основной и продолжает определять содержание мотивационных сфер личности. С начала обучения в средней школе расширяется само понятие "учение", так как теперь оно может выходить за пределы класса, школы, может отчасти осуществляться самостоятельно, целенаправленно. Качественно изменяются требования к мотивации учебной деятельности. Появляется новый вид учебного мотива - мотив самообразования, представленный пока в наиболее простых формах интерес к дополнительным источникам знаний.
Кроме того, успешное обучение в среднем звене требует более глубоких и содержательных побудительных сил: ориентация на способы получения знаний, интерес к закономерностям и принципам, понимание смысла учения "для себя". Если интерес к учению становится смыслообразующим мотивом у ребенка, его учебная деятельность обеспечивает его успешное психическое развитие.
Существенно меняется также характер самооценки школьников этого возраста. Привычные в младших классах ситуации, когда самооценка определялась учителем на основании результатов учебы, подвергаются корректировке и переоценке другими детьми; при этом во внимание принимаются те качества ребенка, которые проявляются в общении.
В этот период ребенок приобретает значительный социальный опыт, начинает постигать себя в качестве личности в системе трудовых, моральных, эстетических общественных отношений. У него возникает намеренное стремление принимать участие в общественно значимой работе, становиться общественно полезным. Эта социальная активность подростка обусловлена большей восприимчивостью к усвоению норм, ценностей и способов поведения, существующих во взрослых отношениях.
В процессе обучения по программе «Химия и биология вокруг нас» школьники должны научиться:
Обосновывать:
- определения основных экологических понятий;
- о факторах, укрепляющих здоровье;
- о воздействии природных и социальных факторах на организм человека.
Распознавать:
влияние экологических и социальных факторов на здоровье человека;
Сравнивать:
Применять знания;
оценивать состояние здоровья;
- соблюдать гигиенические правила и режим дня;
- уменьшать вредное воздействие стресса и утомления;
- проводить наблюдения и самонаблюдения;
- прогнозировать возможные последствия изменения окружающей среды на бытовом уровне.
Делать вывод при :
- выполнение практических работ;
- составление отчетов по итогам практикумов;
- проектная деятельность;
- работа с дополнительной научно-популярной литературой;
- участие в школьных, региональных экологических конференциях.
2 Содержание курса
2.1 Тематический план.
Программа факультативного курса «Химия и биология вокруг нас» , 34 часа.
№ п/п
Темы в соответствии с программой +
практическая часть.
Где и сколько часов отражено по данной теме
Теория
Практика
1
Химические элементы в организме человека.
7
2
2
Химия и косметика
4
2
3
Химия в быту.
4
2
4
Химия и медицина.
4
2
5
Химия и окружающая среда.
4
3
6
Итого
23
11
2.2 Содержание курса
Тема 1. Химические элементы в организме человека. 9 часов.
Состав живой клетки, органические и неорганические соединения. Микро- и макроэлементы, их функция, биологическое значение. Металлы и их биологическое значение. Пагубное влияние тяжелых металлов на организм.
Неметаллы, их биологическое значение. Жиры, белки, углеводы, их биологическая роль.
Окислительно-восстановительные процессы, протекающие в живой клетке. Гидролиз солей в организме, рН среды.
Практические работы . 1. Экспериментальное решение задач.
2. Гидролиз солей.
Тема 2.Химия и косметика. 6 часов
Состав и получение средств по уходу за кожей. Приемы ухода за кожей. Волосы, состав, уход за волосами. Влияние химических завивок, химических красок на волосы. Дезодоранты, их действие, «фреоновая опасность». Декоративная косметика.
Практическая работа. 1. Экспериментальное решение задач.
2.Определение рН косметических средств.
Тема 2. Химия в быту. 6 часов
Строительные материалы (клеи, краски)
Моющие средства
Практическая работа. 1. Экспериментальное решение задач.
2.Определение влияние моющих средств.
Тема 3. Химия и медицина.6 часов
Лекарства и яды в древности и средневековье. Поль Эмих основоположник химия терапии. Химические препараты в борьбе с заболеваниями сердечно-сосудистыми, инфекционными. Народная медицина, фитотерапия, аптека на лугу.
Наркотические вещества, влияние на организм, токсикомания и курение.
Практическая работа. 1. Исследование лекарственных препаратов.
-
Приготовление растворов солей заданной концентрации.
Тема 4. Химия и окружающая среда. 7 часов.
Галогены, физиологическое воздействие галогенов, использование их в медицине. Экологическая опасность галогенов.
Кислород и озон. Разрушение озонового слоя. Применение кислорода в медицине и народном хозяйстве.
Сульфаты. Оксиды серы. Кислородные дожди, экологическая опасность.
Азот, Оксиды азота, азотные удобрения. Оксиды углерода, фотосинтез. Углекислый газ и экология. Париковый эффект.
Практические работы. Решение экспериментальных задач.
2.3 Календарно - тематическое планирование.
№ п/п
дата
Тема раздела программы
Тема урока
обеспечения обязательного минимума содержания образования
ОУУН
Практическая часть
Формы и методы контроля
план
факт
Химические элементы в организме человека.
9
1.Самостоятельно определять задачи учебной деятельности, планировать её.
2.Паравильно организовывать свое рабочее место.
3.Владеть навыками работы по технике безопасности.
4.Владеть навыками работы с химическими веществами и оборудованием.
5. Выполнение работы, используя рациональные приемы ее выполнения.
6. Самостоятельно пользоваться текстом учебной литературы.
7.Выделять главное в тексте параграфа, составлять план прочитанного.
8.Сравнивать, анализировать разные темы изученного материала
9. Слушать объяснение учителя, ответы товарищей и умение их.
10. Подбирать и использовать дополнительную литературу при подготовке к урокам.
оценивать
11. Использовать полученные знания в жизни.
12. Умение применять вычислительные навыки.
13. Умение вести диалоги, пересказывать по составленному плану, создавать связанные высказывания.
14 Владеть основными видами письменных работ.
1литературы.
15. Отвечать на вопросы в соответствии с их характером, объяснять, рецензировать текст, устный ответ.
16. Связанно излагать материал других источников.
17.Использование ПК как средство получения новой информации.
18. Использование для познания мира различных методов (наблюдение, измерение, опыты, эксперимент).
19. Проведение практических и лабораторных работ, несложных экспериментов и описание их результатов.
20. Использование для решения познавательных задач различных источников информации.
21 Соблюдение норм и правил поведения в химических лабораториях, в окружающей среде, а также правил здорового образа жизни
1
Состав живой клетки, органические и неорганические вещества.
1
Знать: химический состав клетки, какую функцию выполняют органические и неорганические вещества, их роль в пластическом обмене.
2
Микро- и макроэлементы, их функции и биологическое значение.
1
Знать: классификацию элементов, их функцию, понятие макро- и микроэлементы, поливитамины. Правила их применение.
3
Металлы и их биологическая роль.
1
Знать: биологическую роль меди, кальция, калия, железа, кобальта, цинка и др.металлов.
Л.Р. «Определение железа в продуктах»
4
Пагубное влияние тяжелых металлов на организм.
1
Знать: влияние ртути, свинца,
радиоактивных металлов и их солей на организм человека и на состояние здоровья.
Работа с Интернет ресурсами
5
Неметаллы и их биологическая роль.
1
Знать: какие значения имеют хлор, бром, фтор, селен, кремний, азот, фосфор, сера и др. неметаллы и их соли в жизни человека. Понятия о витаминах и поливитаминах.
Выступлении с сообщениями.
6
Белки, жиры, углеводы и их биологическая роль.
1
Знать: органический состав клетки, их роль в пластическом и энергетическом обмене веществ в клетке. Строение, состав, нахождение в организме.
Л.Р. «Качественные реакции на белки».
7
Окислительно - восстановительные процессы в живой клетке. Гидролиз солей . рН среды.
1
Знать: химизм протекания процессов в клетке, их значение. Понятие гидролиза, протекающего в организме, определение кислотно - щелочной среды.
Составление таблицы.
8
ПР «Решение экспериментальных задач»
1
Уметь: обращаться с химическим оборудованием, знать ТБ, экспериментально доказывать состав веществ, качественные реакции на ионы.
Практическая работа
Отчет о проделанной работе
9
ПР «Гидролиз солей»
1
Уметь: проводить реакции гидролиза жиров, углеводов и неорганических солей. Работать с лабораторным оборудованием.
Практическая работа
Отчет о проделанной работе
Тема 2. Химия и косметика.
6
10
Состав и получение средств по уходу за кожей, телом.
1
Знать: правила пользования кремами, соответственно типу кожи, правилами пользования средствам, гигиена кожи. Специальные средства по уходу за кожей. Меланин.
11
Волосы: состав, уход. Влияние химических красок, завивок на волосы.
1
Знать: химический состав средств красок для волос, их влияние на волосы, правила пользования. Гигиена ухода за волосами. Народные средства для укрепления волос.
Лаб. Раб. «Окрашивание образцов волос красками».
Составление таблицы
12
Дезодоранты, их действие, «фреоновая опасность».
1
Знать: химический состав дезодорантов, их действие на кожу, их влияние на озоновый слой. Правила пользования дезодорантами.
13
Декоративная косметика.
1
Знать: основные компоненты губной помады, пудры, теней, их виды. Индивидуальные особенности и подбор соответствующей косметики.
Л.Р. «Приготовление средств для окраски ресниц».
Защита рефератов
14
ПР «Экспериментальное решение задач».
1
Знать: обращаться с химическим оборудованием, знать ТБ, экспериментально доказывать состав веществ, качественные реакции на ионы.
Практическая работа
Отчет по работе
15
ПР «определение рН косметических средств».
1
Знать: кислотная мантия, рН кожи, понятие о кислотно - щелочном балансе.
Уметь определять рН на различных образцах косметики с помощью индикатора.
Практическая работа
Отчет по работе
Тема 3. Химия в быту .
16
Строительные материалы (клеи, краски)
2
Знать: основные понятия строительных материалов использования краски виды красок , клей виды клея и влияние на здоровья человека Правила пользования
Л.Р. Применение строительных материалов
Составление таблицы
17
Моющие средства
2
Знать: основные понятия о моющих средствах: мыло шампунь , средство для мытья посуды, порошки. Основные виды, применение и использование Правила пользования.
Л.Р. Влияние на организм моющих средств.
Составление таблицы
18
Практическая работа. 1. Экспериментальное решение задач.
1
Знать: обращаться с химическим оборудованием, знать ТБ, экспериментально доказывать состав веществ, качественные реакции на ионы.
Практическая работа
Отчет по работе
19
ПР 2.Определение влияние моющих средств.
1
Знать: кислотная мантия, рН кожи, понятие о кислотно - щелочном балансе.
Уметь определять рН на различных образцах моющих средств с помощью индикатора.
Практическая работа
Отчет по работе
Тема 3. Химия и медицина.
6
20
Лекарства и яды в средневековье. Поль Эмих - основоположник химиотерапии.
1
Знать: понятия «лекарственные вещества» и «ядовитые вещества», фармакологические группы лекарственных веществ в зависимости от их лечебного действия.
21
Химические препараты в борьбе с заболеваниями сердечно - сосудистыми, инфекционными, желудочно -кишечного тракта.
1
Знать: группы лекарственных препаратов при заболевании, правила пользования лекарствами и условия их хранение. Кровоостанавливающие средства.
Сообщения
22
Народная медицина, фитотерапия, аптека на лугу, на окне.
1
Знать: лекарственные растения, применяемые при различных заболеваниях. Правилами их использования и хранения. Ознакомиться с некоторыми народными средствами.
проекты
23
Наркотические вещества, влияние их на организм.
Токсикомания и курение, влияние на организм человека.
1
Знать: наркотические вещества (марихуана, кокаин, опиаты), действие на организм, отдаленные эффекты действия.
Знать: состав табака, табачного дыма, влияние на организм.
Работа с Интернет ресурсами
Сообщения
24
ПР «Приготовление растворов, лекарственных препаратов».
1
Знать: :формулы массовой доли растворимого вещества и молярной концентрации, готовить растворы заданной концентрации.
Практическая работа
Отчет по работе
25
ПР «Исследование лекарственных препаратов».
1
Знать: качественные реакции на ион, способы их определения.
Практическая работа
Отчет по работе, проекты
Химия и окружающая среда.
7
26
Галогены и физиологическое воздействие соединений на организм, использование их в медицине.
1
Знать: значение фтора, хлора, брома, иода человека, лекарства на их основе. Понятие гормонов и ферментов. Витаминизированные продукты потония.
ЛР. «Качественные реакции на галогены»
27
Кислород и озон. Разрушение озонового слоя.
1
Знать: свойства кислорода и озона, значение озонового слоя, причины его разрушения. Понятие радиации и ее последствия.
сообщения
28
Сульфаты, оксиды серы, кислотные дожди, экологическая опасность.
1
Знать: отрицательное влияние соединений серы на окружающую среду, понятие о «кислотных дождях» и влияние экологию Земли.
Создание проектов
29
Азот, оксиды азота, нитраты, азотные удобрения, их воздействие на окружающую среду.
1
Знать: свойства оксидов азота, значение нитратов, накопление нитратов в организме и отрицательные последствия.
ЛР.»Определение нитратов о овощах».
30
Оксиды углерода (2)и (4), фотосинтез. Углекислый газ и экология, парниковый эффект.
1
Знать: понятие фотосинтеза, его значение. Содержание углекислого газа в атмосфере, последствия парникового эффекта. Экология нашего поселка.
31
ПР «Определение нитратов в продуктах, овощах и фруктах»
1
Знать качественные реакции на нитрат-ион, правила пользования лабораторным оборудованием.
Практическая работа
Отчет по работе
33
Итоговая контрольная работа.
1
Тестирование
ЗАКЛЮЧЕНИЕ
Содержание интегрированного факультативного курса «Химия и биология вокруг нас» соответствует минимальным требованиям стандарта образования, а также содержит некоторый материал по углублению курса химии и биологии в 9 классе, на который следует обратить внимание для успешного изучения.
Каждая тема содержит теоретический материал, а также практический и предусматривает решение задач. Это необходимо для формирования и развития навыков анализа, сравнения, обобщения, самоанализа и самоконтроля, умений устанавливать причинно - следственные связи между различными фактами, умений делать выводы, отстаивать свою точку зрения. Учащиеся будут получать опережающие задания по теме предстоящего занятия. Это делается для того, чтобы учитель не тратил время на объяснение новой темы. На каждом занятии планируется организация самостоятельной работы школьников под руководством преподавателя. Фронтально будут поясняться только отдельные наиболее сложные части теоретического материала, а при индивидуальной работе - те аспекты содержания, которые не понял кто-то из учащихся.
Вниманию учащимся предлагаются различные задания по содержанию и по сложности, которые требуют от учащихся активной познавательной деятельности. Данный курс предлагается всем учащимся, которые желают получить более глубокие знания по предмету.
Программа «Химия и биология вокруг нас» важен потому, что он охватывает теоретические основы химии и практическое назначение химических веществ в повседневной жизни, позволяет расширить знания учащихся о химических методах анализа, способствует овладению методиками исследования. Курс содержит опережающую информацию по химии, раскрывает перед учащимися интересные и важные стороны практического использования химических знаний.
Практическая направленность изучаемого материала делает данный курс очень актуальным. Содержание курса позволяет ученику любого уровня включиться в учебно-познавательный процесс и на любом этапе деятельности.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
1.Алексейчук Н.И. Дары лугов, полей, лесов. М, Физкультура и спорт. 1998 г
2.Володина М.А. - Сборник конкурсных задач по химии с решениями. - М.: МГУ, 1983.
3.Кукушкин Ю.Н. Химия вокруг нас. М. Высшая школа, 2001г.
4.Кукушкин Ю.Н. Неорганическая химия. СПб. Синтез, 2004г.
5.Леенсон И.А.Чет или нечет. М. Химия, 2002г.
6.Лемей Э. Химия в центре наук. (2 тома) М. Мир, 2001 г.
7.Макаров К.М. Химия и здоровье. М. Просвещение, 1999г.
8.Муравьева Д.А. Фармокогнозия. М. Медицина, 1998г.
9.Николаев Л.А. Металлы в живых организмах. М. Просвещение, 1986г.
10.Нифорова Г.П. Экология и химия. М. Наука, 1999г.
11.Популярная библиотека химических элементов. Под редакцией И.В.Петрянова-Соколова. М. Просвещение, 2003г.
12 Пичугина Г.В. Химия и повседневная жизнь человека. М.: Дрофа, 2006г.
13. Рунов Н.Н. Школьный справочник по химии. - Я.: Академия развития, 1997
14. Рябов М.А. - Тесты по химии (к учебнику Габриеляна О.С. «Химия. 8 класс»). - М.: Экзамен, 2004
15. Степин Б.Д. Книга по химии для домашнего чтения. М. Химия, 1995г.
16.Сыромятников И. Секреты макияжа. М. Медицина, 2000г.
17.Фриманиел М. Химия в действии. М. Мир, 1991г.
18.Уалмерс Л. Химические средства в быту и промышленности. Л. Химия, 1989г.
19.Химия и жизнь. 1975г.
20.Юдин А.М. Химия в нашем доме. М. Химия, 1984г.
21.Юдин А.М. Народная энциклопедия быта и здоровья человека с полезными советами. М. Свет, 1992г.
ПРИЛОЖЕНИЕ 1
Методические разработки К ЗАНЯТИЯМ
1. Тест по правилам техники безопасности:
1. Вещества на вкус:
А) можно пробовать
Б) нельзя пробовать
В) надо спросить у учителя.
2. Твердые вещества берут:
А) рукой
Б) ложечкой
В) как придется
Г) не знаю.
3. Посуду при работе надо использовать:
А) чистую
Б) грязную
В) с трещинами
Г) какая есть.
4. К работе в лаборатории можно приступать:
А) когда захочешь
Б) с разрешения учителя
В) когда будешь готов.
5. Объем воды измеряют:
А) на весах
Б) в мерном цилиндре
В) в мерном стакане.
6. Полученный раствор необходимо:
А) отдать учителю
Б) вылить в канализацию.
ПРИЛОЖЕНИЕ.2
Интегрированный урок по химии и биологии
Органические и неорганические соединения в клетке

Другого ничего в природе нет,
Ни здесь, ни там в космических глубинах:
Все - от песчинок малых до планет -
Из элементов состоит единых.
С.Щипачев
Цели. Способствовать развитию интереса к химической и биологической наукам, углубить знания учащихся о неорганических веществах клетки, раскрыть межпредметные связи.
Оборудование. Схемы «Строение эукариотической клетки», «Уровни организации живой материи», «Элементы. Вещества клетки», опорный конспект «Диссоциация воды. рН».
ХОД УРОКА
У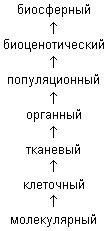 ЧИТЕЛЬ БИОЛОГИИ. Все живые организмы - это биологические системы, имеющие сходные черты строения и жизнедеятельности. У них единый генетический код, близкие химический состав, строение молекул и клеток, однотипное строение тела на одинаковых уровнях организации. Такое единство живых организмов дает возможность построить общую систему уровней организации живой материи от молекулярного до биосферного согласно схеме:
ЧИТЕЛЬ БИОЛОГИИ. Все живые организмы - это биологические системы, имеющие сходные черты строения и жизнедеятельности. У них единый генетический код, близкие химический состав, строение молекул и клеток, однотипное строение тела на одинаковых уровнях организации. Такое единство живых организмов дает возможность построить общую систему уровней организации живой материи от молекулярного до биосферного согласно схеме:
Из этой схемы видно, что низшей ступенью организации является клетка, она обладает всеми свойствами живого. Клетка осуществляет обмен веществ и энергией, растет, размножается и передает по наследству свои признаки.
Она реагирует на внешние раздражители и способна двигаться. Поэтому мы сегодня снова говорим о клетке. Давайте вспомним, как называется наука о клетке. Это цитология. Исследуя клетку как важнейшую структурную единицу живого, цитология занимает центральное положение в ряду биологических дисциплин; она тесно связана с гистологией, анатомией, физиологией и биохимией. Мы вводим новый термин, поэтому запишите его формулировку в тетрадях.
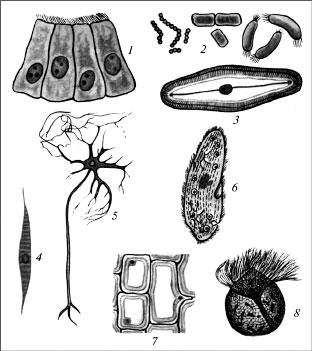
Клетки различной формы, выполняющие разные функции:
1 - клетки кишечника; 2 - бактерии;
3 - диатомовая водоросль; 4 - мышечная клетка; 5 - нервная клетка;
6 - инфузория; 7 - клетки лука; 8 - жгутиконосец
Биохимия - это наука, изучающая входящие в состав организмов химические вещества, их структуру, распределение, превращения и функции.
Биохимия связана с хозяйственной деятельностью человека и медициной. Принципиальное значение для развития биохимии имел первый синтез природного вещества - мочевины, подорвавший представление о «жизненной силе», якобы участвующей в синтезе организмов различных веществ. Используя достижения общей, аналитической и органической химии, биохимия в XIX в. сформировалась в самостоятельную науку. Здесь две науки - биология и химия - неразрывно связаны друг с другом.
Живой мир многообразен. Один из основоположников биохимии Макс Дельбрюк отметил: «Открытие деления и мутаций позволяет верить, что игра эволюции продолжается и разнообразие форм будет безгранично умножаться». Несмотря на многообразие форм, клетки разных типов обладают поразительным сходством в своих главных структурных особенностях.
УЧИТЕЛЬ ХИМИИ.
Сущность живого - это целая цепь хорошо организованных химических реакций. Так, в живой клетке протекает бесчисленное множество превращений одних молекул в другие, что создает энергетическую и материальную основу всего живого. Химические процессы в живых системах очень хорошо организованы, строго сбалансированы, точно обусловлена пространственная и временная очередность событий.
Науке свойственно стремление к познанию первооснов окружающего нас мира. (Учитель вращает глобус.) Две трети поверхности Земли покрыто водами рек, озер, морей, океанов. Океаны, колыбель жизни на Земле, с точки зрения химика, представляют собой водный раствор множества химических веществ. «Именно в этом растворе впервые развились живые организмы, и из этого раствора они получали ионы и молекулы, необходимые для их роста и жизни… - пишет в одной из своих работ лауреат Нобелевской премии американский химик Лайнус Полинг и продолжает: - С течением времени живые организмы развивались и изменялись, что позволило им покинуть водную среду и перейти на сушу и затем подняться в воздух. Они приобрели эту способность, сохранив в своих организмах водный раствор в виде жидкой составляющей ткани, плазмы крови, межклеточной жидкости, содержащей необходимый запас ионов и молекул».
«Химия вокруг нас» - это часто встречающееся утверждение неточно. Химия не только вокруг нас, но и внутри нас. Вся вселенная построена из химических элементов, которые составляют периодическую систему химических элементов Д.И.Менделеева. Они одни и те же и на Земле, и в глубинах космоса. В состав живых клеток входят 24 химических элемента периодической системы Д.И.Менделеева. Это - С, Н, О, N, Fe, Mg, K, Na, Ca, S и др.Химические элементы, входящие в состав клетки, подразделяются на макроэлементы, микроэлементы и ультрамикроэлементы. Какую же роль они играют в клетке? В клетке содержится несколько тысяч веществ, которые участвуют в разнообразных химических реакциях. Химические процессы, протекающие в клетке, - одно из основных условий ее жизни, развития и функционирования. Основные вещества клетки = Нуклеиновые кислоты + Белки + Жиры (липиды) + Углеводы + Вода + Кислород + Углекислый газ. В неживой природе эти вещества нигде не встречаются вместе.
По количественному содержанию в живых системах все химические элементы подразделяются на три группы.
Элементы клетки
Макроэлементы
• О, С, Н, N входят в состав органических веществ клетки. Вместе с водой организма они составляют около 90%.
• Р входит в состав ДНК, АТФ, ферментов, костной ткани и эмали зубов, содержание его в организме 1%.
• Катион Ca2+ входит в состав оболочки клеток растений, костей и зубов у животных, также он участвует в процессе свертываемости крови. В организме бывает до 2,5% ионов кальция по массе.
Микроэлементы
• S входит в состав белков, витаминов и ферментов, ее содержится
0,01-1%.
• Катионы K+ и Na+ участвуют в проведении нервного импульса, поддерживают осмотическое давление в клетке, стимулируют синтез гормонов, их содержание по 0,25%.
• Катион Mg2+ (0,1%) входит в состав молекулы хлорофилла. Он содержится в костях и зубах, активизирует синтез ДНК и энергетический обмен.
• Катион железа входит в состав гемоглобина, миоглобина, хрусталика и роговицы глаза, активизирует деятельность ферментов (0,07%).
• Анион Cl- (0,2%) является компонентом желудочного сока, а анион
I- (0,1%) - обязательным компонентом гормона тироксина (щитовидная железа).Ультрамикроэлементы
Ультрамикроэлементы участвуют в процессах кроветворения, фотосинтеза, катализируют внутриклеточные окислительные процессы.
• Катионы меди и марганца повышают урожайность растений, активизируют процессы фотосинтеза и кроветворения.
• Анионы бора влияют на процессы роста растений.
• Анионы фтора входят в состав эмали зубов.
Учитель биологии по схеме «Элементы. Вещества клетки» рассказывает о неорганических и органических веществах, содержащихся в живой клетке. Подтверждением сказанного служит демонстрационный опыт.
Демонстрационный опыт «Сжигание муки в фарфоровой чашке»
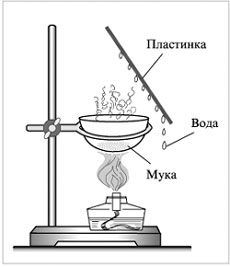
Признаки реакции:
• капельки воды (пары воды конденсируются на холодной стеклянной пластинке);
• дым (сгорают органические вещества);
• зола (неорганические вещества).
Учитель химии проводит беседу «Вещества живой клетки», пользуясь следующей схемой:
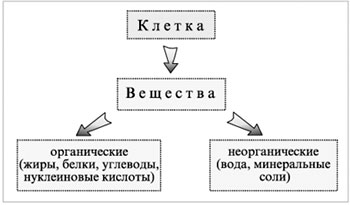
Вопрос. Как можно отличить органические вещества от неорганических?
УЧИТЕЛЬ БИОЛОГИИ.
Вода - один из важнейших факторов внешней среды, от которого зависит здоровье людей. Организм человека находится в состоянии постоянного обмена веществ с окружающей его средой. Различные неорганические и органические вещества непрерывно поступают в организм, претерпевают там многообразные превращения, а «отработанные», ненужные выводятся наружу, в окружающую среду. Обмен веществ - один из главных признаков жизни. Существуют разные виды обмена веществ - углеводный, белковый, жировой и т.д. Обмен веществ включает в себя, конечно, и обмен воды. Совокупность процессов всасывания воды в желудке и кишечнике, распределение ее между тканями организма и выделение через почки, легкие, кожу - в этом и состоит сущность водного обмена.
Клетки и межклеточные вещества живых тканей представляют собой сложные системы, отдельные части которых содержат в качестве необходимого компонента воду. Почему же именно ее?
Вода - прекрасный растворитель для множества веществ живого организма, среда, в которой протекает большинство химических реакций, связанных с обменом веществ. При ее участии, с помощью водного обмена, происходит терморегуляция, т.е. регулируются процессы теплоотдачи и теплопродукции. С водой удаляются из организма ненужные ему продукты обмена, иногда микробы, их токсины и т.п. Многие ученые считают, что человеческая жизнь, в известном смысле, представляет собой борьбу за воду. Почему же вода обладает такими свойствами? Это можно объяснить, исходя из строения молекулы воды.
УЧИТЕЛЬ ХИМИИ.
Рассмотрим строение молекулы воды:
Н2О - молекулярная формула,
Н-О-Н - структурная формула,
![]() - электронная формула, характеризующая ковалентную полярную связь.
- электронная формула, характеризующая ковалентную полярную связь.
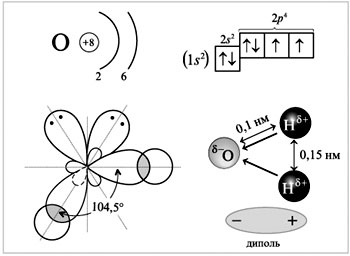
Молекула воды имеет угловое строение: представляет собой равнобедренный треугольник с углом при вершине 104,5°. Молекулярная масса воды в парообразном состоянии равна 18 г/моль. Однако молекулярная масса жидкой воды оказывается более высокой. Это свидетельствует о том, что в жидкой воде происходит ассоциация молекул, вызванная водородными связями.
УЧИТЕЛЬ БИОЛОГИИ.
Какова же роль воды в клетке? Из-за высокой полярности молекул вода является растворителем других полярных соединений, не имея себе равных. В воде растворяется больше веществ, чем в любой другой жидкости. Именно поэтому в водной среде клетки осуществляется множество химических реакций. Вода растворяет продукты обмена веществ и выводит их из клетки и организма в целом. Вода обладает большой теплоемкостью, т.е. способностью поглощать теплоту. При минимальном изменении ее собственной температуры выделяется или поглощается значительное количество теплоты. Благодаря этому она предохраняет клетку от резких изменений температуры. Поскольку на испарение воды расходуется много теплоты, то, испаряя воду, организмы могут защищать себя от перегрева (например, при потоотделении).Вода обладает высокой теплопроводностью. Такое свойство создает возможность равномерно распределять теплоту между тканями тела. Вода является одним из основных веществ природы, без которого невозможно развитие органического мира растений, животных, человека. Там, где она есть, - есть жизнь. А какова роль воды в человеческом организме?
Роль воды в человеческом организме
В состав человеческого тела входит около 65% воды. Это значит, что во взрослом человеке, который в среднем весит 70 кг, примерно 46 кг приходится на воду. Особенно богаты ею ткани молодого организма: в теле трехмесячного человеческого плода - 95% воды, у новорожденного ребенка - 70% (многие ученые одной из причин старения считают понижение способности белков организма связывать большие количества жидкости). Вода входит в состав всех органов и тканей человека; даже такая плотная ткань, как кость, содержит около 20% воды, в печени, мышцах, мозге - 70-80%, в крови - около 80%. Просачиваясь с растворенными в ней солями через органические «стенки», разделяющие ткани, вода течет от более слабого раствора к более крепкому, пока концентрации обоих растворов не сравняются. Этот процесс, называемый осмосом, играет существенную роль в жизни человеческого организма; с его помощью живые клетки получают необходимые им вещества. Поддерживая осмотическое давление, вода участвует и в минеральном обмене. Человек чрезвычайно остро реагирует на нарушение водного баланса. Так, при утрате влаги в размере 6-8% от веса тела он впадает в полуобморочное состояние. Потеря 10% влаги вызывает нарушение глотательного рефлекса, затем начинаются галлюцинации, в конце концов останавливается сердце - оно оказывается не в состоянии проталкивать по сосудам сгустившуюся кровь. При потере организмом более 12% влаги наступает смерть. В норме из организма выделяется в сутки 2,5 л воды: через почки - около 50%, через легкие - 13%, через кишечник - 5%, остальная часть воды (примерно 32%) выделяется через кожу. Однако эти соотношения могут резко изменяться. Так, при заболевании сахарным диабетом почки начинают выделять до 8-10 л воды в сутки. Интенсивная физическая работа, пребывание в горах увеличивают количество воды, уходящей через легкие. При работе в горячих цехах или в жаркую погоду масса воды, теряемой через кожу, может достигать 6-10 л. Во всех этих случаях вследствие обезвоживания организма человек испытывает чувство жажды. Было установлено, что общее количество выделяемой из организма взрослого человека воды в норме должно равняться количеству вводимой, т.е. в среднем 2,5 л. В этом случае соблюдается состояние водного равновесия, нормальный баланс воды.
УЧИТЕЛЬ БИОЛОГИИ.
Конечно, о воде можно говорить много. Действительно, ее роль в любом живом организме огромна. Но помимо воды в числе неорганических веществ клетки нужно назвать и соли. Соли находятся либо в диссоциированном, либо в твердом состоянии. Концентрация катионов и анионов в клетке и в окружающей ее среде неодинакова. В клетке содержится довольно много калия и очень мало натрия. Во внеклеточной среде, например в плазме крови, в морской воде, наоборот, много натрия и мало калия. Раздражительность клетки зависит от соотношения концентраций ионов Na+, K+, Ca2+, Mg2+.
Ребята, на схеме представлены основные результаты первой части урока.
Схема "Элементы. Вещества клетки"
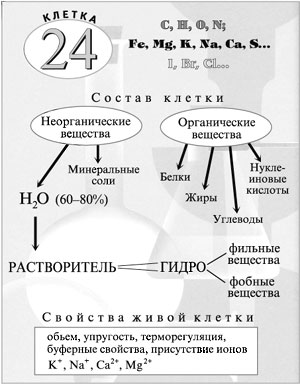
В тканях многоклеточных животных Са2+ входит в состав межклеточного вещества, обеспечивающего сцепленность клеток и упорядоченное их расположение. От концентрации солей зависят осмотическое давление в клетке и ее буферные свойства.
Буферностью называется способность клетки поддерживать слабощелочную реакцию ее содержимого на постоянном уровне.
Определение понятия учащиеся записывают в тетрадях.
УЧИТЕЛЬ ХИМИИ. Рассмотрим уравнения реакций, протекающих в буферных растворах. (На магнитной доске карточка - анион ![]() слабой угольной кислоты H2CO3.)
слабой угольной кислоты H2CO3.)
Если в клетке увеличивается концентрация Н+, то происходит присоединение катиона водорода к карбонат-аниону:
 + Н+
+ Н+  Н
Н![]() .
.
При увеличении концентрации гидроксид-анионов происходит их связывание:
Н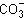 + ОН-
+ ОН- 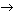
![]() + Н2О.
+ Н2О.
Так карбонат-анион может поддерживать постоянную среду.
Предлагаю вам задание: имеется фосфат анион 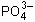 , покажите буферные свойства этого аниона.
, покажите буферные свойства этого аниона.
(Ответ.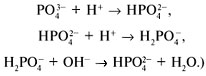
Тест «Неорганические вещества клетки»
1. Сколько химических элементов можно обнаружить в клетке?
а) 24; б) 60; в) 150.
2. Какие химические элементы, содержащиеся в клетке, относят к макроэлементам?
а) S, Na, Ca, K; б) O, H, C, N; в) Ni, Cu, I, Br.
3. В каких клетках человека больше всего воды?
а) Жировых; б) костных; в) нервных.
4. Каковы функции воды в клетке?
а) Передача наследственной информации;
б) среда для химических реакций;
в) источник энергии.
5. К гидрофобным веществам относят:
а) соли; б) сахар; в) жиры.
6. Какие ионы входят в состав гемоглобина?
а) Mg2+; б) Fe2+; в) Zn2+.
7. На каком уровне организации наблюдаются различия между органическим и неорганическим миром?
а) Атомарный; б) молекулярный; в) клеточный.
8. Больше всего воды содержится в клетках:
а) эмбриона; б) молодого человека; в) старика.
9. Вода - основа жизни, т.к. она:
а) может находиться в трех состояниях (жидком, твердом и газообразном);
б) является растворителем, обеспечивающим как приток веществ в клетку, так и удаление из нее продуктов обмена;
в) охлаждает поверхность при испарении.
10. Вещества, хорошо растворимые в воде, называются:
а) гидрофильными; б) гидрофобными; в) амфифильными.
11. Угол между валентными связями Н-О-Н в молекуле воды составляет:
а) 90°; б) 104,5°; в) 120°.
12. Чем объясняется относительное постоянство реакции среды содержимого клетки?
а) Тургором; в) осмосом; в) буферностью.(Ответы. 1 - а; 2 - б; 3 - в; 4 - б; 5 - в; 6 - б; 7 - в; 8 - а; 9 - б; 10 - а; 11 - б; 12 - в.)
УЧИТЕЛЬ БИОЛОГИИ.
Подведем итоги нашего урока. В состав живых организмов входит ряд относительно простых соединений, которые встречаются и в неживой природе. Это неорганические соединения. И конечно, первоочередная роль среди этих соединений принадлежит воде. Она обладает уникальными свойствами. Свойства эти настолько важны, что нельзя представить жизнь живых организмов без этого соединения водорода и кислорода.
«Природа - это открытая книга.
Надо только правильно читать ее».
ПРИЛОЖЕНИЕ 3
ПРАКТИЧЕСКАЯ РАБОТА
Тема: Решение экспериментальных задач по теме: «Гидролиз солей»
Цель: научиться объяснять результаты экспериментальных задач
Обобрудование: растворы солей: сулдьфат алюминия, хлорид натрия, карбонат натрия, сульфат цинка, порошок магния, лакмусовая бумажка.
Ход работы
Опыт № 1 Определение среды растворов солей.
С помощью индикатора определите среду в растворах следующих солей: сульфата алюминия, хлорида натря, карбоната натрия. Какую среду показывает индикатор в каждом случае? Запишите уравнения реакций в молекулярном виде и объясние происходящее.
Опыт № 2. Усиление гидролиза
А) К порошку карбоната натрия добавте сначала холодной воды, а потом горячей. Что наблюдаете? Запишите уравнение реакции в молекулярном виде и объясние происходящее.
Б) К раствору сульфата цинка добавте порошок магния. Какие изменения протекают в растворе? Запишите уравнения реакций в молекулярном виде и объясние происходящее.
Опыт № 3. Взаимное усиление гидролиза солей.
К раствору сульфата алюминия добавте раствор карбоната натрия. Какие изменения протекают в растворе? Запишите уравнения реакций в молекулярном виде и объясние происходящее
Выводы по работе:
-
Какие соли подвергаются гидролизу? По какому типу протекает их гидролиз?
-
Какими способами можно усилить обратимый гидролиз, протекаюший по аниону? по катиону?
-
В каком случае возможен взаимный гидролиз ратворов солей?
ПРИЛОЖЕНИЕ 4
Урок путешествие «Химия в быту».
Цель: 1) познакомить учащихся с составом и свойствами средств гигиены,
показать, как знание химии позволяет грамотно выбирать эти средства;
2) дать полезные советы по уходу за кожей, полостью рта, волосами;
выведению пятен различного происхождения;
3) показать работу «весёлой кухни»;
4) закрепить и обобщить знания учащихся о химии, как науки.
Оборудование: образцы средств гигиены: зубных паст, мыла, шампуней;
для опытов: свекольный борщ, пищевая сода, тарелка, блюдце,
литровая банка, вода, очищенный картофель, насыщенный раствор соли, сахарный песок, кристаллики лимонной кислоты, сырой желток,
сливочное масло, порошок какао.
Методы: рассказ, беседа, объяснение, лабораторные опыты, наблюдение.
Форма: урок - путешествие.
Ход урока.
1. Введение в тему.
Учитель. Здравствуйте, ребята! Сегодня мы проводим необычный урок -урок - путешествие по стране «Химия», цель которого показать, как тесно связана химия с нашей повседневной жизнью, как можно облегчить решение многих бытовых проблем, имея минимальный запас знаний по химии. Поэтому мы познакомимся с составом и свойствами средств гигиены, выясним, как грамотно выбирать эти средства; дадим полезные советы по уходу за кожей, полостью рта, волосами; выведению пятен различного происхождения; покажем работу «весёлой кухни»; таким образом, закрепим и обобщим ваши знания о химии, как науки.
Итак, тема нашего урока «Химия в быту».
2. Изучение нового материала.
Учитель. Мы проведем с вами обычный день с точки зрения химика. С чего начинается ваше утро, что вы делаете вначале?
Ученик 1. Мы встаём с постели и идём в ванную комнату.
Учитель. Правильно, в ванной комнате, вы умываетесь и чистите зубы. И первую остановку мы совершим в краю «Мойдодыр».
Кто из нас с детства не помнит знаменитые строки К.И. Чуковского: «Надо, надо умываться по утрам и вечерам …» Но одной только воды для поддержания чистоты кожи
и зубов недостаточно. Нужно ещё мыло и зубная паста, вот о них мы и поговорим более подробно.
Ученик 2. До изобретения мыла жир и грязь с кожи удаляли золой и мелким речным песком. Египтяне умывались смешанной с водой пастой на основе пчелиного воска.
В Древнем Риме при мытье пользовались истолчённым мелом, пемзой, золой. Заслуга в изобретении мыла принадлежит, вероятно, галльским племенам. По свидетельству Плиния Старшего, из сала и золы букового дерева галлы делали мазь, которую применяли для окрашивания волос и лечения кожных заболеваний. А во втором веке её стали использовать в качестве моющего средства.
Ученик 3. Технология изготовления мыла из животных жиров складывалась на протяжении многих веков. Сначала составляется жировая смесь, которую расплавляют и омыляют - варят со щёлочью. При этом образуются мыло (соли жирных кислот) и глицерин. Глицерин и загрязнения из реакционной массы осаждают добавлением в раствор поваренной соли. В мыльной массе образуются два слоя - ядро (чистое мыло) и подмыленный щёлок. Мыло отделяют, охлаждают, сушат и фасуют. Оно было дорогим,
так как производилось из натурального животного жира и имело не всегда приятный запах. В настоящее время для получения мыла используют высшие карбоновые кислоты и глицерин.
Основа туалетного мыла выглядит так:
- натриевые соли жирных кислот кокосового масла;
- натриевые соли жирных кислот говяжьего жира в соотношении 1:4;
- красители;
- ароматизаторы.
Ученик 4. Многие свойства мыла, например твёрдость, растворимость в воде, пенообразование, моющая способность, зависят от его жирового состава. Так, входящая в состав свиного и говяжьего сала пальмитиновая кислота, придаёт мылу твёрдость и хорошие пенообразующие качества, а олеиновая кислота - растворимость в холодной воде и моющую способность. Стеариновая кислота усиливает моющее действие мыла в горячей воде. Благодаря лауриновой кислоте, содержащейся в кокосовом масле, мыло лучше растворяется в холодной воде, увеличивается его моющая способность и уменьшается набухание.
Помимо жировой основы в состав мыла входят также различные добавки. Это наполнители (диоксид титана или оксид цинка), парфюмерные отдушки, красители, увлажняющие компоненты (глицерин, касторовое масло, воски животного происхождения - ланолин и спермацет). Бактерицидные и дезодорирующие мыла содержат антисептические вещества, например триклозан.
Учитель. А теперь обязательный утренний атрибут - зубная паста.
Ученик 5. Еще совсем недавно, 30-40 лет назад, основным средством чистки зубов были зубные порошки. Применять их начали ещё в ХIХ веке. Составы были достаточно разнообразны, например (в г):
первый - мел очищенный - 1200; углекислая магнезия (MgCO3) - 200; надборнонатриевая соль (NaBO3 4H2O) - 60; мятное масло - 25;
второй - салол (сложный эфир фенола C6H5OH и салициловой кислоты OH - C6H4 - COOH) - 4; фосфорно-кальциевая соль (CaHPO4) - 20; мел очищенный - 20; углемагниевая соль - 15; бикарбонат натрия (NaHCO3) - 15.
В состав первого рецепта входит надборнонатриевая соль, обладающая отбеливающими свойствами. Это очень распространенный компонент современных стиральных порошков.
В состав второго порошка входит салол, известный лекарственный препарат антибактериального действия.
Учитель. Однако в настоящее время мы пользуемся зубными пастами.
Тот, кто чистит зубы пастой, будет смелым и зубастым! В состав любой, даже самой современной, зубной пасты входят моющие и пенообразующие вещества, чаще всего натриевая соль лаурилсерной кислоты. Их действие аналогично действию мыла, а преимущество в том, что они не имеют неприятного запаха и вкуса мыла. В связи с этим и с помощью мыла можно неплохо очистить зубы. К тому же все зубные пасты содержат абразивные вещества (оксиды алюминия Al2O3 и титана TiO2), которые обеспечивают механическую очистку зубов, но при этом происходит истирание зубной эмали; антисептик - бензойная кислота C6H5COOH; фторосодержащий компонент для профилактики кариеса - монофторфосфат натрия Na2PO3F; загуститель - карбоксиметилцеллюлоза, точнее её натриевая соль [C6H7O2(OH)3-х (OCH2COONa)х]n.
Ученик 6. Однако, о пастах, содержащих фтор нужно сказать особо, они достаточно популярны, но использовать эти пасты нужно аккуратно. Если у вас в городе или поселке содержание фтора в воде достаточно высокое, то такие пасты применять нельзя, так как избыток этого элемента может повлечь за собой обратный эффект.
Учитель. Продолжаем наше путешествие. Каждый из нас, после того, как проделает водные процедуры, обязательно выпивает чашечку чая. Поэтому вторая остановка называется «Чайная». Здесь мы и поговорим о любимом напитке - чае.
Ученик 7. Чаем обычно называют высушенные листья чайного куста или чайного дерева. В Китае чайный куст был введён в культуру примерно в III в., однако употребление напитка из листьев дикорастущего чайного дерева было известно китайцам задолго до этого. Вероятно, первыми начали пить чай жители государства Шу, находившегося на территории современной провинции Сычуань.
Ученик 8. Первые любительские опыты по культуре чайного куста в Индии относятся к концу XVIII в. Значительно раньше, чем в Индию, чайный куст из Китая проник в Японию. Это произошло в 805 г., когда буддийский японец Сайнобори посадил у себя на родине привезённые им из далёкого Китая семена этого растения. В Индонезию и на Цейлон чайный куст попал только через восемь столетий. В середине XIX в. Первые чайные плантации появились в Африке, а в начале XX в. Чайный куст достиг берегов Южной Америки.
Ученик 9. В Европе чай первыми начали употреблять голландцы, которые привезли его из Китая в 1610 г. Но особенно понравился китайский напиток англичанам. В начале XX в. на каждого англичанина приходилось около 2,5 кг чая в год, вдвое больше, чем на одного жителя Голландии.
Учитель. Интересно, что в начале XX в. в некоторых странах чай ценился гораздо выше кофе и какао. Чашка чая, например, в Париже стоила 50 коп., чашка какао - 40 коп., а чашка кофе - всего 30 коп. На Руси с чаем познакомились при необычных обстоятельствах. В 1638 г. из Томска
к монгольскому Алтын-хану по распоряжению царя Михаила Фёдоровича было отправлено посольство в лице Василия Старкова и Василия Неверова с богатыми подарками. Кроме самого хана, послы должны были оделить подарками также двух его братьев, один из которых угостил посланников чаем. У русских посланников сложилось невысокое мнение о напитке. И когда Алтын-хан в числе прочих подарков предложил чая, Старков стал упрашивать приближённых хана, чтобы они заменили чай на соболиные шкурки. Однако хан не внял просьбам, и Старкову пришлось везти пакеты с чаем в Москву. Опасения послов не оправдались. Напиток понравился царю и придворным и вскоре от чая остались только приятные воспоминания.
Ученик 10. Чай закупали в Китае, везли караванным путём через Монголию и Сибирь. Поэтому чаепитие было дорогим удовольствием. Но в XIX в. ввоз чая увеличился, и он стал доступен простому люду. Распространение чаепития в России привело к изобретению самовара. [2]
Ученик 11. Сухой чай содержит от 30 до 50 % экстрактивных веществ, которые переходят в заварку и придают чаю неповторимый вкус, аромат, красно-коричневый цвет
и тонизирующее действие. Основную массу экстрактивных веществ чая составляют чайные дубильные вещества, или танины, обладающие терпким вяжущим вкусом и красно-коричневой окраской. Танины улучшают пищеварение, поэтому чай применяют при лечении ряда желудочно-кишечных заболеваний.
Дубильные вещества чая легко вступают в реакцию с белками, на чем и основано применение для дубления кож, состоящих, как известно, из белков. При добавлении в чай молока белки его тоже связывают дубильные вещества чая и последний теряет свою терпкость.
Танины способны растворяться только в горячей воде, при охлаждении они выпадают в осадок и заварка мутнеет. Однако, стоит ее опять подогреть, она станет вновь прозрачной.
Ученик 1. Кроме танинов, к дубильным веществам относятся чайные катехины (эпикатехин и др.), которые укрепляют кровеносные сосуды, снижают проницаемость их стенок и предохраняют от кровоизлияний. Растворы катехинов в кислой среде светлеют,
вот почему, если добавить в чай лимон, то чай светлеет.
Все танины с солями железа дают соединения черного цвета, поэтому не следует заваривать чай в железной посуде или «ржавой водой» - чай получится темным.
Из экстрактивных веществ чая на втором месте находятся алкалоиды - кофеин и теофиллин. В чистом виде препараты кофеина не оказывают на человека такого благоприятного тонизирующего воздействия, как в виде напитка - чая. Объясняется это тем, что в чае тонизирующий эффект достигается совместным действием кофеина, дубильных веществ и комплекса витаминов - С, Р, В1, В2, РР, пантотеновой кислоты - В3.
Аромат чая обусловлен эфирными маслами, которые легко испаряются. Поэтому, если заваренный чай кипятить или долго хранить, он теряет свой аромат и приобретает запах продуктов разложения веществ чайного листа.
Ученик 2. Классическое искусство заваривать чай всегда начиналось с выбора воды. По отношению к чаю действует правило: чем жёстче вода, тем в меньшей степени экстрагируются его вещества. Очень жёсткая вода, содержащая соли серной кислоты - сульфаты кальция и магния, придаёт чаю мутность, неприятный вкус и запах. А если в воде есть соли марганца, чай дает очень слабый настой.
Учитель. Японцы называют чай даром богов и пьют его с соблюдением особых церемоний и без сахара - божественный напиток не нуждается в коррекции.
Учитель. После того, как мы попили чайку, приведём в порядок свои волосы на станции «Золотистый локон», на которой мы расскажем вам, как правильно ухаживать за волосами.
Ученик 3. Знаменитые красавицы, которыми восхищались современники во все времена, - прекрасная Елена, из-за которой началась Троянская война, легендарная Нефертити, дивная Клеопатра - славились роскошными волнистыми или кудрявыми волосами.
1) А что определяет кудрявость волос?
«Строительный материал» волос - это белок кератин, состоящий из длинных цепочек молекул аминокислоты цистеина HS-CH2-CH(NH2)-COOH. Длинные ороговевшие клетки волокнистого слоя волоса состоят из белковых молекул, которые связаны друг с другом посредством дисульфидных «мостиков» S-S и межмолекулярных водородных связей. Именно эти мостики и связи определяют «кудрявость» волоса.
Ученик 4. 2) Врачи-косметологи рекомендуют не расчёсывать мокрые волосы или расчесывать их очень осторожно расчёской с тупыми зубьями? Как это можно объяснить с позиций химии?
Под действием воды происходит разрыв водородных и ионных связей в молекулах кератина, что приводит к разрыхлению наружного слоя волоса и уменьшению его механической прочности. В связи с этим при расчёсывании мокрых волос их очень легко повредить расчёской. После высыхания водородные и ионные связи восстанавливаются
и, следовательно, прочность волос - тоже.
Ученик 5. 3) Врачи считают, что причина перхоти - болезнетворные микроорганизмы. Какие шампуни следует использовать?
Самые распространённые шампуни от перхоти содержат сульсен - дисульфид селена SeS2, а также салициловую кислоту и серосодержащие соединения цинка. Лечебные шампуни могут содержать и другие противогрибковые средства.
4) А почему сера так важна для волос?
В состав кератина входит значительное количество серы, но дефицит этого элемента в организме и становится причиной плохого роста волос и их выпадения.
Учитель. 5) А вот народные средства для блеска, укрепления волос и придания им шелковистости.
Ученик 6. а) Чтобы волосы стали более блестящими, ополаскивать их лучше кислым раствором. Блондинкам подойдет следующий состав: сок половины лимона на 1 л воды; темноволосым - 1 ст.л. 6%-го уксуса на 1 л воды.
б) Для укрепления волос, улучшения роста: 1 стакан сухих листьев крапивы залить 1 стаканом горячей воды, настаивать 1 час. Полоскать волосы после мытья.
в) Для придания волосам шелковистости: 4 ст. л. сухих цветов ромашки залить 1,5 л кипящей воды, кипятить 10-15 минут на очень слабом огне, затем дать настояться и процедить. Использовать после ополаскивания волос
Учитель. Незаметно время подошло к обеду. Только у нас в меню:
на первое - борщ из свеклы; на второе - « плавающий картофель»;
на третье - шипучка; на десерт - шоколадный крем.
Спешите отведать чудесные яства!
Вы, наверное, догадались, что остановились в городе «Поваров».
Ученик 7. Отчего свекольный борщ красный.
Каждой хозяйке известно, что если борщ варится чрезмерно долго, то он постепенно теряет свою красивую тёмно-красную окраску и жидкость в кастрюле становится бледной, слегка зеленоватой. Чтобы вернуть борщу прежний красивый цвет, в него добавляют столовый уксус или твёрдую лимонную кислоту.
Убедиться в этом нетрудно: в тарелку с остатками борща подсыпьте немного пищевой соды (примерно четверть чайной ложки), тотчас вы увидите, как, оставаясь холодной, жидкость «закипит», вспенится, а её цвет из красного станет синевато-серым. Как это объяснить? Очень просто. Красящее вещество свеклы, подобно лакмусу, сохраняет красный цвет только в кислой среде, а сода, как известно, обладает слабощелочными свойствами.
CH3COOH + NaHCO3 = CH3COONa + CO2 + H2O
Учащийся рассказывает, проводит и объясняет опыт.
Ученик 8. Плавающий картофель.
В литровую банку до половины наливают воды и кладут клубень картофеля. Он остаётся на дне банки. Добавляют в банку насыщенный раствор поваренной соли, и клубень всплывает. Если долить чистой воды, то он снова опускается на дно. Обычно картофель в воде тонет, но при добавлении насыщенного раствора соли, удельный вес которого выше удельного веса картофеля, клубень всплывает. При доливании чистой воды раствор разбавляют, и удельный вес его снова изменяется, поэтому картофель опускается на дно.
Учащийся проводит и объясняет опыт.
Ученик 9. Превращение «шипучки» в «вино».
Давайте попробуем приготовить «шипучку», хорошо утоляющую жажду в жаркий день. Возьмите полстакана холодной кипяченой воды, всыпьте в него четверть чайной ложки пищевой соды и одну чайную ложку сахарного песка, добавьте немного (на кончике ножа) твёрдой лимонной кислоты, быстро размешайте и пейте, пока жидкость пенится и шипит, почти как шампанское.Учащийся проводит опыт.
Ученик 10. Шоколадный крем.
Возьмите сырой желток, к нему добавьте две чайные ложки сахарного песка, одну чайную ложку несоленого сливочного масла и одну чайную ложку порошка какао. Растирайте всё это до тех пор, пока сахар не перестанет поскрипывать под ложкой. А теперь ешьте на здоровье приготовленный вами крем! Надеемся, что он вам придётся по вкусу! [3]
Учащийся готовит шоколадный крем.
Учитель. Потихоньку наш день подходит к концу. Что мы делаем вечером? Конечно, каждый из нас занимается домашними делами: стирает, убирает квартиру, гладит белье. А мы займёмся чисткой белья на дому.
Поэтому последняя остановка в нашем путешествии это «Химчистка на дому», где мы послушаем советы по выведению пятен различного происхождения.
Ученик 11. При удалении пятен с различных тканей надо учитывать действие пятновыводящих веществ на ткани, иначе можно испортить вещи.
Для ацетатного шёлка нельзя употреблять кислоту и ацетон, которые его растворяют; для синтетических тканей (капрона, нейлона и др.) не рекомендуется применять растворители (бензин, бензол и др.).
При удалении пятен с шерсти и натурального шёлка не употребляют щелочей, а с хлопчатобумажных тканей - крепких кислот (серной, соляной, азотной). Щавелевая кислота, используемая для удаления ржавчины и красок, а также чернил, должна быть тщательно смыта с ткани после выведения пятен. Хлорная известь также вредно действует на хлопчатобумажные и другие ткани, поэтому ее применяют в небольшом количестве и смывают после удаления пятна.
Ученик 1. Итак, пятна от травы: промывают горячей водой с поваренной солью (1 ст.л. на стакан воды), либо теплым мыльным раствором с небольшим количеством нашатырного спирта.
Пятна от чернил: чернила марки «Радуга» можно вывести томатным соком, подложив под пятно кусок полиэтилена. Через 10 минут прополоскайте холодной водой - чернильное пятно исчезнет, и от сока томатов не будет следа. Небольшое пятно от чернил или пасты шариковой ручки на клеенке, пластике или пальцах рук можно оттереть слегка смоченной головкой спички. Потом это место промойте теплой водой с мылом.
Пятна от ягод и фруктов: пятно смочить 3 % пероксидом водорода, после чего вещь прополоскать.
Пятна от чая и кофе: смочите несколькими каплями глицерина, а потом постирайте вещь в тепловатой воде. Пятна от кофе, шоколада смываются сильно подсоленной водой.
Пятна от жира: жир хорошо впитывается мелом (тальком, жженой магнезией). Посыпьте пятно зубным порошком, прижмите его поплотней к ткани, и оставьте на ночь. Потом аккуратно стряхните мел и окончательно отчистите его. Если нужно срочно свести жир, прогладьте загрязненное место, посыпанное порошком, через бумагу.
Учитель. На этом наше путешествие подошло к своему завершению.
Сегодня, конечно, мы рассмотрели только некоторые области применения химии в домашних условиях. Я думаю, вы убедились, что химические знания необходимы нам и в повседневной жизни. Спасибо, ребята, за работу, остальным - за внимание.
Всего доброго! До новых встреч!
ПРИЛОЖЕНИЕ 5
Практические работы с исследованием
ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ И СРЕДСТВ БЫТОВОЙ ХИМИИ
Использование в процессе практических работ исследовательского характера дает возможность создавать на уроке проблемные ситуации, способствует мотивации для обобщения учебного материала, расширяет возможности для индивидуального и дифференцированного подхода к обучению, повышает творческую активность, позволяет расширить кругозор учащихся. Заметим, что важно придавать им прикладную направленность, тем самым создавать условия для выработки у учащихся умений применять полученные знания при решении реальных задач повседневной жизни и грамотно обращаться с лекарственными препаратами и средствами бытовой химии.
Роль учителя заключается в создании мотивации, сопровождении обучения и обеспечении условий для рефлексии. Каждая работа включает краткие теоретические сведения, задания, вопросы и экспериментальную часть.
Необходимо заранее подготовить информационные карты для учащихся, сводные таблицы «Качественные реакции катионов и анионов», «Качественные реакции органических соединений».
Как показала практика преподавания, включение данных работ в итоговый химический практикум способствует привитию исследовательского подхода к выполнению практических работ, овладению доступными для учащихся научными методами исследования, формирует и развивает творческое мышление.
Практическая работа
Цели: закрепить знания учащихся о качественных реакциях органических соединений и правилах обращения с веществами в повседневной жизни; отработать навыки экспериментального определения органических веществ.
Реактивы и оборудование: ацетилсалициловая кислота (аспирин), вода, хлорид железа(III); ступка с пестиком, стеклянная палочка, спиртовка, держатель, воронка, фильтр, стаканы, пробирки.
Введение. В повседневной жизни человек применяет огромное количество веществ, и, к сожалению, некоторые из них - не по назначению. Примером этого может служить использование аспирина в качестве консервирующей добавки.
Формула ацетилсалициловой кислоты:
Это сложный эфир, образованный уксусной и салициловой кислотами.
В процессе консервирования аспирин долгое время нагревается в присутствии воды, кроме того, используемые продукты могут придавать рассолу кислотный характер.
Задания. Изучите превращения, происходящие с ацетилсалициловой кислотой (аспирином) в процессе консервирования (нагревание в присутствии воды и кислот), и выясните, как эти превращения отразятся на химических свойствах препарата. Напишите соответствующее уравнение реакции:
При необходимости повторите сведения о сложных эфирах
Вопросы - подсказки
• К какому типу относится данная реакция, как она называется?
• К каким классам органических соединений относятся продукты реакции?
• Какие функциональные группы входят в состав ацетилсалициловой кислоты?
• Какая функциональная группа появляется после реакции гидролиза? (Обратите внимание на функциональные группы салициловой кислоты.)
• Как можно проверить наличие этой группы в растворе? (Используйте данные таблицы «Качественные реакции органических соединений».)
• Какие изменения произойдут в химическом составе ацетилсалициловой кислоты (аспирина) в процессе консервирования (нагревание в присутствии воды и кислот)?
Ход работы
1. Измельчите таблетку аспирина в ступке и растворите в воде (объем 10мл)
2. Перенесите в пробирку 2-3 мл полученного раствора.
3. Прокипятите раствор. (Соблюдайте технику безопасности!)
4. Профильтруйте раствор.
5. Проведите качественную реакцию.
6. Сделайте вывод о правильности выдвинутой вами гипотезы.
7. Оформите работу, заполнив таблицу, в которой есть следующие графы: выполняемая операция; реактив; наблюдения; уравнение реакции; вывод.
Вопросы для обсуждения
• На чем основано консервирующее действие аспирина?
• Какое действие на организм человека оказывает салициловая кислота - продукт гидролиза аспирина?
• Какими должны быть условия хранения аспирина?
Сначала учащиеся отмечают наличие карбоксильной группы в аспирине и делают предварительный вывод о том, что консервирующее действие ацетилсалициловой кислоты связано с тем, что в растворе создается кислотная среда, препятствующая размножению бактерий. Написав уравнение реакции, они замечают, что в процессе гидролиза аспирина образуется фенольное соединение, которое помимо бактерицидного оказывает токсическое действие на организм человека. В результате они приходят к выводу, что использование аспирина в качестве консервирующей добавки недопустимо. Наличие фенольного соединения в растворе они доказывают, проведя качественную реакцию с хлоридом железа (III) (фиолетовое окрашивание раствора).
Практическая работа
Цели: закрепить знания учащихся о качественных реакциях неорганических соединений; отработать навыки экспериментального определения качественного состава неорганических веществ.
Реактивы и оборудование: медицинский препарат ферроплекс или любой витаминный комплекс, содержащий ионы железа (например, олиговит), гидроксид натрия, хлорид бария, нитрат серебра, вода; ступка с пестиком, стеклянная палочка, воронка, фильтр, стаканы, пробирки.
Введение. Медицинский препарат ферроплекс применяют для лечения больных с пониженным содержанием гемоглобина в крови. Он состоит из растворимой средней соли, образованной нерастворимым основанием и сильной кислотой. Для лучшего усвоения основного компонента организмом в состав лекарства введена аскорбиновая кислота (витамин С). Применение препарата рассчитано на длительный срок.
Задание: определите качественный состав соли, входящей в состав препарата ферроплекс.
Вопросы-подсказки
• Проанализируйте предложенную информацию. Какие частицы могут входить в состав данной соли?
• Какой способ качественного определения состава ферроплекса следует выбрать? (Используйте данные таблицы «Растворимость кислот, солей и оснований в воде», обратите внимание на название препарата.)
Ход работы
1. Измельчите таблетку ферроплекса в ступке и растворите в воде (5-10 мл).
2. Профильтруйте раствор.
3. Проведите качественные реакции. (Соблюдайте технику безопасности!)
4. Оформите работу, заполнив таблицу, в которой есть следующие графы: гипотеза (предполагаемые катион и анион); реактив; наблюдения; уравнения реакций; выводы.
5. Сделайте вывод о качественном составе препарата ферроплекс.
Пояснения. Основываясь на предложенной информации, исходя из названия препарата и используя метод исключения, учащиеся делают предположение о наличии в составе соли катионов Fe2+ и Fe3+ и анионов SO42 и Сl . Экспериментальная проверка гипотезы позволяет сделать вывод, что состав соли - FeSО4.
ПРИЛОЖЕНИЕ 6
Практическая работа
«Определение влияние моющих средств».
Цели: закрепить знания учащихся об окислительно-восстановительных реакциях, о правилах обращения с веществами в повседневной жизни; отработать навыки экспериментального определения хлора.
Реактивы и оборудование: образцы чистящих средств «Комет», «Мистер Мускул», «Силит», раствор аммиака, иодкрахмальная бумага (фильтровальная бумага, пропитанная концентрированным раствором иодида калия и крахмальным клейстером), вода; тигель, стеклянная палочка.
Введение. Наведение чистоты в современном доме невозможно без использования различных средств бытовой химии. Сильнодействующие, концентрированные, едкие, они требуют очень осторожного обращения и строжайшего выполнения инструкций.
К сожалению, некоторые хозяйки, борясь за чистоту, действуют по принципу: «Лей все сразу, что-нибудь да подействует». А вы читали этикетки «Комета», «Мистера Мускула», «Силита» и других препаратов бытовой химии?
Задание: проверьте, что произойдет, если нарушить правило: «Запрещается использовать порошок «Комет» вместе с жидкостями, содержащими аммиак».
Примечания. Аммиак содержат, например, стеклоочищающие и обезжиривающие средства.
«Комет» имеет в своем составе вещество, известное под торговым названием «хлоринол». Судя по всему, это вещество представляет собой соединение, в котором содержится хлор. Возможно, это соль, кислотный остаток которой С1О.
Вопросы - подсказки
• Какими свойствами - окислительными или восстановительными - обладают хлор и азот в названных веществах?
• Как поведут себя эти вещества, «встретившись» на какой-либо поверхности?
• Образование какого продукта реакции можно ожидать?
• Какой способ качественного определения предполагаемого продукта реакции следует выбрать? (Используйте данные таблицы «Качественные реакции катионов и анионов».)
Ход работы
1. Смешайте в тигле небольшое количество (!) порошка «Комет» и раствора аммиака. (Соблюдайте технику безопасности!)
2. Прикройте тигель влажной иодкрахмальной бумагой.
3. Поясните наблюдаемые процессы.
4. Сделайте вывод о правильности выдвинутой вами гипотезы.
5. Напишите уравнения реакций.
Вопросы для обсуждения
• Почему нельзя смешивать порошок «Комет» с жидкостями, содержащими аммиак?
• Какой тип реакции лежит в основе метода определения при помощи иодкрахмальной бумаги?
Пояснения. Учащиеся делают предположение, что в результате взаимодействия аммиака (окислителя) и ионов Сl (восстановителя) произойдет реакция: 2NH3 + 6С1О = N2 + ЗС12 + 6OН.
Наличие хлора они определяют с помощью иодкрахмальной бумаги:
2KI + С12 = 2КС1 + I2; I2 + крахмал синее окрашивание.
В результате они понимают, почему необходимо соблюдать инструкции и не допускать смешивания названных средств бытовой химии. Во-первых, происходит образование веществ, вредных для здоровья человека, во-вторых, изменение химического состава препарата при таком смешивании снижает его чистящий эффект.
ПРИЛОЖЕНИЕ 7
Тема урок «Подгруппа кислорода и экология»
Цель урока: формирование у учащихся естественно-научных, экологических знаний, умений и убеждений, воспитание культурного отношения к природе.
Оборудование: рисунки на экологическую тему, сделанные учащимися, альбом по экологии, репродукция с картины К. П. Брюллова « Последний день Помпеи», магнитофон.
Ход урока
1. Ты посмотри вокруг,
Как все прекрасно.
К чему печали,
Злость и суета.
2 Мы ходим в шаге
От большой любви и счастья,
А стоит только лишь
Открыть глаза.
(С. Епифанцев)
Учитель. Ребята, мы с вами познакомились с темой « Подгруппа кислорода», посмотрели учебный фильм «Сера», выполнили практическую работу. Вы, наверное, обратили внимание, что те вещества, со свойствами которых мы познакомились, имеют прямое отношение к вопросам самой злободневной сегодня темы- экологии.
А теперь назовите, пожалуйста, аллотропные видоизменения кислорода.
Ученики называют.
Учитель. Это единственные аллотропные видоизменения элементов в газообразном состоянии. Скажите, которое из данных аллотропных видоизменений очень необходимо человеку, полезно? Вопрос, считаю, дискуссионный.
Ответы учащихся самые разнообразные, кто-то говорит, что озон вредный, начинается спор. Наконец, все приходят к выводу, что без кислорода и озона жизнь на Земле невозможна.
Один из учеников говорит, что в зимнее время озон , опускаясь в нижележащие слои атмосферы, разрушается и обогащает воздух кислородом, а атомарный кислород освежает и отбеливает белье, которое сушится на морозе. Летом, во время грозы, в искре молнии из кислорода образуется озон и воздух становится свежее.
Учитель. Что необходимо делать, чтобы сохранился озонный слой и не было « озонных дыр».
Ученик. * ( подразумевается ответы разных учащихся)
Глобальной экологической проблемой является разрушение озонного слоя Земли.
Уменьшение общего содержания озона на 1% вызывает увеличение суточной дозы ультрафиолетового излучения на 1,6-3%. Это излучение отрицательно влияет на здоровье человека, вызывает ожоги, заболевания кожи, глаз, аллергические реакции. Статистика показывает, что увеличение дозы на 1% ведет к увеличению раковых заболеваний кожи на 2%. Разрушителями озонного слоя являются: фреоны, N2O, как продукт разложения азотных удобрений, полеты высоких самолетов, ядерные взрывы.
Ученик. Через 50 лет ожидается уменьшение озона до 5,5-8%. Однако увеличение содержания CO2 понижает температуру стратосферы, что вызывает увеличение количества озона.
Возможно, эти два процесса в какой-то степени компенсируют друг друга.
Учитель. Что же все-таки надо предпринять, чтобы озонный слой не разрушался?
Ученик. Я считаю, что нужно совершенствовать аппаратуру, чтобы она препятствовала загрязнению воздуха и воды, разработать новые, малоотходные и безотходные технологии получения веществ, создать экологически безопасные виды топлива, средств защиты растений, придумать способы опреснения воды и решить проблемы, связанные с радиоактивными отходами.
Учитель. Недавно мы посмотрели фильм «Сера». Вспомните слова античного поэта Лукреция Кара об удивительном веществе- сере
Лукреций Кар жил в 55-99 годах н. э. Такое описание серы не случайно. Обратите внимание на слова « смерть дарящей».
В 79 году н. э. случилось извержение вулкана Везувия, который стер с лица земли такие красивые, цветущие города, как Помпея, Геркуланум, Стабия.
Ученик. Немного об извержении вулканов. Из вулкана, особенно во время сильного извержения, вместе с углекислым газом в большом количестве выделяется сернистый газ. Благодаря большой плотности они « выливаются» из кратера, и растекаются по земле, заполняя низины и удушая все живое на своем пути.
В 1783 году, во время сильного извержения вулкана на острове Исландия от сернистого и углекислого газов, выделившихся из кратера, задохнулись 9 тысяч человек и погибло более 25 тысяч голов скота.
Ученик. Перед нами картина К. П. Брюллова « Последний день Помпеи». На ней изображена страшная трагедия, происшедшая почти 2 тысячи лет тому назад на ограниченной территории. Гибель этих городов объясняется не только тем, что они были засыпаны пеплом, лавой и обломками, а тем, что люди и животные отравились выделившимися из кратера ядовитыми газами H2S и SO2. Они сделали свое страшное дело- уничтожили все живое до того, как города исчезли под слоем пепла и обломков.
Ученик. Сохранилось прекрасное описание знаменитого извержения Везувия в 79 году. Оно было сделано по свежим впечатлениям Плением Младшим в письме к римскому историку Тациту.
Ученик читает отрывок из этого письма( из книги для чтения по химии, авторы- К. Я. Парменов и Л. М. Сморгонский. Рассказ ученика можно заменить прослушиванием записи на магнитофонной ленте).
Ребята задумались.
Учитель. Да, есть над чем задуматься, услышав эту грустную быль.
Ученик. В настоящее время в мире выброс SO2 составляет 140-200 млн. тонн, а к 2010 году составит 350-400 млн. тонн в год.
Ученик. Повышение концентрации SO2 и продуктов его превращения (H2SO4 и сульфаты) в атмосфере приводит к росту респираторных и аллергических заболеваний.
Большое количество SO2 выделяется при обжиге и переработке сульфидных руд меди, свинца, цинка. Некоторые производства выбрасывают в атмосферу газы, содержащие 4- 10 % SO2.
Ученик. При фотохимическом окислении SO2 реагирует с солями щелочных металлов( так, концентрация NaCI над промышленными районами может достигнуть нескольких десятков мг на см3, образуя частицы сульфатов:
H2SO4 + 2 NaCI → Na2SO4 + 2 HCI ,
что может вызвать уменьшение солнечной радиации на 1,6%, и следовательно, оледенение на Земле).
Накопление в атмосфере оксидов серы и азота ведет к образованию серной и азотной кислот, их солей (что увеличивает токсичность) и выпадению кислотных дождей.
Ученик. Кислотные дожди наносят значительный экологический вред, экономический и эстетический ущерб. В результате выпадения кислотных осадков нарушается экологическое равновесие, ухудшается продуктивность сельскохозяйственных растений( они становятся более чувствительными к холоду, засухе, болезням); из почвы вымываются ионы AI и Mg, разрушаются металлоконструкции( коррозия), здания, памятники старины.
Учитель. Ребята, вы нарисовали страшную картину. А можно ли избежать кислотных дождей, выбросов SO2 в атмосферу?
Ученик. Есть несколько способов:
-
Улавливание и направление SO2 на производство серной кислоты и минеральных удобрений.
-
Поглощение SO2щелочными водами.
-
Применение катализаторов, разрушающих SO2.
Ученик. Природный газ очень часто содержит огромное количество соединений серы, например, газ Астраханского месторождения.
С целью очистки газа от соединений серы часть сероводорода, в нем содержащегося, окисляют до оксида серы(IV), который при реакции с сероводородом образует серу:
2 H2S +SO2 → 3S +2H2O
Таким образом на Астраханском газоконденсатном месторождении, характеризующемся высоким содержанием серы, ежегодно получают около миллиона тонн высококачественной элементарной серы. Кроме того, исключается загрязнение атмосферы сернистым газом, сероводородом, рационально используются сернистые соединения.
Учитель. Будем надеяться, что не допустим экологического краха. Мы тоже должны внести лепту в защиту окружающей среды: старательно учиться, познавать азы химии, и не курить, ведь курение- это отравление организма и воздуха не только никотином, но и многими веществами, в том числе сернистым газом.
Тест
Проверим себя
1. . Слово, образованное из двух греческих слов, в переводе означающих: первое- дом, жилище; второе- учение, знание, наука. Что это за слово?
А - зоология
В - экология
С - география
Д - биология
2 Природные источники выброса пыли в атмосферу- это:
А- вулканическая деятельность
В - цементные заводы
С- сталелитейные заводы
Д- электростанции
3. Экологически чистое топливо
А- Кислород
В- Азот
С- Водород
Д- Углерод
4. Какова толщина озонового слоя:
А- 2-4 км.
В - 2-4м.
С- 2-4см.
Д - 2-4мм.
5. Аллотропная модификация кислорода
А - азот
В - озон
С- водород
Д- углерод
6. Токсичный туман- это:
А- Дождь
В- Облако
С- Смог
Д- Пар
7.Основные источники кислотных дождей
А- Атомная электростанция
В - Гидроэлектростанция
С - Тепловая электростанция
Д - Ткацкая фабрика
8. Какие воды очищают с помощью очистных сооружений?
А-Подземные воды
В- Проточные воды
С- Грунтовые воды
Д- Сточные воды
9.Опасные загрязнители воздуха, выбрасываемые в атмосферу электростанциями и домашними печами - это :
А- сера и углерод
В- оксиды серы и оксиды углерода
С- азот и хлор
Д- аргон и оксид магния
10.Отходы производства нужно:
А- использовать в качестве сырья для другого производства
В - выбрасывать в атмосферу
С- сжигать
Д- выбрасывать в водоем, почву
11. Загрязнение воздуха, почвы, воды
А- вызывает у людей множество заболеваний
В - не влияет на здоровье людей
В- благоприятно сказывается на состоянии здоровья людей
Д - не исследуется
12 Ядовитый металл, содержащийся в выхлопных газах автомобилей, работающих на бензине
А- Свинец
В- Олово
С- Алюминий
Д- Медь
13 Какие растения особенно чувствительны к загрязнению воздуха оксидом серы(iv)
А- лиственные деревья
В- хвойные деревья
С- мхи и лишайники
Д- хвощи и плауны
14 Вещество, создающее парниковый эффект
А- Угарный газ
В- Сернистый газ
С- Углекислый газ
Д- Хлорный газ
ПРИЛОЖЕНИЕ 8
Доклад
Разрушение озонового слоя атмосферы
Жизнь на Земле зависит от энергии Солнца. Поступает эта энергия на Землю в виде света видимого излучения, а также инфракрасного и ультрафиолетового излучений. УФ-излучение несет наибольшую энергию и является физиологическое активным, то есть интенсивно действует на живое вещество, приводит к нарушению структуры белков и нуклеиновых кислот и в конце концов к гибели клеток.
Что же защищает нас и всю биосферу от губительного действия "жесткого ультрафиолета"? Озоновый щит Земли.
На высотах 20-50 км воздух содержит повышенное количество озона. Озон образуется в стратосфере за счет кислорода, который поглощает "жесткое" УФ-излучения. От его негативного воздействия наш организм умеет защищаться, синтезируя в коже слой темного пигмента ‒ меланина (загар). Однако это вещество образуется довольно медленно. Поэтому длительное пребывание на весеннем солнце, когда кожа еще не насыщенна меланином, вызывает ее покраснение, головная боль, повышение температуры тела.
В последнее время ученые чрезвычайно обеспокоены снижением содержания озона в озоновом слое атмосферы. Над Антарктидой обнаружена «дыра», в которой содержание озона меньше обычного на 40-50 %. Площадь "дыры" из года в год увеличивается и сегодня уже превышает площадь материка Антарктиды. В результате повысился УФ-фон в странах, расположенных в южном полушарии, ближе к Антарктиде, прежде всего в Новой Зеландии. Медики этой страны охвачены тревогой, констатируя значительный рост заболеваний, связанных с повышением УФ-фона (рак кожи и катаракта). Жители Веллингтона, пытались использовать каждый погожий день (их там бывает не так уж много) для отдыха на воздухе, сегодня опасаются появляться на пляжах. Тревожные сообщения поступают также и из северного полушария: и здесь обнаружено озоновую "дыру" (над Шпицбергеном), правда, не такое большое, как антарктическая.
Уменьшение содержания озона в атмосфере угрожает снижением урожаев сельскохозяйственных культур, заболеваниями людей и животных, увеличением количества вредных мутаций. Если озоновый слой исчезнет совсем, то это приведет к гибели по крайней мере наземной биоты.
Основной источник озоно-разрушающих веществ ‒ деятельность человека. Современная промышленность широко использует так называемые фреоны (хлорфторметаны) ‒ как хладагенты в бытовых холодильниках, как аэрозольные разбрызгиватели в баллончиках с краской, лаком, парфюмерией, для очистки полупроводниковых схем. Для человека пары фреонов не вредны. И они чрезвычайно устойчивой могут сохраняться в атмосфере до 80 лет.
Разрушение озонового слоя происходит так:
• активное функционирование химической промышленности, выпускающей вещества, содержащие хлор и бром, вызывает накопление в атмосфере озоно-разрушающих газов (ОРГ);
• ОРГ поднимаются на высоту 20-50 км над поверхностью Земли, где расположен озоновый слой (особенно благоприятны для этого в приполярных районах);
• солнечные лучи действуют на техногенные газы, из которых выделяется хлор:
CF2Cl2 (CFCl3) + hν = Cl
• хлор разрушает озон, превращая его в кислород;
O3 + Cl = ClO + O2
• при этом каждый атом хлора способен разложить 100 тыс. молекул озона.
К разрушению озонового слоя приводит и военная деятельность, в частности запуск баллистических ракет, их двигатели выбрасывают в атмосферу большое количество оксидов азота. При каждом запуске ракеты в космос в озоновом слое образуется огромная "дыра", которая затягивается лишь за несколько часов. Мировая общественность узнала о преступных опыты милитаристов относительно воздействия на озоновый слой планеты. В 70-е годы американские военные рассеяли в стратосфере над одним из безлюдных островов в Тихом океане специальные химические вещества, в результате чего в озоновом слое над этим островком образовалась "дыра", которая затянулась только через много часов. В результате на острове погибла почти вся наземная биота: пальмы и другие растения, животные, микроорганизмы; из позвоночных животных осталось несколько крупных черепах (их спас толстый костяной панцирь), но они ослепли сетчатка глаз их была сожжена ультрафиолетом.


