- Преподавателю
- Химия
- Учебно-методические рекомендации по лабораторным работам. Естествознание (химия)
Учебно-методические рекомендации по лабораторным работам. Естествознание (химия)
| Раздел | Химия |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Лагно И.А. |
| Дата | 02.09.2015 |
| Формат | doc |
| Изображения | Есть |
Департамент профессионального образования
ОГБПОУ « Колледж индустрии питания, торговли и сферы услуг»
Учебно-методические рекомендации для студентов
по выполнению лабораторных работ
к курсу «Естествознание (химия)»
Томск 2015
Данные методические рекомендации составлены в соответствии с программой по естествознанию для выполнения лабораторных работ по курсу «Естествознание (химия)».
К каждой теме дается краткое теоретическое введение, которое должно при самостоятельной подготовке помочь сознательному выполнению работ. В конце каждой темы приведены контрольные вопросы, фиксирующие внимание учащихся на наиболее важных этапах изучаемого материала.
Общие правила работы в лаборатории
Для успешного выполнения лабораторных работ каждый работающий в лаборатории обязан содержать свое место в чистоте и порядке; работать в лаборатории можно только в халатах. Приступая к работе, необходимо знать свойства применяемых веществ и методы безопасной работы с ними. Пользоваться можно только реактивами, имеющими этикетки и стоящими на полке рабочего стола. Если реактива нет, необходимо обратиться к лаборанту. Излишек взятого реактива не возвращать в посуду, из которой он был взят, а перенести в специальную емкость.
Правила техники безопасности
-
Запрещается пробовать на вкус химические вещества.
-
Щелочи, кислоты и другие ядовитые вещества необходимо набирать в пипетку только при помощи резиновой груши или шприца во избежание химических ожогов полости рта или отравления.
-
При взвешивании сыпучих веществ применять тарированные часовые стекла; химические вещества нельзя оставлять на весах.
-
При взбалтывании растворов в колбах или пробирках необходимо закрывать их пробкой.
-
При нагревании жидкости пробирку следует держать отверстием в сторону от себя и соседей по работе.
-
Во избежание ожогов от брызг и выбросов не накланяться над сосудом, в котором кипит или налита какая-нибудь жидкость.
-
При переносе сосудов с горячими жидкостями держать их обеими руками: одной поддерживать дно, другой - верхнюю часть; руки от ожогов предохраняют полотенце, которым обвертывают сосуд.
-
При работе с горячими и легковоспламеняющимися веществами (эфиры, спирты, бензин и т.д.) нельзя нагревать их на открытом огне или сетке.
-
При определении запаха вещества не следует делать глубокого вздоха, а лишь движением руки направлять к себе воздух.
-
Концентрированную серную кислоту следует приливать в воду тонкой струей при непрерывном перемешивании.
-
Химические стаканы, колбы из обычного стекла нельзя нагревать на голом огне без асбестовой сетки. Категорически запрещается использовать посуду, имеющую трещины или отбитые края.
-
Использованную химическую посуду и приборы, содержащие кислоты. Щелочи и другие едкие вещества, нужно освобождать от остатков и тщательно мыть. Прежде чем слить в раковину, их надо нейтрализовать.
-
При мытье химической посуды запрещается работать с хромовой смесью без резиновых перчаток и защитных очков, а также прорезиненного фартука.
-
Нельзя оставлять без присмотра работающие установки, включенные электронагревательные приборы, газовые горелки.
-
При обнаружении дефектов в приборах немедленно сообщать преподавателю, учащимся запрещается устранять неисправности.
-
Если разбит ртутный термометр или электрод, содержащий ртуть (о случившемся немедленно сообщить лаборанту), рекомендуют капли ртути собрать амальгамированными пластинками из белой жести или меди. После удаления капель ртути необходимо залить место ее разлива 20%-м раствором хлорида железа (III).
-
Во избежание отравлений категорически запрещается принимать пищу в химических лабораториях.
Оказание первой помощи
-
При термических ожогах осторожно обнажить обожженный участок и закрыть сухой асептической повязкой. Обожженный участок нельзя как-либо очищать и мочить водой, этиловым спиртом, перекисью водорода или смазывать мазью.
-
При химических ожогах промыть обожженное место, не обращая внимания на боль, большим количеством проточной воды (10 - 15 мин), в случае кислых реагентах - раствором бикарбоната натрия (2%-м), а в случае щелочных - разбавленным раствором борной или уксусной (кислой на вкус) кислот.
-
При порезах стеклом:
а) промыть рану можно только в случае попадания в нее едких или ядовитых веществ, в остальных случаях, даже если в рану попал песок, ржавчина и т.п., промывать ее водой нельзя;
б) нельзя смазывать рану мазями; перед наложением повязки смазать настойкой йода участок вокруг раны;
в) удалять из раны мелкие осколки стекла может только врач.
-
При отравлении химическими веществами немедленно вызвать врача и одновременно приступить к оказанию первой помощи - если яд попал внутрь - вызвать рвоту, дать противоядие.
В лабораториях должна быть аптечка с набором медикаментов.
Порядок оформления работ
В процессе выполнения лабораторной работы, студент должен наблюдать за ходом эксперимента, отмечая все его особенности: изменение цвета, тепловые эффекты, показание прибора и т.д. Результаты наблюдений записывают в лабораторный журнал, придерживаясь определенной последовательности:
-
Написать тему лабораторной работы, цель работы и дату выполнения;
-
начертить рисунок прибора или схему установки с кратким описанием важных узлов;
-
записать уравнения проводимых реакций и свои наблюдения;
-
произвести расчетную часть работы;
-
полученные данные внести в таблицу, построить график;
-
сделать выводы.
Записи в лабораторном журнале производят ручкой, рисунки приборов, схемы установок, графики выполнят карандашом. Все расчеты необходимо проводить в лабораторном журнале.
Лабораторная работа №1
Дисперсные системы и растворы.
Приготовление раствора с заданной концентрацией.
Теоретическая часть
Чистые вещества в природе встречаются очень редко. Смеси разных веществ в разных агрегатных состояниях могут образовывать дисперсные системы и растворы.
Дисперсными называются системы, в которых одно вещество в виде очень мелких частиц равномерно распределено в объеме другого.
Вещество, которое присутствует в меньшем количестве и распределено в объеме другого, называют дисперсной фазой.
Вещество, присутствующее в большем количестве, в объеме которого распределена дисперсная фаза, называется дисперсионной средой.
По величине частиц, составляющих дисперсную фазу, дисперсные системы делятся на грубодисперсные (взвеси), тонкодисперсные (коллоидные растворы) и растворы.
Взвеси - непрозрачные системы, отдельные частицы которых можно заметить невооруженным глазом. Дисперсная фаза и дисперсионная среда легко разделяются отстаиванием.
К взвесям относятся:
- эмульсии (и среда и фаза - нерастворимые друг в друге жидкости),
- суспензии (среда - жидкость, а фаза - нерастворимое в ней твердое вещество),
- аэрозоли (взвеси в газе мелких частиц жидкостей или твердых веществ).
Коллоидные системы - частицы не видны невооруженным глазом, дисперсная фаза и дисперсионная среда отстаиванием разделяются с трудом.
Растворы - гомогенные системы, состоящие из частиц растворенного вещества, растворителя и продуктов их взаимодействия.
Важной характеристикой вещества является его растворимость. Растворимость - способность вещества растворяться в воде или другом растворителе.
Одним из способов выражения количественного состава растворов является массовая доля растворенного вещества.
Массовая доля растворенного вещества ὠ равна отношению массы растворенного вещества к массе раствора.
ὠ = m (р.в.)/ m (р-р)
Массовая доля может быть выражена в долях или процентах (* 100%).
Практическая часть.
Цель работы: ознакомление с дисперсными системами и приготовление раствора заданной концентрации.
Реактивы: Вода, растительное масло, карбонат кальция CaCO3 (мел), поваренная соль NaCl, сахар.
Оборудование: пробирки, колбы, стеклянная палочка, весы.
Ход работы.
Опыт 1. Приготовление эмульсии. В небольшой объем воды (5 мл) внесите несколько капель растительного или машинного масла. Встряхните, наблюдайте. Что происходит с течением времени.
Опыт 2. Приготовление суспензии. Карбонат кальция ( мел) разотрите в ступке и высыпьте в 5 мл воды. Встряхните. Опишите наблюдаемую систему.
Опыт 3. Приготовление раствора с заданной концентрацией. Получите задание от преподавателя.
Масса соли, г
Объем воды, мл
Массовая доля соли в растворе (в долях)
Массовая доля соли в растворе (в процентах)
0.5
100
0,8
100
1,0
50
0,3
25
0,5
25
Отвесьте на весах соль (вспомните правила взвешивания) и поместите в колбу.
Отмерьте требуемый объем дистиллированной воды (вспомните правила измерения объемы жидкостей) и вылейте её в колбу с солью. Плотность воды принять 1г/мл. Содержимое колбы перемешайте до полного растворения соли.
Представьте расчеты.
Опыт 4. Получите от преподавателя задание; вычислите, сколько соли и воды потребуется для приготовления указанного раствора с заданной массовой долей вещества. ( Рекомендуется взять цветную соль, например сульфат меди CuSO4, тогда образующиеся растворы будут являться шкалой.).
Масса раствора, г
Массовая доля соли
в %
Масса соли, г
Масса воды, г/ мл
10
3
10
5
10
8
10
10
10
12
Контрольные вопросы:
1.С какими приемами работы в химической лаборатории вы познакомились?
2. В чем сходство и различие эмульсий и суспензий?
3. Предложите способ очистки поваренной соли. Как вы понимаете термин перекристаллизация?
Лабораторная работа №2
Химические свойства неорганических веществ. Индикаторы.
Теоретическая часть.
Химия - наука о веществах и их превращениях.
В природе химические реакции протекают постепенно. За счет химических реакций существует все живое на Земле. Например, в зеленых растениях на свету происходит превращение углекислого газа и воды в органические вещества и выделяется кислород. Окисление на воздухе, горение, ржавление железа - все это химические явления. Иначе их называют химическими превращениями, химическими реакциями или химическим взаимодействием.
Химия изучает не только процессы, происходящие в природе, но и создает новые с заданными свойствами вещества.
На химических заводах производят минеральные удобрения, химические средства защиты растений от вредителей и сорняков. Их применение повышает урожайность полей.
Химия обеспечивает переработку полезных ископаемых в топливо, ядерное горючее, прочные и жаростойкие материалы для космических кораблей и ракет, материалы для компьютерной техники. Химия обеспечивает получение металлов и сплавов из руд.
Продукты химии широко используются в быту. В повседневной практике используются изделия из искусственных волокон, искусственной кожи, пластмассы, а также лаки, краски, моющие средства и др.
Химические процессы лежат в основе получения строительных материалов - кирпича, цемента, бетона.
При физических явлениях изменяется форма или физическое состояние вещества или образуются новые вещества за счет изменения состава ядер атомов.
Явления, при которых одни вещества превращаются в другие, отличающиеся от исходных составом и свойствами, и при этом не происходит изменения состава ядер атомов, называются химическими. Признаками химической реакции могут являться: появление осадка, выделение газа, изменение цвета, выделение тепла и света.
Опыт, наблюдение, анализ - основа химической науки. Чтобы понять сущность процессов очень важно научиться наблюдать и анализировать свои наблюдения.
Индикаторы - вещества, способные изменять свою окраску в зависимости от кислотности (щелочности) среды. Индикаторы могут быть в виде растворов и в виде индикаторной бумаги
Химические реакции, характеризующие отдельные классы неорганических соединений:
Кислоты. Кислоты реагируют с металлами, основными оксидами, с основаниями, с солями. При нагревании некоторые кислоты разлагаются, как правило образуется кислотный оксид и вода.
Zn + 2HCl = ZnCl2 + H2↑
CuO + H2SO4= CuSO4 + H2O
NaOH + HCl = NaCl + H2O
ZnCl2 +H2SO4 = ZnSO4 + 2HCl
H2SiO3= H2O +SiO2↑
Основания. Основания реагируют с кислотами, нерастворимые основания при нагревании разлагаются, реагируют с растворами солей.
NaOH + HCl = NaCl + H2O
2Fe(OH)3 =Fe2O3+ 3 H2O
Fe2(SO4)3 + 6KOH= 2Fe(OH)3↓ + 3 K2SO4
Соли.
1. Соли реагируют с металлами, при написании уравнений этих реакций следует руководствоваться рядом, составленным Н.Н.Бекетовым. так как эти реакции протекают в водных растворах, то для опытов нельзя применять металлы, которые при обычных условиях реагируют с водой (Na, Li и т.д.)
2. Соли реагируют с кислотами. При проведении этих реакций обычно берут сухую соль и действуют концентрированной кислотой.
3. Соли реагируют со щелочами в водных растворах.
4. Соли реагируют с солями. Реакции протекают в водных растворах и используются для получения практически нерастворимых солей.
5. Некоторые соли при нагревании разлагаются (обжиг известняка CaCO3)
6. Некоторые соли способны реагировать с водой и образовывать кристаллогидраты (CuSO4 * 5 H2O).
Практическая часть.
Цель работы: изучение химических свойств неорганических веществ, определение кислотности среды с помощью индикаторов.
Реактивы: раствор соляной кислоты HCl и серной кислоты H2SO4, металлический цинк, железо и медная стружка, оксид магния MgO, щелочь NaOH, растворы солей: нитрат серебраAgNO3, хлорид меди (II) CuCl2, сульфат меди (II) CuSO4 ,хлорид бария Ba Cl2, сульфат натрия Na2SO4., хлорид калия KCl, индикаторы.
Оборудование: пробирки, штатив для пробирок, спиртовка, держатель, спички, пипетки, цилиндр, чашечки для выпаривания или предметные стекла.
Ход работы
Опыт 1. Отношение кислот к металлам. В 2 пробирки поместите по 2 кусочка цинка, в две другие насыпьте немного железных опилок, а последние две медные стружки. В одну пробирку с цинком налейте 1 мл серной. а в другую - столько же соляной кислоты. Точно также прилейте эти кислоты в пробирки с железом и медью. Найдите железо, цинк и медь в ряду активности металлов, составленном Н.Н.Бекетовым, и подумайте, на основании каких свойств составлен этот ряд. Напишите уравнения химических реакций, которые наблюдались в этом опыте. К какому типу эти реакции относятся?
Опыт 2. Взаимодействие кислот с основными оксидами. В пробирку насыпьте немного оксида магния (или оксида меди) и прилейте соляной кислоты. Пробирку слегка нагрейте. Перенесите несколько капель на стеклянную пластину и выпарьте. Какие вещества будут на пластине после выпаривании? Составьте уравнение реакции.
Опыт 3. Взаимодействие щелочей с кислотами. Реакция нейтрализации. В пробирку налейте 1 мл раствора гидроксида натрия и добавьте к нему несколько капель раствора фенолфталеина. Прибавляйте по каплям раствор соляной кислоты при перемешивании. Напишите уравнение реакции и отметьте свои наблюдения
Опыт 4. Взаимодействие солей с металлами.
В пробирку налейте 2 мл сульфата меди и всыпьте небольшое количество порошка железа, запишите реакцию и свои наблюдения. Возможна ли реакция между сульфатом железа и медью, дайте объяснение.
Опыт 5. Взаимодействие соли с кислотой. В пробирку налейте 1-2 мл раствора соляной кислоты и по каплям прибавляйте нитрат серебра, запишите реакцию и свои наблюдения. Возможна ли реакция при другом порядке смешивания веществ. Дайте объяснение
Опыт 6. Получение нерастворимых гидроксидов.В пробирку налейте раствор хлорида или сульфата меди (II) и прибавляйте по каплям гидроксид натрия. Опишите образовавшееся вещество, осторожно нагрейте пробирку. Что произошло? Напишите соответствующие реакции.
Опыт 7. Взаимодействие солей друг с другом. В 1 пробирку слейте по 1 мл хлорида бария и сульфата натрия. Что наблюдается? Напишите уравнение реакции. Во вторую пробирку налейте по 1 мл хлорида калия и сульфата натрия. Что наблюдается? Произошла ли химическая реакция? Осторожно выпарьте раствор, какие соли могут образоваться в этом случае? Сформулируйте одно из условий протекания химической реакции до конца.
Опыт 8. Определение кислотности среды с помощью индикаторов.
Берем жидкость из трех пробирок (в первой - кислота, во второй - щелочь, в третьей - вода) и капнем на универсальную индикаторную бумагу. Окраску сравниваем со стандартной шкалой. Записываем окраску индикатора в кислой, нейтральной и щелочной средах.
Результаты наблюдений запишем в таблицу по образцу:
-
Индикаторы
кислота
щелочь
вода
Метиловый оранжевый
Фенолфталеин
Лакмус
Универсальная бумага
Сделайте вывод об индикаторе, который можно использовать для определения во всех средах.
Контрольные вопросы смотрите к каждому опыту.
Лабораторная работа № 3.
Химические свойства кислородсодержащих органических соединений.
Теоретическая часть.
Спиртами называют производные углеводородов, содержащие вместо одного или нескольких атомов водорода в молекуле углеводорода соответствующее число гидроксильных групп ОН.
Спирты в зависимости от строения радикала делятся на предельные и непредельные, в также на ациклические и циклические. Кроме того, по числу гидроксильных групп различают спирты одно- и многоатомные; в зависимости от положения гидроксильной группы - первичные, вторичные и третичные.
Одноатомные предельные спирты
Содержат радикал предельных углеводородов и имеют одну гидроксильную группу. Общая формула R-OH.
Гомологи: CH3OH (метиловый), C2H5OH (этиловый), C3H7OH (пропиловый), C4H9OH (бутиловый), C5H11OH (амиловый).
Физические свойства
Физические свойства спиртов определяются свойствами углеводородных радикалов и гидроксильной группой.
С1 - С11 - жидкости
с С12 - твердые вещества.
Для многих спиртов характерны специфические запахи.
С увеличением молекулярной массы спиртов нормального строения повышаются их температуры кипения и плавления.
Первые три спирта хорошо растворимы в воде. Высшие спирты в воде не растворяются.
Первые члены гомологического ряда легко воспламеняются и горят синеватым, почти не светящим пламенем. Спирты с большой молекулярной массой горят коптящим пламенем и после сгорания оставляют черный налет.
Фенолы - органические соединения, в которых гидроксильная группа связана непосредственно с атомом углерода бензольного кольца С6Н5ОН.
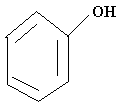
Фенол содержится в каменноугольной смоле, в древесном дегте, откуда их и добывают.
Фенол - кристаллическое вещество, Тпл = 41 - 420С, Ткип = 1820С. Обладает сильным неприятным запахом, растворяется в горячей воде. Является сильным антисептиком, вызывает ожог кожи, ядовит.
Карбоновые кислоты х![]() арактеризуются наличием карбоксильных групп
арактеризуются наличием карбоксильных групп
Классификация карбоновых кислот
-
В зависимости от природы радикала:
-
предельные
-
непредельные
-
ароматические
-
-
По количеству карбоксильных групп:
-
Одноосновные
-
Двухосновные
-
Трехосновные
-
Одноосновные предельные карбоновые кислоты (алкановые)
О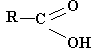 бщая формула:
бщая формула:
НСООН СН3СООН С2Н5 - СООН С3Н7СООН
муравьиная уксусная пропионовая масляная
Изомерия определяется изомерией радикала. Начинается с 4-го члена гомологического ряда. Наиболее распространены тривиальные названия кислот, многие из них связаны с наименованием продуктов, из которых они первоначально были выделены или в которых были обнаружены. Например, муравьиную кислоту получали из муравьев, уксусную - из уксуса, масляную - из прогоркшего масла.
Сложные эфиры низших одноатомных спиртов.
Чаще всего названия сложных эфиров образуют от наименований кислот и спиртов, их образующих.
У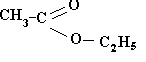 ксусноэтиловый эфир или этиловый эфир уксусной кислоты
ксусноэтиловый эфир или этиловый эфир уксусной кислоты
или этилацетат.
Способы получения:
-
Извлечение из природных продуктов
-
Реакция этерификации
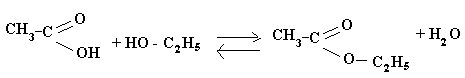
Физические свойства:
Бесцветные жидкости, легче воды. Многие обладают специфическим приятным ароматом плодов, ягод, фруктов (рома, вишни, слив, груш, абрикосов, ананасов, яблок и др.)
Практическая часть
Цель: ознакомление со свойствами спиртов, уксусной кислоты.
Реактивы: растворы этилового, бутилового, изоамилового спиртов. Раствор серной кислоты ( H2SO4), фенолфталеин, перманганат калия (KMnO4), глицерин ( C3H5 (OH)3, хлорид меди ( Cu (OH)2), гидроксид натрия ( NaOH), фенол ( C6H5OH), бромная вода
( Br2), хлорид железа (III) ( Fe(OH)3, раствора йода в йодистом калии, ацетат натрия ( CH3 COONa), серная кислота (конц), уксусная кислота ( CH3COOH)/
Оборудование: штатив с пробирками, спиртовка, спички, газоотводная трубка, бумага, фарфоровая чашка, медная проволока, индикаторная бумага.
Ход работы
Опыт № 1. Растворимость спиртов и их нейтральный характер
В три пробирки налейте по 1 мл окрашенной воды и в каждую добавьте по 0,5 мл : в 1-ю этилового спирта, во 2-ю бутилового, и в 3-ю изоамилового. Отметьте запах спиртов. Хорошо встряхните полученную смесь. Визуально оцените растворимость спиртов в в воде. ( Этиловый спирт неограниченно растворяется в воде, бутиловый мало растворяется, а изоамиловый не растворяется , почти целиком всплывает наверх. Какую закономерность можно вывести о влиянии величины углеводородного радикала на растворимость спиртов.
Затем в чистую пробирку налейте 1 мл этилового спирта, из пробирки стеклянной палочкой нанесите каплю раствора на универсальную лакмусовую бумагу, а в пробирку добавьте каплю раствора фенолфталеин. Изменяется ли окраска индикаторов? Сделайте вывод о среде этилового спирта.
Опыт № 2. Окисление спиртов сильными окислителями.
В пробирку наливают 2-3 капли раствора серной кислоты, 1-2 кристалла перманганата калия (или бихромата калия) и столько же этилового спирта. Содержимое пробирок осторожно нагревают в пламени спиртовки до изменения окраски. Отметьте характерный запах образующегося вещества (какого?). Что происходит с окраской раствора? Составьте уравнение реакции ( серная кислота выступает в роли водоотнимающего средства).
Опыт №3 . Исследование свойств глицерина.
В пробирку налейте 1 мл глицерина, наклоните ее несколько раз в разные стороны. Что вы можете сказать о вязкости и о запахе глицерина? В пробирку добавьте 1 мл воды, взболтайте. Что можно сказать о растворимости глицерина в воде? К полученному раствору добавьте 8 капель хлорида меди и по каплям добавляйте раствор щелочи до появления ярко синей окраски глицерата меди. Это качественная реакция на глицерин.
Опыт № 4 . Взаимодействие фенола с бромной водой.
В пробирку внесите 0,5 мл раствора фенола и добавляйте по каплям бромную воду до появления белой взвеси. Постепенно оседает белый осадок. Составьте уравнение проделанной реакции. Это качественная реакция на фенол.
Опыт № 5. Реакция фенола с хлоридом железа.
В пробирку внесите 0,5 мл раствора фенола. К полученному раствору добавьте пару капель раствора хлорида железа FeCl3. Что наблюдаете? Это качественная реакция на фенол.
Опыт № 6. Получение уксусной кислоты.
В пробирку помещают 1 г ацетата натрия и 1 мл концентрированной серной кислоты, добавьте немного песка для равномерного кипения. Пробирку закрывают пробкой с газоотводной трубкой и укрепляют в лапке штатива. Конец газоотводной трубки погружают до дна в пробирку с 2 мл воды (приемник), прикрыв ее влажным ватным тампоном. Смесь нагревают несильно, до ее вспенивания. В приемник соберется около 1 мл уксусной кислоты. Прекращают нагревание и отделяют приемник от прибора.
Идентификацию уксусной кислоты проводят индикаторной бумагой и по характерному резкому запаху. Напишите уравнение реакции.
Опыт № 7. Кислотные свойства уксусной кислоты
В 2 пробирки наливают по 1 мл уксусной кислоты.
В 1-ю добавьте несколько стружек магния и быстро закройте отверстие пробирки пробкой. Через несколько секунд откройте пробирку и поднесите к отверстию пробирки зажженную лучину. Во 2-ю немного порошка карбоната натрия.
Опишите наблюдения, напишите уравнение реакции.
Опыт № 8. Получение этилацетата ( этилового эфира уксусной кислоты).
Внесите в пробирку 4 - 5 капель концентрированной уксусной кислоты и такое же количество этилового спирта. Добавьте 3 капли концентрированной серной кислоты и щепотку прокаленного речного песка. Доведите смесь до кипения. Дайте остыть полученному эфиру. Понюхайте его (осторожно!) Запишите наблюдения. Напишите уравнение получения этилацетата. Укажите роль серной кислоты в реакции этерификации.
Сделайте вывод.
Лабораторная работа № 4.
Химические свойства белков - природных полимеров.
Теоретическая часть.
Белки или белковые вещества - высокомолекулярные азотсодержащие органические соединения, они являются природными полимерами (биополимерами). Чрезвычайно сложные молекулы белков построены из остатков α-аминокислот. Белки играют первостепенную роль во всех жизненных процессах. Классическое определение связи жизни с белками дал Ф. Энгельс: «Жизнь есть способ существования белковых тел. Повсюду, где мы встречаем жизнь, мы находим, что она связана с каким-либо белковым телом, повсюду, где мы встречаем какое-либо белковое тело, не находящееся в процессе разложения, мы без исключения встречаем и явления жизни».
Биологическое значение и техническое применение белков
Белки имеют огромное биологическое значение. Они являются основным веществом, из которого построены клетки животного организма. Белки - главная составная часть ядра и протоплазмы клеток, основа мышц, костей, кожи, нервной ткани, хрящей. Они входят в состав крови, волос, копыт, рогов, шерсти и т. д. Важнейшие жизненные процессы протекают при непосредственном участии белков. Белки входят в состав ферментов, гормонов, нуклеопротеидов (вещества, регулирующие обменные реакции в организме), антител (используются организмом в борьбе с микробами). Белок в чистом виде представляют собой вирусы - бесклеточные возбудители ряда инфекционных заболеваний.
Белки содержатся и в растительных клетках, но в значительно меньшем количестве, так как основу растений составляют углеводы.
Белки являются основным продуктом питания. Средняя потребность человека в белке в сутки - 80-100 г.
Среднее содержание белковых веществ в некоторых пищевых продуктах (%)
Икра………………….26,7 Картофель………………… 2
Мясо………………12,9-14 Плоды, ягоды……………..0,2-1,0
Рыба……………….13-18 Горох……………………...22
Молоко……………...3,4 Дрожжи кормовые ...........45
Велика роль белков и белковых веществ в легкой промышленности. Натуральные шелка, шерсть используются в производстве тканей. Кожевенная промышленность перерабатывает шкуры животных путем дубления в кожу. Из отходов кожевенной и мясной промышленности получают желатин. Его применяют в пищевой промышленности, в фотографии при получении светочувствительных эмульсий.
Из панциря черепах, копыт, рогов, состоящих преимущественно из белковых веществ, производят галантерейные изделия. Белки применяются и в медицинской практике (например, в виде лечебной сыворотки).
Состав и строение белков.
Белки, представляют собой сложные органические соединения, поэтому выделение индивидуального белка и изучение его состава и строения представляет большие трудности. Почти все белки состоят из пяти основных элементов (%): углерода 50-55, водорода 6,6-7,3, кислорода 21,5-23,5, азота 15-18, серы 0,3-2,5. Некоторые белки содержат фосфор, железо, медь, галогены.
Изучение белков привело к теории о строении белка как полипептидной молекулы (Э. Фишер, Гофмейстер). При гидролизе белков обнаружено 25 - 30 различных α-аминокислот. Поэтому фрагменты молекул белка рассматривают как полипептиды, образованные из этих кислот:
Первичная структура является основой строения белка. Она определяется характером полипептидной цепочки и зависит от того, какие аминокислоты и сколько входят в состав данного полипептида, и от последовательности чередования аминокислотных остатков.
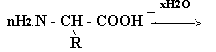
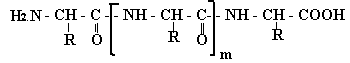
фрагмент полипептидной цепочки
Вторичная структура характеризует состояние полипептидной цени в пространстве. Эти цепи «скручены» в цилиндрическую спираль, отдельные витки которой удерживаются многочисленными водородными связями.
Третичная структура определяет конфигурацию макромолекулы белка. Она представляет собой тем или иным образом свернутую спираль.
Практическая часть.
Цель: Изучить химические свойства белков - качественные реакции. Свертывание белков - денатурация или разрушение.
Реактивы: гидроксид натрия (NaOH), хлорид меди ( Cu(OH)2, сульфат меди ( СuSO4), раствор куриного белка, ацетата свинца Pb(CH3COO)2, нитрат свинца Pb( NO3)2 азотная кислота ( HNO3), раствор аммиака в воде ( NH4OH)
Оборудование: штатив с пробирками, спиртовки, спички, держатель
Ход работы.
Опыт № 1. Цветные реакции на белки. Биуретовая реакция.
В пробирку наливают 2 мл раствора яичного белка. Затем прибавляют равный объем раствора 10% гидроксида натрия и по 1-2 капли 1% раствора сульфата меди. Появляется красно-фиолетовое или сине-фиолетовое окрашивание.
Опыт № 2. Ксантопротеиновая реакция.
К 2-3 мл раствора куриного белка осторожно /по стенке пробирки/ приливает 1-2 мл концентрированной азотной кислоты. Осторожно нагревает, появляется желтое окрашивание. После охлаждения в пробирку осторожно /по стенке/ приливают избыток концентрированного раствора аммиака или гидроксида натрия - жидкость принимает оранжевое или желто-оранжевое окрашивание. Реакцию рекомендуется проводить под тягой!
Опыт № 3. Реакция на аминокислоты, содержащие серу /цистеин, цистин. Реакция Фоля.
В пробирку наливают 2 мл раствора яичного белка. Добавляют 1,5 мл 20% раствора щелочи (гидроксида натрия) и осторожно нагревают до кипения, кипятят 1-2 мин, после чего прибавляет 2-3 капли 1% раствора ацетата свинца или нитрата свинца. В пробирке с белком появляется буровато-черное или черное окрашивание, интенсивность которого зависит от концентрации раствора белка и содержания в ней цистеина и цистина.
Опыт № 4. Свертывание белков.
Налейте в 2 пробирки по 1 мл водного раствора белка и одну пробирку нагрейте в пламени спиртовки до кипения. Обратите внимание на образование хлопьев в пробирке. В другую пробирку с раствором белка добавьте небольшое количество этилового спирта. Опишите свои наблюдения. Добавьте во вторую пробирку воды. Опишите свои наблюдения.
Сделайте вывод.
.
Литература:
-
А.С. Егоров Химия для колледжей Феникс Ростов н/Дону 2013
-
Г.Е.Рудзитис. Ф.Г. Фельдман. Химия 8-10 классы 2008
-
О. С. Габриэлян. Г.Г.Лысова Химия 11 класс. Дрофа М. 2010г.
-
Еремин В.В. и др. Химия. 11 класс, 2008.


