- Преподавателю
- Химия
- Презентация по химии Методика решения расчетных задач по химии
Презентация по химии Методика решения расчетных задач по химии
| Раздел | Химия |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Анисимова Т.А. |
| Дата | 09.08.2015 |
| Формат | docx |
| Изображения | Есть |


Работа учителя химии высшей категории
МБОУ «Лицей №28 г. Йошкар-Олы»
Республики Марий Эл
АНИСИМОВОЙ ТАМАРЫ АЛЕКСЕЕВНЫ
Методика решения расчетных задач по химии
Оглавление
Введение………………………………………………………………………...стр 2
Глава I Методика обучения учащихся решению расчетных задач по химии
§1. Методический подход к решению химических задач…………….стр 3
§2. Логико-структурированная схема решения задач………………...стр 4
Глава II Методика решения расчетных задач по химии
§1. Методика решения задач на определение молекулярной
формулы вещества…………………………………………………..стр 7
§2. Определение молекулярной формулы вещества по уравнениям химических реакций…………………………………………………..стр 13
§3. Определение молекулярной формулы неизвестного
органического вещества…………………………………………….стр 16
§4. Методика решения задач прямого расчетного действия…………стр 19
§5. Методика решения задач с участием смесей веществ……………стр 31
§6. Задачи, предлагаемые на ЕГЭ по химии в блоке "C"
с решением…………………………………………………………..стр 38
Заключение…………………………………………………………………….стр 42
Литература……………………………………………………………………..стр
Введение
В настоящее время перед современной педагогической наукой стоит проблема, как повысить интерес школьников к химии. Это побуждает преподавателей искать новые средства и методы обучения, способствующие развитию интереса к предмету. Однако камнем преткновения для ребят становится решение расчетных задач. А ведь именно умение решать их является основным показателем творческого усвоения предмета. Кроме того, решение задач при изучении теории позволяет значительно лучше разобраться в ней и усвоить наиболее сложные вопросы.
Задачи по химии обычно предлагаются на всех экзаменах: устных и письменных. Блоки "B" и "C" единого экзамена не обходятся без задач, по сложности выходящих за рамки школьной программы, которая позволяет обучить только простейшим расчетам.
Поэтому решение этой проблемы полностью ложится на плечи школьных учителей. А учителям в свою очередь необходимо найти правильный и наиболее доступный для понимания учащихся методический подход к решению задач по химии.
В этом пособии предлагается единый методический подход, логически-структурированная схема решения задачи, система и рациональные способы их решения.
Методика предполагает научить учащихся решению трех типов задач:
I Задачи на определение молекулярной формулы вещества.
II Задачи прямого расчетного действия.
III Задачи на смеси веществ.
Здесь рассмотрена методика решения задач различного уровня сложности, предусмотрен плавный переход от простых к более сложным. Задания такого уровня сложности обычно предлагают на вступительных экзаменах в вузы с повышенными требованиями по химии - химических, биологических, медицинских и др.
Пособие поможет в подготовке участников химических олимпиад и абитуриентов.
В приложении предложены условия задач, составленные с учетом национально-регионального компонента, а также задачи, предлагаемые на едином государственном экзамене в блоках "B" и "C". Ретро-задачи позволят проверить теоретические знания предмета и умение выстраивать логические цепочки.
Разработанный материал, надеемся, поможет учителям-предметникам совершенствовать свое мастерство и облегчить подготовку к урокам и углубленным занятиям с учащимися, заинтересовать ребят наукой химией, поднять их творческий потенциал и, разрушив этот «камень преткновения», повысить интерес к решению расчетных задач.
Глава 1.Методика обучения учащихся решению расчетных задач по химии
§1. Методический подход к решению химических задач
Решение расчетных задач - важная сторона обучения химии. Обучение решению таких задач способствует связи обучения с жизнью, помогает профессиональной ориентации. Оно играет важную роль в воспитании трудолюбия, целеустремленности, формирования мировоззрения и реализации межпредметных связей. Велика развивающая функция задач по химии, т.к. в процессе их решения формируются рациональные приемы мышления, происходит обобщение знаний, устраняется формализм в знаниях, развивается самостоятельность и навыки самоконтроля.
Образовательная функция задач выражается в том, что в процессе их решения закрепляются и совершенствуются химические понятия о веществах и процессах.
Особенность любой химической задачи в том, что она всегда конкретна и всегда может быть решена на основе имеющихся знаний законов, теорий и фактов химии.
Процесс решения задачи - путь от абстрактного к конкретному. Однако всегда должны помнить, что задача - это не самоцель, а средство, способствующее прочному усвоению знаний, а значит к формированию интереса учащихся к изучению химии.
Для того чтобы обучить учеников способам решения расчетных задач, учителю самому необходимо в совершенстве овладеть химической задачей, способами ее решения, методикой ее использования. Умение решать расчетные задачи и обучать этому учеников - важная составляющая часть педагогического мастерства учителя химии.
В решении задач должен соблюдаться единый методический подход. Одна сторона этого подхода - обучение учащихся решению задач. Другая сторона - самостоятельное решение задач школьниками. И высшая степень проверки умения осмысленного решения задач - это составление условия задачи самими учащимися.
Выбирая задачу для учащихся необходимо оценить ее методически с точки зрения разных целей:
-
Какие понятия, законы, теории и факты должны быть закреплены в решении конкретной задачи;
-
Какие приемы решения задачи должны быть сформированы;
-
Какие мыслительные приемы должны быть развиты в процессе решения задачи;
-
Какие дидактические функции выполняет решение данной задачи: повторение, обобщение, закрепление нового материала или проверка знаний.
Если целью является закрепление, то методически задача должна быть уже известна ученикам. Если же учитель хочет объяснить задачу нового типа, то при методической неподготовленности учащихся к ее решению необходимо, чтобы содержание материала, на котором базируется задача, было ученикам уже известно.
Нужно, чтобы все задачи, которые даются ученикам, были заранее решены самим учителем. Учитель должен быть убежден в целесообразности выбора данной задачи, в том, что задача будет посильна для ученика.
§2. Логико-структурированная схема решения задач
Работая с расчетными задачами, я использую логико-структурную схему, основные этапы которой:
I Задача (функция учителя) →
II Анализ условия задачи (функция учителя и ученика) →
III План решения задачи (функция учителя и ученика) →
IV Реализация плана решения (функция учителя и ученика):
- химизм в содержании условия задачи;
- работа с условиями данной задачи;
- осмысление результата (вопроса) решения задачи;
- выбор способа ее решения;
- решение задачи;
- предложение других способов решения;
V Анализ решения (функция учителя и ученика).
При решении задач повышенной сложности, для более глубокого их осмысления после анализа данной задачи, мы еще некоторое время работаем с ней незначительно изменяя ее условие и вновь прорабатывая все этапы ее решения.
I Этап. Выбор задачи всегда остается за учителем. В настоящее время в распоряжении учителя имеется достаточное количество задач, соответствующих школьной программе. С каких задач начать обучение? Я пользуюсь определенной методикой выбора задач, подразделив их на 3 типа:
-
Задачи на нахождение формул неизвестных веществ .
2. Задачи прямого расчетного действия.
3. Решение задач с участием смеси
И на каждой ступени: 8, 9, 10, 11 класс, выбираю задачи, позволяющие совершенствовать методику решения задач каждого типа. Учу ребят использовать все известные способы решения, находить более рациональный. Обращаю внимание на метод решения.
II Этап. Анализ условия задачи предусматривает не только ознакомление с ее текстом, но и, что очень важно, правильную запись условия задачи с четким правильным использованием единых обозначений и определенной формы записи.
Даже, если задача решается по уравнению химической реакции, очень важно записать сначала ее условие.
III - IV Этапы. Мы с учащимися используем тот или иной математический подход к решению каждой химической задачи, первоначально определив ее тип. Олимпиадные же задачи зачастую включают все 3 типа и требуют длительного осмысления плана ее решения. Вот в этом случае я направляю внимание ребят на вопрос, поставленный в задаче, и предлагаю начать с химической формулы, способной вывести к ответу на вопрос, и постепенно подбираться к ней, шаг за шагом находя ее основные составляющие.
Многие задачи могут быть решены несколькими способами. В практике обучению решению задач очень важно поощрять попытки учеников найти разные варианты решения одной и той же задачи. Это даст возможность избежать шаблона, заставит учеников логически мыслить.
Часто в учебниках решение задач по химическим уравнениям реакций предложено с помощью математических пропорций. Конечно, этому способу решения надо обучить учащихся. Но на задачу повышенной сложности затратится масса времени для решения. Поэтому обязательно необходимо научить ребят решать задачи, минуя пропорцию, использую величину ν - количество вещества. Эту величину мы с ребятами назвали «королевой» решения задач.
V Этап. Анализ решения задачи, пожалуй, так же важен, как и само решение. Особенно при обучении решения задач нового типа, т. к. анализ позволяет выявить недостатки решения, найти его наиболее рациональный способ, установить и закрепить в памяти приемы, использованные при решении.
Результаты решения задач, требующих творческого, комплексного применения ранее полученных знаний, мы непременно обсуждаем с ребятами. Сравниваем различные способы решения, выделяем наиболее оригинальные из них.
При первоначальном знакомстве школьников с решением типовой задачи необходимо разъяснить ее условие, добиться понимания учениками новых терминов и понятий, которые им придется использовать при решении задач.
Для лучшего понимания условия задачи обязательно провожу 2-х минутный химический тренажер. Пожалуй, его можно здесь назвать как «устный счет».
При изучении темы "Расчеты по химическим формулам", мы с ребятами сами выводим формулу, по которой проведен химический тренажер.
Например: им знакомо понятие относительная молекулярная масса, молярная масса. Находим устно молярную массу воды: М(Н2О) = 18 г/моль - это масса одного моля. Провожу устный счет:
- чему равна масса 2; 3; 4; 10; 0,5; 0,1 и т. д. молей?
Ребята отвечают, и в конце тренажера мы выводим формулу нахождения массы вещества: m = ν · М.
Подобные тренинги помогают вывести и остальные формулы, которые мы впоследствии будем использовать на каждом уроке темы "Количественные отношения в химии": N = ν · Nа, V = ν · Vm, ν = 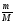 , ν =
, ν = 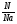 , ν =
, ν = 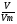 .
.
А чтоб ребята не забывали их, впоследствии на уроках во время химической интеллектуальной разминки можно включать этот устный счет по химическим формулам. Поверьте, это надежный вариант. Возьмем любую науку: химию, математику, физику. Подумаем, в каких вопросах дети находят большее затруднение. Ответ совершенно очевиден - задачи. Логика мышления - она не у всех есть. И надо нам ее постоянно и настойчиво развивать у них. Решение задач как нельзя лучше способствует этому.
После химического тренажера и вывода формулы обращаю внимание ребят на форму записи условия задачи и хода ее решения, а также на формулировку ответа.
В процессе обучения решению задач нового типа необходимо обратить внимание на особенности задачи рассматриваемого вида. Можно сделать это в сравнении с теми задачами, которые они уже научились решать. В процессе объяснения обязательно устанавливаю, какой этап решения вызывает затруднения, и, если это необходимо (а это часто необходимо хотя бы некоторым ребятам), еще раз объясняю и отдельный этап, и в целом ход решения задачи.
Школьники неодинаково свободно решают задачи по разным разделам курса. Задачи с газообразными продуктами, с избытком одного из веществ, нахождение молекулярной формулы соединения вызывают затруднения.
Поэтому необходима постоянная тренировка в их решении. Часы программы, к сожалению, это не предусматривают. Одного тренажа с 5-минутным временем маловато. Ученик должен находить наиболее рациональный путь решения, установив связь между явлениями.
Поэтому во избежание формализма при решении задач я стараюсь приучить их пользоваться различными методами решения, включая алгебраический и графический. Это возможно только во внеурочное время на занятиях элективных курсов и школы олимпийского резерва.
На уроках стараюсь давать задачи систематически: при освоении нового материала, при закреплении и в процессе проверки знаний учебного материала. К примеру, задачи на нахождение молекулярной формулы органического вещества. Выбор рациональных приемов при решении этих расчетных задач способствует активизации познавательной деятельности учащихся. Возможно создание и проблемной ситуации, т.к. в результате соответствующих расчетов необходимо выяснить: состоит ли органическое вещество только из двух химических элементов (углерод и водород) или же в его составе имеется и третий элемент (кислород или азот).
Если ученик научатся хорошо решать задачи, то каждая решенная ими задача станет для ребят маленькой личной победой. Пусть задачи поначалу будут простейшими. Научившись хорошо решать несложные задачи, ребята обязательно захотят покорить следующую высоту - более сложную. Нам важно поддерживать в них это желание, вовремя направить и оказать помощь. В восьмом классе дифференциации при решении задач быть не может - каждый должен научиться решать простейшие задачи. В дальнейшем, конечно, дифференциация возможна даже в условии, формулировке задачи, а не только в выборе задач разной степени сложности. Для слабых ребят - работа с алгоритмом. Пусть используют его, пока не научатся.
Результат не заставит себя ждать: задача станет преодолимым препятствием и не будет уже больше пугать ученика своей неприступностью.
Постарайтесь сделать задачу близкой и понятной для ученика. Решение расчетных задач при желании можно превратить в увлекательное занятие, которое принесет радость как ученикам, так и учителю.
Не только увлекательные опыты, исследование свойств веществ, но и «трудная» решенная задача поможет вызвать интерес учащихся к изучению химии. Задача в химии - это не просто математический расчет, это сложная химическая технология. Если ты умеешь решать задачу, значит, ты знаешь химические теории, законы и факты, т.е. знаешь химию.
Представить, какой труд необходимо вложить учителю при подготовке ребят к олимпиадам, можно, зная, что для решения задач районных и окружных олимпиад необходимо знать учащимся теорию I курса высшей школы. А учитель должен уметь решать все типы задач, самостоятельно изучая необходимую методическую литературу.
Возможно, методика, предложенная в этом пособии, поможет учителям правильно подобрать задачу, выработать систему решения задач, найти более рациональный способ их решения.
Необходимо научить ребят решать 3 типа расчетных задач:
-
Задачи на определение молекулярной формулы вещества.
-
Задачи прямого расчетного действия.
-
Задачи на смеси веществ.
Глава II. Методика решения расчетных задач по химии
§1. Методика решения задач на определение молекулярной формулы вещества
Для решения таких задач целесообразно применение двух общих приемов:
Первый прием заключается в нахождении относительной молекулярной или молярной массы вещества.
Второй прием - нахождение атомных отношений. На первом занятии даю все основные уравнения связи, позволяющие использовать эти приемы:
Уравнения связи:
I Формулы, позволяющие найти молярную массу вещества: СхНуОz
1) М = 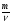 2) М = Дн2 · 2 М= Дв · 29 М = До2 · 32
2) М = Дн2 · 2 М= Дв · 29 М = До2 · 32
(плотность относительно газа - Д).
3) М(СхНуОz) = 12х + у + 16z
(по сумме относительных атомных масс химических элементов).
4) М(СхНуОz) = 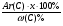
(если известна массовая доля одного из элементов в веществе).
5) М = 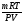
(используя физические данные состояния вещества).
II Нахождение атомных отношений - х : у : z
1 способ: х : у : z = 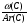 :
: 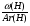 :
: 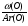 ;
;
2 способ: х : у : z = 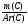 :
: 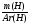 :
: 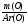 ;
;
3 способ ν (Э) = 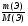 => х : у : z = ν (С) : ν (Н) : ν (О).
=> х : у : z = ν (С) : ν (Н) : ν (О).
3.При изучении органических веществ встречаются задачи, где в условии идет сравнение объемов или масс веществ, участвующих или получившихся в результате химической реакции. Для их решения достаточно знание обычных законов химии:
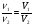
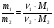
СхНу + (х +  )О2 → хСО2 +
)О2 → хСО2 + 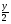 Н2О
Н2О
ν1=1моль ν2=(х+ )моля ν3=х моль ν4=
)моля ν3=х моль ν4=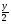 моля
моля
Определив количество веществ, используя пропорцию, мы получаем уравнение реакции с двумя неизвестными "х" и "у", которое решаем методом подбора значений "х".
Сначала решаем задачи, которые требует программа. Условия постепенно усложняем. Предлагаю следующую последовательность задач, позволяющую постепенно шаг за шагом переходить от одного вида задач к другому. (Приложение 1).
Задача 1. Неорганическое вещество состоит из атомов меди, серы и кислорода, массовые доли которых соответственно равны: 40%, 20%, 40%. Определить молекулярную формулу вещества.
Записываем условие задачи:
Дано:
ω% (Cu) = 40%
ω% (S) = 20%
ω% (O) = 40%
Cuх Sу Oz = ?
Решение:
1. Формула вещества состоит из атомов Cu, S, O, число атомов неизвестно: соответственно х, у, z: CuхSуOz
2. Используем второй прием нахождения атомных отношений х : у : z через известные массовые доли их:
х : у : z =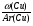 :
: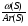 :
: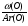 =
=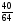 :
: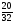 :
: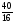 =0,625:0,625:2,5
=0,625:0,625:2,5
3. Наименьшее из чисел принимаем за единицу и находим относительно его остальные числа.
Получилось отношение: х : у : z = 1 : 1 : 4
4. Это означает, что в молекуле на 1 атом серы приходится 1 атом меди и 4 атома кислорода, т.е. формула вещества CuSO4
5. Но из отношения видно, что на 2 атома меди приходится 2 атома серы и 8 атомов кислорода, т.е. Cu2S2O8. Учащиеся такую формулу не знают.
6. Оставляем один ответ: CuSO4 - искомая формула вещества.
Задача 2. Определить формулу хлорида некоторого металла, если известно, что массовая доля хлора в нем 47,65%
Дано:
ω% (Cl) = 47,65%
МClх = ?
Решение:
1. Валентность хлора (I) в хлориде. Валентность металла обозначим за "х".
Формула вещества: МClх
2. Решить эту задачу можно способом определения молярной массы вещества. Зная массовую долю одного из химических элементов, всегда можно определить молярную массу вещества:
М(MeClх) = 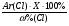 =
= 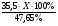 = 74,5 · Х (г/моль)
= 74,5 · Х (г/моль)
3. Применяем метод подбора значений х (от 1 до 3)
Пусть: х = 1 Мr(MeCl) = Ar(Me) + 35,5
Мr(MeCl) = 74,5
4. При равенстве молярных масс вещества мы получаем уравнение:
Ar(Me) + 35,5 = 74,5
Ar(Me) = 39
5. По периодической системе находим одновалентный металл с относительной атомной массой равной 39. Это калий.
6. х = 2 и х = 3 и др. не дают результатов. Решение единственное. Формула хлорида: KCl.
Ответ: формула KCl.
Задача 3. Определить формулу неорганического вещества, если известно, что в 5г его содержится 0,05 молей кальция, а массовая доля кислорода составляет 48%. Третьим элементом является углерод.
Дано:
m (в-ва) = 5г
ν (Са) = 0,05моль
ω%(О) = 48%
СахСуОz = ?
Решение:
1. Анализирую условие, мы видим, что в нем указаны данные об отдельных химических элементах вещества (ν, ω), поэтому выбираем способ нахождения формулу через атомные отношения: х : у : z
Ведущая формула: (I) х : у : z = 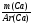 :
: 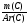 :
: 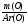 или (II) х : у : z = ν (Са) : ν (С) : ν (О)
или (II) х : у : z = ν (Са) : ν (С) : ν (О)
2. Для расчетов по (I) формуле находим массы каждого элемента в формуле вещества: m(Са) = ν · М(Са) = 0,05моль · 40г/моль = 2г;
m(О) = 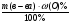 =
= 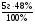 = 2,4г;
= 2,4г;
m(С) = m(в-ва) - m(Са) - m(О) = 5г - 2г - 2,4г = 0,6г.
Мы нашли все компоненты, необходимые для записи атомных отношений элементов:
3. х : у : z = 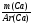 :
: 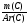 :
: 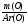 =
= 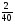 :
: 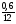 :
: 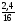 ,
,
находим отношения атомов:
х : у : z = 0,05 : 0,05 : 0,015 = 1 : 1 : 3
искомая формула: СаСО3.
Ответ: формула вещества СаСО3.
Задача 4. Известно, что относительная плотность по водороду одного из газообразных оксидов азота равна 23. Определить формулу оксида азота.
Дано:
Дн2(NxOу) = 23
NxOу = ?
Решение:
Анализируя условие задачи, используем второй прием - находим молярную массу вещества. Напоминаем, что молярную массу необходимо находить двумя способами, чтоб можно было составить уравнение и решить его методом подбора значения "х".
1. Первый способ - по сумме относительных атомных масс элементов:
М(NxOу) = 14х + 16у(г/моль)
2. Второй - через известную относительную плотность вещества по водороду:
М(NxOу) = Дн2 · 2г/моль = 23 · 2г/моль = 46г/моль
3. Составим уравнение и решаем методом "подбора":
14х + 16у = 46
х
у
1
2
2
дробь
(14 · 1 + 16у = 46)
(не подходит).
Целые положительные значения получились при х = 1, у = 2.
Следовательно, формула вещества NO2.
Ответ: формула соединения NO2.
Задача 5. Определить формулу оксида азота, если известно, что 4,4г его при температуре 1 1300С и давлении 200 кПа занимает объем 5,58л.
Дано:
m( NxOу) = 4,4г
t = 1 1300С
р = 200кПа
V( NxOу) = 5,58л
NxOу = ?
Решение:
1. В этой задаче хорошо просматривается связь двух наук - химии и физики. Один из способов нахождений молярной массы через газовые параметры.
М = 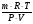 =
= 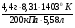 = 46г/моль.
= 46г/моль.
2. Второй способ нахождения молярной массы по сумме относительных атомных масс элементов:
М(NxOу) = 14х + 16у(г/моль)
3. Составляем уравнение, используя равенство молярных масс вещества:
14х + 16у = 46
4. Решаем его, используя метод подбора значений х и у. Пусть:
х
у
1
2
2
дробь
формула NO2
-
Ответ: формула оксида NO2.
Одной из сложнейших задач этого типа задача № 11 (см. приложение 1). В ней неизвестным являются и химические элементы, и их валентность.
Задача 11. Определить формулу вещества "Х", состоящего из элементов А и В, если известно, что массовая доля кислорода в оксиде А равна 47%, а массовая доля водорода в водородном соединении элемента В составляет 5,9%.
Дано:
АуВх
А2Ох ω%(О)=47%
ВНу ω%(Н)=5,9%
АуВх = ?
Решение:
Формула вещества АуВх
1. Определяем элемент А по данным оксида: А2Ох, где х - валентность элемента А
2. Находим молярную массу элемента А по формуле:
М(А) = 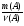 - ведущая формула
- ведущая формула
а) находим количество элемента А через количество атомов кислорода:
ν(А) = 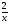 ν(О) =
ν(О) = 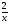 ·
· 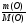 , но так как масса кислорода неизвестна, найдем ее, зная по условию задачи массовую долю кислорода и принимая m(А2Ох) = 100г
, но так как масса кислорода неизвестна, найдем ее, зная по условию задачи массовую долю кислорода и принимая m(А2Ох) = 100г
m(О) = 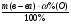 =
= 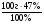 = 47г;
= 47г;
ν(А) = 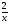 ·
· 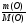 =
= 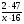 =
= 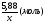 ;
;
б) для нахождения массы элемента А используем тот же прием, как и в случае с кислородом: ω(А)% = 100% - ω%(О) = 100% - 47% = 53%
m(А) = 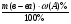 =
= 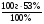 = 53г;
= 53г;
3. Подставляя полученные данные m(А) и ν(А) в ведущую формулу, получаем:
М(А) = 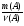 =
= 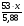 = 9х(г/моль).
= 9х(г/моль).
4. Методом подбора значений "х" - валентности находим Аr(А) и по периодической системе увидим, какой элемент соответствует этому значению валентности и Аr. Пусть:
Х
Аr(А)
1
2
3
9
18
27
- нет одновалентного элемента
- нет
- трехвалентный элемент алюминий Аl - это и есть элемент "А".
5. Элемент "В" определяем по данным водородного соединения: ВНу, где у - валентность элемента В, пользуюсь той же методикой, что и для нахождения элемента А:
а) ведущая формула: М(В) = 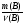 .
.
Пусть масса вещества ВНу = 100г
б) m(Н) = 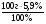 = 5,9г;
= 5,9г;
в) m(В) = 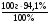 = 94,1г;
= 94,1г;
г) ν(В) = 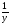 ν(Н) =
ν(Н) = 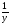 ·
· 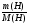 =
= 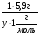 =
= 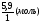 ;
;
д) М(В) = 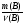 =
= 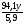 =
= 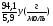 ;
;
е) методом подбора значения "у" - валентности элемента В, находим относительную атомную массу В и сам элемент
Пусть:
у
Аr(В)
1
2
16
32
нет
- элемент сера 
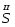 - это элемент В.
- это элемент В.
Ответ: формула 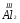
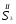 .
.
Вам были предложены задачи по определению формул веществ, не участвующих в химической реакции.
Вторым этапом решения этого типа задач, является определение формул неизвестных веществ, участвующих в химических реакциях.
§2. Определение молекулярной формулы вещества по уравнениям химических реакций
Очень важно уметь определять формулу вещества по известным продуктам сгорания его.
Задача 12. При сгорании 1,7г неизвестного вещества в кислороде выделилось 3,2г оксида серы (IV) и 0,9г воды. Определить молекулярную формулу вещества.
Записываем условие задачи.
Дано:
m(в-ва) = 1,7г
m(SO2) = 3,2г
m(Н2О) = 0,9г
НхSуОz = ?
Решение:
1. Анализируя условие задачи, мы видим, что в результате сгорания вещества образовался оксид - SO2, следовательно, вещество содержит атомы серы, а по выделившейся воде находим в нем атомы водорода. Возможно еще наличие атомов кислорода, но это нам прояснит решение задачи:
вещество + О2 → SO2 + Н2О
НхSуОz + О2 → SO2 + Н2О
Предположили наличие атомов серы, водорода и кислорода
2. По выделившемуся оксиду SO2 мы сможем найти количество серы; по воде - количество водорода:
ν(S) = ν(SO2) =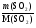 =
= 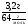 = 0,05моль => m(S) = ν · М(S) = 1,6г;
= 0,05моль => m(S) = ν · М(S) = 1,6г;
ν(Н) = 2ν(Н2О) = 2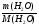 =
= 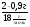 = 0,1моль => m(Н) = ν(Н) · М(Н) = 0,1г.
= 0,1моль => m(Н) = ν(Н) · М(Н) = 0,1г.
3. Содержится ли кислород в веществе, мы узнаем из следующих вычислений:
m(О) = m(в-ва) - m(S) - m(H) = 1,7 - 1,6 - 0,1 = О2 (кислорода нет).
4. Находим формулу вещества НхSу, используя атомные отношения:
х : у = ν(Н) : ν(S) = 0,1 : 0,05 = 2 : 1 => Н2S +
4 : 2 => Н4S2 - не существует
……
Ответ: формула Н2S.
Задача 13. При взаимодействии 6,85г металла с водой выделилось 1,12л водорода (н.у.). Определить этот металл, если он в своих соединениях двухвалентен.
Дано:
m(Ме) = 6,85г
V(Н2) = 1,12л
Ме = ?
Решение:
1. Составим уравнение химической реакции:
Ме + 2Н2О = Ме(ОН)2 + Н2
ν = 1 моль ν (Н2)=1моль
2. Ищем способ ее решения: если в условии задачи известна масса вещества, то найти формулу неизвестного вещества можно, через определение молярной массы его.
М(Ме) = 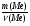 - ведущая формула.
- ведущая формула.
По уравнению реакции видно, что:
ν(Ме) = ν(Н2) = 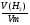 =
= 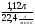 = 0,05моля.
= 0,05моля.
Следовательно: М(Ме) = 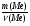 =
= 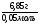 = 137г/моль.
= 137г/моль.
По периодической системе химических элементов находим металл барий (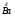 ), его М(Ва) = 137г/моль.
), его М(Ва) = 137г/моль.
Ответ: барий Ва.
Определить неизвестное вещество можно и с помощью ряда последовательно проходящих химических реакций, сравнивая количества веществ участвующих и получающихся в результате реакций.
Задача 15. 1,97г карбоната двухвалентного металла прокалили при 8000С. Полученный белый порошок бурно прореагировал с водой. К образовавшемуся раствору прибавили избыток сульфата калия. Промытый и высушенный осадок весил 2,33г. Определите, какой это металл.
Дано:
m(МеСО3)=1,97г
mос. = 2,33г
Ме = ?
Решение:
1. Записываем уравнения проходящих реакций, нумеруя их.
(1) МеСО3 == МеО + СО2 ↑
ν=1моль ν=1моль
(2) МеО + Н2О == Ме(ОН)2
ν=1моль ν=1моль
(3) Ме(ОН)2 + К2SO4 == 2КОН + МеSO4 ↓
ν=1моль ν=1моль
2. Рассмотрев химические реакции, и, анализируя условия задачи, мы видим, что формулу неизвестного веществаМеСО3 можно найти, вычислив молярную массу карбоната через количество сульфата. Пусть "Х" - относительная атомная масса металла:
а) М(МеСО3) = х + 12 + 48 = х + 60(г/моль);
М(МеSO4) = х + 96(г/моль);
б) М(МеСО3) = 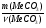 - ведущая формула.
- ведущая формула.
3. Количество вещества МеСО3 находим, используя три параллельные реакции:
ν(МеСО3)1 = ν(МеО)1 = ν(МеОН)2 = ν(МеSO4)3 = 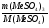 =
= 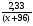 (моль).
(моль).
4. Определяем М(МеСО3) = 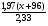 = 0,85(х+96)г/моль.
= 0,85(х+96)г/моль.
5. Составляем уравнение, используя равенство молярных масс карбоната металла, найденных двумя способами: (а) = (б)
Х + 60 = 0,85(х + 96).
Решая его, находим: х = 137. По периодической системе химических элементов находим двухвалентный металл Ва, имеющий Аr = 137.
Ответ: металл - барий.
Необходимо научить учащихся находить неизвестный металл и через изменение массы пластинки, опущенной в раствор соли, используя формулу вычисления количества вещества: ν = 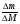 ,
,
где ∆m - изменение массы пластинки.
∆М - разница молярных масс растворяемого металла и металла, образовавшегося во время химической реакции.
Задача 16. (см. приложение 1.).
Решение:
Решим первую часть задачи, определив неизвестный металл.
1. Запишем уравнения всех протекающих в растворе химических реакций:
(1) 2Ме + уCuSO4 = Ме2(SO4)у + уCu;
(2) Ме + уНСl = МеCl + 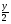 Н2;
Н2;
(3) Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O;
где: у - валентность неизвестного металла
х - относительная атомная масса металла
2. По (3) уравнению определим количество меди, выделившейся из раствора в уравнении (1) и растворенной в азотной кислоте (3).
ν(Cu)Х.Р3 =  ν(NO2) =
ν(NO2) =  ·
· 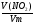 =
=  ·
· 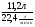 = 0,25моль.
= 0,25моль.
3. Определяем двумя способами: через ν(Cu) и по изменению массы пластинки, количество неизвестного металла, растворившегося в сульфате меди в первой реакции: ν(Ме)Х.Р1 = 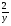 ν(Cu) =
ν(Cu) = 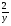 · 0,25 =
· 0,25 = 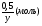 ;
;
ν(Ме)Х.Р1 = 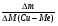 =
= 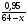 ;
;
4. Получаем уравнение химической реакции и решаем его методом подбора значений у (валентности металла).
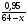 =
= 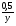
0,95у = (64 - х)0,5
0,95у = 32 - 0,5х
у
х -Ar
I
II
III
62
60
58,5
нет
нет
- химический элемент никель Ni.
По периодической системе находим трехвалентный элемент никель
Ответ: пластинка из металла никеля.
§3. Определение молекулярной формулы неизвестного органического вещества
Методика определения молекулярной формулы органического вещества через атомные отношения элементов и через нахождение молярной массы вещества такая же, как и для неорганических веществ. Однако определенная специфика задач такого рода есть, так как органические вещества - это вещества содержащие атомы углерода и сопутствующие им атомы водорода, кислорода, азота - разнообразие атомов невелико.
Задача18. Для сгорания углеводорода потребовался кислород объемом в 7,5 раз больше объема паров этого углеводорода. Найти формулу органического вещества.
1. Записываем условие задачи и пишем уравнение реакции горения углеводорода, расставляя коэффициенты, которые определят основу решения задачи.
Дано:
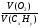 =
= 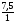
СхНу = ?
Решение:
СхНу + (х +  )О2 → хСО2 +
)О2 → хСО2 + 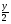 Н2О
Н2О
ν=1моль ν=(х +  )моль
)моль
2. Анализируя условие задачи, вспоминаем одно важное следствие закона Авогадро - объемы газообразных веществ пропорциональны их количеству. Получаем уравнение с двумя неизвестными:
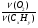 =
= 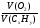 ; ν(СхНу) = 1моль; ν(О2) = (х +
; ν(СхНу) = 1моль; ν(О2) = (х +  )моль;
)моль;
х +  = 7,5
= 7,5
3. Решая полученное уравнение методом подбора значений "х", находим формулу органического вещества:
если х = 1 у = 30 СН30 не может быть
….……...........
х = 5 у = 10 С5Н10 - существует
Ответ: формула С5Н10.
Это же следствие закона Авогадро может определить формулу неизвестного углеводорода, сравнивая объемы любых газообразных веществ в уравнениях реакций (задача 19 в приложении 1).
Для нахождения формул веществ необходимо хорошее знание химических свойств.
Задача 20. Определите молекулярную формулу алкена, если известно, что его образец массой 1,4г может обесцветить 107г 3% раствор бромной воды.
1. Записываем условие задачи и уравнение бромирования алкена:
Дано:
m(СnH2n) = 1,4г
m(Br2)р-р = 107г
ω%(Br2) = 3%
СnH2n = ?
СnH2n + Br2 → СnH2nBr2
ν=1моль ν=1моль
2. Находим молярную массу алкена через алгебраическую сумму относительных масс атомов:
М(СnH2n) = 12n + 2n = 14n(г/моль)
3. Находим молярную массу алкена вторым способом, используя значение массы его, данное в условии задачи:
М(СnH2n) = 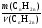 ведущая формула,
ведущая формула,
количество алкена находим, через количество брома, содержащегося в бромной воде.
ν(СnH2n) = ν(Br2) = 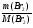 =
= 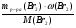 =
= 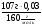 = 0,02моля.
= 0,02моля.
Подставляем найденное значение количества алкена в ведущую формулу молярной массы: М(СnH2n) = 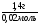 = 70г/моль.
= 70г/моль.
4. Составляем уравнение, используя равенство молярных масс, найденных двумя способами. Находим число "n", формулу углеводорода 14n = 70 n=5.
Формула: С5Н10
Ответ: формула алкена С5Н10.
Подбирая соответствующее условие для задачи, мы можем предложить найти не только формулу молекулярную вещества, но и установить его строение.
Задача 22. При межмолекулярной дегидратации 30г одноатомного спирта выделилось 3,6г воды, причем выход реакции составил 80% от теоретического. Какое строение имеет спирт, если известно, что в его молекуле находятся две метиленовые группы.
Реакция межмолекулярной дегидратации одноатомного спирта протекает по уравнению: 2СхНуОН 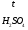 (СхНу)2О + Н2О
(СхНу)2О + Н2О
Дано:
m(СхНуОН)=30г
m(Н2О) = 3,6г
η% = 80%
СхНуОН = ?
1. Находим массу спирта вступившего в химическую реакцию, если ее выход 80%
m(СхНуОН)х.р. = mтеор.· η = 30г · 0,8 = 24г
2. Определяем молярную массу спирта по формуле:
М(СхНуОН) = 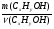
а) Количество спирта находим через количество образовавшейся воды:
ν(СхНуОН) = 2ν(Н2О) = 2·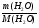 =
= 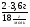 = 0,4моля;
= 0,4моля;
б) Подставляем значение "ν" в ведущую формулу и находим молярную массу спирта:
(1) М(СхНуОН) = 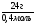 = 60г/моль.
= 60г/моль.
3. Второй способ определения молярной массы - по сумме относительных атомных масс элементов
(2) М(СхНуОН) = 12х + у + 17 (г/моль).
4. Из равенства молярных масс, найденных способами (1) и (2), составляем уравнение и решаем его методом подбора значений "х"
12у + у + 17 = 60
х
у
1
2
3
нет
нет
7
12х + у = 43
Формула С3Н7ОН пропанол
5. Структурная формула содержит две метиленовые группы:
это: СН3 - СН2 - СН2 - ОН пропанол - 1
Ответ: СН3 - СН2 - СН2 - ОН пропанол - 1
Решение задачи № 25 (см. приложение 1) - олимпиадного "шедевра" требует хода мысли и, конечно, знания свойств веществ.
Задача 25.
Решение:
1. Поджигают смесь углеводорода и азота. Вы знаете, что азот в обычных условиях не вступает в реакцию горения. Поэтому химическая реакция одна:
СхНу + (х +  )О2 = хСО2 +
)О2 = хСО2 +  Н2О
Н2О
2. Объем, полеченной при сгорании смеси по условию задачи, 1,4л, а после конденсации воды сократился до 800мл. Следовательно, находим объем паров воды:
V(Н2О)n = 1,4л - 0,8л = 0,6л
3. Новое сокращение объема до 400мл наблюдалось при пропускании газов через раствор КОН. Со щелочами из газовой смеси может вступать в реакцию только СО2. Следовательно, можем найти V(СО2)
V(СО2) = 800мл - 400мл = 400мл. (0,4л).
4. Установим формулу углеводорода, зная объемы выделившейся воды и углекислого газа, пользуюсь атомными отношениями элементов углерода и водорода: х : у = ν(С) : ν(Н)
а) ν(С) = ν(СО2) = 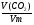 =
= 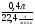 = 0,02моля;
= 0,02моля;
б) ν(Н) = 2ν(Н2О) = 2·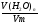 =
= 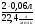 = 0,05моль;
= 0,05моль;
х : у = 0,02 : 0,05 = 2 : 5 простейшая формула С2Н5, но нечетное число атом "Н" не может быть, поэтому удвоим атомные отношения. Получим: х : у = 4 : 10.
Формула углеводорода С4Н10 бутан.
Ответ: С4Н10 бутан.
Итак, при решении всех задач этого типа на определение формулы неизвестного вещества мы пользовались тремя способами: нахождение молярной массы двумя способами; нахождение атомных отношений; соотношение объемов и количества газов.
§4. Методика решения задач прямого расчетного действия
Методика решения задач этого типа предполагает два способа решения: метод пропорций и алгебраический метод. Метод пропорций желательно применять лишь при решении несложных задач программы. Но если мы хотим научить ребят решать задачи любой степени сложности, необходимо применение алгебраического метода, позволяющего использовать известные нам уравнения связи:
m = ν · М
ν = 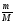
ν = 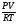
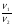 =
= 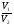
ωр.в =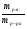
ω(Э) = 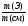
N = ν · Na
ν = 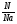
φгаза = 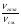
V = ν · Vm
ν = 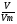
Решать задачи с использованием этих формул с использованием этих формул можно двумя способами: от условия задачи и от вопроса, поставленного в ней. При этом преимущество второго способа бесспорно. Выбрав ведущую формулу (уравнение связи), мы увидим, что необходимо сделать для ее решения.
Задача 1. Определите объем, занимаемый при н. у. углекислым газом, масса которого равна 22г.
Дано:
m(СО2) = 22г
V( СО2) = ?
Решение:
1. Начинаем решать от вопроса, поставленного в задаче - записываем ведущую формулу нахождения объема газа:
V(СО2) = ν(СО2) ·Vm
2. Видим, что количество газа ν(СО2) нам неизвестно. Находим его, используя одно из уравнений связи, подходящее под условие задачи:
ν(СО2) = 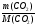 , М(СО2) = 44г/моль;
, М(СО2) = 44г/моль;
ν(СО2) = 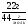 = 0,5моля.
= 0,5моля.
3. Подставляем значение ν(СО2) в (1) уравнение связи и находим объем углекислого газа:
V(СО2) = 0,5моль · 22,4л/моль = 11,2л.
Ответ: V(СО2) = 11,2л.
Затруднения у учащихся вызывают задачи по нахождению массы или объема одной молекулы вещества. Помогут в этом уже известные уравнения связи.
Задача 3. Определить массу одной молекулы школьного мела (СаСО3).
Дано:
N( СаСО3)=1молекула
m(СаСО3) = ?
Решение:
1. Записываем ведущую формулу нахождения массы вещества, т.е. задачу начинаем решать от вопроса, поставленного в ней.
(1) m(СаСО3) = ν(СаСО3) · М(СаСО3)
2. Находим количество, которое составляет 1 молекула карбоната кальция:
ν(СаСО3) = 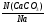 =
= 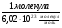 = 0,166 · 10
= 0,166 · 10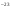 моль.
моль.
3. Определяем массу одной молекулы карбоната кальция по (1) формуле:
М(СаСО3) = 100г/моль;
m(СаСО3) = 0,166 · 10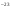 моль · 100г/моль =16,6 · 10
моль · 100г/моль =16,6 · 10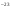 г.
г.
Ответ: m(СаСО3)1 молекулы = 16,6 · 10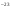 г.
г.
Задача 4. Определить, атомов каких элементов: азота или меди больше и во сколько раз, если известно, что их массовые доли в земной коре почти равны.
Записываем условие задачи.
Дано:
ω(N) ≈ ω(Cu)
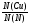 = ?
= ?
1. Эту задачу начинаем решать с вопроса, поставленного в ней. И, если необходимо сравнивать числа, то лучше всего начать с отношения числа атомов:
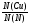 =
= 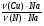
2. Постепенно переходя от одной знакомой формулы: N = ν · Na
к другой ν = 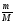 . От нее к формуле нахождения массы элемента по массовой доле его в земной коре: m(Э) = ω(Э) · mземли и сравнивая количества и массы этих двух элементов, подходим к ответу на вопрос, заданный в задаче:
. От нее к формуле нахождения массы элемента по массовой доле его в земной коре: m(Э) = ω(Э) · mземли и сравнивая количества и массы этих двух элементов, подходим к ответу на вопрос, заданный в задаче:
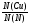 =
= 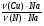 =
= 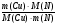 =
= 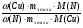 =
= 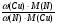
3. По условию задачи массовые доли элементов приблизительно равны, поэтому нам остается сравнить лишь их молярные массы:
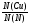 =
= 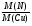 =
= 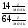
4. Видим, что число атомов азота больше числа атомов меди. Рассчитываем во сколько раз больше. Находим ответ:
N(N) : N(Cu) = 64 : 14 = 4, 57 (раз)
Ответ: число атомов азота в 4,57 раза больше числа атомов меди.
Вот так, используя все известные нам с 8-го класса уравнения связи, решаем задачи прямого расчетного действия с веществами, не вступившими в химическую реакцию.
При решении задач прямого расчетного действия по уравнениям химических реакций мы используем те же формулы. Главенствующей величиной в наших расчетах мы называем количество вещества "ν", называя ее "королевой" задач. Именно она помогает нам быстрее и проще найти правильное решение. То есть в самом начале решения задачи все значения массы и объема мы переводим в количество вещества по формулам:
ν = 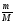
ν = 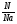
ν = 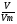
ν = 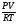
И решаем задачи не методом пропорций, а используя известные нам уравнения связи:
m = ν · М; V = ν · Vm; N = ν · Na.
Задача 1. Окислен аммиак объемом 11,2л. Определить массу выделившейся при этом воды, объем кислорода и число молекул оксида азота (II).
1. Записываем условие задачи и уравнение реакции окисления аммиака:
Дано:
V(NH3) = 11,2л
m(Н2О) = ?
V(O2) = ?
N(NO) = ?
4 NH3 + SO2 = 4 NO ↑ + 6 Н2О
ν=4 моль ν=5 моль ν=4 моль ν=6 моль
Под уравнением реакции записали количество каждого вещества.
2. Находим количество аммиака, участвующее в реакции:
ν(NH3) = 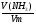 =
= 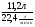 = 0,5моль
= 0,5моль
3. Отвечаем на вопросы в задаче в том порядке, в каком они поставлены. Сначала находим массу воды через ее количество, сравнивая его с количеством аммиака (для этого коэффициент воды делим на коэффициент аммиака):
ν(Н2О) = 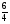 ν(NH3) =
ν(NH3) = 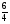 · 0,5 = 0,75(моль);
· 0,5 = 0,75(моль);
m(Н2О) = ν(Н2О) · М(Н2О) = 0,75моль · 18г/моль = 13,5г.
4. Находим объем кислорода через его количество, сравнив с количеством аммиака:
ν(O2) = 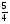 ν(NH3) =
ν(NH3) = 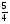 · 0,5 = 0,625(моль);
· 0,5 = 0,625(моль);
V(O2) = ν(O2) · Vm = 0,625моль · 22,4л/моль = 14л.
5. Находим число молекул оксида азота (II) через его количество, сравненное с количеством аммиака:
ν(NO) = 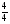 ν(NH3) = 0,5моль;
ν(NH3) = 0,5моль;
N(NO) = ν(NO) · Na = 0,5моль · 6,02 · 10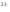 молекул/моль = 3,01 · 10
молекул/моль = 3,01 · 10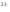 молекул.
молекул.
Ответ: m(Н2О) = 13,5г, V(O2) = 14л, N(NO) = 3,01 · 10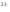 молекул.
молекул.
Так же можно сравнивать количества веществ, участвующих в ряде последовательно идущих реакций, пронумеровав каждую из них.
Например:
(1) N2 + 3H2 = 2NH3
x моль
(2) 4NH3 + SO2 = 4NO + 6H2O
(3) 2NO + O2 = 2NO2
(4) 2NO2 + H2O = HNO3 + HNO2
1 моль
ν(N2)1 =  ν(NH3)1 =
ν(NH3)1 =  ν(NO)2 =
ν(NO)2 =  ν(NO2)3 =
ν(NO2)3 =  ·2ν(HNO3)4,
·2ν(HNO3)4,
т.е. зная ν(HNO3) в (4) реакции, можно, не используя пропорций, благодаря этим переходам, сразу же найти количество азота в (1) реакции:
ν(N2)1 = ν(HNO3)4
ν(N2) = 1 моль, если ν(HNO3) = 1 моль.
Очень хорошо выручает нас значение количества вещества в реакциях, где вещества даны в избытке. Рассмотрим одну из задач этого вида.
Задача 3. Смешали 42г железа с 16г серы и нагрели. После окончания реакции между ними, полученный твердый остаток обработали избытком раствора соляной кислоты. Определить суммарный объем выделившихся при этом газов.
Дано:
m(Fe) = 42г
m(S) = 16г
V(H2S)+V(H2)=?
1. Записываем условие задачи и предполагаемые уравнения химических реакций:
(1) Fe + S = FeS
ν=1моль ν=1моль ν=1моль
(2) FeS + 2HCl = FeCl2 + H2S ↑
ν=1моль ν=1моль
если железо в избытке в (1) реакции то возможна еще и третья реакция:
(3) Fe + 2HCl = FeCl2 + H2 ↑
ν=1моль ν=1моль
2. Возможность протекания (3) реакции мы укажем, рассчитав, какое из веществ: железо или сера в (1) реакции даны в избытке.
Находим избыток веществ. Предварительно массы железа и серы переводя в количество вещества:
ν(Fe) = 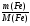 =
= 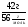 = 0,75моль;
= 0,75моль;
ν(S) = 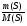 =
= 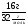 = 0,5моль. ν(Fe)(1) = ν(S)(1) = 0,5моль.
= 0,5моль. ν(Fe)(1) = ν(S)(1) = 0,5моль.
В (1) уравнении количества железа и серы равны, а по условию реакции железа дано больше 0,75моль. Следовательно, сера вся вступила в химическую реакцию, а часть железа осталось и растворилось в соляной кислоте. Следовательно, третья реакция идет.
3. Находим количество железа, участвующего в третьей реакции:
ν(Fe)(3) = ν(Fe)всего - ν(Fe)(1) = 0,75 - 0,5 = 0,25(моль).
4. Находим количество и объем газа водорода, выделившегося при растворении оставшегося железа в соляной кислоте:
ν(Н2)3 = ν(Fe)3 = 0,25моль;
V(H2)3 = ν(Н2)3 · Vm = 0,25моль · 22,4л/моль = 5,6л.
5. Находим количество сульфида железа, полученного в (1) реакции и количество сероводорода, выделившегося во (2) реакции:
ν(FeS)1 = ν(S)1 = 0,5моль;
ν(Н2S)2 = ν(FeS)2 = 0,5моль.
6. Объем сероводорода равен:
V(Н2S)2 = ν(Н2S)2 ·Vm = 0,5моль · 22,4л/моль = 11,2л
7. Суммарный объем газов:
V(Н2)3 + V(Н2S)2 = 5,6л + 11,2л = 16,8л.
Ответ: V(Н2) + V(Н2S) = 16,8л.
Решение задач с участием растворов веществ.
Уравнения связи, которые мы будем использовать при решении этих задач:
mр.в = mр-ра · ωр.в; mр-ра = 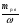 ; ω =
; ω = 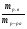 ;
;
mраствора3 = m1 + m2 - mосадка - mгаза;
С = 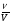 ; ν = C · V, где C - молярная концентрация раствора (моль/л)
; ν = C · V, где C - молярная концентрация раствора (моль/л)
ω - массовая доля растворенного вещества в растворе.
Mр-ра = ρ · Vр-раmр.в - масса растворенного вещества (г)
mр-ра - масса раствора
V - объем раствора (л)
ρ - плотность раствора (г/мл)
Важно научить ребят видеть как из одного раствора образуется другой. Для этого лучше всего прибегнуть к рисунку химического стакана, где будет готовиться раствор: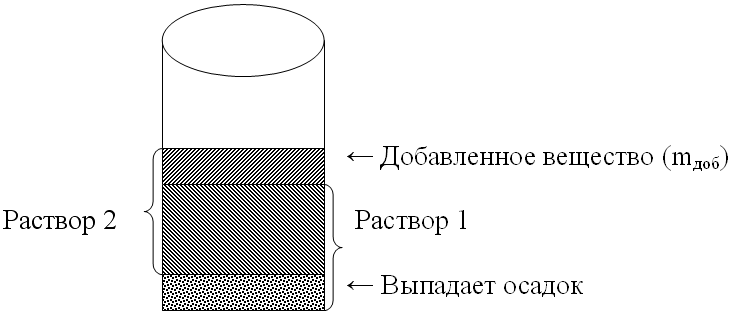
-
mр-р2= mр-р1 + mдоб.
-
Выпадает осадок или выделяется газ - масса раствора уменьшается на массу осадка или газа.
mр-р2 = mр-р1 + mдоб. - mосадка - mгаза.
Вот так, с помощью рисунка, мы учимся находить массы растворов, участвующих в химической реакции и образующихся в результате ее.
Решение задач с участием растворов определенной процентной концентрации учу решать с использованием таблицы, где обозначены три компонента раствора: ωр.в., mр.в. и mр-ра. Если растворов несколько, начинаем с первого.
ω
mр.в
mр-ра
0,1
х г
100 г
В таких задачах должны быть известны все 3 компонента раствора: ω, mр.в. и mр-ра. Если неизвестен один из них, применяем известную нам формулу и находим его:
mр.в. = ω · mр-ра.
Если по условию неизвестное присутствует в двух компонентах, то такие задачи решаем путем составления алгебраического уравнения, используя все те же известные нам формулы.
Например:
Задача 1. Найдите, сколько соли необходимо добавить к 100г воды, чтоб массовая доля растворенного вещества получилась 20%.
1. Записываем условие задачи и составляем таблицу для раствора:
Дано:
m(Н2О) = 100г
ωр.в = 0,2
mр.в = ?
Массу растворенной соли обозначим за х(г).
ω
mр.в
mр-ра
0,2
х
100 + х
mр-ра = m(Н2О) + mр.в
2. Видим, что неизвестное появилось в двух компонентах раствора: mр.в и mр-ра, поэтому составляем алгебраическое уравнение, пользуясь любой формулой, где присутствуют все три составные части раствора и, подставляя их в эту формулу, решаем уравнение и находим неизвестное "х" т.е. массу добавленной соли.
mр.в = ω · mр-ра
х = 0,2(100 + х)
х = 20 + 0,2х
х = 25г
Ответ: mр.в = 25г.
Если по условию задачи мы видим образование еще одного раствора, то сначала находим все неизвестные компоненты первого, а затем и второго, используя каждый раз уже знакомые нам таблицы и каждый раз нумеруя растворы.
Задача 2. Найти массу хлорида натрия, которую необходимо добавить к 200г 5% раствора этой же соли, чтобы ее массовая доля удвоилась.
1. Записываем условие задачи и составляем таблицу для первого раствора.
Дано:
mр-р1 = 200г
ω1 = 0,05
ω2 = 0,1
mдоб(NaCl) = ?
ω1
mр.в1(г)
mр-ра1(г)
0,05
х = 10г
200
(1)
2. Находим массу растворенной соли в первом растворе:
mр.в1 = ω1 · mр-ра1 = 0,05 · 200г = 10г
Подставляем это значение в таблицу: х = 10г.
3. Переходим ко второму раствору. 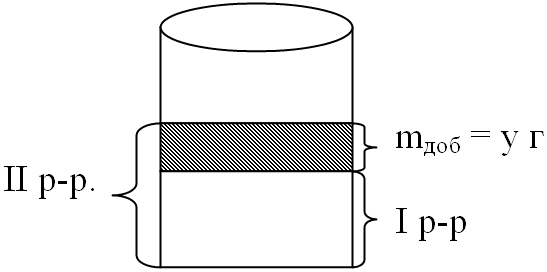
Чтоб легче было представить
его, выполняем рисунок:
массу добавленной соли
обозначим за "у" (г)
4. Получается следующая
таблица:
ω2
mр.в2(г)
mр-ра2(г)
0,1
10 + у
200 + у
(2)
5. Находим массы раствора второго и массу находящегося в нем вещества NaCl:
mр-ра2 = mр-ра1 + mдоб = 200г + у;
mр.в2 = mр.в1 + mдоб = 10 + у.
Данные подставляем в таблицу (2)
6. Неизвестны два компонента раствора: mр.в2 и mр-ра2. Составляем алгебраическое уравнение и решаем его. Находим "у".
mр.в2 = ω2 · mр-ра2;
10 + у = 0,1(200 + у)
у = 11,1г. Т.е. масса добавленной соли равна 11,1г
Ответ: mдоб(NaCl) = 11,1г.
Сложнее всего решение задач с участием кристаллогидратов. В этом случае ребята должны уметь использовать следующие соотношения:
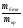 =
= 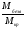 mбезв - масса безводной соли (г)
mбезв - масса безводной соли (г)
mкр - масса кристаллогидрата (г)
М - их молярные массы (г/моль).
Научить необходимо сравнивать и количества веществ безводной соли и образованного ей кристаллогидрата:
CuSO4 · 5H2O
медный купорос
КCr(SO4)2 · 12 H2O
хромо-калиевые квасцы
ν(CuSO4) = ν(CuSO4 · 5H2O)
в купоросе
ν(К2SO4) =  ν(КCr(SO4)2 · 12 H2O)
ν(КCr(SO4)2 · 12 H2O)
в квасцах
Задача 3. Необходимо приготовить 100г 5% раствора сульфата меди (II). Определить массу медного купороса необходимого для этого.
Дано:
mр-ра = 100г
ω(CuSO4) = 0,05
m(CuSO4 · 5H2O) =?
1. Записываем условие задачи. Анализируем его. Видим, что готовят раствор сульфата меди, используя не безводную соль, а кристаллогидрат.
Но таблица, предложенная нами, приемлема лишь для безводных солей. И все три параметра должны касаться только сульфата меди. Поэтому можно воспользоваться формулой соотношения масс CuSO4 и кристаллогидрата и найти массу безводной соли:
Пусть масса CuSO4 · 5H2O равна "х"г
ω
CuSO4
mр.в
CuSO4
mр-р
CuSO4
0,05
0,64х
100
М(CuSO4) = 160г/моль
Мкр = 250г/моль
mб = 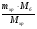 =
= 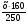 = 0,64х
= 0,64х
2. Составляем алгебраическое уравнение и решаем его:
mр.в(CuSO4) = ω(CuSO4) · mр-ра
0,64х = 0,05 · 100
х = 7,8г CuSO4 · 5H2O.
Ответ: m(CuSO4 · 5H2O) = 7,8г
И только после того, как усвоены решения таких задач ребята могут перейти к решению более сложных - уровня районной или окружной олимпиад.
Рассмотрим одну из них.
Задача 4. Необходимо приготовить 100г 5% раствора CuSO4. Определить массу медного купороса, который необходимо добавить к полученному раствору, чтоб концентрация растворенного вещества в нем удвоилась.
Предыдущие задачи были подготовкой к этой. Первую часть задачи мы уже решили. Для приготовления 100г 5% раствора необходимо взять 7,8г CuSO4 · 5H2O (см. решение задачи 3).
Переходим к решению второй части этой задачи. Мы видим, что при добавлении CuSO4 · 5H2O получается второй раствор.
1. Рассмотрим все 3 компонента раствора №2.
2. Масса добавленного кристаллогидрата "х"г.
ω2
CuSO4
mр.в2
CuSO4
mр-ра2
0,1
5 + 0,64х
100 + х
mр-ра2 = mр-ра1 + mдоб = 100 + х
3. Массу добавленной безводной
соли CuSO4 можно найти по
формуле:
mдоб(CuSO4) = 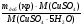 =
= 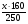 = 0,64х(г).
= 0,64х(г).
4. Находим массу растворенного вещества CuSO4 во втором растворе:
mр.в(CuSO4)2 = mр.в(CuSO4)1 + mдоб(CuSO4) = 10 + 0,64х.
5. Составим алгебраическое уравнение, т.к. неизвестными являются 2 компонента раствора:
mр.в2 = ω2 · mр-ра2
(5 + 0,64х) = 0,1(100 + х). Решая его, получим
х = 1,85г.
Ответ: mдоб.кр = 1,85г.
Для решения этой задачи можно использовать и известный вам прямоугольник Пирсона. Например, из 64% и 5% растворов CuSO4 необходимо приготовить 100г 10% р-ра CuSO4
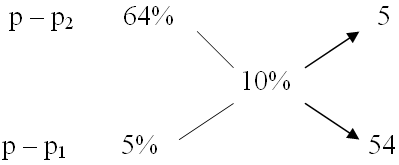
mр-ра2 = 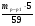 =
= 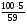 = 8,5г;
= 8,5г;
mр-ра1 = 100г - 8,5 = 91,5г.
Ответ: mдоб(CuSO4 · 5H2O) = 9,26г.
Переходим к решению задач с участием растворов, между которыми возможны химические реакции. Здесь важно хорошо знать теорию химии. Анализируя условия задач, уметь находить избыток вещества и правильно сориентироваться в их решении:
Задача 5. Через 200г 8% раствора NaOH пропустили 5,6л СО2. Определить массовые доли растворенных веществ в полученном растворе.
1. Записываем условие задачи:
Дано:
mр-ра(NaOH) = 200г
ω(NaOH) = 0,08
V(СО2) = 5,6л
ω1( ) = ?
ω2( ) = ?
2. По условию задачи мы не можем определить, какие вещества содержаться в полученном растворе.
3. Предполагаем возможные реакции, нумеруем их.
а) NaOH в избытке:
(1) СО2 + 2NaOH = Na2СО3 + Н2О
б) NaOH в недостатке:
(2) СО2 + NaOH = NaНСО3
(3) NaНСО3 + NaOH = Na2СО3 + Н2О
4. Рассчитав количество каждого из участвующих веществ, находим, какие из трех реакции идут:
ν(NaOH) = 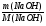 =
= 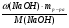 =
= 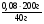 = 0,4моля;
= 0,4моля;
ν(СО2) = 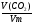 =
= 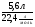 = 0,25моль.
= 0,25моль.
5. Исследуем возможность протекания реакций (1) - (3).
Для первой реакции на 1 моль СО2 требуется 2 моля NaOH. То есть, если ν(СО2)=0,25 моль, то ν(NaOH) должно быть 0,5 молей, а у нас только 0,4 моля, - первая не идет. Если идет только вторая реакция, то ν(NaOH) = ν(СО2) = 0,25молей. Следовательно, идет вторая и третья реакции, щелочи хватает на обе.
(2) СО2 + NaOH = NaНСО3
ν=1моль ν=1моль ν=1моль
(3) NaНСО3 + NaOH = Na2СО3 + Н2О
ν=1моль ν=1моль ν=1моль
6. Одной из солей в полученном растворе является карбонат натрия Na2СО3. Чтоб найти ее количество, необходимо проверить вещества на избыток:
ν(NaOH)х.р2 = ν(СО2)х.р2 = ν(NaНСО3)2 = 0,25моль;
ν(NaOH)ост. = ν(NaOH)всего - ν(NaOH)х.р2 = 0,4 - 0,25 = 0,15моль;
ν(NaНСО3)х.р3 = ν(NaOH)х.р3 = ν(NaOH)ост. = 0,15моль;
ν(Na2СО3)3 = ν(NaOH)3 = 0,15моль;
ν(NaНСО3)ост. = ν(NaНСО3)2 - ν(NaНСО3)х.р3 = 0,25 - 0,15 = 0,1моль,
т.е. в растворе конечном содержится Na2СО3 в количестве 0,15моль и NaНСО3 количеством 0,1моль.
7. Находим массовые доли веществ в полученном растворе:
ω(Na2СО3), ω(NaНСО3)ост.
mр-ра=m(NaOH)р-ра+m(СО2)=m(NaOH)р-р+ν·М(СО2)=200г+0,25моль·44г/моль=211г;
ω(Na2СО3) = 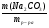 =
= 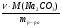 =
= 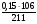 = 0,075 (7,5%);
= 0,075 (7,5%);
ω(NaНСО3)ост. = 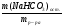 =
= 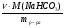 =
= 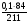 = 0,04 (4%).
= 0,04 (4%).
Ответ: ω%(Na2СО3) = 7,5%, ω(NaНСО3) = 4%.
Необходимо научить учащихся производить расчеты не только процентной, но и молярной концентрации раствора по формулам:
С = 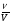 ; ν = С · V.
; ν = С · V.
Предлагаю методику решения задачи, которая поможет понять основные моменты работы с такими растворами.
Задача 21. Определить молярную концентрацию раствора соляной кислоты, пошедшей на нейтрализацию 50г щелочи натрия, если известно, что объем раствора кислоты составил 500мл.
1. Записываем условие задачи и уравнение реакции нейтрализации:
Дано:
m(NaOH) = 50г
Vр-ра(HCl) = 0,5л
С(HCl) = ?
HCl + NaOH = NaCl + Н2О
ν=1моль ν=1моль
2. Записываем ведущую формулу нахождения молярной концентрации вещества:
(2) С(HCl) = 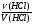 3. Для решения необходимо найти количество соляной кислоты, сравнив его с количеством щелочи, вступившей в химическую реакцию:
3. Для решения необходимо найти количество соляной кислоты, сравнив его с количеством щелочи, вступившей в химическую реакцию:
ν(HCl) = ν(NaOH) = 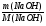 =
= 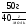 = 1,25моль
= 1,25моль
4. Находим молярную концентрацию кислоты, используя ведущую формулу (2). Не забывайте объем раствора выразить в литрах.
С(HCl) = 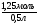 = 2,5моль/л.
= 2,5моль/л.
В 9 классе мы изучаем теорию электролитической диссоциации, поэтому необходимо научить ребят работать и по ионным уравнениям реакций, определять число и массу ионов, участвующих в реакциях, используя все те же уравнения связи, которыми мы пользуемся с 8-го класса.
Задача 23. ( Определить состав и число частиц, содержащихся в 200г 24,5% раствора серной кислоты. Как изменится качественный и количественный состав раствора, если к нему прилить 200г 10% раствора гидроксида натрия.
1. Записываем условие задачи:
Дано:
mр-ра(H2SO4) = 200г
ω(H2SO4) = 0,245
mр-ра(NaOH) = 200г
ω(NaOH) = 0,1
N1(Н+)=?, N1(SO4-2)=?
N2(Н+)=?, N2(SO4-2)=?
2. Решаем первую часть задачи, определяя компоненты раствора кислоты:
H2SO4 → 2 Н+ + SO4-2
ν=1моль ν=2моль ν=1моль
mр.в(H2SO4) = mр-ра · ω(H2SO4) = 200 · 0,245 = 49г;
ν(H2SO4) = 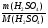 =
= 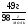 = 0,5моль.
= 0,5моль.
3. Качественный состав раствора серной кислоты видим из уравнения Э.Д.: ионы водорода и сульфат-ионы. Найдем число этих ионов:
Ведущие формулы: N1(Н+) = ν(Н+)1 · Na, N1(SO4-2) = ν(SO4-2)1 · Na
ν(Н+) = 2ν(H2SO4) = 0,5 · 2 = 1моль; ν(SO4-2) = ν(H2SO4) = 0,5моль.
N1(Н+) = 1моль · 6,02 · 1023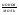 = 6,02 · 1023ионов;
= 6,02 · 1023ионов;
N1(SO4-2) = 0,5моль · 6,02 · 1023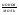 = 3,01 · 1023ионов.
= 3,01 · 1023ионов.
4. Переходим к решению второй части задачи. Качественный и количественный состав раствора меняется, т.к. идет реакция нейтрализации:
(1) H2SO4 + 2NaOH = Na2SO4 + 2Н2О
ν=1моль ν=2моль ν=1моль
(2) H2SO4 + NaOH = NaHSO4 + Н2О.
5. Находим массу и количество гидроксида, нейтрализующего серную кислоту:
mр.в(NaOH) = ω(NaOH) · mр-ра(NaOH) = 0,1 · 200 = 20г;
ν(NaOH) = 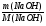 =
= 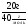 = 0,5моль.
= 0,5моль.
6. ν(NaOH) = ν(H2SO4) = 0,5моль,
следовательно, идет (2) реакция:
(2) H2SO4 + NaOH = NaHSO4 + 2Н2О
ν=1моль ν=1моль
Кислота и щелочь израсходованы полностью. В растворе появилось новое вещество NaHSO4. Пишем уравнение его диссоциации:
NaHSO4 → Na+ + H+ + SO4-2
ν=1моль 1моль 1моль 1моль
7. Находим количество и число образовавшихсяионов:
ν(H+) = ν(NaHSO4)2 = ν(NaOH)2 = 0,5моль;
N(H+) = ν(H+) · Na = 0,5моль · 6,02 · 1023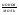 = 3,01 · 1023ионов.
= 3,01 · 1023ионов.
Видим, что число ионов H+ уменьшилось в 2 раза во время реакции.
ν(SO4-2) = ν(NaHSO4)2 = 0,5моль
N(SO4-2) = ν(SO4-2) · Na = 0,5моль · 6,02 · 1023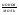 = 3,01 · 1023ионов.
= 3,01 · 1023ионов.
Число ионов SO4-2 не изменилось.
ν(Na+) = ν(NaHSO4)2 = 0,5моль;
N(Na+) = ν(Na+) · Na = 0,5моль · 6,02 · 1023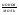 = 3,01 · 1023ионов.
= 3,01 · 1023ионов.
Появились новые ионы Na+ в растворе.
Ответ: N(Na+) = N(H+) = N(SO4-2) = 3,01 · 1023ионов.
Вызывают затруднения у учащихся решение задач на именение массы пластинки (∆m). Научите их пользоваться формулой:
ν = 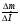 , ∆М - разница молярных масс веществ, у которых идет изменение массы. Предлагаю решение задачи № 26 (см. приложение № 2).
, ∆М - разница молярных масс веществ, у которых идет изменение массы. Предлагаю решение задачи № 26 (см. приложение № 2).
Задача 26. В 200 мл раствора CuSO4 поместили железную пластинку. После обесцвечивания раствора пластинку вынули, высушили и взвесили. Масса ее увеличилась на 2г. Определите молярную концентрацию раствора CuSO4.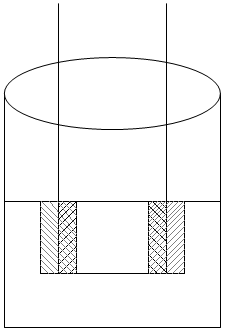
1. Выполним рисунок, показывающий изменение массы пластинки.
Увеличение массы пластинки происходит за счет того,
что Ar(Fe), растворившегося в соли меньше, чем Ar(Cu),
выделившейся на пластинке во время химической реакции. Уменьшение массы пластинки происходит, когда на ней оседает металл более легкий, чем тот, из чего она изготовлена.
2. Запишем уравнение реакции:
CuSO4 + Fe = FeSO4 + Cu
ν=1моль 1моль 1моль 1моль
Дано:
Vр-ра(CuSO4) = 0,2л
∆m = 2г
С(CuSO4) = ?
3. Ведущая формула нахождения молярной концентрации следующая:
С(CuSO4) = 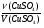
4. Находим количество CuSO4 через количество металла растворившегося и осевшего на пластинке:
ν(CuSO4) = ν(Fe)х.р = ν(Cu)х.р = 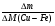 =
= 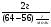 = 0,25моль.
= 0,25моль.
5. Находим молярную концентрацию CuSO4 по ведущей формуле (3)
С(CuSO4) = 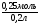 = 1,25моль/л.
= 1,25моль/л.
Ответ: С(CuSO4) = 1,25моль/л.
А сейчас можно приступить и к решению более сложных задач (см. приложение № 2) №№ 23 - 29. И вы смело можете сдавать экзамены в ВУЗ или участвовать на олимпиаде.
Задача 28. (II тур Всероссийской олимпиады 1998г). Продукты полно сгорания 3,36л сероводорода (н.у.) в избытке кислорода поглощены 50,4мл 23% раствора гидроксида калия (ρ = 1,21г/мл). Вычислите массовые доли веществ в полученном растворе и массу осадка, который выделится при обработке этого раствора избытком гидроксида кальция.
1. Записываем условия задачи и все возможные уравнения реакций, происходящих между веществами.
Дано:
V(Н2S) = 3,36л
Vр-ра(КОН) = 50,4мл
ω(КОН) = 0,23
ρ(КОН) = 1,21г/мл.
ω1(КОН) = ?
ω2( ) = ?, mос. = ?
Массовые доли каких веществ будем находить мы сможем узнать, исследовав химическую сторону реакции и произведя простейшие расчеты:
(1) Н2S + 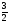 О2 → SO2 + H2O
О2 → SO2 + H2O
ν=1моль ν=1моль
(2) SO2 + КОН = КНSO3 нет
(3) SO2 + 2КОН = К2SO3 + H2O, если КОН в избытке.
(4) КНSO3 + КОН = К2SO3 + H2O, если КОН остался после (2) реакции, нет.
2. Чтоб отбросить реакции, которые не идут, найдем количество веществ, участвующих в них:
ν(Н2S) = 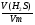 =
= 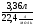 = 0,016 моль;
= 0,016 моль;
ν(КОН) = 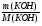 =
= 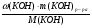 =
= 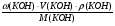 =
= 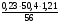 = 0,25 моль.
= 0,25 моль.
3. Находим количество SO2 полученного в (1) реакции:
ν(SO2)1 = ν(Н2S) = 0,016 моль.
4. Видим, что количество КОН равное 0,25 моль достаточно, чтоб полностью нейтрализовать SO2, поэтому идет (3) реакция, а (2) и (4) нет:
(3) SO2 + 2КОН = К2SO3 + Н2О
5. Находим ν(КОН) вступившее в реакцию и оставшееся после ее окончания:
ν(КОН)3 = 2ν(SO2) = 0,016 моль · 2 = 0,032 моль;
ν(КОН)ост. = 0,25 - 0,032 = 0,218 моль.
Найдем массу раствора:
mр-ра = m(SO2) + mр-ра(КОН) = ν · М(SO2) + V · ρ(КОН) = 1,02г + 60,98г = 62г.
6. Еще одна химическая реакция идет при обработке конечного раствора гидроксидом кальция.
(4) К2SO3 + Са(ОН)2 = СаSO3 ↓ + 2КОН
ν=1моль ν=1моль
7. Гидроксид кальция в избытке, поэтому К2SO3 израсходуется весь, а в растворе выпадет осадок СаSO3.
Найдем количество и массу осадка:
ν(СаSO3) = ν(К2SO3) = ν(SO2)3 = 0,016 моль;
m(СаSO3) = ν(СаSO3) · М(СаSO3) = 0,016 моль · 120г/моль = 1,92г.
ω(КОН) = 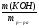 =
= 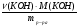 =
= 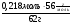 = 0,20 (20%).
= 0,20 (20%).
Больше в растворе нет никаких веществ.
Ответ: ω%(КОН) = 20%, m(СаSO3) = 1,92г.
Итак, мы с вами в определенном порядке прорешали различные виды задач прямого расчетного действия. Это является хорошей подготовкой для решения задач с участием смесей веществ.
§5. Методика решения задач с участием смесей веществ
Уравнения связи, применяемые для решения задач с участием смесей веществ:
-
m(смеси) = m1 + m2 = ν1·М1 + ν2·М2 ;
-
V(смеси) = V1 + V2 = ν1·Vm + ν2·Vm , т.е. ν(смеси) = ν1 + ν2
-
М(смеси) = Дн2(смеси) · 2 , М(см) = Дв(см) · 29
М - молярная масса смеси газов - т.е. масса одного моля смеси.
m = М, если ν(смеси) = 1 моль;
4) Расчет массовой и объемной доли компонентов смеси:
ω(Э) =  , φ(Э) =
, φ(Э) = 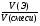 =
= ![]() .
.
Задачи с участием смеси веществ можно разделить на три типа:
-
Истинные смеси
-
Псевдосмеси
-
Задачи, маскирующиеся под смеси.
Задачи первого типа необходимо решать путем введения определенного числа условно известных величин (х, у, z) и составления соответствующего числа уравнений реакций с их участием.
Задачи второго типа можно решать как задачи прямого расчетного действия - путем постепенного нахождения компонентов смеси. Или пользуясь методикой решения задач первого типа.
Задачи третьего типа решают обычным путем - прямыми расчетами.
Рассмотрим методику решения задач первого типа - истинные смеси.
Задача 1. Для полного хлорирования 2,4г смеси железа и меди потребовалось 1,12л хлора. Определить массовые доли металлов в смеси.
Дано:
m(см) = 2,4г
V(Cl2) = 1,12л
ω(Fe) = ? ω(Cu) = ?
Решение:
1. Ведущие формулы нахождения массовой доли металлов в смеси:
ω(Fe) = 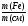 =
= 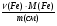 ; ω(Cu) =
; ω(Cu) = 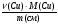 .
.
2. Записываем уравнения химических реакций:
(1) Cu + Cl2CuCl2![]()
ν=1моль ν=1моль
(2) Fe + 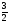 Cl2FeCl3
Cl2FeCl3
ν=1моль ν=1,5моль
3. Вводим неизвестные - столько, сколько веществ в смеси, т.е. два. Мы видим по ведущим формулам, что необходимо найти количества металлов в смеси.
ν(Cu) = х моль, ν(Fe) = у моль.
4. Учитывая, что m = М · ν и, используя уравнение связи, составляем первое уравнение системы:
М(Fe) = 56г/моль, М(Cu) = 64г/моль.
m(смеси) = m(Fe) + m(Cu) = ν(Fe) · М(Fe) + ν(Cu) · М(Cu)
2,4г = 64х + 56у
5. Находим количество вещества хлора, участвующего в реакциях:
ν(Cl2) = 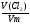 =
= 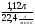 = 0,05 моль;
= 0,05 моль;
ν(Cl2)1 = ν(Сu)1 = х моль - количество хлора, участвующего в первой реакции;
ν(Cl2)2 = 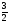 ν(Fe)2 =
ν(Fe)2 = 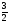 у моль - количество хлора во второй реакции.
у моль - количество хлора во второй реакции.
6. Составляем второе уравнение системы:
ν(Cl2)1,2 = ν(Cl2)1 + ν(Cl2)2
0,05 = х + 1,5у (моль)
7. Составляем систему из двух уравнений с двумя неизвестными:
64х + 56у = 2,4
х + 1,5у = 0,05, решаем ее:
х = 0,02 (моль), у = 0,02 (моль).
8. Рассчитываем массовые доли компонентов смеси:
ω(Cu) = 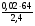 = 0,53 (53%), ω(Fe) = 0,47 (47%).
= 0,53 (53%), ω(Fe) = 0,47 (47%).
Ответ: массовые доли меди и железа соответственно равны 53% и 47%.
При решении задач на трехкомпонентные смеси вводим три неизвестных (х, у, z) и составляем, согласно условиям задачи, три уравнения реакций, включающие неизвестные (х, у, z) и решаем алгебраическим способом систему уравнений.
Приведем пример второго типа задач - с участием псевдосмесей.
Задача 2. Определить количественный состав смеси, состоящей из железа, меди и алюминия, если известно, что при окислении этой смеси избытком кислорода при нагревании в реакцию вступает 5,32л кислорода, а при взаимодействии такой же навески смеси с соляной кислотой потребовалось 99,55мл ее раствора с массовой долей 20% (ρ = 1,1г/мл.). При действии на такую же навеску раствора гидроксида натрия выделилось 1,12л водорода (н.у.).
Дано:
V(О2) = 5,32л
V(НCl) = 99,55мл
ω%(HCl) = 20%
ρ(HCl) = 1,1г/мл
V(H2) = 1,12л
ω(Fe) = ?
ω(Cu) = ?
ω(Аl) = ?
1. Запишем уравнения химических реакций и пронумеруем их:
(1) 2Cu + O2 = 2CuO
(2) 2Fe + 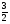 O2 = Fe2O3
O2 = Fe2O3
(3) 2Al + 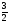 O2 = Al2O3
O2 = Al2O3
(4) Fe + 2HCl = FeCl2 + H2
(5) Al + 3HCl = AlCl3 + 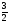 H2
H2
(6) Al + 3NaOH + 3H2O = 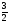 H2 + Na3[Al(OH)6]
H2 + Na3[Al(OH)6]
Эта задача с трехкомпонентной смесью. Но решать ее надо прямым математическим расчетом. Анализируя условие задачи, видим, что по (6) уравнению можно найти массу алюминия в смеси, зная объем выделившегося водорода.
По (5) уравнению находим массу кислоты, вступившей в реакцию с алюминием и оставшейся для реакции с железом.
По (4) уравнению находим массу железа, прореагировавшего с кислотой. И массу меди находим по (1) уравнению, рассчитав предварительно объем кислорода, прореагировавшего с железом и алюминием и оставшегося для окисления меди.
Все эти расчеты могут быть выполнены благодаря обычным решениям пропорций по уравнению реакции.
Третий тип задач, маскирующихся под смеси, включает дополнительные условия, позволяющие решить задачу, не используя систему уравнений с неизвестными.
Задача 3. Газы, полученные при разложении 27,3г смеси нитрата натрия и нитрата меди (II) были пропущены через 115,2мл. воды. При этом 1,12л газа осталось не поглощенной. Определить масса нитратов в исходной смеси.
Дано:
m(см) = 27,3г
V(H2О) = 115,2л
V(газа)ост = 1,12л
m(NaNO3) = ?
m(Cu(NO3)2) = ?
Решение:
1. Запишем уравнения химических реакций, пронумеровав их:
(1) 2NaNO3 = 2NaNO2 + О2
(2) 2Cu(NO3)2 = 2CuO + 4NO2 + О2
(3) 4NO2 + 2Н2О + О2 = 4НNО3
2. Вводим неизвестные: ν(NaNO3) = х моль
ν(Cu(NO3)2) = у моль
3. Используя уравнение связи, составляем уравнение:
m(смеси) = m(NaNO3) + m(Cu(NO3)2) = ν · М(NaNO3) + ν · М(Cu(NO3)2)
(4) 27,3(г) = 85х + 188у
4. Находим количество воды:
ν(Н2О) = 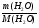 =
= 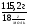 = 6,4 моль
= 6,4 моль
Воды много, поэтому весь оксид азота (IV) поглотился.
5. Находим количество оставшегося газа - кислорода:
ν(О2)ост = 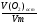 =
= 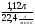 = 0,05 моль;
= 0,05 моль;
ν(О2)ост = ν(О2)1 + ν(О2)2 - ν(О2)3;
ν(О2)1 = 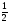 ν(NaNO3) = 0,5х;
ν(NaNO3) = 0,5х;
ν(О2)2 =  ν(Cu(NO3)2) = 0,5у;
ν(Cu(NO3)2) = 0,5у;
ν(О2)3 = 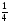 ν(NO2)3 =
ν(NO2)3 = 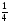 ν(NO2)2 =
ν(NO2)2 = 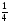 2у = 0,5у;
2у = 0,5у;
ν(О2)ост = 0,5х + 0,5у - 0,5у = 0,05
0,5х = 0,05
х = 0,1 моль - это количество NaNO3
у = 0,1 моль - количество Cu(NO3)2 из (4) уравнения нашли.
6. Находим массы нитратов в смеси:
m(NaNO3) = ν · М(NaNO3) = 0,1 моль · 85г/моль = 8,5г;
m(Cu(NO3)2) = ν · М(Cu(NO3)2) = 0,1 моль · 188г/моль = 18,8г.
Ответ: m(NaNO3) = 8,5г; m(Cu(NO3)2) = 18,8г.
Методика решения задач с участием смесей газообразных веществ имеет некоторые особенности. Если в условии задачи известна относительная плотность газовой смеси, то объемные доли газов в смеси легко вычислить, используя все те же уравнения связи, что и при решении задач на обычные смеси: m(см) = m1 + m2 + m3 … ν(см) = ν1 + ν2 + ν3 …
Логическая схема решения задач
1. Сначала по плотности находим молярную массу смеси:
М(см) = Дн2 · 2г/моль; М(см) = До2 · 32г/моль; М(см) = Дне · 4г/моль.
Молярная масса смеси - это масса 1 моля ее, т.е. если количество смеси 1 моль, то m(см) = М(см).
2. Количество одного из компонентов принимаем за х молей, тогда количество другого (1 - х) молей. Подставляем все эти значения массы, количества и молярной массы в уравнение: m(см) = m1 + m2 = ν1М1 + ν2М2, решая его находим количество каждого компонента.
3. Объемные доли газов можно найти по формуле:
φ1 = 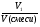 =
= 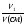 , где φ1 - объемная доля одного из компонентов смеси.
, где φ1 - объемная доля одного из компонентов смеси.
Начинать обучение учащихся этому виду задач необходимо с самой легкой, где в условии задачи предложена лишь относительная плотность газовой смеси.
Задача 8. Относительная плотность по водороду смеси оксидов азота (II) и (IV) равна 16,25. Определить объемные доли газов в смеси.
Дано:
Дн2(см NO,NO2)=16,25
φ(NO) = ? φ(NO2) = ?
Решение:
Ведущие формулы нахождения объемных долей:
φ(NO) = 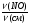 , φ(NO2) =
, φ(NO2) = 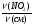 .
.
Т.е. если мы найдем количество каждого оксида в смеси, то объемные доли легко вычислим.
1. Зная относительную плотность смеси, находим ее молярную массу:
М(см) = Дн2(см) · 2 = 16,25 · 2 = 32,5(г/моль).
2. Молярная масса смеси - это масса одного моля ее, т.е. если ν(см) = 1 моль, то m(см) = 32,5г, если ν(NO) = х (моль), ν(NO2) = (1 - х) моль
3. Массу смеси находят по уравнению:
m(см) = m(NO) + m(NO2) = ν(NO) · М(NO) + ν(NO2) · М(NO2)
подставляем в это уравнение связи все известные компоненты m, ν и М газов:
4. Решаем его и находим значение х - количество NO
32,5 = 30х + (1 - х)46
32,5 = 30х + 46 - 46х
16х = 13,5
х = 0,84 моля - ν(NO)
ν(NO2) = 1 - х = 1 - 0,84 = 0,16 (моль).
5. Находим объемные доли газов по ведущим формулам:
φ(NO) = 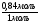 = 0,84 (84%);
= 0,84 (84%);
φ(NO2) = 0,16 (16%).
Ответ: φ%(NO) = 84%, φ(NO2) = 16%.
Усложняем условие задачи. Пусть газы, находящиеся в смеси вступят в химическую реакцию. Чаще всего в реакцию газы вступают неполностью, поэтому изменяется их плотность и можно определить выход реакции по формуле: η = 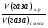 .
.
νх.р - количество газа вступившего в реакцию
νв смеси - количество газа в смеси
η - выход реакции
Для решения таких задач необходимо знать не только их объемные доли, но и настоящие объемы или массы этих веществ.
Задача 9. Относительная плотность по водороду смеси оксида углерода (II) и кислорода равна 15. Определить как измениться ее значение после протекания реакции окисления оксида углерода (II).
Дано:
Дн2(см1) = 15
Дн2(см2) = ?
Решение:
1. Находим молярную массу смеси СО и О2
М(см1) = Дн2(см1) · 2 = 15 · 2 = 30г/моль.
Т.е. если ν(см1) = 1 моль, то m(см1) = 30г.
Пусть ν(СО) = х моль, тогда ν(О2) = 1 - х моль.
2. Пользуясь уравнением связи массы смеси и масс компонентов смеси, находим количество СО и О2 в расчете на 1 моль смеси:
m(см) = m(СО) + m(О2) = ν(СО) · М(СО) + ν(О2) · М(О2)
30 = 28х + (1 - х)32
х = 0,5 моль - ν(СО)
ν(О2) = 0,5 моль
3. Искомое количество смеси СО и О2 не 1 моль а "у" молей, поэтому:
ν(СО) = 0,5у (моль) и ν(О2) = 0,5у (моль).
4. Как изменится состав смеси после протекания реакции, узнаем, записав уравнение ее реакции:
2СО + О2 = 2СО2
ν=2моля 1моль 2моля
Состав конечной газовой смеси: СО2, О2 оставшийся.
5. Найдем сколько в смеси каждого компонента:
ν(СО)х.р = 0,5у (моль)
ν(О2)х.р =  ν(СО)х.р = 0,25у (моль)
ν(СО)х.р = 0,25у (моль)
ν(СО1) = ν(СО) = 0,5у (моль)
Находим количество оставшегося после реакции О2:
ν(О2)ост = ν(О2)всего - ν(О2)х.р = 0,5у - 0,25у = 0,25у (моль)
6. Относительную плотность смеси мы можем найти, рассчитав молярную массу смеси: М(см2) = 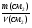
m(см2) = m(О2)ост + m(СО2) = ν(О2)ост · М(О2) + ν(СО2) · М(СО2) =
= 0,25у · 32 + 0,5у · 44 = 30у (г);
ν(см2) = ν(О2)ост + ν(СО2) = 0,25у + 0,5у = 0,75у (моль);
М(см2) = 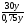 = 40 (г/моль);
= 40 (г/моль);
Д(см2) = 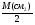 =
= 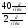 = 20.
= 20.
Ответ: Дн2(см2) = 20.
На состояние газовых смесей влияют давление и температура, поэтому часто при решении задач пользуемся формулой вычислений количества вещества, используя эти значения:
ν = 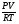
Олимпиадные задачи часто строятся с учетом этих условий протекания реакции.
Рассмотрим методику решения одной из задач, предлагаемых на олимпиадах.
Задача. (районная олимпиада 2000г). Представьте, что Вы - инженер-технолог и решаете одну из сложнейших задач - проблему химического связывания азота. Для подготовки к великому действу попробуем осилить задачу следующего содержания.
Смесь азота и водорода с плотностью по водороду 3,6 массой 72кг при температуре 450 0С и давлением 30КПа пропустили под катализатором (смесь Fe с оксидом калия и алюминия). Определить массовую долю выхода реакции, если известно, что объем полученной газовой смеси при тех же условиях был равен 1 723л.
Дано:
Дн2(см1) = 3,6
m(см1) = 72кг
t = 4500С
Р = 30КПа
V(см2) = 1 723л
η = ?
Решение:
1. Запишем уравнение реакции: N2 + 3Н2 → 2NН3
Плотность по водороду у первоначальной смеси дает нам ее процентный состав:
М(см1) = Дн2(см1) · 2 = 3,6 · 2 = 7,2г/моль
если ν(см1) = 1 моль, то m(см1) = 7,2г
m(см2) = m(О2)ост + m(СО2) = 0,25у · 32 + 0,5у · 44
m(см1) = m(N2) + m(Н2)
если ν(N2) = х моль, то ν(Н2) = (1 - х) моль
7,2 = 28х + 2(1 - х) = 7,2
х = 0,2
ν(N2) = 0,2 моля, ν(Н2) = 0,8 молей, т.е. в смеси 20% N2 и 80% Н2
2. Если количество смеси было z молей, а ее масса 72кг, то уравнение следующее получаем:
72 000 = 0,2z · 28 + 0,8z · 2
z = 10 000 моль
Азота в смеси 2 000 моль
Водорода в смеси 8 000 моль
3. Находим количество смеси после реакции:
ν(см2) = 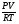 =
= 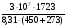 = 8 600 (моль). (ν(NH3), ν(Н2)ост., ν(N2)ост.).
= 8 600 (моль). (ν(NH3), ν(Н2)ост., ν(N2)ост.).
4. Пусть прореагировало "у" молей азота, тогда:
ν(Н2)х.р. = 3ν(N2) = 3у (моль);
ν(NН3) = 2ν(N2) = 2у (моль);
ν(остН2) = 2 000 - 2у (моль);
ν(остN2) = 8 000 - у (моль).
5. Составляем уравнение и решаем его:
ν(см2) = ν(NН3) + ν(Н2)ост + ν(N2)ост
8 600 = 2у + (2 000 - 3у) + (8 000 - у)
у = 700 моль.
6. Азота прореагировало 700 молей, а было в первоначальной смеси 2 000 молей. Находим выход реакции:
η = 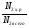 =
= 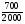 = 0,35 (35%)
= 0,35 (35%)
Ответ: выход реакции 35%.
Как видите, предлагаемая методика решения задач всех трех типов, предполагает работу по химическим уравнениям связи. Отступая от привычных пропорций. Она позволяет понять значимость химических величин, особенно, одной из самых важных - количество взятого для реакции вещества ν. Решение химических задач требует большого внимания, логического мышления, творчества и, что очень важно, трудолюбия.
Познакомившись с одним типом задач, необходимо прорешать как можно больше подобных с изменением тех или иных значений в их условии. Еще лучше попытаться самим составить условия задачи. Подойти к этому творчески и, поверьте, появится желание решать их снова и снова.
Научившись решать все три типа задач. Можно быть уверенным, что задачи, предлагаемые в блоке "C" единого экзамена не покажутся Вам слишком сложными.
§6. Задачи, предлагаемые на ЕГЭ по химии в блоке "C"
Задания блока "С" с развернутым ответом по своему содержанию соответствуют достаточно сложным заданиям, которые предлагают на вступительных экзаменах в вузах. При решении задач учащиеся должны уметь производить расчеты по определению молекулярной формулы вещества, объемных отношений газов при химических реакциях. Необходимо уметь решать задачи прямого расчетного действия и с участием смесей веществ.
Рассмотрим некоторые из них.
Задача 1. (ЕГЭ 2004). При взаимодействии первичного одноатомного спирта, содержащего 60% углерода и 13,3% водорода, с органической кислотой образовалось вещество, плотность паров которого по водороду равна 58. Определите формулу каждого из веществ, участвующих в реакции, и дайте им названия.
Дано:
ω%(С) = 60%
ω%(Н) =13,3%
Дн2 = 58
СхНуОz = ?
Решение:
1. Используя значения массовых долей элементов, найдем соотношения атомов в молекуле спирта:
Формула спирта - СхНуОz
х : у : z =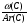 :
: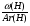 :
: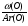 =
=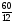 :
: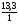 :
: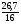 =3 : 8 : 1
=3 : 8 : 1
Формула спирта С3Н7ОН пропанол - 1.
2. Находим молярную массу эфира:
М(эф.) = Дн2 · 2 = 58 · 2 = 116г/моль.
3. Формулу кислоты сможем найти через расчеты молярной массы радикала эфира R - СООС3Н7
М(R) = 116 - 12 - 32 - 43 = 29г/моль;
М(СnH2n+1) = 14n + 1
14n + 1 = 29, n = 2 R - С2Н5, что соответствует пропановой кислоте: С2Н5СООН.
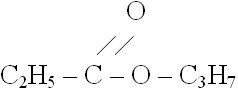
Следовательно, формула эфира:
Это пропиловый эфир пропановой кислоты.
На установление формулы органического вещества в блоке "C" есть и задачи другого вида:
Задача 2. (ЕГЭ, 2004). Установите формулу алкена и продукта взаимодействия его с 1 моль бромоводорода, если это монобромпроизводное имеет Дв = 4,24. Укажите название изомера исходного алкена.
Дано:
Дн2(СnН2n+1B2)=4,24
ν(НВ2) = 1 моль
СnН2n = ?
СnН2n+1B2 = ?
Изомер СnН2n = ?
Решение:
1. По известной плотности определим молярную массу монобромпроизводного СnН2n+1Br двумя способами:
а) М = Дн2 · 29 = 123г/моль.
б) М(СnН2n+1B2) = 12n + 2n + 1 + 80 = 14n + 81.
2. Установим формулу бромалкана, учитывая равенство молярных масс:
14n + 81 = 123, n = 3. Формула: С3Н7В2 бромпропан.
3. Определена формула исходного алкена: С3Н6 пропен.
4. Изомер его - циклопропан 
Используются и объемные отношения газов в задачах такого типа.
Задача 3. Для полного сгорания углеводорода потребуется объем кислорода в 6,5 раз больший, чем объем паров углеводорода в тех же условиях. Напишите возможные структурные формулы и названия, соответствующие этому углеводороду.
Дано:
V(О2) : О(СхНу) = 6,4 : 1
СхНу = ?
1. Запишем уравнения реакции горения углеводорода:
СхНу + (х +  )О2 → хСО2 +
)О2 → хСО2 + 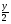 Н2О
Н2О
ν=1моль (х+ )моль
)моль
2. Согласно следствию из закона Авогадро : 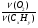 =
= 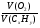
Получаем уравнение с двумя неизвестными:
х +  = 6,5
= 6,5
3. Решаем его методом подбора значений х (1,2,3,4,5,6)
При х = 4 находим целое положительное значение у = 10.
Формула углеводорода С4Н10
4. Структурные формулы: СН3 - СН2 - СН2 - СН3 Н - бутан
2-метилпропан
Рассмотрим решение нескольких задач прямого расчетного действия с участием растворов веществ.
Задача 4. (ЕГЭ, 2004). В 200г 16% раствора сульфата меди поместили железную пластинку массой 50г. Через некоторое время пластинку осторожно вынули, высушили и взвесили. Ее масса оказалась равной 51г. Определить массовые доли соединений в образовавшемся растворе.
Дано:
mр-ра(СuSO4) = 200г
ω(СuSO4) = 0,16
∆m = 1г
ω(FeSO4) = ?
ω(СuSO4)ост = ?
Реакция протекает по уравнению:
СuSO4 + Fe = FeSO4 + Cu.
1. Запишем формулу определения массой доли сульфатов в растворе:
(1) ω(FeSO4) = 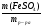 =
= 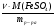 ;
;
(2) ω(СuSO4)ост = 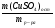 =
= 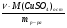 .
.
2. Для решения этой задачи необходимо найти количества участвующих и образовавшихся веществ и массу раствора, которая уменьшилась на 1г.
mр-ра = 200г - 1г = 199г.
ν(FeSO4) = ν(СuSO4)х.р = ν(Fe)х.р = ν(Cu)х.р = 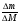 =
= 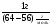 = 0,125 моль.
= 0,125 моль.
3. Находим массовые доли солей в растворе, пользуясь ведущими формулами (1) и (2): ω(FeSO4) = 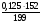 = 0,095 (9,5%);
= 0,095 (9,5%);
Масса СuSO4 - m(СuSO4) = 200 · 0,16 = 32(г);
Масса СuSO4, вступившего в реакцию m(СuSO4)х.р = ν · М = 0,125 · 160 = 20(г);
Масса СuSO4 оставшейся m(СuSO4)ост = 32 - 20 = 12(г);
ω(СuSO4) = 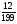 = 0,06 (6%).
= 0,06 (6%).
Ответ: ω%(FeSO4) = 9,5%, ω%(СuSO4) = 6%.
Задача 5. (ЕГЭ, 2002). Какой объем 54%-ного раствора гидроксида калия с плотностью 1,59г/мл потребуется для растворения алюминия, если в результате выделился 1м3 газа (н.у) и образовался тетрагидроксоалюминат калия?
Дано:
ω(КОН) = 0,54
ρ(КОН) = 1,59г/мл
V(газ) = 1м3
Vр-ра(КОН) = ?
1. Запишем уравнение реакции:
КОН + Al + 3Н2О → К[Al(OH)н] + 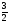 Н2
Н2
ν=1моль ν=1,5моль
2. Ведущая формула определения объема раствора КОН:
(2) Vр-ра = 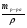 =
= 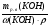 =
= 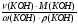 .
.
2. Из него мы видим, что для решения задачи необходимо найти количество гидроксида калия
ν(КОН) = 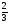 ν(Н2) =
ν(Н2) = 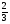 ·
· 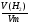 =
= 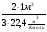 = 0,03 Кмоль.
= 0,03 Кмоль.
3. Масса КОН m(КОН) = ν · М(КОН) = 0,03Кмоль · 56кг/Кмоль = 1,68 кг (1 680г)
4. Находим объем раствора щелочи. Работаем с ведущей формулой (2)
Vр-ра = 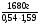 = 1 956,7 мл (≈2л).
= 1 956,7 мл (≈2л).
Ответ: Vр-ра(КОН) = 2л.
Задача 6. (ЕГЭ, 2004). Гидрид кальция внесли в избыток раствора соляной кислоты (масса раствора кислоты 150г, массовая доля НCl 20%). При этом выделилось 6,72л (н.у.) водорода. Рассчитайте массовую долю хлорида кальция в полученном растворе.
Дано:
mр-ра(HCl) = 150г
ω(НCl) = 0,2
V(Н2) = 6,72л
ω(CaCl2) = ?
Решение:
1. Составляем уравнение химической реакции:
CaH2 + 2HCl = CaCl2 + H2 ↑
ν=1моль 2моль ν=1моль
2. Ведущая формула расчета массовой доли соли:
ω(CaCl2) = 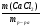 =
= 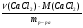 .
.
3. Находим количество хлорида кальция:
ν(CaCl2) = 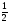 ν(Н2) =
ν(Н2) =  ·
· 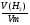 =
= 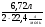 = 0,15 моль.
= 0,15 моль.
4. Находим массу гидрида кальция и массу водорода:
ν(CaH2) =  ν(Н2) = 0,15 моль;
ν(Н2) = 0,15 моль;
m(CaH2) = ν · М(CaH2) = 0,15моль · 42г/моль = 6,3 г;
m(Н2) = ν(Н2) · М(Н2) = 0,3моль · 2г/моль = 0,6 г.
5. Масса раствора:
mр-ра = m(CaH2) + mр-ра(НCl) - m(H2) = 6,3 + 150 - 0,6 = 155,7 (г).
6. Массовую долю хлорида кальция найдем по ведущей формуле (2)
ω(CaCl2) = 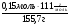 = 0,107 (10,7%).
= 0,107 (10,7%).
Ответ: ω%(CaCl2) = 10,7%.
Как видите, задачи блока "C" единого экзамена можно решать, воспользовавшись методикой, предложенной в работе. Знание теоретического материала, законов химии очень важно для успешного решения задач, поэтому необходимо помимо задач уделять внимание и вопросам теории, выходящей за рамки школьной программы.
Заключение
Изучив методику решения задач прямого расчетного действия, на определение формулы вещества и с участием смесей, можно в заключении сказать, что решение химической задачи любого типа состоит из многих операций, которые должны определенным образом соединяться между собой и применяться в установленной последовательности в соответствии со складывающейся логикой решения. Именно эта последовательность и должна привести к положительному результату. Поэтому очень важно сформировать определенный алгоритм действий при решении задачи. Понять ее суть. Выполнить ее химическую часть, исследовать вероятность всех возможных уравнений реакции, используя математические расчеты. Определив ее тип, решить, подобрав наиболее рациональный способ решения.
Чем тщательнее будет сделан анализ хода решения задачи, тем эффективнее окажется процесс овладения данной методикой. Шаг за шагом, усложняя условие задач, мы должны обращаться к ее алгоритму, чтоб каждая новая задача не показалась учащимся совершенно незнакомой. И, конечно, обязательных условий - прорешивание большого количества задач самими ребятами без нашей помощи.
Из-за ограниченности времени, определенного программой на решение задач, на уроках при изучении каких-либо химических веществ можно включать 1-3 минутные интеллектуальные тренинги (см. приложение), чтоб ребята не забывали основные уравнения связи.
В рамках урока научить учащихся в совершенстве решению всех трех типов задач невозможно. Для тех, кто выбирает своим профилем естественные науки, на занятиях профильных групп обязательно нужно включать методику решения основных типов задач, скорректировав программу. Это также поможет ученикам сдавать выпускные и вступительные экзамены и выступать достойно на химических олимпиадах.
В приложении к работе я предлагаю программу элективного курса для учащихся 9, 10 классов "Секреты химических формул", где в определенной последовательности дана система решения основных типов задач, основанная на программном и выходящем за рамки школьной программы теоретическом материале.
В сценарии учебных занятий курса предусмотрены мини-олимпиады и практические занятия по составлению условия задач силами учащихся для лучшего осмысления их сути.
Вся методика, предложенная в этой работе, включая ее приложение, направлена на то, чтоб "трудная" задача для ребенка стала увлекательной, а не была бы тяжелым камнем, лежащим на его пути.
Знание методики решения задачи и соблюдение определенной последовательности действий в процессе ее решения приведут к получению правильного осмысленного результата. Это поможет ребенку поверить в свои силы, самореализоваться как личности, что и требует современная педагогика. Именно она предлагает нам чаще обращаться к ребенку как субъекту учебной деятельности, как к личности, стремящейся к самоопределению и самоутверждению.
Литература
1. Н.Е. Кузьменко, В.В. Еремин, С.С. Чураков
Сборник конкурсных задач по химии. М.: Экзамен, Оникс 21 век, 2006
2. Г.П. Хомченко, И.Г. Хомченко
Сборник задач по химии для поступающих в вузы. М.: Новая Волна. Оникс, 2013
3. Е.А. Шишкин
Пути решения расчетной задачи / журнал "Химия в школе", № 4, 2005
4. Министерство образования Российской Федерации.
Единый Государственный Экзамен "Интеллект-центр", 2004.
5. Н.Е. Кузьменко, В.В. Еремин
2400 задач по химии. М.: Дрофа, 2006
Методика решения расчетных задач по химии
§1. Методический подход к решению химических задач
Решение расчетных задач - важная сторона обучения химии. Обучение решению таких задач способствует связи обучения с жизнью, помогает профессиональной ориентации. Оно играет важную роль в воспитании трудолюбия, целеустремленности, формирования мировоззрения и реализации межпредметных связей. Велика развивающая функция задач по химии, т.к. в процессе их решения формируются рациональные приемы мышления, происходит обобщение знаний, устраняется формализм в знаниях, развивается самостоятельность и навыки самоконтроля.
Образовательная функция задач выражается в том, что в процессе их решения закрепляются и совершенствуются химические понятия о веществах и процессах.
Особенность любой химической задачи в том, что она всегда конкретна и всегда может быть решена на основе имеющихся знаний законов, теорий и фактов химии.
Процесс решения задачи - путь от абстрактного к конкретному. Однако всегда должны помнить, что задача - это не самоцель, а средство, способствующее прочному усвоению знаний, а значит к формированию интереса учащихся к изучению химии.
Для того чтобы обучить учеников способам решения расчетных задач, учителю самому необходимо в совершенстве овладеть химической задачей, способами ее решения, методикой ее использования. Умение решать расчетные задачи и обучать этому учеников - важная составляющая часть педагогического мастерства учителя химии.
В решении задач должен соблюдаться единый методический подход. Одна сторона этого подхода - обучение учащихся решению задач. Другая сторона - самостоятельное решение задач школьниками. И высшая степень проверки умения осмысленного решения задач - это составление условия задачи самими учащимися.
Выбирая задачу для учащихся необходимо оценить ее методически с точки зрения разных целей:
-
Какие понятия, законы, теории и факты должны быть закреплены в решении конкретной задачи;
-
Какие приемы решения задачи должны быть сформированы;
-
Какие мыслительные приемы должны быть развиты в процессе решения задачи;
-
Какие дидактические функции выполняет решение данной задачи: повторение, обобщение, закрепление нового материала или проверка знаний.
Если целью является закрепление, то методически задача должна быть уже известна ученикам. Если же учитель хочет объяснить задачу нового типа, то при методической неподготовленности учащихся к ее решению необходимо, чтобы содержание материала, на котором базируется задача, было ученикам уже известно.
Нужно, чтобы все задачи, которые даются ученикам, были заранее решены самим учителем. Учитель должен быть убежден в целесообразности выбора данной задачи, в том, что задача будет посильна для ученика.
§2. Логико-структурированная схема решения задач
Работая с расчетными задачами, я использую логико-структурную схему, основные этапы которой:
I Задача (функция учителя) →
II Анализ условия задачи (функция учителя и ученика) →
III План решения задачи (функция учителя и ученика) →
IV Реализация плана решения (функция учителя и ученика):
- химизм в содержании условия задачи;
- работа с условиями данной задачи;
- осмысление результата (вопроса) решения задачи;
- выбор способа ее решения;
- решение задачи;
- предложение других способов решения;
V Анализ решения (функция учителя и ученика).
При решении задач повышенной сложности, для более глубокого их осмысления после анализа данной задачи, мы еще некоторое время работаем с ней незначительно изменяя ее условие и вновь прорабатывая все этапы ее решения.
I Этап. Выбор задачи всегда остается за учителем. В настоящее время в распоряжении учителя имеется достаточное количество задач, соответствующих школьной программе. С каких задач начать обучение? Я пользуюсь определенной методикой выбора задач, подразделив их на 3 типа:
-
Задачи на нахождение формул неизвестных веществ .
2. Задачи прямого расчетного действия.
3. Решение задач с участием смеси
И на каждой ступени: 8, 9, 10, 11 класс, выбираю задачи, позволяющие совершенствовать методику решения задач каждого типа. Учу ребят использовать все известные способы решения, находить более рациональный. Обращаю внимание на метод решения.
II Этап. Анализ условия задачи предусматривает не только ознакомление с ее текстом, но и, что очень важно, правильную запись условия задачи с четким правильным использованием единых обозначений и определенной формы записи.
Даже, если задача решается по уравнению химической реакции, очень важно записать сначала ее условие.
III - IV Этапы. Мы с учащимися используем тот или иной математический подход к решению каждой химической задачи, первоначально определив ее тип. Олимпиадные же задачи зачастую включают все 3 типа и требуют длительного осмысления плана ее решения. Вот в этом случае я направляю внимание ребят на вопрос, поставленный в задаче, и предлагаю начать с химической формулы, способной вывести к ответу на вопрос, и постепенно подбираться к ней, шаг за шагом находя ее основные составляющие.
Многие задачи могут быть решены несколькими способами. В практике обучению решению задач очень важно поощрять попытки учеников найти разные варианты решения одной и той же задачи. Это даст возможность избежать шаблона, заставит учеников логически мыслить.
Часто в учебниках решение задач по химическим уравнениям реакций предложено с помощью математических пропорций. Конечно, этому способу решения надо обучить учащихся. Но на задачу повышенной сложности затратится масса времени для решения. Поэтому обязательно необходимо научить ребят решать задачи, минуя пропорцию, использую величину ν - количество вещества. Эту величину мы с ребятами назвали «королевой» решения задач.
V Этап. Анализ решения задачи, пожалуй, так же важен, как и само решение. Особенно при обучении решения задач нового типа, т. к. анализ позволяет выявить недостатки решения, найти его наиболее рациональный способ, установить и закрепить в памяти приемы, использованные при решении.
Результаты решения задач, требующих творческого, комплексного применения ранее полученных знаний, мы непременно обсуждаем с ребятами. Сравниваем различные способы решения, выделяем наиболее оригинальные из них.
При первоначальном знакомстве школьников с решением типовой задачи необходимо разъяснить ее условие, добиться понимания учениками новых терминов и понятий, которые им придется использовать при решении задач.
Для лучшего понимания условия задачи обязательно провожу 2-х минутный химический тренажер. Пожалуй, его можно здесь назвать как «устный счет».
При изучении темы "Расчеты по химическим формулам", мы с ребятами сами выводим формулу, по которой проведен химический тренажер.
Например: им знакомо понятие относительная молекулярная масса, молярная масса. Находим устно молярную массу воды: М(Н2О) = 18 г/моль - это масса одного моля. Провожу устный счет:
- чему равна масса 2; 3; 4; 10; 0,5; 0,1 и т. д. молей?
Ребята отвечают, и в конце тренажера мы выводим формулу нахождения массы вещества: m = ν · М.
Подобные тренинги помогают вывести и остальные формулы, которые мы впоследствии будем использовать на каждом уроке темы "Количественные отношения в химии": N = ν · Nа, V = ν · Vm, ν = 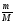 , ν =
, ν = 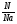 , ν =
, ν = 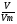 .
.
А чтоб ребята не забывали их, впоследствии на уроках во время химической интеллектуальной разминки можно включать этот устный счет по химическим формулам. Поверьте, это надежный вариант. Возьмем любую науку: химию, математику, физику. Подумаем, в каких вопросах дети находят большее затруднение. Ответ совершенно очевиден - задачи. Логика мышления - она не у всех есть. И надо нам ее постоянно и настойчиво развивать у них. Решение задач как нельзя лучше способствует этому.
После химического тренажера и вывода формулы обращаю внимание ребят на форму записи условия задачи и хода ее решения, а также на формулировку ответа.
В процессе обучения решению задач нового типа необходимо обратить внимание на особенности задачи рассматриваемого вида. Можно сделать это в сравнении с теми задачами, которые они уже научились решать. В процессе объяснения обязательно устанавливаю, какой этап решения вызывает затруднения, и, если это необходимо (а это часто необходимо хотя бы некоторым ребятам), еще раз объясняю и отдельный этап, и в целом ход решения задачи.
Школьники неодинаково свободно решают задачи по разным разделам курса. Задачи с газообразными продуктами, с избытком одного из веществ, нахождение молекулярной формулы соединения вызывают затруднения.
Поэтому необходима постоянная тренировка в их решении. Часы программы, к сожалению, это не предусматривают. Одного тренажа с 5-минутным временем маловато. Ученик должен находить наиболее рациональный путь решения, установив связь между явлениями.
Поэтому во избежание формализма при решении задач я стараюсь приучить их пользоваться различными методами решения, включая алгебраический и графический. Это возможно только во внеурочное время на занятиях элективных курсов и школы олимпийского резерва.
На уроках стараюсь давать задачи систематически: при освоении нового материала, при закреплении и в процессе проверки знаний учебного материала. К примеру, задачи на нахождение молекулярной формулы органического вещества. Выбор рациональных приемов при решении этих расчетных задач способствует активизации познавательной деятельности учащихся. Возможно создание и проблемной ситуации, т.к. в результате соответствующих расчетов необходимо выяснить: состоит ли органическое вещество только из двух химических элементов (углерод и водород) или же в его составе имеется и третий элемент (кислород или азот).
Если ученик научатся хорошо решать задачи, то каждая решенная ими задача станет для ребят маленькой личной победой. Пусть задачи поначалу будут простейшими. Научившись хорошо решать несложные задачи, ребята обязательно захотят покорить следующую высоту - более сложную. Нам важно поддерживать в них это желание, вовремя направить и оказать помощь. В восьмом классе дифференциации при решении задач быть не может - каждый должен научиться решать простейшие задачи. В дальнейшем, конечно, дифференциация возможна даже в условии, формулировке задачи, а не только в выборе задач разной степени сложности. Для слабых ребят - работа с алгоритмом. Пусть используют его, пока не научатся.
Результат не заставит себя ждать: задача станет преодолимым препятствием и не будет уже больше пугать ученика своей неприступностью.
Постарайтесь сделать задачу близкой и понятной для ученика. Решение расчетных задач при желании можно превратить в увлекательное занятие, которое принесет радость как ученикам, так и учителю.
Не только увлекательные опыты, исследование свойств веществ, но и «трудная» решенная задача поможет вызвать интерес учащихся к изучению химии. Задача в химии - это не просто математический расчет, это сложная химическая технология. Если ты умеешь решать задачу, значит, ты знаешь химические теории, законы и факты, т.е. знаешь химию.
Представить, какой труд необходимо вложить учителю при подготовке ребят к олимпиадам, можно, зная, что для решения задач районных и окружных олимпиад необходимо знать учащимся теорию I курса высшей школы. А учитель должен уметь решать все типы задач, самостоятельно изучая необходимую методическую литературу.
Возможно, методика, предложенная в этом пособии, поможет учителям правильно подобрать задачу, выработать систему решения задач, найти более рациональный способ их решения.
Необходимо научить ребят решать 3 типа расчетных задач:
-
Задачи на определение молекулярной формулы вещества.
-
Задачи прямого расчетного действия.
-
Задачи на смеси веществ.
Глава II Методика решения расчетных задач по химии
§1. Методика решения задач на определение молекулярной формулы вещества
Для решения таких задач целесообразно применение двух общих приемов:
Первый прием заключается в нахождении относительной молекулярной или молярной массы вещества.
Второй прием - нахождение атомных отношений. На первом занятии даю все основные уравнения связи, позволяющие использовать эти приемы:
Уравнения связи:
I Формулы, позволяющие найти молярную массу вещества: СхНуОz
1) М = 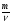 2) М = Дн2 · 2 М= Дв · 29 М = До2 · 32
2) М = Дн2 · 2 М= Дв · 29 М = До2 · 32
(плотность относительно газа - Д).
3) М(СхНуОz) = 12х + у + 16z
(по сумме относительных атомных масс химических элементов).
4) М(СхНуОz) = 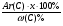
(если известна массовая доля одного из элементов в веществе).
5) М = 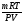
(используя физические данные состояния вещества).
II Нахождение атомных отношений - х : у : z
1 способ: х : у : z = 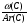 :
: 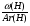 :
: 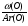 ;
;
2 способ: х : у : z = 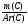 :
: 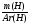 :
: 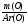 ;
;
3 способ ν (Э) = 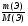 => х : у : z = ν (С) : ν (Н) : ν (О).
=> х : у : z = ν (С) : ν (Н) : ν (О).
3.При изучении органических веществ встречаются задачи, где в условии идет сравнение объемов или масс веществ, участвующих или получившихся в результате химической реакции. Для их решения достаточно знание обычных законов химии:
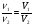
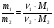
СхНу + (х +  )О2 → хСО2 +
)О2 → хСО2 + 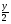 Н2О
Н2О
ν1=1моль ν2=(х+ )моля ν3=х моль ν4=
)моля ν3=х моль ν4=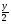 моля
моля
Определив количество веществ, используя пропорцию, мы получаем уравнение реакции с двумя неизвестными "х" и "у", которое решаем методом подбора значений "х".
Сначала решаем задачи, которые требует программа. Условия постепенно усложняем. Предлагаю следующую последовательность задач, позволяющую постепенно шаг за шагом переходить от одного вида задач к другому. (Приложение 1).
Задача 1. Неорганическое вещество состоит из атомов меди, серы и кислорода, массовые доли которых соответственно равны: 40%, 20%, 40%. Определить молекулярную формулу вещества.
Записываем условие задачи:
Дано:
ω% (Cu) = 40%
ω% (S) = 20%
ω% (O) = 40%
Cuх Sу Oz = ?
Решение:
1. Формула вещества состоит из атомов Cu, S, O, число атомов неизвестно: соответственно х, у, z: CuхSуOz
2. Используем второй прием нахождения атомных отношений х : у : z через известные массовые доли их:
х : у : z =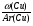 :
: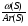 :
: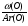 =
=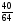 :
: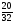 :
: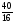 =0,625:0,625:2,5
=0,625:0,625:2,5
3. Наименьшее из чисел принимаем за единицу и находим относительно его остальные числа.
Получилось отношение: х : у : z = 1 : 1 : 4
4. Это означает, что в молекуле на 1 атом серы приходится 1 атом меди и 4 атома кислорода, т.е. формула вещества CuSO4
5. Но из отношения видно, что на 2 атома меди приходится 2 атома серы и 8 атомов кислорода, т.е. Cu2S2O8. Учащиеся такую формулу не знают.
6. Оставляем один ответ: CuSO4 - искомая формула вещества.
Задача 2. Определить формулу хлорида некоторого металла, если известно, что массовая доля хлора в нем 47,65%
Дано:
ω% (Cl) = 47,65%
МClх = ?
Решение:
1. Валентность хлора (I) в хлориде. Валентность металла обозначим за "х".
Формула вещества: МClх
2. Решить эту задачу можно способом определения молярной массы вещества. Зная массовую долю одного из химических элементов, всегда можно определить молярную массу вещества:
М(MeClх) = 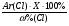 =
= 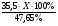 = 74,5 · Х (г/моль)
= 74,5 · Х (г/моль)
3. Применяем метод подбора значений х (от 1 до 3)
Пусть: х = 1 Мr(MeCl) = Ar(Me) + 35,5
Мr(MeCl) = 74,5
4. При равенстве молярных масс вещества мы получаем уравнение:
Ar(Me) + 35,5 = 74,5
Ar(Me) = 39
5. По периодической системе находим одновалентный металл с относительной атомной массой равной 39. Это калий.
6. х = 2 и х = 3 и др. не дают результатов. Решение единственное. Формула хлорида: KCl.
Ответ: формула KCl.
Задача 3. Определить формулу неорганического вещества, если известно, что в 5г его содержится 0,05 молей кальция, а массовая доля кислорода составляет 48%. Третьим элементом является углерод.
Дано:
m (в-ва) = 5г
ν (Са) = 0,05моль
ω%(О) = 48%
СахСуОz = ?
Решение:
1. Анализирую условие, мы видим, что в нем указаны данные об отдельных химических элементах вещества (ν, ω), поэтому выбираем способ нахождения формулу через атомные отношения: х : у : z
Ведущая формула: (I) х : у : z = 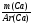 :
: 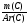 :
: 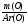 или (II) х : у : z = ν (Са) : ν (С) : ν (О)
или (II) х : у : z = ν (Са) : ν (С) : ν (О)
2. Для расчетов по (I) формуле находим массы каждого элемента в формуле вещества: m(Са) = ν · М(Са) = 0,05моль · 40г/моль = 2г;
m(О) = 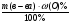 =
= 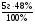 = 2,4г;
= 2,4г;
m(С) = m(в-ва) - m(Са) - m(О) = 5г - 2г - 2,4г = 0,6г.
Мы нашли все компоненты, необходимые для записи атомных отношений элементов:
3. х : у : z = 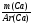 :
: 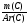 :
: 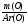 =
= 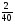 :
: 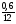 :
: 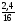 ,
,
находим отношения атомов:
х : у : z = 0,05 : 0,05 : 0,015 = 1 : 1 : 3
искомая формула: СаСО3.
Ответ: формула вещества СаСО3.
Задача 4. Известно, что относительная плотность по водороду одного из газообразных оксидов азота равна 23. Определить формулу оксида азота.
Дано:
Дн2(NxOу) = 23
NxOу = ?
Решение:
Анализируя условие задачи, используем второй прием - находим молярную массу вещества. Напоминаем, что молярную массу необходимо находить двумя способами, чтоб можно было составить уравнение и решить его методом подбора значения "х".
1. Первый способ - по сумме относительных атомных масс элементов:
М(NxOу) = 14х + 16у(г/моль)
2. Второй - через известную относительную плотность вещества по водороду:
М(NxOу) = Дн2 · 2г/моль = 23 · 2г/моль = 46г/моль
3. Составим уравнение и решаем методом "подбора":
14х + 16у = 46
х
у
1
2
2
дробь
(14 · 1 + 16у = 46)
(не подходит).
Целые положительные значения получились при х = 1, у = 2.
Следовательно, формула вещества NO2.
Ответ: формула соединения NO2.
Задача 5. Определить формулу оксида азота, если известно, что 4,4г его при температуре 1 1300С и давлении 200 кПа занимает объем 5,58л.
Дано:
m( NxOу) = 4,4г
t = 1 1300С
р = 200кПа
V( NxOу) = 5,58л
NxOу = ?
Решение:
1. В этой задаче хорошо просматривается связь двух наук - химии и физики. Один из способов нахождений молярной массы через газовые параметры.
М = 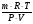 =
= 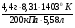 = 46г/моль.
= 46г/моль.
2. Второй способ нахождения молярной массы по сумме относительных атомных масс элементов:
М(NxOу) = 14х + 16у(г/моль)
3. Составляем уравнение, используя равенство молярных масс вещества:
14х + 16у = 46
4. Решаем его, используя метод подбора значений х и у. Пусть:
х
у
1
2
2
дробь
формула NO2
-
Ответ: формула оксида NO2.
Одной из сложнейших задач этого типа задача № 11 (см. приложение 1). В ней неизвестным являются и химические элементы, и их валентность.
Задача 11. Определить формулу вещества "Х", состоящего из элементов А и В, если известно, что массовая доля кислорода в оксиде А равна 47%, а массовая доля водорода в водородном соединении элемента В составляет 5,9%.
Дано:
АуВх
А2Ох ω%(О)=47%
ВНу ω%(Н)=5,9%
АуВх = ?
Решение:
Формула вещества АуВх
1. Определяем элемент А по данным оксида: А2Ох, где х - валентность элемента А
2. Находим молярную массу элемента А по формуле:
М(А) = 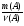 - ведущая формула
- ведущая формула
а) находим количество элемента А через количество атомов кислорода:
ν(А) = 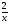 ν(О) =
ν(О) = 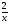 ·
· 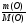 , но так как масса кислорода неизвестна, найдем ее, зная по условию задачи массовую долю кислорода и принимая m(А2Ох) = 100г
, но так как масса кислорода неизвестна, найдем ее, зная по условию задачи массовую долю кислорода и принимая m(А2Ох) = 100г
m(О) = 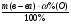 =
= 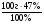 = 47г;
= 47г;
ν(А) = 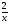 ·
· 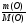 =
= 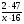 =
= 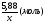 ;
;
б) для нахождения массы элемента А используем тот же прием, как и в случае с кислородом: ω(А)% = 100% - ω%(О) = 100% - 47% = 53%
m(А) = 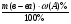 =
= 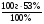 = 53г;
= 53г;
3. Подставляя полученные данные m(А) и ν(А) в ведущую формулу, получаем:
М(А) = 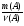 =
= 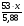 = 9х(г/моль).
= 9х(г/моль).
4. Методом подбора значений "х" - валентности находим Аr(А) и по периодической системе увидим, какой элемент соответствует этому значению валентности и Аr. Пусть:
Х
Аr(А)
1
2
3
9
18
27
- нет одновалентного элемента
- нет
- трехвалентный элемент алюминий Аl - это и есть элемент "А".
5. Элемент "В" определяем по данным водородного соединения: ВНу, где у - валентность элемента В, пользуюсь той же методикой, что и для нахождения элемента А:
а) ведущая формула: М(В) = 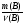 .
.
Пусть масса вещества ВНу = 100г
б) m(Н) = 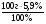 = 5,9г;
= 5,9г;
в) m(В) = 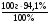 = 94,1г;
= 94,1г;
г) ν(В) =  ν(Н) =
ν(Н) =  ·
· 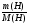 =
= 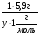 =
= 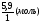 ;
;
д) М(В) = 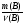 =
= 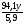 =
= 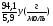 ;
;
е) методом подбора значения "у" - валентности элемента В, находим относительную атомную массу В и сам элемент
Пусть:
у
Аr(В)
1
2
16
32
нет
- элемент сера 
 - это элемент В.
- это элемент В.
Ответ: формула 
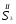 .
.
Вам были предложены задачи по определению формул веществ, не участвующих в химической реакции.
Вторым этапом решения этого типа задач, является определение формул неизвестных веществ, участвующих в химических реакциях.
§2. Определение молекулярной формулы вещества по уравнениям химических реакций
Очень важно уметь определять формулу вещества по известным продуктам сгорания его.
Задача 12. При сгорании 1,7г неизвестного вещества в кислороде выделилось 3,2г оксида серы (IV) и 0,9г воды. Определить молекулярную формулу вещества.
Записываем условие задачи.
Дано:
m(в-ва) = 1,7г
m(SO2) = 3,2г
m(Н2О) = 0,9г
НхSуОz = ?
Решение:
1. Анализируя условие задачи, мы видим, что в результате сгорания вещества образовался оксид - SO2, следовательно, вещество содержит атомы серы, а по выделившейся воде находим в нем атомы водорода. Возможно еще наличие атомов кислорода, но это нам прояснит решение задачи:
вещество + О2 → SO2 + Н2О
НхSуОz + О2 → SO2 + Н2О
Предположили наличие атомов серы, водорода и кислорода
2. По выделившемуся оксиду SO2 мы сможем найти количество серы; по воде - количество водорода:
ν(S) = ν(SO2) =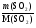 =
= 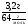 = 0,05моль => m(S) = ν · М(S) = 1,6г;
= 0,05моль => m(S) = ν · М(S) = 1,6г;
ν(Н) = 2ν(Н2О) = 2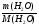 =
= 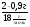 = 0,1моль => m(Н) = ν(Н) · М(Н) = 0,1г.
= 0,1моль => m(Н) = ν(Н) · М(Н) = 0,1г.
3. Содержится ли кислород в веществе, мы узнаем из следующих вычислений:
m(О) = m(в-ва) - m(S) - m(H) = 1,7 - 1,6 - 0,1 = О2 (кислорода нет).
4. Находим формулу вещества НхSу, используя атомные отношения:
х : у = ν(Н) : ν(S) = 0,1 : 0,05 = 2 : 1 => Н2S +
4 : 2 => Н4S2 - не существует
……
Ответ: формула Н2S.
Задача 13. При взаимодействии 6,85г металла с водой выделилось 1,12л водорода (н.у.). Определить этот металл, если он в своих соединениях двухвалентен.
Дано:
m(Ме) = 6,85г
V(Н2) = 1,12л
Ме = ?
Решение:
1. Составим уравнение химической реакции:
Ме + 2Н2О = Ме(ОН)2 + Н2
ν = 1 моль ν (Н2)=1моль
2. Ищем способ ее решения: если в условии задачи известна масса вещества, то найти формулу неизвестного вещества можно, через определение молярной массы его.
М(Ме) = 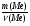 - ведущая формула.
- ведущая формула.
По уравнению реакции видно, что:
ν(Ме) = ν(Н2) = 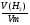 =
= 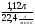 = 0,05моля.
= 0,05моля.
Следовательно: М(Ме) = 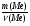 =
= 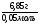 = 137г/моль.
= 137г/моль.
По периодической системе химических элементов находим металл барий ( ), его М(Ва) = 137г/моль.
), его М(Ва) = 137г/моль.
Ответ: барий Ва.
Определить неизвестное вещество можно и с помощью ряда последовательно проходящих химических реакций, сравнивая количества веществ участвующих и получающихся в результате реакций.
Задача 15. 1,97г карбоната двухвалентного металла прокалили при 8000С. Полученный белый порошок бурно прореагировал с водой. К образовавшемуся раствору прибавили избыток сульфата калия. Промытый и высушенный осадок весил 2,33г. Определите, какой это металл.
Дано:
m(МеСО3)=1,97г
mос. = 2,33г
Ме = ?
Решение:
1. Записываем уравнения проходящих реакций, нумеруя их.
(1) МеСО3 == МеО + СО2 ↑
ν=1моль ν=1моль
(2) МеО + Н2О == Ме(ОН)2
ν=1моль ν=1моль
(3) Ме(ОН)2 + К2SO4 == 2КОН + МеSO4 ↓
ν=1моль ν=1моль
2. Рассмотрев химические реакции, и, анализируя условия задачи, мы видим, что формулу неизвестного веществаМеСО3 можно найти, вычислив молярную массу карбоната через количество сульфата. Пусть "Х" - относительная атомная масса металла:
а) М(МеСО3) = х + 12 + 48 = х + 60(г/моль);
М(МеSO4) = х + 96(г/моль);
б) М(МеСО3) = 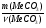 - ведущая формула.
- ведущая формула.
3. Количество вещества МеСО3 находим, используя три параллельные реакции:
ν(МеСО3)1 = ν(МеО)1 = ν(МеОН)2 = ν(МеSO4)3 = 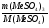 =
= 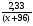 (моль).
(моль).
4. Определяем М(МеСО3) = 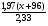 = 0,85(х+96)г/моль.
= 0,85(х+96)г/моль.
5. Составляем уравнение, используя равенство молярных масс карбоната металла, найденных двумя способами: (а) = (б)
Х + 60 = 0,85(х + 96).
Решая его, находим: х = 137. По периодической системе химических элементов находим двухвалентный металл Ва, имеющий Аr = 137.
Ответ: металл - барий.
Необходимо научить учащихся находить неизвестный металл и через изменение массы пластинки, опущенной в раствор соли, используя формулу вычисления количества вещества: ν = 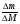 ,
,
где ∆m - изменение массы пластинки.
∆М - разница молярных масс растворяемого металла и металла, образовавшегося во время химической реакции.
Задача 16. (см. приложение 1.).
Решение:
Решим первую часть задачи, определив неизвестный металл.
1. Запишем уравнения всех протекающих в растворе химических реакций:
(1) 2Ме + уCuSO4 = Ме2(SO4)у + уCu;
(2) Ме + уНСl = МеCl + 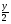 Н2;
Н2;
(3) Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O;
где: у - валентность неизвестного металла
х - относительная атомная масса металла
2. По (3) уравнению определим количество меди, выделившейся из раствора в уравнении (1) и растворенной в азотной кислоте (3).
ν(Cu)Х.Р3 =  ν(NO2) =
ν(NO2) =  ·
· 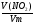 =
=  ·
· 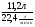 = 0,25моль.
= 0,25моль.
3. Определяем двумя способами: через ν(Cu) и по изменению массы пластинки, количество неизвестного металла, растворившегося в сульфате меди в первой реакции: ν(Ме)Х.Р1 = 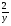 ν(Cu) =
ν(Cu) = 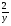 · 0,25 =
· 0,25 = 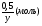 ;
;
ν(Ме)Х.Р1 = 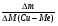 =
= 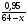 ;
;
4. Получаем уравнение химической реакции и решаем его методом подбора значений у (валентности металла).
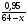 =
= 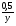
0,95у = (64 - х)0,5
0,95у = 32 - 0,5х
у
х -Ar
I
II
III
62
60
58,5
нет
нет
- химический элемент никель Ni.
По периодической системе находим трехвалентный элемент никель
Ответ: пластинка из металла никеля.
§3. Определение молекулярной формулы неизвестного органического вещества
Методика определения молекулярной формулы органического вещества через атомные отношения элементов и через нахождение молярной массы вещества такая же, как и для неорганических веществ. Однако определенная специфика задач такого рода есть, так как органические вещества - это вещества содержащие атомы углерода и сопутствующие им атомы водорода, кислорода, азота - разнообразие атомов невелико.
Задача18. Для сгорания углеводорода потребовался кислород объемом в 7,5 раз больше объема паров этого углеводорода. Найти формулу органического вещества.
1. Записываем условие задачи и пишем уравнение реакции горения углеводорода, расставляя коэффициенты, которые определят основу решения задачи.
Дано:
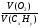 =
= 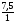
СхНу = ?
Решение:
СхНу + (х +  )О2 → хСО2 +
)О2 → хСО2 + 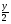 Н2О
Н2О
ν=1моль ν=(х +  )моль
)моль
2. Анализируя условие задачи, вспоминаем одно важное следствие закона Авогадро - объемы газообразных веществ пропорциональны их количеству. Получаем уравнение с двумя неизвестными:
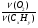 =
= 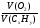 ; ν(СхНу) = 1моль; ν(О2) = (х +
; ν(СхНу) = 1моль; ν(О2) = (х +  )моль;
)моль;
х +  = 7,5
= 7,5
3. Решая полученное уравнение методом подбора значений "х", находим формулу органического вещества:
если х = 1 у = 30 СН30 не может быть
….……...........
х = 5 у = 10 С5Н10 - существует
Ответ: формула С5Н10.
Это же следствие закона Авогадро может определить формулу неизвестного углеводорода, сравнивая объемы любых газообразных веществ в уравнениях реакций (задача 19 в приложении 1).
Для нахождения формул веществ необходимо хорошее знание химических свойств.
Задача 20. Определите молекулярную формулу алкена, если известно, что его образец массой 1,4г может обесцветить 107г 3% раствор бромной воды.
1. Записываем условие задачи и уравнение бромирования алкена:
Дано:
m(СnH2n) = 1,4г
m(Br2)р-р = 107г
ω%(Br2) = 3%
СnH2n = ?
СnH2n + Br2 → СnH2nBr2
ν=1моль ν=1моль
2. Находим молярную массу алкена через алгебраическую сумму относительных масс атомов:
М(СnH2n) = 12n + 2n = 14n(г/моль)
3. Находим молярную массу алкена вторым способом, используя значение массы его, данное в условии задачи:
М(СnH2n) = 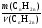 ведущая формула,
ведущая формула,
количество алкена находим, через количество брома, содержащегося в бромной воде.
ν(СnH2n) = ν(Br2) = 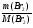 =
= 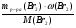 =
= 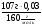 = 0,02моля.
= 0,02моля.
Подставляем найденное значение количества алкена в ведущую формулу молярной массы: М(СnH2n) = 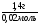 = 70г/моль.
= 70г/моль.
4. Составляем уравнение, используя равенство молярных масс, найденных двумя способами. Находим число "n", формулу углеводорода 14n = 70 n=5.
Формула: С5Н10
Ответ: формула алкена С5Н10.
Подбирая соответствующее условие для задачи, мы можем предложить найти не только формулу молекулярную вещества, но и установить его строение.
Задача 22. При межмолекулярной дегидратации 30г одноатомного спирта выделилось 3,6г воды, причем выход реакции составил 80% от теоретического. Какое строение имеет спирт, если известно, что в его молекуле находятся две метиленовые группы.
Реакция межмолекулярной дегидратации одноатомного спирта протекает по уравнению: 2СхНуОН 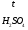 (СхНу)2О + Н2О
(СхНу)2О + Н2О
Дано:
m(СхНуОН)=30г
m(Н2О) = 3,6г
η% = 80%
СхНуОН = ?
1. Находим массу спирта вступившего в химическую реакцию, если ее выход 80%
m(СхНуОН)х.р. = mтеор.· η = 30г · 0,8 = 24г
2. Определяем молярную массу спирта по формуле:
М(СхНуОН) = 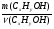
а) Количество спирта находим через количество образовавшейся воды:
ν(СхНуОН) = 2ν(Н2О) = 2·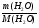 =
= 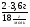 = 0,4моля;
= 0,4моля;
б) Подставляем значение "ν" в ведущую формулу и находим молярную массу спирта:
(1) М(СхНуОН) = 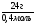 = 60г/моль.
= 60г/моль.
3. Второй способ определения молярной массы - по сумме относительных атомных масс элементов
(2) М(СхНуОН) = 12х + у + 17 (г/моль).
4. Из равенства молярных масс, найденных способами (1) и (2), составляем уравнение и решаем его методом подбора значений "х"
12у + у + 17 = 60
х
у
1
2
3
нет
нет
7
12х + у = 43
Формула С3Н7ОН пропанол
5. Структурная формула содержит две метиленовые группы:
это: СН3 - СН2 - СН2 - ОН пропанол - 1
Ответ: СН3 - СН2 - СН2 - ОН пропанол - 1
Решение задачи № 25 (см. приложение 1) - олимпиадного "шедевра" требует хода мысли и, конечно, знания свойств веществ.
Задача 25.
Решение:
1. Поджигают смесь углеводорода и азота. Вы знаете, что азот в обычных условиях не вступает в реакцию горения. Поэтому химическая реакция одна:
СхНу + (х +  )О2 = хСО2 +
)О2 = хСО2 +  Н2О
Н2О
2. Объем, полеченной при сгорании смеси по условию задачи, 1,4л, а после конденсации воды сократился до 800мл. Следовательно, находим объем паров воды:
V(Н2О)n = 1,4л - 0,8л = 0,6л
3. Новое сокращение объема до 400мл наблюдалось при пропускании газов через раствор КОН. Со щелочами из газовой смеси может вступать в реакцию только СО2. Следовательно, можем найти V(СО2)
V(СО2) = 800мл - 400мл = 400мл. (0,4л).
4. Установим формулу углеводорода, зная объемы выделившейся воды и углекислого газа, пользуюсь атомными отношениями элементов углерода и водорода: х : у = ν(С) : ν(Н)
а) ν(С) = ν(СО2) = 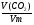 =
= 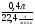 = 0,02моля;
= 0,02моля;
б) ν(Н) = 2ν(Н2О) = 2·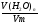 =
= 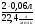 = 0,05моль;
= 0,05моль;
х : у = 0,02 : 0,05 = 2 : 5 простейшая формула С2Н5, но нечетное число атом "Н" не может быть, поэтому удвоим атомные отношения. Получим: х : у = 4 : 10.
Формула углеводорода С4Н10 бутан.
Ответ: С4Н10 бутан.
Итак, при решении всех задач этого типа на определение формулы неизвестного вещества мы пользовались тремя способами: нахождение молярной массы двумя способами; нахождение атомных отношений; соотношение объемов и количества газов.
§4. Методика решения задач прямого расчетного действия
Методика решения задач этого типа предполагает два способа решения: метод пропорций и алгебраический метод. Метод пропорций желательно применять лишь при решении несложных задач программы. Но если мы хотим научить ребят решать задачи любой степени сложности, необходимо применение алгебраического метода, позволяющего использовать известные нам уравнения связи:
m = ν · М
ν = 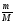
ν = 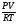
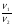 =
= 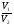
ωр.в =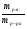
ω(Э) = 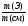
N = ν · Na
ν = 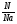
φгаза = 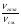
V = ν · Vm
ν = 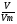
Решать задачи с использованием этих формул с использованием этих формул можно двумя способами: от условия задачи и от вопроса, поставленного в ней. При этом преимущество второго способа бесспорно. Выбрав ведущую формулу (уравнение связи), мы увидим, что необходимо сделать для ее решения.
Задача 1. Определите объем, занимаемый при н. у. углекислым газом, масса которого равна 22г.
Дано:
m(СО2) = 22г
V( СО2) = ?
Решение:
1. Начинаем решать от вопроса, поставленного в задаче - записываем ведущую формулу нахождения объема газа:
V(СО2) = ν(СО2) ·Vm
2. Видим, что количество газа ν(СО2) нам неизвестно. Находим его, используя одно из уравнений связи, подходящее под условие задачи:
ν(СО2) = 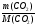 , М(СО2) = 44г/моль;
, М(СО2) = 44г/моль;
ν(СО2) = 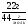 = 0,5моля.
= 0,5моля.
3. Подставляем значение ν(СО2) в (1) уравнение связи и находим объем углекислого газа:
V(СО2) = 0,5моль · 22,4л/моль = 11,2л.
Ответ: V(СО2) = 11,2л.
Затруднения у учащихся вызывают задачи по нахождению массы или объема одной молекулы вещества. Помогут в этом уже известные уравнения связи.
Задача 3. Определить массу одной молекулы школьного мела (СаСО3).
Дано:
N( СаСО3)=1молекула
m(СаСО3) = ?
Решение:
1. Записываем ведущую формулу нахождения массы вещества, т.е. задачу начинаем решать от вопроса, поставленного в ней.
(1) m(СаСО3) = ν(СаСО3) · М(СаСО3)
2. Находим количество, которое составляет 1 молекула карбоната кальция:
ν(СаСО3) = 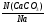 =
= 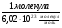 = 0,166 · 10
= 0,166 · 10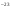 моль.
моль.
3. Определяем массу одной молекулы карбоната кальция по (1) формуле:
М(СаСО3) = 100г/моль;
m(СаСО3) = 0,166 · 10 моль · 100г/моль =16,6 · 10
моль · 100г/моль =16,6 · 10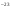 г.
г.
Ответ: m(СаСО3)1 молекулы = 16,6 · 10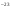 г.
г.
Задача 4. Определить, атомов каких элементов: азота или меди больше и во сколько раз, если известно, что их массовые доли в земной коре почти равны.
Записываем условие задачи.
Дано:
ω(N) ≈ ω(Cu)
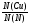 = ?
= ?
1. Эту задачу начинаем решать с вопроса, поставленного в ней. И, если необходимо сравнивать числа, то лучше всего начать с отношения числа атомов:
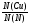 =
= 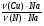
2. Постепенно переходя от одной знакомой формулы: N = ν · Na
к другой ν = 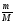 . От нее к формуле нахождения массы элемента по массовой доле его в земной коре: m(Э) = ω(Э) · mземли и сравнивая количества и массы этих двух элементов, подходим к ответу на вопрос, заданный в задаче:
. От нее к формуле нахождения массы элемента по массовой доле его в земной коре: m(Э) = ω(Э) · mземли и сравнивая количества и массы этих двух элементов, подходим к ответу на вопрос, заданный в задаче:
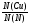 =
= 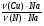 =
= 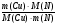 =
= 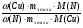 =
= 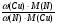
3. По условию задачи массовые доли элементов приблизительно равны, поэтому нам остается сравнить лишь их молярные массы:
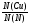 =
= 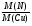 =
= 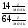
4. Видим, что число атомов азота больше числа атомов меди. Рассчитываем во сколько раз больше. Находим ответ:
N(N) : N(Cu) = 64 : 14 = 4, 57 (раз)
Ответ: число атомов азота в 4,57 раза больше числа атомов меди.
Вот так, используя все известные нам с 8-го класса уравнения связи, решаем задачи прямого расчетного действия с веществами, не вступившими в химическую реакцию.
При решении задач прямого расчетного действия по уравнениям химических реакций мы используем те же формулы. Главенствующей величиной в наших расчетах мы называем количество вещества "ν", называя ее "королевой" задач. Именно она помогает нам быстрее и проще найти правильное решение. То есть в самом начале решения задачи все значения массы и объема мы переводим в количество вещества по формулам:
ν = 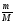
ν = 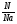
ν = 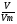
ν = 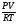
И решаем задачи не методом пропорций, а используя известные нам уравнения связи:
m = ν · М; V = ν · Vm; N = ν · Na.
Задача 1. Окислен аммиак объемом 11,2л. Определить массу выделившейся при этом воды, объем кислорода и число молекул оксида азота (II).
1. Записываем условие задачи и уравнение реакции окисления аммиака:
Дано:
V(NH3) = 11,2л
m(Н2О) = ?
V(O2) = ?
N(NO) = ?
4 NH3 + SO2 = 4 NO ↑ + 6 Н2О
ν=4 моль ν=5 моль ν=4 моль ν=6 моль
Под уравнением реакции записали количество каждого вещества.
2. Находим количество аммиака, участвующее в реакции:
ν(NH3) = 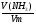 =
= 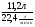 = 0,5моль
= 0,5моль
3. Отвечаем на вопросы в задаче в том порядке, в каком они поставлены. Сначала находим массу воды через ее количество, сравнивая его с количеством аммиака (для этого коэффициент воды делим на коэффициент аммиака):
ν(Н2О) = 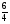 ν(NH3) =
ν(NH3) = 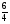 · 0,5 = 0,75(моль);
· 0,5 = 0,75(моль);
m(Н2О) = ν(Н2О) · М(Н2О) = 0,75моль · 18г/моль = 13,5г.
4. Находим объем кислорода через его количество, сравнив с количеством аммиака:
ν(O2) = 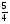 ν(NH3) =
ν(NH3) = 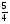 · 0,5 = 0,625(моль);
· 0,5 = 0,625(моль);
V(O2) = ν(O2) · Vm = 0,625моль · 22,4л/моль = 14л.
5. Находим число молекул оксида азота (II) через его количество, сравненное с количеством аммиака:
ν(NO) = 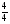 ν(NH3) = 0,5моль;
ν(NH3) = 0,5моль;
N(NO) = ν(NO) · Na = 0,5моль · 6,02 · 10 молекул/моль = 3,01 · 10
молекул/моль = 3,01 · 10 молекул.
молекул.
Ответ: m(Н2О) = 13,5г, V(O2) = 14л, N(NO) = 3,01 · 10 молекул.
молекул.
Так же можно сравнивать количества веществ, участвующих в ряде последовательно идущих реакций, пронумеровав каждую из них.
Например:
(1) N2 + 3H2 = 2NH3
x моль
(2) 4NH3 + SO2 = 4NO + 6H2O
(3) 2NO + O2 = 2NO2
(4) 2NO2 + H2O = HNO3 + HNO2
1 моль
ν(N2)1 =  ν(NH3)1 =
ν(NH3)1 =  ν(NO)2 =
ν(NO)2 =  ν(NO2)3 =
ν(NO2)3 =  ·2ν(HNO3)4,
·2ν(HNO3)4,
т.е. зная ν(HNO3) в (4) реакции, можно, не используя пропорций, благодаря этим переходам, сразу же найти количество азота в (1) реакции:
ν(N2)1 = ν(HNO3)4
ν(N2) = 1 моль, если ν(HNO3) = 1 моль.
Очень хорошо выручает нас значение количества вещества в реакциях, где вещества даны в избытке. Рассмотрим одну из задач этого вида.
Задача 3. Смешали 42г железа с 16г серы и нагрели. После окончания реакции между ними, полученный твердый остаток обработали избытком раствора соляной кислоты. Определить суммарный объем выделившихся при этом газов.
Дано:
m(Fe) = 42г
m(S) = 16г
V(H2S)+V(H2)=?
1. Записываем условие задачи и предполагаемые уравнения химических реакций:
(1) Fe + S = FeS
ν=1моль ν=1моль ν=1моль
(2) FeS + 2HCl = FeCl2 + H2S ↑
ν=1моль ν=1моль
если железо в избытке в (1) реакции то возможна еще и третья реакция:
(3) Fe + 2HCl = FeCl2 + H2 ↑
ν=1моль ν=1моль
2. Возможность протекания (3) реакции мы укажем, рассчитав, какое из веществ: железо или сера в (1) реакции даны в избытке.
Находим избыток веществ. Предварительно массы железа и серы переводя в количество вещества:
ν(Fe) = 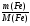 =
= 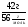 = 0,75моль;
= 0,75моль;
ν(S) = 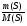 =
= 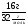 = 0,5моль. ν(Fe)(1) = ν(S)(1) = 0,5моль.
= 0,5моль. ν(Fe)(1) = ν(S)(1) = 0,5моль.
В (1) уравнении количества железа и серы равны, а по условию реакции железа дано больше 0,75моль. Следовательно, сера вся вступила в химическую реакцию, а часть железа осталось и растворилось в соляной кислоте. Следовательно, третья реакция идет.
3. Находим количество железа, участвующего в третьей реакции:
ν(Fe)(3) = ν(Fe)всего - ν(Fe)(1) = 0,75 - 0,5 = 0,25(моль).
4. Находим количество и объем газа водорода, выделившегося при растворении оставшегося железа в соляной кислоте:
ν(Н2)3 = ν(Fe)3 = 0,25моль;
V(H2)3 = ν(Н2)3 · Vm = 0,25моль · 22,4л/моль = 5,6л.
5. Находим количество сульфида железа, полученного в (1) реакции и количество сероводорода, выделившегося во (2) реакции:
ν(FeS)1 = ν(S)1 = 0,5моль;
ν(Н2S)2 = ν(FeS)2 = 0,5моль.
6. Объем сероводорода равен:
V(Н2S)2 = ν(Н2S)2 ·Vm = 0,5моль · 22,4л/моль = 11,2л
7. Суммарный объем газов:
V(Н2)3 + V(Н2S)2 = 5,6л + 11,2л = 16,8л.
Ответ: V(Н2) + V(Н2S) = 16,8л.
Решение задач с участием растворов веществ.
Уравнения связи, которые мы будем использовать при решении этих задач:
mр.в = mр-ра · ωр.в; mр-ра = 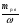 ; ω =
; ω = 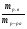 ;
;
mраствора3 = m1 + m2 - mосадка - mгаза;
С = 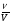 ; ν = C · V, где C - молярная концентрация раствора (моль/л)
; ν = C · V, где C - молярная концентрация раствора (моль/л)
ω - массовая доля растворенного вещества в растворе.
Mр-ра = ρ · Vр-раmр.в - масса растворенного вещества (г)
mр-ра - масса раствора
V - объем раствора (л)
ρ - плотность раствора (г/мл)
Важно научить ребят видеть как из одного раствора образуется другой. Для этого лучше всего прибегнуть к рисунку химического стакана, где будет готовиться раствор:
-
mр-р2= mр-р1 + mдоб.
-
Выпадает осадок или выделяется газ - масса раствора уменьшается на массу осадка или газа.
mр-р2 = mр-р1 + mдоб. - mосадка - mгаза.
Вот так, с помощью рисунка, мы учимся находить массы растворов, участвующих в химической реакции и образующихся в результате ее.
Решение задач с участием растворов определенной процентной концентрации учу решать с использованием таблицы, где обозначены три компонента раствора: ωр.в., mр.в. и mр-ра. Если растворов несколько, начинаем с первого.
ω
mр.в
mр-ра
0,1
х г
100 г
В таких задачах должны быть известны все 3 компонента раствора: ω, mр.в. и mр-ра. Если неизвестен один из них, применяем известную нам формулу и находим его:
mр.в. = ω · mр-ра.
Если по условию неизвестное присутствует в двух компонентах, то такие задачи решаем путем составления алгебраического уравнения, используя все те же известные нам формулы.
Например:
Задача 1. Найдите, сколько соли необходимо добавить к 100г воды, чтоб массовая доля растворенного вещества получилась 20%.
1. Записываем условие задачи и составляем таблицу для раствора:
Дано:
m(Н2О) = 100г
ωр.в = 0,2
mр.в = ?
Массу растворенной соли обозначим за х(г).
ω
mр.в
mр-ра
0,2
х
100 + х
mр-ра = m(Н2О) + mр.в
2. Видим, что неизвестное появилось в двух компонентах раствора: mр.в и mр-ра, поэтому составляем алгебраическое уравнение, пользуясь любой формулой, где присутствуют все три составные части раствора и, подставляя их в эту формулу, решаем уравнение и находим неизвестное "х" т.е. массу добавленной соли.
mр.в = ω · mр-ра
х = 0,2(100 + х)
х = 20 + 0,2х
х = 25г
Ответ: mр.в = 25г.
Если по условию задачи мы видим образование еще одного раствора, то сначала находим все неизвестные компоненты первого, а затем и второго, используя каждый раз уже знакомые нам таблицы и каждый раз нумеруя растворы.
Задача 2. Найти массу хлорида натрия, которую необходимо добавить к 200г 5% раствора этой же соли, чтобы ее массовая доля удвоилась.
1. Записываем условие задачи и составляем таблицу для первого раствора.
Дано:
mр-р1 = 200г
ω1 = 0,05
ω2 = 0,1
mдоб(NaCl) = ?
ω1
mр.в1(г)
mр-ра1(г)
0,05
х = 10г
200
(1)
2. Находим массу растворенной соли в первом растворе:
mр.в1 = ω1 · mр-ра1 = 0,05 · 200г = 10г
Подставляем это значение в таблицу: х = 10г.
3. Переходим ко второму раствору. 
Чтоб легче было представить
его, выполняем рисунок:
массу добавленной соли
обозначим за "у" (г)
4. Получается следующая
таблица:
ω2
mр.в2(г)
mр-ра2(г)
0,1
10 + у
200 + у
(2)
5. Находим массы раствора второго и массу находящегося в нем вещества NaCl:
mр-ра2 = mр-ра1 + mдоб = 200г + у;
mр.в2 = mр.в1 + mдоб = 10 + у.
Данные подставляем в таблицу (2)
6. Неизвестны два компонента раствора: mр.в2 и mр-ра2. Составляем алгебраическое уравнение и решаем его. Находим "у".
mр.в2 = ω2 · mр-ра2;
10 + у = 0,1(200 + у)
у = 11,1г. Т.е. масса добавленной соли равна 11,1г
Ответ: mдоб(NaCl) = 11,1г.
Сложнее всего решение задач с участием кристаллогидратов. В этом случае ребята должны уметь использовать следующие соотношения:
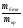 =
= 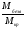 mбезв - масса безводной соли (г)
mбезв - масса безводной соли (г)
mкр - масса кристаллогидрата (г)
М - их молярные массы (г/моль).
Научить необходимо сравнивать и количества веществ безводной соли и образованного ей кристаллогидрата:
CuSO4 · 5H2O
медный купорос
КCr(SO4)2 · 12 H2O
хромо-калиевые квасцы
ν(CuSO4) = ν(CuSO4 · 5H2O)
в купоросе
ν(К2SO4) =  ν(КCr(SO4)2 · 12 H2O)
ν(КCr(SO4)2 · 12 H2O)
в квасцах
Задача 3. Необходимо приготовить 100г 5% раствора сульфата меди (II). Определить массу медного купороса необходимого для этого.
Дано:
mр-ра = 100г
ω(CuSO4) = 0,05
m(CuSO4 · 5H2O) =?
1. Записываем условие задачи. Анализируем его. Видим, что готовят раствор сульфата меди, используя не безводную соль, а кристаллогидрат.
Но таблица, предложенная нами, приемлема лишь для безводных солей. И все три параметра должны касаться только сульфата меди. Поэтому можно воспользоваться формулой соотношения масс CuSO4 и кристаллогидрата и найти массу безводной соли:
Пусть масса CuSO4 · 5H2O равна "х"г
ω
CuSO4
mр.в
CuSO4
mр-р
CuSO4
0,05
0,64х
100
М(CuSO4) = 160г/моль
Мкр = 250г/моль
mб = 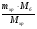 =
= 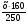 = 0,64х
= 0,64х
2. Составляем алгебраическое уравнение и решаем его:
mр.в(CuSO4) = ω(CuSO4) · mр-ра
0,64х = 0,05 · 100
х = 7,8г CuSO4 · 5H2O.
Ответ: m(CuSO4 · 5H2O) = 7,8г
И только после того, как усвоены решения таких задач ребята могут перейти к решению более сложных - уровня районной или окружной олимпиад.
Рассмотрим одну из них.
Задача 4. Необходимо приготовить 100г 5% раствора CuSO4. Определить массу медного купороса, который необходимо добавить к полученному раствору, чтоб концентрация растворенного вещества в нем удвоилась.
Предыдущие задачи были подготовкой к этой. Первую часть задачи мы уже решили. Для приготовления 100г 5% раствора необходимо взять 7,8г CuSO4 · 5H2O (см. решение задачи 3).
Переходим к решению второй части этой задачи. Мы видим, что при добавлении CuSO4 · 5H2O получается второй раствор.
1. Рассмотрим все 3 компонента раствора №2.
2. Масса добавленного кристаллогидрата "х"г.
ω2
CuSO4
mр.в2
CuSO4
mр-ра2
0,1
5 + 0,64х
100 + х
mр-ра2 = mр-ра1 + mдоб = 100 + х
3. Массу добавленной безводной
соли CuSO4 можно найти по
формуле:
mдоб(CuSO4) = 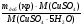 =
= 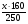 = 0,64х(г).
= 0,64х(г).
4. Находим массу растворенного вещества CuSO4 во втором растворе:
mр.в(CuSO4)2 = mр.в(CuSO4)1 + mдоб(CuSO4) = 10 + 0,64х.
5. Составим алгебраическое уравнение, т.к. неизвестными являются 2 компонента раствора:
mр.в2 = ω2 · mр-ра2
(5 + 0,64х) = 0,1(100 + х). Решая его, получим
х = 1,85г.
Ответ: mдоб.кр = 1,85г.
Для решения этой задачи можно использовать и известный вам прямоугольник Пирсона. Например, из 64% и 5% растворов CuSO4 необходимо приготовить 100г 10% р-ра CuSO4

mр-ра2 = 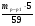 =
= 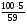 = 8,5г;
= 8,5г;
mр-ра1 = 100г - 8,5 = 91,5г.
Ответ: mдоб(CuSO4 · 5H2O) = 9,26г.
Переходим к решению задач с участием растворов, между которыми возможны химические реакции. Здесь важно хорошо знать теорию химии. Анализируя условия задач, уметь находить избыток вещества и правильно сориентироваться в их решении:
Задача 5. Через 200г 8% раствора NaOH пропустили 5,6л СО2. Определить массовые доли растворенных веществ в полученном растворе.
1. Записываем условие задачи:
Дано:
mр-ра(NaOH) = 200г
ω(NaOH) = 0,08
V(СО2) = 5,6л
ω1( ) = ?
ω2( ) = ?
2. По условию задачи мы не можем определить, какие вещества содержаться в полученном растворе.
3. Предполагаем возможные реакции, нумеруем их.
а) NaOH в избытке:
(1) СО2 + 2NaOH = Na2СО3 + Н2О
б) NaOH в недостатке:
(2) СО2 + NaOH = NaНСО3
(3) NaНСО3 + NaOH = Na2СО3 + Н2О
4. Рассчитав количество каждого из участвующих веществ, находим, какие из трех реакции идут:
ν(NaOH) = 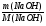 =
= 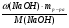 =
= 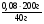 = 0,4моля;
= 0,4моля;
ν(СО2) = 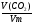 =
= 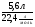 = 0,25моль.
= 0,25моль.
5. Исследуем возможность протекания реакций (1) - (3).
Для первой реакции на 1 моль СО2 требуется 2 моля NaOH. То есть, если ν(СО2)=0,25 моль, то ν(NaOH) должно быть 0,5 молей, а у нас только 0,4 моля, - первая не идет. Если идет только вторая реакция, то ν(NaOH) = ν(СО2) = 0,25молей. Следовательно, идет вторая и третья реакции, щелочи хватает на обе.
(2) СО2 + NaOH = NaНСО3
ν=1моль ν=1моль ν=1моль
(3) NaНСО3 + NaOH = Na2СО3 + Н2О
ν=1моль ν=1моль ν=1моль
6. Одной из солей в полученном растворе является карбонат натрия Na2СО3. Чтоб найти ее количество, необходимо проверить вещества на избыток:
ν(NaOH)х.р2 = ν(СО2)х.р2 = ν(NaНСО3)2 = 0,25моль;
ν(NaOH)ост. = ν(NaOH)всего - ν(NaOH)х.р2 = 0,4 - 0,25 = 0,15моль;
ν(NaНСО3)х.р3 = ν(NaOH)х.р3 = ν(NaOH)ост. = 0,15моль;
ν(Na2СО3)3 = ν(NaOH)3 = 0,15моль;
ν(NaНСО3)ост. = ν(NaНСО3)2 - ν(NaНСО3)х.р3 = 0,25 - 0,15 = 0,1моль,
т.е. в растворе конечном содержится Na2СО3 в количестве 0,15моль и NaНСО3 количеством 0,1моль.
7. Находим массовые доли веществ в полученном растворе:
ω(Na2СО3), ω(NaНСО3)ост.
mр-ра=m(NaOH)р-ра+m(СО2)=m(NaOH)р-р+ν·М(СО2)=200г+0,25моль·44г/моль=211г;
ω(Na2СО3) = 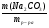 =
= 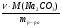 =
= 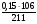 = 0,075 (7,5%);
= 0,075 (7,5%);
ω(NaНСО3)ост. = 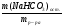 =
= 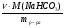 =
= 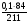 = 0,04 (4%).
= 0,04 (4%).
Ответ: ω%(Na2СО3) = 7,5%, ω(NaНСО3) = 4%.
Необходимо научить учащихся производить расчеты не только процентной, но и молярной концентрации раствора по формулам:
С = 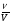 ; ν = С · V.
; ν = С · V.
Предлагаю методику решения задачи, которая поможет понять основные моменты работы с такими растворами.
Задача 21. Определить молярную концентрацию раствора соляной кислоты, пошедшей на нейтрализацию 50г щелочи натрия, если известно, что объем раствора кислоты составил 500мл.
1. Записываем условие задачи и уравнение реакции нейтрализации:
Дано:
m(NaOH) = 50г
Vр-ра(HCl) = 0,5л
С(HCl) = ?
HCl + NaOH = NaCl + Н2О
ν=1моль ν=1моль
2. Записываем ведущую формулу нахождения молярной концентрации вещества:
(2) С(HCl) = 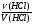 3. Для решения необходимо найти количество соляной кислоты, сравнив его с количеством щелочи, вступившей в химическую реакцию:
3. Для решения необходимо найти количество соляной кислоты, сравнив его с количеством щелочи, вступившей в химическую реакцию:
ν(HCl) = ν(NaOH) = 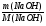 =
= 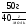 = 1,25моль
= 1,25моль
4. Находим молярную концентрацию кислоты, используя ведущую формулу (2). Не забывайте объем раствора выразить в литрах.
С(HCl) = 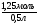 = 2,5моль/л.
= 2,5моль/л.
В 9 классе мы изучаем теорию электролитической диссоциации, поэтому необходимо научить ребят работать и по ионным уравнениям реакций, определять число и массу ионов, участвующих в реакциях, используя все те же уравнения связи, которыми мы пользуемся с 8-го класса.
Задача 23. ( Определить состав и число частиц, содержащихся в 200г 24,5% раствора серной кислоты. Как изменится качественный и количественный состав раствора, если к нему прилить 200г 10% раствора гидроксида натрия.
1. Записываем условие задачи:
Дано:
mр-ра(H2SO4) = 200г
ω(H2SO4) = 0,245
mр-ра(NaOH) = 200г
ω(NaOH) = 0,1
N1(Н+)=?, N1(SO4-2)=?
N2(Н+)=?, N2(SO4-2)=?
2. Решаем первую часть задачи, определяя компоненты раствора кислоты:
H2SO4 → 2 Н+ + SO4-2
ν=1моль ν=2моль ν=1моль
mр.в(H2SO4) = mр-ра · ω(H2SO4) = 200 · 0,245 = 49г;
ν(H2SO4) = 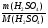 =
= 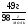 = 0,5моль.
= 0,5моль.
3. Качественный состав раствора серной кислоты видим из уравнения Э.Д.: ионы водорода и сульфат-ионы. Найдем число этих ионов:
Ведущие формулы: N1(Н+) = ν(Н+)1 · Na, N1(SO4-2) = ν(SO4-2)1 · Na
ν(Н+) = 2ν(H2SO4) = 0,5 · 2 = 1моль; ν(SO4-2) = ν(H2SO4) = 0,5моль.
N1(Н+) = 1моль · 6,02 · 1023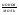 = 6,02 · 1023ионов;
= 6,02 · 1023ионов;
N1(SO4-2) = 0,5моль · 6,02 · 1023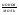 = 3,01 · 1023ионов.
= 3,01 · 1023ионов.
4. Переходим к решению второй части задачи. Качественный и количественный состав раствора меняется, т.к. идет реакция нейтрализации:
(1) H2SO4 + 2NaOH = Na2SO4 + 2Н2О
ν=1моль ν=2моль ν=1моль
(2) H2SO4 + NaOH = NaHSO4 + Н2О.
5. Находим массу и количество гидроксида, нейтрализующего серную кислоту:
mр.в(NaOH) = ω(NaOH) · mр-ра(NaOH) = 0,1 · 200 = 20г;
ν(NaOH) = 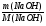 =
= 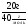 = 0,5моль.
= 0,5моль.
6. ν(NaOH) = ν(H2SO4) = 0,5моль,
следовательно, идет (2) реакция:
(2) H2SO4 + NaOH = NaHSO4 + 2Н2О
ν=1моль ν=1моль
Кислота и щелочь израсходованы полностью. В растворе появилось новое вещество NaHSO4. Пишем уравнение его диссоциации:
NaHSO4 → Na+ + H+ + SO4-2
ν=1моль 1моль 1моль 1моль
7. Находим количество и число образовавшихсяионов:
ν(H+) = ν(NaHSO4)2 = ν(NaOH)2 = 0,5моль;
N(H+) = ν(H+) · Na = 0,5моль · 6,02 · 1023 = 3,01 · 1023ионов.
= 3,01 · 1023ионов.
Видим, что число ионов H+ уменьшилось в 2 раза во время реакции.
ν(SO4-2) = ν(NaHSO4)2 = 0,5моль
N(SO4-2) = ν(SO4-2) · Na = 0,5моль · 6,02 · 1023 = 3,01 · 1023ионов.
= 3,01 · 1023ионов.
Число ионов SO4-2 не изменилось.
ν(Na+) = ν(NaHSO4)2 = 0,5моль;
N(Na+) = ν(Na+) · Na = 0,5моль · 6,02 · 1023 = 3,01 · 1023ионов.
= 3,01 · 1023ионов.
Появились новые ионы Na+ в растворе.
Ответ: N(Na+) = N(H+) = N(SO4-2) = 3,01 · 1023ионов.
Вызывают затруднения у учащихся решение задач на именение массы пластинки (∆m). Научите их пользоваться формулой:
ν = 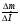 , ∆М - разница молярных масс веществ, у которых идет изменение массы. Предлагаю решение задачи № 26 (см. приложение № 2).
, ∆М - разница молярных масс веществ, у которых идет изменение массы. Предлагаю решение задачи № 26 (см. приложение № 2).
Задача 26. В 200 мл раствора CuSO4 поместили железную пластинку. После обесцвечивания раствора пластинку вынули, высушили и взвесили. Масса ее увеличилась на 2г. Определите молярную концентрацию раствора CuSO4.
1. Выполним рисунок, показывающий изменение массы пластинки.
Увеличение массы пластинки происходит за счет того,
что Ar(Fe), растворившегося в соли меньше, чем Ar(Cu),
выделившейся на пластинке во время химической реакции. Уменьшение массы пластинки происходит, когда на ней оседает металл более легкий, чем тот, из чего она изготовлена.
2. Запишем уравнение реакции:
CuSO4 + Fe = FeSO4 + Cu
ν=1моль 1моль 1моль 1моль
Дано:
Vр-ра(CuSO4) = 0,2л
∆m = 2г
С(CuSO4) = ?
3. Ведущая формула нахождения молярной концентрации следующая:
С(CuSO4) = 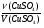
4. Находим количество CuSO4 через количество металла растворившегося и осевшего на пластинке:
ν(CuSO4) = ν(Fe)х.р = ν(Cu)х.р = 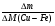 =
= 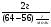 = 0,25моль.
= 0,25моль.
5. Находим молярную концентрацию CuSO4 по ведущей формуле (3)
С(CuSO4) = 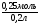 = 1,25моль/л.
= 1,25моль/л.
Ответ: С(CuSO4) = 1,25моль/л.
А сейчас можно приступить и к решению более сложных задач (см. приложение № 2) №№ 23 - 29. И вы смело можете сдавать экзамены в ВУЗ или участвовать на олимпиаде.
Задача 28. (II тур Всероссийской олимпиады 1998г). Продукты полно сгорания 3,36л сероводорода (н.у.) в избытке кислорода поглощены 50,4мл 23% раствора гидроксида калия (ρ = 1,21г/мл). Вычислите массовые доли веществ в полученном растворе и массу осадка, который выделится при обработке этого раствора избытком гидроксида кальция.
1. Записываем условия задачи и все возможные уравнения реакций, происходящих между веществами.
Дано:
V(Н2S) = 3,36л
Vр-ра(КОН) = 50,4мл
ω(КОН) = 0,23
ρ(КОН) = 1,21г/мл.
ω1(КОН) = ?
ω2( ) = ?, mос. = ?
Массовые доли каких веществ будем находить мы сможем узнать, исследовав химическую сторону реакции и произведя простейшие расчеты:
(1) Н2S + 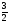 О2 → SO2 + H2O
О2 → SO2 + H2O
ν=1моль ν=1моль
(2) SO2 + КОН = КНSO3 нет
(3) SO2 + 2КОН = К2SO3 + H2O, если КОН в избытке.
(4) КНSO3 + КОН = К2SO3 + H2O, если КОН остался после (2) реакции, нет.
2. Чтоб отбросить реакции, которые не идут, найдем количество веществ, участвующих в них:
ν(Н2S) = 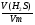 =
= 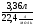 = 0,016 моль;
= 0,016 моль;
ν(КОН) = 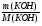 =
= 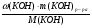 =
= 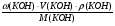 =
= 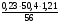 = 0,25 моль.
= 0,25 моль.
3. Находим количество SO2 полученного в (1) реакции:
ν(SO2)1 = ν(Н2S) = 0,016 моль.
4. Видим, что количество КОН равное 0,25 моль достаточно, чтоб полностью нейтрализовать SO2, поэтому идет (3) реакция, а (2) и (4) нет:
(3) SO2 + 2КОН = К2SO3 + Н2О
5. Находим ν(КОН) вступившее в реакцию и оставшееся после ее окончания:
ν(КОН)3 = 2ν(SO2) = 0,016 моль · 2 = 0,032 моль;
ν(КОН)ост. = 0,25 - 0,032 = 0,218 моль.
Найдем массу раствора:
mр-ра = m(SO2) + mр-ра(КОН) = ν · М(SO2) + V · ρ(КОН) = 1,02г + 60,98г = 62г.
6. Еще одна химическая реакция идет при обработке конечного раствора гидроксидом кальция.
(4) К2SO3 + Са(ОН)2 = СаSO3 ↓ + 2КОН
ν=1моль ν=1моль
7. Гидроксид кальция в избытке, поэтому К2SO3 израсходуется весь, а в растворе выпадет осадок СаSO3.
Найдем количество и массу осадка:
ν(СаSO3) = ν(К2SO3) = ν(SO2)3 = 0,016 моль;
m(СаSO3) = ν(СаSO3) · М(СаSO3) = 0,016 моль · 120г/моль = 1,92г.
ω(КОН) = 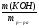 =
= 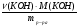 =
= 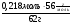 = 0,20 (20%).
= 0,20 (20%).
Больше в растворе нет никаких веществ.
Ответ: ω%(КОН) = 20%, m(СаSO3) = 1,92г.
Итак, мы с вами в определенном порядке прорешали различные виды задач прямого расчетного действия. Это является хорошей подготовкой для решения задач с участием смесей веществ.
§5. Методика решения задач с участием смесей веществ
Уравнения связи, применяемые для решения задач с участием смесей веществ:
-
m(смеси) = m1 + m2 = ν1·М1 + ν2·М2 ;
-
V(смеси) = V1 + V2 = ν1·Vm + ν2·Vm , т.е. ν(смеси) = ν1 + ν2
-
М(смеси) = Дн2(смеси) · 2 , М(см) = Дв(см) · 29
М - молярная масса смеси газов - т.е. масса одного моля смеси.
m = М, если ν(смеси) = 1 моль;
4) Расчет массовой и объемной доли компонентов смеси:
ω(Э) =  , φ(Э) =
, φ(Э) = 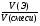 =
= ![]() .
.
Задачи с участием смеси веществ можно разделить на три типа:
-
Истинные смеси
-
Псевдосмеси
-
Задачи, маскирующиеся под смеси.
Задачи первого типа необходимо решать путем введения определенного числа условно известных величин (х, у, z) и составления соответствующего числа уравнений реакций с их участием.
Задачи второго типа можно решать как задачи прямого расчетного действия - путем постепенного нахождения компонентов смеси. Или пользуясь методикой решения задач первого типа.
Задачи третьего типа решают обычным путем - прямыми расчетами.
Рассмотрим методику решения задач первого типа - истинные смеси.
Задача 1. Для полного хлорирования 2,4г смеси железа и меди потребовалось 1,12л хлора. Определить массовые доли металлов в смеси.
Дано:
m(см) = 2,4г
V(Cl2) = 1,12л
ω(Fe) = ? ω(Cu) = ?
Решение:
1. Ведущие формулы нахождения массовой доли металлов в смеси:
ω(Fe) = 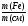 =
= 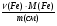 ; ω(Cu) =
; ω(Cu) = 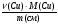 .
.
2. Записываем уравнения химических реакций:
(1) Cu + Cl2CuCl2![]()
ν=1моль ν=1моль
(2) Fe + 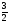 Cl2FeCl3
Cl2FeCl3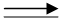
ν=1моль ν=1,5моль
3. Вводим неизвестные - столько, сколько веществ в смеси, т.е. два. Мы видим по ведущим формулам, что необходимо найти количества металлов в смеси.
ν(Cu) = х моль, ν(Fe) = у моль.
4. Учитывая, что m = М · ν и, используя уравнение связи, составляем первое уравнение системы:
М(Fe) = 56г/моль, М(Cu) = 64г/моль.
m(смеси) = m(Fe) + m(Cu) = ν(Fe) · М(Fe) + ν(Cu) · М(Cu)
2,4г = 64х + 56у
5. Находим количество вещества хлора, участвующего в реакциях:
ν(Cl2) = 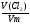 =
= 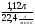 = 0,05 моль;
= 0,05 моль;
ν(Cl2)1 = ν(Сu)1 = х моль - количество хлора, участвующего в первой реакции;
ν(Cl2)2 = 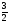 ν(Fe)2 =
ν(Fe)2 = 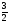 у моль - количество хлора во второй реакции.
у моль - количество хлора во второй реакции.
6. Составляем второе уравнение системы:
ν(Cl2)1,2 = ν(Cl2)1 + ν(Cl2)2
0,05 = х + 1,5у (моль)
7. Составляем систему из двух уравнений с двумя неизвестными:
64х + 56у = 2,4
х + 1,5у = 0,05, решаем ее:
х = 0,02 (моль), у = 0,02 (моль).
8. Рассчитываем массовые доли компонентов смеси:
ω(Cu) = 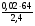 = 0,53 (53%), ω(Fe) = 0,47 (47%).
= 0,53 (53%), ω(Fe) = 0,47 (47%).
Ответ: массовые доли меди и железа соответственно равны 53% и 47%.
При решении задач на трехкомпонентные смеси вводим три неизвестных (х, у, z) и составляем, согласно условиям задачи, три уравнения реакций, включающие неизвестные (х, у, z) и решаем алгебраическим способом систему уравнений.
Приведем пример второго типа задач - с участием псевдосмесей.
Задача 2. Определить количественный состав смеси, состоящей из железа, меди и алюминия, если известно, что при окислении этой смеси избытком кислорода при нагревании в реакцию вступает 5,32л кислорода, а при взаимодействии такой же навески смеси с соляной кислотой потребовалось 99,55мл ее раствора с массовой долей 20% (ρ = 1,1г/мл.). При действии на такую же навеску раствора гидроксида натрия выделилось 1,12л водорода (н.у.).
Дано:
V(О2) = 5,32л
V(НCl) = 99,55мл
ω%(HCl) = 20%
ρ(HCl) = 1,1г/мл
V(H2) = 1,12л
ω(Fe) = ?
ω(Cu) = ?
ω(Аl) = ?
1. Запишем уравнения химических реакций и пронумеруем их:
(1) 2Cu + O2 = 2CuO
(2) 2Fe + 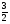 O2 = Fe2O3
O2 = Fe2O3
(3) 2Al + 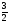 O2 = Al2O3
O2 = Al2O3
(4) Fe + 2HCl = FeCl2 + H2
(5) Al + 3HCl = AlCl3 + 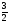 H2
H2
(6) Al + 3NaOH + 3H2O = 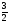 H2 + Na3[Al(OH)6]
H2 + Na3[Al(OH)6]
Эта задача с трехкомпонентной смесью. Но решать ее надо прямым математическим расчетом. Анализируя условие задачи, видим, что по (6) уравнению можно найти массу алюминия в смеси, зная объем выделившегося водорода.
По (5) уравнению находим массу кислоты, вступившей в реакцию с алюминием и оставшейся для реакции с железом.
По (4) уравнению находим массу железа, прореагировавшего с кислотой. И массу меди находим по (1) уравнению, рассчитав предварительно объем кислорода, прореагировавшего с железом и алюминием и оставшегося для окисления меди.
Все эти расчеты могут быть выполнены благодаря обычным решениям пропорций по уравнению реакции.
Третий тип задач, маскирующихся под смеси, включает дополнительные условия, позволяющие решить задачу, не используя систему уравнений с неизвестными.
Задача 3. Газы, полученные при разложении 27,3г смеси нитрата натрия и нитрата меди (II) были пропущены через 115,2мл. воды. При этом 1,12л газа осталось не поглощенной. Определить масса нитратов в исходной смеси.
Дано:
m(см) = 27,3г
V(H2О) = 115,2л
V(газа)ост = 1,12л
m(NaNO3) = ?
m(Cu(NO3)2) = ?
Решение:
1. Запишем уравнения химических реакций, пронумеровав их:
(1) 2NaNO3 = 2NaNO2 + О2
(2) 2Cu(NO3)2 = 2CuO + 4NO2 + О2
(3) 4NO2 + 2Н2О + О2 = 4НNО3
2. Вводим неизвестные: ν(NaNO3) = х моль
ν(Cu(NO3)2) = у моль
3. Используя уравнение связи, составляем уравнение:
m(смеси) = m(NaNO3) + m(Cu(NO3)2) = ν · М(NaNO3) + ν · М(Cu(NO3)2)
(4) 27,3(г) = 85х + 188у
4. Находим количество воды:
ν(Н2О) = 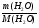 =
= 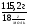 = 6,4 моль
= 6,4 моль
Воды много, поэтому весь оксид азота (IV) поглотился.
5. Находим количество оставшегося газа - кислорода:
ν(О2)ост = 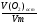 =
= 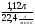 = 0,05 моль;
= 0,05 моль;
ν(О2)ост = ν(О2)1 + ν(О2)2 - ν(О2)3;
ν(О2)1 = 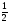 ν(NaNO3) = 0,5х;
ν(NaNO3) = 0,5х;
ν(О2)2 =  ν(Cu(NO3)2) = 0,5у;
ν(Cu(NO3)2) = 0,5у;
ν(О2)3 = 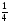 ν(NO2)3 =
ν(NO2)3 = 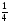 ν(NO2)2 =
ν(NO2)2 = 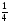 2у = 0,5у;
2у = 0,5у;
ν(О2)ост = 0,5х + 0,5у - 0,5у = 0,05
0,5х = 0,05
х = 0,1 моль - это количество NaNO3
у = 0,1 моль - количество Cu(NO3)2 из (4) уравнения нашли.
6. Находим массы нитратов в смеси:
m(NaNO3) = ν · М(NaNO3) = 0,1 моль · 85г/моль = 8,5г;
m(Cu(NO3)2) = ν · М(Cu(NO3)2) = 0,1 моль · 188г/моль = 18,8г.
Ответ: m(NaNO3) = 8,5г; m(Cu(NO3)2) = 18,8г.
Методика решения задач с участием смесей газообразных веществ имеет некоторые особенности. Если в условии задачи известна относительная плотность газовой смеси, то объемные доли газов в смеси легко вычислить, используя все те же уравнения связи, что и при решении задач на обычные смеси: m(см) = m1 + m2 + m3 … ν(см) = ν1 + ν2 + ν3 …
Логическая схема решения задач
1. Сначала по плотности находим молярную массу смеси:
М(см) = Дн2 · 2г/моль; М(см) = До2 · 32г/моль; М(см) = Дне · 4г/моль.
Молярная масса смеси - это масса 1 моля ее, т.е. если количество смеси 1 моль, то m(см) = М(см).
2. Количество одного из компонентов принимаем за х молей, тогда количество другого (1 - х) молей. Подставляем все эти значения массы, количества и молярной массы в уравнение: m(см) = m1 + m2 = ν1М1 + ν2М2, решая его находим количество каждого компонента.
3. Объемные доли газов можно найти по формуле:
φ1 = 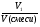 =
= 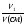 , где φ1 - объемная доля одного из компонентов смеси.
, где φ1 - объемная доля одного из компонентов смеси.
Начинать обучение учащихся этому виду задач необходимо с самой легкой, где в условии задачи предложена лишь относительная плотность газовой смеси.
Задача 8. Относительная плотность по водороду смеси оксидов азота (II) и (IV) равна 16,25. Определить объемные доли газов в смеси.
Дано:
Дн2(см NO,NO2)=16,25
φ(NO) = ? φ(NO2) = ?
Решение:
Ведущие формулы нахождения объемных долей:
φ(NO) = 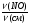 , φ(NO2) =
, φ(NO2) = 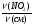 .
.
Т.е. если мы найдем количество каждого оксида в смеси, то объемные доли легко вычислим.
1. Зная относительную плотность смеси, находим ее молярную массу:
М(см) = Дн2(см) · 2 = 16,25 · 2 = 32,5(г/моль).
2. Молярная масса смеси - это масса одного моля ее, т.е. если ν(см) = 1 моль, то m(см) = 32,5г, если ν(NO) = х (моль), ν(NO2) = (1 - х) моль
3. Массу смеси находят по уравнению:
m(см) = m(NO) + m(NO2) = ν(NO) · М(NO) + ν(NO2) · М(NO2)
подставляем в это уравнение связи все известные компоненты m, ν и М газов:
4. Решаем его и находим значение х - количество NO
32,5 = 30х + (1 - х)46
32,5 = 30х + 46 - 46х
16х = 13,5
х = 0,84 моля - ν(NO)
ν(NO2) = 1 - х = 1 - 0,84 = 0,16 (моль).
5. Находим объемные доли газов по ведущим формулам:
φ(NO) = 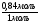 = 0,84 (84%);
= 0,84 (84%);
φ(NO2) = 0,16 (16%).
Ответ: φ%(NO) = 84%, φ(NO2) = 16%.
Усложняем условие задачи. Пусть газы, находящиеся в смеси вступят в химическую реакцию. Чаще всего в реакцию газы вступают неполностью, поэтому изменяется их плотность и можно определить выход реакции по формуле: η = 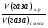 .
.
νх.р - количество газа вступившего в реакцию
νв смеси - количество газа в смеси
η - выход реакции
Для решения таких задач необходимо знать не только их объемные доли, но и настоящие объемы или массы этих веществ.
Задача 9. Относительная плотность по водороду смеси оксида углерода (II) и кислорода равна 15. Определить как измениться ее значение после протекания реакции окисления оксида углерода (II).
Дано:
Дн2(см1) = 15
Дн2(см2) = ?
Решение:
1. Находим молярную массу смеси СО и О2
М(см1) = Дн2(см1) · 2 = 15 · 2 = 30г/моль.
Т.е. если ν(см1) = 1 моль, то m(см1) = 30г.
Пусть ν(СО) = х моль, тогда ν(О2) = 1 - х моль.
2. Пользуясь уравнением связи массы смеси и масс компонентов смеси, находим количество СО и О2 в расчете на 1 моль смеси:
m(см) = m(СО) + m(О2) = ν(СО) · М(СО) + ν(О2) · М(О2)
30 = 28х + (1 - х)32
х = 0,5 моль - ν(СО)
ν(О2) = 0,5 моль
3. Искомое количество смеси СО и О2 не 1 моль а "у" молей, поэтому:
ν(СО) = 0,5у (моль) и ν(О2) = 0,5у (моль).
4. Как изменится состав смеси после протекания реакции, узнаем, записав уравнение ее реакции:
2СО + О2 = 2СО2
ν=2моля 1моль 2моля
Состав конечной газовой смеси: СО2, О2 оставшийся.
5. Найдем сколько в смеси каждого компонента:
ν(СО)х.р = 0,5у (моль)
ν(О2)х.р =  ν(СО)х.р = 0,25у (моль)
ν(СО)х.р = 0,25у (моль)
ν(СО1) = ν(СО) = 0,5у (моль)
Находим количество оставшегося после реакции О2:
ν(О2)ост = ν(О2)всего - ν(О2)х.р = 0,5у - 0,25у = 0,25у (моль)
6. Относительную плотность смеси мы можем найти, рассчитав молярную массу смеси: М(см2) = 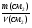
m(см2) = m(О2)ост + m(СО2) = ν(О2)ост · М(О2) + ν(СО2) · М(СО2) =
= 0,25у · 32 + 0,5у · 44 = 30у (г);
ν(см2) = ν(О2)ост + ν(СО2) = 0,25у + 0,5у = 0,75у (моль);
М(см2) = 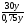 = 40 (г/моль);
= 40 (г/моль);
Д(см2) = 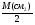 =
= 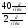 = 20.
= 20.
Ответ: Дн2(см2) = 20.
На состояние газовых смесей влияют давление и температура, поэтому часто при решении задач пользуемся формулой вычислений количества вещества, используя эти значения:
ν = 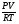
Олимпиадные задачи часто строятся с учетом этих условий протекания реакции.
Рассмотрим методику решения одной из задач, предлагаемых на олимпиадах.
Задача. (районная олимпиада 2000г). Представьте, что Вы - инженер-технолог и решаете одну из сложнейших задач - проблему химического связывания азота. Для подготовки к великому действу попробуем осилить задачу следующего содержания.
Смесь азота и водорода с плотностью по водороду 3,6 массой 72кг при температуре 450 0С и давлением 30КПа пропустили под катализатором (смесь Fe с оксидом калия и алюминия). Определить массовую долю выхода реакции, если известно, что объем полученной газовой смеси при тех же условиях был равен 1 723л.
Дано:
Дн2(см1) = 3,6
m(см1) = 72кг
t = 4500С
Р = 30КПа
V(см2) = 1 723л
η = ?
Решение:
1. Запишем уравнение реакции: N2 + 3Н2 → 2NН3
Плотность по водороду у первоначальной смеси дает нам ее процентный состав:
М(см1) = Дн2(см1) · 2 = 3,6 · 2 = 7,2г/моль
если ν(см1) = 1 моль, то m(см1) = 7,2г
m(см2) = m(О2)ост + m(СО2) = 0,25у · 32 + 0,5у · 44
m(см1) = m(N2) + m(Н2)
если ν(N2) = х моль, то ν(Н2) = (1 - х) моль
7,2 = 28х + 2(1 - х) = 7,2
х = 0,2
ν(N2) = 0,2 моля, ν(Н2) = 0,8 молей, т.е. в смеси 20% N2 и 80% Н2
2. Если количество смеси было z молей, а ее масса 72кг, то уравнение следующее получаем:
72 000 = 0,2z · 28 + 0,8z · 2
z = 10 000 моль
Азота в смеси 2 000 моль
Водорода в смеси 8 000 моль
3. Находим количество смеси после реакции:
ν(см2) = 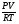 =
= 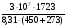 = 8 600 (моль). (ν(NH3), ν(Н2)ост., ν(N2)ост.).
= 8 600 (моль). (ν(NH3), ν(Н2)ост., ν(N2)ост.).
4. Пусть прореагировало "у" молей азота, тогда:
ν(Н2)х.р. = 3ν(N2) = 3у (моль);
ν(NН3) = 2ν(N2) = 2у (моль);
ν(остН2) = 2 000 - 2у (моль);
ν(остN2) = 8 000 - у (моль).
5. Составляем уравнение и решаем его:
ν(см2) = ν(NН3) + ν(Н2)ост + ν(N2)ост
8 600 = 2у + (2 000 - 3у) + (8 000 - у)
у = 700 моль.
6. Азота прореагировало 700 молей, а было в первоначальной смеси 2 000 молей. Находим выход реакции:
η = 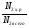 =
= 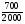 = 0,35 (35%)
= 0,35 (35%)
Ответ: выход реакции 35%.
Как видите, предлагаемая методика решения задач всех трех типов, предполагает работу по химическим уравнениям связи. Отступая от привычных пропорций. Она позволяет понять значимость химических величин, особенно, одной из самых важных - количество взятого для реакции вещества ν. Решение химических задач требует большого внимания, логического мышления, творчества и, что очень важно, трудолюбия.
Познакомившись с одним типом задач, необходимо прорешать как можно больше подобных с изменением тех или иных значений в их условии. Еще лучше попытаться самим составить условия задачи. Подойти к этому творчески и, поверьте, появится желание решать их снова и снова.
Научившись решать все три типа задач. Можно быть уверенным, что задачи, предлагаемые в блоке "C" единого экзамена не покажутся Вам слишком сложными.
§6. Задачи, предлагаемые на ЕГЭ по химии в блоке "C"
Задания блока "С" с развернутым ответом по своему содержанию соответствуют достаточно сложным заданиям, которые предлагают на вступительных экзаменах в вузах. При решении задач учащиеся должны уметь производить расчеты по определению молекулярной формулы вещества, объемных отношений газов при химических реакциях. Необходимо уметь решать задачи прямого расчетного действия и с участием смесей веществ.
Рассмотрим некоторые из них.
Задача 1. (ЕГЭ 2004). При взаимодействии первичного одноатомного спирта, содержащего 60% углерода и 13,3% водорода, с органической кислотой образовалось вещество, плотность паров которого по водороду равна 58. Определите формулу каждого из веществ, участвующих в реакции, и дайте им названия.
Дано:
ω%(С) = 60%
ω%(Н) =13,3%
Дн2 = 58
СхНуОz = ?
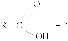
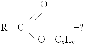
Решение:
1. Используя значения массовых долей элементов, найдем соотношения атомов в молекуле спирта:
Формула спирта - СхНуОz
х : у : z =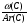 :
: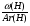 :
: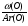 =
=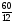 :
: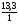 :
: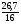 =3 : 8 : 1
=3 : 8 : 1
Формула спирта С3Н7ОН пропанол - 1.
2. Находим молярную массу эфира:
М(эф.) = Дн2 · 2 = 58 · 2 = 116г/моль.
3. Формулу кислоты сможем найти через расчеты молярной массы радикала эфира R - СООС3Н7
М(R) = 116 - 12 - 32 - 43 = 29г/моль;
М(СnH2n+1) = 14n + 1
14n + 1 = 29, n = 2 R - С2Н5, что соответствует пропановой кислоте: С2Н5СООН.
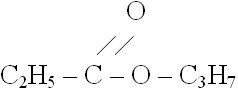
Следовательно, формула эфира:
Это пропиловый эфир пропановой кислоты.
На установление формулы органического вещества в блоке "C" есть и задачи другого вида:
Задача 2. (ЕГЭ, 2004). Установите формулу алкена и продукта взаимодействия его с 1 моль бромоводорода, если это монобромпроизводное имеет Дв = 4,24. Укажите название изомера исходного алкена.
Дано:
Дн2(СnН2n+1B2)=4,24
ν(НВ2) = 1 моль
СnН2n = ?
СnН2n+1B2 = ?
Изомер СnН2n = ?
Решение:
1. По известной плотности определим молярную массу монобромпроизводного СnН2n+1Br двумя способами:
а) М = Дн2 · 29 = 123г/моль.
б) М(СnН2n+1B2) = 12n + 2n + 1 + 80 = 14n + 81.
2. Установим формулу бромалкана, учитывая равенство молярных масс:
14n + 81 = 123, n = 3. Формула: С3Н7В2 бромпропан.
3. Определена формула исходного алкена: С3Н6 пропен.
4. Изомер его - циклопропан 
Используются и объемные отношения газов в задачах такого типа.
Задача 3. Для полного сгорания углеводорода потребуется объем кислорода в 6,5 раз больший, чем объем паров углеводорода в тех же условиях. Напишите возможные структурные формулы и названия, соответствующие этому углеводороду.
Дано:
V(О2) : О(СхНу) = 6,4 : 1
СхНу = ?
1. Запишем уравнения реакции горения углеводорода:
СхНу + (х +  )О2 → хСО2 +
)О2 → хСО2 + 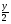 Н2О
Н2О
ν=1моль (х+ )моль
)моль
2. Согласно следствию из закона Авогадро : 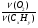 =
= 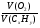
Получаем уравнение с двумя неизвестными:
х +  = 6,5
= 6,5
3. Решаем его методом подбора значений х (1,2,3,4,5,6)
При х = 4 находим целое положительное значение у = 10.
Формула углеводорода С4Н10
4. Структурные формулы: СН3 - СН2 - СН2 - СН3 Н - бутан
2-метилпропан
Рассмотрим решение нескольких задач прямого расчетного действия с участием растворов веществ.
Задача 4. (ЕГЭ, 2004). В 200г 16% раствора сульфата меди поместили железную пластинку массой 50г. Через некоторое время пластинку осторожно вынули, высушили и взвесили. Ее масса оказалась равной 51г. Определить массовые доли соединений в образовавшемся растворе.
Дано:
mр-ра(СuSO4) = 200г
ω(СuSO4) = 0,16
∆m = 1г
ω(FeSO4) = ?
ω(СuSO4)ост = ?
Реакция протекает по уравнению:
СuSO4 + Fe = FeSO4 + Cu.
1. Запишем формулу определения массой доли сульфатов в растворе:
(1) ω(FeSO4) = 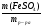 =
= 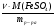 ;
;
(2) ω(СuSO4)ост = 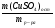 =
= 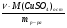 .
.
2. Для решения этой задачи необходимо найти количества участвующих и образовавшихся веществ и массу раствора, которая уменьшилась на 1г.
mр-ра = 200г - 1г = 199г.
ν(FeSO4) = ν(СuSO4)х.р = ν(Fe)х.р = ν(Cu)х.р = 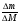 =
= 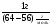 = 0,125 моль.
= 0,125 моль.
3. Находим массовые доли солей в растворе, пользуясь ведущими формулами (1) и (2): ω(FeSO4) = 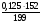 = 0,095 (9,5%);
= 0,095 (9,5%);
Масса СuSO4 - m(СuSO4) = 200 · 0,16 = 32(г);
Масса СuSO4, вступившего в реакцию m(СuSO4)х.р = ν · М = 0,125 · 160 = 20(г);
Масса СuSO4 оставшейся m(СuSO4)ост = 32 - 20 = 12(г);
ω(СuSO4) = 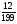 = 0,06 (6%).
= 0,06 (6%).
Ответ: ω%(FeSO4) = 9,5%, ω%(СuSO4) = 6%.
Задача 5. (ЕГЭ, 2002). Какой объем 54%-ного раствора гидроксида калия с плотностью 1,59г/мл потребуется для растворения алюминия, если в результате выделился 1м3 газа (н.у) и образовался тетрагидроксоалюминат калия?
Дано:
ω(КОН) = 0,54
ρ(КОН) = 1,59г/мл
V(газ) = 1м3
Vр-ра(КОН) = ?
1. Запишем уравнение реакции:
КОН + Al + 3Н2О → К[Al(OH)н] + 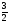 Н2
Н2
ν=1моль ν=1,5моль
2. Ведущая формула определения объема раствора КОН:
(2) Vр-ра = 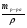 =
= 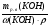 =
= 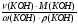 .
.
2. Из него мы видим, что для решения задачи необходимо найти количество гидроксида калия
ν(КОН) =  ν(Н2) =
ν(Н2) =  ·
· 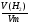 =
= 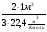 = 0,03 Кмоль.
= 0,03 Кмоль.
3. Масса КОН m(КОН) = ν · М(КОН) = 0,03Кмоль · 56кг/Кмоль = 1,68 кг (1 680г)
4. Находим объем раствора щелочи. Работаем с ведущей формулой (2)
Vр-ра = 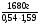 = 1 956,7 мл (≈2л).
= 1 956,7 мл (≈2л).
Ответ: Vр-ра(КОН) = 2л.
Задача 6. (ЕГЭ, 2004). Гидрид кальция внесли в избыток раствора соляной кислоты (масса раствора кислоты 150г, массовая доля НCl 20%). При этом выделилось 6,72л (н.у.) водорода. Рассчитайте массовую долю хлорида кальция в полученном растворе.
Дано:
mр-ра(HCl) = 150г
ω(НCl) = 0,2
V(Н2) = 6,72л
ω(CaCl2) = ?
Решение:
1. Составляем уравнение химической реакции:
CaH2 + 2HCl = CaCl2 + H2 ↑
ν=1моль 2моль ν=1моль
2. Ведущая формула расчета массовой доли соли:
ω(CaCl2) = 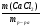 =
= 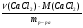 .
.
3. Находим количество хлорида кальция:
ν(CaCl2) = 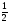 ν(Н2) =
ν(Н2) =  ·
· 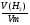 =
= 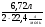 = 0,15 моль.
= 0,15 моль.
4. Находим массу гидрида кальция и массу водорода:
ν(CaH2) =  ν(Н2) = 0,15 моль;
ν(Н2) = 0,15 моль;
m(CaH2) = ν · М(CaH2) = 0,15моль · 42г/моль = 6,3 г;
m(Н2) = ν(Н2) · М(Н2) = 0,3моль · 2г/моль = 0,6 г.
5. Масса раствора:
mр-ра = m(CaH2) + mр-ра(НCl) - m(H2) = 6,3 + 150 - 0,6 = 155,7 (г).
6. Массовую долю хлорида кальция найдем по ведущей формуле (2)
ω(CaCl2) = 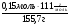 = 0,107 (10,7%).
= 0,107 (10,7%).
Ответ: ω%(CaCl2) = 10,7%.
Как видите, задачи блока "C" единого экзамена можно решать, воспользовавшись методикой, предложенной в работе. Знание теоретического материала, законов химии очень важно для успешного решения задач, поэтому необходимо помимо задач уделять внимание и вопросам теории, выходящей за рамки школьной программы.
Заключение
Изучив методику решения задач прямого расчетного действия, на определение формулы вещества и с участием смесей, можно в заключении сказать, что решение химической задачи любого типа состоит из многих операций, которые должны определенным образом соединяться между собой и применяться в установленной последовательности в соответствии со складывающейся логикой решения. Именно эта последовательность и должна привести к положительному результату. Поэтому очень важно сформировать определенный алгоритм действий при решении задачи. Понять ее суть. Выполнить ее химическую часть, исследовать вероятность всех возможных уравнений реакции, используя математические расчеты. Определив ее тип, решить, подобрав наиболее рациональный способ решения.
Чем тщательнее будет сделан анализ хода решения задачи, тем эффективнее окажется процесс овладения данной методикой. Шаг за шагом, усложняя условие задач, мы должны обращаться к ее алгоритму, чтоб каждая новая задача не показалась учащимся совершенно незнакомой. И, конечно, обязательных условий - прорешивание большого количества задач самими ребятами без нашей помощи.
Из-за ограниченности времени, определенного программой на решение задач, на уроках при изучении каких-либо химических веществ можно включать 1-3 минутные интеллектуальные тренинги (см. приложение), чтоб ребята не забывали основные уравнения связи.
В рамках урока научить учащихся в совершенстве решению всех трех типов задач невозможно. Для тех, кто выбирает своим профилем естественные науки, на занятиях профильных групп обязательно нужно включать методику решения основных типов задач, скорректировав программу. Это также поможет ученикам сдавать выпускные и вступительные экзамены и выступать достойно на химических олимпиадах.
В приложении к работе я предлагаю программу элективного курса для учащихся 9, 10 классов "Секреты химических формул", где в определенной последовательности дана система решения основных типов задач, основанная на программном и выходящем за рамки школьной программы теоретическом материале.
В сценарии учебных занятий курса предусмотрены мини-олимпиады и практические занятия по составлению условия задач силами учащихся для лучшего осмысления их сути.
Вся методика, предложенная в этой работе, включая ее приложение, направлена на то, чтоб "трудная" задача для ребенка стала увлекательной, а не была бы тяжелым камнем, лежащим на его пути.
Знание методики решения задачи и соблюдение определенной последовательности действий в процессе ее решения приведут к получению правильного осмысленного результата. Это поможет ребенку поверить в свои силы, самореализоваться как личности, что и требует современная педагогика. Именно она предлагает нам чаще обращаться к ребенку как субъекту учебной деятельности, как к личности, стремящейся к самоопределению и самоутверждению.
Литература
1. Н.Е. Кузьменко, В.В. Еремин, С.С. Чураков
Сборник конкурсных задач по химии. М.: Экзамен, Оникс 21 век, 2006
2. Г.П. Хомченко, И.Г. Хомченко
Сборник задач по химии для поступающих в вузы. М.: Новая Волна. Оникс, 2013
3. Е.А. Шишкин
Пути решения расчетной задачи / журнал "Химия в школе", № 4, 2005
4. Министерство образования Российской Федерации.
Единый Государственный Экзамен "Интеллект-центр", 2004.
5. Н.Е. Кузьменко, В.В. Еремин
2400 задач по химии. М.: Дрофа, 2006


