- Преподавателю
- Химия
- Рабочая программа по химии 8 класс 2015-2016 уч. год
Рабочая программа по химии 8 класс 2015-2016 уч. год
| Раздел | Химия |
| Класс | 8 класс |
| Тип | Рабочие программы |
| Автор | Шайхуллина З.М. |
| Дата | 14.12.2015 |
| Формат | docx |
| Изображения | Есть |
Приложение №1 к образовательной программе
МУНИЦИПАЛЬНОЕ БЮДЖЕТНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
«СРЕДНЯЯ ШКОЛА №29»
г.Нижневартовск
Рассмотрено:
на заседании МО
протокол №5 от
«25» мая 2015г.
Согласовано:
Зам.дир. по УР _______________.
«27» августа 2015г.
Принято на заседании
педагогического совета
Протокол № 1
от 27.08.2015
УТВЕРЖДАЮ:
Директор МБОУ "СШ №29"
Т.В. Бачинина
Приказ №333 от 27.08. 2015
РАБОЧАЯ ПРОГРАММА ПО ХИМИИ
для 8 класса
(наименование учебного предмета)
Основное общее образование
(уровень образования)
2015-2016 учебный год
(срок реализации программы)
Шайхуллина Зиля Мухарамовна
(Ф.И.О. учителя, составившего рабочую программу)
Оглавление
1. ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Рабочая программа по биологии в 8 классе составлена на основе следующих нормативных документов:
-
Федерального Государственного стандарта.
-
Примерной программы основного общего образования по биологии (базовый уровень)
-
Федерального компонента государственных образовательных стандартов начального общего, основного общего, среднего (общего) образования (Приказ Минобр России № 1019 от 5 марта 2004г
-
Федерального закона об образовании № 273 от 29.12.2012 года
-
Образовательной программы МБОУ «СШ № 29» г. Нижневартовска на 2015-2016 учебный год
Особенность программы состоит в том, что она позволяет сохранить высокий теоретический уровень и сделать обучение максимально развивающим. Это достигается путём вычисления укрупнённой дидактической единицы, в роли которой выступает основополагающее понятие «химический элемент и формы его существования (свободные атомы, простые и сложные вещества)», следования строгой логике принципа развивающего обучения, положенного в основу конструирования программы, и освобождения её от избытка конкретного материала. Поэтому весь теоретический материал курса химии рассматривается на первом году обучения, что позволяет учащимся более осознанно и глубоко изучить фактический материал - химию элементов и их соединений.
Наряду с этим такое построение программы даёт возможность развивать полученные первоначально теоретические сведения на богатом фактическом материале химии элементов. Программа построена с учётом реализации межпредметных связей с курсом физики 7 класса, где изучаются основные сведения о строении атомов. Основное содержание курса химии 8 класса составляют сведения о химическом элементе и формах его существования - атомах, изотопах, ионах, простых веществах и их важнейших соединениях (оксидах и других бинарных соединениях, кислотах, основаниях и солях), о строении вещества (типологии химических связей и видах кристаллических решеток), закономерностях протекания реакций и их классификации
Рабочая программа конкретизирует содержание блоков образовательного стандарта, дает распределение учебных часов по крупным разделам курса и последовательность их изучения. Кроме того, программа содержит перечень практических работ по каждому разделу.
Цели и задачи учебного курса химии
-
освоение важнейших знаний об основных понятиях и законах химии,
-
химической символике;
-
овладение умениями наблюдать химические явления, проводить химический эксперимент, производить расчеты на основе химических формул веществ и уравнений химических реакций;
-
развитие познавательных интересов и интеллектуальных способностей в
-
процессе проведения химического эксперимента, самостоятельного приобретения знаний в соответствии с возникающими жизненными потребностями;
-
воспитание отношения к химии как к одному из фундаментальных компонентов естествознания и элементу общечеловеческой культуры;
-
применение полученных знаний и умений для безопасного использования веществ и материалов в быту, сельском хозяйстве и на производстве, решения практических задач в повседневной жизни, предупреждения явлений, наносящих вред здоровью человека и окружающей среде
Промежуточная аттестация проводится в форме тестов, диктантов, практических и проверочных работ.
Итоговая аттестация - в форме контрольной работы.
Материально-техническое обеспечение образовательного процесса:
Специфическое сопровождение (оборудование):
Наглядные пособия:
-
натуральные: гербарии, коллекции минералов и горных пород;
-
рисунки, иллюстрации.
Электронно-программное обеспечение:
-
электронные библиотеки по химии, электронные энциклопедии. специализированные цифровые инструменты учебной деятельности (компьютерные программы);
-
презентации по географии.
Технические средства обучения:
-
компьютер с учебным программным обеспечением;
-
сканер, ксерокс, принтер.
Курс учитывает идеи и положения, способствующие развитию познавательного интереса, устойчивой мотивации к учению, получению практических навыков, необходимых для дальнейшего процесса школьного обучения и в жизни.
2. ОБЩАЯ ХАРАКТЕРИСТИКА ПРЕДМЕТА.
Основное содержание курса химии 8 класса составляют сведения о химическом элементе и формах его существования - атомах, изотопах, ионах, простых веществах и важнейших соединениях элемента (оксидах и других бинарных соединениях, кислотах, основаниях и солях), о строении вещества (типологии химических связей и видах кристаллических решеток), некоторых закономерностях протекания реакций и их классификации.
Весь теоретический материал курса химии для основной школы рассматривается на первом году обучения, что позволяет учащимся более осознанно и глубоко изучить фактический материал - химию элементов и их соединений. Наряду с этим такое построение программы дает возможность развивать полученные первоначально теоретические сведения на богатом фактическом материале химии элементов. В результате выигрывают обе составляющие курса: и теория, и факты.
Программа построена с учетом реализации межпредметных связей с курсом физики 7 класса, где изучаются основные сведения о строении молекул и атомов, и биологии 6-9 классов, где дается знакомство с химической организацией клетки и процессами обмена веществ.
3. МЕСТО КУРСА ХИМИИ В УЧЕБНОМ ПЛАНЕ.
Предмет химия входит в образовательную область «Обществознание». Федеральный базисный учебный план для общеобразовательных учреждений РФ отводит 70 учебных часов для обязательного изучения в основной школы из расчета 2 учебный часа в неделю. Для реализации рабочей программы изучения учебного предмета «Химия» на этапе полного (среднего) общего образования учебным планом школы отведено 70 часов, из расчета - 2 часа в неделю.
ЦЕННОСТНЫЕ ОРИЕНТИРЫ СОДЕРЖАНИЯ УЧЕБНОГО ПРЕДМЕТА.
Ценностные ориентиры курса химии в основной школе определяются спецификой химии как науки. Понятие «ценности» включает единство объективного и субъективного, поэтому в качестве ценностнных ориентиров химического образования выступают объекты, изучаемые в курсе химии, к которому у обучающихся формируется ценностное отношение. При этом ведущую роль играют познавательные ценности, так как данный учебный предмет входит в группу предметов познавательного цикла, главная цель которых заключается в изучении природы.
Основу познавательных ценностей составляют научные знания, научные методы познания, а ценностные ориентации, формируемые у обучающихся в процессе изучения химии, проявляются:
- в признании ценности научного знания, его практической значимости, достоверности;
- в ценности химических методов исследования живой и неживой природы;
- в понимании сложности и противоречивости самого процесса познания как извечного стремления к Истине.
В качестве объектов ценностей труда и быта выступают творческая созидательная деятельность, здоровый образ жизни, а ценностные ориентации содержания курса химии могут рассматриваться как формирование:
- уважительного отношения к созидательной, творческой деятельности;
- понимания необходимости здорового образа жизни;
- потребности в безусловном выполнении правил безопасного использования веществ в повседневной жизни;
- сознательного выбора будущей профессиональной деятельности.
Курс химии обладает возможностями для формирования коммуникативных ценностей, основу которых составляют процесс общения, грамотная речь, а ценностные ориентации направлены на воспитание у учащихся:
- правильного использования химической терминологии и символики;
- потребности вести диалог, выслушивать мнение оппонента, участвовать в дискуссии;
- способности открыто выражать и аргументированно отстаивать свою точку зрения.
5. СОДЕРЖАНИЕ НАЧАЛЬНОГО КУРСА ХИМИИ
VIII КЛАСС (70ч, 2 ч в неделю)
Введение (6 часов)
Химия - наука о веществах, их свойствах и превращениях.
Понятие о химическом элементе и формах его существования: свободных атомах, простых и сложных веществах.
Превращения веществ. Отличие химических реакций от физических явлений. Роль химии в жизни человека.
Краткие сведения из истории возникновения и развития химии. Период алхимии. Понятие о философском камне. Химия в XVI в. Развитие химии на Руси. Роль отечественных ученых в становлении химической науки - работы М. В. Ломоносова, А. М. Бутлерова, Д. И. Менделеева.
Химическая символика. Знаки химических элементов и происхождение их названий. Химические формулы. Индексы и коэффициенты. Относительные атомная и молекулярная массы. Расчет массовой доли химического элемента по формуле вещества.
Периодическая система химических элементов Д. И. Менделеева, ее структура: малые и большие периоды, группы и подгруппы (главная и побочная). Периодическая система как справочное пособие для получения сведений о химических элементах.
Расчетные задачи.
1. Нахождение относительной молекулярной массы вещества по его химической формуле.
2. Вычисление массовой доли химического элемента в веществе по его формуле
Атомы химических элементов (11 часов)
Атомы как форма существования химических элементов. Основные сведения о строении атомов. Доказательства сложности строения атомов. Опыты Резерфорда. Планетарная модель строения атома.
Состав атомных ядер: протоны и нейтроны. Относительная атомная масса. Взаимосвязь понятий «протон», «нейтрон», «относительная атомная масса».
Изменение числа протонов в ядре атома - образование новых химических элементов.
Изменение числа нейтронов в ядре атома - образование изотопов. Современное определение понятия «химический элемент». Изотопы как разновидности атомов одного химического элемента.
Электроны. Строение электронных оболочек атомов химических элементов № 1-20 периодической системы Д. И. Менделеева. Понятие о завершенном и незавершенном электронном слое (энергетическом уровне).
Периодическая система химических элементов Д. И. Менделеева и строение атомов: физический смысл порядкового номера элемента, номера группы, номера периода.
Изменение числа электронов на внешнем электронном уровне атома химического элемента - образование положительных и отрицательных ионов. Ионы, образованные атомами металлов и неметаллов. Причины изменения металлических и неметаллических свойств в периодах и группах.
Образование бинарных соединений. Понятие об ионной связи. Схемы образования ионной связи.
Взаимодействие атомов химических элементов-неметаллов между собой - образование двухатомных молекул простых веществ. Ковалентная неполярная химическая связь. Электронные и структурные формулы.
Взаимодействие атомов химических элементов-неметаллов между собой - образование бинарных соединений неметаллов. Электроотрицательность. Понятие о ковалентной полярной связи.
Взаимодействие атомов химических элементов-металлов между собой - образование металлических кристаллов. Понятие о металлической связи.
Демонстрации.
Модели атомов химических элементов.
Периодическая система химических элементов Д. И. Менделеева.
Практическая работа
Правила ТБ при работе в химкабинете. Приемы обращения с химическим оборудованием.
Контрольная работа № 1 «Атомы химических элементов»
Простые вещества (7 часов)
Положение металлов и неметаллов в периодической системе химических элементов Д. И. Менделеева. Важнейшие простые вещества - металлы: железо, алюминий, кальций, магний, натрий, калий. Общие физические свойства металлов.
Важнейшие простые вещества - неметаллы, образованные атомами кислорода, водорода, азота, серы, фосфора, углерода. Способность атомов химических элементов к образованию нескольких простых веществ - аллотропия. Аллотропные модификации кислорода, фосфора и олова. Металлические и неметаллические свойства простых веществ. Относительность деления простых веществ на металлы и неметаллы.
Постоянная Авогадро. Количество вещества. Моль. Молярная масса. Молярный объем газообразных веществ. Кратные единицы количества вещества - миллимоль и киломоль, миллимолярная и киломолярная массы вещества, миллимолярный и киломолярный объемы газообразных веществ.
Расчеты с использованием понятий «количество вещества», «молярная масса», «молярный объем газов», «постоянная Авогадро».
Расчетные задачи. 1. Вычисление молярной массы веществ по химическим формулам. 2. Расчеты с использованием понятий «количество вещества», «молярная масса», «молярный объем газов », « постоянная Авогадро ».
Контрольная работа № 2 «Простые вещества»
Соединения химических элементов (13 часов)
Степень окисления. Определение степени окисления элементов по химической формуле соединения. Составление формул бинарных соединений, общий способ их называния. Бинарные соединения: оксиды, хлориды, сульфиды и др. Составление их формул. Представители оксидов: вода, углекислый газ и негашеная известь. Представители летучих водородных соединений: хлороводород и аммиак.
Основания, их состав и названия. Растворимость оснований в воде. Таблица растворимости гидроксидов и солей в воде. Представители щелочей: гидроксиды натрия, калия и кальция. Понятие о качественных реакциях. Индикаторы. Изменение окраски индикаторов в щелочной среде.
Кислоты, их состав и названия. Классификация кислот. Представители кислот: серная, соляная и азотная. Изменение окраски индикаторов в кислотной среде.
Соли как производные кислот и оснований. Их состав и названия. Растворимость солей в воде. Представители солей: хлорид натрия, карбонат и фосфат кальция.
Аморфные и кристаллические вещества.
Межмолекулярные взаимодействия. Типы кристаллических решеток: ионная, атомная, молекулярная и металлическая. Зависимость свойств веществ от типов кристаллических решеток.
Вещества молекулярного и немолекулярного строения. Закон постоянства состава для веществ молекулярного строения.
Чистые вещества и смеси. Примеры жидких, твердых и газообразных смесей. Свойства чистых веществ и смесей. Их состав. Массовая и объемная доли компонента смеси. Расчеты, связанные с использованием понятия «доля».
Расчетные задачи.
1. Расчет массовой и объемной долей компонентов смеси веществ.
2. Вычисление массовой доли вещества в растворе по известной массе растворенного вещества и массе растворителя.
3. Вычисление массы растворяемого вещества и растворителя, необходимых для приготовления определенной массы раствора с известной массовой долей растворенного вещества.
Демонстрации. Образцы оксидов, кислот, оснований и солей. Модели кристаллических решеток хлорида натрия, алмаза, оксида углерода (IV). Способы разделения смесей. Дистилляция воды.
Практическая работа № 2
Очистка загрязненной поваренной соли
Практическая работа № 3
Приготовление раствора с заданной массовой долей
Контрольная работа № 3 « Соединения химических элементов»
Изменения, происходящие с веществами (15 часов)
Понятие явлений как изменений, происходящих с веществами. Явления, связанные с изменением кристаллического строения вещества при постоянном его составе, - физические явления. Физические явления в химии: дистилляция, кристаллизация, выпаривание и возгонка веществ, центрифугирование.
Явления, связанные с изменением состава вещества, - химические реакции. Признаки и условия протекания химических реакций. Понятие об экзо- и эндотермических реакциях. Реакции горения как частный случай экзотермических реакций, протекающих с выделением света.
Закон сохранения массы веществ. Химические уравнения. Значение индексов и коэффициентов. Составление уравнений химических реакций.
Расчеты по химическим уравнениям. Решение задач на нахождение количества вещества, массы или объема продукта реакции по количеству вещества, массе или объему исходного вещества. Расчеты с использованием понятия «доля», когда исходное вещество дано в виде раствора с заданной массовой долей растворенного вещества или содержит определенную долю примесей.
Реакции разложения. Понятие о скорости химических реакций. Катализаторы. Ферменты.
Реакции соединения. Каталитические и некаталитические реакции. Обратимые и необратимые реакции.
Реакции замещения. Электрохимический ряд напряжений металлов, его использование для прогнозирования возможности протекания реакций между металлами и растворами кислот. Реакции вытеснения одних металлов из растворов их солей другими металлами.
Реакции обмена. Реакции нейтрализации. Условия протекания реакций обмена в растворах до конца.
Типы химических реакций (по признаку «число и состав исходных веществ и продуктов реакции») на примере свойств воды. Реакция разложения - электролиз воды.
Реакции соединения - взаимодействие воды с оксидами металлов и неметаллов. Понятие «гидроксиды». Реакции замещения - взаимодействие воды с щелочными и щелочноземельными металлами. Реакции обмена (на примере гидролиза сульфида алюминия и карбида кальция).
Демонстрации. Примеры физических явлений: а) плавление парафина; б) возгонка иода или бензойной кислоты; в) диффузия душистых веществ с горящей лампочки накаливания. Примеры химических явлений: а) взаимодействие соляной кислоты с мрамором или мелом; в) получение гидроксида меди (II); г) взаимодействие разбавленных кислот с металлами; з) разложение пероксида водорода;
Контрольная работа № 4 «Изменения, происходящие с веществами»
Растворение. Растворы. Свойства растворов электролитов (18 часов)
Растворение как физико-химический процесс. Понятие о гидратах и кристаллогидратах. Растворимость. Кривые растворимости как модель зависимости растворимости твердых веществ от температуры. Насыщенные, ненасыщенные и пересыщенные растворы. Значение растворов для природы и сельского хозяйства.
Понятие об электролитической диссоциации. Электролиты и неэлектролиты. Механизм диссоциации электролитов с различным типом химической связи. Степень электролитической диссоциации. Сильные и слабые электролиты.
Основные положения теории электролитической диссоциации. Ионные уравнения реакций. Условия протекания реакции обмена между электролитами до конца в свете ионных представлений.
Классификация ионов и их свойства.
Кислоты, их классификация. Диссоциация кислот и их свойства в свете теории электролитической диссоциации. Молекулярные и ионные уравнения реакций кислот. Взаимодействие кислот с металлами. Электрохимический ряд напряжений металлов. Взаимодействие кислот с оксидами металлов. Взаимодействие кислот с основаниями - реакция нейтрализации. Взаимодействие кислот с солями. Использование таблицы растворимости для характеристики химических свойств кислот.
Основания, их классификация. Диссоциация оснований и их свойства в свете теории электролитической диссоциации. Взаимодействие оснований с кислотами, кислотными оксидами и солями. Использование таблицы растворимости для характеристики химических свойств оснований. Разложение нерастворимых оснований при нагревании.
Соли, их классификация и диссоциация различных типов солей. Свойства солей в свете теории электролитической диссоциации. Взаимодействие солей с металлами, условия протекания этих реакций. Взаимодействие солей с кислотами, основаниями и солями. Использование таблицы растворимости для характеристики химических свойств солей.
Обобщение сведений об оксидах, их классификации и химических свойствах.
Генетические ряды металлов и неметаллов. Генетическая связь между классами неорганических веществ.
Окислительно-восстановительные реакции. Окислитель и восстановитель, окисление и восстановление.
Реакции ионного обмена и окислительно-восстановительные реакции. Составление уравнений окислительно-восстановительных реакций методом электронного баланса.
Свойства простых веществ - металлов и неметаллов, кислот и солей в свете представлений об окислительно-восстановительных процессах.
Демонстрации. Испытание веществ и их растворов на электропроводность. Движение окрашенных ионов в электрическом поле. Зависимость электропроводности уксусной кислоты от концентрации. Взаимодействие цинка с серой, соляной кислотой, хлоридом меди (II). Горение магния. Взаимодействие хлорной и сероводородной воды.
Практическая работа № 4
Решение экспериментальных задач
Практическая работа № 5
Получение, собирание и распознавание кислорода
Практическая работа № 6
Получение, собирание и распознавание углекислого газа
Практическая работа № 7
Решение экспериментальных задач
Итоговая контрольная работа № 5
Тематический план курса
№
основные разделы
количество часов
Практические работы
Контрольная работа
Лабораторные работы
1
Введение
6
2
Атомы химических элементов
10
1
1
3
Простые вещества
7
1
1
4
Соединения химических элементов
14
1
1
5
Изменения, происходящие с веществами
11
1
6
Растворение, растворы, реакции ионного обмена и окислительно-восстановительные реакции.
18
4
1
Резерв
Итого:
70
7
5
1 полугодие
30
1
2
2 полугодие
40
6
3
1 четверть
9 недель
2 четверть
7 недель
3 четверть
10 недель
4 четверть
9 недель
Год
35 недель
Количество часов
18
14
20
18
70
Раздел
1. Введение.
2. Атомы химических элементов.
3.Простые вещества.
3. Простые вещества.
4. Соединения химических элементов.
4. Соединения химических элементов.
5. Изменения происходящие с веществами.
6. Растворы. Растворение. Свойства растворов электролитов.
6. Растворы. Растворение. Свойства растворов электролитов.
7. Обобщение и систематизация знаний.
7
Контрольные работы
1.«Атомы химических элементов»
2.«Простые вещества»
3.«Соединения химических элементов»
4.« Изменения,
происходящие с веществами»
5.Итоговая контрольная работа за курс химии
5
Практические работы
«Знакомство с лабораторным оборудованием. Правила безопасной работы в химической лаборатории»
«Очистка загрязненной поваренной соли»
«Приготовление раствора с заданной массовой долей растворенного вещества»
«Решение экспериментальных задач. «Генетическая связь между основными классами неорганических соединений»
«Получение, собирание и распознавание кислорода»
«Получение, собирание и распознавание углекислого газа»
«Решение экспериментальных задач
«Теория электролитической диссоциации»»
7
Региональный компонент
2
-
3
1
6
Дистанционное обучение
6
4
6
6
22
Кол-во уроков с использован ИКТ
17
13
20
15
65
Кол-во уроков с примен. метода проекта
-
1
1
-
2
5. КАЛЕНДАРНО-ТЕМАТИЧЕСКОЕ ПЛАНИРОВАНИЕ.
Курс «Неорганическая химия» 8 класс (базовый уровень)
№ п/п
Дата
Тема
Цель
Основные понятия и термины
Формы и методы преподавания
Эксперимент
ЦОР, ИКТ
Планируемые результаты
Оборудование
Домашнее задание
план
факт
ученик д/знать
ученик д/уметь
1
2
3
4
5
6
7
8
9
10
11
12
ВВЕДЕНИЕ (6 часов)
1
Вводный инструктаж по ТБ.
Химия -
наука о
веществах и свойствах
Дать понятие о предмете химии. Сформировать первоначальные представления о веществе, о химическом элементе
Химия, вещество, химический элемент, простое вещество, сложное вещество
УОНМ
Фронтальный
Л. р. № 1. Знакомство с образцами простых и сложных веществ
Д. Изделия
из стекла и
алюминия.
Модели
молекул
Понятия: «химический элемент», «вещество», «атомы»,
«молекулы»
Различать понятия:
«вещество» и «тело», «простое вещество» и «химический элемент»
Изделия
из стекла и
алюминия
Модели
молекул
Введе-
ние.
§ 1, упр.
3, 6, 10
2
Превращения веществ.
Роль химии
в жизни
человека
Дать представление о химической реакции
Химическое явление, физические явления, химическая реакция
КУ
Текущий
Упр. 1-3
Л.р.№3 Прокаливание медной проволоки, взаимодействие мела с соляной кислотой, взаимодействие мела с кислотой
Понятие «химическая реакция»
Отличать хими
ческие реакции от физических явлений
Медная проволока, спиртовка, мел, соляная кислота, пробирка
§2,
упр. 1, 2.
§3
3
Периодическая система химических элементов. Знаки химических элементов
Ввести понятие о знаках химических элементов
Периодическая система, периоды, группы
КУ
Фронтальный
Таблица 1, с. 32
Знаки первых 20 химических элементов
- определять положение химического элемента в Периодической системе;
- называть химич элементы
Таблица «Периодическая система химических элементов Менделеева»
§4,
упр. 5
4
Химические формулы. Относительная атомная и молекулярная масса
Дать первые представления о химических формулах
Химическая формула, индекс, коэффициент, относительная молекулярная масса
КУ
Работа с ДМ.
Упр. 1, 2, 6-8
-
определение химической формулы вещества;
-
формулировку закона постоянства состава.
Понимать и записывать химические формулы веществ
Определять состав веществ по химической формуле;
принадлежность к простым и сложным веществам
ПСХЭ
§5,
упр. 1, 2, 8
5
Массовая доля элемента в соединении
Научить устанавливать простейшие формулы вещества по массовым долям элементов
Массовая доля
УОНМ
Работа по карточкам
упр. 6, 7
Понятие «массовая доля»
Вычислять массовую долю химического элемента в соединении
Карточки- задания
«Контрольные и проверочные работы.
Химия-8»
§5,
упр. 6, 7. Практические работы 1-2,
с.174-181
6
Практи
ческая
работа № 1.
Знакомство
с лабора-
торным
оборудова-
нием.
Практи
ческая
работа 1
Правила безо-
пасной работы в химической лаборатории
Обращаться с химической посудой и лабораторным оборудованием
Штатив,
спиртовка,
пробирка,
химический
стакан, колба, вода,
мерный цилинд
Повтор правила ТБ
АТОМЫ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ (10 часов)
7
Основные
сведения о
строении
атомов
Формировать знания учащихся о составе атома и атомного ядра
Атом, радиактивность, элементарные частицы
УОНМ
Текущий.
Упр. 3, 5,
с. 43
Понятия: «атом», «радиоактивность», «элементарные частицы»
Объяснять физический смысл атомного номера
Модели атомов
§6,
упр. 3, 5
8
Изотопы
как разно
видности
атомов
Сформировать представление об изотопах
Изотопы. Изобары
КУ
Фрон-
тальный
Определение понятия «химический
элемент»
Различать понятия изотопы и изобары
ПСХЭ
§7,
упр. 3
9
Периодическая система химических элементов и строение атомов
Сформировать понятие о свойствах элементов
Энергетические уровни. Орбитали
УПЗУ
текущий, упр 3-5, табл с.55
Периодическая система химических элементов
Понятия:энергетические уровни. орбитали
Знать формулировку периодического закона.
Уметь объяснять изменения свойств элементов в пределах малых периодов и главных подгрупп.
ПСХЭ
§8,
упр. 3-5
10
Электроны. Строение электронных оболочек атомов химических элементов
Сформировать представления об электронной оболочке атома и энергетических уровнях
Электроны, энергетические уровни
КУ
Устный. Упр. 1, 2
Периодическая система химических элементов
Понятия: «электроны», «энергетические уровни»
- объяснять физический смысл атомного номера, номеров группы и периода;
- составлять схемы строения атомов 1-20 элем
ПСХЭ, таблицы
§8,
упр. 1, 2
11
Изменение числа электронов на внешнем энергетическом уровне
Уметь объяснять закономерности изменения свойств элементов в приделах малых и больших групп
Металлические и неметаллические свойства
КУ
Текущий. Упр. 2
Периодическая система химических элементов
Понятия: отдачи и присоединения электронов
Знать причину изменения свойств в зависимости от место расположения элемента в периодической системе
Табл по теме «электронное строение атома»
§ 9
упр. 2
12
Взаимодействие атомов элементов - неметаллов между собой.
Дать понятие о ковалентной химической связи
Ковалентная химическая связь
КУ
Текущий. Упр. 1-5
Периодическая система химических элементов
Понятие «ковалентная химическая связь»
Определять тип химической связи в соединениях
Таблицы
§10,
упр. 1-5
13
Ковалент- ная полярная химическая связь
Уметь определять тип химической связи (ковалентная полярная) в соединениях.
Ковалентная полярная химическая связь
КУ
Текущий упр. 3.
Периодическая система химических элементов
Понятие «ковалентная полярная химическая связь»
Определять тип химической связи в соединениях
схемы
§ 11,
упр. 1-4
14
Металлическая химическая связь
Сформировать понятие о металлической химической связи
Металлическая химическая связь
КУ
ТекущийУпр. 1, 3
Периодическая система химических элементов
Понятие «металлическая химическая связь»
Определять тип химической связи в соединениях
Таблицы, модели атомов мeталлов
§ 12, упр. 1, 3
15
Обобщение и систематизация знаний по теме: «Атомы химических элементов»
Повторение, обобщение и закрепление знаний по теме
Ковалентная, ионная, водородная, металлическая химические связи
УПЗУ
Тематический
Периодическая система химических элементов
Понятия: «ковалентная», «ионная», «водородная», «металлическая» химические связи
- объяснять закономерности изменения свойств элементов в пределах малых периодов и главных подгрупп;
- определять тип химической связи в соединениях
Таблицы
Подгот к к.р
16
Контрольная работа № 1.
«Атомы химических элементов»
Контроль знаний по теме:
Атомы химических элементов
Контрольная работа 1
Периодическая система химических элементов
ДМ
Повторить строен атома
17
Анализ контрольной работы
тест
Повторить темы
ПРОСТЫЕ ВЕЩЕСТВА (6 часов)
18
Простые вещества - металлы и неметаллы
Ознакомить с общими физическими свойствами металлов
Электропроводность, теплопроводность
КУ
Текущий
Д. Коллекция металлов
Понятия: «электропроводность», «теплопроводность»
- характеризовать химические элементы на основе положения в Периодической системе и особенностей строения их атомов;
- объяснять связь между составом, строением и свойствами веществ
Коллекция металлов
§ 13,
упр. 1, 3
19
Количество вещества.
Ввести понятие о количестве вещества и единицах его измерения
Моль, молярная масса, число Авогадро
УОП
Текущий.Упр. 2 (а, б), 3 (а, б)
Д. Химические соединения количеством
вещества
1 моль
Понятия «моль», «молярная масса», «число Авогадро»
Вычислять количество вещества, массу по количеству вещества
Химические соединения количеством вещества 1 моль
§15,
упр.
2 (а, б), 3 (а, б)
20
Молярный объем газообразных веществ
Сформулировать понятие о молярном объёме газов и рассмотреть единицы измерения его
Молярный объём
УОП
Текущий. Упр. 1 (а),
2 (а, в), 4, 5
Д. Модель молярного объема газов
Понятие «молярный объем»
Вычислять объем по количеству вещества или массе
Модель молярного объема газов
§16,
упр.
1 (а),
2 (а, в), 4, 5
21
Решение задач по теме: «количества вещества»
Научиться решать задачи по теме: Простые вещества
Количество вещества. Молярная масса. Молярный объем
УПП
Письменный
Понятия «моль», «молярная масса», «молярный объем»
Вычислять количество вещества, массу, объем по известному количеству вещества, массе, объему
Таблицы с формулами
§ 15, 16
22
Подготовка к контрольной работе по теме «Простые вещества»
Обобщить и систематизировать знания по теме «Простые вещества»
Количество вещества. Молярная масса. Молярный объем
УПЗУ
Тематический
Изученные понятия
Производить вычисления
ДМ
Повторить
§ 13-16
23
Контрольная работа № 2.«Простые вещества»
Контроль знаний по теме:
Простые вещества
Контрольная работа 2
24
Работа над ошибками
Ликвидировать пробелы
УИНМ
Вспомнить основные понятия
Применять полученные знания
таблицы
Зад в тет
СОЕДИНЕНИЯ ХМИЧЕСКИХ ЭЛЕМЕНТОВ (15 часов)
25
Степень окисления.
Сформулировать понятие о степени окисления и научить составлять формулы по степени окисления
Степь окисления, оксиды, вода, гидраты
УИНМ
Текущий. Упр. 1, 2, 4
Понятия: «степень окисления», «оксиды», «вода», «гидраты»
- определять степень окисления элемента в соединении
- называть бинарные соединения
ПСХЭ
§ 17,
упр. 2, 5, 6
26
Оксиды. Летучие водородные соединения
Показать значение оксидов и летучих соединений водорода в жизни человека
Оксиды, гидраты
КУ
Текущий. Упр. 1, 5
Д. Образцы оксидов.
Понятия: «оксиды», «гидраты»
- называть оксиды,
- определять состав вещества по их формулам, степень окисления
Образцы оксидов
§ 18,
упр. 1, 4, 5
27
Основания
Рассмотреть классификацию и номенклатуру оснований
Основания, ионы, катионы, анионы, щелочи
КУ
Текущий. Упр. 2, 3, 4; таблица 4
Д. Образцы оснований. Л.р.№6 Получение осадков нерастворимых гидроксидов. Взаимодействие углекислого газа с известковой водой
Понятия: «основания», «ионы», «катионы», «анионы», «щелочи»
-
называть основания;
-
определять состав вещества по их формулам, степень окисления;
- распознавать опытным путем растворы щелочей
Образцы оснований
§ 19,
упр. 2-6
28
Кислоты
Сформировать понятие о кислотах
Кислоты, оксикислоты, индикаторы
КУ
Упр. 1-5; таблица 5, с. 109
Д. Образцы кислот, нейтрализация щелочи кислотой в присутствии индикаторов
Формулы кислот
-
называть кислоты;
-
определять степень окисления элемента в соединении;
- распознавать опытным путем растворы кислот
Гидроксид натрия, соляная кислота, фенолфталеин
§20,
упр. 1, 3, 5, таблица 5
29
Соли
Сформировать понятие о солях
Соли, кислотный остаток, номенклатура солей
КУ
Работа с ДМ.
Упр. 1-3;
таблица 5, с. 109
Д. Образцы солей. Таблица растворимости
Изученные понятия и номенклатуру солей
- называть соли;
- составлять формулы солей
Образцы солей
§21,
упр. 1-3
30
Основные классы неорганических веществ
Проверить знания и умения по основным классам химических соединений
Нитраты, хлориды. Карбонаты, фосфаты
УПЗУ
Обобщающий
Фрмулы кислот
-
называть соединения изученных классов;
-
определять принадлежность вещества
к определенному классу;
- составлять формулы веществ
Таблица растворимости
§ 18-21
31
Кристаллические вещества.
Познакомить с типами кристаллических решеток
Д.1. Модели кристаллических решеток.
2. Возгонка бензойной кислоты или нафталина
ПСХЭ, учебник
Модели кристаллических решеток
Свойства кристаллических решеток. Взаимосвязь кристаллических решеток и видов химической связи
§ 22 №1,4,5
доклады
32
Контр. Работа за первое полугод
Показать место смесей в природе и промышленности
Д.1. Взрыв смеси водорода с воздухом.
2. Способы разделения смесей.
3. Дистилляция воды
ПСХЭ, учебник
§ 23 №1-4
33
Повтор Инстр. По ТБ. Чистые вещества и смеси Разделение смесей. Очистка веществ.
Ознакомить с методами разделения смесей
Лабораторное оборудование
Понятия: «Чистые вещества » и «смеси»
Способы разделения смесей-основа очистки веществ
Презентация
§ 23
34
Практическая работа № 2 «Очистка загрязнённой поваренной соли»
Практическая работа № 2
Фильтрование, выпаривание
Виртуалная лаборатория Кирила и Мифодия
Понятия: «фильтрование», «выпаривание»
Разделять вещества методом фильтрования и выпаривания
Научить способам очистки веществ
Смесь поваренной соли с песком, вода, колба, воронка, фильтр, стеклянная палочка, спиртовка, фарфоровая чашка
§ 23-24
35
Массовая и объемная доли компонентов в смеси.
Изучение и первичное закрепление новых знаний
ПСХЭ, учебник
Массовая и объемная доли компонента.
Понятия: «масса раствора», «массовая доля»
Вычислять массовую долю вещества в растворе, вычислять т, V, v продукта реакции по т, V, v исходного вещества, содержащего примеси
Таблицы
§ 24 №1-3
36
Практическая работа № 3 Приготовление раствора сахара и определение массовой доли сахара в растворе
П/р №3
( в учебнике №5)
Вода, соль,
весы, мер
ный цилиндр, стек
лянная па
лочка, весы
§
37
Контрольная рабо
та № 3.
Соединения химических элементов
Контроль знаний по теме:
Соединения химических элементов
Контрольная
работа 3
ДМ, «Контрольные и про
верочные работы.
Повто-
рить
§ 17-24
ИЗМЕНЕНИЯ, ПРОИСХОДЯЩИЕ С ВЕЩЕСТВАМИ (11 часов)
38
Физические явления в химии
Физические превращения и физические явления в природе
Способы разделения смесей
КУ
Текущий
Упр. 1-3
Понятия: перегонка, кристализация, возгонкка, отстаивание
Таблица «Круговород воды», презентация
§25,
упр. 3
39
Химиче-
ские реак-
ции
Рассмотреть признаки и условия протекания химических реакций
Химическая реакция, классификация химических реакций
КУ
Текущий
Упр. 1-3
Понятия «хими
ческая реакция»,
«классификация хими
ческих реакций»
Признаки и условия протекания химических реакций
ДМ
§26,
упр. 1-3
40
Химические уравнения
Научить составлять уравнения и схемы химических реакций
Закон сохранения массы веществ
КУ
Текущий
работа с ДМ
Закон сохранения массы веществ
Применять закон сохранения массы веществ
ДМ
§27
41
Расчеты по химическим уравнениям
Научить производить расчеты по химическим уравнениям
УОП
Текущий§28,
упр. 3 §27,
упр. 4
Принцип расчета по химическим уравнениям
Вычислять количество вещества, объем или массу по количеству вещества, объему или массе реагентов или продуктов реакции
ДМ
«Контрольные и про
верочные работы. Хи-мия-8» к учебнику
О. С. Габриеляна
с. 150-151
§28,
упр. 3, 4
42
Реакции разложения
Сформировать представление о реакции разложении
Реакция разложения
КУ
Текущий
упр. 1,4
Понятие «реакция разложения»
Составлять уравнения химических реакций
Таблицы
§29,
упр. 1, 4, 5
43
Реакции
соединения
Сформировать представление о реакции соединения
Реакция
соединения
КУ
Текущий.
Упр. 1-3, 8
Понятие «реакции соединения»
- составлять уравнения
химических реакций;
- определять тип
химической реакции
Таблицы.
§30,
упр.1-3,
8
44
Реакции
замещения
Сформировать представление о реакции замещения
Реакция замещения
КУ
Текущий.
Упр. 1-3
JI.р. № 8 взаимо
действие
железа с
сульфатом
меди (II)
Понятие «реакции замещения»
- составлять уравнения
химических реакций;
-характеризовать
химические свойства металлов (взаимодействие с кислотами,
солями)
Таблицы.
Железо металлическое, раствор медного купороса, пробирка
§31,
упр. 1-3
45
Реакции
обмена
Сформировать представление о реакции обмена
Реакция обмена
КУ
Текущий.
Упр. 1, 3, 4
Понятие «реакции обмена»
- составлять уравнения
химических реакций;
- определять тип
реакции, возможность протекания реакций
ионного обмена
Таблицы
§32,
упр. 2-5
46
Типы хи-
мических
реакций на
примере
свойств
воды
Рассмотреть химические реакции на примере свойств воды
Гидролиз
КУ
Текущий.
Упр. 1
Классификацию
химических реакций по признаку «число и состав исходных веществ и продуктов
реакции»
- составлять уравнения
химических реакций;
- определять тип
реакции;
-характеризовать
химические свойства воды
Таблицы
§33,
упр. 1
47
Обобщение и систематизация
знаний по теме «Классы веществ. Изменения, происходящие с веществами»
Обобщить и систематизировать знания по теме «Классы неорганических веществ. Типы химических реакций»
Реакции соединения, разложения, замещения, обмена
УПЗУ
Тематический
Простые и сложные вещества. Основные классы
неорганических
веществ.
- определять принадлежность веществ к
определенному классу
соединений;
- составлять формулы
веществ, уравнения
химических реакций;
Таблицы
Повторить
§ 27-33
48
Контрольная работа № 4.
«Изменения,
происходящие с веществами»
Контроль знаний по теме:
Изменения,
происходящие с веществами
Контрольная работа 4
Повторить
§ 27-33
49
Растворение. Растворимость веществ в воде.
Ознакомить учащихся с растворением как физико-химическим процессом
Растворимость. Коэффициент растворимости
УОНМ
Текущий.
Упр. 2
Классификацию
веществ по растворимости
Находить коэффициент растворимости
ПСХЭ,
таблица растворимости
§34,
упр. 2
50
Электролитическая диссоциация
Сформировать понятие об электролитах и неэлектролитах
Электролиты, неэлектролиты, электролитическая диссоциация
КУ
Текущий. Упр. 1, 4, 5
Д. Растворы электролитов и неэлектролитов
Понятия: «электролиты» и «неэлектролиты», «электролитическая диссоциация»
Различать понятия электролиты и неэлектролиты
ПСХЭ,
таблица растворимости, прибор Черняка, вода, сахароза, сольная кислота, хлорид натрия
§35,
упр. 1, 4, 5
51
Основные положения теории электролитической диссоциации
Сформулировать основные положения теории электролитической диссоциации
Ионы. Катионы и анионы, степень диссоциации
КУ
Фронтальный. Упр. 2-5
Понятия: «ион», «катион», «анион», «степень диссоциации»
Составлять уравнения диссоциации
Портреты Аррениуса и Менделеева
§36,
упр. 1,2, 5
52
Ионные уравнения
Научить школьников составлять ионные уравнения
Ионы. Катионы и анионы
КУ
Текущий
Упр. 1-3
Понятия: «ион»,
«катион», «анион»
-
составлять уравнения реакций;
-
определять возможность протекания реакций ионного обмена;
- объяснять сущность реакций ионного обмена
ПСХЭ,
таблица растворимости
§37,
упр. 1-3
53-54
Кислоты,
их классификация, свойства
Сформировать понятие о кислотах как классе электролитов. Научить школьников пользоваться рядом активности металлов и таблицей растворимос
Кислота
КУ
Текущий. Упр. 1-4
Понятие «кислота». Формулы кислот
-
называть кислоты;
-
характеризовать химические свойства кислот;
-
составлять уравнения химических реакций;
Таблица растворимости, ряд активности металлов
§38,
упр. 1- 4, 6
55-56
Основания, в свете ТЭД их
классификация, свойства
Рассмотреть классификацию оснований по разным признакам
Щелочи, амфотерные гидроксиды
КУ
Письмен
ный.
Упр. 3, 5
Понятия «щелочи», «амфотерные гидроксиды»
- называть основания;
- характеризовать
химические свойства оснований;
- составлять уравнения
химических реакций;
-
распознавать
опытным путем растворы щелочей
Таблица растворимости
§39,
упр. 3, 5
57
Оксиды, их
классифи
кация,
свойства
Обобщить сведения об оксидах
Основные, кислотные, амфотерные
КУ
Текущий
упр. 1-3
Д. Образцы
оксидов
Понятия основных, кислотных и амфотерных оксидов
- называть оксиды;
- составлять формулы,
уравнения реакций
Образцы
оксидов
§40,
упр. 1-3
Практическая работа 7
58
Соли, их
свойства
Сформулировать понятие о солях, как классе электролитов
Кислые,
средние, основные соли
КУ
Устный.
Упр. 2, 4
Понятия: «кислые соли», «средние соли», «основные соли»
- называть соли;
- характеризовать
химические свойства солей;
- определять возможность протекания реакций ионного обмена
Таблица растворимости
§41,
упр. 2, 4
59
Генетическая связь между
классами
неорганических веществ
Сформировать понятие о генетической связи и генетическом ряде
Оксиды, основания, кислоты, соли
УПЗУ
Основные классы
неорганических
веществ
- называть соединения
изученных классов;
- составлять уравнения
химических реакций
Таблицы
§42,
упр. 1-4.
Практические
работы
8-9
60
Практическая работа № 4.
Решение экспериментальных задач «Генетическая связь между основными классами неорганических соединений»
Решать задачи экспериментальным путем
Практическая работа 4
Практические работы
8, 9, с. 241
Лабораторное оборудование
Уметь решать задачи экспериментальным путем
-
обращаться с химической посудой и лабораторным оборудованием;
- распознавать опытным путем растворы кислот, щелочей
ДМ, «Контрольные и проверочные работы. Химия-8»
Повтор техн безопасности
61
Практическая работа № 5. Получение, собирание и распознавание кислорода
Научится Получать собирание и распознавать кислород
Практическая работа 5
Лабораторное оборудование
Проводить химические эксперименты
-
обращаться с химической посудой и лабораторным оборудованием;
- распознавать кислород опытным путем
Лабораторное оборудование
Повтор техн безопасности
62
Практическая работа № 6. Получение, собирание и распознавание углекислого газа
Научится получать собирать и распознавать углекислый газ
Практическая работа 6
Лабораторное оборудование
-
обращаться с химической посудой и лабораторным оборудованием;
- распознавать опытным путем углекислый газ
Лабораторное оборудование
Повтор техн безопасности
63
Практическая работа № 7.
Решение экспериментальных задач «Теория электролитической диссоциации
Уметь проводить химический эксперемент
Практическая работа 7
Лабораторное оборудование
Лабораторное оборудование
Повт техн безопасности
64
Окислительно-восстано-
вительные
реакции
Изучить условия протекания окислительно-восстановительных реакций
Степень окисления, окислитель, восстановитель
УОНМ
Текущий. Упр. 2, 3
Лабораторное оборудование
Понятия «окислитель», «восстановитель», «окисление» и «восстановление»
-
определять степень окисления элемента в соединении;
- составлять уравнения
Таблицы
§43,
упр. 1-3
65
Упражнения в составлении окислительно- восстановительных реакций
Рассмотреть классификацию окислительно - восстановительных реакций
Метод электронного баланса
УОП
Работа с ДМ
Метод электронного баланса
Применять метод электронного баланса на практике
ДМ, «Контрольные и проверочные работы. Химия-8» 3 и 4 вариа
§43
66
Свойства простых веществ- металлов и неметаллов, кислот, солей
в свете ОВР
Рассмотреть свойства простых веществ Ме и НеМе, кислот, солей в свете ОВР
Окислитель, восстановитель, окисление и восстановление
КУ
Текущий. Упр. 4-8
Лабораторное оборудование
Понятия «окислитель», «восстановитель», «окисление» и «восстановление»
- определять степень окисления элемента в соединении;
- составлять уравнения химических реакций
ДМ, «Контрольные и проверочные работы. Химия-8» к учебнику
О. С. Габриеляна с. 154-155 1 и 2 вариант
§43,
упр. 4-8
67
Контрольная работа № 5.
«Окислительно - восстановительные реакции»
Контроль знаний по теме:«Окислительно - восстановительные реакции»
Контрольная работа 5
тест
Повтор темы
ОБОБЩЕНИЕ И СИСТЕМАТИЗАЦИЯ ЗНАНИЙ (2 часа)
68
Обобщение и систематизация знаний по классам неорганических веществ
Подготовиться к итоговой контрольной работе
УПЗУ
Обобщающий
- вычислять массу, объем и количество вещества по уравнениям реакций;
-определять степень окисления элемента в соединении
Повтор хими свойства
69
Итоговая контрольная работа № 6
Проверка знаний
Контрольная работа № 6
ДМ
«Контрольные и проверочные работы. Химия-8»
Повтор темы
70
Повтор. Решение задач комбинированного типа
6.УЧЕБНО-МЕТОДИЧЕСКОЕ ОБЕСПЕЧЕНИЕ ПО ПРЕДМЕТУ
Программа к завершённой предметной линии и системе учебников
Автор: Габриелян О. С. (М.: Дрофа, 2011)
Учебник, учебное пособие
Учебник: «Химия 8» (М.: Дрофа, 2008 Учебное пособие. О. С. Габриелян,
Рабочая тетрадь для обучающихся
Габриелян О.С., Яшукова А.В. Химия. 8 класс: рабочая тетрадь к учебнику Габриеляна О.С. - М.: Дрофа, 2011.
Электронное приложение к УМК
Электронное мультимедийное издание к учебнику О. С. Габриеляна «Химия. 8 класс». «Химия».
Материалы для контроля (тесты и т.п.)
«Химия в тестах, задачах, упражнениях. 8-9 классы», 2010
Решение задач по химии И. Г. Хомченко, 2000
Методическое пособие с поурочными разработками
Габриелян О.С. Химия. 8 - 9 классы: Методическое пособие. - 4-е изд., стереотип. - М.: Дрофа, 2014
Список используемой литературы
Лидин Р.А. Справочник по общей и неорганической химии. - М.:Просвещение: Учеб. лит., 1997.
Курмашева К.К. Химия в таблицах и схемах. Учебно-образовательная серия. - М.: Лист Нью, 2002
Суровцева Р.П., Софронов С.В. Задания для самостоятельной работы по химии в 8 классе : Кн. для учителя. - М.: Просвещение, 1993.
Химия в таблицах. 8 - 11 кл.: Справочное пособие / Авт.-сост. А.Е. Насонова. - М.: Дрофа, 2010.
Цифровые и электронные образовательные ресурсы
hemi.nsu.ru
college.ru HYPERLINK "college.ru/chemistry/" HYPERLINK "college.ru/chemistry/" HYPERLINK "college.ru/chemistry/" HYPERLINK "school-sector.relarn.ru/nsm/chemistry/START.html" HYPERLINK "college.ru/chemistry/" HYPERLINK "college.ru/chemistry/" HYPERLINK "college.ru/chemistry/"school-sector.relarn.ru
alhimikov.net
7. ПЛАНИРУЕМЫЕ РЕЗУЛЬТАТЫ ОБУЧЕНИЯ
В результате изучения химии ученик должен знать/понимать
· химическую символику: знаки химических элементов, формулы химических веществ и уравнения химических реакций;
· важнейшие химические понятия: химический элемент, атом, молекула, относительные атомная и молекулярная массы, ион, химическая связь, вещество, классификация веществ, моль, молярная масса, молярный объем, химическая реакция, классификация реакций, электролит и неэлектролит, электролитическая диссоциация, окислитель и восстановитель, окисление и восстановление;
уметь
· называть: химические элементы, соединения изученных классов;
· объяснять: физический смысл атомного (порядкового) номера химического элемента, номеров группы и периода, к которым элемент принадлежит в периодической системе Д.И. Менделеева; закономерности изменения свойств элементов в пределах малых периодов и главных подгрупп; сущность реакций ионного обмена;
· характеризовать: химические элементы (от водорода до кальция) на основе их положения в периодической системе Д.И.Менделеева и особенностей строения их атомов; связь между составом, строением и свойствами веществ; химические свойства основных классов неорганических веществ;
· определять: состав веществ по их формулам, принадлежность веществ к определенному классу соединений, типы химических реакций, валентность и степень окисления элемента в соединениях, тип химической связи в соединениях, возможность протекания реакций ионного обмена;
· составлять: формулы неорганических соединений изученных классов; схемы строения атомов первых 20 элементов периодической системы Д.И.Менделеева; уравнения химических реакций;
· обращаться с химической посудой и лабораторным оборудованием;
· распознавать опытным путем: кислород, водород, углекислый газ, аммиак; растворы кислот и щелочей, хлорид-, сульфат-, карбонат-ионы;
· вычислять: массовую долю химического элемента по формуле соединения; массовую долю вещества в растворе; количество вещества, объем или массу по количеству вещества, объему или массе реагентов или продуктов реакции;
использовать приобретенные знания и умения в практической деятельности и повседневной жизни для:
· безопасного обращения с веществами и материалами;
· экологически грамотного поведения в окружающей среде;
· оценки влияния химического загрязнения окружающей среды на организм
человека;
· критической оценки информации о веществах, используемых в быту;
· приготовления растворов заданной концентрации.
В результате изучения химии на базовом уровне ученик должен
проводить самостоятельный поиск химической информации с использованием различных источников (научно-популярных изданий, компьютерных баз данных, ресурсов Интернета); использовать компьютерные технологии для обработки и передачи химической информации и ее представления в различных формах;
использовать приобретенные знания и умения в практической деятельности и повседневной жизни для:
- объяснения химических явлений, происходящих в природе, быту и на производстве;
- определения возможности протекания химических превращений в различных условиях и оценки их последствий;
- экологически грамотного поведения в окружающей среде;
- оценки влияния химического загрязнения окружающей среды на организм человека и другие живые организмы;
- безопасного обращения с горючими и токсичными веществами, лабораторным оборудованием;
- приготовление растворов заданной концентрации в быту и на производстве;
- критической оценки достоверности химической информации, поступающей из разных источников.
• прогнозировать результаты воздействия различных факторов на смещение химического равновесия.
• прогнозировать химические свойства веществ на основе их состава и строения;
• прогнозировать способность вещества проявлять окислительные или восстановительные свойства с учётом степеней окисления элементов, входящих в его состав;
• выявлять существование генетической взаимосвязи между веществами в ряду: простое вещество - оксид - гидроксид - соль;
• организовывать, проводить ученические проекты по исследованию свойств веществ, имеющих важное практическое значение.
8. КОРРЕКТИРОВКА ВЫПОЛНЕНИЯ ПРОГРАММЫ, СВЯЗАННАЯ С РИСКАМИ В 2015-2016 УЧЕБНОМ ГОДУ
Риски
Выполнение программ
класс
предмет
дата
кол-во час
тема
дата
предмет
тема
учитель
8
химия
23.02
1
Реакции обмена
27.02
химия
Реакции обмена
8
химия
23.02
1
Типы химических реакций на
примере свойств воды
27.02
химия
Типы химических реакций на
примере свойств воды
8
химия
08.03
1
Растворение. Растворимость веществ в воде.
12.03
химия
Растворение. Растворимость веществ в воде.
8
химия
08.03
1
Электролитическая диссоциация
12.03
химия
Электролитическая диссоциация
9. ПРИЛОЖЕНИЕ
9.1 Практическая часть (состоит из 6 практических работ)
Основная цель практического раздела программы - формирование у обучающихся умений, связанных с использованием полученных знаний, повышения образовательного уровня, расширения кругозора учащихся закрепление и совершенствование практических навыков.
Представленные в рабочей программе практические работы отдельными уроками.
Практическая работа №1
Правила техники безопасности при работе в химическом кабинете. Приёмы обращения с лабораторным оборудованием и нагревательными приборами
Цель: познакомиться с правилами техники безопасности при работе в химической лаборатории и лабораторным оборудованием.
Оборудование: лабораторный штатив, спиртовка, держатель, разнообразная лаботаторная посуда: пробирка, круглодонная и коническая колбы и т.д., спички.
Инструкция по технике безопасности при работе со спиртовкой:
-
Если зажечь спиртовку сразу же после снятия колпачка, загорается плёнка спирта на горлышке спиртовки как раз на том месте, где колпачок прилегает к горлышку. Пламя проникает под диск с трубкой, и пары спирта внутри резервуара загораются. Может произойти взрыв и выброс диска вместе с фитилём. Чтобы избежать этого, приподнимите на несколько секунд диск с фитилём для удаления паров .Если случится воспламенение паров, быстро отставьте в сторону предметы (тетрадь для практических работ) и позовите учителя.
-
Зажжённую спиртовку нельзя переносить с места на место, нельзя также зажигать одну спиртовку непосредственно от другой. Для зажигания спиртовки пользуйтесь спичками.
-
Гасить спиртовку можно только одним способом - накрыть пламя фитиля колпачком. Колпачок должен находиться всегда под рукой.
Опыт №1. Знакомство с лабораторным оборудованием
а) Устройство лабораторного штатива
б) Приёмы работы со спиртовкой
-
Держатель фитиля;
2, 4. Резервуар для спирта;
3. Фитиль;
5. Колпачок.
ТРЕБОВАНИЯ БЕЗОПАСНОСТИ ВО ВРЕМЯ РАБОТЫ В КАБИНЕТЕ ХИМИИ
ЗАПРЕЩАЕТСЯ:
-
Есть, пить в химическом кабинете, пробовать вещества на вкус;
-
Брать вещества руками;
-
Оставлять неубранными рассыпанные или разлитые реактивы;
-
Выливать или высыпать отработанные реактивы в раковину;
-
Выливать или высыпать остатки реактивов в склянки и банки, из которых они были взяты;
-
Набирать ртом при помощи пипетки ядовитые и едкие жидкости;
-
Набирать одной и той же ложечкой или пипеткой различные вещества;
-
Менять пробки и пипетки от различных банок или склянок;
-
Оставлять открытыми склянки с жидкостями и банки с сухими веществами;
-
Работать с легковоспламеняющимися веществами вблизи огня;
-
Переходить на другие рабочие места без разрешения учителя;
-
Перебрасывать друг другу какие-либо предметы;
-
Бесцельно смешивать растворы или испытывать вещества по собственному усмотрению, проводить самостоятельно любые опыты, не предусмотренные данной работой;
-
Уносить с собой, что бы то ни было из предметов и веществ, предназначенных для проведения опытов;
-
Зажигать спиртовку без надобности;
-
Оставлять пробирки и другую химическую посуду грязной.
Инструкция по технике безопасности:
-
Если зажечь спиртовку сразу же после снятия колпачка, загорается плёнка спирта на горлышке спиртовки как раз на том месте, где колпачок прилегает к горлышку. Пламя проникает под диск с трубкой, и пары спирта внутри резервуара загораются. Может произойти взрыв и выброс диска вместе с фитилём. Чтобы избежать этого, приподнимите на несколько секунд диск с фитилём для удаления паров .Если случится воспламенение паров, быстро отставьте в сторону предметы (тетрадь для практических работ) и позовите учителя.
-
Зажжённую спиртовку нельзя переносить с места на место, нельзя также зажигать одну спиртовку непосредственно от другой. Для зажигания спиртовки пользуйтесь спичками.
-
Гасить спиртовку можно только одним способом - накрыть пламя фитиля колпачком. Колпачок должен находиться всегда под рукой.
Опыт №1. Знакомство с лабораторным оборудованием
а) Устройство лабораторного штатива
Устройство штатива (нарисовать штатив, обозначить его составные части)

-
Чугунная подставка
-
Стержень
-
Муфта
-
Лапка
-
Кольцо
б) Приёмы работы со спиртовкой
Устройство спиртовки (нарисовать спиртовку, обозначить её составные части)

1.Сосуд
2.Фитиль
3.Металлическая трубка с диском
4.Колпачёк
1.Снять колпачок
2.Прроверить плотно ли прилегает диск к отверстию сосуда
3. Зажечь спиртовку горящей спичкой (НЕЛЬЗЯ ЗАЖИГАТЬ СПИРТОВКУ ОТ ДРУГОЙ ГОРЯЩЕЙ СПИРТОВКИ!)
4. Погасить спиртовку накрыв пламя колпачком.
3.Посуда (нарисовать пробирки, колбы, химический стакан)
4.Фильтрование
1. приготовить фильтровальную бумагу;
2. смочить фильтровальную бумагу;
3. вложить в воронку;
4. жидкость наливают, по стеклянной палочке, направляя её на стенку воронки;
5. фильтрат, стекает по стенке стакана, а не в центр, чтобы не выплёскивался.
Найти в тексте определения фильтрата, осадка и процесса фильтрования.
Практическая работа №2
Очистка загрязненной поваренной соли
Инструктаж по технике безопасности
Цель работы: Научиться проводить разделение смесей, очистку веществ, фильтрование.
Оборудование: смесь песка с солью, 2 стаканчика, стеклянная палочка, промывалка с водой, фильтр, воронка, спички, спиртовка, зажим, чашка для выпаривания.
Ход работы
-
Фронтальное обсуждение последовательности действий при разделении смеси песка и соли.
-
Оформление таблицы и её заполнение по ходу работы.
Что делал
Что наблюдал
Выводы
В графе «Что делал» рисунки с подписями.
-
Дополнительное задание.
Составить план разделения смеси: а) речной песок, бензин, соль; б) железные, медные опилки, сахарный песок.
Практическая работа №3
Приготовление раствора сахара и определение массовой доли его в растворе
Инструктаж по технике безопасности.
Цель работы: Научиться готовить растворы и определять их массовые доли.
Оборудование: Мерный цилиндр, коническая колба, чайная ложка, лабораторные весы, стеклянная палочка.
Реактивы: Сахар, вода.
Ход работы
-
Определить массу сахара (взвесить);
-
Приготовить раствор;
-
Рассчитать массовые доли сахара и воды в полученном растворе;
-
Рассчитать число молекул сахара в полученном растворе.
Дано:
Н2О, С12Н22О12
mсахара=.
Vводы = 50мл.
______________
ωсахара =?
ωводы = ?
Nсах. = ?
Практическая работа№4.
«Решение экспериментальных задач по теме Классы неорганических соединений»
Цель работы: Научиться опытным путем получать и распознавать неорганические вещества.
Оборудование и реактивы: штатив с кольцом ,пробирки-6 штук, спиртовка,
фарфоровая чашечка, спички, металлическая ложечка для сжигания,
реактивы-индикаторы фенолфталеин,лакмус, гидроксид натрия, соляная кислота,оксид кальция,магний стружка, сульфат меди (II), хлорид железа (III)
Задача1.
В двух пробирках находится прозрачный раствор. Как при помощи индикаторов а)фенолфталеина , б)лакмуса
определить в какой из пробирок находится гидроксид натрия , а в какой соляная кислота
Задача 2.
Осуществить превращение: оксид кальция → гидроксид кальция
В пробирке №3 дан оксид кальция .Получить гидроксид кальция .Доказать , что полученное вещество-щелочь .Записать уравнение химической реакции
Задача3.
Осуществить превращения:
Как получить гидроксид магния , исходя из металлического магния?
магний→ оксид магния→ хлорид магния → гидроксид магния
Запишите уравнения химических реакций
А)горения магния в кислороде
Б)взаимодействия оксида магния с соляной кислотой
В)взаимодействия хлорида магния с гидроксидом натрия
Задача4.
Осуществить превращения:
сульфат меди( II )→ гидроксид меди (II )→ оксид меди (II)
Даны гидроксид натрия и сульфат меди (II) , получить гидроксид меди (II).
Как из гидроксида меди (II )получить оксид меди( II)?
Запишите уравнения химических реакций.
Задача 5.
Как из хлорида железа (III )получить оксид железа (III) (косвенным путем, т.е. в два этапа)?
Осуществить превращение : хлорида железа (III ) → оксид железа (III)
Запишите уравнения химических реакци
Практическая работа№5.
Получение и свойства кислорода
Цель работы: получить кислород и изучить его свойства
Оборудование : штатив , пробирка , лучинка ,спички, стеклянная ложечка
Реактивы: пероксид водорода , оксид марганца IV
Ход работы :
1.В пробирку налить 2 мл пероксида водорода и добавить стеклянной ложечкой немного оксида марганца IV .Наблюдать выделение пузырьков газа из раствора. Какой газ выделяется?
Запишите уравнение химической реакции.
2.Опустить в пробирку (не касаясь жидкости) тлеющую лучинку.Что наблюдали? Запишите уравнение реакции горения угля в кислороде
Выводы: (ответить на вопросы)
1.Почему разложение пероксида водорода при обычной температуре происходит только в присутствии оксида марганца IV?
2.Что такое катализатор?
3.Почему кислород сразу не исчез из пробирки?
4.Почему в присутствии чистого кислорода тлеющая лучинка вспыхивает?
5.Можно ли сохранить кислород в химическом стакане ,закрыв его картонкой? Почему?
6.Какие способы получения кислорода вы знаете ? Запишите уравнения четырех химических реакций.
7.Как можно применить полученные знания?
Практическая работа № 6
Решение экспериментальных задач
Инструктаж по технике безопасности.
Цель работы: Научиться опытным путем получать или определять вещества.
Оборудование: спиртовка, штатив с пробирками.
Реактивы: KCl, MgSO4, Zn, PbNO3, BaCl2, H2SO4
Ход работы
Уравнения реакций
Наблюдения, тип реакции
I.
-
KCl + Pb(NO3)2 =
-
KCl + BaCl2 =
-
MgSO4 + Pb(NO3)2 =
-
MgSO4 + BaCl2 =
II.
Zn + H2SO4 =
Выводы:
Задание:
-
Обнаружение сульфат-ионов SO42- и хлорид-ионов Cl- (стр.238 опыт 3);
-
Получить хлорид цинка ZnSO4 (стр.242 задание 1):
-
определить тип реакции, обратимость;
-
для реакций ионного обмена привести уравнения в молекулярном, в полном и сокращенном ионном виде.
окислительно-восстановительные реакции уравнять методом электронного баланса.
9.2 Срезовая контрольная работа за первое полугодие
Вариант - 1
Часть А
А1. Верны ли следующие суждения о составе веществ?
А.Молекула простого вещества состоит из атомов одного элемента.
Б.Молекулы всех сложных веществ состоят из атомов двух элементов.
1)верно только А 3)верны оба суждения
2)верно только Б 4)оба суждения неверны
А2. Число протонов в ядре атома фтора равно
1)18 2)9 3)2 4)7
А3. Ковалентная полярная связь в молекуле
-
Cl2 2) Na2O 3) H2O 4) Cu
А4. Постоянную валентность в соединениях имеет элемент
1) сера 2) водород 3) фосфор 4) хлор
А5. Степень окисления +5 азот проявляет в соединении
-
N2O 2) HNO3 3) NO2 4) HNO2
А6. Формула силиката калия
-
CaSiO3 2) K2SiO3 3) Ca2Si 4) SiO2
А7. В какой реакции сумма коэффициентов равна пяти
-
CaO + SO3 = CaSO4 3) Zn + 2HCl = ZnCl2 + H2
2) 2KOH + H2SO4 = K2SO4 + 2H2O 4) MgCO3 = MgO + CO2
А8.Экзотермической реакцией является
1)2H2 + O2 = 2H2O + Q 3)2NH3 = N2 + 3H2 - Q
2)N2 + O2 = 2NO - Q 4)CaCO3 = CaO + CO2 -Q
А9.Коэффициент перед формулой кислорода в уравнении реакци
KNO3 = KNO2 + O2 равен
-
5 2) 2 3) 1 4) 3
А10. Количество вещества (моль) кислорода в 64 г вещества равно
-
4 2) 2 3) 6 4) 8
Часть В
В1. Установите соответствие между формулой вещества и классом, к которому оно принадлежит.
ФОРМУЛА ВЕЩЕСТВА НАЗВАНИЕ КЛАССА
А) H2SO4 1)средняя соль
Б) N2O5 2)кислота
В) CuCl2 3)оксид
Г) NaOH 4)кислая соль
В2.Установите соответствие между уравнением реакции и типом реакции.
УРАВНЕНИЕ РЕАКЦИИ ТИП РЕАКЦИИ
А) Cu(OH)2=CuO + H2O 1) замещения
Б) FeCl2 + Al = AlCl3 + Fe 2) соединения
В) Mg + O2 = MgO 3) обмена
Г) NaOH + HCl = NaCl + H2O 4) разложения
Часть С С1. Определите массу оксида кальция, который образуется при взаимодействии 5 г кальция с кислородом.(Ответ округлить до целого числа)
Вариант - 2
Часть А
А1. Верны ли следующие суждения об атоме?
А.В состав ядра атома входят протоны и нейтроны.
Б.Число протонов в атоме равно значению относительной атомной массы.
1)верно только А 3)верны оба суждения
2)верно только Б 4)оба суждения неверны
А2. Схема распределения электронов в атоме фосфора
1)2е 5е 2) 2е 8е 5е 3)2е 8е 4е 4)2е 8е
А3. Ковалентная неполярная связь в молекуле
1)N2 2) N2O 3) K2O 4) Fe
А4. Переменную валентность в соединениях имеет элемент
1) сера 2) водород 3) натрий 4) барий
А5. Формула простого вещества
1)Cu2O 2) NaNO3 3) N2 4) Fe(OH)2
А6. Формула сульфата натрия
1)CaSiO3 2) Na2SO3 3) Na2SO4 4) Na2S
А7. Реакция обмена соответствует запись
1)CaO + SO2 = CaSO3 3) Fe + 2HCl = FeCl2 + H2
2) 2LiOH + H2SO4 = Li2SO4 + 2H2O 4) BaCO3 = BaO + CO2
А8.Эндотермической реакцией является
1)2H2 + O2 = 2H2O + Q 3) N2 + 3H2 =2NH3 + Q
2)N2 + O2 = 2NO - Q 4)С + О2 = CO2 +Q
А9.Коэффициент перед формулой CO2 в уравнении реакции, схема которой Fe2O3 + CO = Fe + CO2 равен
-
5 2) 2 3) 1 4) 3
А10. Масса натрия (г), которой соответствует 0,5 моль вещества, равна
-
11 2) 11,5 3) 10,5 4) 1,5
Часть В
В1. Установите соответствие между формулой вещества и видом химической связи в нем.
ФОРМУЛА ВЕЩЕСТВА ВИД ХИМИЧЕСКОЙ СВЯЗИ
А) NaCl 1) ковалентная полярная
Б) O2 2) ионная
В) H2S 3) металлическая
Г) Bа 4) ковалентная неполярна
В2.Установите соответствие между химической формулой вещества и степенью окисления серы в нем.
ФОРМУЛА ВЕЩЕСТВА СТЕПЕНЬ ОКИСЛЕНИЯ СЕРЫ
А) SO3 1) +2
Б) S 2) +6
В) SO2 3) 0
Г) H2S 4) +4
5) -2
Часть С
С1. Определите массовую долю хлорида кальция в полученном растворе, если к 10%-ному раствору хлорида кальция массой 70 г добавили 20 г воды.(Ответ округлить до целого числа)
9.3 Итоговая контрольная работа.
ВАРИАНТ-1
Часть 1
При выполнении заданий этой части под номером выполняемого вами задания поставьте знак «Х» в клеточку, номер которой соответствует номеру выбранного вами ответа.
А1. Число атомов всех химических элементов в молекуле серной кислоты равно:
1) 3
3) 7
2) 4
4) 6
А2. Число протонов, нейтронов и электронов в атоме фтора 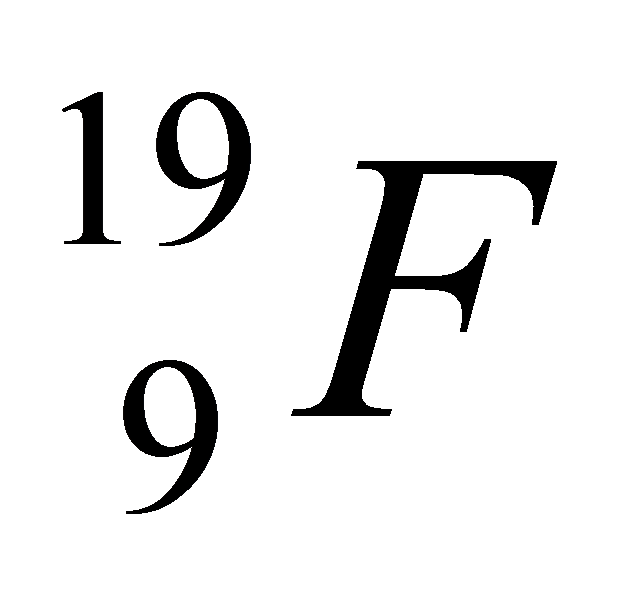
1) p+ - 9; n0 - 10; ē - 19
3) p+ - 9; n0 - 10; ē - 9
2) p+ - 10; n0 - 9; ē - 10
4) p+ - 9; n0 - 9; ē - 19
А3. Группа формул веществ с ковалентным типом связи:
1) H2S, P4, CO2
3) HCl, NaCl, H2O
2) H2, Na, CuO
4) CaO, SO2, CH4
А4. Вещество, при растворении которого в воде электролитической диссоциации практически не происходит:
1) гидроксид натрия
3) хлорид серебра
2) сульфат калия
4) нитрат алюминия
А5. Одновременно могут находиться в растворе ионы:
1) Na+, H+, Ba2+, OH-
3) Mg2+, K+, NO3-, SO42 -
2) Fe2+, Na+, OH- , SO42-
4) Ca2+, H+, CO32-, Cl -
А6. Верны ли следующие высказывания?
А. Оксид фосфора (V) - кислотный оксид.
Б. Соляная кислота - одноосновная кислота.
1) верно только А
3) верно только Б
2) верны оба суждения
4) оба суждения не верны
Часть 2
В задании В1 на установление соответствия запишите в таблицу цифры выбранных вами ответов, а затем полученную последовательность цифр перенесите в бланк ответов без пробелов и других символов. (Цифры в ответе могут повторяться).
В1. Установите соответствие между формулой вещества и классом соединения:
Формула вещества:
Класс соединения:
А) Н3РО4
1) соль
Б) SO3
2) основный оксид
В) Сu(OH)2
3) нерастворимое основание
Г) CaCl2
4) кислотный оксид
5) кислота
6) растворимое основание
А
Б
В
Г
Ответом к заданию В2 является последовательность цифр, которые соответствуют номерам правильных ответов. Запишите выбранные цифры в бланк ответов в порядке возрастания без пробелов и других символов.
В2. С раствором гидроксида натрия реагируют:
1) сульфат меди (II)
4) азотная кислота
2) оксид меди (II)
5) магний
3) гидроксид калия
6) оксид углерода (IV)
Ответом к заданию В3 является число. Запишите это число в бланк ответов без указания единиц измерения.
В3. Масса соли, содержащейся в 150 г 5 %-ного раствора соли, равна _____г. (Запиши число с точностью до десятых).
Часть 3
Запишите номер задания и полное решение
C1. Составьте уравнения химических реакций согласно схеме:
Fe(OH)3 → Fe2O3 → Fe → FeSO4 → Fe(OH)2. Назовите все сложные вещества, укажите тип реакции.
Дорогой восьмиклассник!
На выполнение контрольной работы отводится 40 минут. Работа состоит из 3 частей и включает 10 заданий.
Часть 1 включает 6 заданий базового уровня (А1-А6). К каждому заданию дается 4 варианта ответа, из которых только один правильный. За выполнение каждого задания - 1 балл.
Часть 2 состоит из 3 заданий повышенного уровня (В1-В3), на которые надо дать краткий ответ в виде числа или последовательности цифр. За выполнение каждого задания - 2 балла.
Часть 3 содержит 1 наиболее сложное объемное задание С1, которое требует полного ответа. За выполнение задания ты можешь получить 4 балла.
Баллы, полученные за выполненные задания, суммируются. Максимально ты можешь набрать 16 баллов. Желаю успеха!
Система оценивания работы:
0-6 баллов - «2»
7-10 баллов - «3»
11-14 баллов - «4»
15-16 баллов - «5»
ВАРИАНТ-2
Часть 1
При выполнении заданий этой части под номером выполняемого вами задания поставьте знак «Х» в клеточку, номер которой соответствует номеру выбранного вами ответа.
А1. Число атомов всех химических элементов в молекуле фосфорной кислоты равно:
1) 3
3) 10
2) 6
4) 8
А2. Число протонов, нейтронов и электронов в атоме хлора 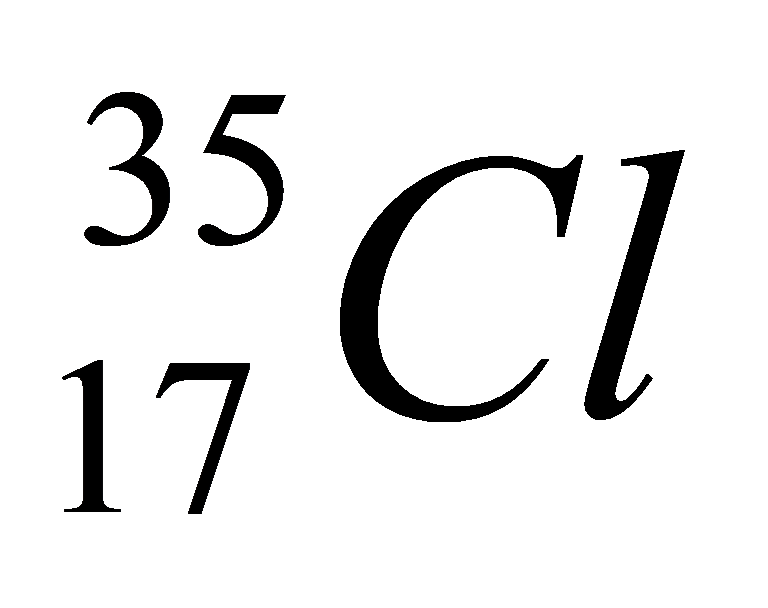
1) p+ - 18; n0 - 18; ē - 18
3) p+ - 17; n0 - 18; ē - 18
2) p+ - 17; n0 - 17; ē - 17
4) p+ - 17; n0 - 18; ē - 17
А3. Группа формул веществ с ионным типом химической связи:
1) Na2S, KCl, HF
3) CO2, BaCl2, NaOH
2) K2O, NaH, NaF
4) Ca, O2, AlCl3
А4. Вещество, которое в водном растворе полностью диссоциирует:
1) оксид меди
3) сульфат бария
2) нитрат калия
4) гидроксид железа (III)
А5. Одновременно не могут находиться в растворе ионы:
1) H+, Ba2+, OH- , NO3-
3) Zn2+, K+, Cl -, SO42 -
2) Fe2+, Na+, NO3- , SO42-
4) K+, Na+, OH-, Cl -
А6. Верны ли следующие высказывания?
А. Серная кислота - двухосновная.
Б. Оксид калия - основный оксид.
1) верно только А
3) верно только Б
2) верны оба суждения
4) оба суждения не верны
Часть 2
В задании В1 на установление соответствия запишите в таблицу цифры выбранных вами ответов, а затем полученную последовательность цифр перенесите в бланк ответов без пробелов и других символов. (Цифры в ответе могут повторяться).
В1. Установите соответствие между формулой вещества и классом соединения:
Формула вещества:
Класс соединения:
А) LiOH
1) соль
Б) SO2
2) основный оксид
В) HNO3
3) нерастворимое основание
Г) CaCO3
4) кислотный оксид
5) кислота
6) растворимое основание
А
Б
В
Г
Ответом к заданию В2 является последовательность цифр, которые соответствуют номерам правильных ответов. Запишите выбранные цифры в бланк ответов в порядке возрастания без пробелов и других символов.
В2. В реакцию с раствором соляной кислоты вступают:
1) ртуть
4) карбонат натрия
2) гидроксид магния
5) хлорид бария
3) оксид натрия
6) оксид серы (VI)
Ответом к заданию В3 является число. Запишите это число в бланк ответов без указания единиц измерения.
В3. В 450 г воды растворили 50 г соли. Массовая доля соли в полученном растворе равна_____%. (Запиши число с точностью до десятых).
Часть 3
Запишите номер задания и полное решение.
C1. Составьте уравнения химических реакций согласно схеме
Na → NaOH → Cu(OH)2 → CuO → Cu. Назовите все сложные вещества, укажите тип реакции.
Ответы.
Часть 1
А1
А2
А3
А4
А5
А6
Вариант 1
3
3
1
3
3
2
Вариант 2
4
4
2
2
1
2
Часть 2
В1
В2
В3
Вариант 1
5431
146
7,5
Вариант 2
6451
234
10,0
Часть 3 (возможный вариант ответа)
Вар-т
Содержание верного ответа и указания по оцениванию
Баллы
Правильно записаны 4 уравнения в молекулярном виде, указан тип реакции, названы сложные вещества
4
В одном уравнении реакции допущена ошибка или ответ неполный
3
В двух уравнениях реакций допущена ошибка или ответ неполный
2
В трех уравнениях реакций допущена ошибка или ответ неполный
1
Все элементы ответа записаны неверно
0
1
1) 2Fe(OH)3 = Fe2O3 + 3H2O - реакция разложения
гидроксид оксид вода
железа(III) железа(III)
2) Fe2O3 + 3Н2 = 2Fe + 3Н2О - реакция замещения
3) Fe + H2SO4 = FeSO4 + H2 - реакция замещения
серная сульфат
кислота железа(II)
4) FeSO4 + 2NaOH = Fe(OH)2 + Na2SO4 - реакция обмена
гидроксид гидроксид сульфат
натрия железа (II) натрия
2
1) 2Na + 2H2O = 2NaOH + H2 - реакция замещения
вода гидроксид
натрия
2) 2NaOH + CuCl2 = Cu(OH)2 + 2NaCl - реакция обмена
хлорид гидроксид хлорид
меди (II) меди (II) натрия
3) Cu(OH)2 = CuO + H2O- реакция разложения
4) CuO + H2 = Cu + H2O- реакция замещения
9.4 Критерии оценки учебной деятельности по химии
1. Оценка устного ответа.
Отметка «5» :
- ответ полный и правильный на основании изученных теорий;
- материал изложен в определенной логической последовательности, литературным языком;
- ответ самостоятельный.
Ответ «4» ;
- ответ полный и правильный на сновании изученных теорий;
- материал изложен в определенной логической последовательности, при этом допущены две-три несущественные ошибки, исправленные по требованию учителя.
Отметка «З» :
- ответ полный, но при этом допущена существенная ошибка или ответ неполный, несвязный.
Отметка «2» :
- при ответе обнаружено непонимание учащимся основного содержания учебного материала или допущены существенные ошибки, которые учащийся не может исправить при наводящих вопросах учителя, отсутствие ответа.
2. Оценка экспериментальных умений.
- Оценка ставится на основании наблюдения за учащимися и письменного отчета за работу.
Отметка «5»:
- работа выполнена полностью и правильно, сделаны правильные наблюдения и выводы;
- эксперимент осуществлен по плану с учетом техники безопасности и правил работы с веществами и оборудованием;
- проявлены организационно - трудовые умения, поддерживаются чистота рабочего места и порядок (на столе, экономно используются реактивы).
Отметка «4» :
- работа выполнена правильно, сделаны правильные наблюдения и выводы, но при этом эксперимент проведен не полностью или допущены несущественные ошибки в работе с веществами и оборудованием.
Отметка «3»:
- работа выполнена правильно не менее чем наполовину или допущена существенная ошибка в ходе эксперимента в объяснении, в оформлении работы, в соблюдении правил техники безопасности на работе с веществами и оборудованием, которая исправляется по требованию учителя.
Отметка «2»:
- допущены две (и более) существенные ошибки в ходе: эксперимента, в объяснении, в оформлении работы, в соблюдении правил техники безопасности при работе с веществами и оборудованием, которые учащийся не может исправить даже по требованию учителя;
- работа не выполнена, у учащегося отсутствует экспериментальные умения.
3. Оценка умений решать расчетные задачи.
Отметка «5»:
- в логическом рассуждении и решении нет ошибок, задача решена рациональным способом;
Отметка «4»:
- в логическом рассуждении и решения нет существенных ошибок, но задача решена нерациональным способом, или допущено не более двух несущественных ошибок.
Отметка «3»:
- в логическом рассуждении нет существенных ошибок, но допущена существенная ошибка в математических расчетах.
Отметка «2»:
- имеется существенные ошибки в логическом рассуждении и в решении.
- отсутствие ответа на задание.
4. Оценка письменных контрольных работ.
Отметка «5»:
- ответ полный и правильный, возможна несущественная ошибка.
Отметка «4»:
- ответ неполный или допущено не более двух несущественных ошибок.
Отметка «3»:
- работа выполнена не менее чем наполовину, допущена одна существенная ошибка и при этом две-три несущественные.
Отметка «2»:
- работа выполнена меньше чем наполовину или содержит несколько существенных ошибок.
- работа не выполнена.
При оценке выполнения письменной контрольной работы необходимо учитывать требования единого орфографического режима.
5. Оценка тестовых работ.
Тесты, состоящие из пяти вопросов можно использовать после изучения каждого материала (урока). Тест из 10-15 вопросов используется для периодического контроля. Тест из 20-30 вопросов необходимо использовать для итогового контроля.
При оценивании используется следующая шкала: для теста из пяти вопросов
• нет ошибок - оценка «5»;
• одна ошибка - оценка «4»;
• две ошибки - оценка «З»;
• три ошибки - оценка «2».
Для теста из 30 вопросов:
• 25-З0 правильных ответов - оценка «5»;
• 19-24 правильных ответов - оценка «4»;
• 13-18 правильных ответов - оценка «З»;
• меньше 12 правильных ответов - оценка «2».
6. Оценка реферата.
Реферат оценивается по следующим критериям:
• соблюдение требований к его оформлению;
• необходимость и достаточность для раскрытия темы приведенной в тексте реферата информации;
• умение обучающегося свободно излагать основные идеи, отраженные в реферате;
• способность обучающегося понять суть задаваемых членами аттестационной комиссии вопросов и сформулировать точные ответы на них.


