- Преподавателю
- Химия
- Разработка урока на тему: Решение качественных задач
Разработка урока на тему: Решение качественных задач
| Раздел | Химия |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Макоева С.Б. |
| Дата | 28.12.2015 |
| Формат | docx |
| Изображения | Есть |
Макоева Светлана Борисовна Решения качественных задач
















МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РСО-АЛАНИЯ
ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ПРОФЕССИОНАЛЬНОЕ
ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
«ПРОФЕССИОНАЛЬНОЕ УЧИЛИЩЕ № 3»
Согласовано
председатель МО
методист _______Т.В. Бдайциева
РАЗРАБОТКА урока по теме :
«Решение качественных задач. »
Исполнитель разработки : преподаватель химии
Макоева Светлана Борисовна .
Владикавказ
2013 год
Решение качественных задач.
-
Предложите не менее трех принципиально разных способов очистки меди от примесей цинка. (3 балла)
Способы очистки меди от примесей цинка основываются на различиях в химических свойствах этих металлов.
-
Так при действии на очищаемый образец соляной кислотой, цинк растворится, а медь нет:
Zn +2HCl = ZnCl2 +H2
Cu + HCl =
медь отделяется фильтрованием, с дальнейшим промыванием водой.
-
При действии на очищаемый образец концентрированным раствором щелочи цинк растворится, а медь нет:
Zn +2KOH +2H2O=K2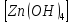 +H2
+H2
Cu + KOH =
медь отделяется фильтрованием, с дальнейшим промыванием водой.
-
Цинк также можно растворить в водном растворе хлорида аммония:
Zn +2NH4Cl +2H2O = H2 + ZnCl2 + 2NH4OH
-
прилить раствор сульфата меди (II), при этом цинк вытеснит медь из раствора соли: Zn + CuSO4 = ZnSO4 + Cu. Медь отделяется фильтрованием, с дальнейшим промыванием водой.
-
Электрохимический способ. Загрязненный образец меди поместим в электролизер и сделаем его анодом. Тонкие листы чистой меди будут играть роль катода; в качестве электролита возьмем подкисленный серной кислотой раствор сульфата меди (II). При пропускании электрического тока медь и цинк будут растворяться на аноде и переходить в раствор в виде ионов:
На аноде: Cu (тв.) → Cu 2+ (водн.) + 2 е -
Zn (тв.) → Zn2+ (водн.) + 2 е -
У меди более положительное значение электродного потенциала, чем у цинка (Е0 Cu 2+/Cu0 = 0,34 В; Е0 Zn 2+/Zn 0 = − 0,76 В), это значит, что медь легче восстанавливается на катоде:
На катоде: Cu 2+ (водн.) + 2 е - = Cu (тв.)
Тщательно регулируя напряжение электролитической ячейки, можно предотвратить осаждение цинка на катоде и получить чистую медь.
-
Имеется смесь этана, этилена, ацетилена. Как химическим путем выделить каждое соединение в индивидуальном виде? Напишите уравнения соответствующих реакций. (4 балла)
-
Пропускаем смесь газов через аммиачный раствор оксида серебра. Образовавшаяся соль ацетиленида серебра выпадает в осадок серого цвета:
HC≡CH + 2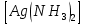 OH →AgC≡CAg +4NH3+2H2O
OH →AgC≡CAg +4NH3+2H2O
Для выделения ацетилена, осадок отфильтровывают и разлагают кислотой:
AgC≡CAg +2HCl → C2H2↑ +2AgCl↓
-
Смесь этана и этилена пропускаем через бромную воду. Поглощается этилен:
С2H4 +Br2 →C2H4Br2
Для регенерации этилена на 1,2 -дибромэтан действуем цинком:
C2H4Br2 + Zn →ZnBr2 +C2H4↑
-
Остался в смеси только этан.
-
Какие из перечисленных веществ могут реагировать с дихроматом калия: хлороводород, гидроксид калия, нитрат калия, серная кислота, метан, этанол. Напишите уравнения реакций и укажите условия их протекания. (5 баллов)
K2Cr2O7(тв)+14HCl(конц) = 2KCl +2CrCl3+3Cl2+7H2O
K2Cr2O7 + 2KOH(конц) = 2K2CrO4 +H2O
K2Cr2O7(тверд) + H2SO4(конц) 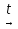 K2SO4 +2CrO3↓+H2O
K2SO4 +2CrO3↓+H2O
3C2H5OH + K2Cr2O7 +4H2SO4 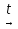 3CH3CHO +Cr2(SO4)3 +K2SO4+7H2O
3CH3CHO +Cr2(SO4)3 +K2SO4+7H2O
3C2H5OH + 2K2Cr2O7 +8H2SO4 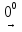 3CH3COOH +2Cr2(SO4)3 +2K2SO4+11H2O
3CH3COOH +2Cr2(SO4)3 +2K2SO4+11H2O
-
Даны вещества: йодид калия, пероксид водорода, озон. Запишите уравнения всех возможных между ними реакций. (5 баллов)
H2O2+2KJ = 2KOH +J2
3H2O2 +KJ = KJO3 +3H2O (в концентрированном горячем KOH)
H2O2 +O3 = 2O2 +H2O
3O3 + KJ = KJO3+3O2
O3+H2O +2KJ = J2 +O2 +2KOH
KJ + O3 = KJO3( в слабощелочной среде)
-
Какие два вещества и при каких условиях вступили в реакцию, если образовались следующие вещества (указаны все продукты реакции без коэффициентов) (5 баллов):
… + … KCl + NaOH
… + … HBr + KBr
… + … Ba3N2 + BaO + BaH2
… + … BaCO3 + Na2CO3 + H2O
… + … CO2 + HCl
KClO + NaH KCl + NaOH
KH + Br2 HBr + KBr
8Ba(изб) + NH4NO3 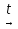 Ba3N2 + 3BaO + 2BaH2
Ba3N2 + 3BaO + 2BaH2
Или 7Ba(изб) + NH4NO2 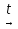 Ba3N2 + 2BaO + 2BaH2
Ba3N2 + 2BaO + 2BaH2
Ba(HCO3)2 + 2NaOH BaCO3 + Na2CO3 + 2H2O или
2NaHCO3 + Ba(OH)2 BaCO3 + Na2CO3 + 2H2O
HCOOH + Cl2 CO2 + 2HCl или COCl2 + H2O CO2 + 2HCl
-
Обсудите возможность взаимодействия следующих веществ (7 баллов):
А) стирол и перманганат калия;
Б) цинк и сульфат алюминия;
В) сульфат меди и метиламин.
а) 1. Окисление стирола водным раствором перманганата калия при нагревании:
3С6Н5 - СН=СН2 +10KMnO4 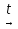 3С6Н5 - СООK + 10MnO2 + 3К2СО3+ KOH + 4H2O
3С6Н5 - СООK + 10MnO2 + 3К2СО3+ KOH + 4H2O
2. Если разбавленным водным раствором перманганата калия действовать на стирол, то он превращается в многоатомный спирт:
3С6Н5 - СН=СН2 +2KMnO4 +4H2O 3С6Н5 - СH(ОH) - CH2(OH) + 2MnO2 + 2KOH
3. Стирол можно окислить до бензоата калия в щелочной среде:
С6Н5 - СН=СН2 +10KMnO4 +13KOH С6Н5 - СООK + 10K2MnO4 + К2СО3+ 8H2O
4. Для превращения стирола в бензойную кислоту реакцию нужно проводить в кислой среде:
С6Н5 - СН=СН2 +2KMnO4 +3H2SO4 С6Н5 - СООH + CO2 + К2SО4+ 2MnSO4 + 4H2O
5.При сжигании стирола в перманганате идет реакция:
3С8H8 +40KMnO4 = 20K2CO3 +40MnO2 +4CO2+12H2O
При нагревании кристаллического перманганата со стиролом - полное окисление
С8Н8 + 20KMnO4 → 10MnO2 + 10K2MnO4 + 8CO2 +4H2O
Б) В водном растворе сульфат алюминия подвергается гидролизу. Среда кислая, цинк реагирует с образовавшемися при гидролизе ионами Н+. Суммарное уравнение примет вид:
Al2(SO4)3 +Zn +2H2O = H2 +2AlOHSO4+ZnSO4
Если вещества находятся в твердом состоянии, то при прокаливании (более 800оС) возможно протекание реакций:
2Al2(SO4)3 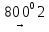 Al2O3+6 SO2 +3O2
Al2O3+6 SO2 +3O2
Образовавшийся кислород начнет реагировать с цинком:
2Zn +O2 =2ZnO
Суммарное уравнение примет вид:
Al2(SO4)3 +3Zn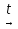 Al2O3 +3ZnO +3SO2↑
Al2O3 +3ZnO +3SO2↑
В) Сульфат меди (II) в водном растворе подвергается гидролизу по катиону. При этом среда раствора кислая. Образовавшийся ион Н+ присоединяется к метиламину с образованием сульфата метиламмония. Итоговое уравнение примет вид:
СuSO4 +2CH3NH2+2H2O = Cu(OH)2 +(CH3NH3)2SO4
Комплексообразование (в избытке концентрированного раствора амина):
CuSO4 + 4CH3NH2 → [Cu(CH3NH2)4]SO4
-
Как одним реактивом различить водные растворы бромоводорода, фторида натрия, гидроксида калия, хлорида алюминия? Напишите уравнения соответствующих реакций. (4 балла)
В качестве реактива используем нитрат серебра AgNO3 . Это вещество с различными ионами образует осадки разных цветов:
HBr +AgNO3 =AgBr↓ +HNO3 (AgBr -желтоватый осадок)
2KOH +2AgNO3 = Ag2O↓+H2O +2KNO3 (Ag2O - бурый осадок)
AlCl3 +3AgNO3 = 3AgCl↓ +Al(NO3)3 (AgCl -белый творожистый осадок)
NaF + AgNO3 = так как AgF растворим
-
В двух пробирках находятся растворы хлорида алюминия и гидроксида натрия. Как, используя только одну чистую пробирку и не используя других реактивов, распознать эти вещества? Напишите уравнения соответствующих реакций. (4 балла)
Для определения в какой из пробирок содержится NaОН, а в какой AlCl3, в чистую пробирку наливаем небольшое количество раствора, например из пробирки № 2. К этому раствору добавляем раствор из пробирки № 1. При этом образуется осадок гидроксида алюминия:
AlCl3 + 3NaOH 3NaCl+Al(ОН)3
Если при дальнейшем добавлении раствора № 1 происходит растворение осадка, значит в пробирке № 1 находится щелочь. В данной реакции образуется гидроксоалюминат:
Al(ОН)3 + NaOH Na[Al(ОН)4]
Если осадок гидроксида алюминия не растворяется при добавлении раствора из пробирки № 1, значит, в этой пробирке находится хлорид алюминия.
-
В четырех пронумерованных пробирках находятся разбавленные растворы гидроксида натрия, хлорида натрия, нитрата серебра, хлороводорода. Как, не используя других реактивов, распознать эти вещества? Напишите уравнения соответствующих реакций. (5 баллов)
-
Вещества
NaOH
NaCl
HCl
AgNO3
NaOH
-
-
+
+ Ag2O↓бурый осадок
NaCl
-
-
-
+ AgCl↓белый творожистый
HCl
+
-
-
+ AgCl↓белый творожистый
AgNO3
+
Ag2O↓ бурый
+
AgCl↓ белый творожистый
+ AgCl↓белый творожистый
-
1 осадок
1 осадок
1 осадок
3 осадка
NaOH +HCl =NaCl +H2O +Q
2NaOH + 2AgNO3=Ag2O↓ +H2O +2NaNO3
NaCl +AgNO3 =AgCl↓+NaNO3
HCl +AgNO3 =AgCl↓+HNO3
По таблице определяем растворы NaOH (один бурый осадок) и AgNO3 (один бурый осадок и 2 осадка белого цвета). Растворы HCl и NaСl дали одинаковый результат (один белый осадок). Чтобы различить эти растворы, воспользуемся осадком Ag2О, который получим при сливании растворов NaOH и AgNO3. Осадок разделим на две пробирки, в каждую из которых прильем исследуемые растворы. При взаимодействии раствора соляной кислоты с Ag2О происходит реакция: Ag2О + 2HCl= 2AgCl↓ + H2О. Мы наблюдаем растворение бурого осадка Ag2О и выпадение белого творожистого осадка AgCl. При добавлении раствора хлорида натрия к Ag2О растворения бурого осадка не происходит (можно наблюдать легкое помутнение раствора вследствие выпадения незначительного количества осадка AgCL, ведь над осадком Ag2О будут находиться ионы серебра, которые взаимодействуют с ионами натрия).
Второй способ различить растворы хлорида натрия и хлороводорода - выпарить на предметном стекле. В случае хлорида натрия останутся белые кристаллы, в случае хлороводорода остатка не будет, при выпаривании кислота «дымит».
-
Соль «А», водный раствор которой образует с нитратом серебра белый творожистый осадок, при действии щелочи и легком нагревании выделяет газ «В» с плотностью по этану 1,5. При сгорании газа «В» образуются два газа, не поддерживающие горения, один из которых - «С» - вызывает помутнение известковой воды. Что из себя представляют вещества «А», «В» и «С»? Приведите их формулы, а также уравнения всех реакций, о которых идет речь в задании. (5 баллов)
Так как соль «А» образует белый творожистый осадок с нитратом серебра, следовательно, это вещество содержит хлорид-ион.
Определим молярную массу газа «В»:
М(В) = 1,5 •М(С2Н6) =1,5•30 =45г/моль
Так как газ «С» не поддерживает горение и вызывает помутнение известковой воды, то это дает основание предположить, что С - углекислый газ. А значит, в состав соли «А» входил и углерод.
Так как при сгорании «В» получился еще один газ, не поддерживающий горение, можно предположить, что этим газом является азот. Следовательно, в состав соли «А» входили элементы: углерод, азот, хлор и вероятно водород. Вещество «В» - является амином. По значению молярной массы (45г/моль) условию задачи удовлетворяет диметиламин или этиламин (вещество «В»)
ИТАК, вещество «А» - хлорид диметиламмония - 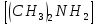 Cl
Cl
Или хлорид этиламмония - 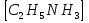 Cl
Cl
Вещество «В» - диметиламин - (СH3)2NH
Или этиламин - C2H5NH2
Вещество «С» - углекислый газ - СО2
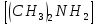 Cl + AgNO3 =AgCl↓+
Cl + AgNO3 =AgCl↓+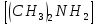 NO3
NO3
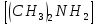 Cl +NaOH = NaCl +H2O +(СH3)2NH↑
Cl +NaOH = NaCl +H2O +(СH3)2NH↑
4(СH3)2NH +15O2 = 8CO2 +2N2 +14H2O
CO2 +Ca(OH)2 = CaCO3+H2O
Или
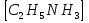 Cl + AgNO3 =AgCl↓+
Cl + AgNO3 =AgCl↓+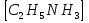 NO3
NO3
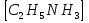 Cl +NaOH = NaCl +H2O+ C2H5NH2↑
Cl +NaOH = NaCl +H2O+ C2H5NH2↑
4C2H5NH2+15O2 = 8CO2 +2N2 +14H2O
CO2 +Ca(OH)2 = CaCO3+H2O
-
Имея в своём распоряжении только концентрированную азотную кислоту и воду, распознайте металлы: алюминий, серебро, железо, никель и кобальт. (5 баллов)
В концентрированной азотной кислоте пассивируются алюминий, железо, кобальт и никель. Значит с помощью концентрированной азотной кислоты можно распознать только серебро:
Ag +2HNO3(конц)= AgNO3 +NO2↑ +H2O
Далее разбавляем кислоту водой(конц. меньше 5%). При такой концентрации все оставшиеся для распознания металлы способны реагировать с ней. Причем алюминий, в отличие от железа, никеля и кобальта реагирует без выделения газообразных веществ:
8Al + 30HNO3(меньше 5%) = 8Al(NO3)3 +3NH4NO3+9H2O
Оставшиеся металлы реагируют с азотной кислотой почти одинаково, однако при этом образуются нитраты этих металлов с различной окраской. Нитрат железа (III) - белый, постепенно на воздухе приобретает коричневую окраску, нитрат кобальта (II) - розовый, а нитрат никеля (II) - изумрудно-зеленый. По окраске образовавшихся растворов можно распознать эти металлы:
Fe +4HNO3 (разб)  Fe(NO3)3 +NO +2H2O
Fe(NO3)3 +NO +2H2O
3Co +8HNO3 (разб)  3Co(NO3)2 +2NO +4H2O
3Co(NO3)2 +2NO +4H2O
3Ni +8HNO3 (разб)  3Ni(NO3)2 +2NO +4H2O
3Ni(NO3)2 +2NO +4H2O
-
Используя в качестве исходных веществ серу, натрий и воду, а также любое оборудование и катализаторы, получите как можно больше других веществ (полученные Вами вещества можно использовать для дальнейших превращений). (За каждое вещество - 1 балл)
S +2Na =Na2S
2Na + 2SNa2S2
2Na +2H2O =2NaOH +H2
6NaOH +3S 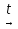 2Na2S +Na2SO3 +3H2O
2Na2S +Na2SO3 +3H2O
S+H2 =H2S
H2S +2NaOH = Na2S + 2H2O
H2S +NaOH = NaHS + H2O
2H2O 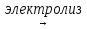 2H2 +O2
2H2 +O2
S +O2 = SO2
2SO2 +O2 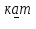 2SO3
2SO3
SO2 +2NaOH = Na2SO3+H2O
SO2 +NaOH = NaHSO3
SO3 +2NaOH = Na2SO4+H2O
SO3 +NaOH = NaHSO4
SO2 +H2O =H2SO3
SO3 +H2O =H2SO4
2Na + H2 = 2NaH
2Na +O2 = Na2O2
Na2O2 +H2O (хол) = H2O2 +2NaOH
2Na2O2 +S 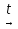 Na2SO3 +Na2O
Na2SO3 +Na2O
Na2SO3 +SO2 = Na2S2O5
Или
1. 2Na + S = Na2S (130°C)
2. 2Na + 2H2O = 2NaOH + H2 (н.у.)
3. S + H2 = H2S (150°C)
4. H2S + NaOH = NaHS + H2O (H2S - избыток, н.у.)
5. 2Na + H2 = 2NaH (t, p)
6. 2H2O = 2H2 + О2 (электролиз воды в присутствии
NaOH)
7. S + О2 = SО2 (горение на воздухе, 280°C)
8. 2SО2 + О2 ↔ 2SО3 (400 - 500°C, кат. Pt, V2O5, Fe2O3)
9. SО2 + NaOH = NaHSО3 (SО2 в избытке, н.у.)
10. SО2 + 2NaOH = Nа2SО3 + H2O (SО2 в недостатке, н.у.)
11. 3О2 ↔ 2О3 (в озонаторе)
12. 4NaОН + 4O3 = 4NaO3 + 2H2O + О2 (действие озона на крист. щелочь)
озонид натрия
13. SО3 + H2O = Н2SО4 (разб.)
14. SО3 (г) + Н2SО4 (безводн.) = Н2S2О7 дисерная кислота
15. Н2SО4 + NaOH = NaHSО4 + H2O (Н2SО4 в избытке, н.у.)
16. Н2SО4 + 2NaOH = Nа2SО4 + 2H2O (Н2SО4 в недостатке, н.у.)
17. SО3 + Nа2SО4 = Nа2S2О7 (45 - 50°C)
18. Nа2SО3 + S = Nа2S2О3 (кипячение)
19. SО2 + H2O↔ Н2SО3 (н.у.)
20. 2Na + 2SO2 = Nа2S2О4 дитионат натрия
21. 2Na + О2 = Na2О2 (умеренное нагревание)
22. Na2О2 + 2H2O = Н2О2 + 2NaOH (на холоду)
23. Na2О2 + Na = 2Na2О (130 - 200°C )
24. Н2О2 + NaOH = NaНО2 + H2O (н.у.)
25. Н2SО4 + H2O2 ↔ Н2SО5 + H2O (н.у.) пероксомоносерная кислота
26. H2S + 3SО2 = H2S4О6 Тетратионовая кислота
27. Na2S + хS(pомб.)= Na2Sх+1 (при сплавлении или в концентрированном растворе) полисульфиды, где х принимает значение от 1 до 7:
28. Nа2SО3 + SO2 = Nа2S2О5 дисульфит (конц. р-р сульфита)
29. Na2O2 + O2 = NaO2 надпероксид (при нагревании под давлением)
30. NaHSO4 + H2O2 (конц) = NaHSO5 + H2O (0оС) пероксосульфат
31. 2NaHSO4 = Na2S2O8 + H2 (электролиз насыщенного раствора) пероксодисульфат (0оС)
32. Na2S2O8 + 2Н2SО4 (конц) = Н2S2О8 +2NaHSO4 (0оС)
Примечание: Возможны и другие продукты
-
Приведите как можно больше способов получения сульфата свинца (II) в одну стадию из разных реагентов. (За каждый способ - 1 балл)
2O3 +PbS = PbSO4 +O2 или 4O3 +3PbS = 3PbSO4
4H2O2 + PbS = PbSO4 +4H2O
Pb + 2H2SO4(конц) = PbSO4 +SO2 +2H2O
Pb(OH)2 + H2SO4(разб) = PbSO4 +2H2O
Pb(NO3)2 + H2SO4(разб) = PbSO4 +2HNO3
PbS + 4H2SO4 (конц) = PbSO4 +4SO2 +4H2O
3PbS + 8HNO3 (разб) 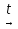 3PbSO4 +8NO +4H2O
3PbSO4 +8NO +4H2O
PbS + 2O2 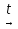 PbSO4
PbSO4
2Pb(SO4)2 +2H2O = 2PbSO4+2H2SO4 +O2
PbO +H2SO4 =PbSO4 +H2O
Или
-
Взаимодействие свинца с серной кислотой:
Pb + H2SO4 = PbSO4↓ +H2 или Pb + 2H2SO4 (конц.)= PbSO4 ↓+2H2O + SO2
-
Взаимодействие свинца с сульфатом менее активного металла:
Pb + CuSO4 = PbSO4 +Cu
-
Взаимодействие оксида свинца (II) c серным ангидридом
PbO + SO3 = PbSO4↓
-
Взаимодействие оксида свинца (II) с серной кислотой
PbO + H2SO4 = PbSO4↓ +H2O
-
Взаимодействие гидроксида свинца (II) c серным ангидридом
Pb(OH)2 + SO3 = PbSO4↓ +H2O
-
Взаимодействие гидроксида свинца (II) с серной кислотой
Pb(OH)2 + H2SO4 = PbSO4↓ +2H2O
-
Взаимодействие растворимой соли свинца с серной кислотой
Pb(NO3)2 + Н2SO4 = PbSO4 ↓+2НNO3
-
Взаимодействие растворимой соли свинца с растворимым сульфатом
Pb(NO3)2 + Na2SO4 = PbSO4 ↓+2NaNO3
9 - 11) Окисление сульфида свинца (II) до сульфата кислородом, озоном или пероксидом водорода
PbS + 2O2 = PbSO4 ↓
3PbS + 4O3 = 3PbSO4 ↓
PbS + 4H2O2 = PbSO4 ↓+4H2O
12 - 13) Окисление сульфида свинца (II) до сульфата концентрированной серной или азотной кислотами
PbS +8HNO3 (конц.) = PbSO4 ↓+ 8NO2 +4H2O
PbS +4HSO4 (конц.) = PbSO4 ↓+ 4SO2 +4H2O
15) из оксида свинца (IV)
PbO2 + SO2 = PbSO4↓
PbO2 +2 H2SO4 = PbSO4 ↓+ 2H2O + O2
PbO2 +2MnSO4 + 3H2SO4 = 5 PbSO4 ↓+ 2HMnO4 + 2H2O
16) окисление сульфита
2PbSO3 + O2 = 2PbSO4
17) взаимодействие комплексной соли с серной кислотой
Na2[Pb(OH)4] + 2H2SO4 (изб) = Na2SO4 + PbSO4 + 4H2O
18) Взаимодействие основной соли с серной кислотой
(PbOH)2CO3 + 2H2SO4 = 2PbSO4 + CO2 + 3H2O
19 - 20) Нейтрализацией или разложением кислой соли
Pb(HSO4)2 + Pb(OH)2 (суспензия) = 2PbSO4 + 2H2O или
Pb(HSO4)2 + 2NaOH (суспензия) = PbSO4 + Na2SO4 + 2H2O
Pb(HSO4)2 = PbSO4 + H2SO4
Примечание: Возможны и другие способы
-
В левом треугольнике схемы превращений все реакции протекают без изменения степени окисления, в правом - все реакции окислительно-восстановительные:
А Г
CuBr2 B SO2
Б Д
Определите неизвестные вещества и запишите уравнения соответствующих реакций. (8 баллов)
Cu(OH)2 6 S
2
1 CuBr2 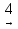 CuS
CuS 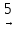 SO2 7 8
SO2 7 8
3
CuO H2SO4
-
Cu(OH)2
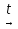 CuO +H2O
CuO +H2O -
Cu(OH)2 +2HBr =CuBr2 +2H2O
-
CuO +2HBr =CuBr2 +H2O
-
CuBr2 +K2S =CuS↓ +2KBr
-
2CuS +3O2
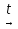 2CuO +2SO2
2CuO +2SO2 -
SO2 +2H2S = 3S +2H2O
-
SO2 +Cl2 +2H2O = H2SO4 +2HCl
-
3S + 6HNO3(конц) = 3H2SO4 +6NO
-
Определите неизвестные вещества и запишите соответствующие уравнения реакций (10 баллов):
С В А алкен изомер В изомер С
изомер А
Один из возможных вариантов решения таков:
1-бромбутан 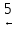 бутанол-1
бутанол-1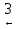 1-хлорбутан
1-хлорбутан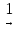 бутен-1
бутен-1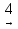 бутанол-2
бутанол-2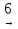 2-бромбутан
2-бромбутан
 2
2
2-хлорбутан
-
CH3 - CH2 - CH2 -CH2Cl +KOH
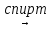 CH3 - CH2 - CH=CH2 +KCl +H2O
CH3 - CH2 - CH=CH2 +KCl +H2O -
CH3 - CH2 - CH=CH2 +HCl → CH3 - CH2 - CHCl - CH3
-
CH3 - CH2 - CH2 -CH2Cl + KOH → CH3 - CH2 - CH2 -CH2OH +KCl
-
CH3 - CH2 - CH=CH2 +H2O
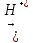 CH3 - CH2 - CHOH - CH3
CH3 - CH2 - CHOH - CH3 -
CH3 - CH2 - CH2 -CH2OH + HBr
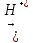 CH3 - CH2 - CH2 -CH2Br +H2O
CH3 - CH2 - CH2 -CH2Br +H2O -
CH3 - CH2 - CHOH - CH3 +HBr
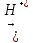 CH3 - CH2 - CHBr - CH3 +H2O
CH3 - CH2 - CHBr - CH3 +H2O
Или
пропаналь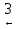 пропанол-1
пропанол-1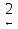 1-бромпропан
1-бромпропан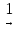 пропен
пропен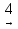 пропанол-2
пропанол-2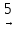 ацетон
ацетон
↓6
2- бромпропан
-
CH3CH2CH2Br +NaOH
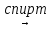 CH3CH =CH2 +NaBr +H2O
CH3CH =CH2 +NaBr +H2O -
CH3CH2CH2Br +NaOH → CH3CH2CH2OH +NaBr
-
CH3CH2CH2OH +CuO
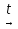 CH3CH2CHO +Cu +H2O
CH3CH2CHO +Cu +H2O -
CH3CH=CH2 +HOH
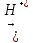 CH3CH(OH)CH3
CH3CH(OH)CH3 -
CH3CH(OH)CH3 +CuO
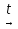 CH3COCH3 +Cu +H2O
CH3COCH3 +Cu +H2O -
CH3CH =CH2 +HBr→ CH3CHBrCH3
или
Вариантов решения существует несколько.
Один из них: А - 1-хлорпропан, В - пропанол - 1, С - пропаналь, изомер А - 2-хлорпропан, изомер В - пропанол - 2, изомер С - ацетон.
-
СН3-СН=СН2 + HBr → СН3-СНBr-СН3 (изомер А )
-
СН3-СН=СН2 + HOH → СН3-СНOH-СН3 (изомер В )
-
СН3-СН2-СН2Вr + КОН (спирт)→ СН3-СН=СН2 (алкен) + KBr + H2O
-
СН3-СН2-СН2Вr + КОН (водн.)→ KBr + СН3-СН2-СН2OH (В)
-
СН3-СН2-СН2OH + СuO → Cu + H2O + СН3-СН2-СHO ( С)
-
СН3-СНOH-СН3 + CuO → Cu + H2O + СН3-СO-СН3 (изомер С)
Другой вариант: Алкен - пропен; А - пропанол-1; В - 1-бромпропан; С - гексан;
Изомер А - пропанол-2; Изомер В - 2-бромпропан; Изомер С - 2,3-диметилбутан
А H2SO4 (конц)
СH3−CH2−CH2−OH → СH3−CH=CH2 + H2O
t°>140°С
H2SO4, t° Изомер А
СH3−CH=CH2 + H2O → СH3−CH(ОН)−CH3
A B
СH3−CH2−CH2−OH + HBr ↔ СH3−CH2−CH2Br + H2O
B t° C
2СH3−CH2−CH2Br + 2Na → СH3−CH2−CH2− СH2−CH2−СH3 + 2NaBr
Изомер В
СH3−CH=CH2 + HBr → СH3−CHBr−CH3
Изомер В t° Изомер С
2СH3−CHBr−CH3 + 2Na → СH3−CH(CH3)−CH(CH3)−СH3 + 2NaBr
Задания взяты из следующих источников:
-
Н.Е. Кузьменко,В.В. Еремин, С.С. Чуранов. Сборник конкурсных задач по химии для школьников и абитуриентов. - М.: Экзамен: Издательский дом «ОНИКС 21век»,2001.
-
С.С. Чуранов. Химические олимпиады в школе. - М.: Просвещение, 1982.
-
Вступительные экзамены и олимпиады по химии в Московском университете:2007/Под ред. Н.Е. Кузьменко и В.И. Теренина. - М.: Изд-во МГУ, 2008.
-
Вступительные экзамены и олимпиады по химии в Московском университете:2010/Под ред. Н.Е. Кузьменко и В.И. Теренина. - М.: Изд-во МГУ, 2010.
Использованы материалы Денисовой В.Г., размещенные на сайте «Химоза»


