- Преподавателю
- Химия
- Концентрированная H2SO4 - окислитель
Концентрированная H2SO4 - окислитель
| Раздел | Химия |
| Класс | - |
| Тип | Конспекты |
| Автор | Климова С.И. |
| Дата | 30.12.2014 |
| Формат | doc |
| Изображения | Есть |
Тема: Концентрированная H2SO4 - окислитель.
Цель: - изучить окислительные свойства концентрированной H2SO4
с позиции окислительно-восстановительных реакций;
-
обратить внимание на технику безопасности с веществами и концентрированной H2SO4;
-
воспитание аккуратности, усидчивости;
-
развитие логического мышления, химического языка.
Оборудование урока:
На столах учащихся:
а) реактивы: гранулы Zn, кусочки медной проволоки;
концентрированная H2SO4, раствор H2SO4.
б) оборудование: штатив с пробирками, спиртовка, спички,
пробиркодержатель.
в) таблицы: "Окислительные свойства H2SO4",
"Техника безопасности"
Тип урока: урок совершенствования знаний, изучение нового материала с элементами исследовательской работы.
Ход урока.
I. Оргмомент.
II. Повторение.
I Работа уч-ся по карточкам у доски:
-
Написать уравнения реакций, при помощи которых можно осуществить следующие превращения:




 H2S-2 1 S 0 2 S+4 O2 3 S+6O34 H2S+6O45 ZnS+6O4
H2S-2 1 S 0 2 S+4 O2 3 S+6O34 H2S+6O45 ZnS+6O4
2 . Расставьте коэффициенты в следующей схеме:
 2KMn+7O4+5H2S-2+3H2SO42Mn+2SO4+5S0+K2SO4+8H2O
2KMn+7O4+5H2S-2+3H2SO42Mn+2SO4+5S0+K2SO4+8H2O
 Mn+7 +5еMn+2 | 2 | восстанавливается, окислитель
Mn+7 +5еMn+2 | 2 | восстанавливается, окислитель
S-2 -2е S 0 | 5 | окисляется, восстановитель
3 . К доске приглашается ученик, который объясняет, какие степени окисления, имеет сера, и какие соединения она при этом образует.
В
 ывод: с переходом S-2S+6 возрастает восстановительная способность серы, а с переходом S+6 S-2 возрастает окислительная способность серы. Следовательно, H2SO4 может быть только окислителем.
ывод: с переходом S-2S+6 возрастает восстановительная способность серы, а с переходом S+6 S-2 возрастает окислительная способность серы. Следовательно, H2SO4 может быть только окислителем.
 +6 - S +6O3 H2S+6O4
+6 - S +6O3 H2S+6O4
 +4 - S +4O2 H2S+4O3
+4 - S +4O2 H2S+4O3
+2 -
- 0 S0
- 2 - H2S-2
Учитель сообщает цель урока - изучить окислительные свойства серной кислоты. (Ученики записывают тему в тетрадях)
III. Новый материал.
1 . Повторение сведений о физических свойствах серной кислоты (агрегатное состояние, цвет, плотность, отношение к воде)
2 . Конц. H2SO4 имеет концентрацию 95% и р=1,83г/см3.
Как приготовить более разбавленный раствор? (Например, 35%-й аккумуляторной кислоты)
Учащиеся вспоминают о правиле, которое надо учитывать при растворении H2SO4 в воде, так как эта реакция имеет большую экзотермичность.
"Сначала вода,
Потом кислота!
Иначе случится,
Большая беда!"
Данные сведения необходимы для того, чтобы учащиеся соблюдали
Технику безопасности при выполнении лабораторных опытов.
3 . Какие химические свойства характерны для H2SO4?
Учащиеся вспоминают, что H2SO4 взаимодействуют с металлами, стоящими в ряду напряжений левее водорода.
Лабораторный опыт.
Учащиеся помещают кусочек Zn в пробирку и наливают раствор H2SO4, наблюдают выделение водорода.
Один ученик записывает реакцию на доске, остальные в тетрадях.
 Zn0 + H2 +SO4 Zn+2SO4+6+ H20
Zn0 + H2 +SO4 Zn+2SO4+6+ H20
 Zn0 -2eZn+2 | 2 | 1 | окисляется, восстановитель.
Zn0 -2eZn+2 | 2 | 1 | окисляется, восстановитель.
 2H+ +2eH20 | 2 | 1 | восстанавливается, окислитель.
2H+ +2eH20 | 2 | 1 | восстанавливается, окислитель.
Вопрос:
Почему в данной реакции H2SO4 не ведет себя как окислитель?
«Окислительная способность проявляется в концентр-х водных растворах H2SO4. Если разбавленная H2SO4 проявляет обычные свойства кислот, в частности в ней "растворяются" (с выделением водорода) металлы, находящиеся в ряду активности левее водорода, то концентрированная кислота ведет себя иначе. При действии на металлы водород из её растворов не выделяется. Более того, в ней "растворяются" многие металлы, стоящие в ряду активности правее водорода, например, медь, ртуть, серебро.»
Лабораторный опыт.
Учащиеся помещают кусочки медной проволоки в пробирку и наливают концентрированный раствор H2SO4, соблюдая осторожность, нагревают. Наблюдают за изменением окраски раствора и выделением газа.
С помощью таблицы «Окислительные свойства H2SO4» ученик записывает реакцию на доске, остальные учащиеся в тетрадях.
Окислительные свойства H2SO4.
-
H
 2 S+6O4 (к) + неактивный металл S+4O2 + соль + вода
2 S+6O4 (к) + неактивный металл S+4O2 + соль + вода
-
H
 2 S+6O4 (к) + активный металл S0+ соль + вода
2 S+6O4 (к) + активный металл S0+ соль + вода
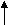

H2S-2 + соль + вода
-
H

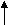 2S+6O4 (к) + неметалл t0S+4O2 +ангидрид + вода
2S+6O4 (к) + неметалл t0S+4O2 +ангидрид + вода
t
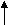 0 S+4O2 + кислота + вода
0 S+4O2 + кислота + вода
-
H
 2 S+6O4 (р) + неактивный металл /
2 S+6O4 (р) + неактивный металл /
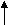
-
H
 2 S+6O4 (р) + активный металл соль + H2
2 S+6O4 (р) + активный металл соль + H2
C
 u0+2 H2 +6SO4 t Cu+2S+6O4+ S+4O2 + H2O
u0+2 H2 +6SO4 t Cu+2S+6O4+ S+4O2 + H2O
конц.
 Cu0 -2eCu+2 | 2 | окисляется, восстановитель.
Cu0 -2eCu+2 | 2 | окисляется, восстановитель.
 S+6 +2eS+4 | 2 | восстанавливается, окислитель!!!
S+6 +2eS+4 | 2 | восстанавливается, окислитель!!!
Вопрос? Почему разбавленная H2 SO4 не является окислителем?
Дело в том, что в разбавленных растворах окислителем металлов выступает нон водорода Н+, а в концентрированных-сульфат - ион SO4-2. При этом в зависимости от условий проведения реакции (температура, концентрация, активность восстановителя) продуктом восстановления сульфат-иона могут быть сероводород, сера или оксид серы (IV).
Посмотрите на таблицу и сделайте соответствующие выводы.
(учащиеся переписывают схемы в тетеради.).
IV. Закрепление в процессе хода урока.
V. Домашнее задание


