- Преподавателю
- Химия
- Технология педагогики сотрудничества
Технология педагогики сотрудничества
| Раздел | Химия |
| Класс | - |
| Тип | Конспекты |
| Автор | Иванова Т.В. |
| Дата | 03.03.2014 |
| Формат | docx |
| Изображения | Есть |
Оглавление
Введение
Обучение в сотрудничестве (или обучение в малых группах, обучение в команде) - это одна из наиболее эффективных технологий личностно-ориентированного образования, так как при обучении на ее основе создаются условия для взаимопомощи и индивидуальной поддержки, для осуществления учебной деятельности каждым учеником на уровне, соответствующем его индивидуальным особенностям, опыту, интересам. Благодаря общности цели и задач (одно задание и одно поощрение на группу) успех команды зависит от вклада каждого, что стимулирует; с одной стороны, индивидуальную ответственность каждого перед группой, а с другой - ответственность группы за каждого своего члена. Взаимная ответственность порождает потребность в эффективном взаимодействии, в процессе которого формируются культура общения, развиваются коммуникативные умения, навыки самостоятельного учения, высказывания в групповом диалоге собственных суждений и принятия ответственных решений, в результате чего успешно осуществляется социализация личности и развитие интеллектуальных способностей. Главная идея обучения в сотрудничестве - учиться вместе, а не просто выполнять что-то вместе.
Перечисленные возможности технологии обучения в сотрудничестве дают основание считать ее одной из базовых технологий профильного обучения. Но благодаря возможности посредством сотрудничества интенсифицировать учебный процесс, она наиболее целесообразна для применения в элективных курсах в профильной и предпрофильной подготовке, причем применяемой не как один из приемов организации учебной деятельности на отдельных занятиях, а как технология целостного педагогического процесса на протяжении всею элективного курса.
Сегодня в мировой педагогике известно большое разнообразие вариантов этой технологии.
Обучение в команде
Обучение происходит в группе из 4-х человек (мальчиков и девочек разного уровня обученности).
Учитель объясняет новый материал, а затем предлагает ученикам в группах его закрепить. Группам дается определенное задание, необходимые опоры.
Задание выполняется либо по частям (каждый выполняет свою часть), либо по "вертушке" (каждое последующее задание выполняется следующим учеником). При этом выполнение любого задания объясняется вслух учеником и контролируется всей группой.
После завершения задания всеми группами на каждом уроке организуется либо общее обсуждение работы над этим заданием разными группами (если задание было одинаковое для всех групп), либо рассмотрение заданий каждой группой, если задания были разные.
Когда учитель убедился, что материал усвоен всеми учащимися, он выдает тест на проверку понимания и усвоения нового материала. Тест учащиеся выполняют индивидуально вне группы. При этом учитель дифференцирует сложность заданий для сильных и слабых учеников.
Оценки за индивидуальную работу суммируются в группе и выставляется общая оценка. Таким образом, и сильный и слабый ученик могут принести группе одинаковые баллы. Соревнуются не сильный со слабым, а со своими собственными ранее достигнутыми результатами.
"Пила"
Учащиеся организуются в группы по 6 человек для работы над учебным материалом, разбитым на фрагменты. Каждый член группы работает над своей частью.
Затем ребята из разных групп, изучающие один и тот же вопрос, встречаются и обмениваются информацией ("встреча экспертов").
После этого они возвращаются в свои группы и обучают всему новому, что узнали сами (как зубья одной пилы).
Отчитывается по всей теме каждый в отдельности и вся команда в целом. На заключительном этапе учитель может попросить любого ученика команды ответить на любой вопрос по данной теме.
"Учимся вместе"
Класс разбивается на разнородные по уровню обученности группы в 3-5 человек. Каждая группа получает одно задание, являющееся подзаданием какой-либо большой темы, над которой работает весь класс. Внутри группы учащиеся самостоятельно определяют роли каждого в выполнении общего задания. Таким образом, группа имеет двойную задачу: академическую и социальную. Я также контролирую не только успешность выполнения задания, но и характер общения между собой, способ оказания помощи друг другу.
Исследовательская работа учащихся в группах
Учащиеся работают либо индивидуально, либо в группах до 6 человек. Группа выбирает подтему общей темы и разбивает на отдельные задания для каждого ученика. На основе дискуссии и обсуждения в группе составляется общий доклад, который и подлежит презентации на уроке перед всем классом.
Коллективные способы обучения (по В.К.Дьяченко)
В отечественном образовании большую популярность у учителей завоевала методика Ривина - Дьяченко - сотрудничество в парах сменного состава, получившая название «коллективные способы обучения» (КСО)
Коллективной формой организации учебных занятий является работа учащихся в парах сменного состава, при которой все обучают каждого и каждый всех. При переходе к КСО ученики все изучают сами. Учитель может объяснить какие-то темы или способы работы в порядке первоначального ознакомления. Качество проработки стимулируется не желанием получить отметку, а научить других. При работе в паре ученик, испытывающий затруднения, получает своевременную помощь, что ускоряет темп продвижения.
Т.В. Иванова, руководитель ШМО «Естествознание»
Урок химии для 9 класса по теме «Подгруппа азота»
Задачи:
-
Научиться общаться, работать в команде.
-
Обобщить и систематизировать знания учащихся о положении элементов подгруппы азота в Периодической системе, об особенностях строения их атомов, физических и химических свойствах.
Оборудование:
Цветовые сигналы, карточки с заданиями, периодическая система химических элементов Д.И.Менделеева.
Ход урока
I. Постановка целей
Вопрос учащимся: «Как сформулировать цель урока?» (учащиеся предлагают свои варианты).
Цель урока написана на обратной стороне доски.
На столе учителя набор фигур с цветовыми сигналами (красный, жёлтый, зелёный). Учащиеся выбирают фигуру и садятся в ту группу, где находится соответствующий сигнал.
II. Интеллектуальная разминка
1. Вместо точек вставьте пропущенные слова.
Азот и фосфор - это элементы ………. подгруппы ………. группы.
2. Выбросите лишнее: белый фосфор, красный фосфор, синий фосфор.
3. . Зачеркни линией элементы главной подгруппы V группы.
N
S
Mg
Na
P
K
Si
O
As
4. Найдите электронную формулу внешнего энергетического уровня элементов подгруппы азота
А) nS2; Б) nS2nр3; В) nS2nр2.
III. Прохождение маршрута командами
По результатам выполненных заданий должно получиться слово. Ответы закодированы буквами русского алфавита.
I команда
1. Степень окисления азота в оксиде NO2 равна.
А) +2; К Б) +4; А В) -4. Н
2. Как называются соли азотной кислоты
А) нитраты; М Б) нитриты; И В) нитриды. Л
3. В каких из указанных реакций азот N2 играет роль восстановителя?
А) N2 + 3Mg = Mg3N2; К Б) N2 + 3F2 = 2NF3; М В) N2 + 3H2 = 2NH3 Н
4. С каким из указанных веществ взаимодействует конц. HNO3 с образованием NO2?
А) Сu; И Б) ZnO; А В) Ag. О
5. Сумма коэффициентов в уравнении реакции NH3 + O2 = N2 +H2O равна:
А) 7; Т Б) 10; С В) 15. А
6. Сколько молей азотной кислоты расходуется на с 10 г карбоната кальция?
А) 0,1 моль; М Б) 2 моль; У В) 0,2 моль. К (АММИАК)
II команда
-
Степень окисления азота в оксиде азота N2O равна
А) +2; К Б) +1; Н В) +4. О
2. Как называются соли азотистой кислоты
А) нитраты; А Б) нитриты; И В) нитриды. В
3. В каких из указанных реакций азот N2 играет роль окислителя?
А) N2 + 3Mg = Mg3N2; Т Б) N2 + 3F2 = 2NF3; Б В) N2 + O2 = 2NO В
4. В молекуле азота связь
А) одинарная; Л Б) двойная; С В) тройная. Р
5. Сумма коэффициентов в уравнении реакции NH3 + O2 = NO + H2O равна
А) 19; А Б) 9; У В) 12. И
6. Какой объём углекислого газа выделяется в реакции азотной кислоты с 21,2 г карбоната натрия?
А) 2,24 л; М Б) 44,8 л; Х В) 4,48 л Т (НИТРАТ)
III команда
1. Степень окисления фосфора в оксиде Р2О5 равна
А) +3; А Б) +5;Ф В) - 3. К
2. Как называются соли фосфорной кислоты?
А) фосфиды; А Б) фосфориты; У В) фосфаты.О
3. В каких из указанных реакций фосфор играет роль восстановителя?
А) 2Р+8Н2О=2Н3РО4+5Н2 С Б) 3Са+2Р=Са3Р2 М В)3Nа+Р= Nа3Р Н
4. С каким из указанных веществ взаимодействует оксид фосфора (V) Р2О5?
А) НNО3 Н Б) NаОН Ф В)СО2 А
5. Сумма коэффициентов в уравнении реакции РН3+О2=Р2О5+Н2О равна
А) 10 И Б) 6 А В) 4 О
6) Сколько граммов соли образуется в реакции фосфорной кислоты с 12г гидроксида натрия.
А) 16,4г Д Б)98г К В) 19,6г Т (ФОСФИД)
IV. Защита полученных результатов
Представители команд защищают выполненные задания. Учитель подводит итог работы команд.
V .Рефлексия
Учащиеся высказывают мнение об уроке. Учитель подводит итог урока, выставляет оценки.
Т.В. Иванова
Урок химии для 11 класса по теме «Обратимость химической реакции, химическое равновесие»
Задачи:
Систематизировать и углубить знания обучающихся об обратимых и необратимых химических реакциях, химическом равновесии как динамическом состоянии реагирующей смеси.
Знать:
-факторы, влияющие на смещение химического равновесия;
-определение принципа Ле Шателье.
Уметь:
- объяснять на конкретных примерах способы смещения химического равновесия, применяя принцип Ле Шателье.
Оборудование урока:
-
Карточки-тексты 20 карточек с уравнениями обратимых химических реакций
-
Инструкция для работы в группе
-
3 карточки - задания
-
Карточки-задания
Ход урока
-
Организационный момент. Деление на группы
-
Актуализация знаний, сообщение темы и цели урока
-
Работа в группах
Каждый ученик получает карточку, содержащую небольшой по объему текст, который состоит из 5 смысловых частей. Ознакомившись с этим текстом ученик выбирает дну из частей текста для детальной проработки.
Понятие обратимости химической реакции
Реакции, протекающие одновременно в двух взаимно противоположных направлениях, называются обратимыми.
nA + mB ↔ pC + qD.
Реакция, протекающая в направлении слева направо, называется прямой →
Реакция, протекающая в направлении справа налево, называется обратной ←
В ходе обратимой реакции скорость прямой реакции уменьшается, т.к. концентрация продуктов реакции возрастает. В конце концов, наступает такой момент, когда скорости прямой и обратной реакции окажутся одинаковыми.
Vпр. = Vобр. - это условие химического равновесия.
Химическое равновесие не означает состояние покоя. Прямая и обратная реакции протекают, но с равной скоростью. Поэтому оно называется подвижным (динамическим) равновесием.
Состояние равновесия можно нарушить, изменяя условия протекания реакций.
Условия смещения равновесия.
Направление сдвига химического равновесия определяется принципом Ле Шателье: если на систему, находящуюся в состоянии химического равновесия, оказать внешнее воздействие, то в системе произойдет смещение равновесия, которое ослабит эффект внешнего воздействия.
На смещение химического равновесия оказывают влияние следующие факторы: температура, концентрация, давление.
Температура
Изменение температуры будет только тогда оказывать влияние на смещение равновесия, если химическая реакция протекает с тепловым эффектом, т.е. в ходе реакции тепло либо выделяется (экзотермическая реакция), либо поглощается (эндотермическая реакция).
nA + mB ↔ pC + qD + Q - экзотермическая реакция.
nA + mB ↔ pC + qD - Q - эндотермическая реакция.
-
Экзотермическая реакция
Эндотермическая реакция
понижение to →
nA + mB ↔ pC + qD + Q
повышение to ←
понижение to ←
nA + mB ↔ pC + qD - Q
повышение to →
Концентрация
nA + mB ↔ pC + qD
→повышение концентрации веществ А и В, либо понижение СD
←повышение концентрации C и D, либо понижение А и В.
Давление
Влияет на смещение равновесия, если в реакции участвуют газы и реакция протекает с изменением объема газовой смеси.
Например, для реакции 2А(г) + 4В(г) ↔ 3D(г), которая протекает с уменьшением объема газовой смеси (в реакцию вступает 2 + 4 = 6 объемов, а получается всего 3. Смотри на коэффициенты), при увеличении давления равновесие сместится в сторону прямой реакции (→), а при уменьшении давления - в сторону обратной реакции (←).
Изучив содержание текста, ученики создают группы нового состава таким образом, чтобы в каждой новой группе собрались те, кто изучал содержание одной и той же части. Таких групп должно быть 3 (по количеству смысловых частей текста).
Задание для групп. В течение пяти минут подготовить сообщение для остальных учащихся, проиллюстрировав его схемами, рисунками или инсценировками.
Затем следует представление групп
После того, как представили результаты работы группы все группы, их участники вновь возвращаются в свои первоначальные группы и получают задания:
Распределить карточки с уравнениями обратимых химических реакций в таблице .
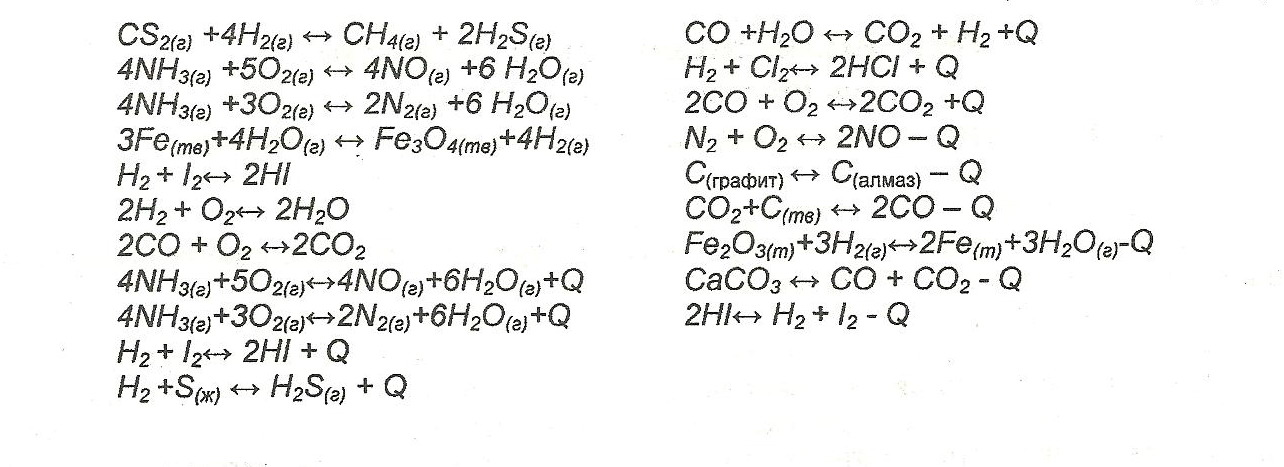
На смещение химического равновесия вправо влияет
Понижение температуры
Повышение температуры
Понижение давления
Повышение давления
-
Каждая группа получает карточку-задание

Даны уравнения обратимых химических реакций (одинаковые для всех групп).

Представители группы представляют результат работы. Обсуждение результатов работы групп.
-
Итог урока
Домашнее задание п.14, упр. 1-5, стр. 147, портфолио по теме «Обратимость химических реакций» (карточку с домашним заданием получает каждый ученик).
Портфолио - портфель достижений по теме «Обратимость химических реакций»
Разделы портфолио:
-
Я знаю
-
Я понимаю
-
Я могу объяснить
-
Я не понимаю
Т.В. Иванова
Современные уроки с использованием технологии сотрудничества
Муниципальное бюджетное общеобразовательное учреждение
"Средняя общеобразовательная школа № 2"
Адрес: Ростовская область, г. Батайск,
ул. 50 лет Октября, д. 71
Телефон: (86354) 6-78-52
E-mail: [email protected]


