- Преподавателю
- Химия
- Муниципальный этап всероссийской олимпиады школьников по химии, 2015
Муниципальный этап всероссийской олимпиады школьников по химии, 2015
| Раздел | Химия |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Панарина Н.Г. |
| Дата | 26.01.2016 |
| Формат | docx |
| Изображения | Есть |
 Муниципальный этап всероссийской олимпиады школьников по химии
Муниципальный этап всероссийской олимпиады школьников по химии
8 класс
Задача 8 - 1 (7 баллов). В смеси находятся строительный песок, сахарный песок, парафин, железные опилки. Как разделить эту смесь веществ?
Задача 8 - 1 (7 баллов). Решение. 1. С помощью магнита выделим из смеси железо (1 балл). 2. Приливаем к смеси воду (1 балл). 3. Парафин нерастворим в воде. Его можно аккуратно собрать с ее поверхности (2 балла). 4. Сахар растворился в воде. Отделяем водный раствор сахара от песка при помощи фильтрования (2 балла). 5. Выпаривая воду, получаем сахар(1 балл.).
Задача 8 - 2 (4 балла). Какие химические элементы названы в честь России, Франции, Польши? Какой элемент впервые открыт на Солнце?
Задача 8 - 2 (4 балла). Решение. 1. Элемент рутений (Ru) назван в честь России (1 балл). 2. Элемент полоний (Ро) назван в честь Польши (1 бал). 3. Элемент франций (Fr) назван в честь Франции (1 балл). 4.Элемент гелий (Не) впервые открыт на Солнце (1 балл).
Задача 8 - 3 (6 баллов). Ранним весенним утром, когда температура окружающего воздуха была еще 0°С, а давление 760 мм. рт. ст., три товарища, прогуливая своих собак, увидели бутылку на газоне. «Она пуста», - сказал один из них. «Нет, она полна до краев, и я знаю формулу вещества, которым она заполнена», - сказал другой. «Оба вы неправы», - сказал третий и для убедительности провел расчет количества вещества и числа частиц, содержащихся в бутылке. Объем бутылки 0,7 л. Повторите доводы и вычисления третьего из товарищей.
Задача 8 - 3 (6 баллов). Решение. 1. В бутылке находится воздух. Поэтому ее нельзя считать пустой (1 балл). 2. Поскольку воздух - это смесь веществ, то нельзя говорить об одном веществе, из которого состоит воздух(1 балл). 3. Температура воздуха 0°С, и давление 760 мм. рт. ст., соответствуют нормальным условиям. При этих условиях в соответствии с законом Авогадро объем 0,7 л может занимать газ количеством вещества, равным n = 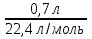 = 0,03125 моль (2 балла). 4. В этом количестве вещества (воздуха) содержится число частиц (различных молекул - в основном кислорода, азота и аргона), равное
= 0,03125 моль (2 балла). 4. В этом количестве вещества (воздуха) содержится число частиц (различных молекул - в основном кислорода, азота и аргона), равное
N = n ∙ (NA) = 0,03125∙ (6,02 ∙1023) = 0,188 ∙1023 частиц (2 балла).
Задача 8 - 4 (2 балла). В 1820 году в Лондоне разразился скандал. На одном из аристократических приемов известный ювелир сказал графине, хозяйке дома: «У вас, миледи, в перстне не алмаз, а подделка!» Как ювелир смог тут же доказать графине свою правоту?
Задача 8 - 4 (2 балла). Решение. По внешнему виду страз отличить от алмаза трудно, но его происхождение выдает недостаточная твердость: он не царапает стекло.
Задача 8 - 5 (6 баллов). Используя только 11 букв, которые входят в название элемента номер 91 в периодической системе Д.И.Менделеева, составьте как можно больше названий других химических элементов. Предложив 6 названий, вы получите максимальный балл.
Задача 8 - 5 (6 баллов). Решение. Актиний, №89. Титан, №22. Иттрий, №39. Торий, №90. Натрий, №11. Криптон, №36.
Задача 8 - 6 (4 балла). Рассчитайте, во сколько раз масса атома кислорода больше массы атома гелия.
Задача 8 - 6 (4 балла). Дано: элементы О (кислород) и Не (гелий). Определить 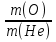 (m - масса атома элемента).
(m - масса атома элемента).
Решение. 1. Ar (O) = 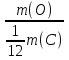 и
и 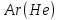 =
=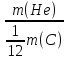 (2балла)
(2балла)
2. Используя полученные формулы получаем 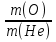 =
=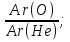
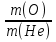 =
=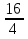 = 4 (2 балла).
= 4 (2 балла).
Задача 8 - 7 (2 балла). Магний с серой соединяется в массовом отношении 3:4. Определите массу магния, который прореагирует с 20 г серы.
Задача 8 - 7 (2 балла). Решение. m(Mg) = 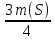 ; m(Mg) =
; m(Mg) = 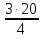 = 15 г.
= 15 г.
Задача 8 - 8 (6 баллов). Чему равна масса смеси, состоящей из 10 моль газообразного водорода и 5 моль кислорода?
Задача 8 - 8 Решение. 1. Определяем массу кислорода, входящего в состав смеси: m(О2) = n(О2) ∙ М(О2); m(О2) = 5 моль∙32г/моль = 160 г (2 балла). 2. Рассчитываем массу водорода, входящего в состав смеси: m(Н2) = n(Н2) ∙ М(Н2); m(Н2) = 10 моль∙2г/моль = 20 г (2 балла). 3. Вычисляем массу смеси кислорода и водорода: m(смеси) = m(Н2) + m(О2); m(смеси) = 20г + 160 г = 180 г (2 балла).
Задача 8 - 9 (6 баллов). Определите общее количества вещества (в молях), которое содержится в 800 г 15%-ного по массе водного раствора нитрата кальция.
Задача 8 - 9 (6 баллов). Решение. 1. В задании требуется определить число молей двух веществ: нитрата калия и воды, из которых состоит раствор (2 балла). 2.Условию задания соответствует выражение для доли (в. мас. %) растворенного вещества 15 = 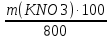 , откуда
, откуда 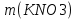 =120г. М(КNO3) = 101г/моль. Массе соли m(KNO3) = 120 г соответствует ее количество, равное n(КNO3) =
=120г. М(КNO3) = 101г/моль. Массе соли m(KNO3) = 120 г соответствует ее количество, равное n(КNO3) = 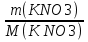 =
= 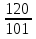 = 1,19 моль (2 балла).
= 1,19 моль (2 балла).
Масса воды в растворе массой 800 г. равна m(H2O) ==800 - m(KNO3) = 800 - 120 = 680 г. Этой массе воды соответствует ее количество, равное n(H2O) = 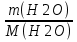 =
= 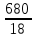 =37,8 моль (2 балла).
=37,8 моль (2 балла).
Муниципальный этап всероссийской олимпиады школьников по химии
9 класс
Задача 9 - 1 (5 баллов). Две пробирки наполнены на одну треть каждая прозрачными растворами гидроксида натрия и хлорида алюминия. Количества растворенных веществ в растворах эквивалентны друг другу, т.е. реактивы после смешивания полностью прореагируют между собой без остатка с образованием максимального количества осадка. Имея только эти две пробирки с растворами и ничего более, распознайте пробирку с раствором щелочи и пробирку с раствором соли. Ответ мотивируйте.
Задача 9 - 1 (6 баллов). Решение. 1. Все зависит от порядка сливания (что к чему приливать (2 балла). 2. Если к раствору хлорида алюминия приливать по каплям раствор гидроксида натрия, то осадок будет образовываться сразу же после первых капель добавленного раствора щелочи: AlCl3 + 3NaOH =Al(OH)3↓ + 3NaCl (2балла). Если же к раствору гидроксида натрия приливать по каплям раствор хлорида алюминия, то избыток щелочи на начальном этапе будет препятствовать образованию осадка; осадок будет образовываться только с добавлением последних порций раствора соли (2 балла).
Задача 9 - 2 (6 баллов). Твердое, белое, дымящееся на воздухе вещество, принесли из цеха, где делают мороженое, поместили в стакан с дистиллированной водой. Кусок «исчез». В получившемся растворе лакмус изменяет окраску на красную. Известно, что относительная плотность этого вещества по воздуху в газообразном состоянии 1,5. Назовите вещество.
Задача 9 - 2 (6 баллов). Решение. Речь идет о твердом оксиде углерода (IV) - «сухом льде». Применяют его для охлаждения, например, мороженого, металла (2балла).
Возможные уравнения реакций: СО2 + Н2О ⇄ Н2СО3 (1 балл); СО2 + Са(ОН)2 = СаСО3 ↓ + Н2О (1 балл); СаСО3+ СО2 + Н2О = Са(НСО3)2 (1 балл); СО2 + СаО = СаСО3 (1 балл).
Задача 9 - 3 (9 баллов). Определите массовые доли (в %) сульфата железа (II) и сульфида алюминия в смеси, если при обработке 25 г этой смеси водой выделился газ, который полностью прореагировал с 960 г 5%-ного раствора сульфата меди.
Задача 9 - 3 (9 баллов). Решение. 1) Составлены уравнения реакций: Al2S3 + 6H2O = 2Al(OH)3 + 3H2S; CuSO4 + H2S = CuS +H2SO4 (2 балла). 2) Рассчитано количество вещества сероводорода: n (CuSO4 ) = 960 ∙ 0,05 / 160 = 0,3 моль; n(H2S) = n(CuSO4) = 0,3 моль (2 балла). 3) Рассчитаны количество вещества и массы сульфида алюминия и сульфата железа(II): n (Al2 S 3) = 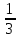 n (H 2S) = 0,1моль; m(Al2 S 3) = 0,1∙150 =15 г; m(FeSO4 ) = 25 -15 = 10 г (3 балла). 4) Определены массовые доли сульфата железа(II) и сульфида
n (H 2S) = 0,1моль; m(Al2 S 3) = 0,1∙150 =15 г; m(FeSO4 ) = 25 -15 = 10 г (3 балла). 4) Определены массовые доли сульфата железа(II) и сульфида
алюминия в исходной смеси: ω(FeSO4) = 10 / 25 = 0,4, или 40%; ω (Al2S3) =15 / 25 = 0,6, или 60% (2 балла).
Задача 9-4. «Когда в густой крепкой купоросной водке, с которой четыре доли воды смешано, влитую в узкогорлую стклянку, положены будут железные опилки, тогда выходящий пар от свечного пламени загорается… Иногда случается, что загоревшийся пар стклянку с великим треском разрывает» (М. В. Ломоносов, Полное собрание сочинений, - М.: 1953, т. 1, стр. 474).
Вопросы:
-
Определите массовую долю (%) растворённого вещества в разбавленной «купоросной водке», если исходная массовая доля в «крепкой купоросной водке» составляла 98 %, а доли воды при разбавлении были взяты по массе.
-
Напишите уравнения реакций железа с раствором «купоросной водки» и горения «выходящего пара».
-
Напишите 3 уравнения реакций, которые могут протекать при взаимодействии железных опилок с раствором «купоросной водки» в зависимости от ее концентрации.
-
Определите соотношение объёмов разбавленного раствора «купоросной водки» (плотность 1,2 г/см3) и «выходящего пара» при нормальных условиях, если принять протекание химических процессов количественными.
Задача 9- 4 (автор - Жиров А. И.). Решение. Пусть было 100 г концентрированного раствора. (Содержание «купоросной водки» - серной кислоты - 98 г) Тогда масса добавленной воды составит 400 г. Общая масса раствора - 500 г. Массовая доля серной кислоты составит 98 : 5 = 19,6 (%).
-
При взаимодействии железа с разбавленной серной кислотой образуется сульфат железа (II) и водород:
Fe + H2SO4 = FeSO4 + H2
2H2 + O2 = 2H2O
-
При более высокой концентрации кислоты наряду с водородом могут выделяться сероводород и сера:
4Fe + 5H2SO4 = 4FeSO4 + H2S + 4H2O
3Fe + 4H2SO4 = 3FeSO4 + S + 4H2O
Концентрированная серная кислота образует оксид серы (IV) и cульфат железа (III):
2Fe + 6H2SO4  Fe2(SO4)3 + 3SO2 + 6H2O
Fe2(SO4)3 + 3SO2 + 6H2O
4. Литр разбавленного раствора серной кислоты имеет массу 1200 г и содержит 0,196 ∙ 1200 = 235,2 г серной кислоты, что составляет 2,4 моль кислоты. Тогда при полном взаимодействии кислоты с железом выделяется 2,4 моль водорода или 2,4 · 22,4 = 53,76 (л). Объём выделяющегося водорода в 53,76 раз больше объёма разбавленной серной кислоты (или объём кислоты в 53,76 раз меньше объёма водорода).
Система оценивания
-
Расчёт концентрации - 5 баллов
-
Реакция с железом - 2 балла
-
Горение водорода - 1 балл
-
Три реакции по 2 балла - 6 баллов
-
Соотношение объёмов - 6 баллов
ИТОГО: 20 баллов
Задача 9-5. Ниже представлена таблица, описывающая взаимодействие растворов бинарных солей калия и элементов X1, X2, X3 и X4, расположенных в одной группе периодической таблицы, с растворами нитратов серебра, свинца и ртути.
AgNO3
Pb(NO3)2
Hg(NO3)2
KX1
↓жёлтый осадок
↓жёлтый осадок
↓красно-оранжевый осадок
KX2
↓белый осадок
↓белый осадок
изменений нет
KX3
изменений нет
↓белый осадок
изменений нет
KX4
↓светло-жёлтый осадок
↓светло-жёлтый осадок
↓белый осадок
Вопросы:
-
Определите соли элементов X1, X2, X3 и X4.
-
Напишите уравнения взаимодействия бинарных солей элементов X1, X2, X3 и X4 с нитратами серебра, свинца и ртути. В уравнениях обязательно укажите вещество, выпадающее в осадок.
-
Напишите уравнения взаимодействия твёрдых бинарных солей калия элементов X1, X2, X3 и X4 с концентрированной серной кислотой.
-
При взаимодействии смеси сухих солей LiX2, NaX2 и KX2 массой 5,85 г с концентрированной серной кислотой образовалось 12,0 г гидросульфатов. Определите объём (при 30 °С и 130 кПа) газа, который может выделится.
Задача 9-5 (автор - Антонов А. А.). Решение. 1. Нитрат свинца и нитрат серебра являются качественными реагентами на галогены. При этом фторид серебра является растворимым. Значит, зашифрованные элементы являются галогенами. Фторид серебра, как указано выше, является растворимым, значит KX3 - KF. Белый осадок при взаимодействии с нитратом серебра образуют хлориды, значит KX2 - KCl. Самыми интенсивно окрашенными являются йодиды серебра и свинца, тогда KX1 - KI, а KX4 - KBr.
KX1 - KI, KX2 - KCl, KX3 - KF, KX4 - KBr.
2.
AgNO3
Pb(NO3)2
Hg(NO3)2
KI
AgNO3 + KI →
→ AgI↓ + KNO3
Pb(NO3)2 + 2KI →
→ PbI2↓ + 2KNO3
Hg(NO3)2 + 2KI →
→ HgI2↓ + 2KNO3
KCl
AgNO3 + KCl → →AgCl↓ + KNO3
Pb(NO3)2 + 2KCl →
→ PbCl2↓ + 2KNO3
─
KF
─
Pb(NO3)2 + 2KF →
→ PbF2↓ + 2KNO3
─
KBr
AgNO3 + KBr → →AgBr↓ + KNO3
Pb(NO3)2 + 2KBr →
→ PbBr2↓ + 2KNO3
Hg(NO3)2 + 2KBr →
→HgBr2↓ + 2KNO3
3. KX1: 2KI + 3H2SO4 → 2KHSO4 + I2 + SO2 + 2H2O или
6KI + 7H2SO4 → 6KHSO4 + 3I2 + S + 4H2O или
8KI + 9H2SO4 → 8KHSO4 + 4I2 + H2S + 4H2O
KX2: KCl + H2SO4 → KHSO4 + HCl↑
KX3: KF + H2SO4 → KHSO4 + HF
KX4: KBr + H2SO4 → KHSO4 + HBr↑ или
2KBr + 3H2SO4 → 2KHSO4 + Br2 + SO2 + 2H2O
Во всех случаях будет образовываться кислая соль, так как используется концентрированная серная кислота, т. е. имеется значительный избыток кислоты.
4. Запишем уравнения всех реакций:
LiCl + H2SO4 → LiHSO4 + HCl↑
NaCl + H2SO4 → NaHSO4 + HCl↑
KCl + H2SO4 → KHSO4 + HCl↑
Пусть во взаимодействия вступило x моль серной кислоты, тогда в результате выделилось x моль хлороводорода. Масса реакционной смеси до взаимодействия 5,85 + 98x, а после взаимодействия 12 + 36,5x. По закону сохранения массы
5,85 + 98x = 12 + 36,5x,
откуда x = 0,1 моль. Значит V = νRT/p = 0,1∙8,31∙303:130 = 1,94 л
Система оценивания:
-
По 1 баллу за верное определение каждого вещества (элемента) 4 балла. Примечание для проверяющих: если угадана группа (т. е. что зашифрованы галогены), но в неправильном порядке, то не более 1 балла за данный пункт.
-
9 уравнений по 1 баллу. 9 баллов.
-
4 уравнения по 1 баллу. 4 балла
Примечание для проверяющих: в реакции с бромом и йодом засчитывать любую одну реакцию. Если вместо гидросульфатов указаны сульфаты, то 0,5 балла за реакцию.
-
По 0,5 балла за уравнения с хлоридами лития и натрия. За расчёт числа молей 1,5 балла.
За расчёт объёма 0,5 баллов. всего 3 балла.
ИТОГО: 20 баллов
Муниципальный этап всероссийской олимпиады школьников по химии
10 класс
Задача10-1 (11 баллов). Сосуд, заполненный азотом, имеет массу 80,84 г; тот же сосуд, заполненный алкеном, имеет массу 81, 33 г. (газы в сосуде находятся при нормальных условиях). Определите структурную формулу алкена и назовите его, если известно, что он имеет одно ответвление от главной цепи. Учтите, что масса сосудов без газов равна 80,35 г.
Задача10-1 (11 баллов). Дано: m (c) = 80,35 (c - сосуд); m (с +N2) = 80,84 г; m (с +а) = 81,33 г; (а - алкен). Определить: х - формулу алкена.
Решение. 1. Определяем массу и количество вещества азота, находящегося в сосуде
m(N2) = m(c +N2) - m(c); m(N2) = 80,84 г - 80,35г = 0,49 г
n(N2) = 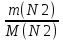 ; n(N2) =
; n(N2) = 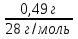 = 0,0175 моль (2 балла)
= 0,0175 моль (2 балла)
2. Представим молярную массу в виде М(Сх Н2х) = хМ(С) + 2хМ(Н) (2 балла);
М(Сх Н2х) = 14х г/моль. Вычисляем массу и количество вещества алкена в смеси:
m(a) = m(c + a) - m(c); m(a) = 81,33 г - 80,35г = 0,98 г
n(a) = 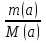 ; n(a) =
; n(a) = 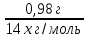 =
= 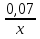 моль (2 балла)
моль (2 балла)
СН2 = С - СН3
СН3 (2 балла)
3. Из закона Авогадро следует: n(N2) = n(a); 0,0175 =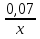 ; х = 4. Эмпирическая формула алкена С4Н8 (3 балла). Учитывая, что алкен имеет одно ответвление от главной цепи, напишем его формулу:
; х = 4. Эмпирическая формула алкена С4Н8 (3 балла). Учитывая, что алкен имеет одно ответвление от главной цепи, напишем его формулу:
Задача 10 - 2 (9 баллов). На нейтрализацию предельной одноосновной кислоты массой 7,4 г затрачен раствор с массовой долей гидроксида калия 40% объемом 10 мл и плотностью 1,4 г/мл. Определите формулу кислоты.
Задача 10 - 2 (9 баллов). Дано: m(ПК) = 7,4 г (ПК предельная одноосновная кислота) Сх Н2х+1СООН; V = 10 мл; ρ = 1,4 г/мл; w(КОН) =40%. Определить: х - формулу кислоты.
Решение. 1. Вычисляем массу и количество вещества КОН, который содержится в растворе: m = V ∙ ρ; m =10 мл∙1,4 г/мл =14г (1 балл)
m (КОН) = 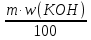 ; m (КОН) =
; m (КОН) = 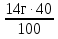 = 5,6 г; n(КОН) =
= 5,6 г; n(КОН) = 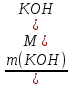 n(КОН) =
n(КОН) = 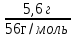 = 0,1 моль (2 балла).
= 0,1 моль (2 балла).
2.Расчитываем количество вещества кислоты, взятой для реакции.
М(ПК) = хМ(С) +(2х +1)М(Н)+М(С) +2М(О) +М(Н); М(ПК)=(14х + 46) г/моль
n(ПК) =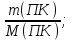 n(ПК) =
n(ПК) = 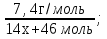 (3 балл).
(3 балл).
3.Составляем уравнение реакций: СxH2x+1COOH +КОН → СxH2x+1COOК + Н2О (1 балл)
4.Из уравнения реакции следует: n(ПК) = n(КОН); 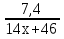 = 0,1(1 балл)
= 0,1(1 балл)
5.Отсюда следует, что х =2. Формула кислоты С2Н5СООН. Это пропионовая кислота (1 балл).
Задача 10 - 3. (12 баллов). Химические свойства хлора и йода отличаются во многих деталях. Приведите примеры, в которых хлор и йод реагируют по-разному.
Задача 10 - 3. (12 баллов). Решение. 1. С металлической медью или железом при нагревании: 2Сu + I2 =2CuI; Cu + Cl2 = CuCl2; Fe + I2 → Fe I2; 2Fe + 3Cl2 → 2FeCl 3 (4 балла)..
2. Со фтором: I2 + 5F2 → 2IF5; Cl2 + 3F2 → 2ClF3 (2 балла).
3. С раствором щелочи на холоде: 2NaOH + Cl2 → NaCl + NaOCl + H2O;
6NaOH + 3I2 → 5NaI + NaIO3 + 3H2O (2 балла).
4. С раствором тиосульфата натрия: Na2S2O3 + 4Cl2 + 5H2O → Na2SO4 + H2SO4 + 8HCl;
Na2S2O3 + I2 → Na2S4O6 +2NaI (2 балла).
Задача 10 - 4 (9 баллов). Определите массовые доли (в %) сульфата железа (II) и сульфида алюминия в смеси, если при обработке 25 г этой смеси водой выделился газ, который
полностью прореагировал с 960 г 5%-ного раствора сульфата меди.
Задача 10 - 4 (9 баллов). Решение. 1) Составлены уравнения реакций: Al2S3 + 6H2O = 2Al(OH)3 + 3H2S; CuSO4 + H2S = CuS +H2SO4 (2 балла). 2) Рассчитано количество вещества сероводорода: n (CuSO4 ) = 960 ∙ 0,05 / 160 = 0,3 моль; n(H2S) = n(CuSO4) = 0,3 моль (2 балла). 3) Рассчитаны количество вещества и массы сульфида алюминия и сульфата железа(II): n (Al2 S 3) = 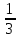 n (H 2S) = 0,1моль; m(Al2 S 3) = 0,1∙150 =15 г; m(FeSO4 ) = 25 -15 = 10 г (3 балла). 4) Определены массовые доли сульфата железа(II) и сульфида
n (H 2S) = 0,1моль; m(Al2 S 3) = 0,1∙150 =15 г; m(FeSO4 ) = 25 -15 = 10 г (3 балла). 4) Определены массовые доли сульфата железа(II) и сульфида
алюминия в исходной смеси: ω(FeSO4) = 10 / 25 = 0,4, или 40%; ω (Al2S3) =15 / 25 = 0,6, или 60% (2 балла).
Задача 10-5 (20 баллов). Однажды химик Юра Б., разбирая в своей лаборатории старый заброшенный сейф, обнаружил в нём неподписанную банку с белым кристаллическим веществом (соль X), окрашивающим пламя в фиолетовый цвет. «Что же там?» - подумал Юра.
И, взяв с соседней полки концентрированную серную кислоту, прилил её к навеске соли массой 7,35 г (реакция 1). При этом он наблюдал выделение бурого газа с удушающим запахом (газ A) с плотностью по водороду 33,75.
«Налью-ка я туда чего-нибудь другого», - решил Юра и добавил к аликвоте соли этой же массы концентрированную соляную кислоту (реакция 2). Каково было удивление химика, когда он обнаружил выделение жёлто-зелёного газа (газ B). Плотность газовой смеси по водороду составляла 35,5.
«Как опасно!», - воскликнул Юра и осторожно прибавил к навеске данной соли немного концентрированного раствора щавелевой кислоты (реакция 3). При этом он наблюдал бурное выделение из раствора смеси газов A и С (плотность смеси по водороду 29,83).
«Теперь мне всё ясно, надо её подальше убрать, а то мало ли что может случиться», - твёрдо сказал химик и спрятал банку с солью подальше в сейф.
Результаты опытов сведены в таблицу.
Реакция
Мольное соотношение газов
Плотность газовой смеси по водороду
Объём раствора KOH (ρ = 1,092 г/мл, ω = 10 %), пошедший на полное поглощение газовой смеси (t = 40 °C)
A
B
C
1
1
-
-
33,75
20,51 мл
2
-
1
-
35,50
184,62 мл
3
2
-
1
29,83
61,53 мл
Вопросы:
-
Расшифруйте формулы газов А, B, C. Ответ подтвердите расчётами.
-
Напишите уравнения реакций поглощения газов А, В, С раствором KOH.
-
Какую соль обнаружил Юра у себя в сейфе? Приведите необходимые расчёты.
-
Напишите уравнения реакций 1-3.
-
Напишите уравнения разложения соли X при 400 °C в присутствии катализатора (MnO2) и без него.
-
Объясните, чего опасался Юра? Где применяется соль X? Дайте её тривиальное название.
Задача 10-5 (автор - К. А.Куриленко). Решение. 1. Рассчитываем молярную массу газа В 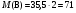 (г/моль), учитывая, что этот газ получен при взаимодействии соли X c соляной кислотой, им может быть хлор. B - Cl2.
(г/моль), учитывая, что этот газ получен при взаимодействии соли X c соляной кислотой, им может быть хлор. B - Cl2.
Рассчитаем молярную массу газа А. 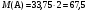 (г/моль)
(г/моль)
Исходя из дробной молярной массы A, его бурой окраски и удушающего запаха, можно предположить, что данный газ содержит хлор, тогда на оставшиеся элементы приходится 67,5 - 35,5 = 32 г/моль. Это соответствует 2 атомам кислорода, тогда возможная формула A - ClO2.
Зная молярную массу A и мольное соотношение, можно определить газ С.
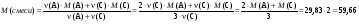
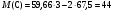 г/моль. Газом с такой молярной массой, выделяющимся из раствора щавелевой кислоты, может быть лишь CO2. C - CO2.
г/моль. Газом с такой молярной массой, выделяющимся из раствора щавелевой кислоты, может быть лишь CO2. C - CO2.
A - ClO2
B - Cl2
C - CO2.
2. Уравнения реакций взаимодействия газов со щёлочью в соответствии с условием задачи:
2ClO2 + 2KOH = KClO2 + KClO3 + H2O (1)
3Cl2 + 6KOH = KClO3 + 5KCl + 3H2O (2)
Cl2 + 2KOH = KCl + KOCl + H2O (2а)
CO2 + 2KOH = K2CO3 + H2O (3)
3. По окраске пламени и выделении двуокиси хлора при взаимодействии соли X с концентрированной H2SO4 можно судить о наличии в её составе калия и хлора. По реакции 1 рассчитаем молярную массу X.
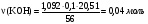 , по уравнению реакции
, по уравнению реакции 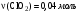
Составим таблицу
Соотношение
ν(X) : ν(ClO2)
M(X)
X
1:1
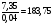
-
2:1
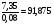
-
3:2
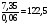
KClO3
1:2
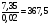
-
Из таблицы видно, что единственной солью с данной молярной массой, в которой присутствуют хлор и калий, может являться хлорат калия.
X - KClO3
4. Уравнения взаимодействия KClO3 c кислотами.
3KClO3 + 3H2SO4 → 3KHSO4 + HClO4 + 2ClO2 + H2O
KClO3 + 6HCl → KCl + 3Cl2 + 3H2O
2KClO3 + H2C2O4 → K2CO3 + CO2 + 2ClO2 + H2O
5. Разложение KClO3 начинается уже при 400 °C. Так, в присутствии катализатора (MnO2 и др.) разложение преимущественно идёт по следующей реакции:
2KClO3 → 2KCl + 3O2
В отсутствие катализатора образуются хлорид и перхлорат калия:
4KClO3 → 3KClO4 + KCl
6) Тривиальное название соли X - бертолетова соль. Она применяется в спичечном производстве, при изготовлении взрывчатых веществ и сигнальных ракет. Смеси этой соли с восстановителями (серой, фосфором и др.) легко взрываются от удара (видимо, это вызвало опасения Юры, и он аккуратно убрал банку с бертолетовой солью глубоко в сейф).
Система оценивания:
-
3 газа + 3 расчёта = 3∙2 балла + 3∙0,5 балла 7,5 баллов
-
3 уравнения по 1 баллу 3 балла
-
соль + расчёт = 2 балла + 0,5 балла 2,5 балла
-
3 уравнения по 1 баллу 3 балла
-
2 уравнения по 1 баллу 2 балла
-
Объяснение опасений Юры + применение 2∙0,5 балла
+ название 1 балл 2 балла
ИТОГО 20 баллов
Муниципальный этап всероссийской олимпиады школьников по химии
11 класс
Задача 11 - 1 (6 баллав). При взаимодействии 25,5 г предельной однооснóвной карбоновой кислоты с избытком раствора гидрокарбоната натрия выделилось 5,6 л (н.у.) газа. Определите молекулярную формулу кислоты.
Задача 11 -1 Решение. (6 баллав). 1. Cоставлено уравнение реакции в общем виде, и вычислено количество вещества газа: СnH2n+1COOH + NaHCO3 = СnH2n+1COONa + H2O + CO2
n(CO2) = 5,6 : 22,4 = 0,25 моль (2 балла). 2. Рассчитана молярная масса кислоты: n(CO2) = n(СnH2n+1COOH) = 0,25 моль; М(СnH2n+1COOH) = 25,5/0,25 = 102 г/моль (2 балла)
3. Установлена молекулярная формула кислоты: М(СnH2n+1COOH) = 12n + 2n + 1 + 45 = 102; 14n + 46 = 102; 14n = 56; n = 4; Молекулярная формула - C4H9COOH (2 балла).
Задача 11 -2 (4 балла). Железо растворили в горячей концентрированной серной кислоте. Полученную соль обработали избытком раствора гидроксида натрия. Выпавший бурый осадок отфильтровали и прокалили. Полученное вещество сплавили с железом. Напишите уравнения четырёх описанных реакций.
Задача 11 -2 (4 балла). Решение. Написаны четыре уравнения описанных реакций:
1) 2Fe + 6H2SO4 →t° Fe2(SO4)3 + 3SO2 + 6H2O (1 балл)
2) Fe2(SO4)3 + 6NaOH = 2Fe(OH)3 + 3Na2SO4 (1 балл)
3) 2Fe(OH)3 →t° Fe2O3 + 3H2O (1 балл)
4) Fe2O3 + Fe = 3FeO (1 балл)
Задача 11 - 3 (7 баллов). Ученик слил растворы хлорида алюминия и карбоната калия. Учитывая особенности гидролиза данных солей, подробно опишите происходящие при этом процессы.
Задача 11 - 3 (10 баллов). Решение. AlCl3 - соль, образованная сильной кислотой НCl и слабым основанием Al(ОН)3 (1 балл).. В водном растворе AlCl3 подвергается гидролизу. Первая ступень: Al+3 + НОН ⇄ Al(ОН)2+ + Н+ (1 балл).
Вторая ступень: Al(ОН)2+ + НОН ⇄ Al(ОН) 2+ + Н+ (1 балл).
Третья ступень: гидролиз не идет из-за накопления в растворе ионов водорода (1 балл).
Карбонат калия К2СО3 - соль, образованная слабой нестойкой кислотой Н2СО3 и сильным основанием КОН (1 балл), в водном растворе подвергается гидролизу:
Первая ступень: СО32- + НОН ⇄ НСО3 - + ОН- (1 балл).
Вторая ступень: гидролиз не идет из-за накопления в растворе гидроксид-ионов (1 балл).
При сливании растворов AlCl3 и К2СО3 ионы водорода первого раствора связываются гидроксид-ионами второго: Н+ + ОН- = Н2О. В соответствии с принципом Ле Шаталье равновесие смещается вправо и гидролиз двух солей идет до конца.
2AlCl3 + 3К2СО3 + 3Н2О = 2 Al(ОН)3 + 3СО2 + 6КСl (3 балла)
Задача 11 - 4. (9 баллов). Определите массовые доли (в %) сульфата железа(II) и сульфида алюминия в смеси, если при обработке 25 г этой смеси водой выделился газ, который
полностью прореагировал с 960 г 5%-ного раствора сульфата меди.
Задача 11 - 4 (9 баллов). Решение. 1) Составлены уравнения реакций: Al2S3 + 6H2O = 2Al(OH)3 + 3H2S; CuSO4 + H2S = CuS +H2SO4 (2 балла). 2) Рассчитано количество вещества сероводорода: n (CuSO4 ) = 960 ∙ 0,05 / 160 = 0,3 моль; n(H2S) = n(CuSO4) = 0,3 моль (2 балла). 3) Рассчитаны количество вещества и массы сульфида алюминия и сульфата железа(II): n (Al2 S 3) = 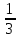 n (H 2S) = 0,1моль; m(Al2 S 3) = 0,1∙150 =15 г; m(FeSO4 ) = 25 -15 = 10 г (3 балла). 4) Определены массовые доли сульфата железа(II) и сульфида
n (H 2S) = 0,1моль; m(Al2 S 3) = 0,1∙150 =15 г; m(FeSO4 ) = 25 -15 = 10 г (3 балла). 4) Определены массовые доли сульфата железа(II) и сульфида
алюминия в исходной смеси: ω(FeSO4) = 10 / 25 = 0,4, или 40%; ω (Al2S3) =15 / 25 = 0,6, или 60% (2 балла).
Задача 11 - 5. (12 баллов). Химические свойства хлора и йода отличаются во многих деталях. Приведите примеры, в которых хлор и йод реагируют по-разному.
Задача 11 - 5. (12 баллов). Решение. 1. С металлической медью или железом при нагревании: 2Сu + I2 =2CuI; Cu + Cl2 = CuCl2; Fe + I2 → Fe I2; 2Fe + 3Cl2 → 2FeCl 3 (4 балла)..
2. Со фтором: I2 + 5F2 → 2IF5; Cl2 + 3F2 → 2ClF3 (2 балла).
3. С раствором щелочи на холоде: 2NaOH + Cl2 → NaCl + NaOCl + H2O; 6NaOH + 3I2 → 5NaI + NaIO3 + 3H2O (2 балла).
4. С раствором тиосульфата натрия: Na2S2O3 + 4Cl2 + 5H2O → Na2SO4 + H2SO4 + 8HCl; Na2S2O3 + I2 → Na2S4O6 +2NaI (2 балла).
Задача 11- 6. (20 баллов). Нарушается ли принцип Ле Шателье? Аммиак - самый многотоннажный продукт химической промышленности, ежегодно его получают более 100 млн. тонн. Реакция синтеза обратима: N2 + 3H2 ⇄ 2NH3. При 200 °C и давлении 1 атм константа равновесия, выраженная через мольные доли, Kx = 1, а при 400 °C и том же давлении Kx = 0,01.
1. Напишите выражение для константы равновесия Kx.
2. С выделением или поглощением теплоты происходит реакция синтеза аммиака? Объясните.
3. Сколько молей аммиака может образоваться при 200 °C из 1 моль N2 и 3 моль H2?
4. В равновесной смеси при некоторых условиях находится 0,65 моль N2, 0,25 моль H2 и 0,1 моль NH3. В какую сторону сместится равновесие при добавлении к этой смеси 0,25 моль азота? Объясните ваш ответ.
Задача 11-6 (автор - Ерёмин В. В.) (20 баллов). Решение 1. 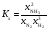
2. При нагревании константа равновесия уменьшается, то есть равновесие смещается в сторону реагентов. Согласно принципу Ле Шателье это означает, что реакция идёт с выделением теплоты.
3. Пусть в реакцию вступило a моль N2, тогда прореагировало 3a моль H2 и образовалось 2a моль NH3. Общее количество вещества после реакции: (N2) + (H2) + (NH3) = (1-a) + (3-3a) + 2a = 4 - 2a.
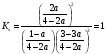 .
.
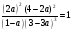 .
.
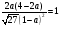 .
.
a = 0,34.
(NH3) = 2 0,34 = 0,68 моль.
4. Рассчитаем мольные доли веществ после добавления азота и составим из них величину Q, по форме аналогичную константе равновесия:
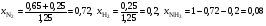 .
.
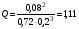 .
.
Это значение превышает значение константы равновесия:
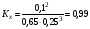 .
.
Это означает, что продукта реакции больше, чем необходимо в равновесной смеси, следовательно, для достижения равновесия должна пойти обратная реакция. Таким образом, в данном случае добавление реагента приводит к смещению равновесия влево.
Комментарий: Это противоречит традиционной формулировке принципа Ле Шателье (но не самому принципу!). Кажущееся противоречие объясняется тем, что количество азота в исходной смеси сильно превышает стехиометрическое, поэтому дальнейшее добавление азота термодинамически невыгодно.
Система оценивания
-
За правильное выражение для константы равновесия 2 балла
-
2 балла за правильный ответ (выделение теплоты), 2 балла за объяснение 4 балла
-
За правильный расчёт числа молей 6 баллов
-
2 балла за правильный ответ (равновесие сместится влево),
6 баллов за объяснение с расчётом (4 балла за объяснение без расчёта) 8 баллов
ИТОГО 20 баллов
Список литературы и интернет-ресурсов
-
Артемов А.В. Школьные олимпиады. Химия 8 - 11 классы. - М.: Айрис-пресс, 2007. - 240 с.
-
Всероссийская химическая олимпиада школьников: Кн. Для учителя/ П.А.Оржековский, Ю.Н.Медведев, А.В.Чураков, С.С.чуранов; Под редакцией Г.В.Лисичкина. - М.: Просвещение, учебная литература, 1996. - 192 с.
-
Габриелян О.С. Химия. 8 - 11 классы. Региональные олимпиады. 2000/2002/авт. Сост. О.С.Габриелян, А.Н.Прошлецов. - М.:Дрофа, 2005. - 287 с.
-
Габриелян О.С. Химия, 8 класс: учебник для общеобразовательных учреждений - 13 - изд., испр. - М.: Дрофа, 2008. - 270 с.
-
Хомченко И.Г. Решение задач по химии. - М.: РИА «Новая волна»: Издатель Умеренков, 2010 - 256 с.
-
Портал Всероссийской олимпиады школьников. Химия - chem.rosolymp.ru/


