- Преподавателю
- Химия
- Дидактические материалы для учителей химии Изучение окислительно-восстановительных реакций
Дидактические материалы для учителей химии Изучение окислительно-восстановительных реакций
| Раздел | Химия |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Волкорез Е.И. |
| Дата | 08.11.2015 |
| Формат | doc |
| Изображения | Есть |
18
Муниципальное бюджетное общеобразовательное учреждение
«Средняя общеобразовательная школа № 2»
ДИДАКТИЧЕСКИЕ МАТЕРИАЛЫ
для учителя химии
«ИЗУЧЕНИЕ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ»
Номинация: дидактические материалы
Автор:
Волкорез Елена Ильинична
учитель химии,
высшая квалификационная категория
г. Радужный, 2014 г.
Дидактические материалы по химии
«Изучение окислительно - восстановительных реакций»
В условиях компетентностного подхода к образованию изучение химии в общеобразовательной школы нацелено на формирование базовых компетенций учащихся:
- учебно-познавательной (определять цели и порядок работы, самостоятельно планировать свою учебную деятельность и учиться, устанавливать связи между отдельными объектами, применять освоенные способы в новых ситуациях, осуществлять самоконтроль);
- коммуникативной (сотрудничать, оказывать помощь другим, участвовать в работе команды, обмениваться информацией);
- информационной (самостоятельно искать, анализировать и отбирать информацию, структуировать, преобразовывать, сохранять и передавать её);
- личностного самосовершенствования (анализировать свои достижения и ошибки, обнаруживать проблемы и затруднения в сообщениях одноклассников, осуществлять взаимную помощь и поддержку в затруднительных ситуациях, критически оценивать и переоценивать результаты своей деятельности
Содержательная компонента курса «Химия» в рамках требований государственного образовательного стандарта сроится вокруг понятия окислительно-восстановительные реакции, которое является одним из центральных в науке.
Понимание содержания понятия окислительно-восстановительные и применение его компонентов в жизни очень важно, так как именно окислительно-восстановительные реакции широко распространены в природе и используются в технике. В основе жизни лежат окислительно-восстановительные реакции, происходящие при фотосинтезе, дыхании, транспорте электронов; они же обеспечивают основную часть энергопотребления человечества за счет сжигания органического топлива, получение металлов, извлечение энергии взрыва.
Понимание сущности окислительно-восстановительных процессов формируется на основе теоретических знаний и практических навыков.
Именно актуальность вопроса обеспечивает место заданной проблемы в курсе химии (8, 9 и 11кл).
Тема является очень сложной для понимания процессов, происходящих в результате этих реакций.
При изучении сущности окислительно-восстановительных реакций (ОВР) образовательный процесс не только целенаправлен, но и обеспечивает решение следующих образовательных задач:
1. формирование научного представления о химическом процессе окислительно-восстановительных реакций;
2. развитие умений составлять электронный баланс для уравнений, анализировать ход химической реакции, определять свойства химических веществ, умение работать в условиях соблюдения техники безопасности, проводить опытные исследования, разрабатывать проекты (краткосрочные и долгосрочные)
3. воспитание навыка работы в команде, качеств исполнителя и организатора учебной деятельности, в условиях самоконтроля и взаимоконтроля.
Основные умения и компентенции выстраиваются в иерархии: узко в рамках одной темы и более широко в масштабе целой темы или раздела программы.
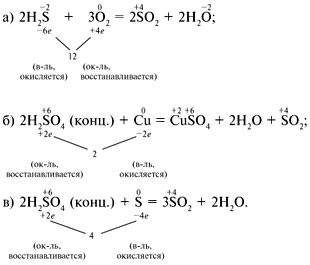
Так например, умения в составлении электронного баланса для уравнений ОВР, приобретенные в 8-м классе, совершенствуются в теме «Сера и ее соединения». Здесь уже встречаются уравнения более сложного уровня, например:
Центральное место в курсе 9-го класса занимает урок «Закономерности окислительно-восстановительных реакций», который проводится в теме «Подгруппа азота» перед изучением азотной кислоты как окислителя. Тема «Азот и его соединения» создает условия для углубления накопленных знаний, развития умений: используя знание закономерностей ОВР, учащиеся изучают свойства молекулы азотной кислоты, обусловленные наличием в ее составе атома азота в высшей степени окисления
Полный курс неорганической химии, дает возможность осмыслить сущность окислительно-восстановительные процессы, при этом учащиеся действительно готовы объяснять причины их протекания.
В органической химии при изучении различных классов веществ формируются навыки определения cтепени окисления на конкретных примерах, на основе умений и правил, известных учащимся с 8-го класса правила.
Например:
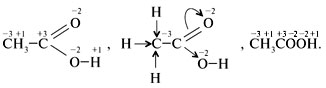
К этим записям учащиеся приходят после рассуждения о полярности имеющихся в молекуле связей и смещении электронной плотности к атомам кислорода с учетом слабой полярности связей С-Н.
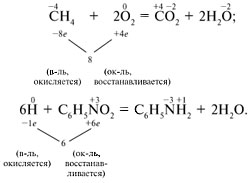
При составлении уравнений ОВР, протекающих с участием органических веществ, в простейших случаях можно применять понятие «степень окисления». Приведем уравнения реакций, в которых коэффициенты могут быть определены по такому же правилу, что и для ОВР в неорганической химии:
В 11-м классе, обобщаются знания о классификации химических реакций, в основе лежит уже сформированное у учащихся представление об одной из классификаций по изменениям степеней окисления атомов, входящих в состав взятых и полученных веществ. Важность и ценность урока в том, что у учащихся формируются комплексные системные знания об ОВР (мировозрренческая компонента компетенций), на основе применения в практической деятельности понятий «электроотрицательность», «степень окисления», «окислитель», «окисление», «восстановитель», «восстановление», закономерности ОВР, правила составления уравнений ОВР и нахождения коэффициентов с помощью метода электронного баланса.
Уровень обученности и работоспособности класса позволяют дифференцировать объем научных знаний, и вывести на уровень представлений об электронно-ионных уравнениях при рассмотрении ОВР. Пример:
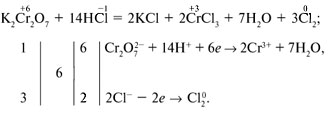
Для формирования научного понимания сущности окислительно-восстановительных процессов и развития навыков практической деятельности учебно-познавательная деятельность строится на разных формах, методах и приемах обучения.
-
индивидуальная, групповая и фронтальная работа с теоретическими материалами учебника: применяя анализ, синтез, структурирование, классификацию;
2. работа над мини-проектами, способствует формированию мотивации учения, актуализировать субъектный опыт учащихся, что обеспечивает развитие восприятия, осмысления, и способствует запоминанию учащимися изучаемого материала.
-
метод тестирование для формирования умений и контроля (самоконтроль и взаимоконтроль);
-
решение практических задач: определения валентности, степени окисления; составление ОВР методом электронного баланса, составление ОВР методом полуреакций,
5. исследовательская работа, решение проблемных задач, которые ориентированы на 5 теоретических блоков:
1. Валентность и степень окисления.
4. ОВР в органической химии.
3. Что такое ОВР.
5. Окислительно-восстановительные реакции
Исследовательская работа, ориентированная на практическую значимость данных процессов, например, путешествие в царство «рыжего дьявола" (работа над понятием коррозия, сущности этого процесса, классификация - химическая, электрохимическая, механохимическая; способы защиты от коррозии).
«Знаете, ли Вы что..» выходит за рамки учебной программы (возможно изучить виды коррозии).
«Этот день Победы». Применение окислительно-восстановительных реакций на войне. Проблемные вопросы, которые связанные с окислительно-восстановительными процессами, происходящими в окружающем нас мире, вызывают интерес у ребят к изучению этих сложных химических процессов которые чтобы как можно подробнее показать все явления.
По этой теме учащимся предлагаются такие проблемные вопросы:
а. Где в окружающем нас мире мы встречаемся с ОВР?
б. В чем отличие обменных реакций от окислительно-восстановительных?
в. Чем отличается степень окисления от валентности?
г. Какие особенности протекания ОВР в органической химии?
6. Мини-сочинения, которые выполняют ребята, помогают обеспечить понимание учащимися поставленную цель, в ходе самостоятельной работы над источником (дома или в классе):
-
«Путешествие окислителя и восстановителя»;
-
нарисовать образ окислителя и восстановителя;
-
подобрать или придумать тезис к проблемному вопросу.
Система работы по формированию понимания сущности окислительно-восстановительных процессов, результатов исследовательских работ, обеспечивают не только научное понимание, но и мировоззренческую позицию на основе грамотно сформированных взглядов об окружающем нас мире, как гигантской химической лаборатории, в которой ежесекундно протекают химические реакции в основном окислительно-восстановительные и пока в природе существуют окислительно- восстановительные процессы, конец света невозможен.
Убедительным фактором сформированности учебно-познавательной компетенции является умение учащихся самостоятельно разобраться над наиболее трудными вопросами данной темы, а так же подготовиться к сдаче ЕГЭ по химии.
Применение дидактических материалов позволяет более четко структурировать самостоятельную мыслительную деятельность и способствует формирования навыков работы:
-
Алгоритм составления уравнений окислительно-восстановительных реакций методом электронного баланса (Приложение 1).
-
Алгоритм определения степени окисления (Приложение 2)
3. Алгоритм определения степени окисления химического элемента в бинарных соединениях (Приложение 3)
4.Самостоятельная работа по теме «Степень окисления. Окислительно-восстановительные реакции» (Приложение 4)
5. Практикум по окислительно-восстановительным реакциям (упражнения и демонстрационные опыты) (приложение 5)
6. Тест «Окислительно-восстановительные реакции» (Приложение 6)
7. Тесты, кроссворды с применением ИКТ (Приложение 7)
8. Творческие задания (Приложение 8).
Приложение 1
Алгоритм
составления уравнений ОВР методом электронного баланса
-
Составить схему реакции.
Mg + H2SO4 → MgSO4 + H2S + …
-
Определить степени окисления элементов в реагентах и продуктах реакции.
Mg0 + H2+1S+6O4-2 → Mg+2S+6O4-2 + H2+1S-2 + …
-
Определить, является реакция окислительно-восстановительной или она протекает без изменения степеней окисления элементов.
-
Подчеркнуть элементы, степени, окисления которых изменяются.
Mg0 + H2+1S+6O4-2 → Mg+2S+6O4-2 + H2+1S-2 + …
-
Определить, какой элемент окисляется, (его степень окисления повышается) и какой элемент восстанавливается (его степень окисления понижается), в процессе реакции.
Mg0 → Mg+2 окисляется
S+6 → S-2 восстанавливается
-
В левой части схемы обозначить с помощью стрелок процесс окисления (смещение электронов от атома элемента) и процесс восстановления (смещение электронов к атому элемента)
Mg0 - 2 ē → Mg+2 окисление
S+6 + 8 ē → S-2 восстановление
-
Определить восстановитель и окислитель.
Mg0 - 2 ē → Mg+2 восстановитель
S+6 + 8 ē → S-2 окислитель
-
Сбалансировать число электронов между окислителем и восстановителем.
Mg0 - 2 ē → Mg+2 8 S+6 + 8 ē → S-2
9. Определить коэффициенты для окислителя и восстановителя, продуктов окисления и восстановления.
Mg0 - 2 ē → Mg+2 4 8 S+6 + 8 ē → S-2 1
-
Расставить коэффициенты перед формулами окислителя и восстановителя.
4Mg + 5H2SO4 → 4MgSO4 + H2S + 4H2O
-
Проверить уравнение реакции. Посчитаем количество атомов кислорода справа и слева, если их будет равное количество - уравнение мы уравняли.
5 * 4 = 20 4 * 4 + 4 = 20
Приложение 2
Алгоритм
определение степени окисления
Правила для определения степеней окисления химических элементов в соединениях.
1. Степень окисления любого элемента в простом веществе равна 0.
2. Сумма степеней окисления всех атомов, входящих в состав частицы (молекул, ионов и т. д.) равна заряду этой частицы. В частности, сумма степеней окисления всех атомов в составе нейтральной молекулы равна 0.
3. Если соединение образовано двумя элементами, то у элемента с большей электроотрицательностью степень окисления меньше нуля, а у элемента с меньшей электроотрицательностью - больше нуля.
4. Максимальная положительная степень окисления любого элемента равна номеру группы в периодической системе элементов, а минимальная отрицательная равна N - 8, где N - номер группы.
5. Степень окисления фтора в соединениях равна -1.
6. Степень окисления щелочных металлов (лития, натрия, калия, рубидия, цезия) равна +1, металлов главной подгруппы II группы периодической системы (магния, кальция, стронция, бария) равна +2, степень окисления алюминия равна +3.
7. Степень окисления водорода в соединениях равна +1(исключение - соединения с металлами NaH, CaH2, в этих соединениях степень окисления у водорода равна -1).
8. Степень окисления кислорода равна -2 (исключения - перекиси H2O2, Na2O2, BaO2 в них степень окисления водорода равна -1, а в соединении с фтором - +2).
Приложение 3
Алгоритм
определения степени окисления химического элемента в бинарных соединениях
1. Находим, какой из двух элементов в соединении является более электроотрицательным.
Над символом более электроотрицательного элемента ставим знак «минус» (-).
Над символом менее электроотрицательного элемента ставим знак «плюс» (+).
2. Определяем числовое значение степени окисления для более электроотрицательного элемента. (См. правила.)
3. Определяем общее число отрицательных зарядов в соединении. Для этого степень окисления более электроотрицательного элемента умножаем на его индекс.
4. Находим степень окисления менее электроотрицательного элемента, помня, что алгебраическая сумма степеней окисления химических элементов в соединении должна быть равна 0. Для этого общее число положительных зарядов делим на индекс у данного элемента.
Приложение 4
Самостоятельная работа по теме
«Степень окисления. Окислительно-восстановительные реакции»
Вариант 1.
1. Определите степень окисления каждого элемента в соединениях:
а) СО2, б) Р4 , в) Na2SO4
2. Составьте формулы соединений на основании знания степени окисления каждого элемента:
а) Na+ S -2 ; б) Mn +7O ; в) Sn +4 Cl -
3. Разберите сущность окислительно-восстановительной реакции и расставьте коэффициенты в уравнении:
KClO3 + P ----- KCl + P2O5
Вариант 2.
2. Определите степень окисления каждого элемента в соединениях:
а) KCl, б) Br2 , в) NaNO3
3. Составьте формулы соединений на основании знания степени окисления каждого элемента:
а) P -3H+ ; б) Fe +2Cl - ; в) Cr +6 O
4. Разберите сущность окислительно-восстановительной реакции и расставьте коэффициенты в уравнении:
SiO2 + Mg ------ Si + MgO
Приложение 5
Тест «ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ».
1.Степень окисления фосфора в соединении, имеющем формулу H4P2O7:
1) +7; 2) +3; 3) +5; 4) - 3.
2.Степень окисления серы уменьшается в ряду веществ, имеющих формулы:
1) SO2 - Na2SO3 - Na2S; 2) SO2 - Na2S2O3 - KHS;
3) S - SO3 - BaSO4; 4) H2SO4 - SOCl2 - H2SO3.
3.Выберите группу оксидов, подобранных случайным образом:
1) Na2O, MgO, Cu2O; 2) N2O5, NO, Cr2O3;
3) CrO3, P2O5, CO2; 4) Fe2O3, ZnO, CuO.
4.Соединение, содержащее Mn+7, в кислотной среде восстанавливается до:
1) Mn+4; 2) Mn+6; 3) Mn+2; 4) Mn0.
5.Не являются окислительно-восстановительными пара реакций, уравнения которых:
1) 2C2H5-Cl + 2Na → C4H10 + 2NaCl CH3Cl + NaOH → CH3OH + NaCl;
(водн. р-р)
2) 3CH ≡ CH → C6H6 (C (акт.), t) CH3NH2 + CH3Cl → CH3 - NH - CH3 + HCl;
3) CH2 ═ CH2 + H2 → CH3 - CH3 (t, ρ, Ni) CH3CH2Cl + NaOH → CH3 - CH2 - OH +NaCl;
(водн. р-р)
4) C6H5 - NO2 + 3H2 → C6H5 - NH2 + 2H2O (kat Ni)
CH3-COOH + C2H5OH → CH3-COOC2H5 + H2O.
6.Уравнение реакции диспропорционирования:
1) 2H2S + SO2 → 3S + 2H2O; 2) NH4NO2 → N2 + 2H2O;
3) 2KNO3 → 2KNO2 + O2; 4) 6KOH + 3S → 2K2S + K2SO4 + 3H2O.
7. Три из четырех реакций разложения, схемы которых приведены ниже, можно объединить в группу в соответствии с общим признаком. Укажите уравнение реакции, не входящей в эту группу:
1) KClO3 → KCl + O2 (MnO2); 2) Cu(NO3)2 → CuO + NO2 + O2;
3) HCOOH → CO + H2O (H2SO4); 4) CH4 → HC ≡ CH + H2.
8.Укжите схему реакции, которая не относится к тому же типу окислительно-восстановительных реакций, что и три остальных:
1) NH4NO3 → N2O + H2O; 2) KNO3 → KNO2 + O2;
3) KMnO4 → K2MnO4 + MnO2 + O2; 4) H2O2 → H2O + O2.
9. В окислительно-восстановительной реакции схема, которой
K2S + K2SO3 + H2SO4 → S + K2SO4 + H2O
окислителем является вещество с формулой: 1) K2S; 2) K2SO3; 3) H2SO4; 4) S.
10.В превращении, схема которого HClO3 + H2SO3 → HCl + H2SO4,
число электронов, отданных одной молекулой восстановителя, равно: 1) 3; 2) 2; 3) 5; 4)6.
11.В окислительно-восстановительной реакции, схема которой NH3 + O2 → NO + H2O,
сумма всех коэффициентов равна: 1) 9; 2) 11; 3) 16; 4) 19.
12.В окислительно-восстановительной реакции, схема которой
KI + NaNO2 + H2SO4 → I2 + NO + K2SO4 + Na2SO4 + H2O
сумма коэффициентов перед формулами продуктов реакции равна:1) 7; 2) 9; 3) 11; 4) 14.
13.Верным является утверждение:
1) наиболее сильным окислителем перманганат калия является в кислотной среде;
2) наиболее сильным окислителем перманганат калия является в
щелочной среде;
3) наиболее сильным окислителем перманганат калия является в
нейтральной среде;
4)кислотность среды не влияет на окислительную способность перманганата калия.
14.Найдите ошибку в утверждении, приведенном ниже: «Водород не выделяется при взаимодействии следующих кислот и металлов»:
1) концентрированная серная кислота и цинк;
2) разбавленная азотная кислота и железо;
3) концентрированная соляная кислота и серебро;
4) разбавленная серная кислота и алюминий.
15.Закончите уравнение окислительно-восстановительной реакции, схема которой
FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + … .
Сумма коэффициентов перед исходными веществами равна: 1) 11; 2) 15; 3) 16; 4) 20.
16.Восстановите уравнение реакции: … → Fe2O3 + NO2 + O2.
Сумма коэффициентов перед формулами всех веществ данного уравнения равна:
1) 15; 2) 17; 3) 21; 4) 24.
17. Коэффициент перед формулой одного из веществ в уравнении реакции, схема которого Al + HNO3 → Al(NO3)3 + NH4NO3 + H2O, равен 9. Число атомов в формульной единице этого соединения равно: 1) 13; 2) 9; 3) 5; 4)3.
18. Задания С (Вопросы ЕГЭ). Определите окислитель и восстановитель.
1. Р2О3 + Н2Сг2О7 + ...- --> Н3Р04 + СгРО4. 2. РН3 + AgN03 +... --> Ag +... + HNО3.
3. РНз + НС103 -->НС1 + ... . 4. НСОН + КМпО4 + ... --> СО2 + K2SО4 + ... + ....
5. NО + KC1О + ... --> KNO3 + ….+ Н2О.
Приложение 6
Практикум
по окислительно-восстановительным реакциям
(упражнения и демонстрационные опыты)
Знать: электронный баланс, окислитель, восстановитель, электронное уравнение.
Уметь: расставлять коэффициенты в окислительно-восстановительных реакциях методом электронного баланса.
Р ассмотрим реакцию между цинком и серой.
ассмотрим реакцию между цинком и серой.
Цинк окисляется серой до сульфида цинка белого цвета.
Zn+S=ZnS
Расставляем степени окисления: Zn0+S0=Zn2++2S-2
Составляем электронные уравнения. В каждое уравнение записывается атом, изменяющий степень окисления. Сумма зарядов и количество атомов в обеих частях уравнения должно быть одинаковым. Количество атомов уравнивают с помощью коэффициентов, общий заряд - с помощью добавления или уменьшения количества электронов (электронный баланс). Далее находят НОК числа электронов и опорные коэффициенты делением НОК на количество электронов в каждом электронном уравнении.
S0+2е=S-2
Zn0-2е= Zn2+
Вывод: опорные коэффициенты равны 1, значит, их не выставляют в уравнение реакции
Приложение 7
Тесты, кроссворды с применением ИКТ
Начало формы
л

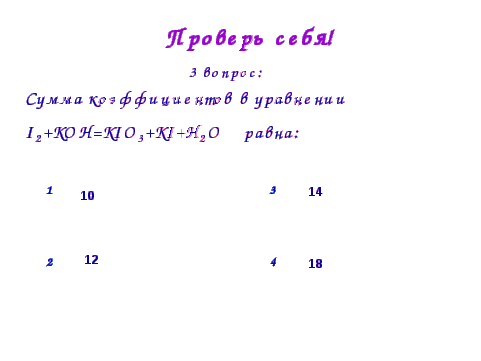
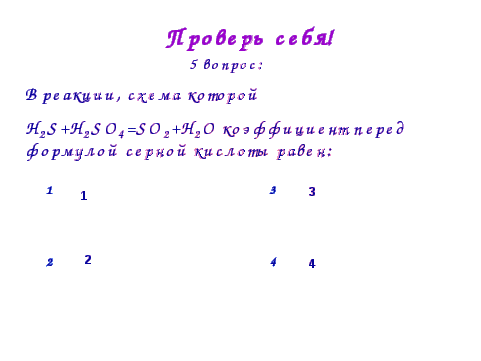
Приложение 8





