- Преподавателю
- Химия
- Методическая разработка по химии Тренажер для подготовки к ЕГЭ по химии. Блок Химические реакции
Методическая разработка по химии Тренажер для подготовки к ЕГЭ по химии. Блок Химические реакции
| Раздел | Химия |
| Класс | - |
| Тип | Тесты |
| Автор | Фурман О.Н. |
| Дата | 23.12.2014 |
| Формат | zip |
| Изображения | Есть |
Ижморский муниципальный район
Муниципальное казенное общеобразовательное учреждение
«Святославская средняя общеобразовательная школа»
Тренажер
для подготовки к ЕГЭ по химии
Блок «Химические реакции»
Методическая разработка
Составитель:
Фурман Оксана Николаевна,
учитель химии
МКОУ «Святославская СОШ»
Ижморский район
Святославка 2011
Содержание
Введение………………………………………………………………………3
Тема «Классификация химических реакций»………………………………5 Тема «Термохимия и химическая кинетика»………………………………16
Тема «Электролитическая диссоциация. Реакции ионного обмена. Гидролиз»……………………………………………………………………..28
Тема «Окислительно - восстановительные реакции. Электролиз»………41
Тема «Реакции, подтверждающие генетическую связь между классами неорганических и органических соединений»……………………………..57
Список литературы………………………………………………………….70
Введение
В 2008 году закончилсяся эксперимент по введению единого государственного экзамена (ЕГЭ), а с 2009 года для всех выпускников и желающих поступить в вузы ЕГЭ стал обязательным, поэтому цель этого пособия - подготовка выпускников к сдаче ЕГЭ.
Треть заданий экзаменационной работы составляют задания блока «Химическая реакция». Они проверяют усвоение следующих элементов содержания:
1) Классификация химических реакций
2) Понятие о скорости химических реакций
3) Факторы, влияющие на скорость реакций
4) Тепловой эффект химических реакций
5) Обратимые и необратимые химические реакции
6) Химическое равновесие и способы его смещения
7) Электролитическая диссоциация
8) Реакции ионного обмена
9) Гидролиз солей
10) Окислительно - восстановительные реакции
11) Электролиз расплавов и растворов
12) Реакции, подтверждающие генетическую связь между классами неорганических и органических соединений.
Проверка указанных выше элементов содержания осуществляется на всех трёх уровнях сложности - базовом (9 заданий с выбором ответа), повышенном (3 задания с кратким ответом) и высоком (3 задания с развёрнутым ответом).
В данной работе представлены тестовые задания для подготовки учащихся к сдаче ЕГЭ по теме «Химические реакции». Задания проверочных работ подобны тем, которые использовались в контрольных измерительных материалах ЕГЭ по химии. Задания в каждом варианте в сборнике представлены в различной форме:
-
Десять заданий базового уровня (А) с выбором одного правильного ответа из четырёх, время выполнения, которых приблизительно 1-2 минуты;
-
Два задания повышенного уровня (В) с кратким ответом, время выполнения - до 5 минут;
-
Одно задание высокого уровня (С) с развёрнутым ответом, на выполнение которого отводится до10 минут.
Каждый вариант выполняется в течение одного урока. За выполнение различных по сложности заданий даётся один или более баллов. За задания части А и В - по одному баллу, за задания части С - до пяти баллов, в зависимости от полноты правильного ответа. Баллы, полученные за выполненные задания, суммируются.
Тема «Классификация химических реакций»
Вариант 1
Часть 1
А1. Реакция, уравнение которой
СаСО3 + СО2 + Н2О = Са(НСО3)2 является реакцией
1) обмена 3) разложения
2) соединения 4) замещения
А2. Взаимодействие кислоты с основанием относится к реакциям
1) разложения 3) нейтрализации
2) замещения 4) присоединения
А3. Какое явление не является признаком химических превращений:
1) появление осадка 3) изменение объема
2) появление запаха 4)появление запаха
А4. Реакции, при которых из нескольких простых или сложных веществ образуется одно более сложное вещество, называются реакциями:
1) разложения 3) соединения
2) замещения 4) обмена
А5. Укажите химическое взаимодействие, которое относится к реакциям замещения:
1) 2NaOH + CuSO4 → Cu(OH)2 + Na2SO4
2) CuSO4 + Fe → FeSO4 + Cu
3) 2Н2 + O2→ 2H2O
4) 2Fe(OH)3→Fe2O3 + 3H2O
А6. Реакции, в ходе которых происходит изменение степеней окисления элементов, называются реакциями
1) ионноного объмена
2) окислительно - восстановительными
3) нейтрализации
4) каталитическими
А7. Для алканов характерными реакции:
1) замещения 3) полимеризации
2) присоединения 4) поликонденсации
А8. Какой процесс относится к реакциям разложения и к окислительно - восстановительным реакциям одновременно:
1) серная кислота + гидроксид магния
2) цинк + раствор серной кислоты
3) нагревание перманганата калия
4) горение алюминия
А8.Неверно одно из следующих утверждений:
«Получение этилена из этанола является реакцией
1) присоединения 3) гетерогенной
2) каталитической 4) дегидратации»
А9 . К экзотермическим реакциям не относится следующий биохимический процесс:
1) спиртовое брожение глюкозы
2) гликолиз
3) хемосинтез
4) синтез жиров из глицерина и жирных кислот
А10. Синтез аммиака из азотоводородной смеси относится к реакциям:
1) обратимым и каталитическим
2) окислительно - восстановительным и необратимым
3) соединения и некаталитическим
4) разложения и фотохимическим
Часть 2
В1. Установите соответствие между реагирующими веществами и типом химической рекции
РЕАГИРУЮЩИЕ ТИП
ВЕЩЕСТВА РЕАКЦИИ
А) Fe + Cl2→ 1) соединение
Б) FeО + HCl→ 2) замещение
В) Fe + H2SO4(paз6) → 3) обмен
Г) Fe +НCl → 4) разложение
A
Б
В
Г
В2. Установите соответствие между окислительно - восстановительной реакцией и формулой окислителя
ОКИСЛИТЕЛЬНО-
ВОССТАНОВИТЕЛЬНАЯ ОКИСЛИТЕЛЬ
РЕАКЦИЯ
1)Си + H2SO4(конц.) →CuSO4 + SO2+ Н2О; А) S
2)H2 + S→ H2S; Б) H2SO4(конц.)
3)SO2 + О2 → 2SO3; В) SO2
4)H2SO4(p-p) + Zn → ZnSO4 + H2 Г) О2
Д) H2SO4(p-p)
1
2
3
4
Часть 3
С1.Запишите уравнения реакций, с помощью которых можно осуществить превращения:
А→Б→В→Г→Д→Е→гидрокарбонат кальция.
Реакции 3,4 - окислительно - восстановительные, остальные таковыми не являются, все вещества содержат общий элемент. Укажите условия протекания реакций. Одной стрелке соответствует одна реакция.
Вариант 2
Часть 1
А1. Реакция, уравнение которой
2NaOH + CuSO4 → Cu(OH)2 + Na2SO4 , является реакцией
1) обмена 3) разложения
2) соединения 4) замещения
А2. Хлорирование бензола на свету относится к реакциям
1) разложения 3) отщепления
2) замещения 4) присоединения
А3. К реакциям, протекающим с изменением состава вещества, относится получение:
1) изобутана из н-бутана
2) белого фосфора из красного
3) диметилового эфира из метанола
4) алмаза из графита
А4. Реакции, при которых сложные вещества обмениваются составными частями, называются реакциями:
1) разложения 3) соединения
2) замещения 4) обмена
А5. Укажите химическое взаимодействие, которое относится к
реакциям разложения:
1) 2NaOH + CuSO4 → Cu(OH)2 + Na2SO4
2) CuSO4 + Fe → FeSO4 + Cu
3) 2Н2 + O2→ 2H2O
4) 2Fe(OH)3→Fe2O3 + 3H2O
А6. Реакции, в ходе которых не происходит изменение степеней окисления элементов, не могут быть реакциями
1) ионноного объмена
2) окислительно - восстановительными
3) нейтрализации
4) гидролиза
А7. Для алкенов практически не характерны реакции
1) замещения 3) полимеризации
2) присоединения 4) элиминирования
А8. Какой процесс относится и к реакциям соединения, и к окислительно - востановительным реакциям, и к экзотермическим реакциям одновременно:
1) серная кислота + гидроксид магния
2) цинк + раствор серной кислоты
3) нагревание перманганата калия
4) горение фосфора
А9. Неверно одно из следующих утверждений:
«Реакция этерификации - это реакция:
1) обмена 3) обратимая
2) каталитической 4) соединения кислоты и спирта в
сложный эфир»
А10. К фотохимическим реакциям не относится следующая:
1) фотосинтез
2) получение озона в тропосфере
3) хлорирование метана
4) разложение пероксида водорода в присутствии оксида марганца (IV)
Часть 2
В1. Установите соответствие между химическим термином и его антонимом:
ТЕРМИН АНТОНИМ
А) гидрирование 1) гидролиз
Б) этерификация 2) деполимеризация
В) полимеризация 3) дегидрирование
Г) дегидрохлорирование 4) гидрохлорирование
5) дегидратация
A
Б
В
Г
В2
Среди перечисленных реакций …
1) CaO + SO2 = CaSO3
2) CaSO3 + 2HCl = CaCl2 + H2O + SO2
3) CaCl2(расплав) = Ca + Cl2↑
4) Сa +2H2O = Ca(OH)2 + H2 ↑
5) Ca(OH)2 + CO2 =CaCO3 ↓ + H2O
6) CaCO3 + CO2(избыток) + H2O = Ca(HCO3)2
окислительно - востановительными являются…
Часть 3
С1. Органическое вещество вступает в реакцию «серебряного зеркала», при нагревании в присутствии концентрированной кислоты дегидратируется, превращаясь в угарный газ. Определите вещество, запишите уравнения реакций.
Вариант 3
Часть 1
А1. Взаимодействие цинка с соляной кислотой относится к
реакциям:
1)обмена 3) разложения
2)соединения 4) замещения
А2. Какому типу реакции соответствует уравнение?
Zn(OH)2 + H2SО4= ZnSO4 + 2Н2О
1) обмена 3) разложения
2) соединения 4) замещения
А3. С наибольшей скоростью протекают реакции
1) экзотермические 3) горения
2) ионного обмена 4) фотохимические
А4. Укажите неверное утверждение:
«Реакция нейтрализации - это реакция:
1) не окислительно - восстановительная
2) обмена
3) экзотермическая
4) всегда обратимая»
А5. При щелочном гидролизе жиров образуются:
1)глицерин и вода
2) карбоновые кислоты и одноатомные спирты
3) карбоновые кислоты и глицерин
4) глицерин и мыла
А6. Какое из приведенных уравнений соответствует реакции нейтрализации?
1) ВаСО3 + 2HCl =ВаС12 + Н2О + СО2
2) Ва(ОН)2 + H2SO4 = BaSO4 + 2Н2О
3) СаС12 + Na2CO3 = СаСО3 + 2NaCl
4) 3NaOH + FeCl3 = Fe(OH)3 + 3NaCl
А7. Укажите неверное утверждение: «Реакция синтеза оксида азота(II) из азота и кислорода - это реакция:
1)соединения 3) гомогенная
2) обратимая 4) экзотермическая
А8. Укажите окислительно - восстановительную реакцию замещения:
1) CaO + SO2 = CaSO3
2) 2NaOH + CuSO4 → Cu(OH)2 + Na2SO4
3) CuSO4 + Fe → FeSO4 + Cu
4) 2Н2 + O2→ 2H2O
А9. К эндотермическим реакциям не относится:
1) биосинтез белков
2) фотосинтез
3) брожение глюкозы
4) образование АТФ из АДФ
А10. Окисление оксида серы (IV) в оксид серы (VI) относится к реакциям:
1) обратимым и некаталитическим
2) окислительно - восстановительным и каталитическим
3) соединения и некаталитическим
4) разложения и фотохимическим
Часть 2
В1. Установите соответствие между органическим веществом и продуктом его реакции с натрием:
ФОРМУЛА ВЕЩЕСТВА ФОРМУЛА
ПРОДУКТА РЕАКЦИИ
А) CH3Cl 1) CH3COONa
Б) C6H5OH 2) C2H5ONa
В) C2H5OH 3) C2H6
Г) CH3COOH 4) C6H5ONa
5) CH3OH
A
Б
В
Г
В2. Соотнесите схему реакции и её тип:
СХЕМА РЕАКЦИИ: ТИП РЕАКЦИИ:
А) АВ+С=АВС 1) обмен
Б) АВС=АСВ 2) присоединение
В) АВС=АВ+С 3) отщепление
Г) АВ+С= АС+В 4) изомеризация
5) замещение
A
Б
В
Г
С1. К насыщенному раствору перманганата калия добавили раствор серной кислоты, а затем несколько гранул цинка. Через некоторое время раствор обесцветился. Объясните наблюдаемое явление.
Вариант 4
Часть 1
А1. Какое из приведенных уравнений включает в себя два процесса: обмен и разложение?
1) ВаСО3 + 2HCl =ВаС12 + Н2О + СО2↑
2) Ва(ОН)2 + H2SO4 = BaSO4↓ + 2Н2О
3) СаС12 + Na2CO3 = СаСО3↓ + 2NaCl
4) 3NaOH + FeCl3 = Fe(OH)3 ↓+ 3NaCl
А2.Взаимодействие натрия с водой относится к реакциям:
1) соединения 3) обмена
2) замещения 4) разложения
А3.Взаимодействие карбоновой кислоты и спирта относится к реакциям:
1) присоединения 3) гидролиза
2) этерификации 4) нейтрализации
А4. Неверно одно из следующих утверждений:
«Получение аммиака из азота и водорода является прцессом:
1) соединения 3) каталитическим
2) эндотермическим 4) обратимым
А5.Зкончите выражение, подобрав к термину антоним: «Гидрирование - дегидрирование, этерификация - гидролиз, полимеризация -..
1) поликонденсация 3) деполимеризация
2) вулканизация 4) сополимеризация
А6.Реакции горения - это:
1) реакции, протекающие с выделением теплоты;
2) реакции, протекающие с выделением теплоты и света;
3) реакции, протекающие с поглощением теплоты;
4) реакции, протекающие с образованием осадка.
А7.Какой из перечисленных ниже параметров всегда остается неизменным в химических реакциях:
1) масса 3) давление
2) объем 4) концентрация
А8.Укажите окислительно - восстановительную реакцию соединения:
1) CaO + SO2 = CaSO3
2) 2NaOH + CuSO4 → Cu(OH)2 + Na2SO4
3) CuSO4 + Fe → FeSO4 + Cu
4) 2Н2 + O2→ 2H2O
А9.Сумма коэффициентов в уравнении реакции обмена
NaOH + CuSO4 → Cu(OH)2 + Na2SO4 равна:
1) 2 3) 3
2) 4 4) 5
А10. Наибольшим образованием копоти сопроводается горение:
1) гексана 3) гексена
2) циклогексана 4) бензола
Часть 2
В1. Соотнесите тип реакции и название реакции:
ТИП НАЗВАНИЕ РЕАКЦИИ РЕАКЦИИ
А) замещение 1) поликонденсация Б) отщепление 2) пиролиз
В) присоединение 3) дегидратация
Г) разложение 4) гидрохлорирование
5) нитрование
A
Б
В
Г
В2. Выберите соединения, которые будут вступать в реакцию замещения с натрием:
1) этанол 5) 2-бромбутан
2) бензол 6) пропилен
3) фенол 7) НСlконц
4) пропин 8) этилен
Часть 3
С1. Напишите уравнения реакций получения тетрагидроксоалюмината натрия из простых веществ (можно использовать продукты их взаимодействия).
Укажите условия протекания реакций.
ОТВЕТЫ И РЕШЕНИЯ по теме
«КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ»
№
задание
вариант
I
II
III
IV
А1
2
1
4
1
А2
3
4
1
2
А3
3
3
2
2
А4
3
4
4
2
А5
2
4
4
3
А6
2
2
2
2
А7
1
1
4
1
А8
3
4
3
4
А9
1
4
3
4
А10
4
4
2
4
В1
1322
3124
3421
5342
В2
БАГД
34
2435
1347
С1 ( вариант 1)
CaO→CaSO3→CaCl2→Ca→Ca(OH)2→CaCO3→Ca(HCO3)2
1) CaO + SO2 = CaSO3
2) CaSO3 + 2HCl = CaCl2 + H2O + SO2↑ (нагревание)
3) CaCl2(расплав) = Ca + Cl2↑ (электрический ток)
4) Сa +2H2O = Ca(OH)2 + H2 ↑
5) Ca(OH)2 + CO2 =CaCO3 ↓ + H2O
6) CaCO3 + CO2(избыток) + H2O = Ca(HCO3)2
С1 ( вариант 2)
Реакция «серебряного зеркала» характерна для веществ, содержащих альдегидную группу. Описанный способ получения угарного газа используется в лаборатории для его получения из муравьной кислоты. НСООН - вещество с двойственными свойствами, так как содержит и альдегидную, и карбоксильную группы.
t
НСООН + 2[Аg(NH3)2]OH = CO2+ 2H2O + 2Ag + 4NH3↑
t
НСООН = CO + H2O ( В присутствии концентрированной серной кислоты)
С3 ( вариант 3)
Цинк реагирует с раствором серной кислоты:
H2SO4 + Zn = ZnSO4 + H2↑
Водород является восстановителем, поэтому происходит следующая реакция:
2KMnO4 + 5H2 + H2SO4 = 2MnSO4 + 8H2O + K2SO4
Первоначально раствору придавали окраску ионы MnO4 -, но так как в результате марганец восстанавливается до неокрашенных ионов Мn2+, то и раствор обесцвечивается.
С1 ( вариант 4)
-
2Al = 3Cl2 = 2AlCl3
-
2H2 + O2 = 2H2O
-
2Na + 2H2O = 2NaOH + H2 ↑
-
AlCl3 + 3 NaOH = NaOH ↓+ 3NaCl
-
NaOH + NaOHизбыток = Na[Al(OH)4]
Или вместо 1,4 и 5:
-
2Al + 2NaOH + 6 H2O = 2 Na[Al(OH)4] + 3H2 ↑
Тема «Термохимия и химическая кинетика»
Вариант 1
Часть 1
А1. Верны ли следующие суждения о горении фосфора в атмосфере кислорода?
А. Это экзотермическая реакция.
Б. Это реакция замещения.
-
Верно только А;
-
Верно только Б;
-
Верны оба утверждения;
-
Оба утверждения неверны.
А2. Быстрее всех при комнатной температуре будет протекать реакция между 10%-ным раствором соляной кислоты и цинком
-
В гранулах;
-
Большим куском;
-
Покрытым медью;
-
В порошке.
А3. К эндотермическим реакциям относится
-
Образование воды из простых веществ;
-
Образование иодоводорода из простых веществ;
-
Образование аммиака из простых веществ;
-
Восстановление оксида железа (III) алюминием/
А4. На смещение равновесия 2NH3 = 3H2 + N2 +Q в сторону продуктов реакции влияет одновременное
-
Повышение температуры и повышение давления;
-
Понижение температуры и повышение давления;
-
Повышение температуры и понижение давления;
-
Понижение температуры и понижение давления/
А5. Увеличить скорость реакции 4FеS2 + 11О2 = 2Fе2О3 + 8SO2 + Q можно
-
Измельчив пирит;
-
Используя воздух, обогащённый азотом;
-
Поглощая сернистый газ водой;
-
Снижая температуру.
А6. При понижении температуры на 100С скорость реакции
-
Увеличивается в 2-4 раза;
-
Увеличивается в 3-6 раз;
-
Уменьшается в 2-4 раза;
-
Не изменяется.
А7. Вещества, которые повышают скорость химической реакции, оставаясь к концу её неизменными, называются
-
Активаторами;
-
Катализаторами;
-
Ингибиторами;
-
Ферментами.
А8. Французский химик А.Ле Шателье сформулировал
-
Условие необратимости химической реакции;
-
Общий закон смещения химического равновесия;
-
Закон действующих масс;
-
Определение ферментов.
А9. При увеличении температуры на 300С скорость реакции возрастает в 8 раз. Температурный коэффициент реакции равен
-
8;
-
2;
-
3;
-
4.
А10. Как называют уравнения, в которых указано количество теплоты?
-
Термодинамическим;
-
Термическим;
-
Химотермическим;
-
Термохимическим.
Часть 2
В1. При полном сгорании 0,1 моль кокса в кислороде выделилось 40,2 кДж теплоты. Теплота образования углекислого газа из простых веществ
______________кДж\моль.
В банк ответов запишите целое число без единиц измерения.
В2. Назовите пять факторов смещения химического равновесия вправо для реакции синтеза аммиака в промышленности.
Часть 3
С1. При горении магния в углекислом газе на каждый моль образовавшейся сажи (С) выделяется 810 кДж энергии. Сколько граммов магния требуется для того, чтобы выделилось 101 кДж теплоты?
Вариант 2
Часть 1
А1. При комнатной температуре с наименьшей скоростью протекает реакция:
-
Zn c 10%- ным раствором HCl;
-
Zn c 5%- ным раствором HCl;
-
Zn c 2%- ным раствором HCl;
-
Zn c 0,1%- ным раствором HCl.
А2. Химической реакции в растворе отвечает уравнение А + В = АВ. Как изменится скорость этой реакции, если концентрацию вещества А увеличить в 3 раза, оставив концентрацию В прежней?
-
увеличится в 3 раза;
-
увеличится на 1/3;
-
не изменится;
-
уменьшится в 3 раза.
А3.Каким образом можно сместить равновесие реакции
2SO2 + O2 ↔ 2SO3 + Q в сторону исходных веществ?
-
понизить давление;
-
повысить давление;
-
понизить температуру;
-
использовать катализатор.
А4. Какой из факторов не оказывает влияния на скорость химической реакции в растворах?
-
концентрация вещества;
-
использование катализатора;
-
использование ингибитора;
-
объем реакционного сосуда.
А5.Скорость химической реакции между металлом и серой не зависит:
-
от температуры;
-
от площади поверхности соприкосновения веществ;
-
от давления;
-
от природы металла.
А6. Взаимодействие, какой пары веществ будет протекать с большей скоростью, если известно, что концентрация растворов кислот во всех случаях одинакова?
-
Pb и HCl;
-
Fe и HCl;
-
Zn и HCl;
-
Mg и HCl.
А7. Увеличение давления сместит равновесие в сторону исходных веществ в реакции:
-
2NO↔ N2O4;
-
CH4 + H2O ↔ 3 H2 + CO;
-
C + 2H2 ↔ CH4;
-
N2 + O2 ↔2NO.
А8. К эндотермическим реакциям относится :
-
разложение известняка;
-
разложение гидрида титана;
-
окисление глюкозы;
-
нейтрализация кислоты щелочью
А9. Во сколько раз увеличивается скорость химической реакции при повышении температуры на 200С, если температурный коэффициент равен 3?
-
в 3 раза;
-
в 6 раз;
-
в 9 раз;
-
в 90 раз.
А10. Скорость гетерогенной реакции, в отличие от скорости гомогенной реакции, зависит от:
-
молярных концентраций исходных и образовавшихся веществ;
-
молярных концентраций исходных и образовавшихся веществ и времени протекания реакции;
-
площади поверхности соприкосновения реагирующих веществ;
-
степени перемешивания.
Часть 2
В1. В равновесной системе 3А + В ↔ 2С + Д концентрация вещества С = 1 моль\л, концентрация вещества А = 1,5 моль\л. Укажите исходную концентрацию вещества А.
В2. При 200С реакция протекает за 2 минуты. Сколько времени будет протекать эта же реакция при 00С? температурный коэффициент равен 2.
Часть 3
С1. Реакция синтеза йодоводорода обратима. Какие условия влияют на положение химического равновесия в этой системе? Какие условия не оказывают влияния? Дайте обоснованный ответ.
Вариант 3
Часть 1
А1. Протекает экзотермическая реакция обмена, если взаимодействуют:
-
KOH и H2SO4;
-
CH4 и Cl2;
-
Mg и HCl;
-
CaO и CO2.
А2. Максимальная скорость горения сероводорода в кислороде будет при :
-
уменьшении температуры и увеличении давления;
-
одновременным увеличении температуры и давления;
-
увеличении температуры и уменьшении давления;
-
одновременным уменьшении температуры и давления.
А3. При комнатной температуре медленнее всего протекает реакция между:
-
Cu и O2;
-
Na2CO3 (твердый) и HCl (раствор);
-
NaOH (раствор) и HCl (раствор);
-
Na и O2.
А4. Скорость горения водорода в кислороде можно уменьшить, если одновременно:
-
внести катализатор и повысить давление;
-
повысить температуру и понизить давление;
-
увеличить давление и температуру;
-
разбавит кислород азотом и понизить давление.
А5. Увеличение давления не повлияет на смещение равновесия в реакции:
-
2NO↔ N2O4;
-
CH4 + H2O ↔ 3 H2 + CO;
-
C + 2H2 ↔ CH4;
-
N2 + O2 ↔2NO.
А6. На смещение равновесия CO2 + C ↔ 2 CO + Q в сторону продуктов реакции влияет одновременное:
-
повышение температуры и повышение давления;
-
понижение температуры и повышение давления;
-
повышение температуры и понижение давления;
-
понижение температуры и понижение давления.
А7. Как изменится молярный объем газов при увеличении температуры от 00С до 200С при постоянном давлении?
-
увеличится в 2 раза;
-
увеличится в 1,07 раз;
-
увеличится в 3 раза.
-
останется равным 22,4 л\моль.
А8. В результате реакции, которая описывается уравнением
MgCO3(ТВ) = MgO(ТВ) + CO2(г) - 102кДж, поглотилось 5,1 кДж теплоты. Объем выделившегося CO2(н.у.) равен:
-
0,112л;
-
1,12л;
-
2,24л;
-
22,4л.
А9. Для увеличения скорости реакции в 81 раз (температурный коэффициент реакции равен 3) температуру газообразной смеси следует повысить на :
-
200С;
-
300С;
-
400С;
-
500С.
А10. Скорость простой реакции вида mA + nB = pC + qD определяют по формуле:
V = k* cAm * cBn,
где k - это:
-
коэффициент, равный сумме молей реагирующих веществ;
-
константа для данного типа химических реакций;
-
константа, равная скорости реакции при концентрации реагирующих веществ 1 моль\л;
-
константа, равная концентрации лимитирующего вещества.
Часть 2
В1. Теплота сгорания этана 1600 кДж\моль. Объем метана (н.у.), необходимый для получения 320 кДж теплоты ________ л. В бланк ответов перепишите ответ под номером соответствующего задания.
В2. Скорость некоторой реакции при 100С составляет 2 моль/лс. Рассчитайте скорость этой реакции (моль/лс) при 500С, если температурный коэффициент равен 3.
Часть 3
С1. При горении магния в углекислом газе на каждый моль образовавшейся сажи (С) выделяется 810 кДж энергии. Сколько граммов магния требуется для того, чтобы выделилось 101 кДж теплоты? Ответ запишите на отдельном листе или на обратной стороне бланка.
Вариант 4
Часть 1
А1. Реакции, которые протекают в однородной среде без образования поверхности раздела реагирующих веществ, называют
-
Гетерогенными
-
Гомогенными
-
Каталитическими
-
Обратимыми
А2. Как можно эффективно увеличит скорость образования водорода при реакции металлического цинка с соляной кислотой?
-
Увеличив молярные концентрации цинка и кислоты
-
Увеличив объём цинка
-
Измельчив цинк
-
Изменить скорость реакции нельзя
А3. Укажите реакцию, которая является необратимой
-
N2 +О2 = 2NО + Q
-
2SO2 + О2 =2SO3 + Q
-
СО2 + Н2О = Н2СО3
-
НСl +AqNO3=AqCl + НNO3
А4. Скорость реакции измеряется в
-
моль
-
моль\л
-
г\л
-
моль\л*с
А5. Что произойдёт, если убрать часть йода из реакционной смеси
Н2 +I2 = 2НI +Q
-
Понизится температура
-
Равновесие сместится вправо
-
Равновесие сместится влево
-
Повысится температура
А6. Какое значение имеет изменение энтальпии для экзотермической реакции?
-
Положительное
-
Отрицательное
-
Не имеет знака
-
Правильного ответа нет
А7. «При повышении температуры на каждые 100С скорость реакции увеличивается в 2 -4 раза». Это формулировка
-
Правила Гульдберга и Вага
-
Правила Вант - Гоффа
-
Правила Ле Шателье
-
Правила Клайперона
А8. Что нужно изменить, чтобы сместить равновесие реакции вправо?
N2 +3H2=2NH3 +Q
-
Понизить температуру
-
Повысить температуру и давление
-
Повысить температуру и давление
-
Понизить температуру и повысить давление
А9. Химическое равновесие наступит быстрее, если
-
Изменить температуру
-
Внести катализатор
-
Изменить давление
-
Изменить концентрации конечных продуктов прямой реакции
А10. Смесь веществ, реагирующих при температуре 00С, нагрели до 200С. Как изменилась скорость данной реакции, если температурный коэффициент её равен 2?
-
Увеличилась в 4 раза
-
Увеличилась в 8 раз
-
Не изменилась
-
Увеличилась в 2 раза
Часть 2
В1. Исходные концентрации веществ, взаимодействие которых соответствует реакции 2А + В = А2В, равны по 4моль\л. Равновесная концентрация вещества А2В равна 0,5 моль\л. Укажите равновесную концентрацию вещества А.
В2. В результате реакции, термохимическое уравнение которой
2Аl + Fe2О3 = Аl2О3 + 2Fe +848 кДж, выделилось 169,6кДж теплоты.
Масса образовавшегося железа равна _________ г.
Укажите ответ с точностью до десятых.
Часть 3
С1.В системе А + В = С, ![]() Н0 < 0,
Н0 < 0,
где А, В и С - газы, установилось равновесие. Какое влияние на равновесное количество вещества С в единице объёма системы окажут:
-
Увеличение давления
-
Увеличение количества вещества А в системе
-
Повышение температуры
Ответы и решения по теме «Термохимия и химическая кинетика»
Ответы
Вариант 1
Вариант 2
Вариант 3
Вариант 4
А1
1
1
1
2
А2
4
1
2
3
А3
4
1
1
4
А4
2
3
4
4
А5
1
4
4
3
А6
3
1
4
2
А7
2
2
2
2
А8
2
1
2
4
А9
2
3
3
2
А10
4
3
3
2
В1
402
3
4,48
3
В2
-
Повышение концентрации азота
-
Повышение концентрации водорода
-
Понижение концентрации аммиака
-
Понижение температуры
-
Повышение давления
8 мин
162
22,4
Часть С
Вариант 1
2Мq + СО2 = С + МqО + 810 кДж
n (С) : n (М q) = 1:2
m (Мq) = 101*2*24:810 = 6г
Вариант 2
H2 + I2 ↔2HI + Q
На положение химического равновесия в этой системе повлияют следующие условия: изменение температуры, изменение концентрации H2, I2, HI.
На положение химического равновесия в этой системе не повлияет изменение давления.
Вариант 3
-
Составлено термохимическое уравнение реакции горения угля в оксиде азота (I):
C + 2N2O = CO2 + 2N2 + 558 кДж
2) Определено молярное соотношение оксидов по уравнению реакции:
n (CO2) : n (N2O) = 1: 2
3) Рассчитано количество вещества оксида азота (I), требующегося для образования 16,7 кДж теплоты:
N (N2O) = (16,7* 2) : 558 = 0,06 (моль).
Вариант 4
1. При протекании реакции общее количество газообразных веществ уменьшается (с 2 моль до 1 моль). В соответствии с правилом Ле Шателье повышение давления приведёт к смещению равновесия в сторону реакции, приводящей к уменьшению количества газов, то есть в сторону вещества С. Количество С увеличится.
2. При увеличении количества вещества А равновесие будет смещаться в сторону реакции, которая уменьшает количество А, то есть в сторону образования продукта С. Количество С увеличится.
3. Так как  Н0 < 0, то теплота выделяется в ходе прямой реакции, она является экзотермической. Обратная реакция будет эндотермической. Повышение температуры всегда благоприятствует протеканию реакции с поглощением теплоты, то есть равновесие сместится в сторону вещества А и В, и количество С уменьшится.
Н0 < 0, то теплота выделяется в ходе прямой реакции, она является экзотермической. Обратная реакция будет эндотермической. Повышение температуры всегда благоприятствует протеканию реакции с поглощением теплоты, то есть равновесие сместится в сторону вещества А и В, и количество С уменьшится.
Тема «Электролитическая диссоциация солей, кислот, щелочей.
Реакции ионного обмена. Гидролиз солей»
Вариант 1
Часть 1
А1. Процесс распада молекул электролита на ионы называется:
-
Диссоциация;
-
Гидролиз;
-
Электролиз;
-
Ассоциация.
А2. К электролитам относятся все вещества группы:
-
NaOH, H2, H2O;
-
C2H5OH, HCl, NaI;
-
C6H12O6, NaOH, HF;
-
KOH, Na2SO4, HBr.
А3. Сильным электролитом является:
-
CO2;
-
O2;
-
H2S;
-
H2SO4.
А4. В водном растворе ступенчато диссоциирует:
-
K2SO4;
-
K2S;
-
H2S;
-
Na2SO4.
А5. Если при диссоциации вещества в качестве катионов образуются только катионы H+, то это:
-
Щелочь;
-
Соль;
-
Кислота;
-
Кислая соль.
А6. Реакция ионного обмена протекает до конца при сливании растворов:
-
Нитрата натрия и сульфата калия;
-
Сульфата калия и соляной кислоты;
-
Хлорида кальция и нитрата серебра;
-
Хлорида калия и сульфата натрия.
А7. Не будет происходить видимых изменений, если в растворе одновременно окажутся ионы:
-
Na+, SO42- , OH-, Ba2+;
-
Na+, SO42- , OH-, K+;
-
Cu2+, SO42-, OH-, K+;
-
H+, Cl-, CO32-, K+.
А8. Сокращенное ионное уравнение
Fe2+ + 2OH- = Fe(OH)2
соответствует взаимодействию веществ:
-
Fe(NO3)3 и KOH;
-
FeSO4 и LiOH;
-
Na2S и Fe(NO3)2;
-
Ba(OH)2 иFeCl3.
А9. Кислая среда в водных растворах каждого вещества пары:
-
NaCl, Na2SO4;
-
AlCl3, Ba(NO3)2 ;
-
Na2CO3, Na2S ;
-
ZnCl2, (NH4)2SO4.
А10. Гидролизу по катиону подвергаются:
-
Na2CO3;
-
MgCl2;
-
K2SO4;
-
Na3PO4.
Часть 2
В1. Установите соответствие между химическими реакциями и сокращенными ионными уравнениями.
-
Ca(OH)2 + HCl→
-
NH4Cl + NaOH→
-
AlCl3 + KOH→
-
BaCl2 + Na2SO4→
А) NH4+ + OH-→ NH3 + H2O
Б) Al3+ + 3 OH-→ Al(OH)3
В) H+ + OH-→ H2O
Г) SO42- + Ba2+→ BaSO4
1
2
3
4
В2. Установите соответствие между формулой соли и молекулярно - ионным уравнением гидролиза этой соли.
Формула соли
-
CuSO4;
-
K2CO3;
-
CH3COONa;
-
(NH4)2SO4.
Молекулярно - ионное уравнение
А. CH3COO- + H2O ↔ CH3COOH + OH-
Б. NH4+ + H2O ↔ NH3.H2O + H+
В. Cu2+ + H2O ↔ Cu(OH)+ + H+
Г. CO32- + H2O ↔ HCO3- + OH-
Д. Cu2+ + 2H2O ↔Cu(OH)2 + 2H+
1
2
3
4
Часть 3
С1. Напишите уравнение гидролиза Na2CO3 по ступеням.
Вариант 2
Часть 1
А1. Мерой электролитической диссоциации является…
-
период полураспада;
-
константа гидролиза;
-
степень диссоциации;
-
молярная концентрация раствора.
А2. К электролитам относятся все вещества ряда:
-
H2O, KOH, O2;
-
Na2SO4 , CH3COOH, Fe(NO3)2,
-
H2S, HCl, CaCO3;
-
HCl, Ca(NO3)2, NaOH.
А3. К сильным электролитам относятся все вещества ряда:
-
HNO3, Cu(OH)2, KOH;
-
HCl, Ca(NO3)2, NaOH.
-
NaCl, CH3COOH, Fe(NO3)2,
-
H2S, H2SO4, CaCO3;
A4. Ступенчато будет диссоциировать:
-
гидроксид кальция;
-
хлорид железа (III);
-
сульфат алюминия;
-
карбонат натрия.
А5. Если при диссоциации вещества в качестве анионов образуется только кислотный остаток, то это:
-
щелочь;
-
соль;
-
кислота;
-
кислая соль.
А6. Реакции ионного обмена протекает до конца при взаимодействии:
-
H2SO4 и FeCl2;
-
Fe(OH)2 и Na2SO4;
-
растворов Fe SO4 и NaOH;
-
растворов BaCl2 и Na2SO4.
А7. Одновременно не могут находиться в растворе все ионы:
-
K+, H+, NO3-, SO42-;
-
Ba2+, Ag+, OH-, F-;
-
H3O-, Ca2+, Cl-, NO3-;
-
Mg2+, H3O-, Br-,Cl-.
А8. Сокращенное ионное уравнение Al3+ + 3 OH- → Al(OH)3↓
-
хлорида алюминия с водой;
-
оксида алюминия с водой;
-
хлорида алюминия со щелочью;
-
алюминия со щелочью.
А9. Лакмус краснеет в растворе соли:
-
Zn SO4;
-
NaCl;
-
NaNO3;
-
Na 2CO3.
А10. В водном растворе гидролизу по аниону подвергается соль:
-
Na2S;
-
FeCl2;
-
Al2(SO4)3;
-
Ba(NO3)2.
Часть 2
В1.Установите соответствие между исходными веществами, вступающими в реакции обмена, и сокращенными ионными уравнениями этих реакции
ИСХОДНЫЕ ВЕЩЕСТВА
-
H2SO4 и BaCl2;
-
Ba(OH)2 и K 2CO3;
3.Al(NO3)3 и KOH;
4. BaBr2 и Na2SO4
СОКРАЩЕННЫЕ ИОННЫЕ УРАВНЕНИЯ
А) Al3+ + 3 OH- = Al(OH)3;
Б) Ba2+ + SO42- = Ba SO4;
В) Na+ + Br- = NaBr;
Г) Ba2+ + СO32- = Ba СO3;
Д) K+ + NO3- = KNO3
1
2
3
4
В2. Общая сумма всех коэффициентов в полном и сокращенном ионном уравнениях реакции между нитратом серебра и гидроксидом натрия равна…
Часть 3
С1. Имеются растворы гидроксида натрия, хлорида железа(III), азотной кислоты, карбоната натрия. напишите 4 уравнения реакций, протекающих между ними.
Вариант 3
Часть 1
А1. Диссоциация лимонной кислоты является обратимой, так как эта кислота:
-
Слабый электролит;
-
Изменяет цвет индикатора;
-
Растворима в воде;
-
Сильный электролит.
А2. К электролитам относятся все вещества группы:
-
NaOH, H2, H2O;
-
C6H12O6, NaOH, HF;
-
KOH, Na2SO4, HBr.
-
C2H5OH, HCl, NaI;
А3. Слабым электролитом является:
-
Гидроксид кальция;
-
Азотная кислота;
-
Угольная кислота;
-
Нитрат калия.
А4. В водном растворе практически не диссоциирует…
-
CH3OH;
-
Fe(NO3)3 ;
-
CuSO4;
-
KOH.
А5. Если при диссоциации вещества в качестве катионов образуются катионы H+ и Меп+, то это:
-
Щелочь;
-
Соль;
-
Кислота;
-
Кислая соль.
А6. Практически до конца идет реакция:
-
Na2SO4 + KCl →
-
H2SO4 + BaCl2 →
-
KNO3 + NaOH →
-
CuCl2 + Na2SO4→
А7. Не будет происходить видимых изменений, если в растворе одновременно окажутся ионы:
-
Na+, NO3-, OH-, Ba2+;
-
Na+, Cl-, NO3-,Ag+;
-
Cu2+, SO42-, OH-, Na+;
-
H+, SO42- , HCO3-, K+.
А8. Сокращенному ионному уравнению
Fe3+ + 3OH- = Fe(OH)3↓
соответствует молекулярное уравнение:
-
Fe2(SO4)3 + 3Ba(OH)2 = 2 Fe(OH)3↓ + 3 BaSO4↓;
-
FeCl3 + 3 NaOH = Fe(OH)3↓ + 3 NaCl;
-
Fe2S3 + 6 H2O = 2 Fe(OH)3↓ + 3H2S;
-
Fe2O3 + 3 H2O = 2 Fe(OH)3↓.
А9. Водные растворы какой пары соединений имеют одинаковую реакцию ( кислотную, щелочную или нейтральную):
-
NaCl и HCl;
-
NH3и NH4Cl;
-
Na2CO3 и NaOH;
-
CuCl2и Cu(OH)2.
А10. Гидролизу не подвергается:
-
Этиловый эфир уксусной кислоты;
-
Уксусная кислота;
-
Крахмал;
-
Белок.
Часть 2
В1. Установите соответствие между реагирующими в водном растворе веществами и признаком реакции.
Реагирующие вещества
-
CaCO3 + HCl
-
CuSO4 + Ba(OH)2
-
Fe(NO3)2 + Na2S
-
BaS + H2SO4
Признак реакции
А) только газ
Б) только осадок
В) образование воды
Г) два осадка
Д) осадок и газ Е) образование комплексного соединения
1
2
3
4
В2.Установите соответствие между формулой соли и типом ее гидролиза.
Тип гидролиза
-
Соль гидролизуется частично с образованием кислотной среды
-
Соль гидролизуется частично с образованием щелочной среды
-
Соль полностью разлагается водой
-
Соль хорошо растворима, но не гидролизуется
Формула соли
А) CaCO3
Б) CaCl2
В) AlCl3
Г) Al2S3
Д) Na2CO3
Е) CuS
1
2
3
4
Часть 3
С1. В пробирку налили концентрированный раствор хлорида железа(III) и добавили концентрированный раствор карбоната натрия, при этом происходит выделение газа и образование осадка. Объясните наблюдаемые явления.
Вариант 4
Часть 1
А1. Гидроксид натрия в водном растворе может реагировать с:
-
HCl;
-
CaCO3;
-
Au;
-
KCl.
А2. Кислотность почвы можно увеличить введением раствора:
-
NH4NO3;
-
Na NO3;
-
NaCl;
-
Na2SO4.
А3. Слабыми электролитами являются все вещества группы:
-
CH3COOH, Ba(OH)2, K2S;
-
H2SO3, KOH, CH3COONa;
-
H2S, NH4OH, Fe(SCN)3;
-
HNO3, Mg(OH)2, NaHCO3.
А4. Ступенчато происходит диссоциация:
-
Al2(SO4)3, FeCl3;
-
H2SO4, Na2SO4;
-
Ba(OH)2, HClO;
-
NaHSO4, H3PO4.
А5. Протоны в наибольшем количестве образуются при диссоциации:
-
C6H5 - OH;
-
C6H5COOH;
-
H2SiO3;
-
NaHCO3.
А6. Реакции ионного обмена идут до конца в результате образования нерастворимого в воде вещества при взаимодействии:
-
NaOH и MgCl2;
-
NaCl и CuSO4;
-
KOH и HNO3;
-
CaCO3 и HCl(раствор).
А7. Одновременно могут находиться врастворе все ионы:
-
Na+, NO3-, OH-, Ba2+;
-
H+, Fe2+, Cl-, OH-;
-
Na+, Ba2+, CO32-, Cl-;
-
H3O+, NH4+, HSO4-, SiO32-.
А8. Сокращенному ионному уравнению S2- + 2H+ = H2S↑ соответствует молекулярное уравнение:
-
Na2S + Ba(OH)2 = 2 NaOH + BaS;
-
Na2S + 2 HCl = H2S↑ + 2NaCl;
-
Fe2S3 + 6 H2O = 2 Fe(OH)3↓ + 3H2S↑;
-
FeS + 2РСд = H2S↑ +FeCl2.
А9. Водные растворы какой пары солей имеют одинаковую реакцию (кислотную, щелочную или нейтральную)?
-
KNO3, NaCl;
-
Na 2CO3, FeCl3;
-
Na2SO4, Cu(NO3)2;
-
BaBr2, AlBr3.
А10. При щелочном гидролизе жиров под действием NaOH образуются…
-
Глицерат натрия и карбоновые кислоты;
-
Глицерин и карбоновые кислоты;
-
Глицерин и натриевые соли карбоновых кислот;
-
Растительные масла.
Часть 2
В1. Установите соответствие между реагирующими в водном растворе веществами и признаком реакции.
Признак реакции
-
Только осадок
-
Только газ
-
Осадок и газ
-
Слабый электролит
Реагирующие вещества
А) AlCl3 + Na 2CO3
Б) Cu(OH)2 + H2SO4
В) FeS + HCl
Г) Na 2CO3 + KNO3
Д) Ca(NO3)2 + NaF
Е) K2SO4 + HCl
1
2
3
4
В2. Установите соответствие между типом реакции ионного обмена и сокращенным ионным уравнением.
Тип реакции
-
Сильная кислота + сильное основание = соль + вода
-
Сильная кислота + слабое основание = соль + вода
-
Соль + сильное основание = соль + слабое основание
-
Соль + сильная кислота = соль + слабая кислота
Сокращенное ионное уравнение
А) S2- + 2H+ = H2S
Б) H+ + OH- = H2O
В) Ag+ + Cl- = AgCl↓
Г) Fe3+ + 3 OH- = Fe(OH)3↓
Д) 2H+ + Cu(OH)2 = Cu2+ + 2 H2O
Е) Ba2+ + SO42- = BaSO4
Часть 3
С1. В пробирку налили концентрированный раствор хлорида алюминия и добавили порошок магния, при этом происходит выделение газа.
Объясните наблюдаемое явление.
Ответы по теме «Электролитическая диссоциация
солей, кислот, щелочей.
Реакции ионного обмена. Гидролиз солей»
Варианты
I
II
III
IV
А1
1
3
1
2
А2
4
4
3
1
А3
4
2
1
3
А4
3
1
1
4
А5
3
2
4
2
А6
3
4
2
1
А7
2
2
1
1
А8
2
3
2
2
А9
4
1
3
1
А10
2
1
2
3
В1
ВАБГ
БГАБ
АГБД
ДВАБ
D2
ВГАБ
20
ВДГБ
БДГА
Часть 3
Вариант 1
Первая ступень:
1)CO32- + H2O ↔ HCO3- + OH-
или
2)Na2CO3 + H2O ↔ NaНCO3 + NaOH
Вторая ступень:
3)HCO3- + H2O ↔ Н2CO3 + OH-
или
4)NaНCO3 + H2O ↔ Н2CO3 + NaOН
Вариант 2
-
Na 2CO3 + 2HNO3 = 2 NaNO3 + CO2↑ + H2O
-
2 FeCl3 + 3 Na 2CO3 + 3H2O = 2 Fe(OH)3↓ + 3CO2↑ + 6 NaCl
-
NaOH + HNO3 = NaNO3 + H2O
-
FeCl3 + 3 NaOH = Fe(OH)3↓+ 3 NaCl
Вариант 3
И FeCl3 , и Na2CO3 подвергаются гидролизу, но FeCl3 гидролизуется по катиону, а Na2CO3 - по аниону. Поэтому гидролиз одной соли усиливает гидролиз другой. Следовательно, процесс гидролиза каждой из них доходит до конца.
2FeCl3 + 3 Na2CO3 + 3 H2O → = 2 Fe(OH)3↓ + 3 CO2↑ + 6 NaCl
Вариант 4
AlCl3 подвергается гидролизу по катиону: Al3+ + HOH = AlOH2+ + H+;
AlCl3 + HOH = AlOHCl2 + HCl.
В результате образуется кислота, она реагирует с магнием, и наблюдается выделение водорода.
Mg + 2HCL = MgCl2 + H2↑.
Тема «Окислительно-восстановительные реакции. Электролиз»
Вариант 1
Часть 1
А1. Какой процесс называется окислительно-восстановительным:
а) процесс отдачи электронов атомами или ионами;
б) процесс приёма электронов атомами;
в) процесс перехода или смещения электронов от атомов с меньшей электроотрицательностью к атомам с большей электроотрицательностью;
г) процесс понижения степени окисления атомов элементов при химических реакциях
А2. В каком из уравнений допущены ошибки при определении степеней окисления: а) 2Na0O-2H+ + Cl20 = Na+Cl+O-2 + Na+Cl- + H2+2O-2
б) 2Fe0 + 3Cl20 = 2Fe+3Cl3-
в) Ca+2(O-2H+)2 + 2H+Br- = Ca+2Br2- + 2H2+O-2
г) Na+Cl- + Ag+N+5O3-2 = Ag+Cl- + Na+N+5O3-2
А3. Какой из приведённых ниже процессов является окислительно-восстановительным: а) 2е,8е,8е,1е _______ 2е, 8е, 8е
2е,8е,6е _________ 2е,8е,7е
б) CaO + CO2 ______ CaCO3
в) CuCl2 + 2KOH _____ 2KCl + Cu(OH)2
г) Ba(OH)2 + SO3 _______ BaSO4 + H2O
А4. Какому из уравнений окислительно-восстановительных реакций соответствует приведённый ниже электронный баланс
Cl20 + 2e _____ 2Cl- (восстановление, окислитель)
2Br-__ 2e _____Br20 (окисление, восстановитель):
а) Zn + 2HCl = ZnCl2 + H2
б)2Na + Br2 = 2NaBr
в) Cl2 + 2KBr = Br2 + 2KCl
г)Cu + Cl2 = CuCl2
А5. В какой роли выступает в данной химической реакции водород
Fe2O3 + 3H2 = 2Fe + 3H2O: а) окислителя;
б) восстановителя;
в) электроотрицательного элемента;
г) катализатора?
А6. При составлении химической формулы какого соединения допущена ошибка:
а) Na2+S-2;
б) Mn+7O2-2;
в) C+4O2-2;
г) H+F-
А7. Восстановителем в окислительно-восстановительных реакциях называется атом или ион, который:
а) принимает электроны;
б) отдаёт электроны;
в) изменяет степень окисления;
г) не изменяет степень окисления?
А8. Какой из процессов считается окислительно-восстановительным:
а) гидратация этилена;
б) ржавление железа во влажном воздухе;
в) разогревание раствора при смешении концентрированной серной кислоты с водой;
г) выделение газа при прокаливании питьевой соды
А9. В результате электролиза на инертных электродах образовались водород и кислород. Электролизу подвергался: а) расплав гидроксида натрия;
б) раствор хлорида меди (II);
в) расплав нитрата серебра;
г) раствор гидроксида натрия
А10. Во время превращения H2O2_____ H2O степень окисления одного из элементов изменяется (от _____ до):
а) __1 _____ __2;
б) +1 _____ +2;
в) +2 _____ +3;
г) __ 1 _____ +1
Часть 2
В1. Установите соответствие между реагентами и степенью окисления атома-окислителя:
Реагенты Степень окисления
А) H2O2 + H2S = 1) -2
Б) СuBr2 + Cl2 = 2) -1
В) KClO3 + HCl = 3) 0
Г) HIO3 + H2S = 4) +3
5) +5
6) +7
А
Б
В
Г
В2. Установите соответствие между формулой и процессом, протекающим на аноде, при электролизе расплава соли:
Формула Анодный процесс
А) NaCl 1) 2NO3- __ 2e = O2 + 2NO2
Б) CuSO4 2) 2Cl- __ 2e = Cl2
В) AlCl3 3) 2SO42- __ 4e = O2 + 2SO3
Г) NaNO3
А
Б
В
Г
Часть 3
С1. Составьте уравнение реакции электролиза водного раствора гидроксида кальция. Вычислите объемы каждого из газов, образовавшихся в реакции (н.у.), если масса воды в растворе составляет 108г
Вариант 2
Часть 1
А1. В окислительно-восстановительной реакции
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O азот изменяет степень окисления -(от___до):
а) +5____+4;
б) +5_____+2;
в) +4_____-4;
г) +3_____+4;
А2. Какая из перечисленных ниже реакций не является окислительно-восстановительной: а) Al + V2O5 = Al2O3 + V;
б) SO3 + MgO = MgSO4;
в) N2 + Mg = Mg3N2;
г) H2 + S = H2S;
А3. Укажите, какой элемент окисляется и какой восстанавливается в следующей химической реакции N-3H3+ + O20 = N20 + H2+O-2 :
а) окисляется азот, восстанавливается водород;
б) окисляется кислород, восстанавливается водород;
в) окисляется азот, восстанавливается кислород;
г) окисляется водород, восстанавливается азот
А4. Какую высшую степень окисления способен проявлять в соединениях селен:
а) +7;
б) +8;
в) +6;
г) -4?
А5. При составлении химической формулы какого соединения допущена ошибка: а) Fe+3I3- б)H2+S+4O3-2 в)Si+4H4- г)Ba+2H4-
А6. В какой роли выступает углерод в реакции
MgO + CO = Mg + CO2
а) окислителя;
б) восстановителя;
в) наиболее электроотрицательного элемента;
г) наименее электроотрицательного элемента?
А7. Какая из перечисленных ниже реакций является окислительно-восстановительной:
а) почернение серебряных предметов;2
б) образование озона в воздухе при грозе;
в) выделение газа при прокаливании мрамора;
г) растворение кусочка мела в соляной кислоте
А8. Коэффициент перед формулой окислителя в уравнении реакции между алюминием и бромом равен:
а) 1;
б) 2;
в) 3;
г) 4
А9. В уравнении полуреакции восстановления N2_____ NH3
число принятых электронов равно:
а) 2;
б) 5;
в) 8;
г) 6
А10. В уравнении полуреакции окисления NaCl ______ Cl2
число отданных электронов равно:
а) 3;
б) 4;
в) 2;
г) 8
Часть 2
В1. Установите соответствие между формулой вещества и схемой процесса, в котором он участвует в роли окислителя:
Формула вещества Схема процесса
А) O2 1) S + KClO3 = SO2 + KCl
Б) P2O5 2) C + H2 = CH4
B) C 3) P2O5 + C = P + CO
Г) S 4) H2O + P2O5 = H3PO4
5) Na + S = Na2S
6) C + O2 = CO2
А
Б
В
Г
В2. Установите соответствие между формулой вещества и продуктами электролиза его водного раствора:
Формула вещества Продукты электролиза
А) NaCl 1) Na, Cl2
Б) СuSO4 2) H2, O2
B) Al(NO3)3 3) Cu, O2, H2SO4
Г) HgCl2 4) Cu, H2, O2
5) H2, Cl2, NaOH
6) Hg, Cl2
А
Б
В
Г
Часть 3
С1. Составьте уравнение реакции электролиза расплава AgNO3
Вычислите объем кислорода (н.у.), который образуется в результате электролиза 3,4г нитрата серебра.
Вариант 3
Часть 1
А1. Какой из процессов не является окислительно-восстановительным:
а) выделение газа при прокаливании гидрокарбоната калия; б) горение серы на воздухе; в) растворение магния в соляной кислоте; г) восстановление магния из оксида раскалённым углём
А2. Во время превращения SO32- ______SO42-
степень окисления одного из элементов повышается (от _____ до):
а) +3 _____ +5;
б) +4 ______ +6;
в) +3 ______ +6;
г) +6 _____ +7
А3. В уравнении полуреакции восстановления MnO4 - _____ Mn+2
число принятых электронов равно: а) 1; б) 2; в) 3; г) 5
А4. В уравнении реакции P + KClO3 = KCl + P2O5
сумма всех коэффициентов равна:
а) 17;
б) 18;
в) 19;
г) 20
А5. Степень окисления азота в соединении (NH4)2CO3 равна:
а) - 3;
б) + 1;
в) - 2;
г) + 5
А6. К окислительно-восстановительным относится реакция:
а) гидролиза крахмала;
б) полимеризации метилметакрилата;
в) гидрирования ацетилена;
г) нейтрализации уксусной кислоты гидроксидом кальция
А7. В уравнении реакции горения аммиака на воздухе коэффициент перед формулой восстановителя равен:
а) 1;
б) 2;
в) 3;
г) 4
А8. Укажите соединение, в котором сера проявляет низшую степень окисления:
а) FeS;
б) SO2;
в) K2SO4;
г) SCl2
А9. Продуктами электролиза расплава гидроксида калия являются:
а) К, Н2;
б) К, Н2О, О2;
в) К, О2;
г) Н2, О2
А10. В уравнении полуреакции окисления Ca(NO2)2_______ Ca(NO3)2 число отданных электронов равно:
а) 2;
б) 3;
в) 4;
г) 6
Часть 2
В1. Установите соответствие между схемой окислительно-восстановительной реакции и веществом, которое является в нем восстановителем:
Схема Восстановитель
А) PH3 + O2 = H3PO4 1) O2
Б) HNO3 + H2S = NO2 + SO2 + H2O 2) KOH
В) KOH + Cl2 = KCl + KClO3 + H2O 3) H2S
Г) Fe + Cl2 = FeCl3 4) PH3
5) Fe
6) Cl2
А
Б
В
Г
В2. Установите соответствие между формулой и процессом, протекающим на аноде, при электролизе водного раствора соли:
Формула Анодный процесс
А) NaCl 1) 2NO3-__ 2e = O2 + 2NO2-
Б) CuSO4 2) 2Cl- __ 2e = Cl2
В) Al(NO3)3 3) 2H2O + 2e = H2 + 2OH-
Г) HgCl2 4) 2H2O - 4e = O2 + 4H+
5) 2SO42- __ 4e = O2 + 2SO3
А
Б
В
Г
Часть 3
С1. Составьте уравнение окислительно-восстановительной реакции методом электронного баланса, укажите окислитель и восстановитель:
S + HNO3(конц) = SO2 + …
Вариант 4
Часть 1
А1. Какой из процессов не является окислительно-восстановительным:
а) образование зелёного налёта на медных предметах;
б) выделение кислорода при нагревании перманганата калия;
в) обжиг известняка;
г) коррозия цинковой пластинки под воздействием атмосферной влаги
А2. В кратком ионном уравнении реакции
Cu + H+ + SO42- = Cu+2 + SO2 + H2O
сумма всех коэффициентов равна:
а) 7;
б) 10;
в) 11;
г) 12
А3. В уравнении полуреакции окисления P ______PO43-
число отданных электронов равно:
а) 3;
б) 4;
в) 5;
г) 6
А4. В уравнении реакции внутримолекулярного окисления-восстановления
Pb(NO3)2 _______PbO + NO2 + O2
сумма всех коэффициентов равна:
а) 7;
б) 10;
в) 9;
г) 13;
А5. Продуктами электролиза расплава соли сульфата калия являются:
а) калий и сера;
б) калий, оксид серы (VI), кислород;
в) калий, оксид серы (IV), кислород;
г) водород и кислород
А6. Во время превращения KClO3______KCl степень окисления одного из элементов понижается (от ______ до):
а) +5 _____ - 1;
б) +7 _____ +2;
в) +4 _____ +2;
г) +3 _____ - 2
А7. Элемент кремний расположен в третьем периоде и четвертой группе главной подгруппе ПС. Какую наивысшую положительную степень окисления он может проявлять в соединениях:
а) +2;
б) +6;
в) +4;
г) +3
А8. Окислителем в окислительно-восстановительных реакциях называется атом или ион, который: а) принимает электроны;
б) отдает электроны;
в) изменяет степень окисления;
г) не изменяет степень окисления
А9. При составлении химической формулы какого соединения допущена ошибка:
а) H+N+3O2-2;
б) H2+S-2;
в) Cu+2F2-;
г) Cr+2O3-2
А10. В уравнении полуреакции восстановления Fe2O3 _____ Fe
число принятых электронов равно:
а) 6;
б) 5;
в) 4;
г) 1
Часть 2
В1. Установите соответствие между химической формулой вещества и степенью окисления, которую проявляет бром в данном веществе:
Химическая формула Степень окисления
А) Br2 1) +2
Б) HBrO3 2) +5
В) IBr 3) +3
Г) HBrO 4) 0
5) - 1
6) +1
А
Б
В
Г
В2. Установите соответствие между формулой вещества и продуктами его электролиза:
Формула вещества Продукты электролиза
А) NaCl (расплав) 1) Hg, O2, HNO3
Б) FeSO4 (раствор) 2) H2, Cl2, NaOH
В) KI (раствор) 3) Fe, O2, H2SO4
Г) Hg(NO3)2 (раствор) 4) Fe, O2, SO3
5) KOH, I2, H2
6) Na, Cl2
А
Б
В
Г
Часть 3
С1. Составьте уравнение окислительно-восстановительной реакции методом электронного баланса, укажите окислитель и восстановитель:
Mg + HNO3(разб) = NH4NO3 + …
Ответы на задания
Вариант 1
Задание
Ответ
А1
В
А2
А
А3
А
А4
В
А5
Б
А6
Б
А7
Б
А8
Б
А9
Г
А10
А
В1
А-2 Б-3 В-5 Г-5
В2
А-2 Б-3 В-2 Г-1
С1. Ca(OH)2 = Ca2+ + 2OH-
H2O = H+ + OH-
Катод Анод
2H+ + 2e = H2 4OH-__ 4e = 2H2O + O2
108г хл ул
2H2O = 2H2 + O2V(H2) =__ 108г 44,8л__ = 134,4л
36г 44,8л 22,4л 36г
V(O2) = __ 108г 22,4л __ = 67,2л
36г
Вариант 2
Задание
Ответ
А1
А
А2
Б
А3
В
А4
В
А5
Г
А6
Б
А7
А
А8
В
А9
Г
А10
В
В1
А-6 Б-3 В-2 Г-5
В2
А-5 Б-3 В-2 Г-6
С1. AgNO3 = Ag++ NO3-
Катод Анод
Ag+ + e = Ag 2NO3-__ 2e = 2NO2 + O2
3,4г хл
2AgNO3 = 2Ag + 2NO2 + O2 V(O2) = 0,224л
340г 22,4л
Вариант 3
Задание
Ответ
А1
А
А2
Б
А3
Г
А4
В
А5
А
А6
В
А7
Г
А8
А
А9
Б
А10
В
В1
А-4 Б-3 В-6 Г-5
В2
А-2 Б-4 В-4 Г-2
С1. S + 4HNO3 = SO2 + 4NO2 + 2H2O
S - 4e = S+4 1 (окисление, восстановитель)
N+5 +e = N+4 4 (восстановление, окислитель)
Вариант 4
Задание
Ответ
А1
В
А2
Б
А3
В
А4
В
А5
Б
А6
А
А7
В
А8
А
А9
Г
А10
А
В1
А-4 Б-2 В-5 Г-6
В2
А-6 Б-3 В-5 Г-1
С1. 4Mg + 10HNO3 = NH4NO3 + 4Mg(NO3)2 + 3H2O
Mg - 2e = Mg+2 4 (окисление, восстановитель)
N+5 + 8e = N-3 1 (восстановление, окислитель)
Тема «Реакции, подтверждающие генетическую связь между классами неорганических и органических соединений»
Вариант 1
Часть 1
А1. Гидроксиду меди (II) соответствует оксид, формула которого:
-
СО
-
СО2
-
Сu2O
-
CuO
А2. Веществами, обозначенными X и Y,
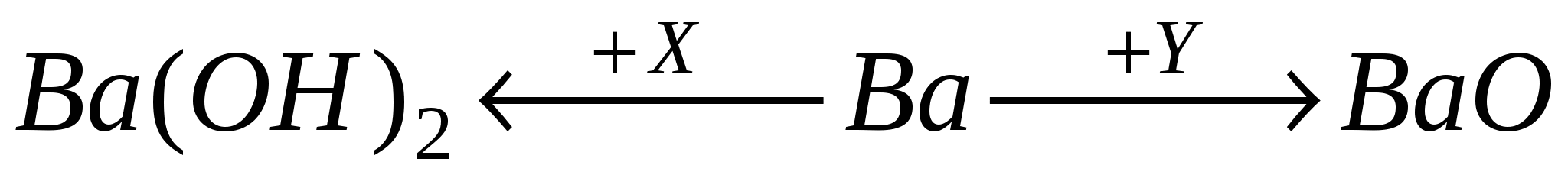
являются:
-
X - H2O, Y - O
-
X - H2O2, Y - O2
-
X - H2O, Y - O2
-
X - H2, Y - O2
А3. Формула, какого вещества в цепочке превращений обозначена X?
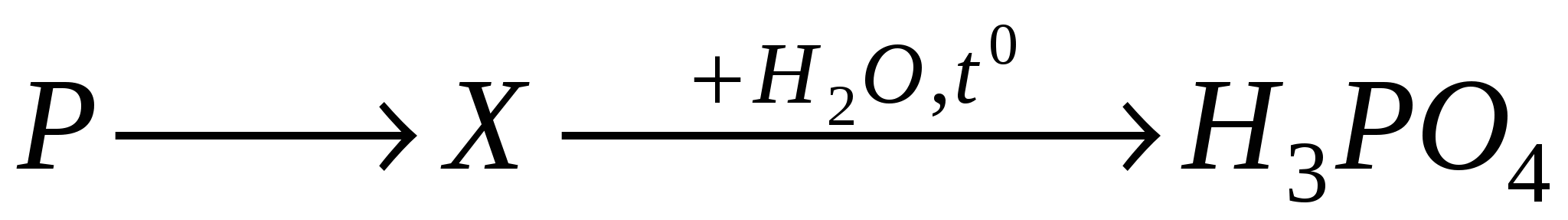
-
PO
-
P2O5
-
P2O3
-
P4O6
А4. Хлорид цинка реагирует с каждым из двух веществ:
-
СаО и Н2SO4
-
SO3 и KNO3
-
Mg и AgNO3
-
N2O5 и BaO
А5. В схеме превращений 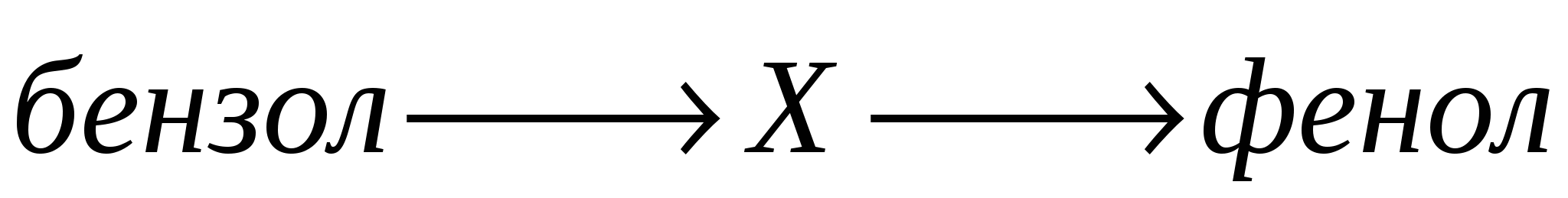 веществом «X» является:
веществом «X» является:
-
хлорбензол
-
нитробензол
-
бензальдегид
-
анилин
А6. Оксид углерода (IV) реагирует с обоими веществами группы:
-
водой и оксидом кальция
-
кислородом и оксидом серы (IV)
-
сульфатом калия и гидроксидом натрия
-
фосфорной кислотой и водородом
А7. В каких реакциях, схемы которых приведены ниже, не получится сульфат магния:
-
Mg(ОН)2 + Nа2SO4
-
MgО + SO3
-
Mg(ОН)2 + Н2SO4
-
MgО + Н2SO4
А8. Взаимодействуют между собой:
-
этан и вода
-
бензол и хлороводород
-
фенол и оксид меди (II)
-
этанол и оксид меди (II)
А9. Конечным продуктом в цепочке превращений на основе соединений натрия 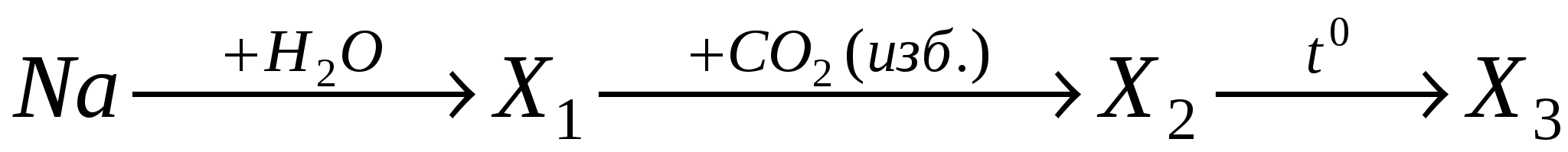 является:
является:
-
натрий
-
карбонат натрия
-
гидроксид натрия
-
гидрокарбонат натрия
А10. Из какого оксида невозможно получить кислоту, действуя водой при обычных условиях:
-
оксид серы (IV)
-
оксид кремния (IV)
-
оксид углерода (IV)
-
оксид азота (IV)
Часть2
В1. выберите соединения, которые будут вступать в реакцию с натрием:
-
этанол
-
бензол
-
фенол
-
пропин
-
2-бромбутан
-
прпилен
-
анилин
В2. Вещество «X», участвующее в цепи превращений:
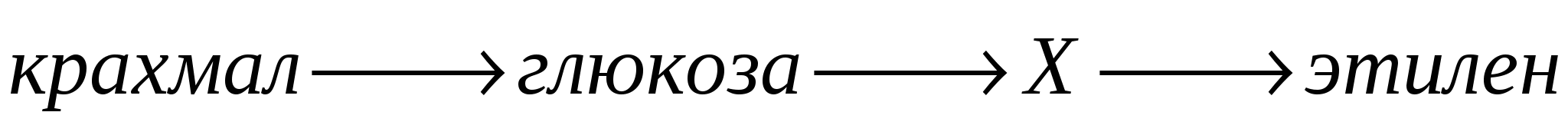
по систематической номенклатуре называется…(Запишите название вещества в именительном падеже.)
Часть 3
С1. Составьте схему получения бензола из целлюлозы. Запишите уравнения реакций с указанием условий их осуществления.
Вариант 2
Часть 1
А1. Веществами Х и Y в схеме превращений
карбид кальция ![]() X
X  Y являются
Y являются
-
Х - ацетилен, Y - 1,1-дихлорэтан;
-
Х - метан, Y - 1,1-дихлорметан;
-
Х - этилен, Y - 1,2-дихлорэтан;
-
Х - ацетилен, Y - 1,2-дихлорэтилен.
А2. Веществами X, Y, Z в цепи превращений
 H12O6
H12O6 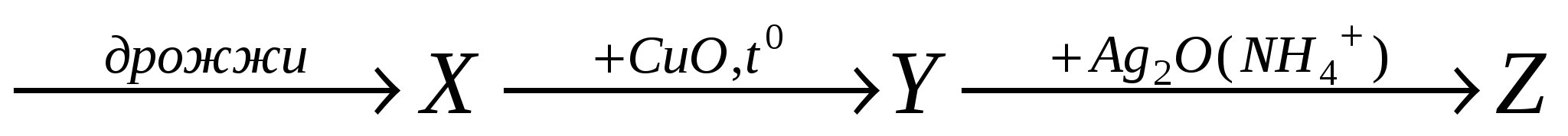
соответственно являются :
-
этанол, этаналь, уксусная кислота;
-
молочная кислота, пропадиовая кислота, пропионат серебра;
-
ацетальдегид, уксусная кислота, ацетат серебра;
-
уксусная кислота, этанол, этаналь.
А3. В схеме превращений
HNO3(конц.)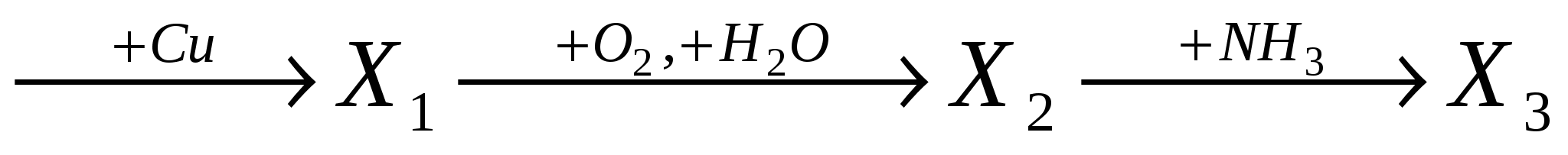
соответственно являются:
-
NO2, HNO3, NH3, H2O;
-
NO, NO2, NH4 NO3;
-
NO2, N2O5, NH4 NO3;
-
NO2, HNO3, NH4 NO3.
А4. В схеме превращений
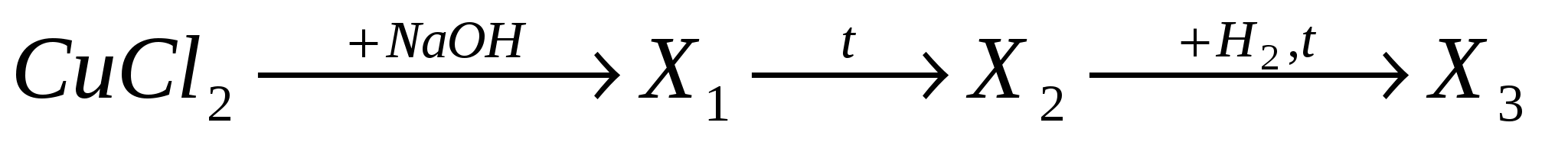
веществами Х1, Х2, Х3 соответственно являются:
-
Cu(OH)2, CuO, Cu;
-
Cu(OH)2, CuO, CuH2;
-
CuO, Cu, CuH2;
-
CuO, Cu, Cu(OH)2.
А5. Вещество Х может реагировать с фенолом , но не реагирует с предельными одноатомными спиртами. Какое это вещество?
-
HNO3;
-
NaOH;
-
O2;
-
Na.
А6. Назовите промежуточные вещества Х и Y в синтезе, протекающем по приведенной схеме С2H2 → X → Y → C6H5OH.
-
X - C6H6, Y - C6H5Cl;
-
X - C4H6, Y - C6H5Cl;
-
X - C6H5NO2, Y - C6H5NH2;
-
X - C2Na2, Y - C6H6.
А7. Назовите промежуточное вещество Х в синтезе, протекающем по приведенной схеме:
CaC2 →X → CH3CHO
-
X - CO2;
-
X - С2H2;
-
X - Ca(OH)2;
-
X - CH4.
А8. В ряду превращений 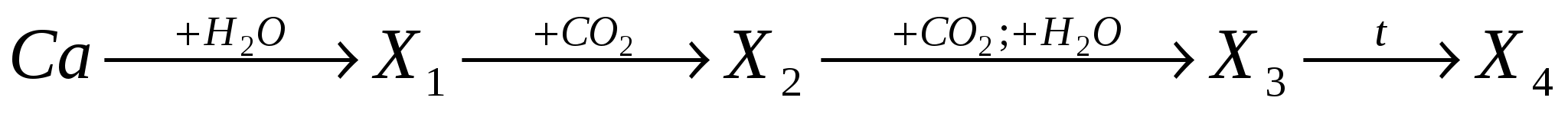
конечным веществом является:
-
CaCO3;
-
Ca(HCO3)2;
-
Ca(OH)2;
-
Ca.
А9.В цепочке превращений Fe(OH)2 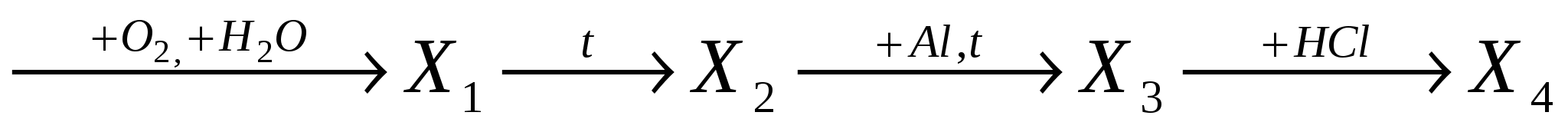 конечным веществом Х4 является:
конечным веществом Х4 является:
-
хлорид железа (II);
-
хлорид железа ( III );
-
хлоридгидроксожелеза ( II );
-
хлоридгидроксожелеза ( III ).
А10. В схеме превращений
этилен 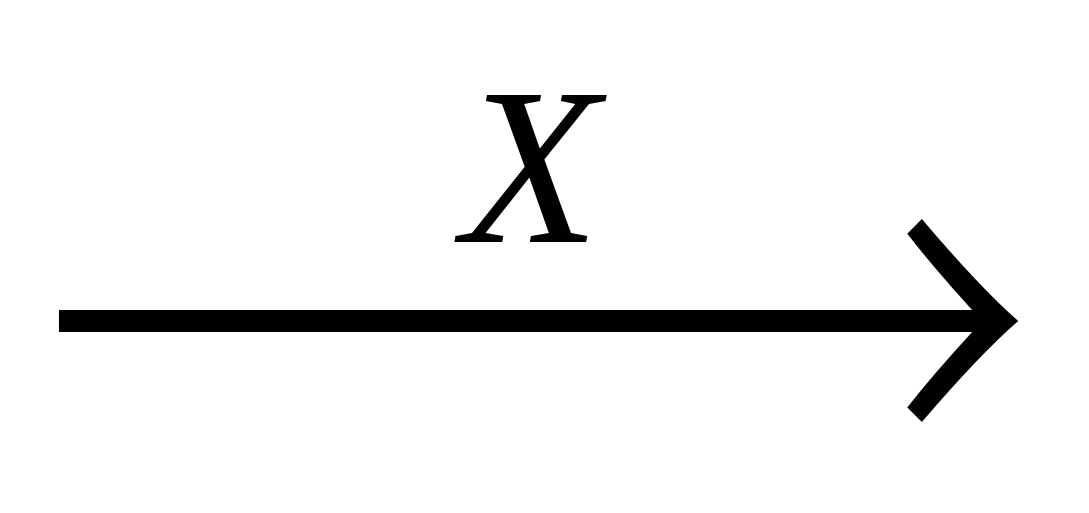 хлорэтан
хлорэтан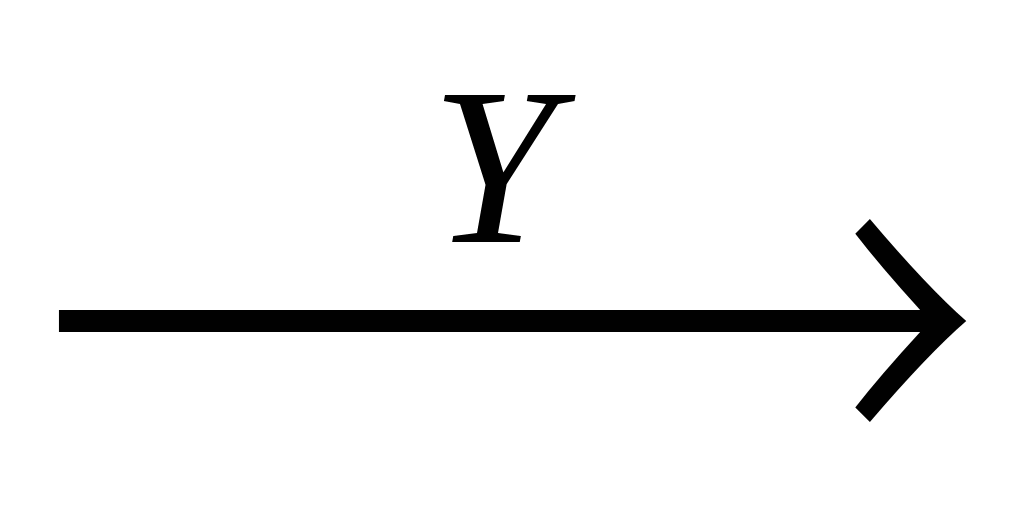 этанол
этанол
вещества «Х» и «У» соответственно:
-
Х - HCl, Y - KOH(водн.)
-
Х - HCl, Y - KOH(спирт.)
-
Х - HCl, Y - H2O;
-
Х - NaCl, Y - KOH(водн.)
Часть 2
В1. Установите соответствие между формулой кислотного оксида и формулой соли, которую можно получить из этого оксида с помощью обменных реакций.
формула оксида формула соли
1) SO2 А) Ba(NO2)2
2) SO3 Б) NH4HCO3
3) N2O5 В) Ca(HSO3)2
4) N2O3 Г) Cu(NO3)2
Д) FeS
Е) (NH4)2SO4
1
2
3
4
В2. Установите соответствие между формулами органических веществ и продуктами их реакций с HCl.
вещество продукт реакции
1) CH3COONa А) (CH3)3CCl
2) CH3NH2 Б) (CH3)3CCl(CH3)3
3) (CH3)3COH В) CH3COOH
4) CH2CH2 Г) CH3CH2Cl
Д) CH3NH3Cl
Е) CH3Cl
1
2
3
4
Часть 3
С1. Напишите уравнения реакций, с помощью которых можно осуществить превращения:
этилен → этанол → этаналь→ этановая кислота → метиловый эфир этановой кислоты→ оксид углерода (IV).
Вариант 3
Часть 1
А1. Оксиду серы (VI) соответствует формула гидроксида:
-
Н2SO4
-
Н2SO3
-
Sn(OH)2
-
K2SO4
А2. Общая схема 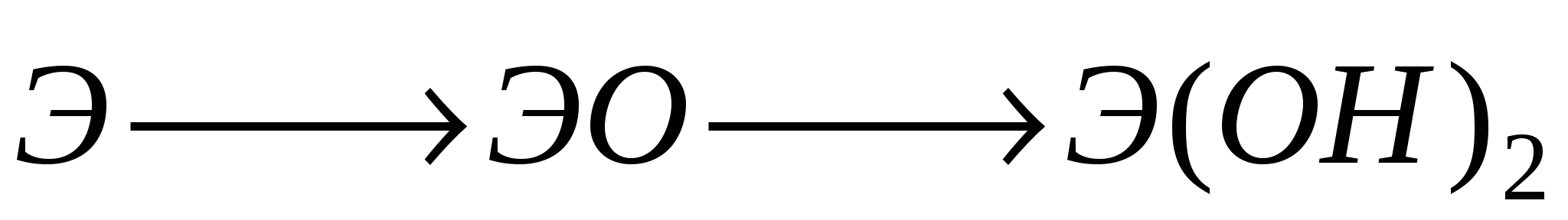 соответствует цепочке превращении:
соответствует цепочке превращении:
-
кальций, оксид кальция, гидроксид кальция
-
натрий, оксид натрия, гидроксид натрия
-
алюминий, оксид алюминия, гидроксид алюминия
-
азот, оксид азота(V), гидроксид азота(V)
А3. Глицерин реагирует со всеми веществами группы:
-
водород, метиловый спирт, уксусная кислота
-
раствор перманганата калия, бромная вода, азотная кислота
-
свежеприготовленный гидроксид меди(II), кислород, металлический натрий
-
серная кислота, цинк, гидроксид натрия
А4. Сульфат меди(II) реагирует по отдельности с веществами:
-
Fe, Na2S, KOH
-
Ag, K2CO3, BaCl2
-
Zn,HNO3, CaCO3
-
Al, KCl, KOH
А5. В схеме превращений 
веществом «X» является:
-
этанол
-
этаналь
-
этилен
-
этан
А6. Назовите промежуточные вещества «X» и «Y» в следующей схеме синтеза:
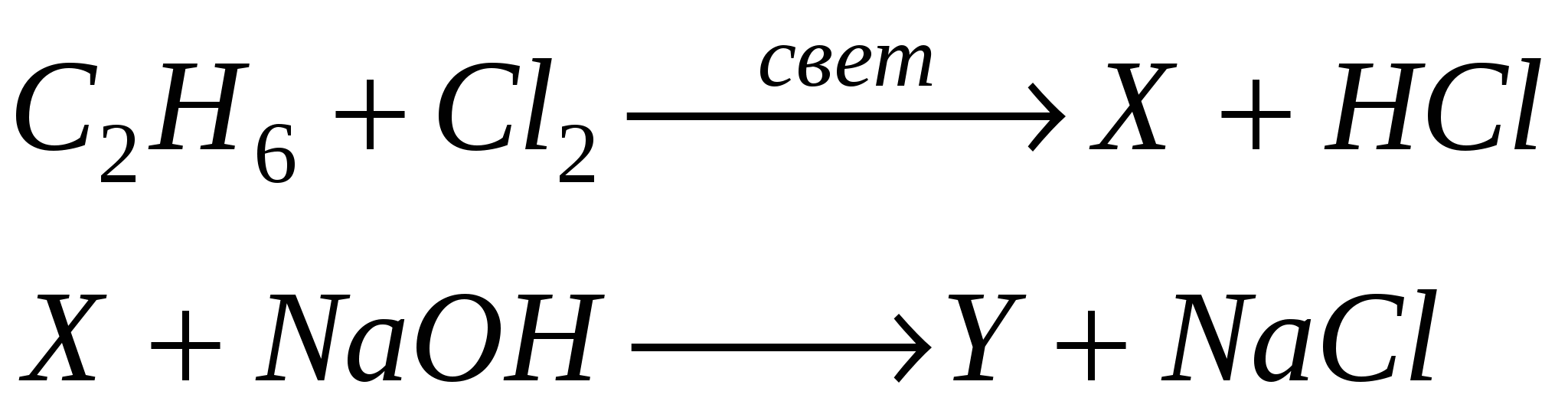
-
X - C2H5Cl, Y - CH3COOH
-
X - C2H5Cl, Y - CH3CH2OH
-
X - C2H5Cl, Y - CH3OH
-
X - C2H5Cl, Y - CH3CHO
А7. Назовите вещество «А» в следующей схеме синтеза
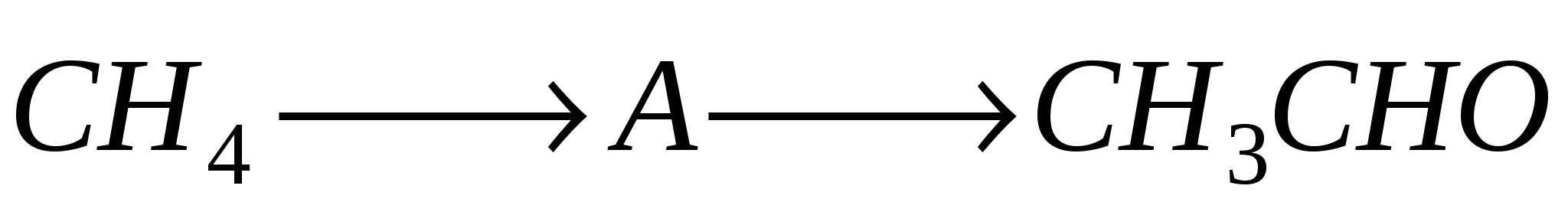
-
ацетилен
-
этанол
-
уксусная кислота
-
углекислый газ
А8. В схеме превращений 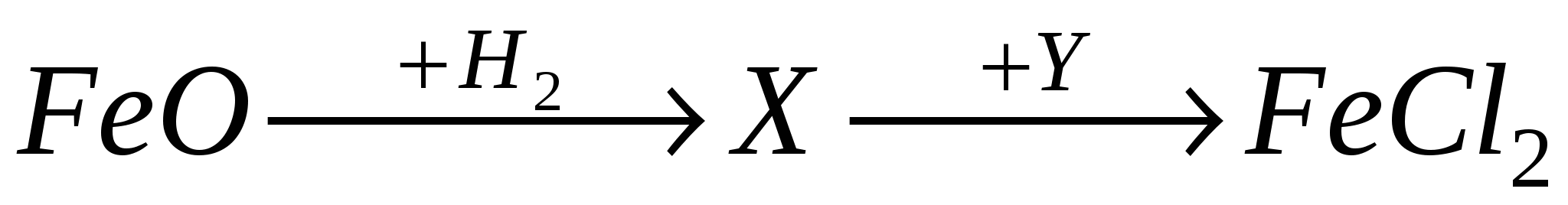
веществами «X» и «Y» соответственно являются:
-
Fe и Cl2
-
Fe2O3и HCl
-
Fe и HCl
-
Fe3O4и HCl
А9. Веществами «X» и «Y» в цепочке превращений
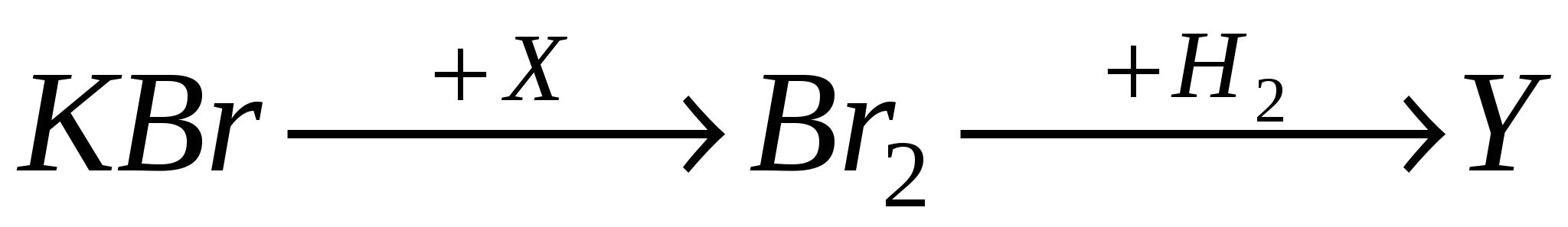
соответственно являются:
-
I2, HBr
-
Cl2, HBrO
-
Cl2, HBr
-
I2, HBrO
А10. Из какого оксида невозможно получить щёлочь, действуя водой при обычных условиях:
-
оксид натрия
-
оксид кальция
-
оксид калия
-
оксид алюминия
Часть 2
В1. И азотная кислота, и гидроксид кальция способны реагировать с:
-
карбонатом натрия
-
оксидом меди(II)
-
цинком
-
гидроксидом хрома(III)
-
гидроксидом натрия
-
оксидом серы (VI)
В2. При растворении алюминия в избытке щёлочи образуется комплексная соль с координационным числом 4. Составьте уравнение реакции и укажите в ответе сумму коэффициентов в нём.
Часть 3
С1. Химики XIX века считали, что органические вещества нельзя получить из неорганических. Опровергните это мнение, написав уравнения реакций, с помощью которых можно получить уксусную кислоту из мрамора. Укажите условия осуществления каждой реакции.
Вариант 4
Часть 1
А1. Веществами Х и У в схеме превращений
карбид алюминия 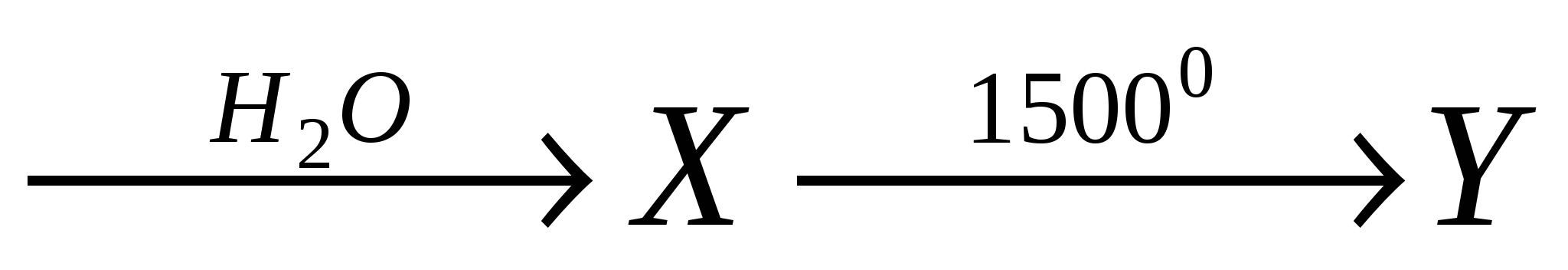 являются:
являются:
-
Х - метан, У - этан;
-
Х - метан, У - ацетилен;
-
Х - ацетилен, У - водород;
-
Х - ацетилен, У - сажа.
А2. В цепочке превращений
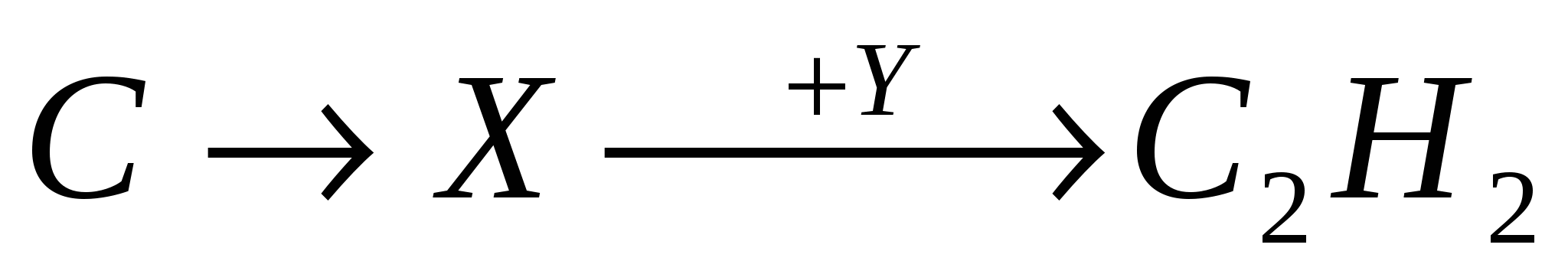 веществами Х и У соответственно являются:
веществами Х и У соответственно являются:
-
CaC2 и H2O;
-
CaO и H2;
-
CaH2 и H2O;
-
Ca(OH)2 и H2.
А3. В цепочке превращений
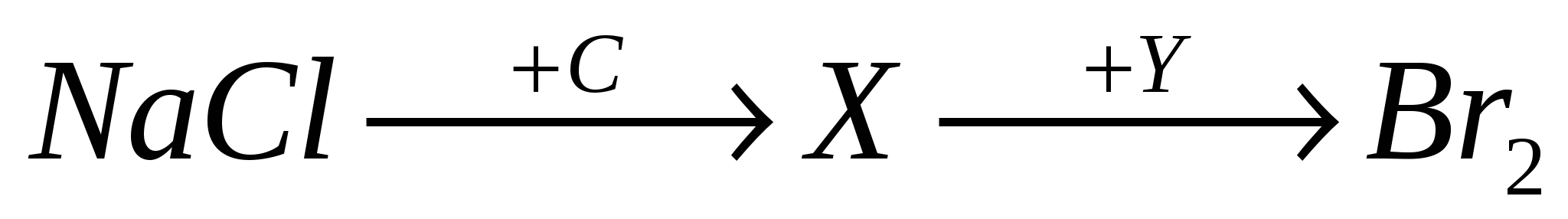 веществами Х и У соответственно являются:
веществами Х и У соответственно являются:
-
NaOH и HBr;
-
H2 и NaBr;
-
Cl2 и NaBr;
-
NaBr и HCl.
А4. В схеме превращений 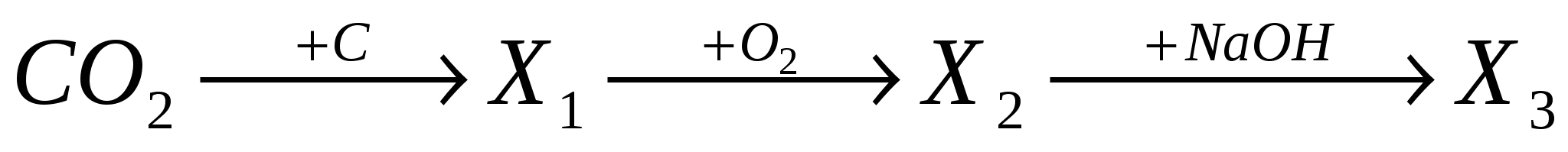
веществами Х1, Х2, Х3 соответственно являются:
-
CO, CO2, Na2CO3;
-
CO, CO2, NaHCO3;
-
C2H2, CO2, Na2CO3;
-
C2H2, CO2 ,NaHCO3.
А5. В схеме превращений  FeO
FeO 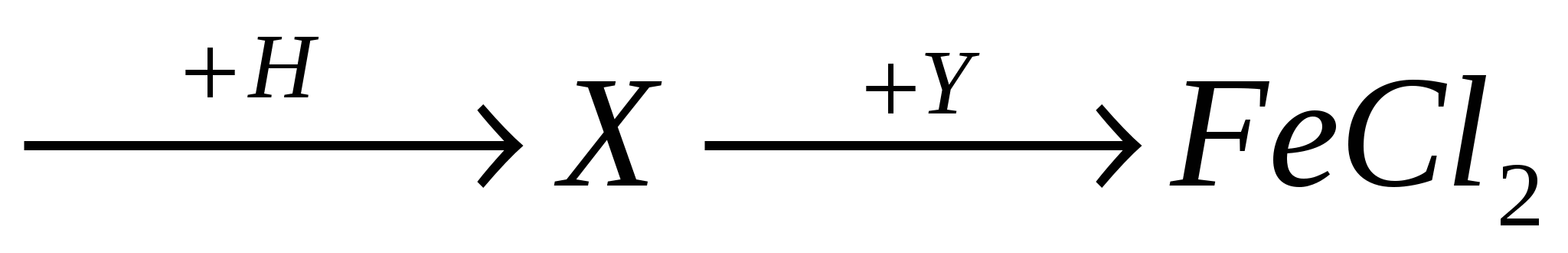 веществами Х и У соответственно являются:
веществами Х и У соответственно являются:
-
Fe и Cl2;
-
Fe2O3 и HCl;
-
Fe и HCl;
-
Fe3O4 и HClю
А6. Оксиду СuO соответствует основание:
-
гидроксид меди(II);
-
гидроксид меди (I);
-
гидроксид кальция;
-
гидроксид магния.
А7. В цепочке превращений 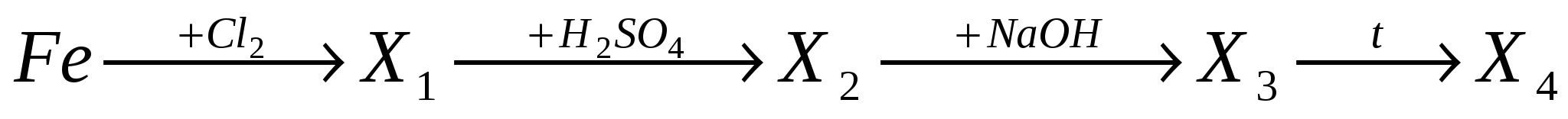 конечным веществом Х4 является:
конечным веществом Х4 является:
-
оксид железа (II);
-
оксид железа (III);
-
гидроксид железа (II);
-
гидроксид железа (III).
А8. Веществом Х в цепочке превращений
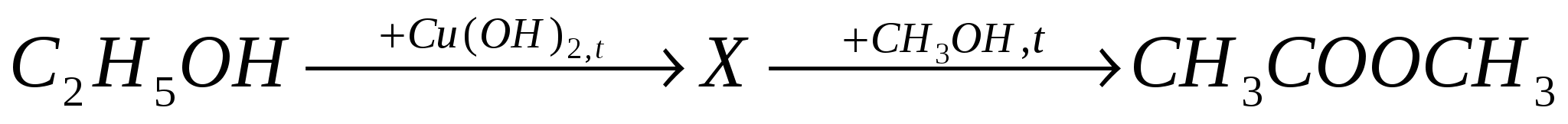
является:
-
этиловый спирт;
-
диэтиловый эфир;
-
уксусная кислота;
-
бутадиен - 1,3.
А9. Для осуществления превращений:
оксид кальция  карбонат кальция
карбонат кальция  оксид углерода (IV) необходимы вещества:
оксид углерода (IV) необходимы вещества:
-
а - углекислый газ и вода, б - соляная кислота;
-
а - углекислый газ, б - хлорид натрия;
-
а - углекислый газ , б - соляная кислота;
-
а - карбонат натрия, б - хлорид натрия.
А10. В цепочке химических превращений
FeS2→X→SO3→H2SO4 вещество Х - это :
-
H2SO4
-
SO2
-
S
-
H2SO3
Часть 2
В1. Какое вещество образуется в результате следующих превращений:
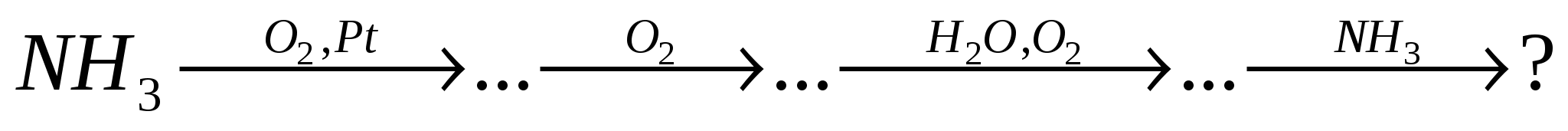
(В ответе запишите название вещества)
В2. Каков объём углекислого газа (н у), выделившегося при термическом разложении карбоната магния, если при этом было получено 10 г оксида магния? (В ответе укажите число с точностью до десятых)
Часть 3
С1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения (укажите условия протекания реакций):
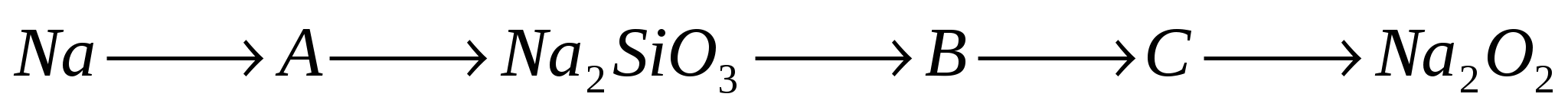

Одной стрелке соответствует одна реакция.
Ответы и решения по теме «Реакции, подтверждающие генетическую связь между классами неорганических и органических соединений»
Код задания
Вариант 1
Вариант 2
Вариант 3
Вариант 4
А1
4
1
1
2
А2
3
1
1
1
А3
2
1
3
3
А4
3
1
1
1
А5
1
2
2
3
А6
1
1
2
1
А7
1
2
1
2
А8
4
1
3
3
А9
2
1
3
3
А10
2
1
4
2
В1
13457
ВЕГА
134
Нитрат аммония
В2
ЭТАНОЛ
ВДАГ
15
5,6
Часть 3
Вариант 1
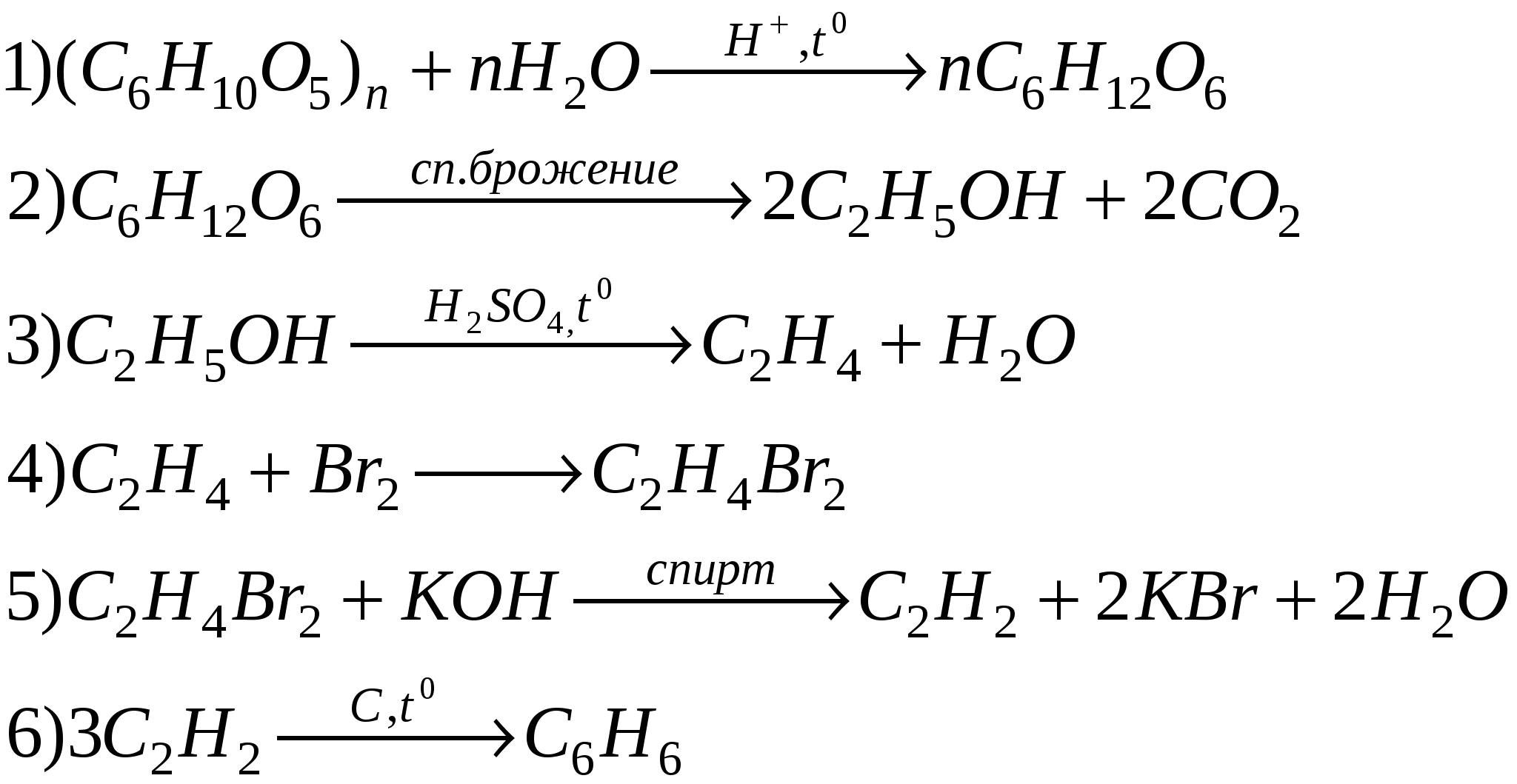
Вариант 2
Составлены уравнения реакций, соответствующие схеме превращений:
-
C2H4 + H2O
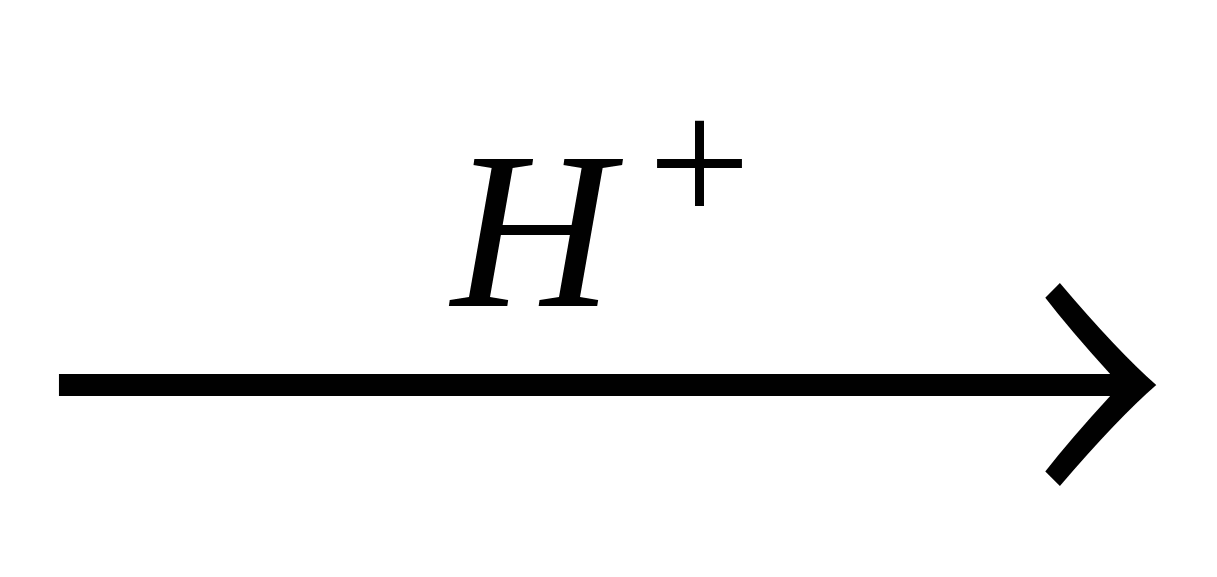 C2H5OH
C2H5OH -
C2H5OH + CuO
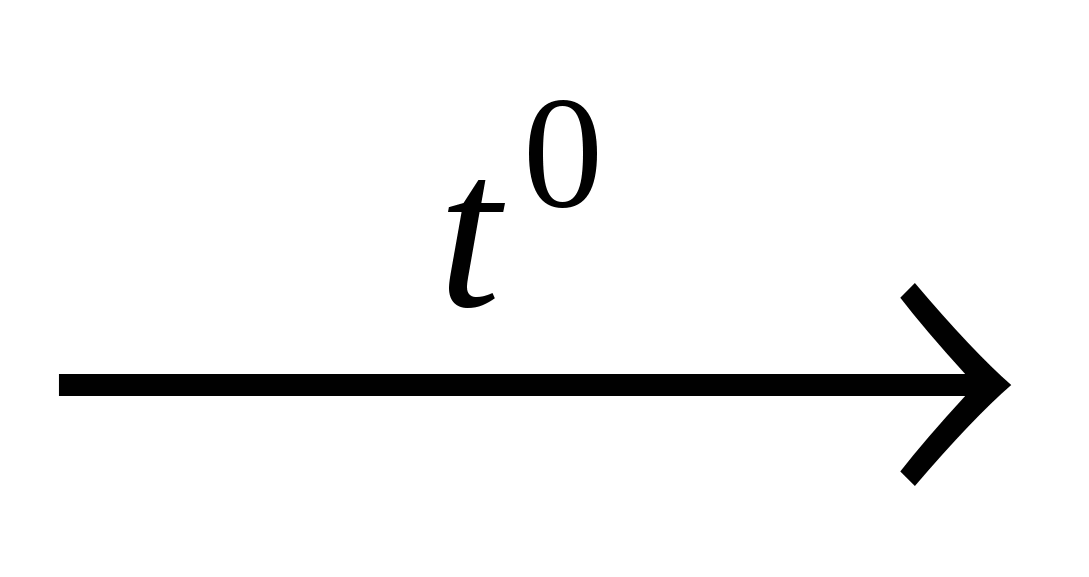 C2H4O + H2O + Cu
C2H4O + H2O + Cu -
C2H4O + Ag2O
 C2H4O + 2Ag
C2H4O + 2Ag -
CH3COOH + CH3OH
 CH3COOCH3 + H2O
CH3COOCH3 + H2O -
2 CH3COOCH3 + 7O2 → 6CO2 + 6 H2O
Вариант 3
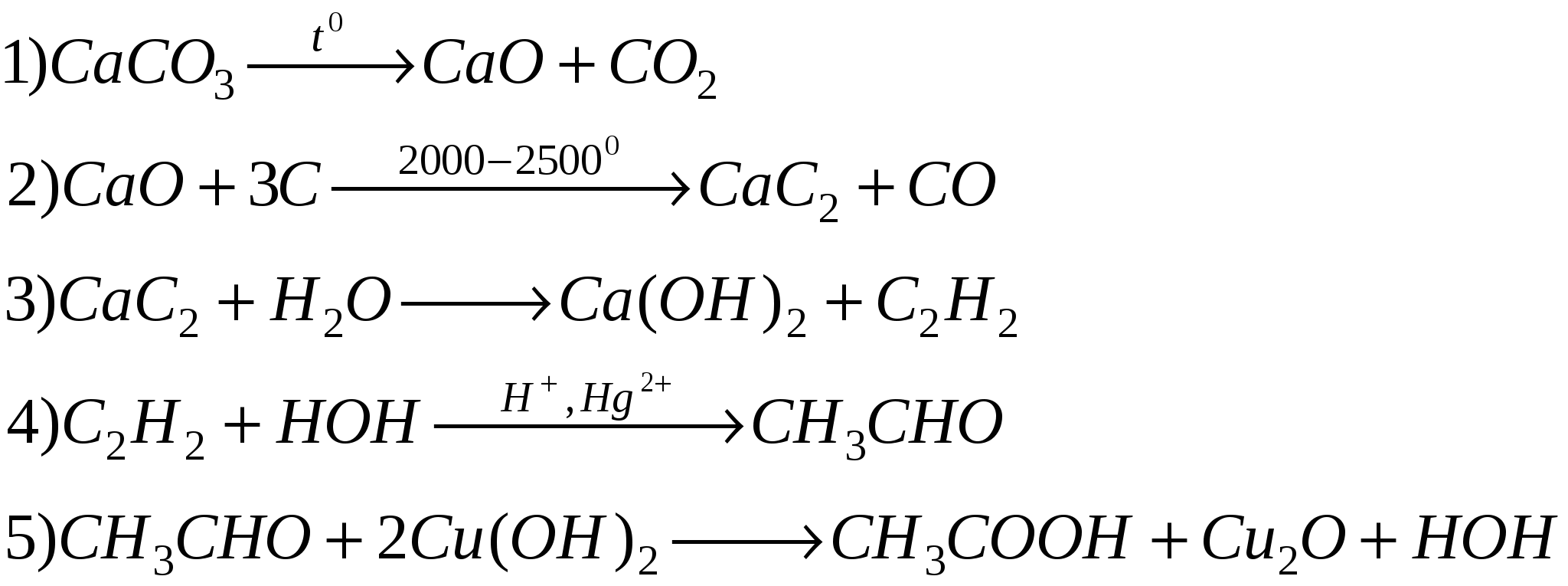
Вариант 4
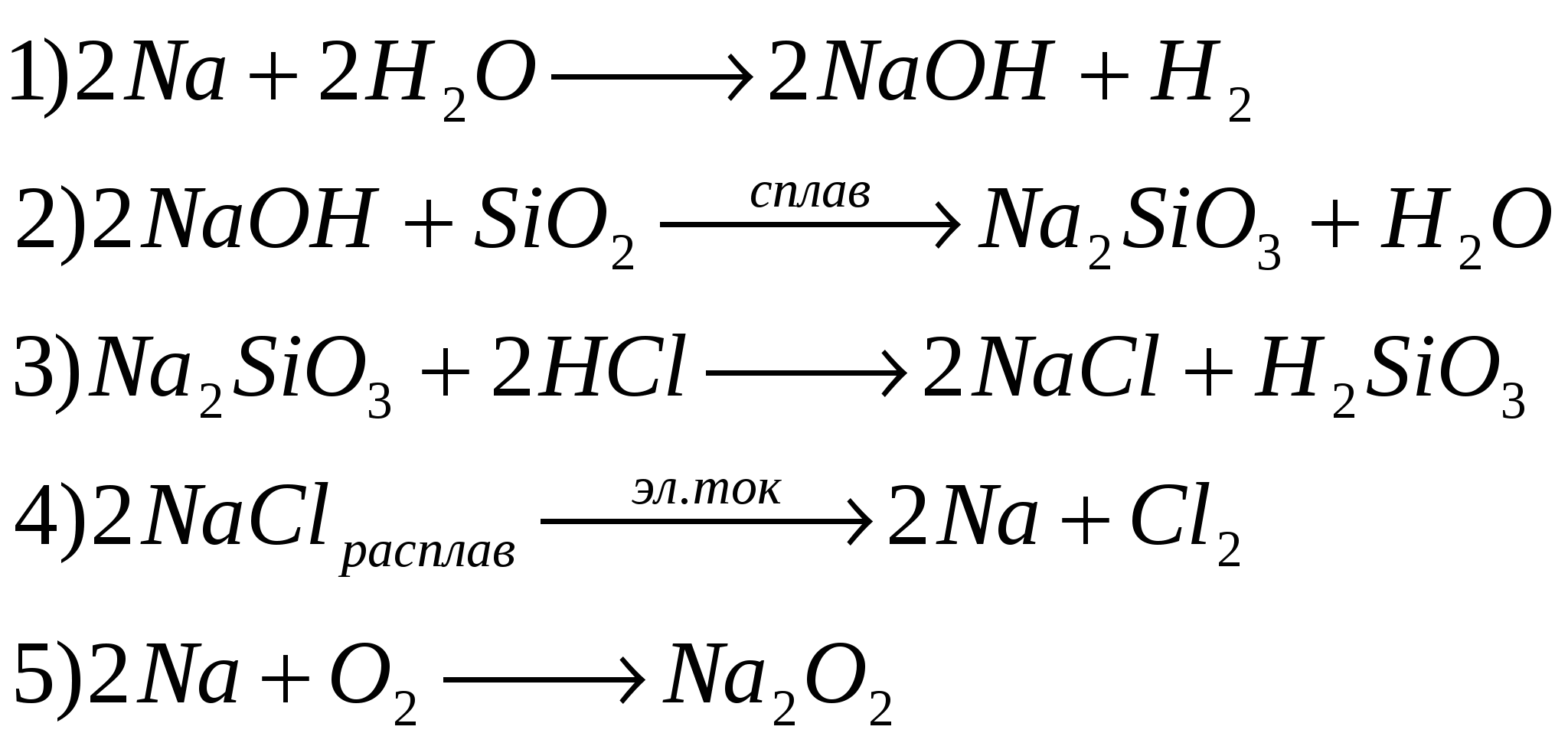
Список литературы
-
Аргишева, А.И. Химия: Подготовка к государственному централизованному тестированию/ А.И. Аргишева , Э.А. Задумина .-Саратов: Лицей, 2002. - 144с.
-
Богданова, Н.Н. Сборник тестовых заданий для тематического и итогового контроля. Химия 10-11 класс. /Богданова Н.Н., Васюкова Е.Ю. - под общей редакцией Оржековского П.А., Татура А.О. -М.: «Интеллект-Центр», 2007.-208с.
-
Горбунцова, С.В. Тесты по основным разделам школьного курса химии: 8 - 9 классы/ С.В. Горбунцова.- М.: «ВАКО», 2006. - 208с. - (Мастерская учителя).
-
Егоров, А.С. Как сдать ЕГЭ по химии на 100 баллов/ А.С. Егоров.-Ростов н/Д: Феникс, 2003. - 288с. (Серия «100 баллов».)
-
Еремина, Е.А. ЕГЭ 2007. Химия. Типовые тестовые задания/ Е.А. Еремина. - М.: Издательство «Экзамен», 2007. - 96 с.
-
Левина, Э.М. ЕГЭ. Химия: Раздаточный материал тренировочных тестов/ Э.М.Левина. - СПб.: Тригон, 2008 - 96 с.
-
Оржековский , П.А. ЕГЭ-2008. Химия. Тренировочные задания / П.А. Оржековский, Н.Н. Богданова, М.В. Дорофеев и др. - М.: Эксмо, 2008. - 128с.
-
Соколова, И.А. ЕГЭ 2008. химия. Тематические тренировочные задания/ И.А. Соколова. - М.: Эксмо, 2008. - 88 с.


