- Преподавателю
- Химия
- Конспект урока по химии на тему Оксиды
Конспект урока по химии на тему Оксиды
| Раздел | Химия |
| Класс | - |
| Тип | Конспекты |
| Автор | Жанкулова Н.С. |
| Дата | 12.08.2015 |
| Формат | doc |
| Изображения | Есть |
Тема урока Оксиды
Тип урока изучение и первичное закрепление новых знаний и умений.
Цели урока
Личностные: создать условия для проявления активности и самостоятельности учащихся при закреплении и систематизации изученного материала.
Метапредметные: создать условия для развития умений: работать по алгоритму, сравнивать, анализировать полученную информацию, формулировать выводы, составлять опорный конспект, осуществлять самоконтроль и взаимоконтроль.
Предметные: организовать деятельность учащихся по закреплению имеющихся знаний об оксидах, изучению классификации, физических и химических свойств оксидов; развитию умений по составлению: формул оксидов и гидроксидов, уравнений реакций по химическим свойствам оксидов, названий оксидов, оснований, кислот и солей.
Этапы урока
Основные дидактические задачи этапа
Приёмы и виды заданий для активизации УУД различных блоков
Примерное время
1.Организационный
Вовлечь учащихся в образовательный процесс.
Активизация познавательных УУД, инструктаж о выполнении заданий на уроке.
2 мин.
2.Актуализация знаний.
Целеполагание.
Обеспечение мотивации и принятие цели урока.
Актуализация знаний.
Активизация регулятивных УУД: постановка проблемы, определение цели урока, составление плана урока.
5 мин.
3.Усвоение новых знаний и умений.
Организовать деятельность учащихся по закреплению имеющихся знаний об оксидах и формированию понятий об их классификации, физических и химических свойствах; развитию умений идентифицировать оксиды, составлять уравнения реакций по их свойствам, указывать типы реакций и названия солей.
Активизация познавательных УУД: выполнение заданий по развитию общеучебных и логических универсальных действий.
Активизация коммуникативных УУД при выполнении лабораторного опыта.
Активизация регулятивных УУД: самоконтроль, взаимоконтроль, планирование.
20 мин
4.Первичная проверка понимания изученного.
Выявление уровня усвоения знаний и умений.
Коррекция, исправление ошибок.
Развитие способности учащихся к самоконтролю и взаимоконтролю.
Активизация регулятивных и коммуникативных УУД.
Выполнение проверочной работы.
15 мин.
5.Информация о домашнем задании.
Обеспечить понимание учащимися целей, содержания и способов выполнения домашнего задания
1 мин.
6.Подведение итогов урока.
Оценить работу класса и некоторых учащихся
Активизация коммуникативных и регулятивных УУД.
2 мин.
Содержание приёмов и заданий , обуславливающих необходимость совершения УУД на различных этапах урока и описание методики их применения.
Этап 1. Учитель приветствует учащихся и дает информацию о материалах, расположенных на ученических столах:
- лист №1 с опорным планом - конспектом урока,
- лист заданий №2,
- лист заданий - тренингов №3,
- лист с проверочной работой №4.
Этап 2. Вводя учащихся в тему урока, учитель задает вопросы:
Что такое «парниковый эффект»?
Что вы знаете о негашеной извести?
В результате обсуждения выясняется, что
- виновником «парникового эффекта» является углекислый газ,
- негашеная известь - это оксид кальция,
- оба вещества относятся к классу оксидов,
- углекислый газ - это оксид неметалла, негашеная известь - это оксид металла (информация о веществах
давалась при изучении темы «Кислород. Оксиды. Горение»).
Следовательно, оксиды можно разделить на группы по определенным классификационным признакам.
Каковы эти признаки и на какие группы делятся оксиды нам предстоит узнать на уроке.
Цель урока: Познакомиться с классификацией оксидов, повторить и систематизировать знания о физических и
химических свойствах оксидов.
План урока: - изучить классификацию оксидов, научиться различать оксиды разных групп,
- повторить и систематизировать свойства оксидов разных групп,
- составлять формулы оксидов, гидроксидов,
- составлять уравнения реакций по свойствам оксидов,
- давать названия оксидам, солям,
- указывать типы реакций.
В ходе урока вам предстоит:
- заполнить лист №1 опорный план - конспект урока,
- выполнить задания на листе №2, на листе №3 и оценить свою работу с помощью эталона,
- выполнить проверочную работу на листе №4 и сдать ее учителю в конце урока,
- выставить себе оценку за урок, суммировав баллы за выполненные задания.
Желаю всем успеха!
Этап №3. Беседа Дайте определение оксидам, приведите примеры оксидов и назовите их.
Учащиеся приводят формулы оксидов, составленных по валентности, некоторые оксиды добавляет
учитель, все формулы записываются на доске:
CaO SO2 P2O5 FeO H2O CO2 CuO NO K2O CrO SO3 CrO3 B2O3 CO
Распределите оксиды по группам и укажите признак, положенный в основу классификации.
Учащиеся разделяют оксиды на две группы по признаку: оксиды металлов и оксиды неметаллов.
Учитель дает определение основным и кислотным оксидам, учащиеся начинают заполнение опорного
плана - конспекта, внося в него примеры основных и кислотных оксидов, оставшиеся оксиды СО и NО
относят к несолеобразующим.
Учитель предлагает учащимся выполнить задание №1 по вариантам на листе заданий №2 затем
поменяться листами и проверить задания друг друга, воспользовавшись листом проверки №4.
Фронтальный опрос:
- каковы физические свойства оксидов,
- как оксиды металлов и неметаллов относятся к воде.
Учащиеся выполняют лабораторный опыт - задание №2 на листе заданий №2.
На основании проведенных опытов учащиеся делают выводы и заполняют опорный план-конспект:
оксиды активных металлов растворяются в воде, образуя щелочи;
оксиды неметаллов (кроме SiO2) растворяются в воде, образуя кислоты.
Учитель проводит опыт, демонстрирующий взаимодействие оксидов с гидроксидами (взаимодействие
оксида меди с серной кислотой и углекислого газа с известковой водой), учащиеся записывают
уравнения реакций в опорный план - конспект и делают выводы:
основной оксид взаимодействует с кислотой, образуя соль и воду,
кислотный оксид взаимодействует со щелочью, образуя соль и воду.
Видеофрагмент взаимодействие негашеной извести с углекислым газом демонстрирует взаимодействие
оксидов между собой, вывод:
оксиды взаимодействуют между собой, образуя соли.
Учитель предлагает учащимся выполнить задание - тренинг №3 на листе заданий №3, затем, пользуясь
листом проверки, оценить свою работу.
Беседа Учитель: Подведем итоги.
Учащиеся повторяют свойства основных и кислотных оксидов и записывают выводы в опорный план -
конспект:
Основной оксид + вода = растворимое основание (щелочь) Кислотный оксид + вода = кислота
Основной оксид + кислота = соль + вода Кислотный оксид + р.основание = соль + вода
Основной оксид + кислотный оксид = соль Кислотный оксид + основной оксид = соль
Для закрепления темы учащиеся выполняют задание - тренинг №4 на листе заданий №3 с последующим фронтальным обсуждением и коррекцией ошибок.
Этап №4 Учитель предлагает учащимся выполнить проверочную работу на листе №4 и по окончании работы сдать лист №4 на проверку. На этом же листе учащиеся суммируют баллы за выполненные задания и выставляют себе оценку: 17 -20 баллов - «5», 13 -16 баллов - «4», 9 - 12 баллов - «3». Лист №4 сдают учителю.
Этап №5 Учитель: Посмотрите еще раз на цели нашего урока и ответьте смогли ли мы их достигнуть, все ли вопросы
достаточно отработали? Доработать тему вам предстоит в домашнем задании: §30, упр.1, 4, 5 стр.92-93
Этап №6 Учитель: Благодарю вас за активность на уроке, ваши ответы были очень хорошими, надеюсь, что оценки за выполненные работы будут высокими. Урок окончен!
Приложение
Лист №1 Опорный план - конспект урока
Основные оксиды
Кислотные оксиды
Несолеобразующие
оксиды
Это оксиды металлов (I, II), которым соответствуют
основания
Это оксиды неметаллов и металлов (V, VI , VII) которым соответствуют кислоты
CO NO
CaO ─ Ca(OH)2
Na2O ─ NaOH
FeO ─ Fe(OH)2
K2O ─ KOH
CO2 ─ H2CO3
SO3 ─ H2SO4
P2O5 ─ H3PO4
CrO3 ─ H2CrO4
Химические
1.Взаимодействие
1.Оксиды активных металлов взаимодействуют с водой, образуя растворимые основания (щелочи)
Na2O + H2O = 2NaOH
BaO + H2O = Ba(OH)2
2.Взаимодействие
2.Основные оксиды взаимодействуют с кислотами с образованием соли и воды
CuO + H2SO4 = CuSO4 + H2O
3.Взаимодействие
3.Основные оксиды взаимодействуют с кислотными с образованием соли
Na2O + SO2 = Na2SO3
свойства
с водой
1.Оксиды неметаллов (кроме ) взаимодействуют с водой, образуя кислоты
CO2 + H2O = H2CO3
P2O5 + 3H2O = 2H3PO4
с гидроксидами
2.Кислотные оксиды взаимодействуют с растворимыми основаниями с образованием соли и воды
CO2 + Ca(OH)2 = CaCO3 + H2O
(H2CO3)
оксидов друг с другом
3.Кислотные оксиды взаимодействуют с основными с образованием соли
3Na2O + P2O5 = 2Na3PO4
Основной оксид + вода = растворимое основание (щелочь)
Основной оксид + кислота = соль + вода
Основной оксид + кислотный оксид = соль
Кислотный оксид + р.основание = соль + вода
Основной оксид + кислотный оксид = соль Кислотный оксид + основной оксид = соль
Приложение Задание №1
Лист №2
Составьте формулы гидроксидов, соответствующие оксидам, используя алгоритм:
1.Определите валентность элемента (металл, неметалл) в оксиде;
2.Определите характер оксида и соответствующего ему гидроксида;
3.Составьте формулу гидроксида (основания или кислоты)
Вариант №1
Оксид
MgO
SO3
Cu2O
P2O5
B2O3
PbO
Гидроксид
Вариант №2
Оксид
SiO2
ZnO
Cl2O7
CrO
N2O5
Li2O
Гидроксид
Оценка: одна формула - один балл, максимальный балл - 6
Задание №2
Проведите лабораторный опыт, исследующий растворимость оксидов в воде. Свои наблюдения и выводы занесите в таблицу:
Оксиды
CaO
P2O5
CuO
Вода (растворяется или не растворяется оксид)
Гидроксиды (формулы)
Лакмус (окраска)
Вывод о растворимости - 1 балл,
Формула полученного гидроксида - 1 балл,
Окраска лакмуса, вывод - 1 балл, максимальный балл - 7
Приложение лист №3 Задание - тренинг №3
Заполни схемы до конца (в первой строке - формулы оксидов и кислот, во второй - соответствующих им солей). Каждая формула - 1 балл, максимальный балл - 7


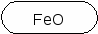

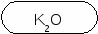

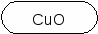








Задание - тренинг №4
Вариант №1 Вариант №2
Выберите из предложенного перечня формулы Выберите из предложенного перечня формулы веществ, с которыми взаимодействует оксид веществ, с которыми взаимодействует оксид бария (II) фосфора (V)
1.Серная кислота 1.Угольная кислота
2.Вода 2.Оксид натрия
3.Оксид углерода (IV) 3.Гидроксид лития
4.Гидроксид меди (II) 4.Вода
5.Оксид железа (II) 5.Оксид азота (IV)
6.Нитрат кальция 6.Карбонат калия
Приложение лист №4
Проверочная работа
Вариант №1 Вариант №2
Составьте уравнения возможных реакций между Составьте уравнения возможных реакций между
оксидом кальция и следующими веществами: оксидом серы (IV) и следующими веществами:
1.Азотная кислота 1.Хлороводородная кислота
2.Оксид углерода (IV) 2.Оксид натрия
3.Вода 3.Вода
4.Оксид меди (II) 4.Оксид фосфора (V)
5.Гидроксид натрия 5.Гидроксид калия
6.Хлорид магния (II) 6.Карбонат натрия
Назовите продукты реакций, укажите типы реакций. Назовите продукты реакций, укажите типы реакций.
Выбранная формула - 1 балл, уравнение реакции - 1балл, тип реакции - 1балл, название продукта - 1 балл. Макс балл12
Оценки за выполненные задания и тренинги:
«5» - 17 - 20 баллов
«4» - 13 - 16 баллов
«3» - 9 - 12 баллов


