- Преподавателю
- Химия
- МЕТОДИЧЕСКИЕ УКАЗАНИЯ ПО ВЫПОЛНЕНИЮ ПРАКТИЧЕСКИХ и лабораторных занятий по общей неорганической химии
МЕТОДИЧЕСКИЕ УКАЗАНИЯ ПО ВЫПОЛНЕНИЮ ПРАКТИЧЕСКИХ и лабораторных занятий по общей неорганической химии
| Раздел | Химия |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Амирова С.А. |
| Дата | 04.11.2015 |
| Формат | doc |
| Изображения | Есть |
Министерство образования и науки Челябинской области
государственное образовательное учреждение
среднего профессионального образования
«Южно-Уральский многопрофильный колледж»
МЕТОДИЧЕСКИЕ УКАЗАНИЯ ПО ВЫПОЛНЕНИЮ
ПРАКТИЧЕСКИХ и лабораторных занятий
по учебной дисциплине
Общая и неорганическая химия
для студентов специальности
18.02.10 «Коксохимическое производство»
Челябинск, 2015
ОДОБРЕНО:
ЦМК
Председатель _________________ / В.А. Дружинина
Протокол № ______ от __________________ 2015
Составитель:
преподаватель ГБОУ СПО (ССУЗ) ЮУМК __________ / С.А. Амирова
Методические указания по выполнению практических и лабораторных работ разработаны на основе рабочей программы учебной дисциплины «Общая и неорганическая химия».
Содержание практических и лабораторных работ ориентировано на подготовку студентов к освоению - Математического и общего естественнонаучного учебного цикла - программы подготовки специалистов среднего звена;
по специальности «Коксохимическое производство» и овладению профессиональными компетенциями.
СОДЕРЖАНИЕ
1 Введение 4
2 Методические указания
Лабораторная работа 1. Реакции, идущие с образованием осадка, газа или воды.
Практическая работа 1. Приготовление растворов различных видов концентрации.
Лабораторная работа 2. Окислительно - восстановительные реакции (ОВР)
Практическая работа 2. Методы составления окислительно-восстановительных реакций.
Лабораторная работа 3. Получение аммиака, его свойства.
Практическая работа 3. Взаимосвязь между классами веществ.
Лабораторная работа 4. Получение гидроксида алюминия и цинка и исследование их свойств.
Лабораторная работа 5. Получение гидроксидов железа (+2, +3) и исследование их свойств, и окислительные свойства хрома (+6).
3 Литература
Основные источники:
1.Габриелян, О.С. Химия для профессий и специальностей технического профиля [Текст] : учебник / О.С. Габриелян, И.Г. Остроумов. - 2-е изд., стер. - М.: Издательский центр «Академия», 2011.
2.Габриелян, О.С. Химия. 11 класс. Профильный уровень [Текст] : учеб. для общеобразоват. Учреждений / О.С. Габриелян, Г.Г. Лысова. - 13-е изд., стереотип. - М. : Дрофа, 2011.
3.Габриелян О.С. Практикум по общей, неорганической и органической химии [Текст]: учеб. Пособие для студ. Проф. Учеб. Заведений / Габриелян О.С., Остроумов И.Г., Дорофеева М.М.- М., 2007
Дополнительные источники:
1.Ерохин, Ю.М. Химия [Текст] : учеб. для сред. проф. учеб. заведений / Юрий Михайлович Ерохин. - 4-е изд., стер. - М.: Издательский центр «Академия», 2004.
2.Ерохин Ю.М., Фролов В.И. Сборник задач и упражнений по химии (с дидактическим материалом) [Текст]: учеб. Пособие для студентов средн. Проф. Завед. - М., 2004.
3.Габриелян О.С., Лысова Г.Г. Химия в тестах, задачах и упражнениях [Текст]: учеб. Пособие/ О.С. Габриелян, П.Н. Березкин, А.А Ушакова. - 5 изд., стереотип. - М.: Дрофа, 2008.
Интернет- ресурс: «Основы неорганической химии» [Электронный ресурс] // химия. - Режим доступа: InternetUrok.ru
1 ВВЕДЕНИЕ
Содержание практических и лабораторных работ направлено на реализацию Федеральных государственных требований к минимуму содержания и уровню подготовки выпускников средних специальных учебных заведений и составлено на основе рабочей программы по дисциплине «Общая и неорганическая химия».
Ведущей дидактической целью практических и лабораторных занятий является формирование профессиональных практических умений необходимых в последующей учебной деятельности по математическим и естественно-научным.
В соответствии с рабочей программой учебной дисциплины «Общая и неорганическая химия» предусмотрено проведение практических и лабораторных занятий.
В результате их выполнения, обучающийся должен:
уметь:
- давать характеристику химических элементов в соответствии с их положением в периодической системе химических элементов Д.И. Менделеева;
- использовать лабораторную посуду и оборудование;
- находить молекулярную формулу вещества;
- применять на практике правила безопасной работы в химической лаборатории;
- проводить качественные реакции на неорганические вещества и ионы, отдельные классы органических соединений;
- составлять уравнения реакций, проводить расчеты по химическим формулам и уравнениям реакции;
- составлять электронно-ионный баланс окислительно-восстановительных процессов;
знать:
- гидролиз солей, электролиз расплавов и растворов (солей и щелочей);
- диссоциацию электролитов в водных растворах, сильные и слабые электролиты;
- классификацию химических реакций и закономерности их проведения;
- обратимые и необратимые химические реакции, химическое равновесие, смещение химического равновесия под действием различных факторов;
- общую характеристику химических элементов в связи с их положением в периодической системе;
- окислительно-восстановительные реакции, реакции ионного обмена;
- основные понятия и законы химии; основы электрохимии;
- периодический закон и периодическую систему химических элементов Д.И. Менделеева, закономерности изменения химических свойств элементов и их соединений по периодам и группам;
- тепловой эффект химических реакций, термохимические уравнения;
- типы и свойства химических связей (ковалентной, ионной, металлической, водородной);
- формы существования химических элементов, современные представления о строении атомов;
- характерные химические свойства неорганических веществ различных классов.
Содержание практических работ ориентировано на подготовку студентов к освоению Математического и общего естественнонаучного учебного цикла, программы подготовки специалистов среднего звена основной по специальности и овладению профессиональными компетенциями:
ПК 1.1. Управлять параметрами технологического процесса, в том числе с использованием средств автоматизации.
ПК 1.2. Эксплуатировать технологическое оборудование.
ПК 1.3. Контролировать сырье, полуфабрикаты и готовую продукцию.
ПК 1.4. Выполнять требования безопасности производства, охраны труда и защиты окружающей среды.
ПК 2.1. Планировать собственную деятельность, работу подразделения, смены, участка, бригады, коллектива исполнителей.
ПК 2.2. Обеспечивать выполнение персоналом требований безопасности производства, охраны труда и защиты окружающей среды.
ПК 3.1. Участвовать во внедрении новой технологии.
ПК 3.2. Участвовать в обеспечении и оценке экономической эффективности инновационного мероприятия.
ПК 3.3. Оформлять результаты экспериментальной и исследовательской деятельности.
А также формированию общих компетенций:
ОК 2. Организовывать собственную деятельность, определять методы и способы выполнения профессиональных задач, оценивать их эффективность и качество.
ОКЗ. Решать проблемы, оценивать риски и принимать решения в нестандартных ситуациях.
ОК 4. Осуществлять поиск, анализ и оценку информации, необходимой для постановки и решения профессиональных задач, профессионального и личностного развития.
ОК 5. Использовать информационно-коммуникационные технологии для совершенствования профессиональной деятельности.
ОК 6. Работать в коллективе и команде, обеспечивать её сплочение, эффективно общаться с коллегами, руководством, потребителями.
ОК 7. Ставить цели, мотивировать деятельность подчиненных, организовывать и контролировать их работу с принятием на себя ответственности за результат выполнения заданий.
ОК 8. Самостоятельно определять задачи профессионального и личностного развития, заниматься самообразованием, осознанно планировать повышение квалификации.
ОК 9. Быть готовым к смене технологий в профессиональной деятельности.
Выполнение студентами практических работ по учебной дисциплине «Общая и неорганическая химия» направлено на:
- обобщение, систематизацию, углубление, закрепление, развитие и детализацию полученных теоретических знаний по конкретным темам учебной дисциплины;
- формирование умений применять полученные знания на практике, реализацию единства интеллектуальной и практической деятельности;
- формирование и развитие умений: наблюдать, сравнивать, сопоставлять, анализировать, делать выводы и обобщения, самостоятельно вести исследования, пользоваться различными приемами измерений, оформлять результаты в виде таблиц, схем, графиков;
- приобретение навыков работы с различными приборами, аппаратурой, установками и другими техническими средствами для проведения опытов;
2 МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Тема 1.5 Растворы.
Лабораторная работа 1.
Реакции, идущие с образованием осадка, газа или воды.
Формируемая (-ые) компетенция (-и):
ПК 2.1. Планировать собственную деятельность, работу подразделения, смены, участка, бригады, коллектива исполнителей.
ПК 2.2. Обеспечивать выполнение персоналом требований безопасности производства, охраны труда и защиты окружающей среды.
Цель:
-
Научиться подбирать из имеющихся растворов солей, кислот и щелочей такие растворы, которые при взаимодействии между собой привели бы: к образованию осадка, газа, малодиссоциирующего вещества.
-
Развивать умения составлять уравнения реакций ионного обмена в молекулярной и ионной формах.
Реактивы и оборудования: растворы сульфата натрия, хлорида бария, карбоната натрия, ацетата свинца, иодида калия, сульфата меди, хлорида железа (III), серной и соляной кислот, гидроксида натрия, фенолфталеина, штатив с пробирками, спички.
Подготовка к работе
Контрольные вопросы
-
Какой процесс называется электролитической диссоциацией?
-
Какие вещества относятся к электролитам?
-
Какие реакции называются реакциями ионного обмена?
-
При каких условиях реакции ионного обмена протекают между растворами до конца?
Выполнение работы
Опыт 1. Реакции, идущие с образованием осадка.
Пользуясь таблицей растворимости солей и оснований в воде, подберите из имеющихся растворов вещества, образующие выпадение осадка.
-
В пробирку налейте небольшое количество (0,5 - 1 мл.) раствора сульфата натрия и раствора хлорида бария. Что наблюдается? Уравнения реакций напишите в молекулярной и ионной формах.
-
В пробирку налейте 0,5 - 1 мл. раствора хлорида железа (III) и добавьте 0,5 мл. раствора гидроксида натрия. Запишите наблюдения.
Составьте уравнение реакции в молекулярной и ионной формах.
-
В пробирку налейте 0,5 мл. раствора ацетата свинца и такое же количество раствора иодида калия. Запищите наблюдения и уравнения реакций.
Опыт 2. Реакции, идущие с выделением газообразного вещества.
-
В пробирку прилили 0,5 мл. раствора карбоната натрия и 0.5 мл. раствора соляной кислоты. Что наблюдаете?
Внесите в пробирку зажженную спичку. Что наблюдаете?
-
В пробирку прилили 0,5 мл. раствора карбоната натрия и 0,5 мл. раствора серной кислоты. Запищите наблюдения. Напишите уравнения реакций в молекулярной и ионной формах.
Опыт 3. Реакции протекающие с образованием малодиссоциирующего вещества, или воды.
-
В пробирку прилили 0,5 мл. раствора ацетата свинца и 0,5 мл. раствора соляной кислоты. Что наблюдаете?
-
В пробирку прилили 0,5 мл. раствора гидроксида натрия, 1-2 капли фенолфталеина, потом добавили раствора серной кислоты до образования прозрачного раствора. Запишите и объясните наблюдаемые явления. Напишите все уравнения реакций в молекулярной и ионной формах.
Задания для самостоятельных выводов
1. Какие из реакций идут до конца, если слить растворы следующих солей:
а)нитрата серебра и хлорида бария;
б)карбоната натрия и хлорида бария;
в)нитрата кальция и хлорида бария.
Напишите уравнения реакций в молекулярной и ионной формах.
Тема 1.5 Растворы.
Практическая работа№ 2
Приготовление растворов различных видов концентрации
Формируемая (-ые) компетенция (-и):
ПК 2.1. Планировать собственную деятельность, работу подразделения, смены, участка, бригады, коллектива исполнителей.
ПК 2.2. Обеспечивать выполнение персоналом требований безопасности производства, охраны труда и защиты окружающей среды.
Цель:
-
Научить студентов решению расчетных задач на определение количества вещества для приготовления раствора данной концентрации.
-
Составлять уравнения в молекулярной и ионной формах.
Подготовка к проведению занятия
-
Что называется концентрацией раствора? Назовите виды концентраций.
-
Какая концентрация называется: процентной, молярной, нормальной?
-
Назовите формулы выражения:
процентной концентрации - 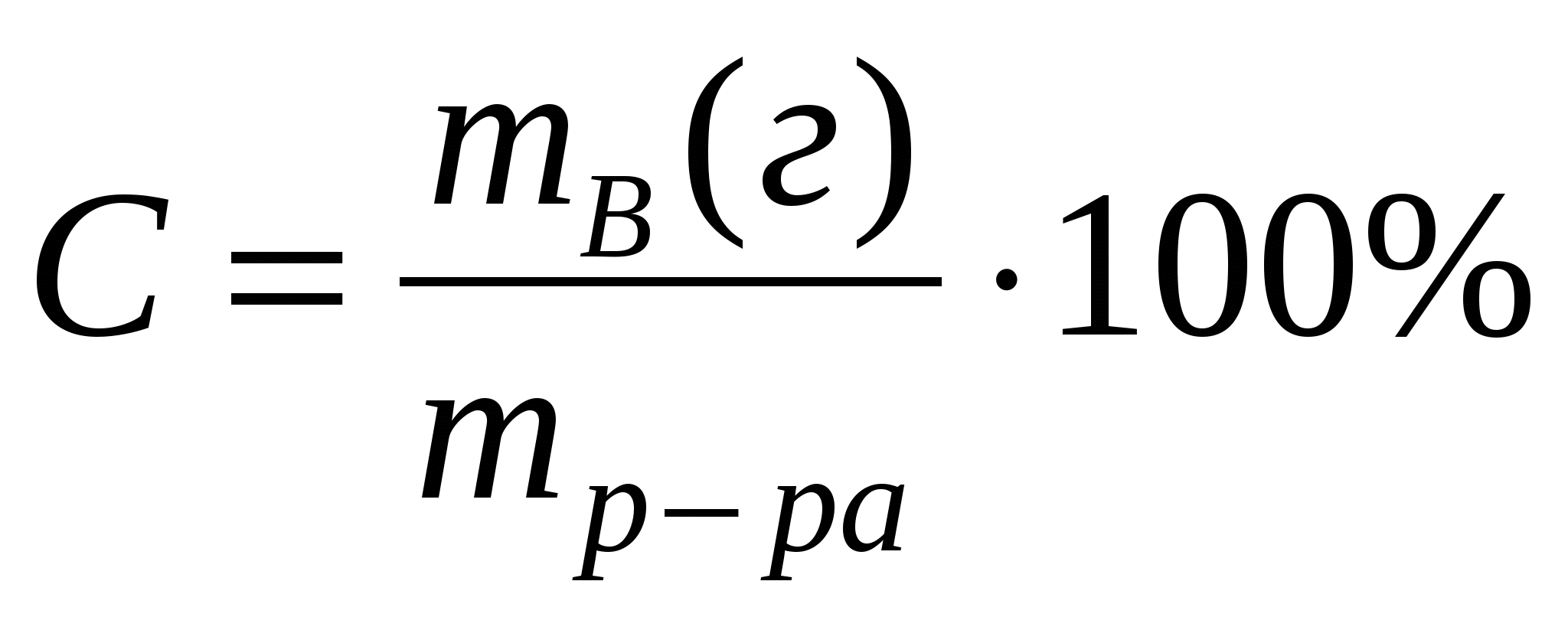
молярной концентрации - 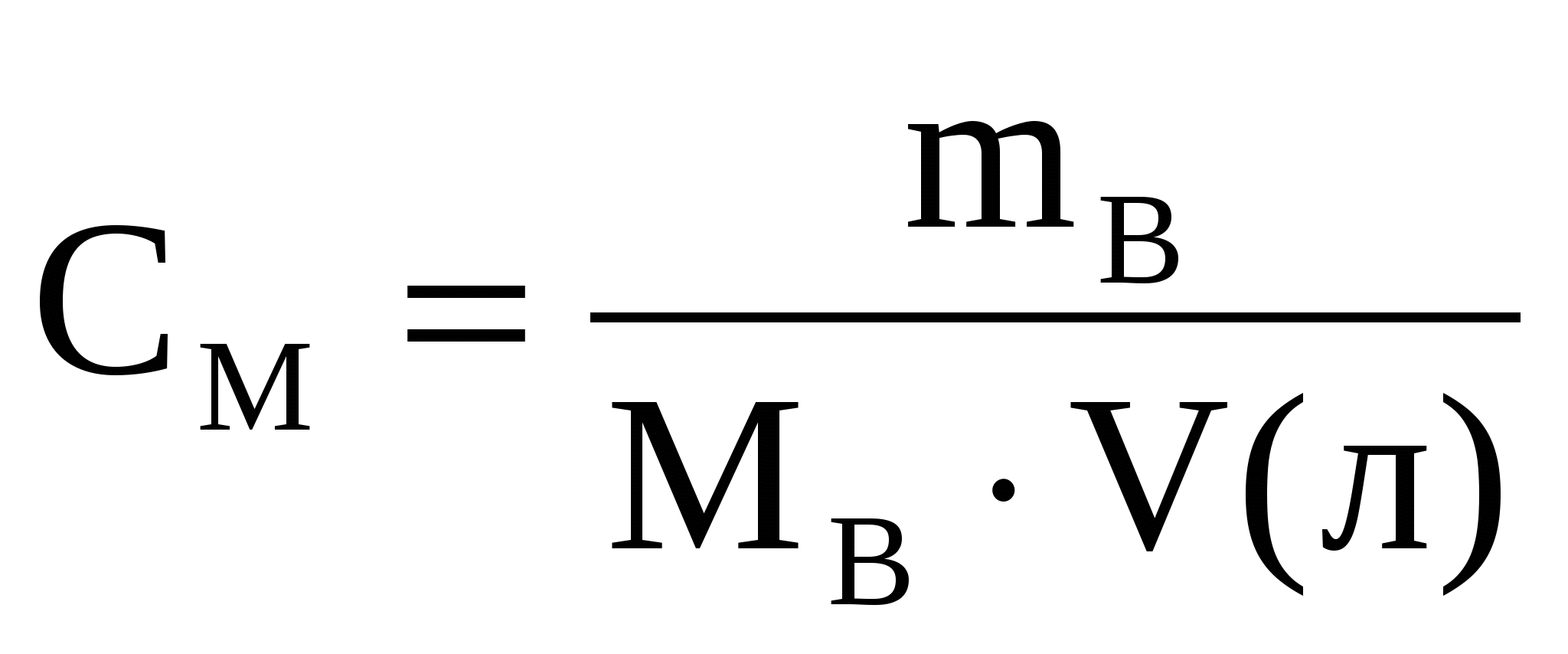 (моль/л)
(моль/л)
нормальной концентрации - 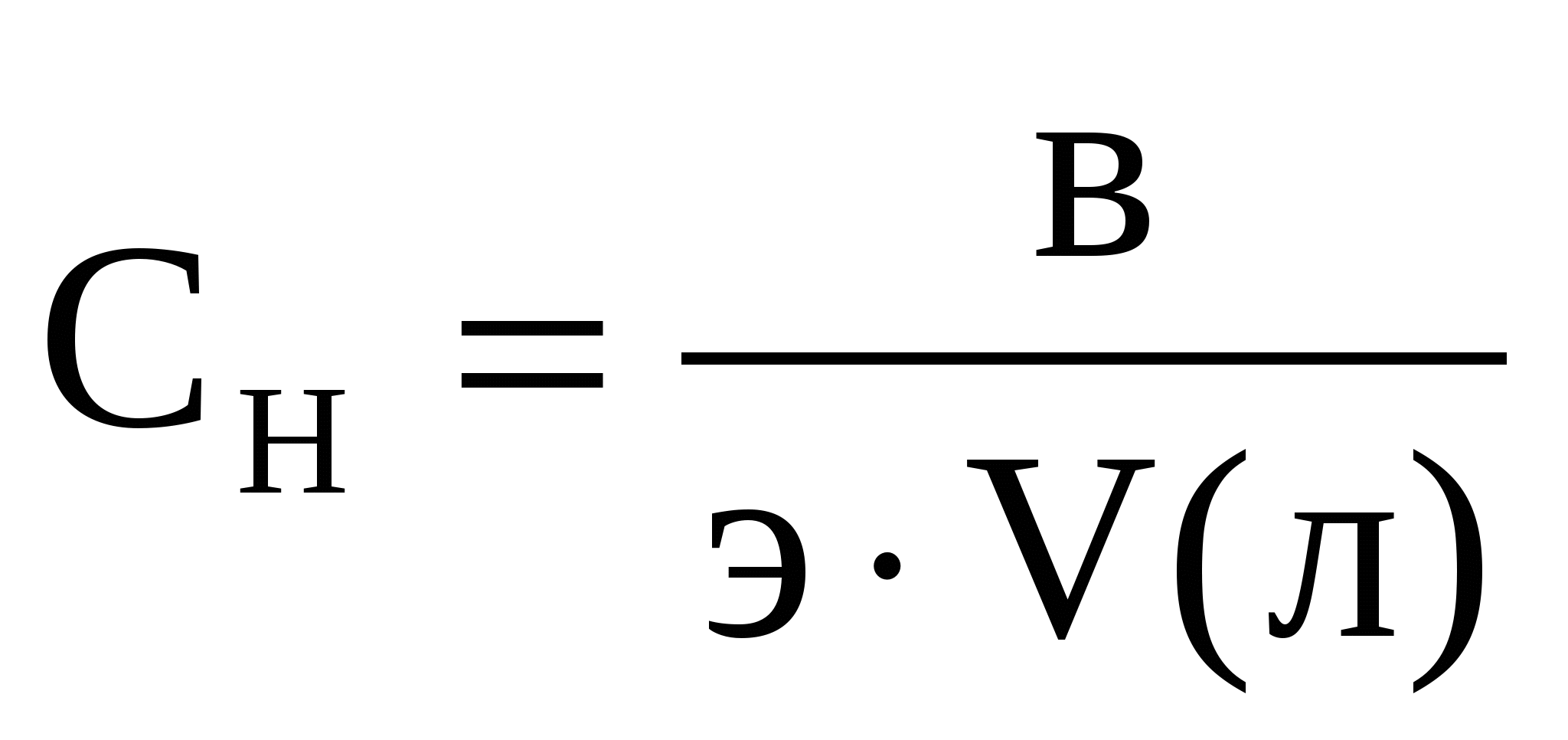 (г-экв./л)
(г-экв./л)
Решение задач
Пример 1. Сколько граммов хлорида калия содержится в 750 г 10-процентного раствора?
Дано:
mр-ра = 750 г
С = 10%
mB-?Решение:
Запишите формулу для определения процентной концентрации в общем виде: 
Из данной формулы найдите массу вещества:

Подставьте данные задачи в формулу:
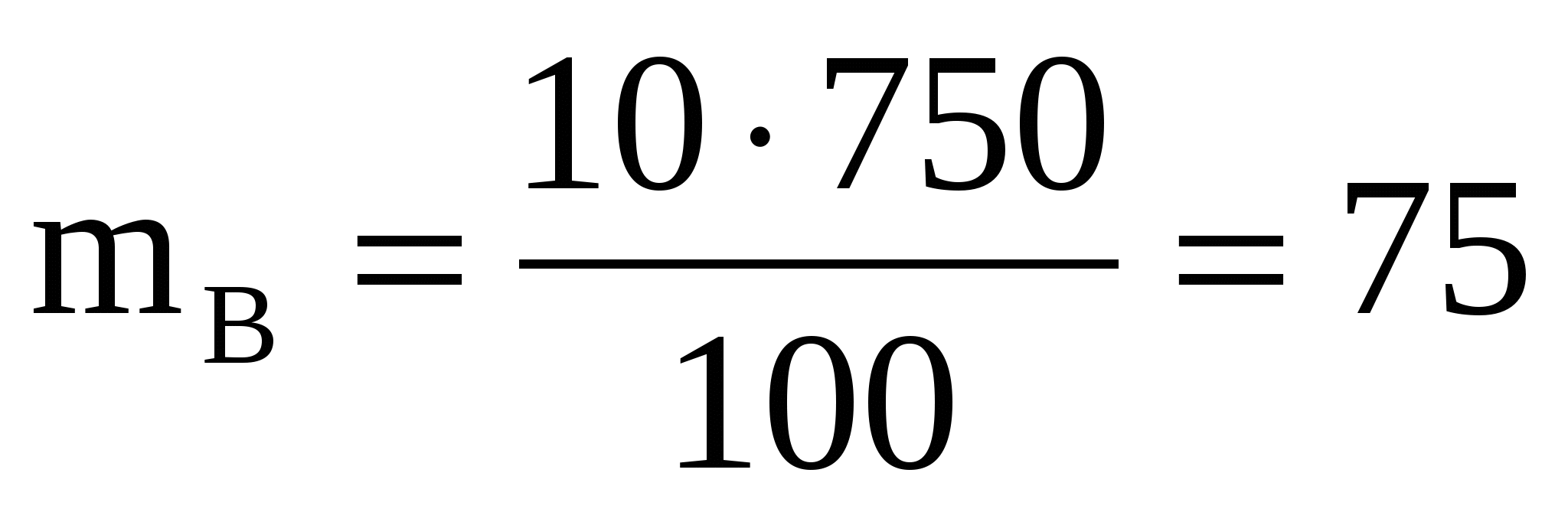 кг
кг
Ответ: 75 г KCl содержится в 750 г 10-процентного раствора.
Пример 2. Сколько граммов хлороводорода содержится в 250 мл 1М раствора соляной кислоты.
Дано:
V =250 мл= 0,25 л
CHCl = 1M
mHCl - ?
Решение:
1. 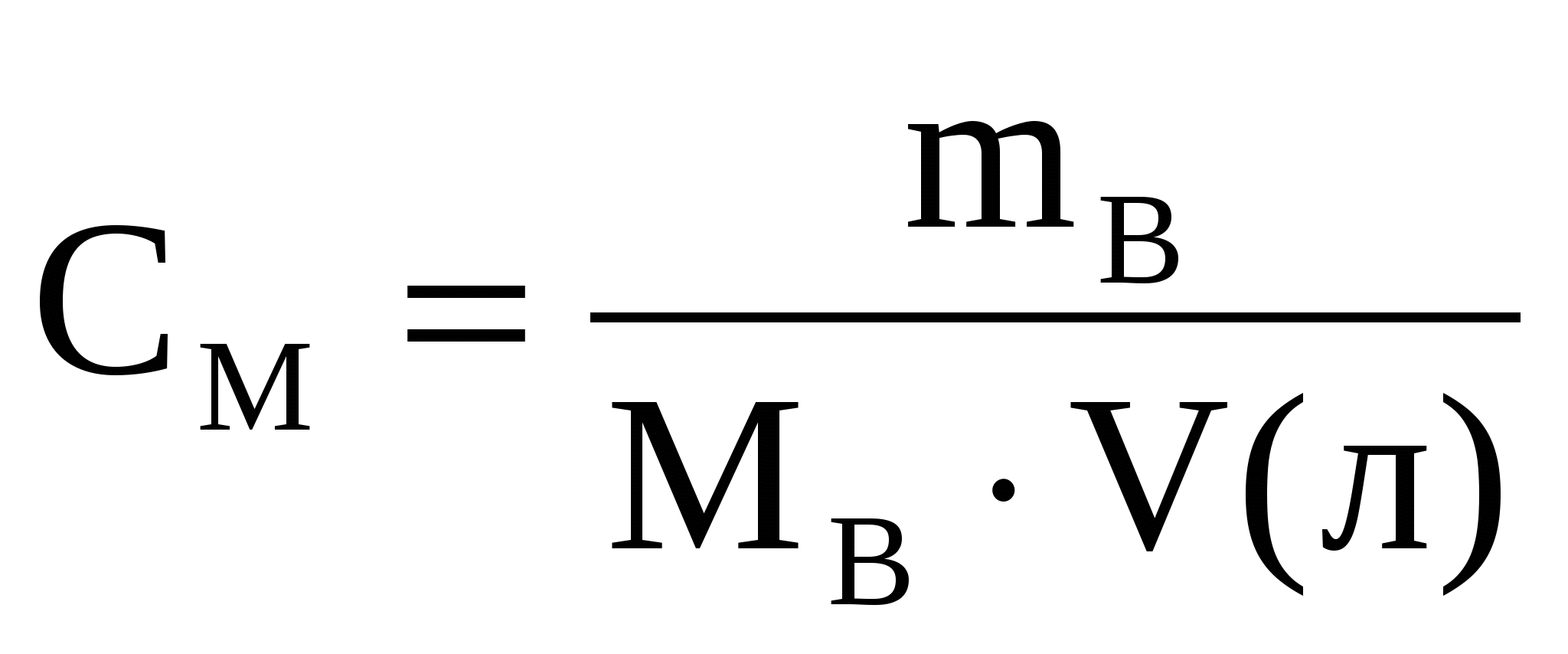
2. МHCl = 1 + 35,5 = 36,5
3.HCl = CM · MB · V = 1· 36,5 · 0,25 = 9,13 г
Ответ: 9,13 г хлороводорода
Пример 3. В каком объеме 1 М раствора серной кислоты содержится 4,9 г H2SO4?
Дано:
С = 1
mB= 4,9 г
V - ?Решение:
1. 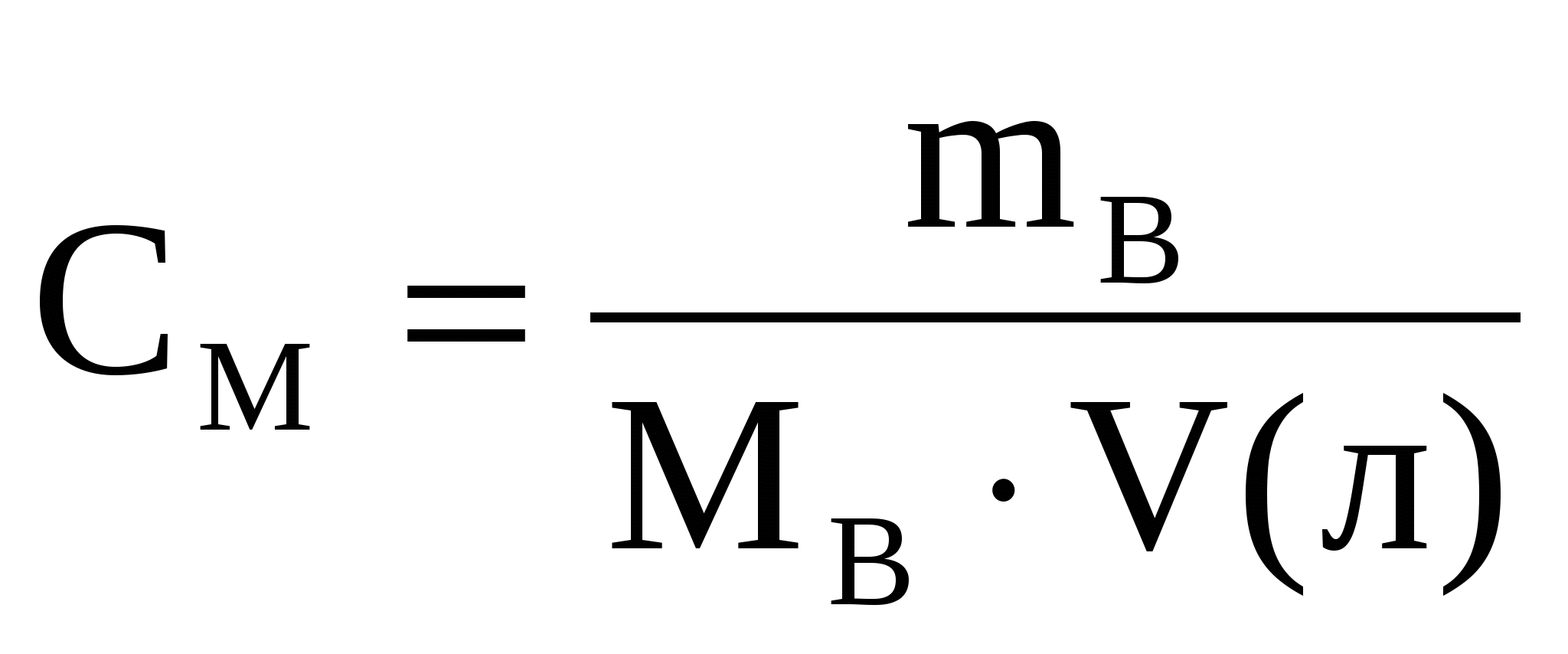
2. 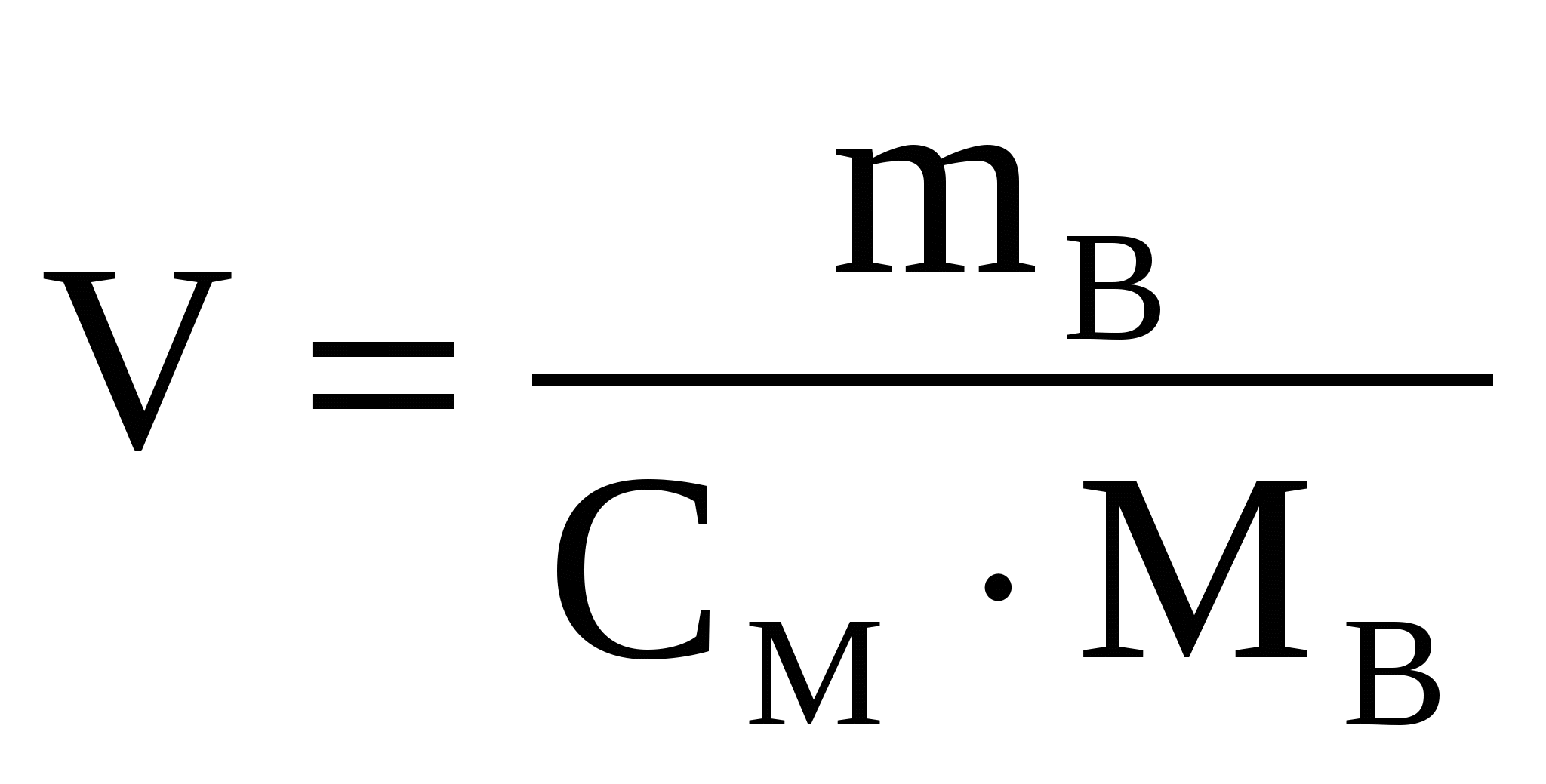
3. 
4. 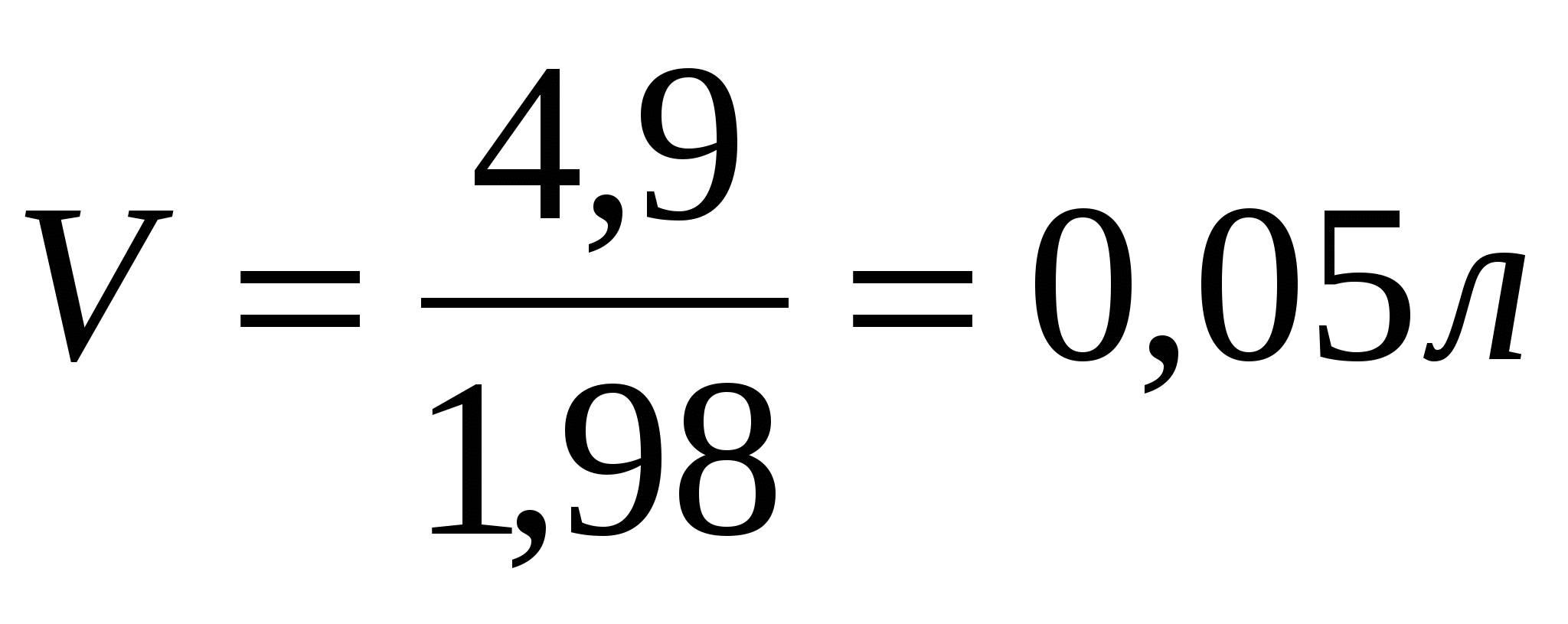
Ответ: 50 мл Н2SO4.
Решить самостоятельно
1. Сколько граммов Н3РО4 потребуется для приготовления 100 мл 0,02Н раствора? Ответ: 0,065 г.
2. Найдите массу AlCl3, необходимую для приготовления 2 л 0,5М и 2 л 0,5Н растворов? Ответ: 133,5 г; 44,5 г.
3. В каком количестве воды следует растворить 2 моля NaCl, чтобы получить 25-процентный раствор? Ответ: 351 г.
4. В каком объеме 0,5Н раствора растворены 3,8 г сульфата железа (II)?
5. При составлении уравнений реакций ионного обмена надо помнить о трех случаях, когда реакции между растворами идут до конца: образование осадка, газа, воды или малодиссоциирующего вещества.
Задание. Составить уравнения реакций в молекулярной и ионной формах, протекающие между растворами:
-
Na3PO4 + AgNO3 →
-
K2CO3 + HCl →
-
NaOH + H2SO4 →
Тема 1.6 Окислительно-восстановительные реакции. Электрохимические процессы.
Лабораторная работа№ 2
Окислительно-восстановительные реакции (ОВР).
Формируемая (-ые) компетенция (-и):
ПК 2.1. Планировать собственную деятельность, работу подразделения, смены, участка, бригады, коллектива исполнителей.
ПК 2.2. Обеспечивать выполнение персоналом требований безопасности производства, охраны труда и защиты окружающей среды.
Цель работы: осуществить сущность окислительно-восстановительной реакции.
Задание по работе: проделать практически ряд окислительно-восстановительных реакций и для каждой из них определить, какой атом или ион является восстановителем и какой окислителем. Определить какое вещество окисляется, а какое восстанавливается
Реактивы и оборудования: пробирки, раствор медного купороса, гранулированный цинк, раствор йодид калия, бромная вода, раствор перманганата калия( KMn04), серная кислота (2Н), свежий приготовленный раствор FeS04 (сульфата железа -II), раствор нитрит натрия( NaN02), раствор К2Сг207
Ход работы.
Вытеснение металла из раствора его солей.
Налейте в пробирку 1 мл раствора медного купороса Положите в эту же пробирку несколько кусочков гранулированного цинка и некоторое время осторожно взболтайте. Что при этом происходит?
Вытеснение галогенов из солей.
К 1 мл раствора йодида калия прилить равный объем бромной воды. Какой цвет имеет раствор йодида калия и раствор брома в воде? Написать уравнения происходящей реакции, составив схему перемещения электронов с подсчетом коэффициентов.
Окислительные свойства перманганата калия.
Взять в пробирку 1 мл раствора KMn04 прибавить 1 мл серной кислоты (2Н) и по каплям свежий приготовленный раствор FeS04 (сульфата железа -II) до изменения цвета раствора
Реакция идет по следующей схеме:
KMn04+ FeS04 +H2S04 = MnS04 + Fe2(SO4)3 + H20 + K2SO4
Подобрать коэффициенты, предварительно составив уравнения электронного баланса
Восстановительные свойства нитрита натрия NaNO2.
В пробирку взять по 1 мл раствора КМп04 и H2S04 (2Н) и по каплям добавлять раствор NaN02 до изменения окраски.
Какой цвет раствора получился?
Реакция идет по следующей схеме:
NaNO2 + KMn04 + H2S04 = NaNO3 + MnS04 + K2S04 + H20
Подобрать коэффициенты, предварительно составив уравнения электронного баланса
Восстановительные свойства йодида калия.
Взять в пробирку по 1 мл растворов KJ, H2S04 и К2Сг207. Наблюдать происходящее явление. Реакция идет по следующей схеме:
KJ + H2S04 + K2Cr207 = J2 + Cr2(S04)3+ K2S04 + H2O
Расставить коэффициенты методом электронного баланса
Упражнения.
Подобрать коэффициенты, предварительно составив схемы перемещения электронов с указанием окислителей и восстановителей для следующих реакций:
-
КСlO3 → KCl + O2
-
Zп +HN03 → Zn(N03)2 +NH4N03 +H2O
-
Р+ HN03 + H2O → Н3Р04 + NO
4 NiS + HNO3 + HCl → NiCl2 + S + NO + H20
Тема 1.6 Окислительно-восстановительные реакции. Электрохимические процессы.
Практическая работа№ 3
Методы составления окислительно-восстановительных реакций.
Формируемая (-ые) компетенция (-и):
ПК 2.1. Планировать собственную деятельность, работу подразделения, смены, участка, бригады, коллектива исполнителей.
ПК 2.2. Обеспечивать выполнение персоналом требований безопасности производства, охраны труда и защиты окружающей среды.
Цель работы: научиться составлять и уравнивать окислительно-восстановительные реакции.
Основные положения:
Окислительно-восстановительные реакции - самые распространенные и играют большую роль в природе и технике. С ними связаны такие процессы как дыхание и обмен веществ в живых организмах, фотосинтез в растениях, круговорот элементов в природе. Они происходят при сгорании топлива, коррозии металлов, лежат в основе металлургических процессов. С их помощью происходит превращение химической энергии в электрическую энергию - в гальванических элементах и аккумуляторах.
Окислительно-восстановительные реакции - реакции, протекающие с изменением степени окисления элементов. Степень окисления - это условный заряд атома элемента в соединении, равный количеству смещенных электронов. Степень окисления может иметь положительное, отрицательное и нулевое значения, которые ставятся над атомом элемента, например: 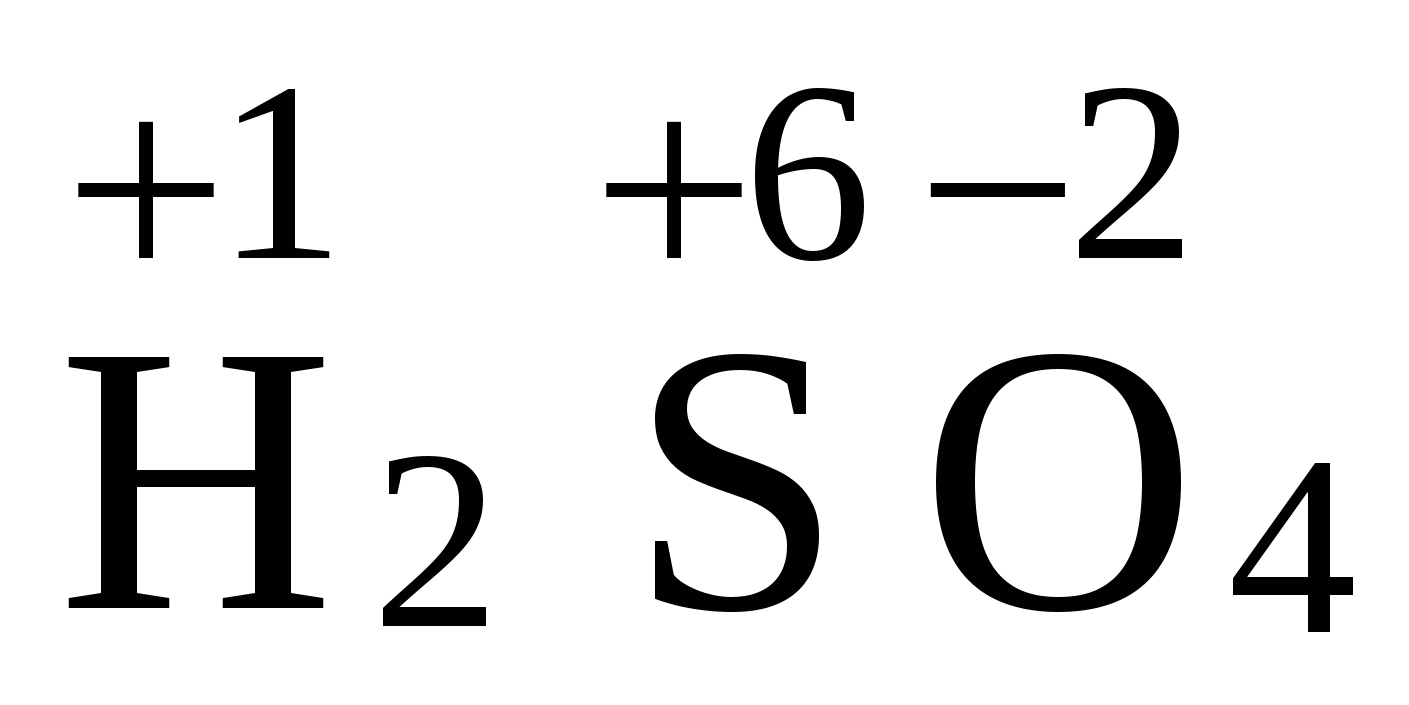 ,
, ![]() . Атомы в молекулахпростых веществ всегда имеют степень окисления равную нулю, например:
. Атомы в молекулахпростых веществ всегда имеют степень окисления равную нулю, например: 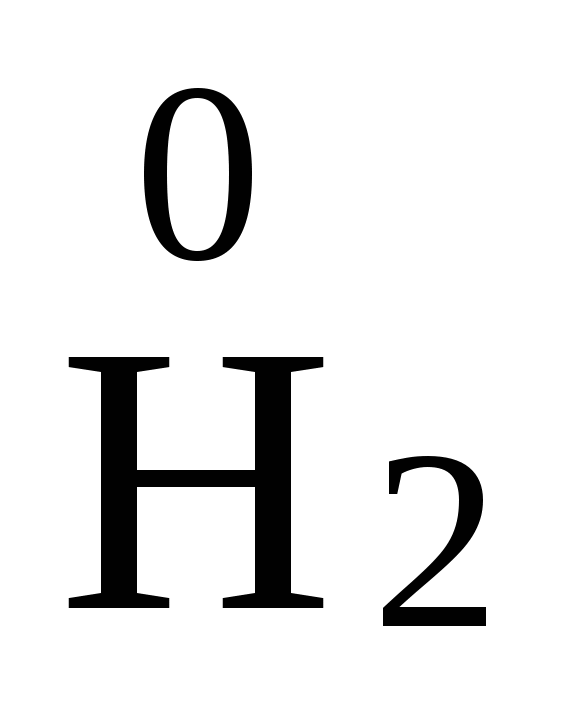 ,
, ![]() ,
, ![]()
Постоянную степень окисления в молекулах сложных веществ имеют:
+1 имеют водород и щелочные металлы (H, Li, Na, K, Rb, Cs);
+2 имеют щелочно - земельные металлы (Be, Mg, Ca, Sr, Ba);
+3 имеет Al;
-1 имеют галогены (F, Cl, Br, J);
-2 имеет O, исключение составляет перекись водорода 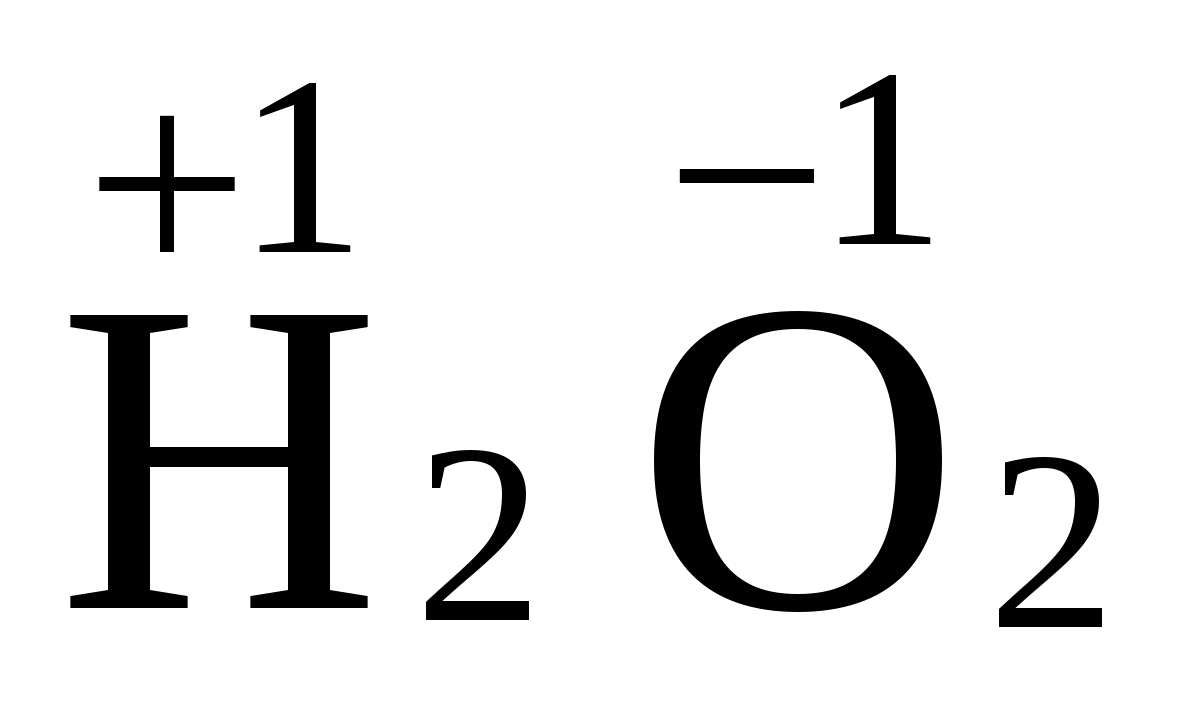 .
.
Степени окисления остальных атомов в сложных соединениях нужно вычислять, учитывая, что сумма степеней окисления всех атомов в соединении равна нулю, а в сложном ионе - заряду иона. Например:
![]()
![]()
(+1)·3 + X + (-2)·4 = 0 X·2 + (-2)·7 = -2
X = +5 X = +6
Теория окисления-восстановления
Окисление - это процесс отдачи электронов:  - 3
- 3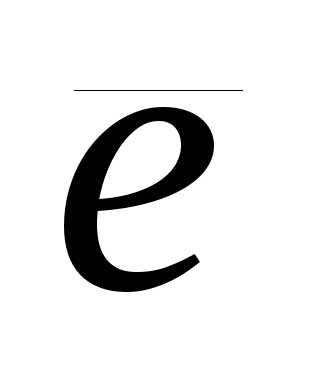


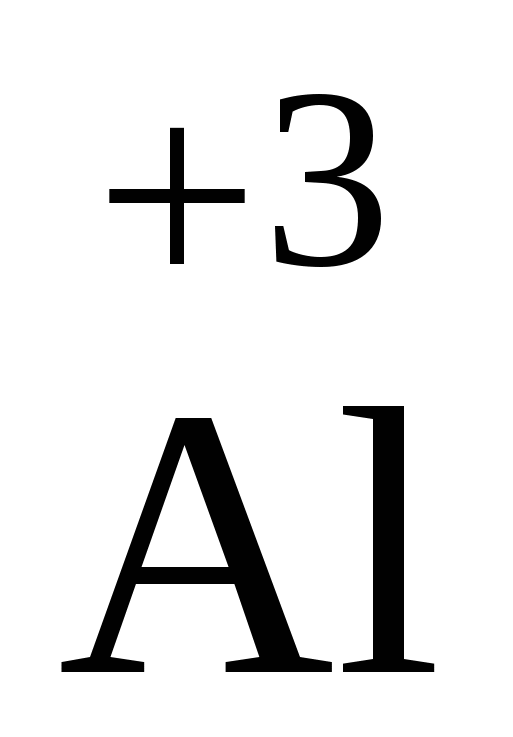
Восстановление - это процесс принятия электронов: 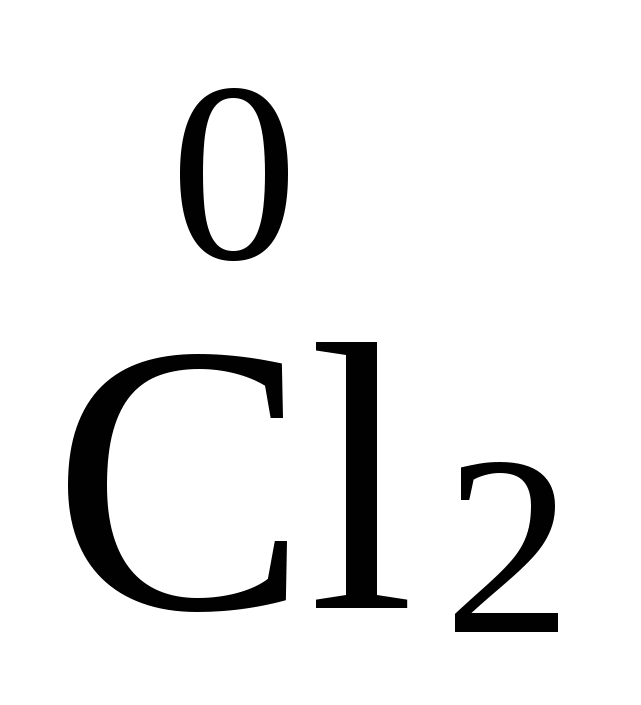 + 2
+ 2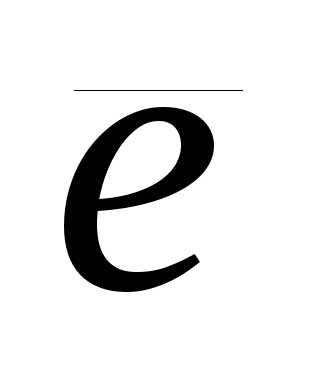
 2Cl−
2Cl−
Вещества, отдающие электроны, называются восстановителями. Вещества, принимающие электроны, называются окислителями.
Окисление всегда связано с восстановлением и наоборот. Число электронов, отдаваемых восстановителем, равно числу электронов, принимаемых окислителем.
Применяют два метода составления окислительно-восстановительных реакций: метод электронного баланса и метод полуреакций.
Метод электронного баланса
-
Составляем схему реакции (исходные вещества и продукты реакции).
H2S + KMnO4 + H2SO4 ![]() S + MnSO4 + K2SO4 + H2O
S + MnSO4 + K2SO4 + H2O
-
Находим два элемента, которые меняют степени окисления (до и после реакции). Для этого определяем наличие простых веществ и исключаем элементы, имеющие постоянную степень окисления. В нашем примере степень окисления меняют марганец Mn и сера S.
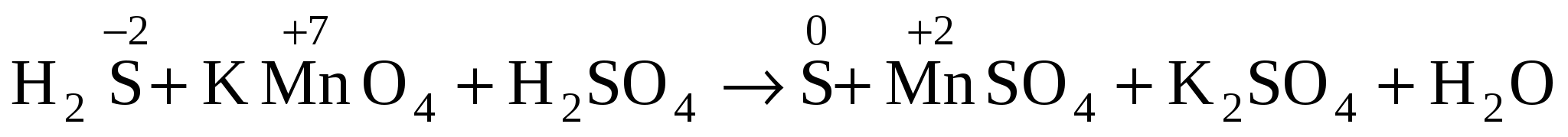
-
Составляем полуреакции окисления и восстановления, уравниваем количество отданных и принятых электронов.
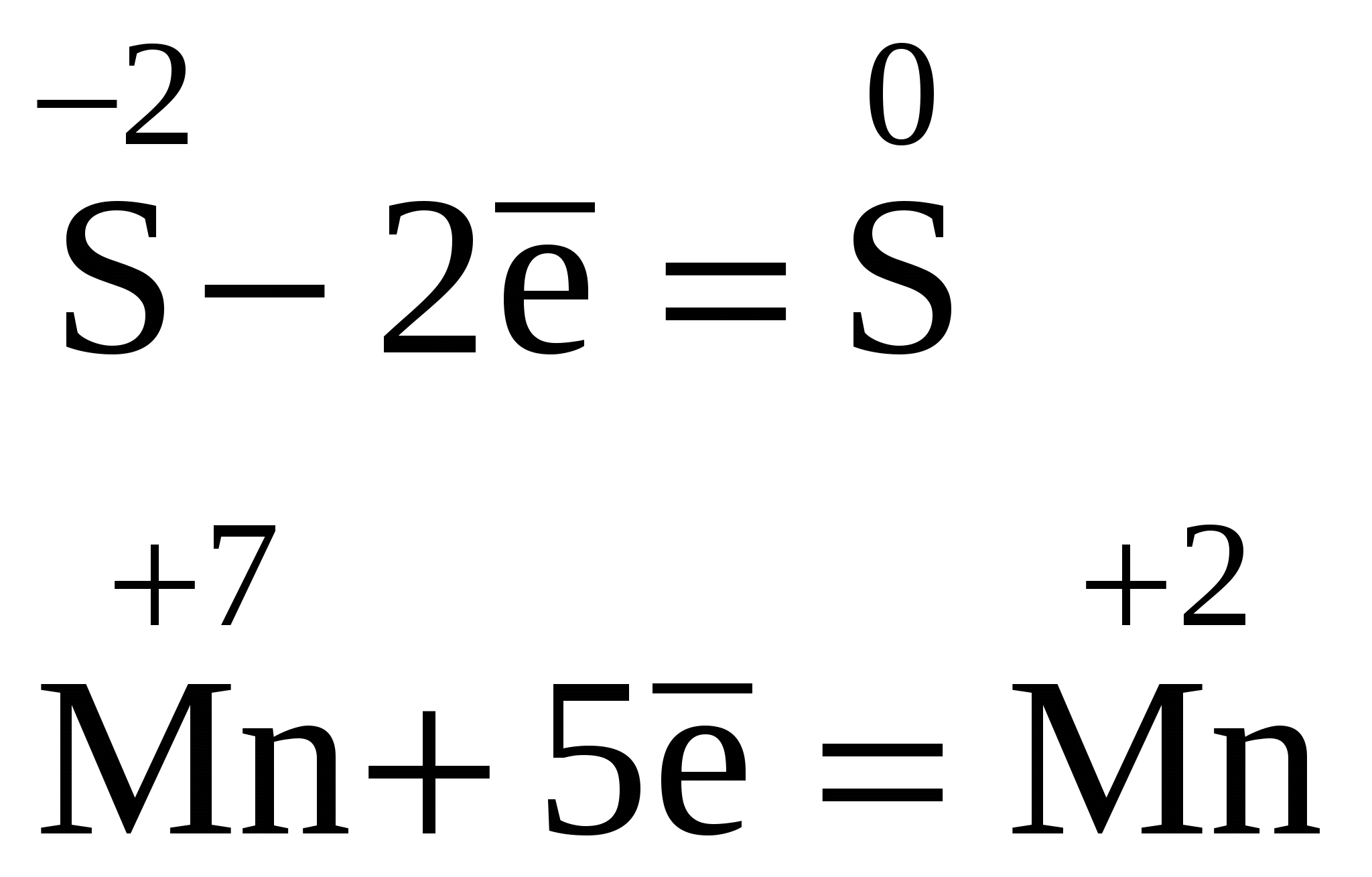
10
-
Подставляем в уравнение реакции найденные коэффициенты 5 и 2 перед восстановителем и окислителем:
5H2S + 2KMnO4 + H2SO4 5S + 2MnSO4 + K2SO4 + H2O
5S + 2MnSO4 + K2SO4 + H2O
-
По числу кислотных остатков в правой части уравнения находим коэффициент для серной кислоты H2SO4 и воды H2O. В продуктах реакции три иона
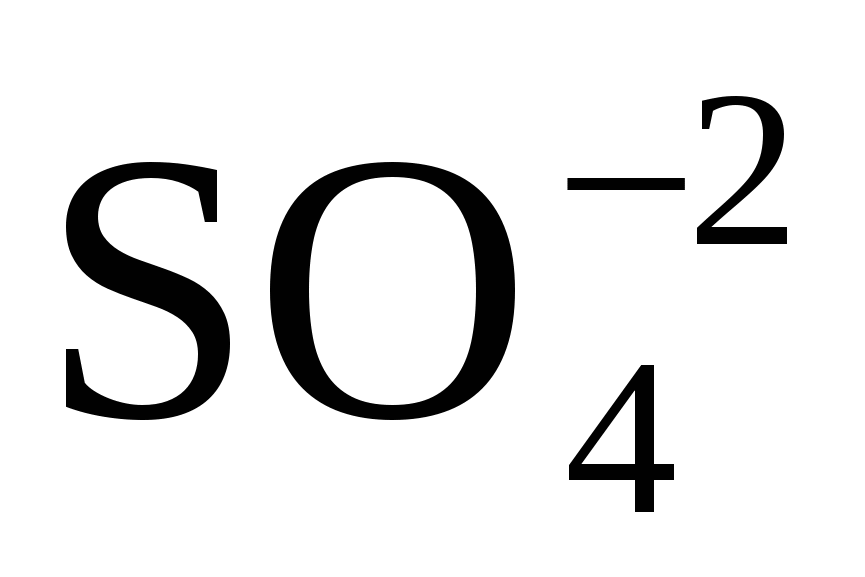 , следовательно, H2SO4 надо взять 3 молекулы. В левой части уравнения 16 атомов водорода, следовательно, надо взять 8 молекул воды. Окончательно уравнение реакции имеет вид:
, следовательно, H2SO4 надо взять 3 молекулы. В левой части уравнения 16 атомов водорода, следовательно, надо взять 8 молекул воды. Окончательно уравнение реакции имеет вид:
5H2S + 2KMnO4 + 3H2SO4 = 5S + 2MnSO4 + K2SO4 + 8H2O
6. Правильность написания уравнения определяем, подсчитав количество атомов одного элемента, например, кислорода O:
в левой части: 2·4 + 3·4 = 20, в правой части: 2·4 + 4 + 8 = 20.
Метод полуреакций (электронно - ионный метод)
Этот метод предпочтителен для составления окислительно-восстановительных реакций в растворах электролитов. При составлении электронно-ионных уравнений сильные электролиты записывают в виде ионов, а слабые электролиты, осадки и газы, - в виде молекул. В ионную схему включают частицы, которые проявляют окислительные и восстановительные свойства, а также частицы, характеризующие среду раствора: кислую - ион H+, щелочную - ион OH─, нейтральную - молекула H2O.
-
Записываем схему реакции:
Na2SO3 + K2Cr2O7 + H2SO4 Na2SO4 + Cr2(SO4)3 + K2SO4 + H2O
Na2SO4 + Cr2(SO4)3 + K2SO4 + H2O
Уравнение в ионном виде:
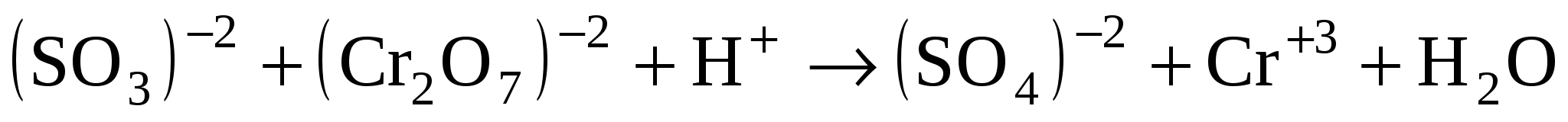
-
Находим два элемента, изменяющих свою степень окисления, и записываем их в виде частиц, в состав которых они входят. Окислителем в этой реакции
является ион 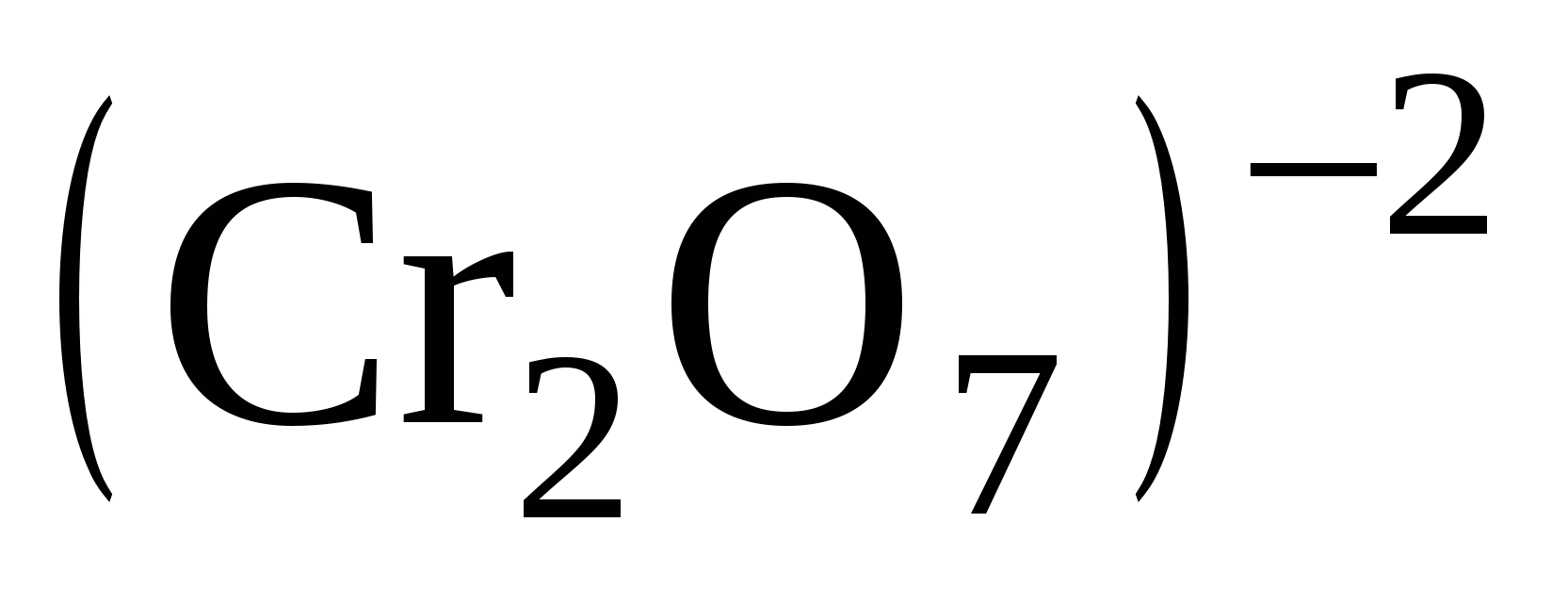 , который превращается в ион Cr+3, а освободившийся
, который превращается в ион Cr+3, а освободившийся
кислород, входящий в состав иона(Cr2O7)─2, вместе с ионом H+ образует воду:
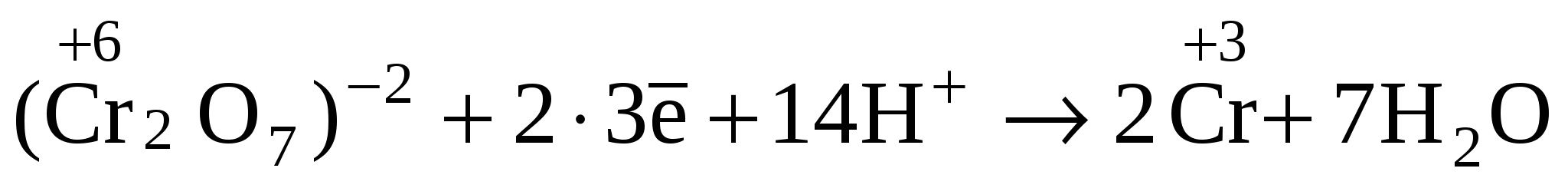
Восстановителем является ион (SO3)─2, который окисляется до иона(SO4)─2.
Получившийся ион (SO4)─2 содержит больше кислорода, чем ион (SO3)─2, поэтому недостающий кислород пополняется за счет молекул воды, при этом освобождаются ионы H+.
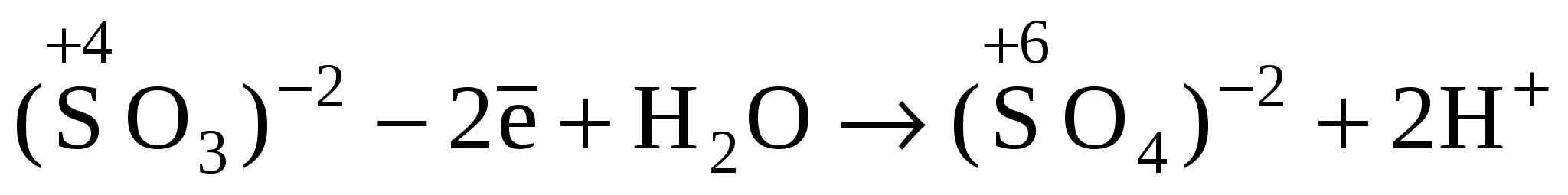
-
Уравниваем количество принятых и отданных электронов, при этом находим коэффициенты для окислителя и восстановителя.
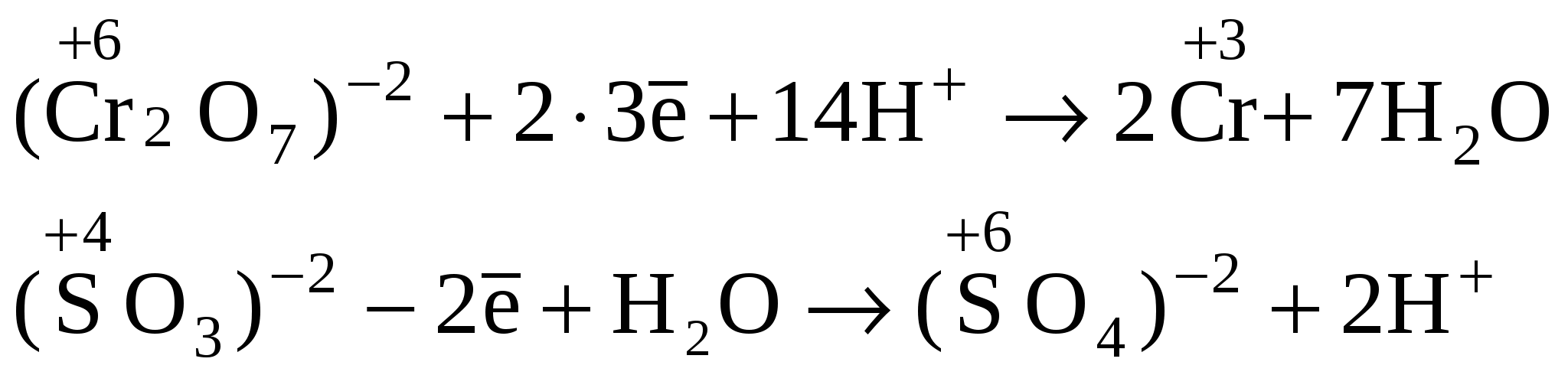
6 
-
Записываем суммарное ионное уравнение с учетом коэффициентов.
(Cr2O7)─2 +14H+ + 3(SO3)─2 + 3H2O  2Cr+3+ 7H2O + 3(SO4)─2 + 6H+
2Cr+3+ 7H2O + 3(SO4)─2 + 6H+
-
Сокращаем одинаковые частицы в левой и правой частях уравнения:
(Cr2O7)-2 +8H+ + 3(SO3)─2 2Cr+3 + 4H2O + 3(SO4)─2
2Cr+3 + 4H2O + 3(SO4)─2
-
По ионному уравнению расставляем коэффициенты в исходном молекулярном уравнении реакции.
3Na2SO3 + K2Cr2O 7+4 H2SO4 = 3Na2SO4 + Cr2(SO4)3 + K2SO4 + 4H2O
Таблица. Важнейшие восстановители и окислители
Восстановители
Окислители
Металлы, водород, уголь
Оксид углерода (II) СО
Сероводород H2S, сульфид натрия Na2S, оксид серы (IV) SO2, сернистая кислота H2SO3 и ее соли, тиосульфат натрия Na2S2O3
Иодоводородная кислота HI, бромоводородная кислота HBr, хлороводородная (соляная) кислота HCl
Хлорид олова (II) SnCl2, сульфат железа (II) МnSO4, сульфат хрома (Ш) Cr2(SO4)2
Азотная кислота HNO2, аммиак NH3, гидразин N2H4, оксид азота (II) NO
Фосфористая кислота H3PO3, ортомышьяковистая кислота Н3AsO3, гексацианоферрат (II) калия K4[Fe(CN)6]
Галогены
Оксид марганца (VII) Mn2O7, оксид марганца (VI) MnO2, перманганат калия KMnO4, манганат калия К2MnO4
Оксид хрома (VI) CrO3, хромат калия К2CrO4, дихромат калия K2Cr2O7
Азотная кислота HNO3
Кислород О2, озон О3, пероксид водорода Н2О2
Серная кислота H2SO4 (конц.), селеновая кислота H2SeO4
Оксид меди (II) СuO, оксид серебра (I) Ag2O, оксид свинца (IV) PbO2
Ионы благородных металлов (Ag+, Au3+ и др.)
Висмутат натрия NaВiO3, персульфат аммония (NH4)2S2O8, гексацианоферрат (III) калия K3[Fe(CN)6], хлорид железа (III) FeCl3
Контрольные вопросы.
-
Что такое степень окисления элемента?
-
Правила расчета степени окисления.
-
Какие реакции являются окислительно-восстановительными?
-
Порядок составления окислительно-восстановительной реакции.
-
Отличие метода электронного баланса от метода полуреакций.
Тема 1.7 Классификация веществ. Простые вещества. Лабораторная работа 3
Получение аммиака, его свойства.
Формируемая (-ые) компетенция (-и):
ПК 2.1. Планировать собственную деятельность, работу подразделения, смены, участка, бригады, коллектива исполнителей.
ПК 2.2. Обеспечивать выполнение персоналом требований безопасности производства, охраны труда и защиты окружающей среды
Цель работы: получить аммиак в лабораторных условиях и изучить его свойства.
Оборудование: лабораторный штатив, сухие пробирки, пробка с газоотводной трубкой, фарфоровая ступка с пестиком, ложки для сыпучих веществ, спиртовка, спички, стеклянные палочки, стакан с водой.
Реактивы: кристаллический гидроксид кальция, кристаллический хлорид аммония, концентрированная соляная, азотная и 20% - я серная кислоты, водный раствор аммиака, раствор ф - ф, раствор хлорида железа (ΙΙΙ).
Задание 1. Получение и сбор аммиака
1. Соберите прибор для получения аммиака.
2. В фарфоровую ступку поместите кристаллический хлорид аммония и кристаллический гидроксид кальция в соотношении 2:1 и разотрите смесь пестиком. Происходит ли образование аммиака при этих условиях? (Опыт удается лучше, если известь слегка влажная).
3. Полученную смесь всыпьте в пробирку (на 1∕5 часть ее объема), которую затем закройте пробкой с газоотводной трубкой и закрепите в штативе так, чтобы дно ее было несколько выше отверстия. На конец газоотводной трубки наденьте пробирку - приемник для собирания аммиака.
4. Пробирку со смесью хлорида аммония и гидроксида кальция прогрейте сначала всю, а затем нагревайте в том месте, находится смесь.
5. Для обнаружения аммиака поднесите влажную фенолфталеиновую бумажку к отверстию пробирки - приемника.
6. Обнаружив аммиак, наполните им пробирку способом вытеснения воздуха.
7. Когда пробирка - приемник наполнится газом, снимите ее с газоотводной трубки и отверстие закройте большим пальцем. Конец газоотводной трубки закройте мокрой ватой.
8. Опустите пробирку - приемник (вверх дном) в стакан с водой и отведите палец от отверстия. Слегка покачивайте пробирку и наблюдайте, как вода поднимается вверх пробирки. Снова закройте отверстие пробирки пальцем (под водой) и выньте пробирку из сосуда.
Задание 2. Изучение свойств аммиака
a) В пробирку налейте 6 - 7 мл водного раствора аммиака и добавьте 1 - 2 капли раствора фенолфталеина. Каков цвет раствора?
b) Смочите стеклянную палочку концентрированной соляной кислотой, другую - концентрированной азотной кислотой. Внесите их поочередно в пробирки с аммиаком. Что вы наблюдайте?
c) Разлейте полученный водный раствор аммиака в воде в две пробирки. В одну пробирку добавьте несколько капель раствора фенолфталеина и осторожно прилейте серную кислоту до исчезновения окраски индикатора. Что вы наблюдайте? Составьте уравнения реакций образования сульфата и гидросульфата аммония.
d) В другую пробирку с раствором аммиака добавьте раствор хлорида железа (ΙΙΙ). Что вы наблюдайте?
Заполните таблицу
Тема 1.7 Классификация веществ. Простые вещества.
Практическая работа 3
Взаимосвязь между классами веществ
Формируемая (-ые) компетенция (-и):
ПК 2.1. Планировать собственную деятельность, работу подразделения, смены, участка, бригады, коллектива исполнителей.
ПК 2.2. Обеспечивать выполнение персоналом требований безопасности производства, охраны труда и защиты окружающей среды
Цель:
-
знать теорию электролитической диссоциации и иметь понятие о современной теории кислот и оснований; состав, названия и характерные свойства основных классов неорганических соединений;
-
уметь записывать реакции ионного обмена; составлять полные и сокращенные ионные уравнения; генетические ряды, образованные классами неорганических веществ.
Контрольные вопросы.
-
Какие вещества относятся к электролитам? Что называется электролитической диссоциацией?
-
Какие реакции называются реакциями ионного обмена?
-
Какие существуют условия течения реакций ионного обмена до конца?
-
Что такое кислоты, основания и соли с точки зрения теории электролитической диссоциации?
Рекомендации к выполнению работы.
-
Помните, что процесс диссоциации обратимый.
-
Ступенчато могут диссоциировать многоосновные кислоты, многовалентные основания, кислые и основные соли.
-
При составлении уравнений реакции ионного обмена:
а)составить молекулярное уравнение реакции, проверить составление формул по валентности, расставить коэффициенты в левой и правой частях уравнений реакции;
б) установите, идет ли реакция до конца;
в) напишите полное ионное уравнение реакции;
г)исключите из уравнения реакции ионы, не принимающие участия в реакции;
д)напишите сокращенное ионное уравнение реакции.
Выполнение работы.
-
Напишите уравнения полной диссоциации в водных растворах следующих электролитов: НСlO3, HBr, NaOCl, KH2P04, NaOH, Са(ОН)2, NH4OH, Fe2(S04)3, Ca(N03)2, (NH4)2C03, Mg(OH)2, NO3, KC03.
-
Напишите молекулярные и ионные уравнения реакций между растворами:
а)гидроксида калия и серной кислотой;
б)нитрата алюминия и гидроксида натрия;
в)карбоната натрия и фосфорной кислотой;
г)сульфатом аммония и гидроксидом натрия.
-
При помощи каких реакций можно осуществить следующие превращения? Напишите уравнения реакций в молекулярной и ионной формах:
a) FeSО4 → Fe(OH)2 → Fe(N03)2 → Zn(NQ3)2 → Zn(OH)2 → Na2Zn02;
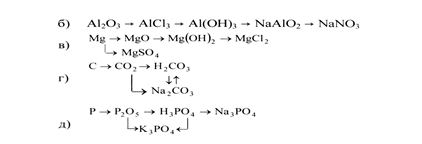
-
С какими из перечисленных веществ будет реагировать соляная кислота: гидроксид кальция, алюминий, карбонат натрия, серебро, оксид магния, ртуть? Напишите молекулярные и ионные уравнения возможных реакций.
-
Как, имея в своем распоряжении сульфат натрия, соляную кислоту и гидроксид бария, можно получить хлорид натрия? Напишите молекулярные и сокращенные ионные уравнения реакций.
Тема 1.8 Химия элементов.
Практическая работа 4
Получение гидроксида алюминия и цинка и исследование их свойств.
Формируемая (-ые) компетенция (-и):
ПК 2.1. Планировать собственную деятельность, работу подразделения, смены, участка, бригады, коллектива исполнителей.
ПК 2.2. Обеспечивать выполнение персоналом требований безопасности производства, охраны труда и защиты окружающей среды
Цель:
-
Научиться получать гидроксиды алюминия и цинка
-
Изучить химические свойства гидроксидов алюминия и цинка.
-
Развивать умения составлять молекулярные, ионные уравнения реакций, подтверждающие химические свойства гидроксидов алюминия и цинка.
Реактивы и оборудование: 1 М раствор соли алюминия (например, Al2(SO4)3), 1М раствор гидроксида натрия NaOH, 1М раствора H2SO4, 1М раствора соли цинка (например, ZnSO4), пробирки
Выполнение работы.
Опыт 1. Получение гидроксида алюминия и его свойства
Выполнение опыта
Налить в 2 пробирки по 4-5 капель 1М раствора соли алюминия (например, Al2(SO4)3). Прибавить в обе пробирки по по 4-5 капель 1М раствора гидроксида натрия NaOH. Наблюдать образование осадка. Затем в первую пробирку добавить 6-7 капель 1М раствора NaOH, а во вторую - 6-7 капель 1М раствора H2SO4.
Запись наблюдений и результатов опыта
1. Записать наблюдения.
2. Написать уравнения протекающих реакций.
3. Записать вывод о кислотно-основных свойствах гидроксида алюминия.
Опыт 2. Получение гидроксида цинка и его свойства
Выполнение опыта
Налить в 2 пробирки по 6-8 капель 1М раствора соли цинка (например, ZnSO4). Прибавить в обе пробирки по 2 капли 1М раствора гидроксида натрия NaOH. В первую пробирку добавить избыток 1М раствора NaOH, а во вторую - избыток 1М раствора H2SO4.
Запись наблюдений и результатов опыта
1. Записать наблюдения.
2. Написать уравнения протекающих реакций.
3. Записать вывод о кислотно-основных свойствах гидроксида цинка.
Тема 1.8 Химия элементов.
Практическая работа 5
Свойства гидроксидов железа и окислительные свойства хроматов.
Формируемая (-ые) компетенция (-и):
ПК 2.1. Планировать собственную деятельность, работу подразделения, смены, участка, бригады, коллектива исполнителей.
ПК 2.2. Обеспечивать выполнение персоналом требований безопасности производства, охраны труда и защиты окружающей среды
Цель:
-
Научиться получать гидроксиды железа (II и III).
-
Изучить химические свойства гидроксидов железа и хроматов.
-
Развивать умения составлять молекулярные, ионные, окислительно-восстановительные уравнения реакций, подтверждающие химические свойства гидроксидов железа и хроматов калия.
Реактивы и оборудование: растворы сульфата железа (II), хлорида железа (III), гидроксида натрия, серной и соляной кислот, хромата калия, штатив с пробирками.
Контрольные вопросы.
-
Какие гидроксиды образует железо? Каковы их физические свойства?
-
Как получают лабораторным путем нерастворимые в воде основания или гидроксиды?
-
Что такое хроматы? Какую степень окисления имеет хром в хромате калия?
Выполнение работы.
Опыт 1. Получение гидроксида железа (II) и превращения его в гидроксид железа (III).
В пробирку налейте 1мл., раствора сульфата железа (II), добавьте несколько капель раствора гидроксида натрия. Что наблюдаете?
Разделите полученный осадок с раствором в две пробирки. Одну из них оставьте для следующего опыта, другую энергично встряхиваете некоторое время. Что наблюдаете?
Напишите уравнения: а) взаимодействия сульфата железа (II) с гидроксидом натрия в молекулярной и ионной формах;
б) окисления влажного гидроксида железа (II) на воздухе в гидроксид железа (III).
Опыт 2. Изучение основных свойств гидроксида железа (II).
К полученному в предыдущем опыте гидроксиду железа (II) прилейте несколько капель соляной кислоты до растворения осадка. Какие свойства проявляет гидроксид железа (II)?
Напишите уравнения реакции в молекулярной и ионной формах.
Опыт 3.Получение гидроксида железа (III) при действии щелочи на раствор соли.
В пробирку к 3-4 каплям раствора хлорида железа (III) прилейте 1 - 2 капли раствора гидроксида натрия. Запишите наблюдения.
Напишите уравнения реакций в молекулярной и ионной формах.
Опыт 4. Изучение основных свойств гидроксида железа (III).
К полученному в предыдущем опыте гидроксиду железа (III) прилейте несколько капель серной кислоты до растворения осадка. Запишите наблюдения.
Напишите уравнения реакций в молекулярной и ионной формах.
Опыт 5. Окисление сульфата железа (II) хроматом калия.
В пробирку к 4-5 каплям раствора хромата калия добавьте 2-3 капли раствора серной кислоты и 4-5 капли раствора сульфата железа (II). Что наблюдаете?
Напишите уравнение реакции окисления сульфата железа (II) хроматом калия в кислой
среде.
Расставьте коэффициенты методом электронного баланса, укажите восстановитель и окислитель.
Задания для самостоятельных выводов.
-
Как получают гидроксиды железа (II) и (III)?
-
Какими химическими свойствами обладают гидроксиды железа?
-
Что происходит на воздухе влажного гидроксида железа (II)?
-
Почему хромат калия обладает окислительными свойствами?
3 Литература
Основные источники:
1.Габриелян, О.С. Химия для профессий и специальностей технического профиля [Текст] : учебник / О.С. Габриелян, И.Г. Остроумов. - 2-е изд., стер. - М.: Издательский центр «Академия», 2011.
2.Габриелян, О.С. Химия. 11 класс. Профильный уровень [Текст] : учеб. для общеобразоват. Учреждений / О.С. Габриелян, Г.Г. Лысова. - 13-е изд., стереотип. - М. : Дрофа, 2011.
3.Габриелян О.С. Практикум по общей, неорганической и органической химии [Текст]: учеб. Пособие для студ. Проф. Учеб. Заведений / Габриелян О.С., Остроумов И.Г., Дорофеева М.М.- М., 2007
Дополнительные источники:
1.Ерохин, Ю.М. Химия [Текст] : учеб. для сред. проф. учеб. заведений / Юрий Михайлович Ерохин. - 4-е изд., стер. - М.: Издательский центр «Академия», 2004.
2.Ерохин Ю.М., Фролов В.И. Сборник задач и упражнений по химии (с дидактическим материалом) [Текст]: учеб. Пособие для студентов средн. Проф. Завед. - М., 2004.
3.Габриелян О.С., Лысова Г.Г. Химия в тестах, задачах и упражнениях [Текст]: учеб. Пособие/ О.С. Габриелян, П.Н. Березкин, А.А Ушакова. - 5 изд., стереотип. - М.: Дрофа, 2008.
Интернет- ресурс: «Основы неорганической химии» [Электронный ресурс] // химия. - Режим доступа: InternetUrok.ru


