- Преподавателю
- Химия
- МЕТОДИЧЕСКИЕ УКАЗАНИЯ к лабораторным и практическим занятиям по дисциплине ХИМИЯ для специальности 270843 Монтаж, наладка и эксплуатация электрооборудования промышленных и гражданских зданий
МЕТОДИЧЕСКИЕ УКАЗАНИЯ к лабораторным и практическим занятиям по дисциплине ХИМИЯ для специальности 270843 Монтаж, наладка и эксплуатация электрооборудования промышленных и гражданских зданий
| Раздел | Химия |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Тихонова Т.В. |
| Дата | 05.05.2015 |
| Формат | docx |
| Изображения | Есть |
Министерство образования и науки Самарской области
Государственное бюджетное образовательное учреждение
среднего профессионального образования
Самарский техникум промышленных технологий
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
к лабораторным и практическим занятиям
по дисциплине ХИМИЯ
для специальности
270843 Монтаж, наладка и эксплуатация электрооборудования промышленных и гражданских зданий
Самара
2012
ОДОБРЕНЫ
Предметно-цикловой комиссией ______________________
_____________________________
_____________________________
Протокол №___от ________2012 г.
Председатель ПЦК
______________/И.О. Фамилия/
Составлены в соответствии с Государственными требованиями к минимуму содержания и уровню подготовки выпускника по специальности 270843
Организация-разработчик
ГБОУ СПО Самарский техникум промышленных технологий
Разработчик Тихонова Татьяна Васильевна, преподаватель ГБОУ СПО СТПТ
Экспертизу выполнила
Сомова Вера Яковлевна, методист ГБОУ СПО СТПТ
Методические указания к лабораторным и практическим занятиям по дисциплине химия разработаны в соответствии с «Рекомендациями по реализации образовательной программы среднего (полного) общего образования в образовательных учреждениях начального профессионального и среднего профессионального образования в соответствии с федеральным базисным учебным планом и примерными учебными планами для образовательных учреждений Российской Федерации, реализующих программы общего образования» (письмо Департамента государственной политики и нормативно-правового регулирования в сфере образования Минобрнауки России от 29.05.2007 № 03-1180);
- на основе примерной программы учебной дисциплины Химия для специальностей среднего профессионального образования, одобренной ФГУ «Федеральный институт развития образования» «10» апреля 2008 г. и утвержденной Департаментом государственной политики и нормативно-правового регулирования в сфере образования Минобрнауки России «16» апреля 2008 г.;
- на основе Федерального государственного образовательного стандарта среднего профессионального образования по специальности 270843 Монтаж, наладка и эксплуатация электрооборудования промышленных и гражданских зданий;
- на основе рабочей программы учебной дисциплины Химия, разработанной преподавателем Тихоновой Т.В.
Организация-разработчик
ГБОУ СПО Самарский техникум промышленных технологий
Разработчик Тихонова Татьяна Васильевна, преподаватель ГБОУ СПО СТПТ
Экспертизу выполнила
Сомова Вера Яковлевна, методист ГБОУ СПО СТПТ
Выполнение лабораторных и практических работ направлено на: обобщение, систематизацию и углубление теоретических знаний по конкретным темам дисциплины; формирование умений применять полученные знания на практике; развитие аналитических умений; выработку таких профессионально значимых качеств как самостоятельность, ответственность, творческая инициатива.
ОБЩИЕ ПРАВИЛА РАБОТЫ В ХИМИЧЕСКОЙ ЛАБОРАТОРИИ
Лабораторные и практические работы по химии проводятся в специально оборудованном химическом кабинете. Выполнение работ связано с использованием оборудования, химической посуды и реактивов, способных нанести травмы при неумелом обращении. Поэтому учащиеся должны с первых дней приучаться к аккуратной и внимательной работе, строгому соблюдению правил техники безопасности
1. Рабочее место содержите в чистоте и порядке, не загромождайте его посторонними предметами.
2. Не допускайте попадания химических реактивов на кожу и одежду. Нельзя брать вещества руками и пробовать на вкус
3. Не уносите на свои рабочие места реактивы общего пользования. Если нет указаний по дозировке реактивов для данного опыта, то берите их в минимальном количестве.
4. Запрещается пользоваться реактивами без этикеток или с сомнительными этикетками.
5. Во всех опытах используйте дистиллированную воду. Сухие реактивы берите только чистым шпателем. Не путайте пробки от склянок с различными реактивами. Излишки реактивов не высыпайте и не выливайте в склянки, из которых они взяты.
6. Особую осторожность соблюдайте при работе ядовитыми и вредными веществами, с концентрированными кислотами и щелочами. Работать с ними следует в вытяжном шкафу.
7. При нагревании жидкости в пробирке необходимо держать ее так, чтобы в случае разбрызгивания жидкость не попала на самого экспериментатора и рядом работающих студентов, т.е. отверстие пробирки должно быть направлено в сторону от себя и товарищей. Лучше всего направить его на стенку вытяжного шкафа. Не забывайте пользоваться при этом держателем.
8. После опытов остатки реактивов сливайте в раковину после разбавления водой. Металлы собирайте в отведенную для этого склянку. Остатки агрессивных и дорогостоящих реактивов собирайте в специальные склянки.
9. Не трогайте, не включайте и не выключайте без разрешения рубильники и электрические приборы.
10. В лаборатории соблюдайте тишину, не занимайтесь посторонними делами, не проводите опыты, не относящиеся к данной лабораторной работе и не описанные в методическом указании.
Студентам следует заранее готовиться к лабораторному занятию. Выполнению лабораторной работы предшествует собеседование с преподавателем. Подготовку рекомендуется начинать с изучения теоретического материала, относящегося к данной работе. Необходимо твердо усвоить основные теоретические положения, законы и их математические выражения.
Перед выполнением работы следует ознакомиться с методикой проведения эксперимента, изучить принцип действия приборов и установок, понять цель работы. При выполнении лабораторной работы внимательно следите за ходом опыта. В случае неудачной постановки опыта, прежде чем его повторить, установите причину неудачи. После окончания работы необходимо вымыть посуду, привести в порядок рабочее место.
За чистоту и порядок на рабочем месте отвечает студент, а в лаборатории - дежурный студент. Дежурный принимает рабочее место у студентов, закончивших выполнение лабораторной работы, и сдает лабораторию лаборанту. Кроме того, дежурный студент должен получить у лаборанта все необходимое для проведения данной лабораторной работы, а после окончания занятия - сдать. После выполнения лабораторной работы студент должен оформить отчет и сдать его преподавателю.
Отчет должен содержать следующие сведения:
1. Название работы и дату ее выполнения.
2. Цель работы.
3. Номер и название опыта.
4. Краткое описание хода работы с указанием условий проведения опыта.
5. Рисунки и схемы используемых приборов,
6. Наблюдения и уравнения реакций.
7. Расчеты, таблицы, графики.
8. Выводы. Ответа на контрольные вопросы.
Если в лабораторных работах необходимо проводить расчеты. Следует иметь в виду, что излишняя точность в расчетах, значительно превышающая экспериментальную погрешность, не повышает точность результата. Для числовых значений рассчитываемых величин достаточно 3-4 значащие цифры (число знаков, стоящих после предшествующих им нулей). Число значащих цифр не следует путать с числом знаков после запятой. Так в числах: 101,3; 21,73; 0,4385; 0,004500 имеется четыре значащих цифры. В расчетах принято указывать значащие цифры и в том случае, когда это нули, стоящие в конце числа. Поэтому правильной будет запись с точностью до четвертой значащей цифры - 0,2500, а не 0,25.
Результаты измерений неизбежно будут отклоняться от истинных значений соответствующих величин. Для определения ошибки необходимо получить 4-5 параллельных результатов измерений и найти среднее арифметическое значение, которое будет больше всего приближаться к истинному значению.
При обработке результатов следует определять абсолютную и относительную ошибку измерения данной величины.
Абсолютная ошибка показывает, на сколько данная измеряемая величина больше или меньше истинной величины
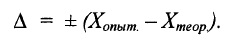
Отношение абсолютной ошибки к истинной величине, умноженное на 100 %, дает относительную ошибку определения (в процентах) или погрешность:
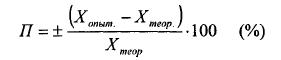
Если результаты измерений необходимо представить в виде графика, то чертеж необходимо выполнять на миллиметровой бумаге и вклеить его в отчет. Оси координат располагают на расстоянии 2 - 2,5 см от края листа. Около осей указывают буквенные обозначения величин и их единиц измерений. Масштаб выбирают так, чтобы кривая полученной зависимости занимала почти всю площадь графика и не прижата к одной из осей координат. Против делений ставят числовые значения измеряемой величины. Кривую проводят через точки, руководствуясь не только их расположением, но и теоретическими соображениями о виде полученной зависимости. Если исследуемая зависимость должна быть линейна, то проводят прямую линию, так чтобы большинство точек приближались к этой линии. Экспериментальные точки могут несколько отклоняться от нее из-за погрешности эксперимента.
-
Лабораторная химическая посуда
В химической лаборатории очень часто приходится работать с посудой из стекла и фарфора. Лабораторную посуду можно подразделить на следующие виды:
1. посуду общего назначения;
2. посуду специального назначения;
3. мерную посуду;
4. фарфоровую посуду.
-
Посуда общего назначения
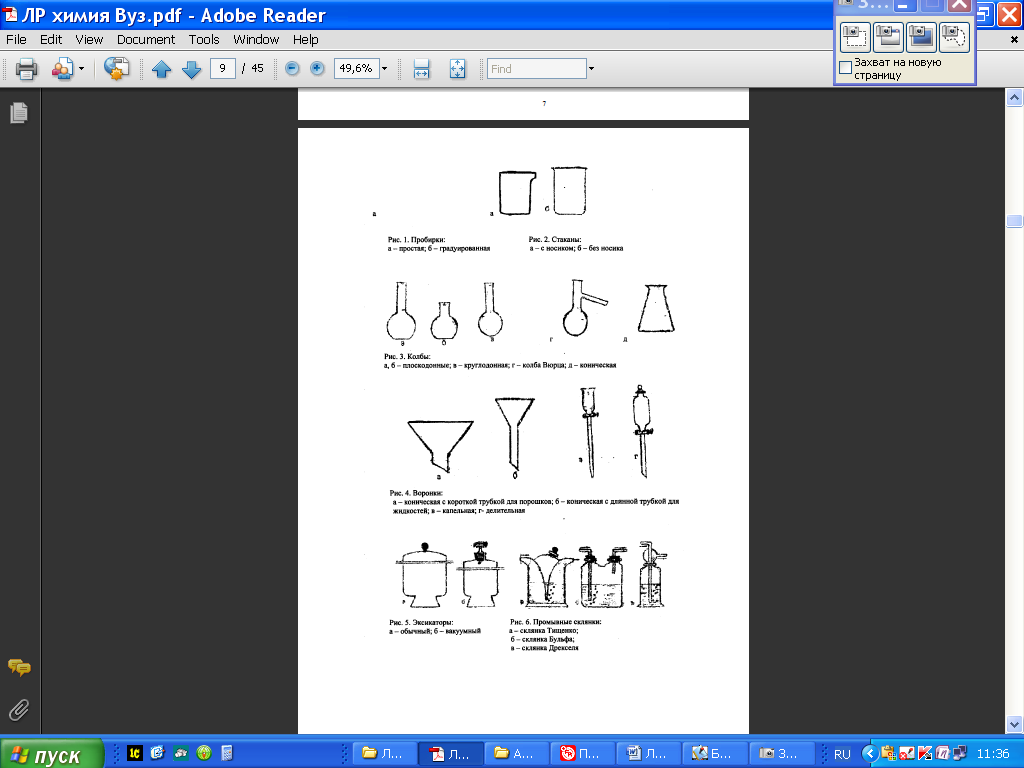
Пробирки (рис. 1.) используют для проведения химических опытов с небольшим количеством веществ. Пробирки могут быть цилиндрические и конические. Хранят пробирки в штативах. Перемешивание веществ в них проводят встряхиванием пробирки, нанося небольшой удар пальцем по нижней части пробирки. Моют пробирки с помощью ерша.
Колбы (рис. 2.) бывают разной вместимости (от 1-2 литров до 25 миллилитров) и разной формы: плоскодонные, круглодонные, конические, колбы Вюрца.
Стаканы (рис. 3.) могут быть разной вместимости (от 1 литра до 25 миллилитров), разной формы, разные по высоте и ширине, термостойкие и нетермостойкие.
Воронки (рис. 4.) бывают различной формы и размеров, и в зависимости от этого имеют разное назначение.
1.2.2. Посуда специального назначения
Эксикаторы (рис. 5.) применяют для хранения веществ, легко поглощающих влагу, и для высушивания веществ. Для этого в нижнюю часть эксикатора помещают вещества, которые способны поглощать воду:
СаC l2 (безводный),H2SO4 (концентрированная),Р205.
Промывные склянки (рис. 6.) используют для промывания, очистки и высушивания газов.
1.2.3. Мерная посуда
Мерная посуда (рис. 7.) - мерной называют посуду, применяемую для измерения объема жидкости с разной точностью.
Для измерения объема с небольшой точностью применяют мерные цилиндры и мензурки.
Для точного измерения объема жидкости используют пипетки, бюретки и мерные колбы.
Мерная посуда может быть разной вместимости. В зависимости от объема, который должен быть измерен, подбирается посуда соответствующей вместимости. Мерная посуда градуируется в миллилитрах (мл) или литрах (л). 1 мл соответствует 1 см3, а 1 л - 1 дм3.
При измерении объема жидкости мерный сосуд необходимо держать в вертикальном положении, а отсчеты вести по нижней части вогнутой поверхности мениска жидкости. Причем глаз наблюдателя должен находиться на одной горизонтальной линии с нижним краем мениска (рис. 8.).
Пипетки (рис. 7.) используют для отмеривания и переноса, точно определенного объема жидкости. Обыкновенная пипетка представляет собой стеклянную трубку небольшого диаметра с расширением посередине или без него, если пипетка небольшой вместимости (от 0,1 до 2-5 мл). Нижний конец пипетки оттянут в капилляр, а на верхнем конце имеется метка, до которой набирают жидкость. Для отмеривания необходимого объема жидкости нижний конец пипетки, соответствующей вместимости, опускают в жидкость до дна сосуда и с помощью груши (или рта, если раствор не опасен) набирают жидкость, следя за тем, чтобы кончик пипетки все время находился в жидкости. Жидкость набирают выше метки на 2-3 см, затем быстро закрывают верхнее отверстие указательным пальцем, придерживаю пипетку большим и средним пальцами. Затем, слегка ослабив нажим указательного пальца, дают жидкости медленно вытекать из пипетки. Как только нижний мениск жидкости дойдет до метки, палец снова плотно прижимают к верхнему отверстию пипетки. Таким образом, с помощью пипетки отбирается необходимый объем жидкости. Затем пипетку вводят в колбу (или стакан), в которую нужно перенести жидкость, отнимают указательный палец от верхнего отверстия пипетки и дают жидкости стечь по стенке колбы. Оставшуюся при этом жидкость в пипетке не выдувают, так как объем пипетки рассчитан на свободное истечение жидкости.
Бюретки (рис. 7.) применяют при титровании или для того, чтобы отмерить объем жидкости с точностью до 0,05 мл. Бюретка - стеклянная градуированная трубка, нижний конец которой оттянут и на него надета резиновая трубка со стеклянным шариком. Могут быть и бюретки с притертым стеклянным краном.
Перед началом работы бюретки закрепляют в штативе. Заполняют бюретку жидкостью сверху через воронку так, чтобы внутри находился раствор без пузырьков воздуха. Для удаления пузырьков воздуха резиновую трубку изгибают таким образом, чтобы кончик капилляра был направлен вверх, и вытесняют жидкостью весь воздух. Затем бюретку заполняют до нулевой отметки.
Мерные колбы (рис. 7.) используют для приготовления растворов точной концентрации. Для этого в колбу вносят точную навеску сухого вещества или рассчитанный объем исходного раствора. Затем до половины объема колбы наливают дистиллированную воду. Раствор тщательно перемешивают и доливают дистиллированную воду до метки, (последние 1-2 мл лучше по каплям с помощью пипетки). Потом плотно закрывают колбу пробкой и тщательно перемешивают
раствор, переворачивая колбу несколько раз.
1.2.4. Фарфоровая посуда
К фарфоровой посуде относят тигли, чашки, ступки, кружки, стаканы и т. д. (рис. 9). Чашки и тигли используют для выпаривания жидкостей и прокаливания твердых веществ. Они выдерживают температуру выше 1000°С. для измельчения твердых веществ используют ступки.
1.3. Первая помощь при несчастных случаях
В лаборатории бывают случаи, требующие неотложной медицинской помощи, - порезы рук стеклом, ожоги горячими предметами, кислотами, щелочами. В особо серьезных случаях необходимо обратиться к врачу.
Для оказания первой помощи в лаборатории имеется аптечка.
1. При ранении стеклом удалите осколки из раны, смажьте края раны раствором йода и перевяжите бинтом.
2. При ожоге рук или лица реактивом смойте реактив большим количеством воды, затем либо разбавленной уксусной кислотой (в случае ожога щелочью), либо раствором соли (в случае ожога кислотой), а затем опять водой.
3. При ожоге горячей жидкостью или горячим предметом обожженное место обработайте свежеприготовленным раствором перманганата калия, смажьте обожженное место мазью от ожога или вазелином. Можно присыпать ожог содой и забинтовать.
4. При химических ожогах глаз обильно промойте их водой, используя глазную ванночку, а затем обратитесь к врачу.
Лабораторная работа№1. Приготовление эмульсий и суспензий. Свойства дисперсных систем
Цели работы
-
изучить способы приготовления эмульсий и суспензий;
-
научиться отличать коллоидный раствор от истинного;
-
отработать навыки экспериментальной работы, соблюдая правила техники безопасности при работе в кабинете химии.
Краткие теоретические сведения
Организмы животных и растений, гидросфера, земная кора и недра, космическое пространство часто представляют собой вещества в раздробленном, или, как говорят, дисперсном, состоянии. Большинство веществ окружающего нас мира существует в виде дисперсных систем: почвы, ткани живых организмов, пищевые продукты и др. Химия дисперсного состояния довольно новая наука, но она почти не изучается ни в школе, ни в нехимических высших учебных заведениях, хотя эта научная область имеет не меньшее значение для нашей жизни, чем химия комплексных и органических соединений. Читая эту главу, постоянно думайте, когда и где вы встречаете описываемое явление в природе, быту или производстве, а также, как можно его использовать.
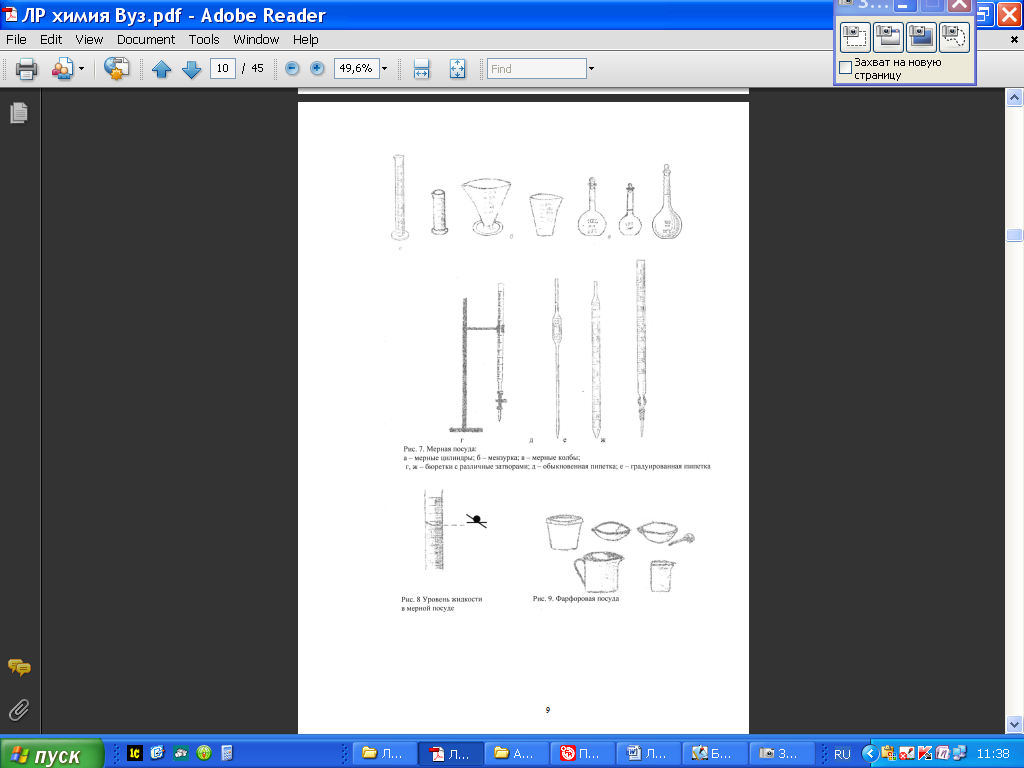
Дисперсные системы - это системы, в которых мелкие частицы вещества, или дисперсная фаза, распределены в однородной среде (жидкость, газ, кристалл), или дисперсионной фазе
-
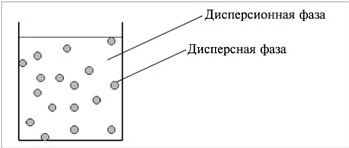
Рис.13
Размер частиц дисперсной фазы характеризуется дисперсностью. В зависимости от нее дисперсные системы можно разделить на высокодисперсные, или собственно коллоидные, и низкодисперсные (грубодисперсные).
Размер частиц низкодисперсных систем составляет 10-3 мм и больше. Размер частиц высокодисперсных систем лежит в интервале 10-6-10-4 мм (от 1 до 100 нм), что, как минимум, на порядок больше размера частиц в истинных растворах (10-7 мм).
Химия дисперсных систем изучает поведение вещества в сильно раздробленном, высокодисперсном состоянии, характеризующемся очень высоким отношением общей площади поверхности всех частиц к их общему объему или массе (степень дисперсности).
От названия коллоидных систем произошло название отдельной области химии - коллоидной. «Коллоидная химия» - традиционное название химии дисперсных систем и поверхностных явлений. Раньше коллоидами называли клееподобные вещества, теперь это высокодисперсные системы с сильно развитой поверхностью раздела фаз. Ниже мы будем использовать старые традиционные термины, понимая их современный смысл. Например, под выражением «коллоидный раствор» будем иметь в виду высокодисперсное состояние вещества в воде в качестве дисперсионной среды.
Важнейшая особенность дисперсного состояния вещества состоит в том, что энергия системы главным образом сосредоточена на поверхности раздела фаз. При диспергировании, или измельчении, вещества происходит значительное увеличение площади поверхности частиц (при постоянном суммарном их объеме). При этом энергия, затрачиваемая на измельчение и на преодоление сил притяжения между образующимися частицами, переходит в энергию поверхностного слоя - поверхностную энергию. Чем выше степень измельчения, тем больше поверхностная энергия. Поэтому область химии дисперсных систем (и коллоидных растворов) считают химией поверхностных явлений.
Коллоидные частицы настолько малы (содержат 103-109 атомов), что не задерживаются обычными фильтрами, не видны в обычный микроскоп, не оседают под действием силы тяжести. Их устойчивость со временем снижается, т.е. они подвержены «старению». Дисперсные системы термодинамически неустойчивы и стремятся к состоянию с наименьшей энергией, когда поверхностная энергия частиц становится минимальной. Это достигается за счет уменьшения общей площади поверхности при укрупнении частиц (что может также происходить при адсорбции на поверхности частиц других веществ).
Свойства вещества в раздробленном, или дисперсном, состоянии значительно отличаются от свойств того же вещества, находящегося в недисперсном состоянии, т.е. в виде куска твердого тела или некоторого объема жидкости.
Классификация дисперсных систем
Дисперсная фаза
Дисперсионная
среда
Название системы
Примеры
Газ
Газ
(Дисперсная система не образуется)
-
Жидкость
Пена
Пена газированной воды, пузырьки газа в жидкости, мыльная пена
Твердое тело
Твердая пена
Пенопласт, микропористая резина, пемза, хлеб, сыр
Жидкость
Газ
Аэрозоль
Туман, облака, струя из аэрозольного баллона
Жидкость
Эмульсия
Молоко, сливочное масло, майонез, крем, мазь
Твердое тело
Твердая эмульсия
Жемчуг, опал
Твердое тело
Газ
Аэрозоль, порошок
Пыль, дым, мука, цемент
Жидкость
Суспензия, золь (коллоидный раствор)
Глина, паста, ил, жидкие смазочные масла с добавкой графита или MoS
Твердое тело
Твердый золь
Сплавы, цветные стекла, минералы
Конус Тиндаля тем ярче, чем выше концентрация и больше размер частиц. Интенсивность светорассеяния усиливается при коротковолновом излучении и при значительном отличии показателей преломления дисперсной и дисперсионной фаз. С уменьшением диаметра частиц максимум поглощения смещается в коротковолновую часть спектра, и высокодисперсные системы рассеивают более короткие световые волны и поэтому имеют голубоватую окраску. На спектрах рассеяния света основаны методы определения размера и формы частиц.
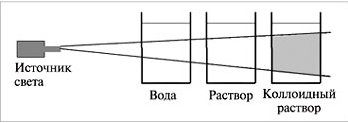
Рис.14
Методы исследования дисперсных систем (определение размера, формы и заряда частиц) основаны на изучении их особых свойств, обусловленных гетерогенностью и дисперсностью, в частности оптических. Коллоидные растворы обладают оптическими свойствами, отличающими их от настоящих растворов, - они поглощают и рассеивают проходящий через них свет. При боковом рассматривании дисперсной системы, через которую проходит узкий световой луч, внутри раствора на темном фоне виден светящийся голубоватый так называемый конус Тиндаля.
Приборы и реактивы
-
ступка с пестиком, ложка-шпатель, стакан, стеклянная палочка, фонарик, пробирка;
-
вода, карбонат кальция (кусочек мела), масло, ПАВ, мука, молоко, зубная паста, раствор крахмала, раствор сахара
Опыт № 1. Приготовление суспензии карбоната кальция в воде
Суспензии имеют ряд общих свойств с порошками, они подобны по дисперсности. Если порошок поместить в жидкость и перемешать, то получится суспензия, а при высушивании суспензия снова превращается в порошок. Поэтому способы получения суспензий и порошков одинаковы, лишь при получении суспензий появляется дополнительная технологическая стадия - смешивание порошка с дисперсионной средой.
Концентрированные суспензии (пасты) могут быть получены как в результате оседания более разбавленных суспензий, так и непосредственно растиранием порошков или массивных твердых тел с жидкостями.
В ступке из кусочка мела приготовить порошок. В стакан насыпать ложку порошка мела и постепенно при помешивании стеклянной палочкой добавить воды. Запишите наблюдения.
На что похожа полученная смесь?
Опыт № 2. Получение эмульсии моторного масла
В водной среде молока эмульгированы мелкие капельки жира. Они постепенно поднимаются на поверхность, поскольку их плотность меньше, чем плотности воды. В молоке за несколько часов образуется слой сливок. Молоко является не устойчивой эмульсией.
В пробирку налейте ¼ часть воды и столько же масла. Тщательно перемешайте. Добавьте каплю ПАВ (эмульгатора) и перемешайте ещё раз. Сравните результаты. Запишите наблюдения.
Молоко, поступающее в продажу с предприятий молочной промышленности, должны быть более устойчивы к расслоению. Каким образом можно повысить устойчивость данной эмульсии.
Опыт № 3. Ознакомление со свойствами дисперсных систем
Изучить образцы дисперсных систем и заполнить таблицу.
Характеристика дисперсных систем
Виды дисперсных систем.
Аэрозоли
Эмульсии
Суспензии
Коллоидные растворы
Истинные растворы
Состав
Дисперсная фаза
Дисперсионная среда
Примеры (дополнить список)
Мука
Молоко
Зубная паста
Раствор крахмала
Раствор сахара
Размеры частиц
Внешний вид.
Эффект Тиндаля.
Способность осаждаться
Значение
Вопросы для выводов
-
Как отличить коллоидный раствор от истинного?
-
Значение дисперсных систем в повседневной жизни.
Литература
Габриелян О. С. Химия: учеб. для студ. проф. учеб. заведений. - М., 2010.
Лабораторная работа №2
Свойства кислот
Цели работы
-
изучить важнейшие классы неорганических соединений: оксиды, основания, кислоты и соли; их способы получения и свойства;
-
провести реакции, которые характерны для кислот;
-
работать в лаборатории с соблюдением правил ТБ;
-
научиться составлять УХР и делать выводы.
Краткие теоретические сведения
Известно около 300 тысяч неорганических соединений; их можно разделить на четыре важнейших класса - оксиды, основания, кислоты и соли.
Оксиды - продукты соединения элементов с кислородом. Различают солеобразующие и несолеобразующие оксиды.
Несолеобразующих оксидов немного (например, CO, NO, N2O), они не образуют солей ни с кислотами, ни с основаниями.
Солеобразующие оксиды подразделяют на основные, кислотные и амфотерные.
Основные оксиды образуют металлы с низшими степенями окисления +1, +2, их гидратами являются основания. Основания щелочноземельных металлов (Ca, Sr, Ba) также образуются при растворении в воде соответствующих оксидов, но их растворимость меньше, к щелочам приближается только гидроксид бария Ba(OH)2.
Основные оксиды реагируют с кислотными оксидами и кислотами, образуя соли:
CaO + CO2 = CaCO3, CuO + 2HCl = CuCl2 + H2O
Неметаллы (B, C, N, P, S, Cl и др.), а также металлы, расположенные в побочных подгруппах больших периодов в высших степенях окисления +5, +6, +7 (V, Cr, Mn и др.), образуют кислотные оксиды, взаимодействие которых с основными оксидами и основаниями приводит к солям: SO2 + Na2O = Na2SO3 , N2O5 + 2NaOH = 2NaNO3 + H2O
Металлы главных и побочных подгрупп средних степеней окисления +3, +4 (Cr, Mn, Sn и др.), иногда +2 (Sn, Pb) образуют амфотерные оксиды.
Их гидраты проявляют как основные, так и кислотные свойства, реагируя как с кислотами, так и с основаниями: Cr2O3 + 6HCl = 2CrCl3 + 3H2O, Cr2O3 + 2NaOH = 2NaCrO2 + H2O
Оксиды можно получить реакцией соединения элемента с кислородом: 2Mg + O2 = 2MgO, 4P + 5O2 = 2P2O5
или реакцией разложения сложного вещества: CaCO3 = CaO + CO2, 2Zn(NO3)2 = 2ZnO + 4NO2 + O2
Продукты взаимодействия оксидов с водой называют гидроксидами или гидроокисями. Их состав выражают общей формулой Э(ОН)n, где Э - атом элемента, n - индекс соответсвующий степени окисления Э. В зависимости от природы атома элемента Э гидроксиды диссоциируют по связи Э-ОН и по связи ЭО-Н с образованием основных (основания), кислотных (кислоты) и амфотерных гидроксидов (амфолиты).
Основания при диссоциации в растворе в качестве анионов образуют только гидроксид-ионы:
NaOHNa+ + OH⎯
Кислотность основания определяется числом ионов OH⎯. Многокислотные основания диссоциируют ступенчато: Ca(OH)2 (CaOH)+ + OH⎯,(CaOH)+ Ca2+ + OH⎯
Водные растворы хорошо растворимых оснований называют щелочами. Щелочи получают растворением оксидов в воде: Na2O + H2O = 2NaOH
Индикаторы в щелочных растворах меняют окраску: так фиолетовый лакмус приобретает синий цвет, бесцветный фенолфталеин становится малиновым, метиловый оранжевый - желтым.
Основания реагируют с кислотами, образуя соль и воду: NaOH + HCl = NaCl + H2O
Если основание и кислота взаимодействуют в эквивалентных отношениях, то среда становится нейтральной - реакция нейтрализации.
Многие нерастворимые в воде основания при нагревании разлагаются: Cu(OH)2 ⎯⎯t→ CuO + H2O
Нерастворимые в воде основания обычно получают действием щелочей на растворимые соли металлов: CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
Различают кислоты бескислородные (HCl, HI, H2S, HCN) и кислородсодержащие (HNO3, H2SO4, H2SO3, H3PO4).
В растворах кислот лакмус становится красным, метиловый оранжевый - розовым, фенолфталеин остается бесцветным.
Кислоты получают растворением кислотных оксидов в воде: P2O5 + 3H2O = 2H3PO4
или по реакции обмена соли с кислотой: Ca3(PO4)2 + 3H2SO4 = 3CaSO4 + 2H3PO4
Амфолиты представляют собой гидроксиды, проявляющие в реакциях как основные, так и кислотные свойства. К ним относятся Be(OH)2, Al(OH)3, Zn(OH)2, Cr(OH)3 и др. Амфотерные гидроксиды реагируют с основаниями как кислоты, с кислотами - как основания:
Сr(OH)3 + 3HCl = CrCl3 + 3H2O, Сr(OH)3 + 3NaOH = Na3[Cr(OH)6]
Различают средние, кислые и основные соли. Существуют также двойные соли, образованные разными металлами и одним кислотным остатком KAl(SO4)2.
Средние соли можно рассматривать как продукты полного замещения атомов водорода в кислоте атомами металла или гидроксогрупп основания кислотными остатками: NaCl, K2SO4, AlPO4.
Кислые соли (гидросоли) являются продуктами неполного замещения атомов водорода многоосновных кислот атомами металла: NaHSO4, Al(H2PO4)3, KHCO3.
Основные соли (гидроксосоли) являются продуктами неполного замещения гидроксогрупп многокислотного основания на кислотные остатки: AlOHSO4, MgOHCl, (CuOH)2SO4.
Средние соли могут быть получены многими способами:
1) соединением металла и неметалла: 2Na + Cl2 = 2NaCl
2) соединением основного и кислотного оксидов: CaO + CO2 = CaCO3
3) вытеснением активным металлом водорода или менее активного металла:
Zn + 2HCl = H2 + ZnCl2, Zn + CuSO4 = ZnSO4 + Cu
4) реакцией нейтрализации: NaOH + HCl = NaCl + H2O
5) реакцией обмена: Ba(NO3)2 + Na2SO4 = BaSO4 + 2NaNO3
Кислые соли могут быть получены в кислой среде: NaOH + H2SO4 (избыток) = NaHSO4 + H2O
Na3PO4 + 2H3PO4 (избыток) = 3NaH2PO4
Основные соли могут быть получены в щелочной среде: H2SO4 + 2Cu(OH)2 (избыток) = (CuOH)2SO4 + Na2SO4, 2CuSO4 + 2NaOH(недостаток) = (CuOH)2SO4 + Na2SO4
Кислые соли при избытке щелочи и основные соли при избытке кислоты переходят в средние соли:
NaHSO4 + NaOH (избыток) = Na2SO4 + H2O, (CuOH)2SO4 + H2SO4 (избыток) = 2CuSO4 + 2H2O
Приборы и реактивы
-
растворы: серной кислот; раствор гидроксида натрия; растворы индикаторов: метилоранжа,; растворы солей: нитрат бария, оксид кальция;
-
кювета для капельного анализа, пипетка, стеклянная палочка, универсальная индикаторная бумага, синий лакмус
Опыт № 1. Изучения свойств кислот.
Опыт выполняется капельным методом. В семь кювет для капельного анализа внести по 4 капли серной кислоты. Затем добавьте в кювету:
№ 1. индикатор метиловый оранжевый
№ 2. индикатор лакмус синий
№ 3. индикатор универсальный
№ 4. стружку магния
№ 5. оксид кальция
№ 6. индикатор метиловый оранжевый, а далее гидроксид натрия
№ 7. соль бария
Запишите наблюдаемые явления и составьте УХР.
Вопросы для выводов
С какими классами веществ взаимодействуют кислоты?
Контрольные вопросы
-
С какими из перечисленных веществ взаимодействует соляная кислота:
MgO; AgNO3; SO3; CuSO4; Ca(OH)2; Cu; Fe; KOH?
Лабораторная работа №3
Свойства оснований
Цели работы
-
изучить важнейшие классы неорганических соединений: оксиды, основания, кислоты и соли; их способы получения и свойства;
-
провести реакции, которые характерны для оснований;
-
работать в лаборатории с соблюдением правил ТБ;
-
научиться составлять УХР и делать выводы.
Краткие теоретические сведения
Известно около 300 тысяч неорганических соединений; их можно разделить на четыре важнейших класса - оксиды, основания, кислоты и соли.
Оксиды - продукты соединения элементов с кислородом. Различают солеобразующие и несолеобразующие оксиды.
Несолеобразующих оксидов немного (например, CO, NO, N2O), они не образуют солей ни с кислотами, ни с основаниями.
Солеобразующие оксиды подразделяют на основные, кислотные и амфотерные.
Основные оксиды образуют металлы с низшими степенями окисления +1, +2, их гидратами являются основания. Основания щелочноземельных металлов (Ca, Sr, Ba) также образуются при растворении в воде соответствующих оксидов, но их растворимость меньше, к щелочам приближается только гидроксид бария Ba(OH)2.
Основные оксиды реагируют с кислотными оксидами и кислотами, образуя соли:
CaO + CO2 = CaCO3, CuO + 2HCl = CuCl2 + H2O
Неметаллы (B, C, N, P, S, Cl и др.), а также металлы, расположенные в побочных подгруппах больших периодов в высших степенях окисления +5, +6, +7 (V, Cr, Mn и др.), образуют кислотные оксиды, взаимодействие которых с основными оксидами и основаниями приводит к солям: SO2 + Na2O = Na2SO3 , N2O5 + 2NaOH = 2NaNO3 + H2O
Металлы главных и побочных подгрупп средних степеней окисления +3, +4 (Cr, Mn, Sn и др.), иногда +2 (Sn, Pb) образуют амфотерные оксиды.
Их гидраты проявляют как основные, так и кислотные свойства, реагируя как с кислотами, так и с основаниями: Cr2O3 + 6HCl = 2CrCl3 + 3H2O, Cr2O3 + 2NaOH = 2NaCrO2 + H2O
Оксиды можно получить реакцией соединения элемента с кислородом: 2Mg + O2 = 2MgO, 4P + 5O2 = 2P2O5
или реакцией разложения сложного вещества: CaCO3 = CaO + CO2, 2Zn(NO3)2 = 2ZnO + 4NO2 + O2
Продукты взаимодействия оксидов с водой называют гидроксидами или гидроокисями. Их состав выражают общей формулой Э(ОН)n, где Э - атом элемента, n - индекс соответсвующий степени окисления Э. В зависимости от природы атома элемента Э гидроксиды диссоциируют по связи Э-ОН и по связи ЭО-Н с образованием основных (основания), кислотных (кислоты) и амфотерных гидроксидов (амфолиты).
Основания при диссоциации в растворе в качестве анионов образуют только гидроксид-ионы:
NaOHNa+ + OH⎯
Кислотность основания определяется числом ионов OH⎯. Многокислотные основания диссоциируют ступенчато: Ca(OH)2 (CaOH)+ + OH⎯,(CaOH)+ Ca2+ + OH⎯
Водные растворы хорошо растворимых оснований называют щелочами. Щелочи получают растворением оксидов в воде: Na2O + H2O = 2NaOH
Индикаторы в щелочных растворах меняют окраску: так фиолетовый лакмус приобретает синий цвет, бесцветный фенолфталеин становится малиновым, метиловый оранжевый - желтым.
Основания реагируют с кислотами, образуя соль и воду: NaOH + HCl = NaCl + H2O
Если основание и кислота взаимодействуют в эквивалентных отношениях, то среда становится нейтральной - реакция нейтрализации.
Многие нерастворимые в воде основания при нагревании разлагаются: Cu(OH)2 ⎯⎯t→ CuO + H2O
Нерастворимые в воде основания обычно получают действием щелочей на растворимые соли металлов: CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
Различают кислоты бескислородные (HCl, HI, H2S, HCN) и кислородсодержащие (HNO3, H2SO4, H2SO3, H3PO4).
В растворах кислот лакмус становится красным, метиловый оранжевый - розовым, фенолфталеин остается бесцветным.
Кислоты получают растворением кислотных оксидов в воде: P2O5 + 3H2O = 2H3PO4
или по реакции обмена соли с кислотой: Ca3(PO4)2 + 3H2SO4 = 3CaSO4 + 2H3PO4
Амфолиты представляют собой гидроксиды, проявляющие в реакциях как основные, так и кислотные свойства. К ним относятся Be(OH)2, Al(OH)3, Zn(OH)2, Cr(OH)3 и др. Амфотерные гидроксиды реагируют с основаниями как кислоты, с кислотами - как основания:
Сr(OH)3 + 3HCl = CrCl3 + 3H2O, Сr(OH)3 + 3NaOH = Na3[Cr(OH)6]
Различают средние, кислые и основные соли. Существуют также двойные соли, образованные разными металлами и одним кислотным остатком KAl(SO4)2.
Средние соли можно рассматривать как продукты полного замещения атомов водорода в кислоте атомами металла или гидроксогрупп основания кислотными остатками: NaCl, K2SO4, AlPO4.
Кислые соли (гидросоли) являются продуктами неполного замещения атомов водорода многоосновных кислот атомами металла: NaHSO4, Al(H2PO4)3, KHCO3.
?Основные соли (гидроксосоли) являются продуктами неполного замещения гидроксогрупп многокислотного основания на кислотные остатки: AlOHSO4, MgOHCl, (CuOH)2SO4.
Средние соли могут быть получены многими способами:
1) соединением металла и неметалла: 2Na + Cl2 = 2NaCl
2) соединением основного и кислотного оксидов: CaO + CO2 = CaCO3
3) вытеснением активным металлом водорода или менее активного металла:
Zn + 2HCl = H2 + ZnCl2, Zn + CuSO4 = ZnSO4 + Cu
4) реакцией нейтрализации: NaOH + HCl = NaCl + H2O
5) реакцией обмена: Ba(NO3)2 + Na2SO4 = BaSO4 + 2NaNO3
Кислые соли могут быть получены в кислой среде: NaOH + H2SO4 (избыток) = NaHSO4 + H2O
Na3PO4 + 2H3PO4 (избыток) = 3NaH2PO4
Основные соли могут быть получены в щелочной среде: H2SO4 + 2Cu(OH)2 (избыток) = (CuOH)2SO4 + Na2SO4, 2CuSO4 + 2NaOH(недостаток) = (CuOH)2SO4 + Na2SO4
Кислые соли при избытке щелочи и основные соли при избытке кислоты переходят в средние соли:
NaHSO4 + NaOH (избыток) = Na2SO4 + H2O, (CuOH)2SO4 + H2SO4 (избыток) = 2CuSO4 + 2H2O
Приборы и реактивы
-
растворы: соляной, серной кислот; раствор гидроксида натрия; растворы индикаторов: фенолфталеина, метилоранжа; растворы солей: сульфат меди (II);
-
держатель, прибор для нагревания, спички, фарфоровая чашка, кювета для капельного анализа , пипетка, стеклянная палочка, универсальная индикаторная бумага, синий лакмус.
Опыт № 1. Изучения свойств оснований.
Опыт выполняется капельным методом.
В пять кювет для капельного анализа внести по 2 капли щёлочи.
Затем добавьте в кювету:
№ 1. индикатор метиловый оранжевый
№ 2. индикатор лакмус синий
№ 3. индикатор универсальный
№ 4. индикатор фенолфталеин
№ 5. индикатор метиловый оранжевый, а далее кислоту.
Прикрепить держатель к фарфоровой чашке
В фарфоровую чашку внести по 2 капли щёлочи и по каплям добавить соль меди.
Запишите наблюдаемые явления и составьте УХР.
Вопросы для выводов
С какими классами веществ взаимодействуют щелочи?
Контрольные вопросы
-
С какими из перечисленных веществ взаимодействует гидроксид калия:
MgO; AgNO3; SO3; CuSO4; Ca(OH)2; Cu; Fe; KOH?
-
При помощи каких реакций можно осуществить следующие превращения:
Zn → ZnCl2 → Zn(OН)2→ ZnO ?
Лабораторная работа №4
Свойства солей
Цели работы
-
провести реакции, которые характерны для солей;
-
научиться определять реакцию среды растворов солей различных типов;
-
исследовать растворов различных солей на протекание реакций гидролиза;
-
отработать навыки экспериментальной работы, соблюдая правила техники безопасности при работе в кабинете химии;
-
отработать навыки составления уравнений реакций гидролиза и делать выводы.
Краткие теоретические сведения
Различают средние, кислые и основные соли. Существуют также двойные соли, образованные разными металлами и одним кислотным остатком KAl(SO4)2.
Средние соли можно рассматривать как продукты полного замещения атомов водорода в кислоте атомами металла или гидроксогрупп основания кислотными остатками: NaCl, K2SO4, AlPO4.
Гидролиз соли - взаимодействие ионов соли с водой, когда образуется слабый электролит.
[H+] = [OH-] - среда нейтральная,
[H+] > [OH-] - среда кислая,
[OH-] > [H+] - среда щелочная.
Классификация электролитов
Степень электролитической диссоциации
Сила электролита
Примеры
α > 30%
сильные
кислоты
H2SO4, HNO3,HCl, HBr, HI
основания
Ме(OH)n Р., М. в воде
соли
Р. в воде
3% < α < 30%
средние
кислоты
HF , H2SO3, Н3PO4
основания
Fe(OH)3
α < 3%
слабые
кислоты
H2S, H2CO3, H2SiO3, СН3СООH
основания
Ме(OH)n Н. в воде и NH4OH
соли
М. в воде
В зависимости от своего состава соли по-разному реагируют с водой, поэтому можно выделить 4 типа гидролиза солей.
1. Соль образована катионом слабого основания и анионом сильной кислоты.
(CuCl2, NH4Cl, Fe2(S04)3 - гидролиз по катиону)
CuCl2 Cu+2 + 2Сl-
Н2О Н+ + ОН-
Cu+2 + 2Сl- + Н+ + ОН- CuОН+ + Н++ 2Сl-
Выводы: [ Н+] > [ОН-] pH < 7 среда раствора кислая окраска индикаторов изменяется
2. Соль образована катионом сильного основания и анионом слабой кислоты.
(К2С03, Na2S - гидролиз по аниону)
К2С03 2К+ + С03-2
Н2О Н+ + ОН-
2К+ + С03-2+ Н+ + ОН - НС0-3 + 2К+ + ОН-
Выводы: [ Н+] < [ОН-] pH > 7 среда раствора щелочная окраска индикаторов изменяется
3. Соль образована катионом слабого основания и анионом слабой кислоты. ((NH4)2CO3, CH3COONH4, AlCl3- гидролиз по катиону и по аниону)
Fe2 (C03)3 2Fe +3 + 3C03-2
Н2О Н+ + ОН-
2Fe +3 + 3C03-2+ Н+ + ОН- Fe (ОН)3+ C02 + Н2О идёт до конца
Выводы: Характер среды определяется относительной силой кислоты и основания.
4. Соль образована катионом сильного основания и анионом сильной кислоты. (гидролизу не подвергаются (NaCl, К2SО4, Ba(N03)2).
NaCl Na+ + Сl-
Н2О Н+ + ОН-
Na+ + Сl- + Н+ + ОН- Na+ + Сl- + Н+ + ОН
Выводы: [ Н+] = [ОН-] pH = 7 среда раствора нейтральная окраска индикаторов не изменяется
Реактивы и оборудование
-
растворы солей: карбонат калия, карбонат натрия, нитрат калия, сульфат алюминия, сульфат железа (III), сульфат меди (II), хлорид железа (III), хлорид натрия, хлорид цинка, гидроксид натрия, железо (гвоздь);
-
штатив с пробирками, предметные стёкла, пипетка, стеклянная палочка.
Опыт № 1. Испытание растворов солей индикатором. Гидролиз солей.
Цель: убедиться, что среда в растворах солей может быть нейтральной, кислой и щелочной.
Исследовать растворы солей. На полоску универсальной индикаторной бумаги нанесите пипетками по одной капле раствора каждой соли (из списка реактивов). Результаты наблюдений занесите в таблицу №1.
Таблица 1. Определение среды растворов солей
Формула соли
Цвет универсального индикатора
Какими основаниями и кислотами
сильными () или слабыми ()
соль образована:
Нейтральная
Кислая
Щелочная
1. К2СО3
синий
kt основания и an кислоты
2.
3.
4.
5.
6.
7.
8.
9.
Примечание: среду раствора в таблице и цвет индикатора должны соответствовать друг другу.
Составьте уравнения реакций гидролиза солей, растворы которых имели,
кислую или щелочную среду раствора. С помощью уравнений реакций объясните происходящие реакции.
Опыт № 2. Изучения свойств солей.
Опыт выполняется капельным методом.
На предметное стекло нанести отдельно по одной капле хлорида бария и сульфата меди (II)
Затем добавьте в каплю:
№ 1. карбонат натрия
№ 2. гидроксид натрия
В пробирку поместить гвоздь и добавить 3 капли сульфата меди (II).
Запишите наблюдаемые явления и составьте УХР.
Вопросы для выводов
С какими классами веществ взаимодействуют соли?
Контрольные вопросы
-
С какими из перечисленных веществ взаимодействует хлорид бария:
MgO; AgNO3; SO3; CuSO4; Ca(OH)2; Cu; Fe; KOH?
-
При помощи каких реакций можно осуществить следующие превращения:
Ва → ВаCl2 → ВаSO4?
Литература
Габриелян О. С. Химия: учеб. для студ. проф. учеб. заведений. - М., 2010.
Лабораторная работа№5
Типы химических реакций
Цель работы: сформировать знания о классификации химических реакций
по числу и составу реагирующих веществ
-
Реакции, идущие с образованием осадка.
В одну пробирку налейте 3-4 мл раствора сульфата меди (2), во вторую- столько же раствора хлорида кальция. В первую пробирку добавьте немного раствора гидроксида натрия, во вторую - раствор ортофосфата натрия.
-
Реакции, идущие с выделением газа.
В одну пробирку налейте 3-4 мл раствора сульфита натрия , во вторую - столько же карбоната натрия. В каждую из них добавьте столько же серной кислоты. В первой пробирке выделяется газ с острым запахом, во второй- без запаха.
3. Реакции, идущие с образованием малодиссоциирующего вещества. В одну пробирку налейте 3-4 мл раствора гидроксида натрия добавьте 2-3 капли фенолфталеина. Раствор приобретает малиновый цвет. Затем прилейте раствор соляной или серной кислоты до обесцвечивания.
Составьте уравнения реакций в молекулярном и ионном виде.
-
Реакции замещения меди железом в растворе медного купороса. В пробирку налейте3-4 мл раствора медного купороса и поместите в раствор железный стержень или насыпьте железные опилки. Через 3-4 мин. отметьте происходящие изменения.
Лабораторная работа №6
Скорость химических реакций
Цели работы
-
провести реакции, которые протекают с различной скоростью;
-
исследовать факторы влияющие на скорость химических реакций;
-
отработать навыки экспериментальной работы, соблюдая правила техники безопасности при работе в кабинете химии;
-
отработать навыки составления уравнений реакций.
Краткие теоретические сведения
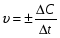 Скорость химической реакции - изменением концентрации реагирующих или образующихся веществ в единицу времени.
Скорость химической реакции - изменением концентрации реагирующих или образующихся веществ в единицу времени.
С - молярная концентрация, t - время
Реактивы и оборудование
-
записать самостоятельно
Опыт № 1.
Все опыты проводим капельным методом (по 3 капли каждого реактива)!!!
Налейте в две пробирки соляную и уксусную кислоты.
Одновременно в каждую пробирку добавьте кусочек цинка.
В какой пробирке реакция протекает быстрее? Почему?
Составьте УХР.
Опыт № 2.
В 2 пробирки налейте уксусной кислоты и добавьте одновременно несколько гранулу цинка.
Одну пробирку нагрейте.
В какой из пробирок реакция идет быстрее? Как влияет температура на скорость реакции?
Составьте УХР.
Опыт № 3.
В 1 пробирку налейте раствор НСl.
Во 2 пробирку концентрированной НСl.
Одновременно в каждую пробирку добавьте гранулу цинка.
В какой пробирке реакция идет быстрее?
Как влияет концентрация реагирующих веществ на скорость реакции? Почему?
Составьте УХР.
Опыт № 4.
В 2 пробирки налить раствор медного купороса.
Одновременно в каждую пробирку добавьте гранулу алюминия.
В первую пробирку добавить несколько кристаллов хлорида натрия.
Что наблюдаете?
Составьте УХР.
Опыт № 5.
Налейте в 2 пробирки уксусной кислоты.
Одновременно в каждую пробирку добавьте в 1 пробирку кусочек мела, а
во 2 пробирку порошок мела.
Как зависит скорость реакции от площади соприкосновения веществ?
Составьте УХР.
Вопросы для выводов
-
Что такое скорость химической реакции?
-
Какие факторы влияют на скорость химической реакции?
Контрольные вопросы
-
От чего зависит скорость химической реакции между металлом и серой?
-
Как называется реакция в присутствии катализатора?
Литература
Габриелян О. С. Химия: учеб. для студ. проф. учеб. заведений. - М., 2010.
Лабораторная работа №7
Качественные реакции на хлорид-, сульфат-, фосфат- и карбонат-анионы.
Цель работы. Ознакомиться на практике с характерными реакциями на анионы, запомнить свойства веществ, получить навыки проведения химического эксперимента, навыки самостоятельно теоретического толкования наблюдений и выводов, вытекающих из эксперимента, получить навыки соблюдения правил техники безопасности.
Оборудование: штатив, четыре пробирки с растворами солей (сульфата натрия, хлорида натрия, карбоната натрия и фосфора натрия ), склянки с растворами реактивов: нитрата серебра, хлорида бария, соляной кислоты.
Качественные реакции неорганических соединений
Определяемые ионы и вещества.
Реактивы.
Признаки.

Индикаторы
Лакмус - синий
Метилоранж - желтый
Фенолфталеин - малиновый
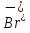
1)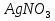
2)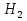
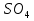
Желтоватый осадок
Выделение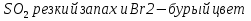
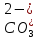
Сильные кислоты
Бесцветный газ без запаха,
вызывающий помутнение
известковой воды Cа(OH
1)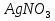
2)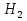
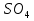
Желтый осадок
Выделение 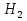 S и
S и 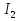 ( Фиолетовый цвет)
( Фиолетовый цвет)
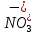
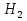
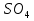 и Cu при нагревании
и Cu при нагревании
Бурый газ с неприятным запахом
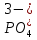
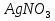
Желтый осадок, растворимый в кислотах
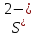
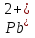 (Соль)
(Соль)
Черный осадок

Сильные кислоты
Бесцветный газ, с резким запахом, помутнение известковой воды
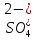
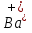 (Соль)
(Соль)
Белый осадок
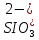
Сильные кислоты
Студенистый осадок
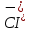
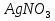
Белый творожистый осадок,
нерастворимый в кислотах
Инструкция.
1.Напишите на развороте тетради (на двух листах) номер и название работы.
2.Приготовьте в тетради таблицу по следующему образцу и разместите ее на развороте тетради.
№
п/п
Название
опыта.
Что делали.
Что наблюдали.
Уравнения реакций
Вывод
1.
Испытание раствора в пробирке
…
2.Выполните указанное задание.
3.Оформите отчет согласно предложенной таблице.
Задание.
1.В предложенных пробирках под номерами ( 1,2,3,4 ) находятся растворы солей: хлорида натрия, сульфата натрия, фосфата натрия и карбоната натрия.
2.В склянках даны реактивы: нитрат серебра, хлорид бария, соляная кислота.
3.Определите экспериментально раствор, какой соли находится в пробирке №1, в пробирке №2,в пробирке №3, в пробирке №4.
Контрольные вопросы.
1.Что значит характерная реакция на какое-либо соединение?
2.В четырех склянках без этикеток содержатся растворы серной кислоты, хлорида кали, хлорида бария, нитрата серебра. Как, не пользуясь другими реактивами, узнать, что в какой склянке находится?
Лабораторная работа №8
Изготовление моделей молекул органических веществ
Цели работы
-
изучить особенности строения молекул органических веществ;
-
найти общие признаки и различия гомологов и изомеров;
-
научиться составлять модели молекул различной сложности.
Краткие теоретические сведения
Для того чтобы понять сущность работы, надо знать, что:
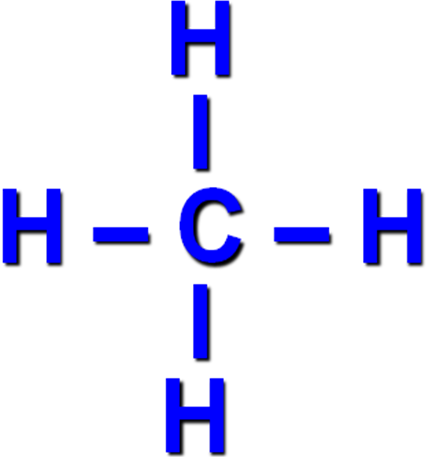
1. Простейшим представителем насыщенных углеводородов является метан, структурная формула которого
2. sp3- гибридизация характерна для атомов
углерода в (алканах) - в частности, в метане.
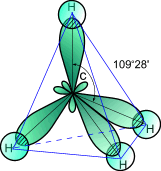 рис. 10
рис. 10
3. Атом углерода в молекуле метана расположен в центре тетраэдра, атомы водорода - в его вершинах.
4. Валентные углы между направлениями связей равны между собой и составляют угол 109°28'.
5. В этане есть углерод-углеродные связи.
L (С-С) = 0,154 нм.
Оборудование
-
пластилин, спички.
-
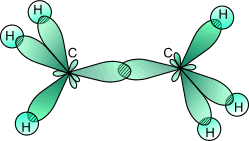 рис. 11
рис. 11
Задание № 1. Составление сокращённых структурных формул углеводородов.
-
Формула молекулы метана.
-
Формула молекулы этана.
-
Формула молекулы пропана.
-
Формулы молекул бутана и изобутана.
-
Формулы молекулы пентана и всех его изомеров.
Задание № 2. Изготовление моделей молекул углеводородов
-
Модель молекулы метана. Соберите модель молекулы метана, используя для этого спички и пластилин. Для этого из пластилина (в наборе 16 шариков) выберите четыре шарика, а из пластилина (в наборе 7 шариков) - один шарик. В качестве стержней можно использовать спички. Учтите, что в молекуле метана угол между химическими связями С-Н составляет 109°28', т. е. молекула имеет тетраэдрическое строение (см. рис. 10).
-
Модель молекулы этана. Соберите модель молекулы этана, используя для этого спички и пластилин. Учтите, что в молекуле этана угол между химическими связями С-Н составляет 109°28', а углерод-углеродные связи L (С-С) = 0,154 нм. (см. рис. 11).
-
Модель молекулы пропана. Соберите модель молекулы пропана, используя для этого спички и пластилин.
-
Модели молекул бутана и изобутана. Соберите модель молекулы н-бутана, используя пластилин. Подумайте и переделайте модель н-бутана в модель молекулы изобутана. Учтите, что в бутане атомы углерода расположены по отношению друг к другу под углом 109°, т. е. углеродная цепь должна иметь зигзагообразное строение. В молекуле изобутана все связи центрального атома углерода направлены к вершинам правильного тетраэдра. Сравните строение этих углеводородов.
-
Модели молекул пентана и всех его изомеров. Соберите модель молекулы н-пентана и всех его изомеров последовательно, используя пластилин.
Вопросы для выводов
-
Сколько моделей: а) гомологов, б) изомеров было собрано во время лабораторной работы
-
Что общего и в чём различия в строении а) гомологов, б) изомеров
Контрольные вопросы
-
Какие вещества называют органическими?
-
В чем отличие органических веществ от неорганических веществ?
-
Определите молекулярную формулу вещества, если оно содержит С-80%,Н-20%, а плотность вещества по водороду равна 15.
Литература
Габриелян О. С. Химия: учеб. для студ. проф. учеб. заведений. - М., 2010.
Лабораторная работа №9
Ознакомление с коллекцией образцов нефти и продуктов её переработки
Цели работы
-
обобщить и систематизировать знания об углеводородах;
-
ознакомиться с образцами нефти, гипотезами происхождения нефти, составом и свойствами;
-
изучить способы получения и областях использования углеводородов, включая экологические аспекты
-
уметь самостоятельно работать с новыми источниками информации: анализировать, систематизировать, классифицировать, отбирать требуемую информацию, представлять ее в табличной форме, переводить информацию из одной знаковой системы в другую
-
уметь работать в парах, группах и индивидуально
Краткие теоретические сведения
Что же такое нефть? Теплотехник ответит, что это прекрасное, высококалорийное топливо. Но химик возразит: нет! Нефть - это сложная смесь жидких углеводородов, в которых растворены газообразные и другие вещества. И чтобы перечислить все продукты, получаемые из нефти, нужно потратить несколько листов, так как их уже несколько тысяч. Еще Д.И. Менделеев заметил, что топить печь нефтью все равно, что топить ее ассигнациями.
Нефть (от перс. neft) - горючая маслянистая жидкость со специфическим запахом, распространенная в осадочной оболочке Земли и являющаяся важнейшим полезным ископаемым.
Нахождение в природе
Залежи нефти находятся в недрах Земли на разной глубине, где нефть заполняет свободное пространство между некоторыми породами. Если она находится под давлением газов, то поднимается по скважине на поверхность Земли. По запасам нефти наша страна занимает одно из ведущих мест в мире.
Физические свойства.
Нефть - маслянистая жидкость от светло-бурого до черного цвета с характерным запахом. Она немного легче воды и практически в ней не растворяется. Так как нефть - смесь различных углеводородов, то у нее нет определенной температуры кипения.
Нефть сильно варьирует по цвету (от светло-коричневой, почти бесцветной, до темно-бурой, почти черной) и по плотности (от легкой 0,65-0,70 г/см 3 , до тяжелой 0,98-1,05 г/см 3 ).
Начало кипения нефти обычно выше 28 0 С. температура застывания колеблется от +30 0 до -60 0 С и зависит в основном от содержания парафина (чем его больше, тем температура застывания выше). Теплоемкость нефти 1,7-2,1 кДж/кг; теплота сгорания 43,7-46,2 мДж/кг.
Вязкость изменяется в широких пределах и зависит от химического и фракционного состава нефти и смолистости (содержания в ней асфальтосмолистых веществ). Температура вспышки нефти колеблется от -35 до 1200С в зависимости от фракционного состава и давления насыщенных паров. Нефть растворима в органических растворителях, в воде при обычных условиях практически нерастворима, но может образовывать с ней стойкие эмульсии.
Классификация нефти.
По содержанию серы:
Малосернистые (до 0,5 % S) и Сернистые (0,5-2 % S)
По потенциальному содержанию масел:
М1 - не меньше 25 % и М2 - меньше 25 %.
Высокосернистые (св. 2 % S).
По потенциальному содержанию фракций, выкипающих до 3500С:
a) Т1 - тип нефти, в которой указанных фракций не меньше 45 %,
b) Т2 - 30-44,9 %, c) Т3 - меньше 30 %.
По качеству масел:
Подгруппа И1 - с индексом вязкости масел больше 85
Подгруппа И2 - с индексом 40-85.
Состав нефти
В зависимости от месторождения нефть имеет различный качественный и количественный состав. Так, например, бакинская нефть богата циклопарафинами и сравнительно бедна предельными углеводородами. Значительно больше предельных углеводородов в грозненской и ферганской нефти. Пермская нефть содержит ароматические углеводороды.
Представляя собой жидкость, более легкую, чем вода, нефть разных мест, иногда даже и соседних, различна по многим свойствам: цвету, плотности, летучести, температуры кипения... Однако любая нефть это жидкость почти нерастворимая в воде и по элементарному составу содержащая преимущественно углеводороды с подмесью небольшого количества кислородных, сернистых, азотистых и минеральных соединений, что видно не только по элементарному составу, но и по всем свойствам углеводородов. В бакинской (апшеронской) нефти Марковников и Оглоблин нашли от 86,6 до 87,0% углерода и от 13,1 до 13,4% водорода.
Нефть и способы ее переработки
Истоки современных представлений о происхождении нефти возникли в XVIII - начале XIX века. М. В. Ломоносов заложил гипотезы органического происхождения нефти, объясняя ее образование воздействием "подземного огня" на "окаменелые уголья", в результате чего, по его мнению, образовывались асфальты, нефти и "каменные масла". Идея о минеральном происхождении нефти впервые была высказана А. Гумбольдтом в 1805 году.
Добыча нефти
Почти вся добываемая в мире нефть, извлекается посредством буровых скважин, закрепленных стальными трубами высокого давления. Для подъема нефти и сопутствующих ей газа и воды на поверхность скважина имеет герметичную систему подъемных труб, механизмов и арматуры, рассчитанную на работу с давлениями, соизмеримыми с пластовыми. Добыче нефти при помощи буровых скважин предшествовали примитивные способы: сбор ее на поверхности водоемов, обработка песчаника или известняка, пропитанного нефтью, посредством колодцев.
Очистка нефти
Первый завод по очистке нефти был построен в России в 1745 г., в период правления Елизаветы Петровны, на Ухтинском нефтяном промысле. В Петербурге и в Москве тогда пользовались свечами, а в малых городах - лучинами. Но уже тогда во многих церквях горели неугасаемые лампады. В них наливалось гарное масло, которое было не чем иным, как смесью очищенной нефти с растительным маслом. Купец Набатов был единственным поставщиком очищенной нефти для соборов и монастырей.
В конце XVIII столетия была изобретена лампа. С появлением ламп возрос спрос на керосин.
Очистка нефти - удаление из нефтепродуктов нежелательных компонентов, отрицательно влияющих на эксплуатационные свойства топлив и масел.
Химическая очистка производится путем воздействия различных реагентов на удаляемые компоненты очищаемых продуктов. Наиболее простым способом является очистка 92-92% серной кислотой и олеумом, применяемая для удаления непредельных и ароматических углеводородов.
При адсорбционной очистке из нефтепродуктов удаляются непредельные углеводороды, смолы, кислоты и др. адсорбционную очистку осуществляют при контактировании нагретого воздуха с адсорбентами или фильтрацией продукта через зерна адсорбента.
Каталитическая очистка - гидрогенизация в мягких условиях, применяемая для удаления сернистых и азотистых соединений.
Перегонка нефти
Братья Дубинины впервые создали устройство для перегонки нефти. С 1823 г. Дубинины стали вывозить фотоген (керосин) многими тысячами пудов из Моздока внутрь России. Завод Дубининых был очень прост: котел в печке, из котла идет труба через бочку с водой в пустую бочку. Бочка с водой - холодильник, пустая - приемник для керосина.
На современном заводе вместо котла устраивается ложная трубчатая печь. Вместо трубки для конденсации и разделения паров сооружаются огромные ректификационные колонны. А для приёма продуктов перегонки выстраиваются целые городки резервуаров.
Нефть состоит из смеси различных веществ (главным образом углеводородов) и потому не имеет определённой точки кипения. На трубчатках нефть подогревают до 300-325оС. При такой температуре более летучие вещества нефти превращаются в пар.
Печи на нефтеперегонных заводах особые. С виду они похожи на дома без окон. Выкладываются печи из лучшего огнеупорного кирпича. Внутри, вдоль и поперёк, тянутся трубы. Длина труб в печах достигает километра.
Нефтяники нашли способ перегонки нефти без разложения углеводородов.
Крекинг нефтепродуктов.
Выход бензина из нефти можно значительно увеличить (до 65-70 %) путем расщепления углеводородов с длинной цепью, содержащихся, например, в мазуте, на углеводороды с меньшей относительной молекулярной массой. Такой процесс называется крекингом (от англ. Crack- расщеплять).
Крекингом называется процесс расщепления углеводородов, содержащихся в нефти, в результате которого образуются углеводороды с меньшим числом атомов углерода в молекуле.
Крекинг изобрел русский инженер В.Г. Шухов в 1891 г. В 1913 г изобретение Шухова начали применять в Америке. В настоящее время в США 65% всех бензинов получается на крекинг - заводах.
При крекинге нефть подвергается химическим изменениям. Меняется строение углеводородов. В аппаратах крекинг - заводов происходят сложные химические реакции. Эти реакции усиливаются, когда в аппаратуру вводят катализаторы.
Термический крекинг. Расщепление молекул углеводородов протекает при более высокой температуре (470-550 0 С). Процесс протекает медленно, образуются углеводороды с неразветвленной цепью атомов углерода.
В бензине, полученном в результате термического крекинга, наряду с предельными углеводородами, содержится много непредельных углеводородов. Поэтому этот бензин обладает большей детонационной стойкостью, чем бензин прямой перегонки.
В бензине термического крекинга содержится много непредельных углеводородов, которые легко окисляются и полимеризуются. Поэтому этот бензин менее устойчив при хранении. При его сгорании могут засориться различные части двигателя. Для устранения этого вредного действия к такому бензину добавляют окислители.
Каталитический крекинг. Расщепление молекул углеводородов протекает в присутствии катализаторов и при более низкой температуре (450-500 0 С). Главное внимание уделяют бензину. Его стараются получить больше и обязательно лучшего качества. Каталитический крекинг появился именно в результате долголетней, упорной борьбы нефтяников за повышение качества бензина. По сравнению с термическим крекингом процесс протекает значительно быстрее, при этом происходит не только расщепление молекул углеводородов, но и их изомеризация, т.е. образуются углеводороды с разветвленной цепью атомов углеродов.
Бензин каталитического крекинга по сравнению с бензином термического крекинга обладает еще большей детонационной стойкостью , ибо в нем содержатся углеводороды с разветвленной цепью углеродных атомов.
В бензине каталитического крекинга непредельных углеводородов содержится меньше, и поэтому процессы окисления и полимеризации в нем не протекают. Такой бензин более устойчив при хранении.
Риформинг - (от англ. Reforming - переделывать, улучшать) промышленный процесс переработки бензиновых и лигроиновых фракций нефти с целью получения высококачественных бензинов и ароматических углеводородов. При этом молекулы углеводородов в основном не расщепляются, а преобразуются. Сырьем служит бензинолигроиновая фракция нефти.
Перспективы на будущее
В настоящее время нефтехимия дает почти четверть всей химической продукции. Нефть - ценнейшее природное ископаемое, открывшее перед человеком удивительные возможности "химического перевоплощения". Всего производных нефти насчитывается уже около 3 тысяч.
Нефть занимает ведущее место в мировом топливно-энергетическом хозяйстве. Ее доля в общем потреблении энергоресурсов непрерывно растет. Нефть составляет основу топливно-энергетических балансов всех экономически развитых стран.
Продукты, получаемые из нефти, их применение
Из нефти выделяют разнообразные продукты, имеющие большое практическое значение. Вначале от нее отделяют растворенные углеводороды (преимущественно метан). После отгонки летучих углеводородов нефть нагревают. Первыми переходят в газообразное состояние и отгоняются углеводороды с небольшим числом атомов углерода в молекуле, имеющие относительно низкую температуру кипения. С повышением температуры смеси перегоняются углеводороды с более высокой температурой кипения. Таким образом можно собрать отдельные смеси (фракции) нефти. Чаще всего при такой перегонке получают три основные фракции, которые затем подвергаются дальнейшему разделению. Основные фракции нефти следующие:
Фракция, собираемая от 400 до 200 0С, - газолиновая фракция бензинов - содержит углеводороды от С5 Н12 до С1 Н 24 . При дальнейшей перегонке выделенной фракции получают: газолин (от 400 до 700С), бензин (от 700 до 1200 С) - авиационный, автомобильный и т.д.
Лигроиновая фракция , собираемая в пределах от 1500 до 2500 С, содержит углеводороды от С8 Н18 до С14 Н30 . Лигроин применяется как горючее для тракторов.
Керосиновая фракция включает углеводороды от С12 Н26 до С18 Н38 с температурой кипения от 1800 до 300 0С. керосин после очистки используется в качестве горючего для тракторов, реактивных самолетов и ракет.
Газойль (выше 275 0 С) - дизельное топливо.
Мазут - остаток от перегонки. Содержит углеводороды с большим числом атомов углерода (до многих десятков) в молекуле. Мазут также разделяют на фракции:
Соляровые масла - дизельное топливо,
Смазочные масла (авиатракторные, авиационные, индустриальные и др.),
Вазелин (основа для косметических средств и лекарств).
Из некоторых сортов нефти получают парафин (для производства спичек, свечей и др.). После отгонки остается гудрон . Его широко применяют в дорожном строительстве.
Оборудование
-
коллекции: «Нефть и продукты ее переработки», «Топливо», «Уголь и продукты его переработки»
Задание № 1. Ознакомление с различными видами природных источников углеводородов.
Таблица № 1
-
ПИУ
Природный и попутный газы
Нефть
Уголь
1. Агрегатное состояние и состав
2. Запасы
3. Переработка
4. Применение
Задание № 2. Ознакомление с коллекцией «Нефть и продукты ее переработки»
1. Рассмотрите выданную вам коллекцию. Заполните таблицу № 2. Объясните, почему все нефтепродукты (кроме мазута) называют светлыми. Запишите формулы углеводородов, образующих фракции светлых нефтепродуктов. Какие физические процессы лежат в основе их получения?
2. Познакомьтесь со смазочными маслами, получаемыми перегонкой мазута. Какие процессы лежат в основе их получения? Таблица № 2
Продукты
НЕФТЕПЕРЕРАБОТКИ
Свойства
(агр. сост., цвет, особенности)
Применение
1. Газ
2. Бензин
3. Лигроин
4. Керосин
5. Мазут
6. Гудрон
Вопросы для выводов
Дать оценку экологической и экономической эффективности нефти, угля и природного газа как топлива и сырья для хим. промышленности.
Литература
Габриелян О. С. Химия: учеб. для студ. проф. учеб. заведений. - М.,2010
Лабораторная работа №10 Карбоновые кислоты, глицерин
Свойства многоатомных спиртов
Цели работы
-
изучить качественные реакции на многоатомные спирты;
-
научиться проводить качественные реакции в лабораторных условиях соблюдая правила техники безопасности;
-
научиться проводить наблюдения и делать выводы,
Краткие теоретические сведения
Многоатомные спирты
Получение
1. Этиленгликоль (этандиол-1,2) синтезируют из этилена различными способами:
3CH2=CH2 + 2KMnO4 + 4H2O 3HO-CH2-CH2-OH + 2MnO2 + 2KOH
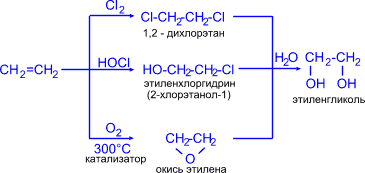
2. Глицерин (пропантриол -1,2,3) получают гидролизом жиров (тема "Жиры") или из пропилена по схемам:

Физические свойства
Этиленгликоль и глицерин - бесцветные, вязкие жидкости, хорошо растворимые в воде, имеют высокие температуры кипения. Глицерин - безопасен, а этиленгликоль - сильный яд.
Химические свойства
Для многоатомных спиртов характерны основные реакции одноатомных спиртов. В отличие от них, они могут образовывать производные по одной или по нескольким гидроксильным группам, в зависимости от условий проведения реакций.
1. Многоатомные спирты, как и одноатомные, проявляют свойства кислот при взаимодействии с активными металлами.
CH2-OH
I
CH2-OH
Na
---
-1/2H2
CH2-ONa
I
CH2-OH
Na
---
-1/2H2
CH2-ONa
I
CH2-ONa
Увеличение числа гидроксильных групп в молекуле приводит к усилению кислотных свойств многоатомных спиртов по сравнению с одноатомными.
2. Они способны растворять свежеосаждённый гидроксид меди (II) с образованием внутрикомплексных соединений:
CH2-OH
2 I + Cu(OH)2(голубой осадок)
CH2-OH
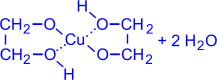 (гликолят меди (ярко-синий раствор))
(гликолят меди (ярко-синий раствор))
(одноатомные спирты с Cu(OH)2 не реагируют).
3. Глицерин легко нитруется, давая тринитроглицерин - сильное взрывчатое вещество (основа динамита):
CH2-O-
-H
HO-
-NO2
CH2-O-NO2
I
H2SO4
I
CH -O-
-H
+
HO-
-NO2
---
CH-O-NO2
+ 3H2O
I
I
CH2-O-
-H
HO-
-NO2
CH2-O-NO2
Применение
Этиленгликоль: в качестве антифриза; для синтеза высокомолекулярных соединений (например, лавсана).
Глицерин: в парфюмерии и в медицине (для изготовления мазей, смягчающих кожу); в кожевенном производстве и в текстильной промышленности; для производства нитроглицерина.
Реактивы и оборудование
-
вода, глицерин, щёлочь, сульфат меди (II)
-
пробирки, штатив для пробирок, пробка
Опыт № 1. Свойства глицерина.
К 1 мл дистиллированной воды в пробирке прилейте 1 мл глицерина и смесь взболтайте. Затем добавьте еще 1 мл глицерина и еще раз перемешайте смесь. Что ложно сказать о растворимости глицерина в воде?
Опыт №2. Качественная реакция на глицерин.
К 2 мл раствора щелочи в пробирке прилейте несколько капель раствора медного купороса (сульфата меди (II)). Что наблюдаете? Составьте УХР.
К полученному осадку прибавьте по каплям глицерин и смесь взболтайте. Что наблюдаете? Составьте УХР.
Вопросы для выводов
Как можно отличить многоатомные спирты от других веществ?
Литература
Габриелян О. С. Химия: учеб. для студ. проф. учеб. заведений. - М., 2010
Лабораторная работа№10
Карбоновые кислоты
Цель работы:
-
изучить свойства карбоновых кислот;
-
исследовать химические свойства карбоновых кислот, в лаборатории соблюдая правила техники безопасности;
-
проводить наблюдения и делать выводы.
Краткие теоретические сведения.
. Карбоновые кислоты - органические соединения, в молекулах которых содержатся одна или несколько карбоксильных групп, соединённых с углеводородным радикалом или атомом водорода
Классификация карбоновых кислот
1. одноосновные, двухосновные и многоосновные (в зависимости от числа функциональных групп),
2. предельные, непредельные и ароматические (в зависимости от строения радикала).
Общая формула предельных одноосновных кислот:
Атом «Н» в группе «- OH» в кислотах гораздо более подвижен, чем в молекулах спиртов. Поэтому растворимые в воде карбоновые кислоты диссоциируют:
Номенклатура.
а) исторически сложившиеся названия кислот: муравьиная, уксусная, пропионовая, масляная, валериановая, капроновая, энантовая;
б) по международной номенклатуре - от названий соответствующих углеводородов + "овая" с прибавлением слова "кислота".
Пример: Н-СООН муравьиная или метановая, СН3-СООН уксусная или этановая кислоты.
O O
// //
R - C или CnH2n+1 - C
\ \
OH O - H
O
//
R - C ⇆ R - COO- + H+.
\
O - H
Получение
В лаборатории карбоновые кислоты можно получить из их солей, действуя на них серной кислотой при нагревании, например: 2СН3 - СООNa + H2SO4 2СН3 - СООН + Na2SO4
В промышленности получают окислением углеводородов, спиртов и альдегидов.
Химические свойства 1. Из-за смещения электронной плотности от гидроксильной группы O-H к сильно поляризованной карбонильной группе C=O молекулы карбоновых кислот способны к электролитической диссоциации: R-COOH → R-COO- + H+
Сила карбоновых кислот в водном растворе невелика.
2. Карбоновые кислоты обладают свойствами, характерными для минеральных кислот. Они реагируют с активными металлами, основными оксидами, основаниями, солями слабых кислот.
2СH3COOH + Mg → (CH3COO)2Mg + H2
2СH3COOH + СaO → (CH3COO)2Ca + H2O
H-COOH + NaOH → H-COONa + H2O
2СH3CH2COOH + Na2CO3 → 2CH3CH2COONa + H2O + CO2
СH3CH2COOH + NaHCO3 → CH3CH2COONa + H2O + CO2
Карбоновые кислоты слабее многих сильных минеральных кислот (HCl, H2SO4 и т.д.) и поэтому вытесняются ими из солей: СH3COONa + H2SO4(конц.) →CH3COOH + NaHSO4
3. Образование функциональных производных:
a) при взаимодействии со спиртами (в присутствии концентрированной H2SO4) образуются сложные эфиры. Образование сложных эфиров при взаимодействии кислоты и спирта в присутствии минеральных кислот называется реакцией этерификации (ester с латинского "эфир").
CH3- -OH + HO-CH3 CH3-
-OH + HO-CH3 CH3- -OCH3 + H2O
-OCH3 + H2O
уксусная кислота метиловый спирт метиловый эфир уксусной кислоты
Общая формула сложных эфиров R- -OR' где R и R' - углеводородные радикалы: в сложных эфирах муравьиной кислоты - формиатах -R=H.
-OR' где R и R' - углеводородные радикалы: в сложных эфирах муравьиной кислоты - формиатах -R=H.
Обратной реакцией является гидролиз (омыление) сложного эфира:
CH3- -OCH3 + HO-H CH3-
-OCH3 + HO-H CH3- -OH + CH3OH. Как видно, процесс этерификации обратимый.
-OH + CH3OH. Как видно, процесс этерификации обратимый.
b) при воздействии водоотнимающих реагентов в результате межмолекулярной дегидратации образуются ангидриды
CH3- -OH + HO-
-OH + HO- -CH3 →CH3-
-CH3 →CH3- -O-
-O- -CH3 + H2O
-CH3 + H2O
4. Галогенирование. При действии галогенов (в присутствии красного фосфора) образуются α-галогензамещённые кислоты:
α
CH3-CH2-COOH →CH3-
CH-COOH (α -бромпропионовая кислота(2-бромпропановая кислота)) + HBr
I
Br
Применение
Муравьиная кислота - в медицине, в пчеловодстве, в органическом синтезе, при получении растворителей и консервантов; в качестве сильного восстановителя.
Уксусная кислота - в пищевой и химической промышленности (производство ацетилцеллюлозы, из которой получают ацетатное волокно, органическое стекло, киноплёнку; для синтеза красителей, медикаментов и сложных эфиров).
Масляная кислота - для получения ароматизирующих добавок, пластификаторов и флотореагентов.
Щавелевая кислота - в металлургической промышленности (удаление окалины).
Стеариновая C17H35COOH и пальмитиновая кислота C15H31COOH - в качестве поверхностно-активных веществ, смазочных материалов в металлообработке.
Олеиновая кислота C17H33COOH - флотореагент и собиратель при обогащении руд цветных металлов.
Реактивы и приборы
-
раствор гидроксида натрия, карбонат натрия, карбонат кальция,оксид меди (II), уксусная кислота, лакмус синий, цинк;
-
штатив с пробирками, водяная, прибор для нагревания, спички, держатель для пробирок.
Опыт № 1. Свойства уксусной кислоты.
Налейте в четыре пробирки по 2 мл раствора уксусной кислоты. Осторожно понюхайте этот раствор. Что ощущаете? Вспомните, где вы применяете уксусную кислоту дома.
В первую пробирку с раствором уксусной кислоты добавьте несколько кусочек лакмуса. Что наблюдаете? Затем нейтрализуйте кислоту избытком щелочи. Что наблюдаете? Запишите УХР.
В три оставшиеся пробирки с раствором уксусной кислоты добавьте: во вторую - гранулу цинка, в третью - несколько крупинок оксида меди (II) и подогрейте ее, в четвёртую - кусочек мела или соды (на кончике шпателя). Что наблюдаете? Запишите УХР.
Вопросы для выводов
-
Дать определение классу веществ "Карбоновые кислоты".
-
Указать какие свойства карбоновых кислот как неорганических кислот были исследованы в данной работе.
Контрольные вопросы
-
Назовите три основных способа получения уксусной кислоты.
-
Исходя из углерода, воды, показать все возможные способы получения уксусной кислоты
(указать условия течения реакций). Назвать все промежуточные вещества.
Литература
Габриелян О. С. Химия: учеб. для студ. проф. учеб. заведений. - М., 2010.
Лабораторная работа №11
Углеводы
Цели работы
-
познакомиться с важнейшими химическими свойствами глюкозы и крахмала;
-
отработать навыки экспериментальной работы, соблюдая правила техники безопасности при работе в кабинете химии.
Краткие теоретические сведения
Углеводы - природные соединения. Являясь основным компонентом пищи, углеводы поставляют большую часть энергии, необходимой для жизнедеятельности. Некоторые углеводы входят в состав нуклеиновых кислот, осуществляющих биосинтез белка и передачу наследственных признаков.
Углеводы широко распространены в природе и играют большую роль в биологических процессах живых организмов и человека. К ним относятся, например, виноградный сахар или глюкоза, свекловичный (тростниковый) сахар или сахароза, крахмал и клетчатка. Название "углеводы" возникло в связи с тем, что химический состав большинства соединений этого класса выражался общей формулой Сn(H2O)m. Дальнейшее исследование углеводов показало, что такое название является неточным. Во-первых, найдены углеводы, состав которых не отвечает этой формуле. Во-вторых, известны соединения (формальдегид СН2О, уксусная кислота С2Н4О2), состав которых хотя и соответствует общей формуле Сn(H2O)m, но по свойствам они отличаются от углеводов.
Углеводы в зависимости от их строения можно подразделить на моносахариды, дисахариды и полисахариды.
В молекулах моносахаридов может содержаться от четырех до десяти атомов углерода. Названия всех групп моносахаридов, а также названия отдельных представителей оканчиваются на - оза. Поэтому в зависимости от числа атомов углерода в молекуле моносахариды подразделяют на тетрозы, пентозы, гексозы и т. д. Наибольшее значение имеют гексозы и пентозы.
Классификация углеводов
Простые
(не подвергаются гидролизу)
Сложные (подвергаются гидролизу)
Моносахариды
Олигосахариды (Дисахариды)
Полисахариды
Глюкоза С6Н12О6
Фруктоза С6Н12О6
Рибоза С5Н10О5
Сахароза (дисахарид)
С12Н22О11
Крахмал (С6Н10О5)n
Целлюлоза (С6Н10О5)n
Глюкоза C6H12O6, химическое строение глюкозы можно выразить формулой:
O
//
CH2OH - CHOH - CHOH - CHOH - CHOH - C
\
H
Вывод: глюкоза - многоатомный альдегидоспирт. Изомер глюкозы - фруктоза - кетоноспирт.
В водном растворе глюкозы находятся в динамическом равновесии три изомерные формы: α-форма, альдегидная и β-форма.
К дисахаридам относятся: сахароза (сахар), мальтоза, лактоза. Все они имеют молекулярную формулу С12Н22О11. Часто сведения о строении веществ можно получить путём расщепления - гидролиза молекул. Анализ продуктов гидролиза позволяет обнаружить фруктозу и глюкозу. (Молекулы сахарозы состоят из остатков α-глюкозы и β-фруктозы).
Крахмал - полисахарид. Это белый аморфный порошок, не растворимый в воде. В горячей воде крахмальные зёрна набухают и образуют коллоидный раствор, называемый крахмальным клейстером. Крахмал - природное высокомолекулярное соединение, формула (С6Н10О5)n (n - от нескольких сотен до нескольких тысяч). О строении крахмала можно судить по продуктам его гидролиза. Гидролиз обычно проходит постепенно: в начале образуются продукты с меньшей молекулярной массой, чем крахмал, - декстрины, затем дисахарид - мальтоза и, наконец, глюкоза. Схема гидролиза:
(С6Н10О5)n → (С6Н10О5)n-x → C12H22O11 → C6H12O6.
Установлено, что в результате гидролиза крахмала образуется α-глюкоза. Отсюда вывод: макромолекулы крахмала состоят из остатков α - глюкозы. (При неполном гидролизе получается смесь декстринов и глюкозы, называемая патокой).
Приборы и реактивы
-
раствор глюкозы, крахмал, растворы CuSO4 и NaOH, раствор йода (I2), кусочек чёрного хлеба;
-
штатив с пробирками, прибор для нагревания, держатель, спички.
Опыт № 1. Свойства глюкозы и сахарозы.
а) В пробирку внесите 5 капель раствора глюкозы, каплю раствора соли меди (II) и при взбалтывании несколько капель раствора гидроксида натрия до образования светло - синего раствора. Такой опыт проделывали с глицерином.
Что общего в свойствах глицерина и глюкозой? Что доказывает опыт с глюкозой? Наличие какой функциональной группы доказывает опыт, к какому классу веществ относится глюкоза. Составить уравнение реакции глюкозы с гидроксидом меди (II).
б) Полученный раствор нагреть. Что наблюдаете?
Наличие, какой функциональной группы в молекуле глюкозы доказывает опыт? Составить уравнение реакции глюкозы с гидроксидом меди (II) при нагревании.
Опыт №2. Свойства крахмала.
При помощи шпателя поместить в пробирку крахмал и прилить 2 мл воды. Содержимое взболтать. Далее вылить небольшими порциями содержимое пробирки (при помешивании) в стакан с 5-6 мл горячей воды. Полученный крахмальный клейстер - коллоидный раствор - использовать для проведения последующих опытов.
а) Качественная реакция на крахмал.
К 5-6 каплям крахмального клейстера в пробирке прибавить каплю спиртового раствора йода. Какую окраску принимает раствор?
б) Ферментативный гидролиз крахмала.
Под действием пищеварительного фермента амилазы происходит гидролиз крахмала.
Хорошо разжеванный маленький кусочек чёрного хлеба пометить в пробирку. Прилить к нему каплю раствора соли меди (II) и несколько капель раствора NaOH до появления слабо - голубого окрашивания. Содержимое пробирки нагреть. Что замечаете? Указать конечный продукт ферментативного гидролиза крахмала.
Вопросы для выводов
1. Указать какие функциональные группы имеет глюкоза, и какие свойства проявляет?
2. Какие важные химические свойства крахмала были отражены в проведенных реакциях?
Контрольные вопросы
1. Какие вещества относятся к углеводам, и почему им было дано такое название?
2. Какие химические свойства для глюкозы и глицерина являются общими, и чем эти вещества отличаются друг от друга? Напишите уравнения соответствующих реакций.
3. Составить уравнения реакций при помощи, которых сахарозу можно превратить в этанол.
Литература
Габриелян О. С. Химия: учеб. для студ. проф. учеб. заведений. - М.,20 10
Лабораторная работа №12
Белки
Цели работы
-
познакомиться с важнейшими химическими свойствами белков;
-
отработать навыки экспериментальной работы, соблюдая правила техники безопасности при работе в кабинете химии.
Краткие теоретические сведения
АМИНОКИСЛОТЫ
Аминокислотами называются карбоновые кислоты, в углеводородном радикале которых один или несколько атомов водорода замещены аминогруппами. В зависимости от взаимного расположения карбоксильной и аминогрупп различают -, -, - и т.д. аминокислоты.
CH3-
CH-COOH - аминопропионовая кислота
I
NH2
Чаще всего термин "аминокислота" применяют для обозначения карбоновых кислот, аминогруппа которых находится в - положении, т.е. для - аминокислот. Общую формулу - аминокислот можно представить следующим образом:
H2N-
CH-COOH
I
R
Таблица. Важнейшие α- аминокислоты,
входящие в состав белков.
*Незаменимые α- аминокислоты
Получение
1) Важнейший источник аминокислот - природные белки, при гидролизе которых образуются смеси - аминокислот. Разделение этой смеси - довольно сложная задача, однако по обыкновению одна или две аминокислоты образуются в значительно больших количествах, чем все другие, и их удается выделить достаточно просто.
2) Синтез аминокислот из галогенозамещенных кислот действием аммиака
3) Микробиологический синтез. Известны микроорганизмы, которые в процессе жизнедеятельности продуцируют - аминокислоты белков.
Физические свойства
Аминокислоты представляют собой кристаллические вещества с высокими (выше 250○С) температурами плавления, которые мало отличаются у индивидуальных аминокислот и поэтому нехарактерны. Плавление сопровождается разложением вещества. Аминокислоты хорошо растворимы в воде и нерастворимы в органических растворителях, чем они похожи на неорганические соединения. Многие аминокислоты обладают сладким вкусом.
Химические свойства
1) Некоторые свойства аминокислот, в частности высокая температура плавления, объясняется своеобразным их строением. Кислотная (-COOH) и основная (-NH2) группы в молекуле аминокислоты взаимодействуют друг с другом, образуя внутренние соли (биполярные ионы). Например, для глицина
H2N-CH2-COOH H3N+-CH2-COO-
2) Вследствие наличия в молекулах аминокислот функциональных групп кислотного и основного характера α- аминокислоты являются амфотерными соединениями, т.е. они образуют соли как с кислотами, так и со щелочами.
3) 3) α- Аминокислоты вступают друг с другом в реакцию поликонденсации, приводя к амидам кислот. Продукты такой конденсации называются пептидами. При взаимодействии двух аминокислот образуется дипептид:
-
H2N-H
I
CH-
O
II
C-NH-
CH3
I
CH-
O
II
C-OH + H2O
глицилаланин
Аминокислота
Сокращенное (трехбуквенное) название
Строение R
Алифатические
Глицин
Gly
H-
Аланин
Ala
CH3-
Валин*
Val
(CH3)2CH-
Лейцин*
Leu
(CH3)2CH-CH2-
Изолейцин*
Ile
CH3-CH2-CH-
I
CH3
Содержащие OH- группу
Серин
Ser
HO-CH2-
Треонин*
Thr
CH3-CH(OH)-
Содержащие COOH- группу
Аспарагиновая
Asp
HOOC-CH2-
Глутаминовая
Glu
HOOC-CH2-CH2-
Содержащие NH2CO- группу
Аспарагин
Asn
NH2CO-CH2-
Глутамин
Gln
NH2CO-CH2-CH2-
Содержащие NH2- группу
Лизин*
Lys
NH2-(CH2)3-CH2-
Аргинин
Arg
NH2-C-NH-(CH2)2-CH2-
II
NH
Серусодержащие
Цистеин
Cys
HS-CH2-
Метионин*
Met
CH3-S-CH2-CH2-
Ароматические
Фенилаланин*
Phe
Тирозин
Tyr

Гетероциклические
Триптофан*
Trp
Гистидин
His

Иминокислота
Пролин
Pro
Пептиды. Белки
Пептиды и белки представляют собой высокомолекулярные органические соединения, построенные из остатков α- аминокислот, соединенных между собой пептидными связями.
Ни один из известных нам живых организмов не обходится без белков. Белки служат питательными веществами, они регулируют обмен веществ, исполняя роль ферментов - катализаторов обмена веществ, способствуют переносу кислорода по всему организму и его поглощению, играют важную роль в функционировании нервной системы, являются механической основой мышечного сокращения, участвуют в передаче генетической информации и т.д. Как видно, функции белков в природе универсальны. Белки входят в состав мозга, внутренних органов, костей, кожи, волосяного покрова и т.д. Основным источником α- аминокислот для живого организма служат пищевые белки, которые в результате ферментативного гидролиза в желудочно-кишечном тракте дают α- аминокислоты. Многие α- аминокислоты синтезируются в организме, а некоторые необходимые для синтеза белков α- аминокислоты не синтезируются в организме и должны поступать извне. Такие аминокислоты называются незаменимыми. К ним относятся валин, лейцин, треонин, метионин, триптофан и др. При некоторых заболеваниях человека перечень незаменимых аминокислот расширяется.
Пептиды и белки различают в зависимости от величины молекулярной массы. Условно считают, что пептиды содержат в молекуле до 100 (соответствует молекулярной массе до 10000), а белки - свыше 100 аминокислотных остатков (молекулярная масса от 10000 до нескольких миллионов). При этом в пептидах различают олигопептиды, содержащие в цепи не более 10 аминокислотных остатков, и полипептиды, содержащие до 100 аминокислотных остатков.
Первичная структура белка - специфическая аминокислотная последовательность, т.е. порядок чередования α- аминокислотных остатков в полипептидной цепи.
Вторичная структура белка - конформация полипептидной цепи, т.е. способ скручивания цепи в пространстве за счет водородных связей между группами NH и CO. Одна из моделей вторичной структуры - спираль.
Третичная структура белка - трехмерная конфигурация закрученной спирали в пространстве, образованная за счет дисульфидных мостиков -S-S- между цистеиновыми остатками и ионных взаимодействий.
Четвертичная структура белка - структура, образующаяся за счет взаимодействия между разными полипептидными цепями. Четвертичная структура характерна лишь для некоторых белков, например гемоглобина.
Химические свойства
1) Денатурация. Утрата белком природной (нативной) конформации, сопровождающаяся обычно потерей его биологической функции, называется денатурацией. С точки зрения структуры белка - это разрушение вторичной и третичной структур белка, обусловленное воздействием кислот, щелочей, нагревания, радиации и т.д. Первичная структура белка при денатурации сохраняется. Денатурация может быть обратимой (так называемая, ренатурация) и необратимой. Пример необратимой денатурации при тепловом воздействии - свертывание яичного альбумина при варке яиц.
2) Гидролиз белков - разрушение первичной структуры белка под действием кислот, щелочей или ферментов, приводящее к образованию - аминокислот, из которых он был составлен.
3) Качественные реакции на белки:
a) Биуретовая реакция - фиолетовое окрашивание при действии солей меди (II) в щелочном растворе. Такую реакцию дают все соединения, содержащие пептидную связь.
b) Ксантопротеиновая реакция - появление желтого окрашивания при действии концентрированной азотной кислоты на белки, содержащие остатки ароматических аминокислот (фенилаланина, тирозина).
Приборы и реактивы
-
раствор белка, растворы сульфата меди (II) и щёлочи, азотная кислота, водный раствор аммиака «нашатырный спирт», шесть;
-
штатив с пробирками, прибор для нагревания, держатель, тигельные щипцы, спички.
Опыт № 1. Свойства белков
-
В пробирку налейте 2 мл раствора белка и добавьте 2 мл раствора щелочи, а затем несколько капель раствора медного купороса (сульфата меди (II)). Что наблюдаете?
-
В пробирку с 2 мл раствора белка добавьте несколько капель азотной кислоты. Что наблюдаете? Нагрейте содержимое пробирки. Что наблюдаете? Охладите смесь и добавьте к ней по каплям 2-3 мл нашатырного спирта. Что наблюдаете?
-
Подожгите несколько шерстяных нитей. Охарактеризуйте запах горящей шерсти.
-
К 3-4 мл раствора белка в воде добавьте несколько капель раствора медного купороса (сульфата меди (II)). Что наблюдаете?
Вопросы для выводов
Указать какие качественные реакции характерны для белков?
Контрольные вопросы
1. Что такое денатурация?
2. Указать условия денатурации белковых молекул.
Литература
Габриелян О. С. Химия: учеб. для студ. проф. учеб. заведений. - М., 2010
Практическая работа№1. Характеристика элемента по положению его в Периодической системе Д.И. Менделеева. Написание электронно-графических формул.
Цель работы: сформировать практические навыки и умения характеристика химических элементов с учётом положения в периодической системе, написания электронных и электронографических формул.
Задание № 1.
Дать характеристику химических элементов с № 1 по № 20 (по выбору преподавателя) по плану
ПЛАН ХАРАКТЕРИСТИКИ ХИМИЧЕСКОГО
ЭЛЕМЕНТА
ПО ПЕРИОДИЧЕСКОЙ СИСТЕМЕ Д.И. МЕНДЕЛЕЕВА.
1. Положение элемента в периодической системе:
-
порядковый номер
-
период, ряд
-
группа, подгруппа
-
относительная атомная масса
2. Строение атома элемента:
-
заряд ядра атома
-
формула состава атома (количество р; n; е )
-
количество энергетических уровней и размещение на них электронов
-
формула электронной конфигурации (1S2S2Р3S3P4S4P5S4D5P6S5D4F6P7S6D5F7P)
-
квантовые ячейки (графическая формула)
-
число электронов на последнем слое => металл или неметалл
3. Формулы соединений:
-
оксида
-
гидроксида (кислоты или основания)
-
летучего водородного соединения (для неметаллов)
4. Химический характер, его доказательство:
а) кислотный: кислотный оксид + щелочь = соль + вода; кислота + основание = соль + вода
б) основной: основной оксид + кислота = соль + вода;основание + кислота = соль + вода
в) амфотерный (а + б)
5. Сравнение с соседями:
а) по периоду б) по группе
(металл с неметаллами сравнивать нельзя)
Задание № 2
Определите химический элемент по его электронной формуле.
Вариант
1s2 2s2 2p6 3s2 3p6 4s2 3d1
1s2 2s2 2p6 3s2 3p6 4s2 3d3
1s2 2s2 2p6 3s2 3p6 4s2 3d6
1s2 2s2 2p6 3s2 3p6 4s1 3d10
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p1
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p4
Вопросы для выводов
Почему формулировка ПЕРИОДИЧЕСКОГО ЗАКОНА (Д. И. Менделеева) была изменена? Поменялся ли физический смысл ПЗ?
Литература
Габриелян О. С. Химия: учеб. для студ. проф. учеб. заведений. - М.,2010
Практическая работа №2.
Приготовление раствора соли с определённой массовой долей растворённого вещества.
Цель работы: сформировать практические навыки и умения приготовления раствора с определённой массовой долей растворённого вещества.
1. Произведите расчёты: определите массу соли и воды необходимых для приготовления раствора, указанных в условии задачи.
1Вариант. Приготовить 20 г. водного раствора поваренной соли с массовой долей соли 5%.
2Вариант. Приготовить 25 г. водного раствора хлорида калия с массовой долей соли 4%.
2. Отвесить соль и поместить её в стакан. Отмерьте измерительным цилиндром необходимый объём воды и вылейте в стакан. Содержимое перемешайте палочкой.
3. В отчёте приведите расчёты, последовательность действий, сделайте рисунок.
Литература
Габриелян О. С. Химия: учеб. для студ. проф. учеб. заведений. - М.,2010
Практическая работа№3.
Получение, собирание и распознавание газов.
Цель работы: сформировать практические навыки получения газообразных неорганических веществ, умения по их идентификации с помощью качественных реакций, а также изучение некоторых свойств.
Порядок работы .1. Получения водорода .В пробирку поместите две гранулы цинка и прилейте 1-2 мл соляной кислоты. (Что наблюдаете ? Напишите уравнение реакции.)
Накройте пробирку с цинком пробиркой большого диаметра. Через 1-2 мин поднимайте большую пробирку вверх и , не переворачивая её , закрыв пальцем , поднесите к пламени спиртовки , откройте пробирку . (Что наблюдаете ? Что можно сказать о чистоте собранного вами водорода ? Почему водород собирали в перевернутую вверх дном пробирку ?)
2.Получение углекислого газа. В пробирку объёмом 20 мл прилейте 5-7 мл раствор уксусной кислоты . Через 1-2 мин внесите в пробирку горящую лучинку . ( Что наблюдаете? ) В пробирку налейте 1-2 мл прозрачного раствора известковой воды. Через стеклянную пробирку осторожно продувайте через раствор выдыхаемой вами воздух. (Что наблюдаете?) Напишите уравнение реакции и выводы.
Практическая работа №4
Решение экспериментальных задач по неорганической химии
Цель работы: формирование практических навыков и умений осуществлять цепочки превращений, применять знания о качественных реакциях, написании уравнений гидролиза, определении среды раствора.
вариант 1
1. Осуществите превращения:
Кальций → гидроксид кальция → хлорид кальция → карбонат кальция
В ходе превращений установите наличие гидроксид-ионов в гидроксиде кальция и докажите качественный состав хлорида кальция.
2. Составьте план анализа и определите, в каких пробирках (1,2,3) находятся растворы: нитрата калия, фосфата натрия и сульфата аммония.
3. Составьте уравнения гидролиза сульфата аммония, запишите окраску лакмуса, фенолфталеина и метилоранжа в таком растворе.
вариант 2
1. Осуществите превращения:
фосфор → оксид фосфора (v)→ фосфорная кислота → фосфат натрия
В ходе превращений установите наличие фосфат-ионов в фосфате натрия и докажите качественный состав фосфата натрия.
2. Составьте план анализа и определите, в каких пробирках (1,2,3) находятся растворы: сульфата магния, нитрата аммония и карбоната калия.
Практическая работа №5 Решение экспериментальных задач на идентификацию органических соединений.
Цель работы: сформировать практические навыки и умения
по определению органических соединений с помощью качественных реакций
Теоретическая часть
Распознавание органических веществ
Этилен -- KMnO4 → обесцвечивание раствора в результате образования
этиленгликоля
-- Br2 (вода) → обесцвечивание раствора в результате образования
дибромэтана
Этиловый спирт -- CuO → Cu↓, выделение паров уксусного альдегида
Многоатомные спирты -- Cu(OН)2 → раствор василькового цвета
Фенол -- Br2 (вода) → белый осадок трибромфенола
-- FeCl 3 → раствор фиолетового цвета
Альдегиды -- Aq2O → Aq↓ («серебряное зеркало»)
-- Cu (ОН)2 → красный осадок Cu2O↓
Муравьиная кислота -- лакмус → раствор красного цвета
-- Aq2O → Aq↓ («серебряное зеркало»)
Уксусная кислота -- лакмус → раствор красного цвета
Глюкоза -- Aq2O → Aq↓ («серебряное зеркало»)
-- Cu (ОН)2 → красный осадок Cu2O↓
Крахмал -- раствор I2→ раствор синего цвета
Белок яичный -- Aq2O → раствор красно-фиолетового цвета
-- НNО3→ осадок желтого цвета
Анилин -- Br2 (вода) → белый осадок триброманилина
Задача №1. В трёх пробирках под номерами находятся растворы веществ : белок , глицерин и глюкоза. Определите каждое вещество при помощи одних и тех же реактивов. Запишите объяснения и уравнения реакций.
Задача №2. В двух пробирках содержатся вещества: уксусная кислота и этиловый спирт. С помощью каких реагентов можно определить эти вещества? Докажите опытным путём, запишите уравнения реакций.
Задача №3. Докажите опытным путём, что сырой картофель
и хлеб содержат крахмал. Сделать вывод.
Практическая работа№6
Распознавание пластмасс и химических волокон.
Цель работы. Научиться на практике распознавать пластмассы и волокна, упрочить связь теоретической химии с повседневной жизнью, получить навыки проведения химического эксперимента, навыки самостоятельного теоретического толкования наблюдений и вывод, вытекающих из эксперимента, получить навыки соблюдения правил техники безопасности.
Материально-техническое оснащение: спиртовка, ложка для сжигания веществ, пронумерованные образцы пластмасс и волокон.
Порядок работы.
-
Возьмите щипцами образец пластмассы, волокна и внесите его в верхнюю часть пламени , обратите внимание плавиться ли образец ,как быстро он загорается .
-
После того как вещество загорелось , выньте его из пламени. Гаснет пламя или продолжает гореть ?
-
К выделяющемся продуктам сгорания поднесите влажную лакмусовую бумажку , отметьте изменение цвета .
-
Движением руки направьте к носу газообразные продукты сгорания и определить их запах.
-
Дождитесь, когда твёрдый остаток горения полностью остынет . рассмотрите его внешней вид ,цвет .
-
Попробуйте растереть золу или спёкшийся шарик между пальцами Изучая свойство пластмасс и волокон воспользуйтесь данными таблицы .
Названия пластмассы или волокна
Физические свойства
Отношение к нагреванию
Характер и продукты горения
Свойства пластмасс
Полиэтилен
Неокрашенный материал, полупрозрачен. эластичный ,жирный на ощупь
Плавится. Из расплавленного материала можно вытянуть нити
Горит синеватым пламенем с запахом горящей свечи. Продолжает гореть вне пламени, при этом с образца падают капли.
Поливинилхлорид
Эластичный, механически прочен, имеет различную окраску
Плавится и начинает разлагаться
Горит коптящем пламенем. Выделяется хлороводород, обнаруживается по покраснению лакмусовой бумажки.
Тефлон
Умеренно эластичный,бело-молочногоцвета, прочный, жирный на ощупь
Оплавляется при длительном нагревании, на поверхности появляется чёрный налет
При нагревании в пламени спиртовки не горит
Целлулоид
Фенолоформальдегидная смола
Не эластичный твёрдый материал , как правило , тёмных тонов
Не плавится, разлагается
Загорается с трудом. Вне пламени постепенно гаснет.. Продукты горения имеют характерный запах фенола
Название волокна
Отношение к нагреванию
Характер и продукты горения
Хлопок
Быстро сгорает с запахом жжёной бумаги . Остаётся серая зола .
Шерсть , шёлк
Горит медленно , с образованием чёрного шарика . Запах жженного рога .
Капрон
Плавится с образованием тёмного блестящего шарика . Из расплава можно вытянуть нить .
Загорается при сильном нагревании с не приятным запахом .Продукты горения окрашивают лакмусовую бумажку в синий цвет .
Лавсан
То же
Горит коптящим пламенем . Продукты горения имеют запах .
Ацетатное волокно
Быстро сгорает, образуя не хрупкий темный шарик . В не пламени постепенно гаснет . Продукты горения окрашивают лакмусовую бумажку в синий цвет .
Литература
Габриелян О. С. Химия: учеб. для студ. проф. учеб. заведений. - М., 2010.
53