- Преподавателю
- Химия
- Обощающее занятие по теме МЕТАЛЛЫ (подготовка к ЕГЭ)
Обощающее занятие по теме МЕТАЛЛЫ (подготовка к ЕГЭ)
| Раздел | Химия |
| Класс | - |
| Тип | Конспекты |
| Автор | Анищенко Н.В. |
| Дата | 14.12.2014 |
| Формат | docx |
| Изображения | Есть |
10
Занятие по теме «МЕТАЛЛЫ»
Цели:
- способствовать обобщению и закреплению понятий о металлах главных и побочных подгрупп и их соединениях.
- способствовать развитию общеучебных умений и мыслительных операций, умения ставить цели и выбирать план действий
- способствовать развитию способности работать в группах, принимать чужое мнение и аргументировать своё, коммуникативной
компетентности учащихся.
Задачи:
Образовательные:
- способствовать обобщению и систематизации знаний учащихся о металлах в виде простых и сложных веществ, о закономерностях строения кристаллической решетки металлов, о химических реакциях с участием металлов.
- повторить, обобщить и закрепить, конкретизировать на материале химии металлов такие важнейшие химические понятия, как химическая связь, кристаллические решетки, окисление и восстановление, написание электронных уравнений реакций, составление электронного баланса
Развивающие:
-Развивать умение планировать и осуществлять учебную деятельности и организовать учебное сотрудничество с педагогами и сверстниками.
-Развивать умения, выделять главное, обобщать полученные знания.
-Развивать мышление учащихся посредством анализа, сравнения и обобщения изучаемого материала.
-Развитие речи, эмоций, логического мышления учащихся.
Воспитательные:
-Продолжить формирование мотивации учащихся к обучению и целенаправленной познавательной деятельности
-Воспитывать активность, самостоятельность и аккуратность в работе.
-Воспитывать и развивать у учащихся ответственность при работе в коллективе
Приглашенные на занятие учащиеся заранее получают задания из таблицы
Вопросы для повторения
Обратить внимание
Примеры, упражнения, тесты (разобрать только вопросы, которые могут вызвать затруднения у конкретной аудитории)
Положение металлов в ПСХЭ, закономерности изменения характеристик и свойств атомов химических элементов
(сравните активность известных вам металлов I и II группы главной подгруппы, затем - побочной подгруппы)
металлы находятся ниже диагонали бор-астат, а также выше нее в побочных подгруппах
В периодах и главных подгруппах действуют известные нам закономерности в изменении металлических, и значит, восстановительных свойств атомов элементов.
Химические элементы, расположенные вблизи диагонали бор - астат, обладают двойственными свойствами: в одних своих соединениях ведут себя как металлы, в других - проявляют свойства неметалла.
В побочных подгруппах восстановительные свойства металлов с увеличением порядкового номера чаще всего уменьшаются.

1. У элементов I А группы сверху вниз
1) усиливаются окислительные свойства
2) ослабевают восстановительные свойства
3) увеличиваются радиусы атомов
4) уменьшаются радиусы атомов
2. Валентные электроны наиболее легко отдают атомы
1) алюминия 2) натрия 3) бериллия 4) магния
3. Восстановительные свойства наиболее выражены у
1) алюминия 2) магния 3) натрия 4) калия
3.В порядке увеличения восстановительной способности металлы расположены в ряду:
1) K,Al,Cr,Sn 3) Sn,Ca,Al,K
2)Sn,Cr,Al,Zn 4) Au,Al,Ca,Li
4.В ряду элементов: натрий - магний - алюминий возрастает их
1) атомный радиус
2) восстановительная способность
3) химическая активность
4) электроотрицательность
5. У магния металлические свойства выражены
1) слабее, чем у бериллия 2) сильнее, чем у алюминия
3) сильнее, чем у кальция 4) сильнее, чем у натрия
6. В порядке уменьшения восстановительных свойств металлы расположены в ряду:
1) Al,Zn,Fe 2)Al,Na,K
3)Fе,Zn,Mg 4) Fe,Zn,Al
7. Наибольший радиус имеет атом
1) лития 2) натрия 3) кальция 4) калия
8. У элементов II А группы сверху вниз
1) уменьшаются радиусы атомов,
2) увеличивается число валентных электронов в атоме
3) увеличиваются радиусы атомов
4) уменьшается число валентных электронов в атоме
9. Способность атомов отдавать электроны увеличивается
1) B, Al, Si 2) Mg, Na, Zn 1) Sr, Ca, Mg, 2) Li, Be, B
3) Ca, Mg, Be 4) Al, Mg, Na 3) Li, Na, K 4) Ca, K, Na
10. Металлами являются:
1)все s-элементы; 2) все p-элементы;
3) все d-элементы; 4) все элементы главных подгрупп.
11. Среди металлов нет:
а) s-элементов б) р-элементов в) d-элементов г) f-элементов
12. Наибольший атомный радиус имеет: 1) Be; 2) Sr; 3) Са; 4) Ba.
13. В составе иона 25Mg2+ содержится:
1) 12 протонов, 12 электронов, 13 нейтронов
2) 10 протонов, 12 электронов, 13 нейтронов
3) 12 протонов, 10 электронов, 12 нейтронов
4) 12 протонов, 10 электронов, 13 нейтронов
14. Атомы металлов при взаимодействии с атомами неметаллов:
1) отдают валентные электроны
2) принимают электроны
3) в одних случаях принимают электроны, в других - отдают
4) являются окислителями
15.С увеличением порядкового номера металла в главной подгруппе способность отдавать электроны ...
1 )увеличивается 2) не изменяется
3)уменьшается 4) увеличивается, а затем уменьшается
16. Атомы металлов, отдавая электроны, приобретают электронную структуру внешнего энергетического уровня:
1) щелочных 2) галогенов 3) благородных газов 4) кислорода
17. В ряду натрий - магний - алюминий элементы расположены в порядке увеличения
1) атомного радиуса 2) электроотрицательности
3) металлических свойств 4) числа электронных слоев
18. Металлические свойства усиливаются в ряду элементов
1) натрий - магний - алюминий 2) литий - натрий - калий
3) барий - кальций - магний 4) калий - натрий - литий
19.Наиболее выраженные металлические свойства проявляет:
1)А1 2)Na 3)Mg 4) Be 5) Fe
20. Металл, у которого наиболее устойчивая степень окисления +1, - это:
1) медь; 2) серебро; 3) золото; 4) у всех перечисленных выше металлов
степень окисления +1 одинаково устойчивая.
21.Верны ли следующие суждения о щелочных металлах?
А. Во всех соединениях они имеют степень окисления +1.
Б.С галогенами они образуют соединения с ионной связью.
1)верно только А; 2) верно только Б;
3)верны оба суждения; 4)оба суждения неверны.
22.На внешнем энергетическом уровне один электрон у ...
1) щелочноземельных металлов 2) алюминия
3)щелочных металлов 4) железа
23. Из приведенных ниже металлов наиболее активным является
1) бериллий 2) магний 3) кальций 4) барий
24. Ряд элементов, в котором усиливаются металлические свойства...
1) Li - Be - В 2) Cs - Rb - К 3) Al, Fe, Ag 4) Ca, Sr, Ba
Простые вещества - металлы
металлическая химическая связь
Металлическую связь образуют элементы, атомы которых на внешнем слое имеют мало валентных электронов по сравнению с большим числом внешних энергетически близких орбиталей. Их валентные электроны слабо удерживаются в атоме. Электроны, осуществляющие связь, обобществлены и перемещаются по всей кристаллической решетке в целом нейтрального металла.
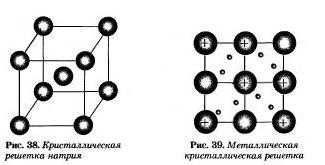
Атомы в кристаллических решетках металлов удерживаются посредством:
1) ионной связи 2) ковалентной полярной связи
3) водородной связи 4)металлической связи
физические свойства
(объяснить причины, определяющие основные физические свойства металлов. Почему металлы пластичны?)
металлический блеск, пластичность, высокая электрическая проводимость и теплопроводность, рост электрического сопротивления при повышении температуры,
как плотность, температуры плавления и кипения, твердость, магнитные свойства.
Механическое воздействие на кристалл с металлической кристаллической решеткой вызывает смещение слоев ион-атомов относительно друг друга, в так как электроны перемещаются но всему кристаллу, разрыв связей не происходит, поэтому дли металлов характерна большая пластичность
Напряжения приобретают направленное движение, то есть проводят электрический ток. При повышении температуры мета-тля возрастают амплитуды колебании находящихся в узлах кристаллической решетки атомов и ионов. Это затрудняет перемещение электронов, электрическая проводимость металла падает. Чаще всего с той же закономерностью, как и электрическая проводимость, изменяется теплопроводность металлов.
Наиболее пластичные металлы - это Аu, Af, Cu, Sn, РЪ, Zn. Они легко вытягиваются в проволоку, поддаются ковке, прессованию, прокатыванию в листы- Например, из золота можно изготовить золотую фольгу толщиной 0,008нм, в из 0,5 г этого металла можно вытянуть нить длинной 1 км.
Наибольшую электрическую проводимость имеют серебро, медь, в также золото, алюминий,
электропроводность и теплопроводность обусловлена большой подвижностью свободных электронов, которые, сталкиваясь с колеблющимися ионами и атомами, обмениваются с ними энергией. Поэтому происходит выравнивание температуры по всему куску металла.
Щелочные металлы, атомы которых имеют один валентный электрон, мягкие (режутся ножом), с небольшой плотностью (литий - самый легкий металл р - 0.53 г/см3) и плавятся при невысоких температурах (например, температура плавления цезия 29 'С). Единственный металл, жидкий при обычных условиях. - ртуть - имеет температуру плавления, равную 38.9 'С.
Кальций, имеющий два электрона ни внешнем энергетическом уровне атомов, гораздо более тверд и плавится при более высокой температуре (842º С).
Еще более арочной является кристаллическая решетка, образованная атомами скандия, которые имеют три валентных электрона.
Но самые прочные кристаллические решетки, большие плотности и температуры плавления наблюдаются у металлов побочных подгрупп V, VI, VII, МП групп. Это объясняется тем. что для металлов побочных подгрупп, имеющих неспаренные валентные электроны на d-подуровне, характерно образование очень прочных ковалентных связей между атомами, помимо металлической, осуществляемой электронами внешнего слоя с s-орбиталей.
Самый тяжелый металл - это осмий (компонент сверхтвердых и износостойких сплавов), самый тугоплавкий металл -это вольфрам (применяется для изготовления нитей накаливания ламп), самый твердый металл - это хром Сг (царапает стекло). Они входят в состав материалов, из которых изготавливают металлорежущий инструмент, тормозные колодки тяжелых машин и др.
Металлы различаются по отношению к магнитным полям. Но этому признаку их делят на три группы:
• ферромагнитные Способны намагничиваться под действием даже слабых магнитных полей (железо - альфа-форма, кобальт, никель, гадолиний);
• парамагнитные проявляют слабую способность к намагничиванию (алюминий, хром, титан, почти все лантаноиды);
• диамагнитные не притягиваются к магниту, лаже слегка отталкиваются от него (олово, мель, висмут).
1. В каком ряду приведены символы соответственно самого твердого и самого тугоплавкого металлов? 1) W, Ti; 2) Cr, Hg; 3) Cr, W; 4) W, Cr,
2. Какой металл является самым распространенным на Земле:
1) алюминий 2) золото 3) железо 4) магний
3. Для металлов характерны:
1) низкая теплопроводность и электропроводность 2) летучесть
3) ковкость и пластичность 4) в обычных условиях газообразное состояние
4.Металл, используемый для сплавов, применяемых в самолетостроении; для восстановления металлов из оксидов: устойчивы коррозии, с малой плотностью -
1)цинк 2) медь 3) алюминий 4)хром
5.Какое свойство не является общим для всех металлов:
1)электропроводность; 2)теплопроводность;
3)твёрдое агрегатное состояние при стандартных условиях; 4)металлический блеск.
6. Характерное свойство металлов:
1) плохая теплопроводность; 2) оксиды имеют ионный характер;
3) многие из них окислители; 4) большинство оксидов - ковалентные соединения.
Химические свойства
По близости химических свойств выделяют щелочные (металлы I группы главной подгруппы),
щелочноземельные (кальций, стронций, барий, радий),
редкоземельные металлы (скандий, иттрий, лантан и лантаноиды, актиний и актиноиды).
Металлы в химических реакциях всегда восстановители. Восстановительная способность атомов простых веществ - металлов, образованных химическими элементами одного периода или одной главной подгруппы Периодической системы Д. И. Менделеева, изменяется закономерно.
Восстановительную активность металла в химических реакциях, которые протекают в водных растворах, отражает его положение в электрохимическом ряду напряжений металлов.
1. Щелочные металлы
1)являются сильными восстановителями
2) проявляют как окислительные, так и восстановительные свойства
3) легко образуют отрицательно заряженные ионы
4) легко присоединяют электроны в химических реакциях

2. Какие утверждения для металлов неверны:
1) металлы составляют большинство элементов Периодической системы;
2) в атомах всех металлов на внешнем энергетическом уровне содержится не более двух электронов;
3) в химических реакциях для металлов характерны восстановительные свойства;
4) в каждом периоде атом щелочного металла имеет наименьший радиус.
3. В атомах каких металлов в основном состоянии на энергетическом d- подуровне содержится пять электронов?
1) титана; 2) хрома; 3) сурьмы; 4) марганца.
4.Окислительные свойства какого иона наиболее ярко выражены:
1)Сu2+ 2) Pb2+ 3) Sn2+ 4)Zn2+
Взаимодействие с простыми веществами-неметаллами
1. С кислородом большинство металлов образуют оксиды - основные и амфотерные. Кислотные оксиды переходных металлов, например оксид хрома или оксид марганца не образуются при прямом окислении металла кислородом. Их получают косвенным путем.
Щелочные металлы Nа, К активно реагируют с кислородом воздуха, образуя пероксиды.
Оксид натрия получают косвенным путем, при прокаливании пероксидов с соответствующими металлами:
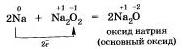
2. С галогенами металлы образуют соли галогеноводородных кислот.
3. С водородом самые активные металлы образуют гидриды - ионные солеподобные вещества, в которых водород имеет степень окисления -1, например: гидрид кальция.
4. С серой металлы образуют соли - сульфиды.
5. С азотом металлы реагируют несколько труднее, так как химическая связь в молекуле азота очень прочна, при этом образуются нитриды. При обычной температуре взаимодействует с азотом только литий
1. Активнее других реагирует с кислородом ... 1) Al 2)Ag 3)Zn 4)Ва
2.Активнее других взаимодействует с кислородом ...
1) Li 2)Na 3)К 4) Pt
3. Хлорид железа(II) не может быть получен взаимодействием:
1)раствора хлорида меди(II) с железом;
2)железа с хлором;
3)железа с соляной кислотой;
4)хлорида железа(III) с железом.
Взаимодействие со сложными веществами
1. С водой. Щелочные и щелочноземельные металлы при обычных условиях вытесняют водород из воды и образуют растворимые основания-щелочи.
Другие металлы, стоящие в ряду напряжений до водорода, тоже могут при определенных условиях вытеснять водород из воды. Но алюминий бурно взаимодействует с водой, только если удалить с его поверхности оксидную пленку.
Магний взаимодействует с водой только при кипячении, при этом также выделяется водород. Если горящий магний внести в воду, то горение продолжается, так как протекает реакция: горит водород. Железо взаимодействует с водой только в раскаленном виде.
2. С кислотами в растворе взаимодействуют металлы, стоящие в ряду напряжений до водорода. При этом образуются соль и водород. А вот свинец (и некоторые другие металлы), несмотря на его положение в ряду напряжений (слева от водорода), почти не растворяется в разбавленной серной кислоте, так как образующийся сульфат свинца PbSO4 нерастворим и создает на поверхности металла защитную пленку.
Взаимодействие серной кислоты H2SO4 с металлами
Окисляющие кислоты могут взаимодействовать и с металлами, стоящими в ЭРАМ после водорода:
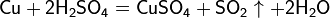
Очень разбавленная кислота реагирует с металлом по классической схеме:
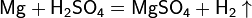
При увеличении концентрации кислоты образуются различные продукты:
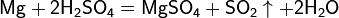
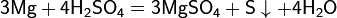
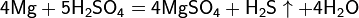
Реакции для азотной кислоты (HNO3)
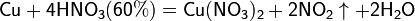
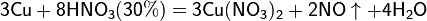
При взаимодействии с активными металлами вариантов реакций ещё больше:
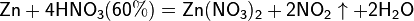
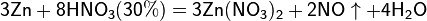
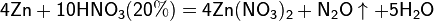
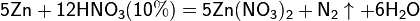
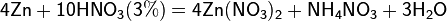
3. С солями менее активных металлов в растворе. В результате такой реакции образуется соль более активного металла и выделяется менее активный металл в свободном виде.
Нужно помнить, что реакция идет в тех случаях, когда образующаяся соль растворима. Вытеснение металлов из их соединений другими металлами впервые подробно изучал Н. Н. Бекетов - крупный русский физикохимик. Он расположил металлы по химической активности в «вьггеснительный ряд», ставший прототипом ряда напряжений металлов.
4. С органическими веществами. Взаимодействие с органическими кислотами аналогично реакциям с минеральными кислотами. Спирты же могут проявлять слабые кислотные свойства при взаимодействии со щелочными металлами.
5. Со щелочами в растворе взаимодействуют металлы, гидроксиды которых амфотерны.
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
2Al + 2KOH -(t)à 2KAlO2 + H2
1. При нагревании меди с концентрированной серной кислотой образуется
1) оксид серы (IV) 3) оксид серы (VI)
2) водород 4) сероводород
2. Медь может вступать во взаимодействие с водным раствором
1) гидроксида натрия 2) хлорида кальция
3) нитрата цинка 4) азотной кислоты
3. Верны ли следующие суждения?
А. Только s-элементы содержит IA группа.
Б. Все элементы IA группы взаимодействуют с водой при комнатной температуре.
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
4.. Медь не взаимодействует с
1) разбавленной серной кислотой
2) концентрированной серной кислотой
3) разбавленной азотной кислотой
4) концентрированной азотной кислотой
5. Верны ли следующие суждения?
А. Магний взаимодействует с кислотами и щелочами.
Б. С концентрированными серной и азотной кислотами магний реагирует только при нагревании.
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
6. Щелочной металл реагирует с каждым из двух веществ
1) KOH, H2 2) O2, ZnCl2 1) H2, FeSO4 2) H2O, Cu(OH)2
3) H2O, Cl2 4) HCl, Mg 3) Zn, O2 4) H2SO4, S
7. Химическая реакция возможна между
1) Cu и H2O 2) Au и H2 3) Na и Cl2 4) Fe и NaCl
8. Выберите реакцию, соответствующую схеме: Ме° - nе Меn+
-
2КОН + H2SO4 = K2SO4 + 2Н2O 3) Fe + 2НС1 = FeCl2 + Н2
-
СаО + СO2 = СаСО3 4) FeO + Н2 = Fe + Н2O
9.Схеме: Men+ + ne Me0 соответствует реакция ...
1)Mg + S = MgS 2) NaOH + HC1 = NaCl + H2O
3)Fe2O3 + 3H2 = 2Fe + 3H2O 4) MgO + CO2 = MgCO3
10 .Схеме: Меn+ + nе Ме° соответствует реакция ...
-
2А1 + 3S = A12S3 3) Са + 2Н2O = Са(ОН)2 + Н2
-
Fe2O3 + 2А1 = А12O3 + 2Fe 4) MgO + СO2 = MgCO3
11. Оксид металла и водород образуются при нагревании с водой
-
Калия 2)цинка 3)ртути 4)натрия
12.С разбавленной серной кислотой не реагирует каждый из двух металлов:
1)медь и цинк 2)железо и хром
3)медь и серебро 4)железо и олово
13. С разбавленной серной кислотой не реагирует каждый из двух металлов:
1)медь и цинк 2)железо и хром
3)медь и серебро 4)железо и олово
14.Медь взаимодействует с каждым из двух веществ:
1)H2SO4(конц.) и Cl2 2)NaOH и ZnCl2
3)H2SO4(разб.) и NH3 4)HCl(разб.) и Ca(NO3)2
15.Медь взаимодействует с разбавленным раствором каждого из двух веществ:
1)соляной кислоты и азотной кислоты 2) соляной кислоты и нитрата серебра
3)азотной кислоты и нитрата серебра 4)серной кислоты и соляной кислоты
16.С бóльшей скоростью идет реакция соляной кислоты с
1)медью 2)железом 3)магнием 4)цинком
17.При комнатной температуре как с H2O, так и с HCl может реагировать каждый из двух металлов:
1) K и Ag 2) Cu и Zn 3) Ca и Na 4) Li и Pb
18.Цинк вытесняет каждый из перечисленных металлов из растворов их солей:
1) Mg, Al, Na 2) Ca, Cu, Ag 3) Fe, Cu, Ag 4) Mg, Ba, Ag
19.С разбавленной серной кислотой не реагирует каждый из двух металлов:
1)медь и цинк 2)железо и хром 3)медь и серебро 4)железо и олово
20. Укажите символы металлов, которые можно окислить ионами Н+ в водном растворе кислоты:
1) Cu; 2) Zn; 3) Fe; 4) Ag.
21. С водой только при нагревании реагируют:
1) натрий; 2) цинк; 3) медь;4) железо.
22. Какой из металлов не вытесняет водород из разбавленной серной кислоты?
1) железо 2) хром 3) медь 4) цинк
23. Водород не вытесняется из кислот
1) оловом 2) свинцом 3) серебром 4) магнием
24. С кислородом не взаимодействует ...l)Fe 2)Zn 3)Аl 4) Pt
25. Какие металлы реагируют с водой при комнатной температуре с образованием гидроксидов и водорода: 1) Fе 2) Zn 3) Na 4) Аu
26. При комнатной температуре вытесняет водород из воды ...
1)медь 2) железо 3) литий 4) цинк
27.Наиболее энергично взаимодействует с водой ... l)Mg 2)Са 3)Ва 4) Be
28. С образованием щелочи с водой взаимодействует
1) алюминий 2) цинк 3) барий 4) ртуть
29.Щелочь и водород образуются при взаимодействии с водой ...
l)Fe 2) Сu 3)А1 4) Na
30. Оксид металла образуется при взаимодействии с водой ... l)Zn 2)Ва 3)Na 4) Au
31. Все металлы какого ряда реагируют с соляной кислотой:
1) Al, Аu, Hg 2) Mg, Zn, Fе 3) K, Pt, Ag 4) Zn, Ag, Ba
32. С какой кислотой металлы практически никогда не реагируют с выделением водорода:
1) НСl 2) НNО3 3) H2SО4 4) НI
33. Какие металлы реагируют с водным раствором гидроксида натрия с образованием комплексных солей: 1) Аl 2) Са 3) К 4) Ва
34. Для растворения как меди, так и железа, следует использовать
1) концентрированную фосфорную кислоту
2) разбавленную азотную кислоту
3) разбавленную соляную кислоту
4) раствор гидроксида калия
35. При обычных условиях практически осуществима реакция между железом и
1) серой (тв) 2) серной кислотой (конц.)
3) нитратом меди (II) (р-р) 4) нитратом цинка (р-р)
36. Какие металлы будут вытеснять олово из водных растворов его солей:
1) Рb 2) Сu 3) K 4) Mg
37. Какие металлы будут вытеснять медь из водных растворов ее солей:
1) Аu 2) Mg 3) Na 4) Ag
38. Между какими парами веществ возможна химическая реакция в водном растворе:
1) Ag и CuCl2 2) Рb(NОЗ)2 и Zn 3) HCl и Cu 4) Fе и MgCl2
39. Как изменится масса цинковой пластинки через некоторое время, после того как ее опустили в раствор хлорида железа (II):
1) не изменится 2) увеличится 3) уменьшится 4) пластинка растворится
40. Никель может выступать в качестве восстановителя по отношению к ионам:
1) Сu2+ 2) Zn2+ 3) Аl3+ 4) Mg2+
41. Oтметьте металлы, которые могут окисляться ионами свинца Pb2+:1) Аu 2) Сu 3) Zn 4) Ag
42. Реакция замещения происходит между ...
1)Сu и FeSO4 раствор 2) А1 и AgNO3 раствор
3)Ag и А1С13 раствор 4) Fe и ZnCl2 раствор
43.Химическая реакция проходит между ...
1)Mg и ZnCl2 раствор 2) Ag и АlСl3 раствор
3)Сu и FeSO4 раствор 4) Рb и Mg(NO3)2 раствор
44.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
Al и KOH(р-р) гидроксид алюминия и сера
Al и H2SO4(разб.) гидроксид алюминия и сероводород
Al2S3 и H2O тетрагидроксоалюминат калия и водород
Al и H2O сульфат алюминия и водород
алюминат калия и оксид алюминия
гидроксид алюминия и водород
Металлы участвуют в реакциях с галогеналканами, которые используют для получения низших циклоалканов и для синтезов, в ходе которых происходит усложнение углеродного скелета молекулы (реакция А. Вюрца):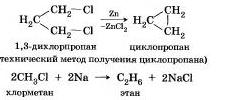
Особенности железа и хрома
Взаимодействие с неметаллами:
С водородом непосредственно не взаимодействуют
3Fe + 2O2 = Fe3O4.
2Fe + 3Cl2 = 2FeCl3,
Fe+S =FeS
4Cr + 3O2 = 2Cr2O3.
2Cr + 3Cl2 = 2CrCl3. 2Cr + 3S = Cr2S3
Взаимодействие с кислотами Fe + 2HCl = FeCl2 + H2,
Fe + H2SO4 = FeSO4 + H2;
Fe + 4HNO3 = Fe(NO3)3 + NO + 2H2O.
Cr + 2HCl = CrCl2 + H2;
Cr + H2SO4 = CrSO4 + H2.
В присутствии кислорода воздуха образуются соли хрома (III):
4Cr + 12HCl + 3O2 = 4CrCl3 + 6H2O.
При обычных условиях концентрированные серная и азотная кислоты пассивируют железо и хром. При нагревании возможно взаимодействие с образованием солей железа и хрома (III).
2Fe + 6H2SO4 = Fe2(SO4)3 +3SO2 +6H2O,
Fe + 6HNO3 = Fe(NO3)3 + 3NO2 + 3H2O.
2Cr + 6H2SO4 = Cr2(SO4)3 + 3SO2 + 6H2O;
Cr + 6HNO3 = Cr(NO3)3 + 3NO2 + 3H2O
В воде в присутствии кислорода железо медленно окисляется кислородом воздуха (корродирует):
4Fe + 3O2 + 6H2O = 4Fe(OH)3.
При температуре 700-900 °С раскаленное железо реагирует с водяным паром:
3Fe + 4H2O = Fe3O4 + 4H2.
Вытесняют металлы, которые расположены правее в электрохимическом ряду напряжений их растворов солей:
Fe + SnCl2 = FeCl2 + Sn,
2Cr + 3CuCl2 = 2CrCl3 + 3Cu.
1. Верны ли следующие суждения?
А. И хром, и железо образуют устойчивые оксиды в степени окисления +3.
Б. Оксид хрома (III) является амфотерным.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
2. Железо не реагирует с
1) соляной кислотой 1) серой
2) хлором 2) хлоридом меди (II)
3) хлоридом цинка 3) кислородом
4) водой при нагревании 4) гидроксидом калия
3. Установите соответствие между исходными веществами и продуктами реакции
ИСХОДНЫЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
А) Fе + Сl2 1) FеСl2
Б) Fе + НСl 2) FeCl3
В) FеО + НСl 3) FeCl2 + H2
Г) Fе2О3 + НСl 4) FeCl3 + H2
4. При взаимодействии хрома с соляной кислотой образуются
1) СrС12 и Н2 2) СrС13 и Н2О 3) СrС12 и Н2O 4) СrС13 и Н2
5. Хром, так же, как алюминий и железо, ...
1) способен образовывать соединения со степенью окисления +6
2) пассивируется холодными концентрированными Н2SО4
3) образует оксид со степенью окисления +3 зеленого цвета
4) образует типичный кислотный оксид
6.При обычных условиях практически осуществима реакция между железом и
1) серой (кр.) 2) серной кислотой (конц.)
3) нитратом цинка (р-р) 4) нитратом меди (II) (р-р)
7.Железо может взаимодействовать с ... и ...
-
кислотами 2) основными оксидами 3)щелочами 4) галогенами
8.С железом взаимодействуют растворы ...
l)MgSО4 2) КОН 3)НСl 4)СuС12
Оксиды и гидроксиды металлов
Оксиды, образованные типичными металлами, относят к солеобраяующим, основным по характеру свойств. Им соответствуют гидроксиды. являющиеся основаниями, которые в случае щелочных и щелочноземельных металлов растворимы в воде, являются сильными электролитами и называются щелочами.
Оксиды и гидроксиды некоторых металлов амфотерны, то есть могут проявлять и основные, и кислотные свойства в зависимости от веществ, с которыми они взаимодействуют.
Например:
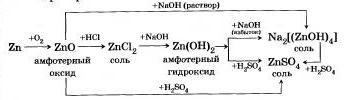
Многие металлы побочных подгрупп, имеющие в соединениях переменную степень окисления, могут образовывать несколько оксидов и гидроксидов, характер которых зависит от степени окисления металла.
Например, хром в соединениях проявляет три степени окисления: +2, +3, +6, поэтому он образует три ряда оксидов и гидроксидов, причем с увеличением степени окисления усивается кислотный характер и ослабляется основный.
1. Оцените справедливость суждений о металлах:
А. Чем сильнее атом удерживает валентные электроны, тем ярче выражены металлические свойства элемента.
Б. Чем сильнее выражены металлические свойства элемента, тем более основный характер имеет его гидроксид.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
2. Оцените справедливость суждений о металлах:
А. Для атомов металлов характерно малое число валентных электронов и слабое их притяжение к ядру.
Б. Чем выше степень окисления металла в его гидроксиде, тем более основными свойствами обладает гидроксид.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
3. В ряду оксидов CrO - Сr2О3 - СrОз происходит
1) уменьшение степени окисления хрома
2) усиление восстановительных свойств
3) увеличение массовой доли хрома
4) усиление кислотных свойств
4. Сила оснований возрастает в ряду:
1) Ве(ОН)2, Mg(OH)2, Ca(OH)2
2) Ва(ОН)2, Са(ОН)2, Ве(ОН)2
3) Са(ОН)2, Mg(OH)2, Ве(ОН)2
4) Sr(OH)2, Ca(OH)2, Mg(OH)2
5. Основные свойства веществ ослабевают в ряду:
1) NaОН - КОН -RbOH
2) А1(ОН)3 -Mg(OH)2 - NaOH
3) Са(ОН)2 - Mg(OH)2 - Be(OH)2
4) В(ОН)3 -Ве(ОН)2 - LiOH
6. Отметьте ряды, в которых основные свойства гидроксидов металлов убывают:
1) LiOH, КОН, CsOH 2) Са(ОН)2, Mg(OH)2, Ве(ОН)2
3) Аl(ОН)3, Mg(OH)2, NaOH 4) Ва(ОН)2, CsOH, RbOH
7. Отметьте ряды, в которых основные свойства оксидов металлов убывают:
1) ВаО, Cs2О, Rb2О 2) Li2О, К2О, Cs2О
3) Аl2О3, MgO, Na2О 4) СаО, MgO, ВеО
8. Какие утверждения по отношению к металлам являются верными:
1)большая часть химических элементов является металлами
2) гидроксиды металлов проявляют кислотные свойства
3)для металлов характерны окислительные свойства
4) металлы плохо проводят электрический ток
9. Укажите справедливые утверждения:
1) все элементы d- и f-семейств являются металлами;
2) среди элементов р-семейства нет металлов;
3) гидроксиды металлов могут обладать как основными, так амфотерными и кислотными свойствами;
4) металлы не могут образовывать гидроксиды с кислотными свойствами.
10. Отметьте формулу оксида металла с наиболее выраженными кислотными свойствами:
1) K2O; 2) MnO; 3) Cr2O3; 4) Mn2O7.
Решение расчетных задач
1. При обработке 8 г смеси магния и оксида магния соляной кислотой выделилось 5.6 л водорода (н, у.). Какова массовая доля (в %) ИЮНЯ в исходной смеси?
Ответ: 75%.
2. Определите массовую долю (в процентах) углерода в стали (сплав железа с углеродом), если при сжигании ее навески массой 10 г в токе кислорода было собрано 0,28 л оксида углерода(ІV) (н. у.).
Ответ: 1.5%.
3. Образец натрии массой 0.5 г поместили в воду. Ни нейтрализацию полученного раствора израсходовали 29,2 г 1,5%-ной соляной кислоты. Какова массовая доля (в процентах) натрия в образце?
Ответ: 55.2%.
4. Сплав меди и алюминия обработали избытком раствора гидроксидя натрия, при этом выделился газ объемом 1,344 л (н. у.), Остаток после реакции растворили в азотной кислоте, затем раствор выпарили и прокалили до постоянной массы, которая оказалась равной 0.4 г. Каков состав сплава? Ответ: 1.08 г Аl 0,32 г Сu или 77,14% Аl 22.86% Сu.
5. Какую массу чугуна, содержащего 94% железа, можно получить из 1 т красного железняка (Fe2О3), содержащего 20% примесей?
Ответ: 595.74 кг.


