- Преподавателю
- Химия
- Конспект урока Свойства альдегидов и кетонов
Конспект урока Свойства альдегидов и кетонов
| Раздел | Химия |
| Класс | - |
| Тип | Конспекты |
| Автор | Арсеньева Е.Н. |
| Дата | 04.11.2014 |
| Формат | doc |
| Изображения | Есть |
МКОУ «Новогуровская средняя общеобразовательная школа»
Тема медиа-урока:
«Свойства и применение альдегидов и кетонов»
10 класс
Урок подготовила и провела:
учитель химии
Арсеньева Е.Н.
ТЕМА МЕДИА-УРОКА: « Свойства и применение альдегидов»
Цели: - Рассмотреть физические и химические свойства альдегидов и кетонов, и изучить их.
- Познакомить учащихся с применением альдегидов и кетонов.
- Рассмотреть генетическую связь между альдегидами, спиртами и углеводородами.
- Продолжить знакомить учащихся с возможностями ИКТ на уроках химии.
Оборудование: Учебно-электронное пособие «Химия (8-11 классы). Виртуальная лаборатория»,
«Химия для всех - XXI», «Органическая химия», «Репетитор по химии Кирилла и
Мефодия», компьютер, проектор, экран.
Ход урока.
I. Организационный момент. Сообщаю учащимся тему, цели и задачи урока.
II.Проверка домашнего задания. Индивидуальный опрос.
- Рассказать о строении молекул альдегидов и кетонов, построив виртуальные модели формальдегида, ацетальдегида и ацетона. (1 уч-ся работает у доски и за компьютером)
Фронтальный опрос класса.
- Сформулируйте определение класса альдегидов и кетонов.
- Какая функциональная группа называется карбонильной и какая альдегидной?
- Какая между ними разница?
- По каким признакам можно классифицировать альдегиды и кетоны?
- Укажите родовые суффиксы класса альдегидов и кетонов.
- Какие типы изомерии характерны для предельных альдегидов и кетонов? Приведите примеры. (1 уч-ся у доски приводит примеры изомеров для вещества состава C4H8O)
Дополнительные вопросы. - Почему в названии альдегидов по систематической номенклатуре не
указывается положение карбонильного атома углерода?
- Указывается ли положение атома углерода карбонильной группы в названии
кетонов?
Опрос по индивидуальному заданию.
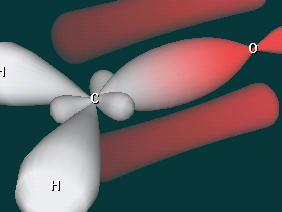
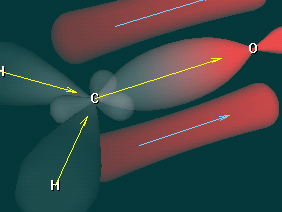
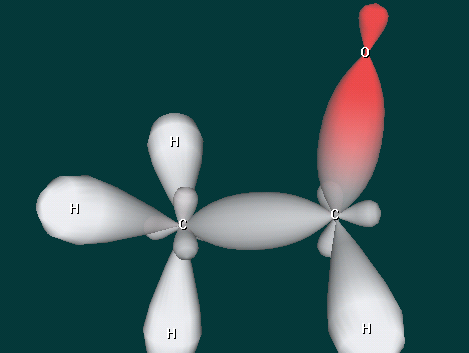
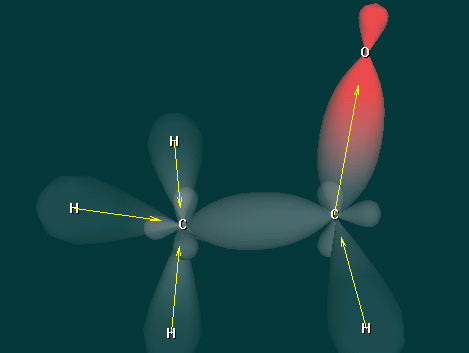
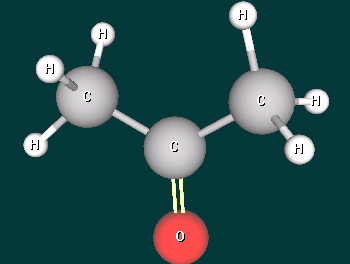
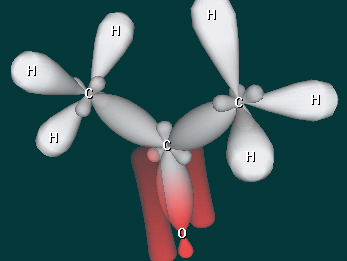
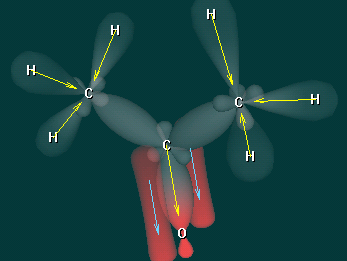
Дополнительные вопросы - В каком состоянии находится атом углерода карбонильной группы?
- Какой вид химической связи в молекулах альдегидов и кетонов?
III. Объяснение нового материала.
Из строения молекул альдегидов и кетонов следуют их химические свойства.
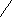
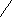 б+O б- O
б+O б- O
R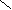 C R1 C R2 C = O - и π- связи - сильнополярные;
C R1 C R2 C = O - и π- связи - сильнополярные;
H С H - слабо полярная связь, H - не обладает
подвижностью как в молекуле спирта (H O)
Ф изические св-ва. Насыщенные альдегиды являются бесцветными жидкостями со своеобразным запахом, имеют более низкие температуры кипения, чем соответствующие алканолы. Это объясняется отсутствием межмолекулярных взаимодействий через водородные связи (отсутствием
изические св-ва. Насыщенные альдегиды являются бесцветными жидкостями со своеобразным запахом, имеют более низкие температуры кипения, чем соответствующие алканолы. Это объясняется отсутствием межмолекулярных взаимодействий через водородные связи (отсутствием
гидроксильных групп в молекулах). Простейший альдегид - газ, ядовит. Раствор метаналя в воде(35 - 40%) - формалин. Следующие за ним низшие альдегиды - легкокипящие жидкости. Высшие альдегиды и кетоны - твёрдые вещества. Ацетон - легколетучая жидкость.
Химические св-ва. Альдегиды, благодаря наличию активной группы -COH, являются реакционноспособными соединениями. Выделяют два типа химических реакций:
I. Реакции присоединения ( реакции восстановления) - гидрирование по месту разрыва π- связи:
H - C O H + H2 CH3-OH
метаналь метанол
II. Реакции окисления - важнейшее свойство альдегидов - способность легко окислятся с образованием карбоновых кислот, содержащих функциональную карбоксильную группу -COOH. 1) реакция «серебряного зеркала» - качественная реакция. (Учебно-электронное пособие «Химия (8-11 классы). Виртуальная лаборатория»). Выделяемое в результате окисления альдегидов металлическое серебро может кристаллизоваться на стенках сосуда, в котором проводится реакция, в виде зеркалоподобного слоя, благодаря чему реакция и получила это название.
(Учебно-электронное пособие «Химия (8-11 классы). Виртуальная лаборатория»). Выделяемое в результате окисления альдегидов металлическое серебро может кристаллизоваться на стенках сосуда, в котором проводится реакция, в виде зеркалоподобного слоя, благодаря чему реакция и получила это название.
CH3-C O H + Ag2O CH3-COOH + 2Ag↓
Ag2O [Ag(NH3)2]OH - аммиачный раствор.
2)  (Учебно-электронное пособие «Химия (8-11 классы). Виртуальная лаборатория»). Аналогично протекают реакции окисления альдегидов свежеосаждённым гидроксидом меди (II), в щелочной среде, которую называют еще реакцией медного зеркала. В результате нагревания альдегидов с Сu(ОН)2 образуется смесь продуктов его восстановления, включая металлическую медь, способную кристаллизоваться в виде зеркального слоя. CH3-C O H + 2Cu(OH)2 + NaOH CH3-COONa + Cu2O + 3H2O Cu+2 - окислитель, восстанавливается до Cu+1
(Учебно-электронное пособие «Химия (8-11 классы). Виртуальная лаборатория»). Аналогично протекают реакции окисления альдегидов свежеосаждённым гидроксидом меди (II), в щелочной среде, которую называют еще реакцией медного зеркала. В результате нагревания альдегидов с Сu(ОН)2 образуется смесь продуктов его восстановления, включая металлическую медь, способную кристаллизоваться в виде зеркального слоя. CH3-C O H + 2Cu(OH)2 + NaOH CH3-COONa + Cu2O + 3H2O Cu+2 - окислитель, восстанавливается до Cu+1
3) (Учебно-электронное пособие «Химия (8-11 классы). Виртуальная лаборатория»). Деструктивное окисление альдегидов протекает достаточно легко, но практического значения не находит.
(Учебно-электронное пособие «Химия (8-11 классы). Виртуальная лаборатория»). Деструктивное окисление альдегидов протекает достаточно легко, но практического значения не находит.
4 ) Формальдегид способен подвергаться полимеризации с образованием полиформальдегида. При пропускании сухого формальдегида над катализатором Fe(CO)5 образуется полимер со средней Mr, приблизительно, 30000. Он обладает высокой прочностью и химической стойкостью и применяется для получения синтетических волокон и разнообразных изделий, работающих в экстремальных условиях.
) Формальдегид способен подвергаться полимеризации с образованием полиформальдегида. При пропускании сухого формальдегида над катализатором Fe(CO)5 образуется полимер со средней Mr, приблизительно, 30000. Он обладает высокой прочностью и химической стойкостью и применяется для получения синтетических волокон и разнообразных изделий, работающих в экстремальных условиях.
IV. Закрепление. - Определите степени окисления атомов углерода в соединениях:
C-22H+16O-2 C-12H+14O-2 C02H+14O-22
этанол этаналь уксусная кислота
В этом ряду степень окисления углерода повышается, т.е., чем более окисленным является соединение (чем больше О в молекуле), тем выше степень окисления атома углерода и наоборот.
Альдегиды и кетоны занимают промежуточное положение между спиртами и карбоновыми кислотами. Поэтому альдегиды обладают двойственной окислительно-восстановительной функцией.
+2H [O]
спирт альдегид карбоновая кислота
Генетическая связь.
алканы алкены спирты альдегиды карбоновые кислоты
CH3-CH3 CH2=CH2 CH3-CH2-OH CH3-COH CH3-COOH
Задание: осуществите цепочку превращений.
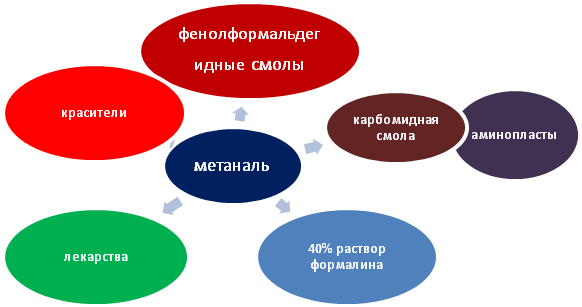
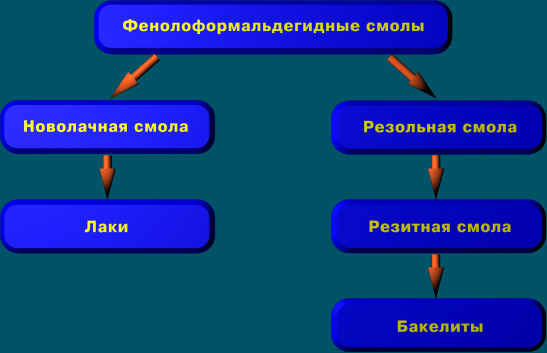
V. Объяснение нового материала. Применение.
VI. Домашнее задание. §25 - повторить, §26, стр.106 вопрос 2 (1), задача 1.


