- Преподавателю
- Химия
- Опорный конспект по теме Кислоты
Опорный конспект по теме Кислоты
| Раздел | Химия |
| Класс | - |
| Тип | Конспекты |
| Автор | Степанова В.Н. |
| Дата | 26.05.2015 |
| Формат | doc |
| Изображения | Есть |
Кислоты
Общая формула Н+1хАn х- , Аn х- - кислотный остаток, заряд которого равен числу атомов водорода.
Классификация кислот
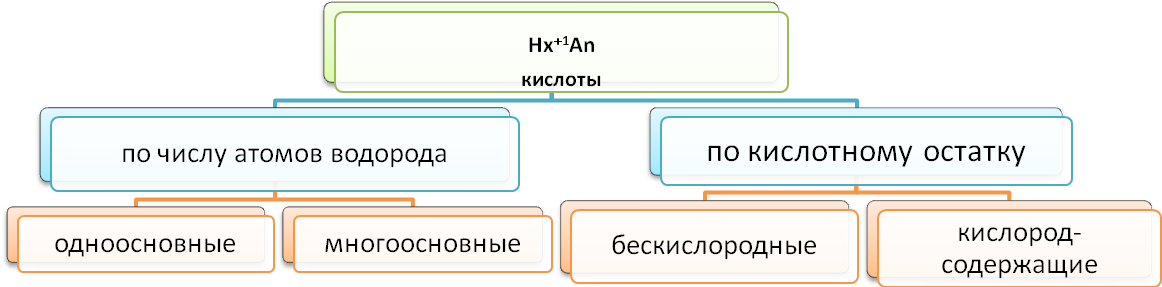
Н оменклатура бескислородных кислот: к названию кислотообразующего элемента прибавить
оменклатура бескислородных кислот: к названию кислотообразующего элемента прибавить
соединительную букву «о» + словосочетание …. водородная кислота. Например: НCl - хлороводородная кислота , Н2S- сероводородная кислота
Номенклатура кислородсодержащих кислот: к русскому названию кислотообразующего элемента добавляют суффиксы в зависимости от степени окисления. Например: HN+5O3 - азотная кислота, HN+3O2- азотистая кислота. Если степень окисления кислотообразующего элемента одинаковая, а он образует несколько кислот, то добавляют приставку «орто» или «мета». Например: H3P+5O4- ортофосфорная кислота, HP+5O3- метафосфорная кислота.
Классификация кислот
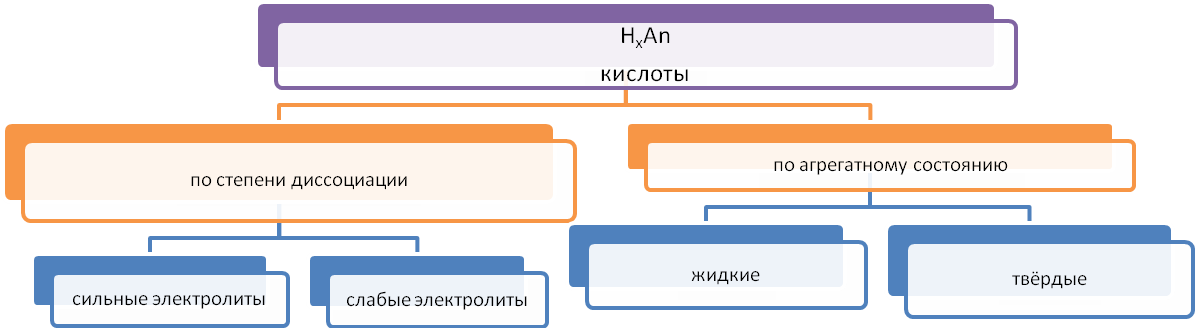
Получение бескислородных кислот: 1.Взаимодействием водорода с неметаллом с последующим растворением полученного продукта в воде: S+ Н2 = Н2S↑
2. Действием на соль бескислородной кислоты более сильной кислотой: FeS +2НCl = Н2S↑+ FeCl2
Получение кислородсодержащих кислот: 1.Взаимодействием кислотных оксидов с водой (исключение составляет кремниевая кислота): N+52O5 + Н2O = 2HN+5O3 ;
2. Реакцией обмена соли слабой кислоты с более сильной кислотой: Na2SiO3+ 2НCl= Н2SiO3 ↓+ NaCl
Химические свойства кислот
1. С точки зрения ТЭД кислоты - электролиты, которые в водных растворах диссоциируют на ионы: HNO3= H+ + NO3- ; Н2S ↔ 2 H+ + S2-
2. Изменяют цвет индикаторов, это качественная реакция на ион H+:
-
Название индикатора
Цвет в нейтральной среде
Цвет в растворах кислот
Лакмус
фиолетовый
красный
Метилоранж
оранжевый
красный
Фенолфталеин
бесцветный
бесцветный
3. Взаимодействуют с основаниями, образуя соль и воду: а) NaOH +НСl= NaСl +Н2О (молекулярное уравнение, все вещества записаны как молекулы );
Na+ +OH- +Н++Сl-= Na++Сl- +Н2О (полное ионно- молекулярное, в виде ионов только вещества сильные электролиты); OH- +Н+= Н2О (сокращенное ионно- молекулярное)- эта реакция называется реакцией нейтрализации
б) Fe(OH)2↓+ 2HNO3= Fe (NO3)2+ 2Н2О (молекулярное); Fe(OH)2↓+ 2Н++2 NO3- = Fe2++2 NO3- + 2Н2О (полное ионно- молекулярное); Fe(OH)2↓+2Н+= Fe2++ 2Н2О (сокращенное).
4. Взаимодействуют с основными оксидами, образуя соль и воду : СаО + Н2SО4 = СаSО4+ Н2О; СаО+2Н++ SО42- = СаSО4↓+ Н2О
5. Взаимодействуют с амфотерными оксидами, образуя соль и воду: 2HCl + ZnO= ZnCl2+ Н2О; 2Н++2Cl-+ ZnO= Zn2++2Cl-+ Н2О; 2Н++ ZnO= Zn2+ + Н2О
6 . Взаимодействуют с солями согласно правилам, образуя при этом новую кислоту и новую соль: a) 2НNO3+ Na2CO3= 2NaNO3+ Н2CO3CO2↑; 2Н++ CO32- = CO2↑+ Н2O
. Взаимодействуют с солями согласно правилам, образуя при этом новую кислоту и новую соль: a) 2НNO3+ Na2CO3= 2NaNO3+ Н2CO3CO2↑; 2Н++ CO32- = CO2↑+ Н2O
 Н2О
Н2О
б) Н2SО4+ Ba(NO3)2= BaSО4 ↓ + 2НNO3; SО42-+ Ba2+= BaSО4 ↓
7. Взаимодействуют с металлами, стоящими в ряду активности до водорода, образуя соль и водород (исключения НNO3 любой концентрации, Н2SО4 (к)): Zn+ 2НСl= ZnCl2+ Н2↑; Zn+ 2Н+= Zn2++ Н2↑
8. Некоторые кислоты разлагаются (угольная , сернистая, кремниевая) , образуя оксид и воду.
Н2C+4O3= C+4O2↑+ Н2О
Задания для закрепления материала.
-
Из следующего списка выпишите только формулы кислот, классифицируйте их по различным признакам, назовите их: Н2O, BaSО4, НСl , HNO3 , Na2CO3 , Н 2CO3 , KOH, HMnO4, N2O5.
-
Составьте уравнения реакций, которые можно использовать для получения ортофосфорной и хлороводородной кислоты.
-
Закончите следующие уравнения химических реакций, характеризующие химические свойства кислот, реакции запишите в молекулярном и ионно- молекулярном виде
1) а) ВаО + НСl → 2) а) KOH + H2SO4 → 3) а) Nа2S + H2SO4→
б) Na2O +H2SO4→ б) Zn(OH)2+ НСl → б) AgNO3+ НСl →
в) FeO + HNO3 → в) Fe(OH)3 + HNO3 → в) K2SiO3 + H3PO4→
4) а) Al+ НСl →
б) Mg + HBr→
в) Zn+ H2SO4 →
-
* С какими из ниже перечисленных веществ реагирует соляная кислота: медь, барий, сера, оксид углерода (IV), оксид алюминия, оксид железа (II), гидроксид кальция, гидроксид калия, нитрат серебра, сульфат натрия. Составьте уравнения возможных реакций в молекулярном и ионно- молекулярном виде. Сделайте вывод о химических свойствах соляной кислоты.


