- Преподавателю
- Химия
- Методические рекомендации для проведения лабораторных и практических работ по химии
Методические рекомендации для проведения лабораторных и практических работ по химии
| Раздел | Химия |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Толкачева Г.И. |
| Дата | 17.04.2015 |
| Формат | doc |
| Изображения | Есть |
Комитет образования и науки Курской области
областное бюджетное профессиональное
образовательное учреждение
« Железногорский политехнический колледж»
Методические рекомендации
для проведения лабораторных
и практических работ по химии
Составитель:
Толкачева Г.И.
2015 г.
АННОТАЦИЯ
Одним из наиболее действенных путей, который позволит достичь определенных образовательных целей, является практико-ориентированная деятельность обучающихся на занятиях, которая способствует обучению, воспитанию, развитию.
Практикум по химии соответствует программе дисциплины «Химия» и представляет собой практическое руководство по методике проведения лабораторных и практических работ в среднем профессиональном учебном заведении.
Лабораторные и практические работы, входящие в практикум составлены таким образом, что имеют теоретическую часть, изучение которой позволит обучающимся вспомнить учебный материал по теме лабораторной или практической работы, а также непосредственно практическую часть.
Составитель: Толкачева Галина Ивановна, преподаватель химии ОБПОУ «Железногорский ПК».
Рецензент: Иванова Нина Александровна- преподаватель химии, ОБОУ СПО «Железногорский горно - металлургический колледж»
Печатается по решению научно-методического совета колледжа
1. Общие положения
Практические и лабораторные занятия должны проводиться в учебных кабинетах. Продолжительность занятия не менее двух академических часов.
Необходимыми структурными элементами практического и лабораторного занятия, помимо самостоятельной деятельности студентов, являются инструктаж, проводимый преподавателем, а также анализ и оценка выполненных работ и степени овладения студентами, запланированными умениями.
Выполнению лабораторных работ и практических занятий, предшествует проверка знаний студентов - их теоретической готовности к выполнению задания.
Целью практических занятий является приобретение начальных практических навыков, при которых студент:
- получает способность владеть культурой речи, это приобретается при попытках выполнить практическое задание и при обсуждении с преподавателем отчёта о выполнении практического задания;
- учится использовать базовые положения при решении профессиональных задач, это приобретается при поиске и привлечении необходимого теоретического материала при решении поставленных в практическом задании задач;
- получает способность использовать профессионально-ориентированную риторику, это приобретается при формировании в письменной форме всех высказываний, необходимых для пояснения своих действий;
- учится владеть навыками самостоятельной работы, это приобретается непосредственно в процессе подбора на основе анализа поставленной в практической работе задачи необходимого теоретического материала для решения этой задачи;
- учится владеть основными методами, средствами и способами получения, хранения, переработки информации, иметь навыки работы с компьютером, это приобретается при выполнении отчёта о решении поставленной задачи.
Практические и лабораторные работы выполняются студентами по выданному преподавателем заданию.
Задания первого уровня трудоёмкости (сложности) содержат практические вопросы, решение которых возможно только при усвоении теоретического материала.
Задания второго уровня трудоёмкости (сложности), для решения которых необходимо обладать теоретическими знаниями пройденных тем.
Результатом выполнения задания является отчёт, представляемый студентом в специальной тетради для практических и лабораторных работ, который должен удовлетворять общепринятым требованиям.
Практические и лабораторные занятия способствуют более глубокому пониманию теоретического материала учебного курса, а также развитию, формированию и становлению различных уровней составляющих профессиональной компетентности студентов.
Практические и лабораторные работы по химии проводятся согласно календарно-тематическому планированию, в соответствии с требованиями учебной программы по химии. Практические и лабораторные работы проводятся как индивидуально, так и для пары или группы студентов.
Рекомендации к оформлению отчета по выполнению лабораторных и практических работ по химии.
1. Отчет проверяется преподавателем после каждой проведенной работы, оценки выставляются каждому студенту, с занесением оценок в журнал.
2. От предыдущей работы отступают 3-4 клетки и записывают дату проведения. Посередине следующей строки записывают номер лабораторной работы. Далее, каждый раз с новой строки записывают тему, цель и оборудование. После строки «ход работы» коротко поэтапно описывается выполнение работы.
3. Если в ходе работы задается вопрос, то записывается ответ, если требуется оформить рисунок, заполнить таблицу, то соответственно выполняется рисунок или заполняется таблица.
4. Рисунки должны иметь размер не меньше, чем 6х6 см. не обязательно рисовать все, что видно в микроскоп, достаточно зарисовать небольшой фрагмент. Все рисунки должны иметь обозначения составных частей.
5. Рисунки должны располагаться на левой стороне тетрадного листа, подписи к рисункам - внизу.
6. Таблицы заполняются четко и аккуратно. Таблица должна занимать всю ширину тетрадной страницы.
7. Схемы должны быть крупными и четкими, выполненными простым карандашом (допускается использование цветных карандашей), содержать только главные, наиболее характерные особенности, детали.
8. Ответы на вопросы должны быть аргументированы; ответы типа «да» или «нет» не принимаются.
9. В конце каждой лабораторной работы обязательно записывается вывод по итогам выполненной работы (вывод формулируется исходя из цели работы).
Лабораторная работа № 1
Тема: «Моделирование построения Периодической таблицы химических элементов».
Цель: Научиться моделированию построения Периодической таблицы химических элементов, дать характеристику элемента по таблице.
Реактивы и оборудование: таблицы Периодической системы химических элементов Д.И.Менделеева.
Теоретические основы
1. В основу построения таблицы Периодической системы химических элементов положен Периодической закон Д.И.Менделеева ( 1 марта 1869г):
Свойства химических элементов и образованных ими веществ находятся в периодической зависимости от их относительных атомных масс.
В основу построения таблицы лежат два основных признака: величина атомной массы и свойства Д.И.Менделеев обнаружил, что свойства элементов изменяются в пределах определенных их совокупностей линейно (монотонно возрастают или убывают), а затем повторяются периодически, то есть через определенное число элементов встречаются сходные. Периодический закон и Периодическая система имеют периодические закономерности: горизонтальную(по периодам) периоличность, периодичность вертикальную (по группам) и диагональную.
Периоды делятся на малые и большие ( ряды). Группы делятся на главную и побочную.
Период - это горизонтальный ряд химических элементов, расположенных по возрастанию порядкового номера, начинаются щелочным металлом и заканчивается инертным газом; слева направо в периодах нарастают неметаллические свойства, что связано с нарастанием числа электронов на последнем слое в атоме, а значит, по способности их присоединять электроны.
Группа - вертикальная группировка элементов, в которой один под другими размещены сходные методу собой элементы. Группа делятся на главную и побочную.
Группа (главная подгруппа) - вертикальный ряд химических элементов, где сверху вниз нарастают металлические свойства, что связано с нарастанием числа электронных слоев в атоме, а значит со способностью отдавать электроны.
В главную подгруппу входят химические элементы только больших периодов.
В побочную подгруппу входят химические элементы только больших периодов.
Номер периода показывает число электронных слов.
Номер группы показывает высшую валентность элементов и число электронов на последнем слое.
Порядковый номер элемента показывает заряд ядра и число электронов в атоме.
Под диагональной периодичностью понимают повторяемость сходства химических свойств и соединений элементов, расположенных по диагонали друг от друга в Периодической системе.
Сходство в свойствах между простыми веществами и соединениями, образованными химическими элементами, расположенными по диагонали, объясняется тем, что нарастание неметаллических свойств в периодах слева направо приблизительно уравновешивается эффектом увеличения металлических свойств в группах сверху вниз.
Например, Li похож на Mg во всем, что отличает его от Na.
Аналогично В больше напоминает Si, чем Al.
Группа период
2
Li
Be
C
N
3
Na
Mg
Al
Si
P
Лучше всего диагональную периодичность свойств неметаллов характеризует хорошо известная диагональ B-Si-As-Te-At, которая условно делит элементы на металлы и неметаллы.
2. Характеристика химического элемента по Периодической таблице Д.И. Менделеева.
2.1 порядковый номер, название элемента, химический знак
2.2 металл или неметалл
2.3 относительная атомная масса
2.4 номер периода (малый или большой)
2.5 номер группы, подгруппа (главная или побочная)
2.6 электронная схема, электронная формула, графическая формула наружного электронного слоя
2.7 формула высшего оксида
2.8 формула водородного соединения неметалла
2.9 сравнение металлических или неметаллических свойств по периоду и по подгруппе.
Контрольные вопросы:
-
Современная формулировка Периодического закона.
-
Дать характеристику двум диагоналям:
Al-Ge-Sb и Zn-Ln-Pb.
-
Почему так похожи свойства лантана и лантаноидов, актиния и актиноидов?
-
Дать характеристику химического элемента по таблице:
4.1 Li, Al, P
4.2 Na, Be, Cl
4.3 K ,Ti, F
4.4 Rb, Zn, Br
4.5 Ag, Mg, O
4.6 Cs, Ca, C
4.7 Fr, Sn, N
4.8 Hg, Sr, N
4.9 Cu, Fe, I
4.10 Ni, Mn, B
4.11 Mo, Au, P
4.12 Fe, Ag, C
4.13 Co, Al, S
4.14 Ni, Zn, Cl
4.15 Pt, Ca, O
4.16 Cd, Pb, H
Лабораторная работа № 2
Тема: «Получение суспензии и эмульсии. Ознакомление со свойствами дисперсных систем »
Цель: Ознакомиться со свойствами дисперсных систем. Получить суспензии и эмульсии.
Реактивы и оборудование: СаСОз, моторное масло, растительное масло, пробирки, коллекции паст, суспензий, эмульсий.
Теоретические основы Смеси веществ. Гетерогенные системы (дисперсные системы), гомогенные системы (растворы).
Дисперсными называют гетерогенные системы, в которых одно вещество в виде очень мелких частиц равномерно распределено в объёме другого. То вещество, которое присутствует в дисперсной системе в меньшем количестве и распределено в объеме другого, называют дисперсной фазой. Вещество, присутствующее в дисперсной системе в большом количестве, в объеме которого распределена дисперсная фаза, называют дисперсионной средой.
По величине частиц вещества, составляющие дисперсную фазу, дисперсные системы делятся на грубодисперсные с размерами частиц более 100 нм и тонкодисперсные с размерами частиц от 100 до 1нм.
Эмульсии - это грубодисперсная система с жидкой дисперсионной средой и жидкой дисперсной фазой.
Суспензия - это грубодисперсная система с твердой дисперсной фазой и жидкой дисперсионной средой.
Аэрозоли - это грубодисперсные системы, которых дисперсионной средой является газ (например, воздух),а дисперсной фазой могут быть капельки жидкости (облака, радуга, выпущенный из баллончика лак для волос или дезодорант) или частицы твердого вещества (пылевое облако, смерч).
Гели - это коллоидные системы, в которых частицы дисперсной фазы образуют пространственную структуру.
Золи - это коллоидные системы, в которых дисперсионной средой является жидкость, дисперсной фазое - твердой вещество.
Классификация дисперсных систем и растворов
ДИСПЕРСНЫЕ РАСТВОРЫ И СИСТЕМЫ
Таблица №1 РАСТВОРЫ
Грубодисперсные системы:
1.Эмульсии
2.Суспензии
3.Аэрозоли
Молекулярные
1.Молекулярно-ионные
2.Ионные
Коллоидные системы:
1.Гели
2.Золи
Ход работы
Опыт№1 Ознакомление с дисперсными системами.
Приготовьте небольшую коллекцию образцов дисперсных систем из имеющихся дома суспензий, эмульсий, паст и гелей. Поменяетесь с соседом коллекциями и затем распределите образцы коллекции в соответствии с классификацией дисперсных систем(таблица№2). Ознакомьтесь со сроками годности пищевых, медицинских и косметических гелей. Каким свойством гели определяется срок их годности?
Опыт №2 Получение эмульсии масла.
В пробирку наливают несколько капель подсолнечного масла. Добавляют дистиллированную воду до половины пробирки. Закрыв отверстия пробирки пробкой, хорошо взбалтывают ее содержимое. В другую пробирку наливают столько же масла и воды, добавляют несколько капель 1%- нога раствора мыла. Взбалтывают так же, как первую пробирку. В какой пробирке получится более стойкая эмульсия? Объясните, понижает или повышает мыло поверхностное натяжение. Почему?
Опыт №3 Получения золя гидроксила железа (III).
К 10мл дистиллированной воды, нагретой до кипения, прибавляют по каплям 2% -ный р-р FeCl3 (~ 1мл). Кипятят 2-Змин. Как меняется цвет раствора? Почему? Составьте молекулярное и ионное уравнения гидролиза Fe Cl3.
Контрольные вопросы:
1. Почему чистый воздух, природный газ истинные растворы не относятся к дисперсным системам?
2. Как подразделяют грубодисперсные системы? Назовите представителей каждой группы и укажите их значение.
3. Как подразделяют коллоидные системы? Назовите представителей каждой группы и укажите их значение.
4. Почему природа в качестве носителя эволюции выбрала именно коллоидные системы?
Классификации дисперсных систем по агрегатному состоянию Таблица №2
Дисперсионная среда
Дисперсная фаза
Примеры некоторых природных и бытовых дисперсных систем
Газ
Жидкость
Туман, попутный газ с капельками нефти, карбюраторная смесь в двигателях автомобилей (капельки бензина в воздухе), аэрозоли
Твердое вещество
Пыль в воздухе, дымы, смог, самумы (пыльные и песчаные бури), твердые аэрозоли
Жидкость
Газ
Шипучие напитки, пены
Жидкость
Эмульсии. Жидкие среды организма (плазма крови, лимфа, пищеварительные соки), жидкое содержимое клеток (цитоплазма, кариоплазма)
Твердое вещество
Золи, гели, пасты (кисели, студни, клеи). Речной и морской ил, взвешенные в воде; строительные растворы
Твердое вещество
Газ
Снежный наст с пузырьками воздуха в нем, почва, текстильные ткани, кирпич и керамика, поролон, пористый шоколад, порошки
Жидкость
Влажная почва, медицинские и косметические средства (мази, тушь, помада и т. д.)
Твердое вещество
Горные породы, цветные стекла, некоторые сплавы
Лабораторная работа № 3
Тема: «Химические свойства неорганических кислот, оснований Гидролиз солей»
Цель: изучить химические свойства кислот, оснований, солей. Научиться составлять уравнения реакций в молекулярной и ионных формах.
Реактивы: фенолфталеин, лакмус, метиловый оранжевый, железа (опилки), медь( стружка), цинк( гранулы), фильтры, карбонат натрия, хлорид цинка, нитрат калия, соляная кислота, нитрат серебра, гидроксид натрия, серная кислота, оксид меди (II), сульфат меди (II).
Ход работы
-
. Выполнить опыты
-
. Заполнить таблицу (смотри образец)
-
. Выполнить свой вариант самостоятельной работы
Опыт № 1 Различные случаи гидролиза солей.
В три пробирки прилейте по 1-2мл растворов: в первую - карбоната натрия, во вторую - хлорида цинка, в третью - нитрата калия. Испытайте действие растворов на универсальную индикаторную бумажку. Что наблюдаете?
Объясните результаты наблюдений и запишите уравнения реакций в молекулярной и ионной формах.
Опыт № 2 Изучение взаимодействия кислот с солями.
В пробирку с раствором карбоната натрия (1-2мл) прилейте такой же объем раствора соляной кислоты. (Что наблюдаете?)
В пробирку с раствором соляной кислоты добавьте несколько капель раствора нитрата серебра(I). (Что наблюдаете?) Напишите уравнения реакций в молекулярной и ионной формах.
Опыт № 3 Свойства нерастворимых и растворимых оснований.
Растворите выданные вам в пробирках гидроксиды натрия, калия. Отметьте их агрегатное состояние и цвет. Прилейте в пробирки по 3-4мл воды и взболтайте. Мутные жидкости отфильтруйте. К фильтратам добавьте несколько капель раствора фенолфталеина. Что наблюдаете? Напишите уравнения диссоциации для щелочей.
Опыт № 4 Действие кислот на индикаторы.
Поместите в штатив 3 пробирки .В пробирки налейте по 1мл разбавленной серной кислоты. Добавьте в первую пробирку несколько капель лакмуса, во вторую - несколько фенолфталеина, третью - несколько капель метилового оранжевого. Что наблюдаете? Напишите уравнения диссоциации кислот.
Опыт № 5 Действие кислот на металлы.
В пробирку поместите по одной грануле цинка, в другую - немного железных опилок, еще в третью - немного медных стружек. В каждую пробирку добавьте 1мл разбавленной серной кислоты. Что наблюдаете? Напишите уравнения реакций в молекулярной и ионной формах.
Опыт № 6 Взаимодействие кислот с основными оксидами.
В пробирку насыпьте немного черного порошка оксида меди (II), прилейте 1мл разбавленной серной кислоты. Закрепите пробирку в держателе и слегка нагрейте. Что наблюдаете? Напишите уравнения реакций в молекулярной и ионной формах.
Опыт № 7 Взаимодействие кислот со щелочами.
Налейте в пробирку 1мл раствора щелочи и добавьте к нему несколько капель фенолфталеина. Что наблюдаете? Прилейте затем в эту пробирку избыток раствора серной кислоты. Что наблюдаете? Напишите уравнения реакций в молекулярной и ионной формах.
Опыт № 8 Взаимодействием кислот с нерастворимыми основаниями.
В пробирку налейте 1мл раствора сульфата меди (II) и добавьте 1мл гидроксида натрия. Что наблюдаете? В пробирку добавьте до полного растворения серной кислоты. Что наблюдаете? Напишите уравнения реакций в молекулярной и ионной формах.
Контрольные вопросы
Осуществить превращения. Напишите уравнения реакций в молекулярной и ионной формах.
1. 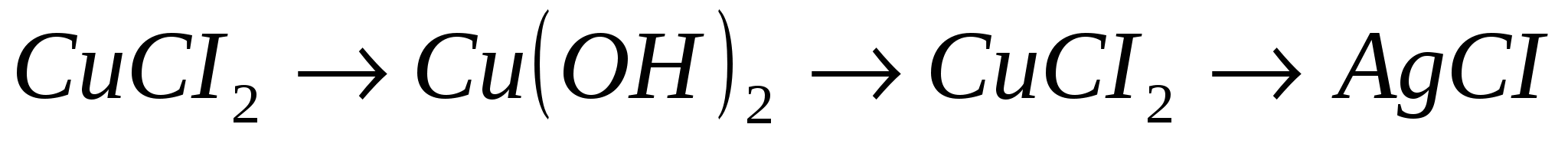
2. 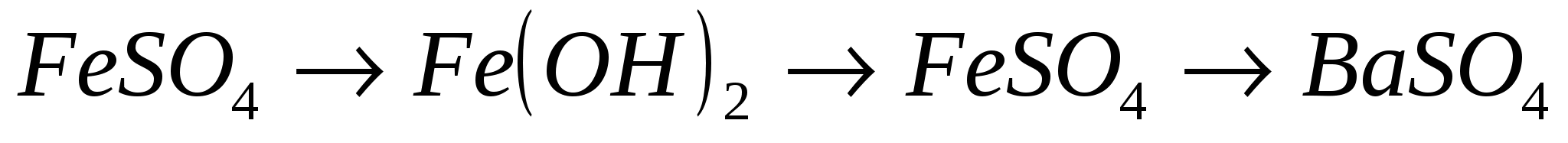
3. 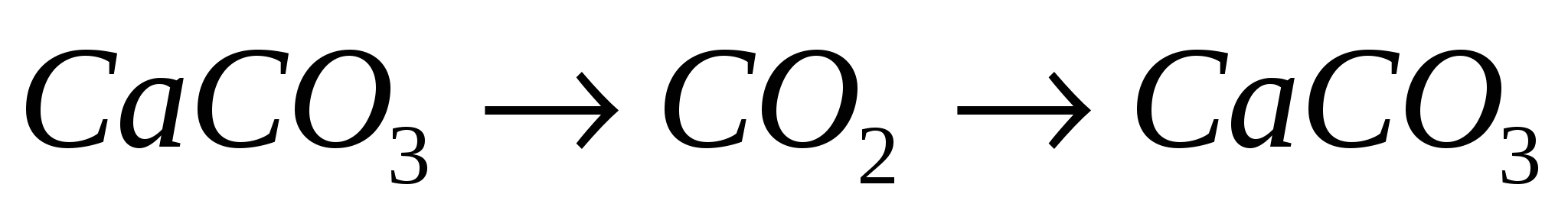
4. 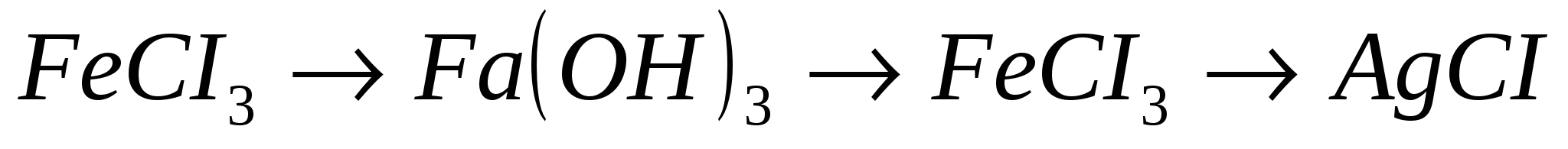
5. 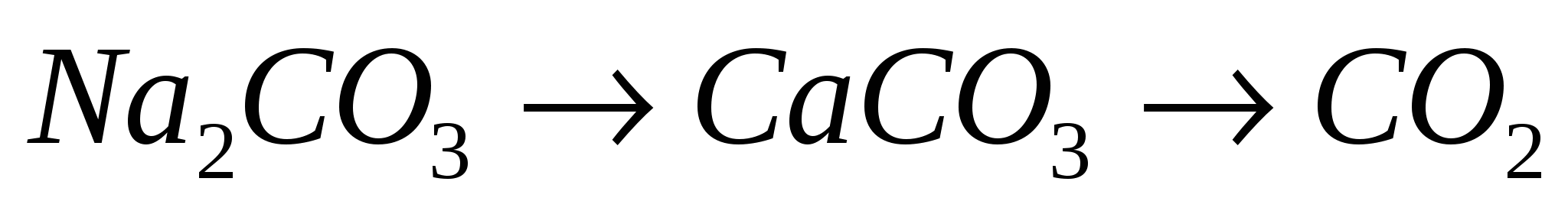
6. 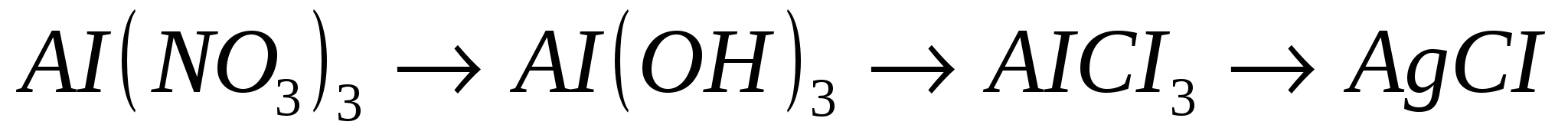
7. 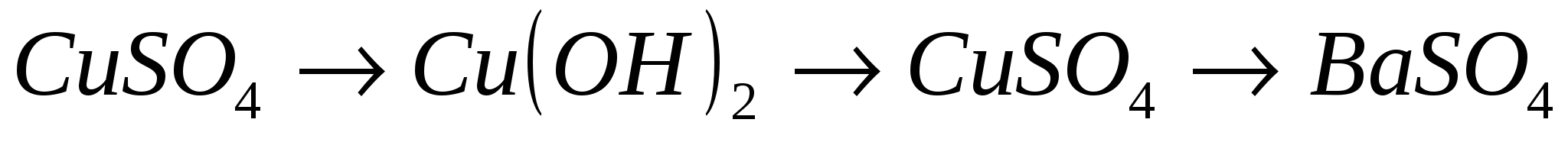
8. 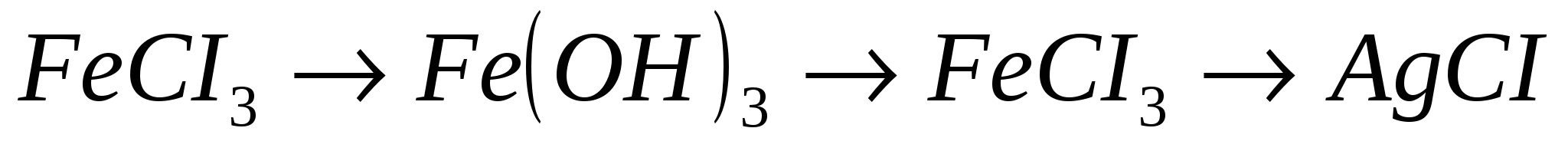
9. 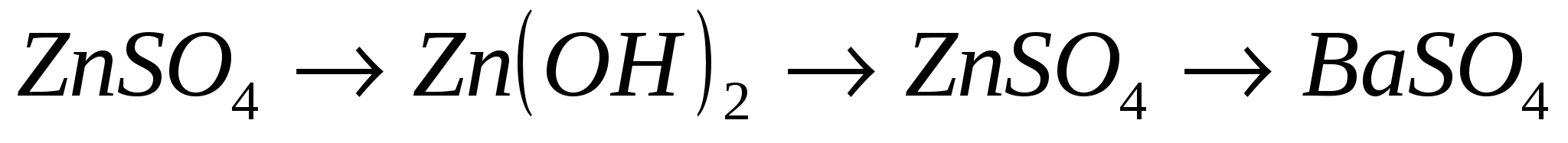
10. 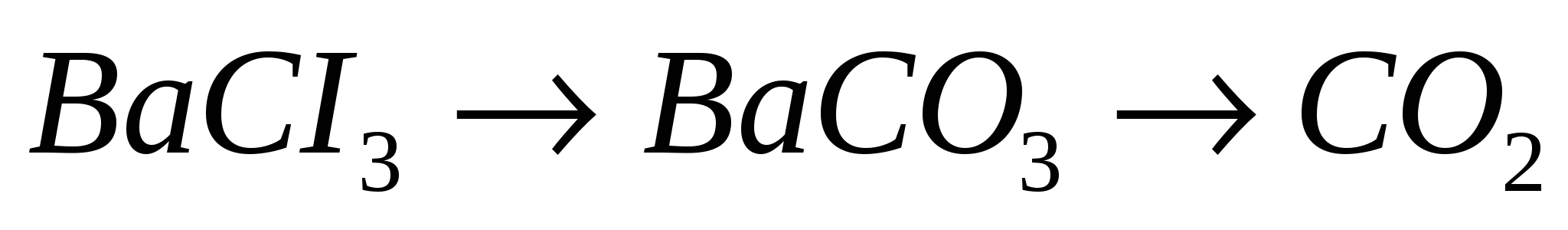
11. 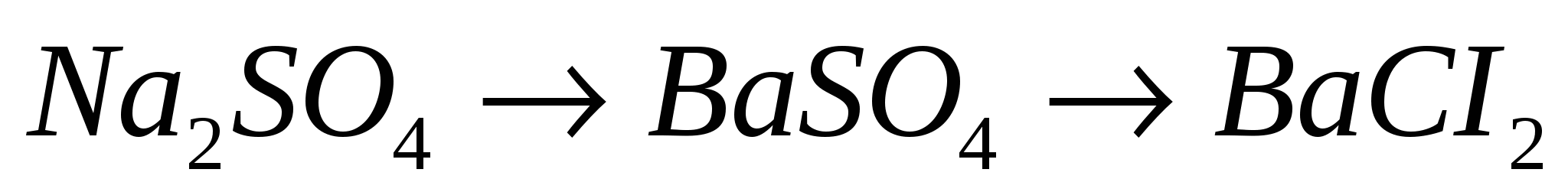
12. 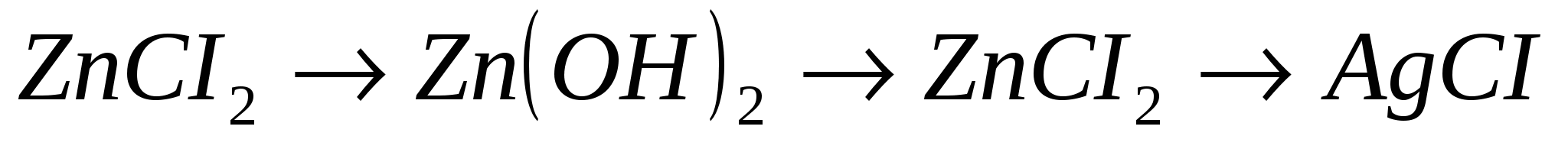
13. 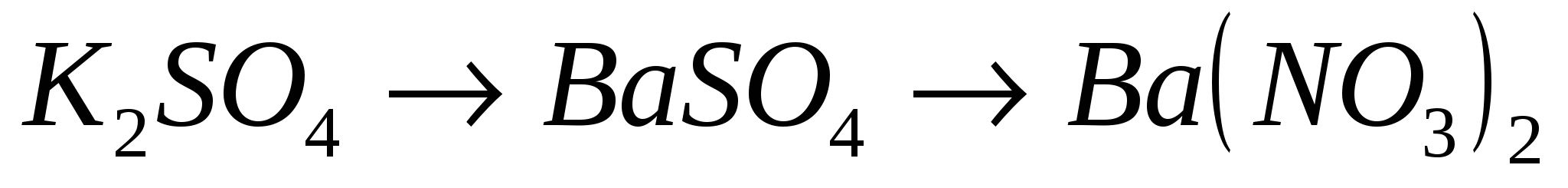
14. 
15.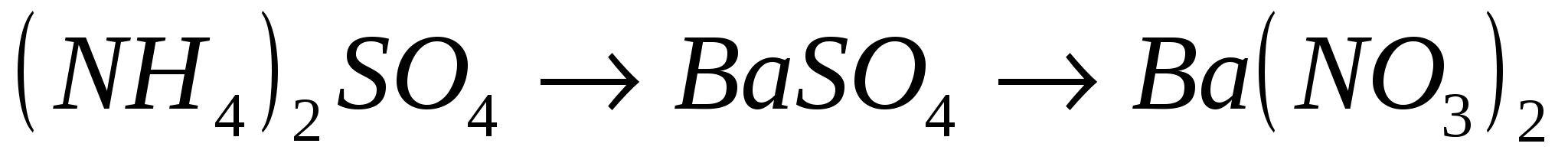
16. 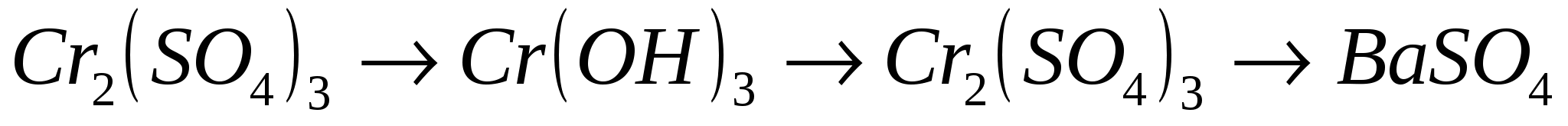
Лабораторная работа № 4
Тема: «Реакции ионного обмена. Зависимость скорости реакции от концентрации, температуры».
Цель: ознакомиться с реакциями ионного обмена, сформировать умения записывать уравнения химических реакций в молекулярном и ионных видах; изучить зависимость скорости реакции от концентрации, температуры и катализатора.
Теоретические основы
I. Реакции между ионами называют ионными реакциями, а уравнение таких реакций ионными уравнениями. При составлении ионных уравнений следует руководствоваться тем, что формулы веществ малодиссациирующих, нерастворимых и газообразных записываются в молекулярном виде. Рассмотрим эти 3 случая.
1. Если в результате реакции образовался осадок:
молекулярное уравнение
Na2S04+BaCl2^BaS04+2NaCl полное ионное уравнение
2Na++S042"+Ba2++2ClBaS04|+2Na++2 Cl сокращенное ионное уравнение
Ba2++S042BaS04|
2. Рассмотрим ионное уравнение, которое протекает с образованием газа:
молекулярное уравнение Na2C03+2HCl-+2NaCl+H20+C02 полное ионное уравнение
2Na++C032"+2H++2Cl" =2Na++2Cl"+H20+C02T сокращенное ионное уравнение
2H++C032"=H20+C02t
3. Реакция ионного обмена протекает до конца, когда образуется
малодиссоциирующее вещество, например вода.
молекулярное уравнение
NaOH+HN03NaN03+H20
полное ионное уравнение
Na++ OH-+H+N03Na++N03-+H20
сокращенное ионное уравнение
0Н"+Н+Н2О
Указанная реакция взаимодействия сильной кислоты со щелочью называется реакцией нейтрализации.
Это частный случай реакции обмена. Вывод: Реакции ионного обмена в растворах электролитов практически необратимо протекают только в том случае, если в результате образуется осадок, газ или малодиссоциирующее вещество.
2. Раздел химии, изучающий скорость химической реакции, называется химической кинетикой.
Чтобы охарактеризовать быстроту течение химической реакции, пользуются понятием скорость химической реакции (v ).
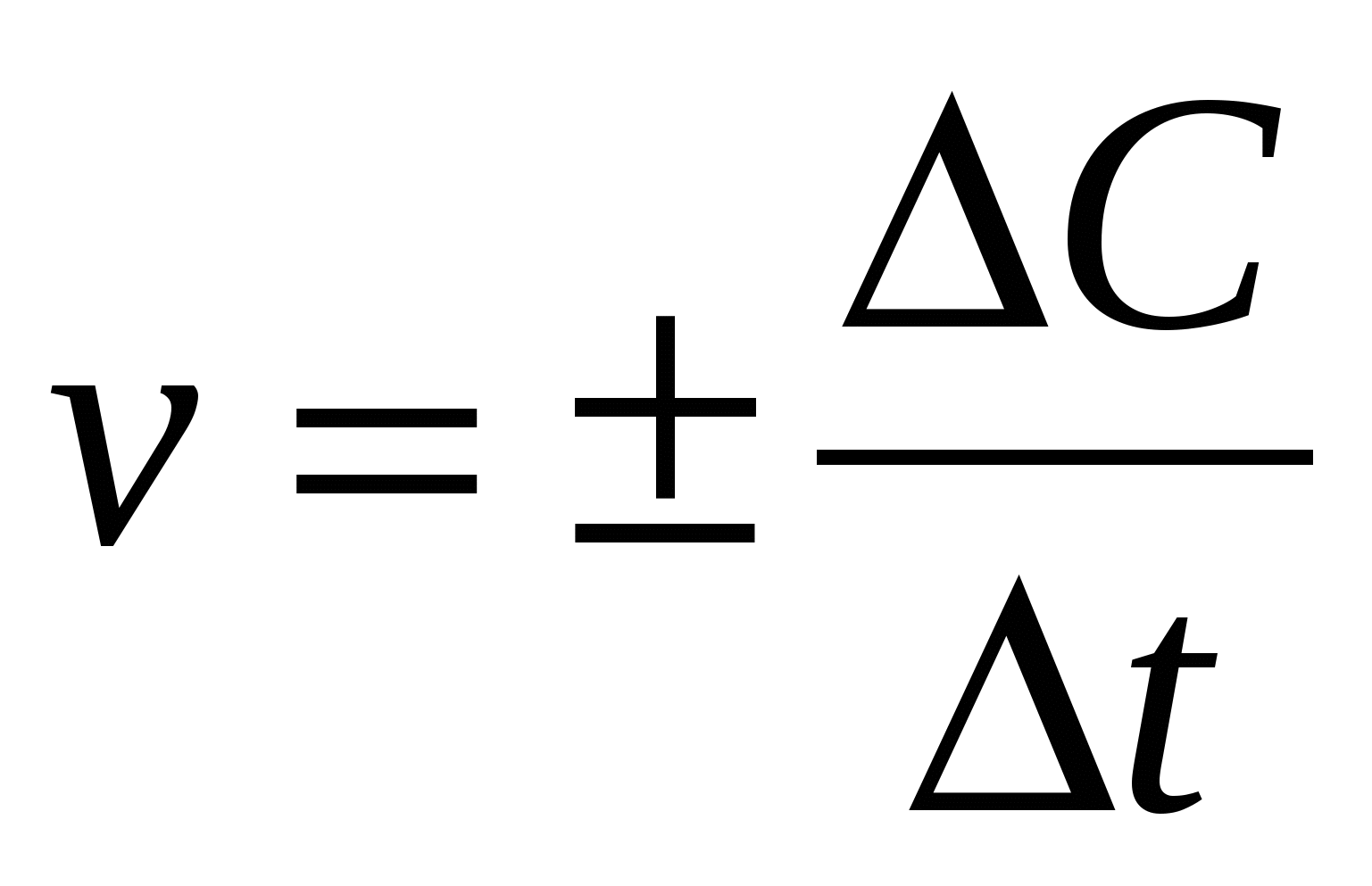
где C2-C1= С - молярные концентрации веществ, моль/л t2-t1= t - время, сек
Знак + перед дробью ставится, когда при определении скорости реакции по возрастающей концентрации образующихся веществ величина дроби получается положительной.
Знак - если концентрация исходного вещества убывает по мере протекания реакции.
Реакции, которые протекают в однородной среде, называются гомогенными.
Реакции, которые протекают в неоднородной среде (есть поверхность раздела реагирующих веществ), называются гетерогенными.
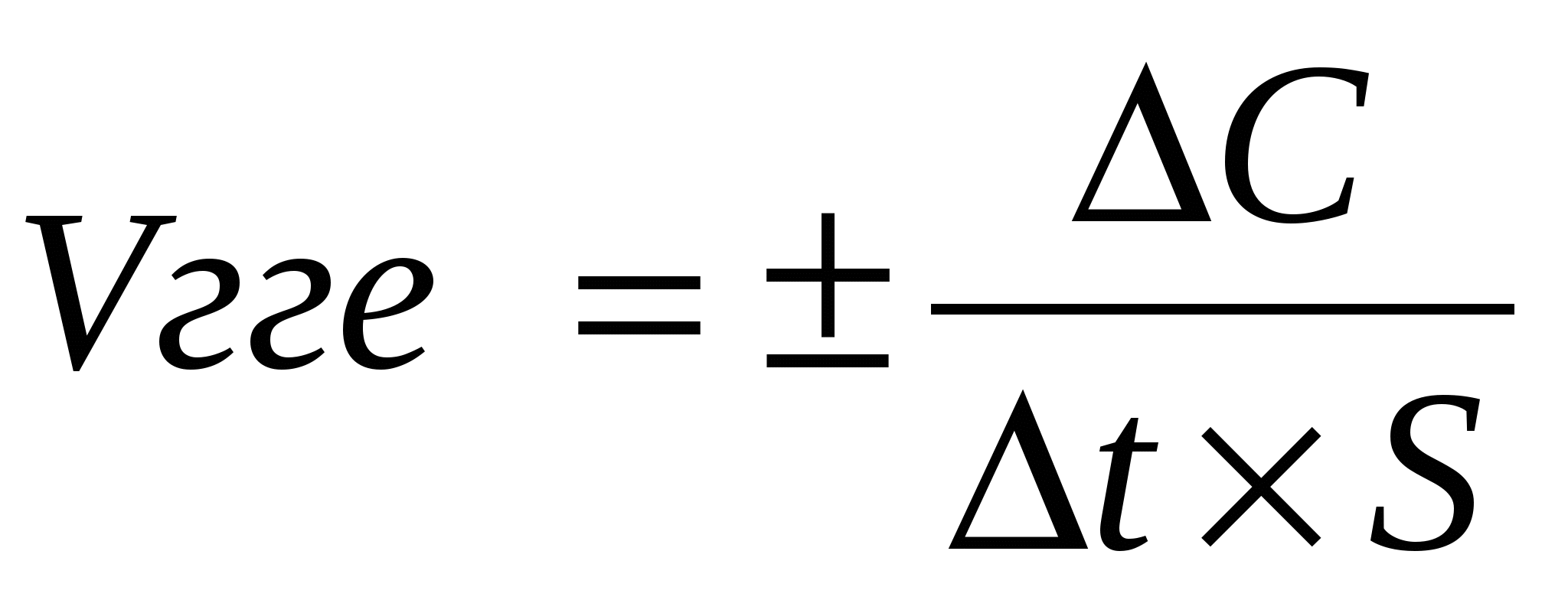
S - площадь поверхности твердого вещества.
Основные факторы, влияющие на скорость химических реакции
1 .Природа реагирующих веществ.
2.а) концентрация веществ в растворенном состоянии и газов
б) для веществ в твердом состоянии скорость прямо пропорциональна
поверхности реагирующих веществ.
3. Температура; правило Вант - Гоффа: «При повышении температуры на каждые 10° С скорость химических
реакции возрастает в 2-4 раза».
![]()
где у - температурный коэффициент.
4.Катализаторы (вещества, которые ускоряют ход химической реакции, но при этом не расходуются)
Ход работы
Опыт 1. Изучение реакций обмена (взаимодействия карбоната натрия с хлоридом кальция)
В пробирку налейте 2мл раствора карбоната натрия и добавьте равный объем раствора хлорида кальция. (Что происходит?). Напишите уравнение реакции обмена в молекулярной и ионной формах.
Опыт 2. Изучение взаимодействия кислот с основаниями
В пробирку налейте 2-Змл раствора щелочи и несколько капель фенолфталеина. (Что наблюдаете?) Затем прилейте в пробирку раствор кислоты до полного обесцвечивания содержимого. (Объясните результат наблюдений.
Получите нерастворимый гидроксид меди (II) реакцией обмена. С этой целью в пробирку с 2-3 мл раствора сульфата меди (II) прилейте 1-2 мл раствора щелочи. (Что наблюдаете?)
К полученному осадку прилейте раствор соляной или серной кислоты до полного его растворения. Объясните результаты наблюдений. Напишите уравнения реакций в молекулярной и ионной формах.
Опыт 3. Изучение разложения пероксида водорода в присутствии катализатора
В пробирку налейте 2мл раствора пероксида водорода, добавьте на кончике шпателя оксид марганца (IV). (Что наблюдаете?) Напишите уравнение реакции. Как доказать, что выделяющийся газ - это кислород?
Опыт 4. Изучение скорости взаимодействия раствора соляной кислоты с металлами
В три пробирки налейте по 2-Змл раствора соляной кислоты. В первую опустите гранулу цинка, во вторую-кусочек магния, в третью- кусочек железа. (В какой из пробирок выделение пузырьков водорода наиболее интенсивное, в какой - наименее? Почему?) Напишите уравнение реакции в молекулярной и ионной формах. Рассмотрите окислительно - восстановительные процессы.
Опыт 5. Изучение зависимости скорости химической реакции от концентрации
В три пробирки налейте соответственно 1,2,3 мл раствора соляной кислоты. В первую пробирку добавьте 2мл воды, во вторую- 1мл. (В какой пробирке концентрация кислоты наибольшая, в какой- наименьшая?) Затем в каждую из пробирок опустите по одной грануле цинка. (Как зависит скорость реакции от концентрации кислоты?)
Опыт 6.Изучение зависимости скорости химической реакции от температуры
В три пробирки поместите небольшое количество черного порошка оксида меди(П). В каждую пробирку прилейте по 2мл раствора серной кислоты. Первую пробирку оставьте в штативе, вторую поместите в стакан с кипятком, третью закрепите в держателе и нагрейте на пламени спиртовки. (Что наблюдаете? Почему?)
Контрольные вопросы
1. Составить реакции в молекулярном, ионном и кратком ионном виде:
a) Mg(OH)2 + H2S04 б) КОН + Н3Р04
в) Fe(OH)3+ НС1 г) Ва(ОН)2 + Н2СОэ
д.) Cu(N03)2 + Na2S е) NaCl + AgN03
ж) FeCl3 + Na3P04 з) Ba(N03)2 + A12(S04)3
Объяснить, почему реакция идет до конца.
2. Составить молекулярные и ионные уравнения реакций:
a) H2S04 + Cu(OH)2 б) H2SO4 + NaOH
в) H2S04 + Са(ОН)2 г) H2S04 + А1(ОН)3
д) Ca(NO3)2 + К2С03 е) AgNO3 + НС1
ж) AgN03 + Na2S04 з) Ba(N03)2 + H2S04
3. Составить уравнения электролитической диссоциации
а)гидроксида натрия, соляной кислоты, нитрата меди (П); б)серной кислоты, гидроксида лития, хлорида железа (Ш); в)азотной кислоты, гидроксида калия, сульфида натрия:
г) гидроксида кальция, хлорида бария, нитрата серебра;
д)нитрата калия, гидроксида бария, сульфата алюминия;
е) хлорид железа (II), нитрат магния, фосфорной кислоты;
ж) сульфата меди (II), карбоната калия, нитрат свинца:
з)хлорид никеля (П), сульфат бериллия, иодид кальция.
4. По какому иону происходит гидролиз в растворе:
а) сульфид калия; б) сульфата алюминия:
в) карбоната калия; г) нитрата железа (П);
д) хлорида аммония; е) нитрат свинца;
ж) хлорид железа (П); з) сульфата меди (П)
Определить среду в растворе соли. Какую окраску в растворе соли имеют индикаторы?
Лабораторная работа № 5
Тема: «Ознакомление с коллекцией железных руд и чугуна»
Цели: познакомиться с коллекцией железных руд, чугуна. Научиться определять наличие в растворе ионов Fe2+ , Fe3+ с помощью качественных реакций; проводить химические реакции, характеризующие свойства гидроксидов железа; закрепить умение изображать реакции в молекулярном и ионном виде.
Теоретические основы
Железо - второе по распространенности в природе металл после алюминия. В самородном состоянии встречается очень редко (метеориты, иногда вкраплено в базальты). Важнейшими железными рудами являются:
FeOFe203=Fe304 - магнетит (магнитный железняк) 72% Fe
Fe203 - гематит (красный железняк) 65%Fe
Fe203-nH20 - лимонит (бурый железняк) 60%Fe
FeS2 - пирит (серный колчедан) 46,6%Fe
FeC03 - сидерит (железный шпат) 35%Fe
В современной технике и в обыденной жизни применяются сплавы железа: чугун, сталь. В чугуне углерода содержится от 1,7-5%; в стали от 0,3-1,7%. Различают три вида чугунов: литейный, передельный, специальный.
Литейный (серый) чугун содержит углерод в виде графита, используется для отливки чугунных изделий, на изломе имеют серый цвет.
Передельный (белый) чугун содержит углерод в виде цемента Fe3C, используется для переработки в сталь.
Специальные чугуны различаются содержанием Si, Mn, Р, С. Используются для производства высококачественной стали.
Качественной реакцией на ионы железа(II) является комплексная соль K3(Fe(CN)6) - красная кровяная соль (или гексацианоферрат (III) калия); при взаимодействии ее с солями железа (II) образуется темно-синий осадок (лурнбулева синь).
Ионы железа (III) можно открыть с помощью тиоцианата (роданида) аммония NH4CNS; при этом образуется тиоцианат железа (III) кроваво-красного цвета. Ионы железа (III) можно также обнаружить желтой кровяной солью К4(Fe(CN)6)- гексацианоферрат (II) калия; при этом образуется темно-синий осадок (берлинская лазурь).
Ход работы
Реактивы: FeS04, FeCl3, H2S04, NaOH, K3(Fe(CN)6), K4(Fe(CN)6), NH4CNS.
Задания
1. Записать теоретическую часть в тетрадь.
2. Проделать опыты и записать уравнения реакций в молекулярной
и ионном виде.
3. Выполнить свой вариант самостоятельной работы
Опыт 1 Ознакомление с коллекцией железных руд
Рассмотрите, выданные образцы железных руд (например, гематит, магнетит, лимонит, сидерит). Заполните таблицу 1.
Таблица 1
№ п/п
Название железных руд
Формула
Внешний
Народно-
вид
хозяйственное
значение
1.
Магнитный железняк (магнетит)
Красный железняк
(гематит)
J.
Бурый железняк (лимонит)
Железный шпат (сидерит)
0пыт2
Получите гидроксид железа(II) и гидроксид железа (III) и докажите их основной характер.
Опыт 3
Проведите качественную реакцию на ионы Fe2+. Опыт 4
Проведите качественную реакцию на ионы Fe3+. Опыт 5
Определить процентное содержание железа в предложенных образцах стали с помощью рентгенофлуорецентного спектрометра Альфа - 2000, записать.
Контрольные вопросы
Осуществить превращения, дать названия веществам, возможные реакции изобразить в ионном виде.

Лабораторная работа № 6
Тема: «Изготовление моделей углеводородов и галогенпроизводных»
Цель: закрепить знания о пространственном строении алканов
Реактивы и оборудование: шарики различного диаметра, металлические стержни.
Теоретические основы
Углеводороды с общей формулой Сn Н2п+2, которые не присоединяют водород и другие элементы, называют предельными углеводородами или алканами (парафинами).
п- целое число, указывает количество атомов углерода в молекуле. Простейший представитель алканов- метан
Молекулярная формула - СН4
н Н
• •
н- С - н н • • с • • н
н • •
Н
структурная электронная
формула метана формула метана
Молекула метана имеет тетраэдрическое строение. Гибридные электронные орбитами атома углерода направлены к вершинам тетраэдра, образуют угол 10928. вершины этих гибридных орбитами перекрываются с орбиталями электронов атомов водорода, образуя б- связи.
Электронное и пространственное строение других представителей алканов сходно со строением молекул метана.
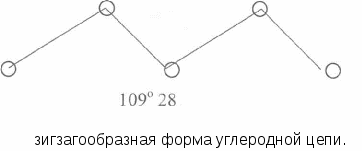
Углеродная цепь в пространстве имеет зигзагообразную форму, но при изображении формул эти углы не показывают (СН3 - СН2 - СН3 и т. д.).
Ход работы
Опыт 1. Изготовление модели молекулы метана.
Взять четыре шарика одного цвета и размера и один шар другого цвета, диаметр которого в 1,5 раз больше предыдущих. На поверхности шарика большого размера (атом углерода) примерно на одинаковых расстояниях в четырех местах вставьте стержни, к концам которого присоедините четыре маленьких шарика (атомы водорода).
Опыт 2. Изготовление модели молекул пропана.
Взять восемь шариков одинакового цвета и размера и три шарика другого цвета, диаметр которых в 1,5 раз больше предыдущих. Три шарика большего размера (атомы углерода) при помощи стержней соедините между собой под углом примерно 109°
В соответствии со структурной формулой пропана к шарикам большего размера при помощи стержней присоедините восемь шариков меньшего
размера, которые условно изображают атомы водорода.
Опыт 3. Изготовление модели молекулы 1-хлоропропана.
С одного стержня модели молекулы пропана снимите один маленький шарик
(атом водорода). Вместо него прикрепите шарик другого цвета (атом хлора),
диаметр которого примерно в 2 раза больше диаметра маленького шарика.
Контрольные вопросы
-
Почему для изготовления моделей молекул требуются шарики различных размеров?
-
Какое из основных положений теории А.М. Бутлерова вы использовали при изготовлении молекул моделей углеводородов и галогенпроизводных?
-
Почему при изготовлении модели молекулы пропана атомы углерода нужно соединять примерно под углом 109?
-
Алкан имеет формулу
а) 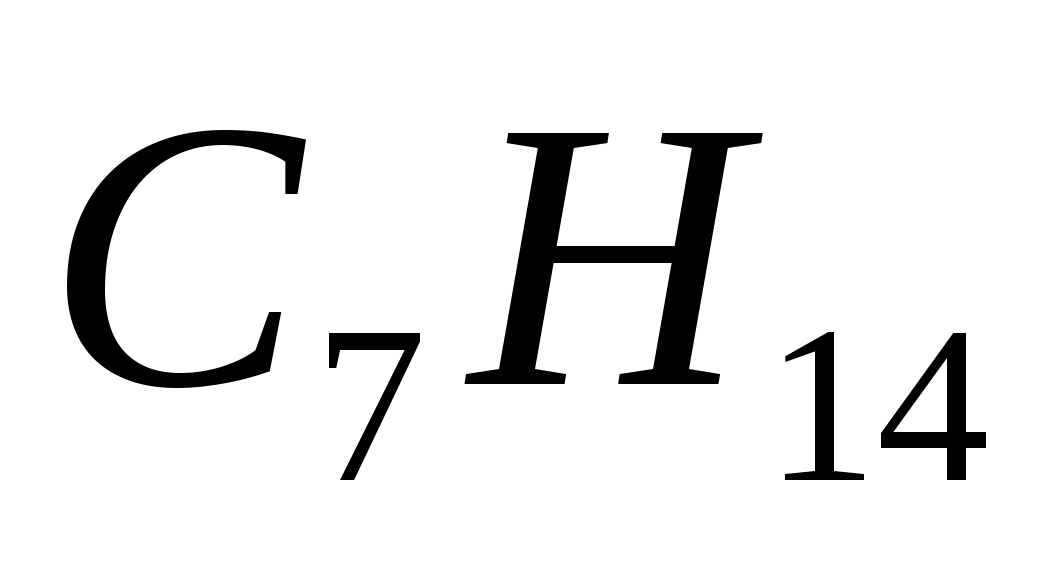 в)
в) 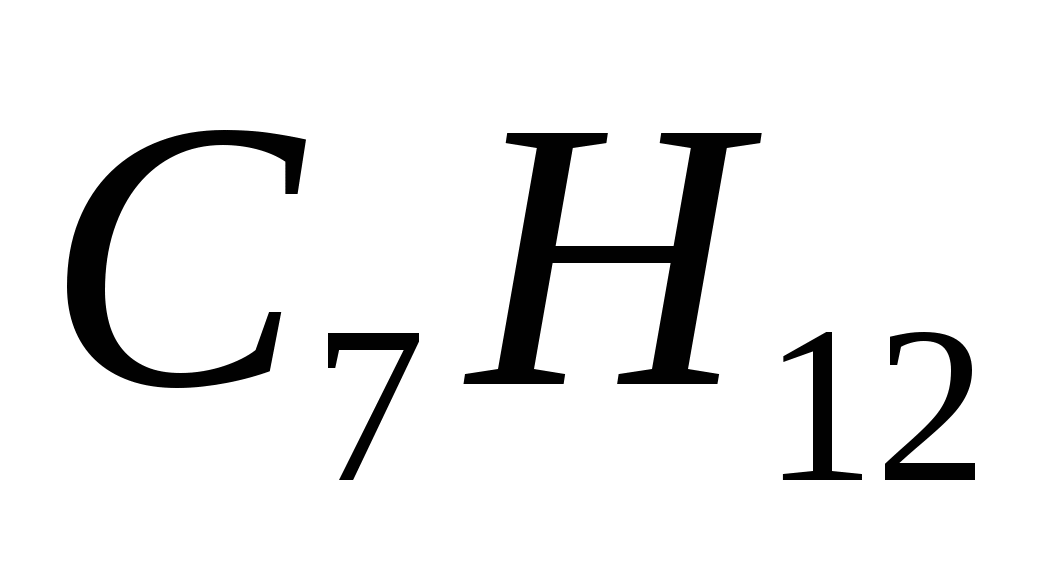
б) 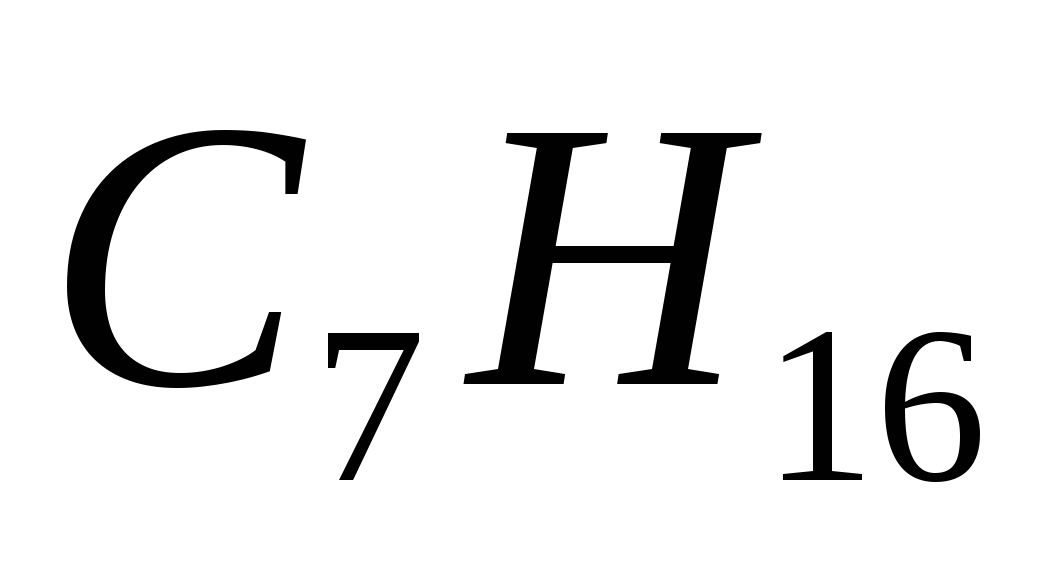 г)
г) 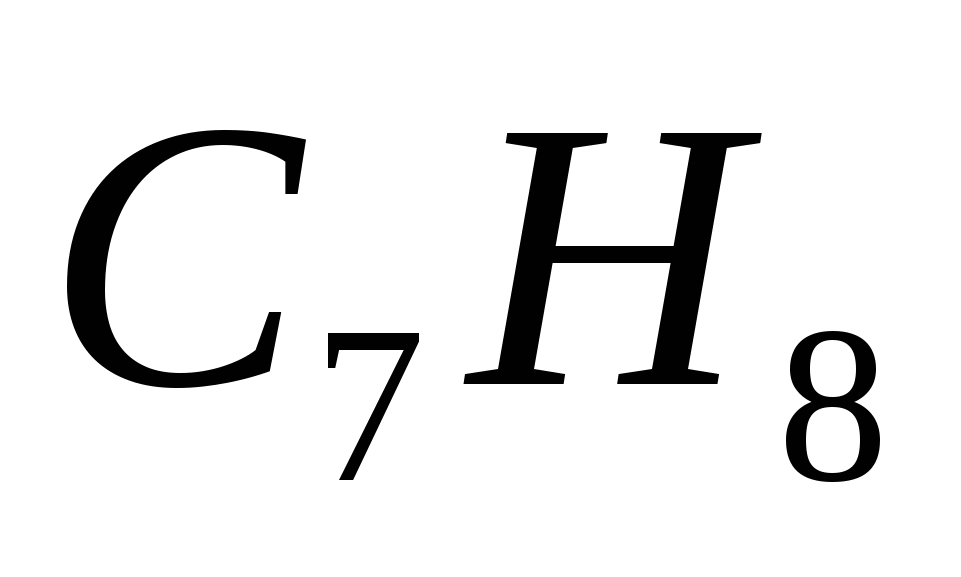
5. Формулы только алканов записаны в ряду
а) 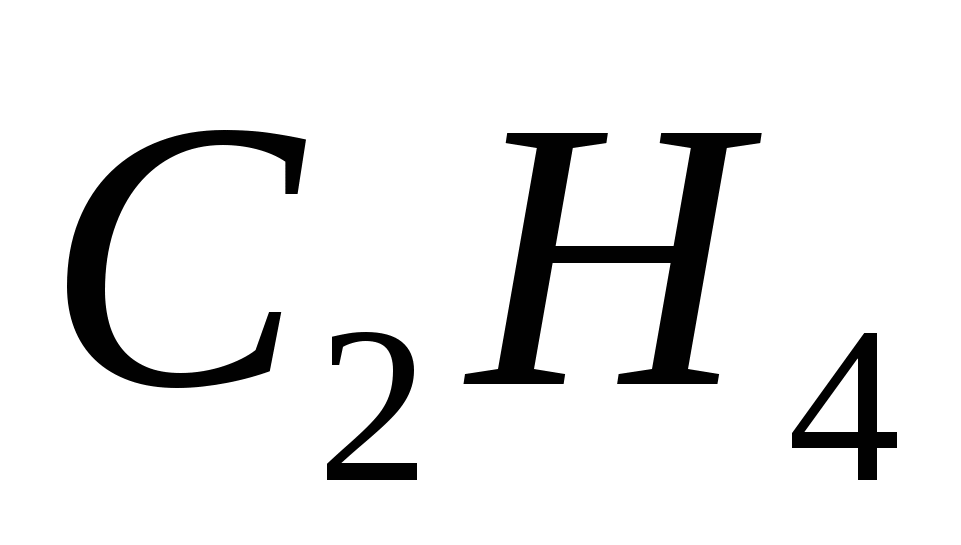 ,
, 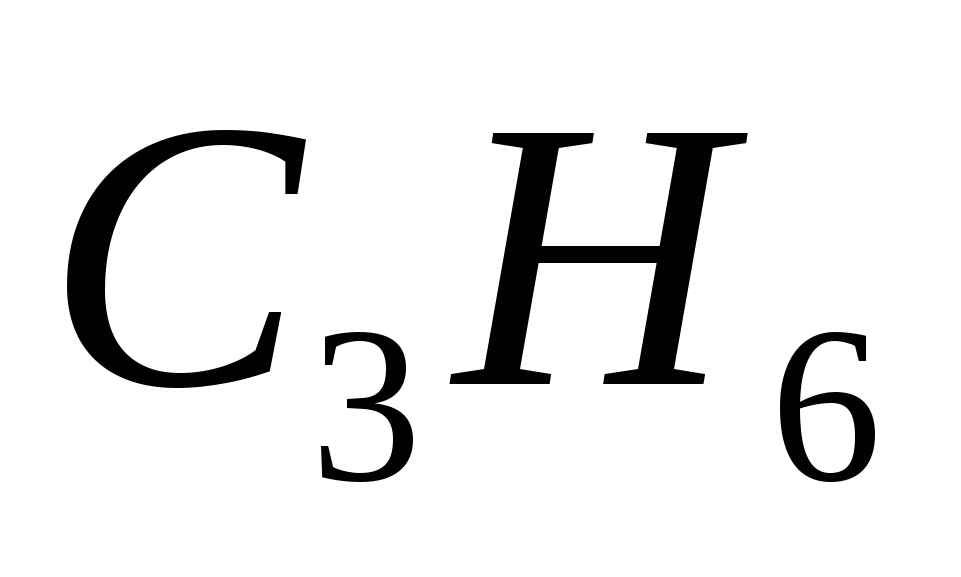 ,
, 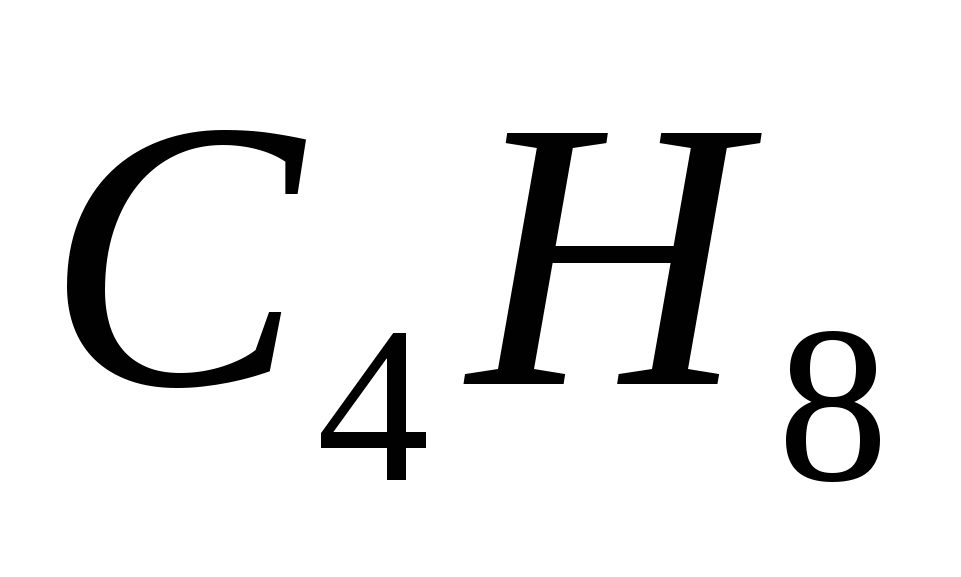
б) 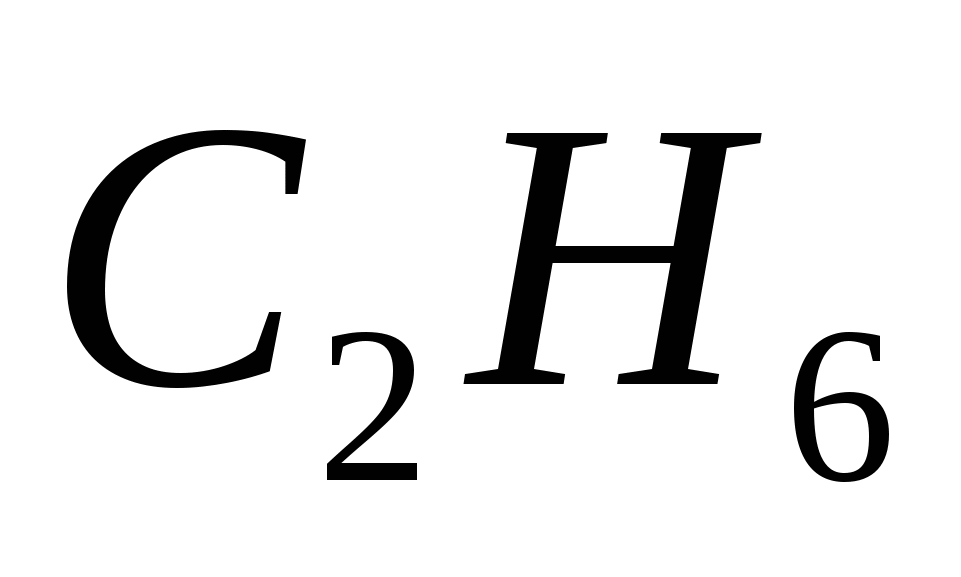 ,
, 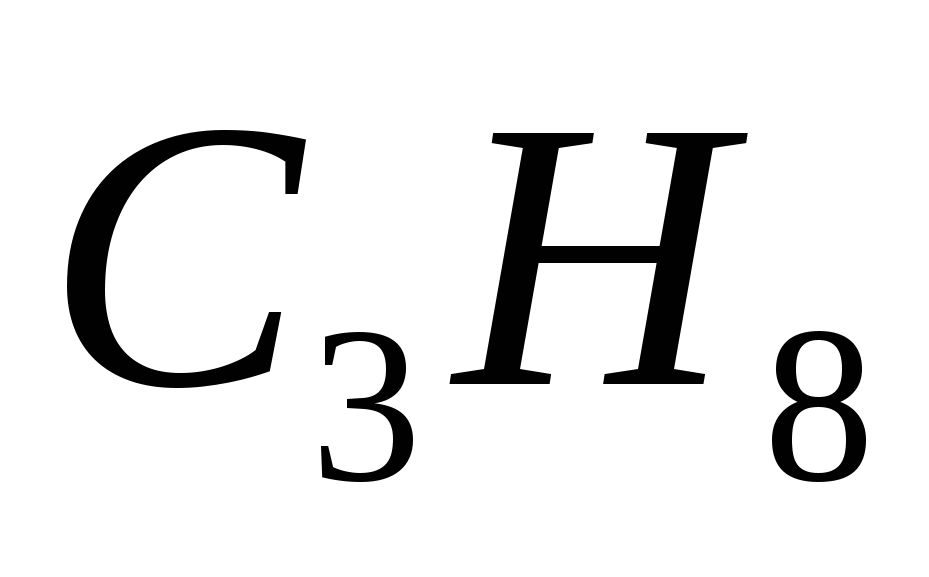 ,
, 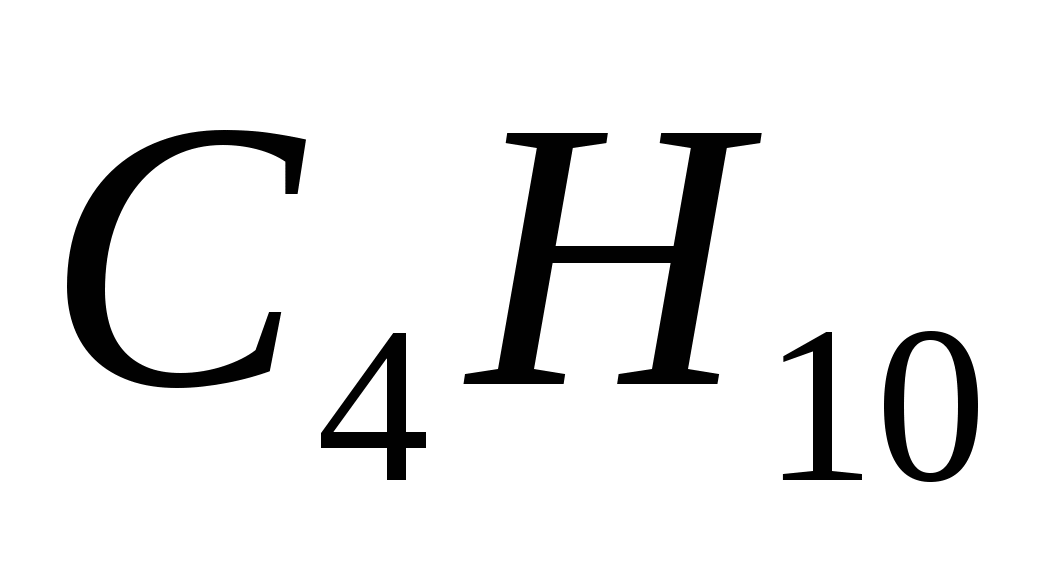
6. Какие вещества называют гомологами?
Приведите примеры.
7. Дать названия алканам
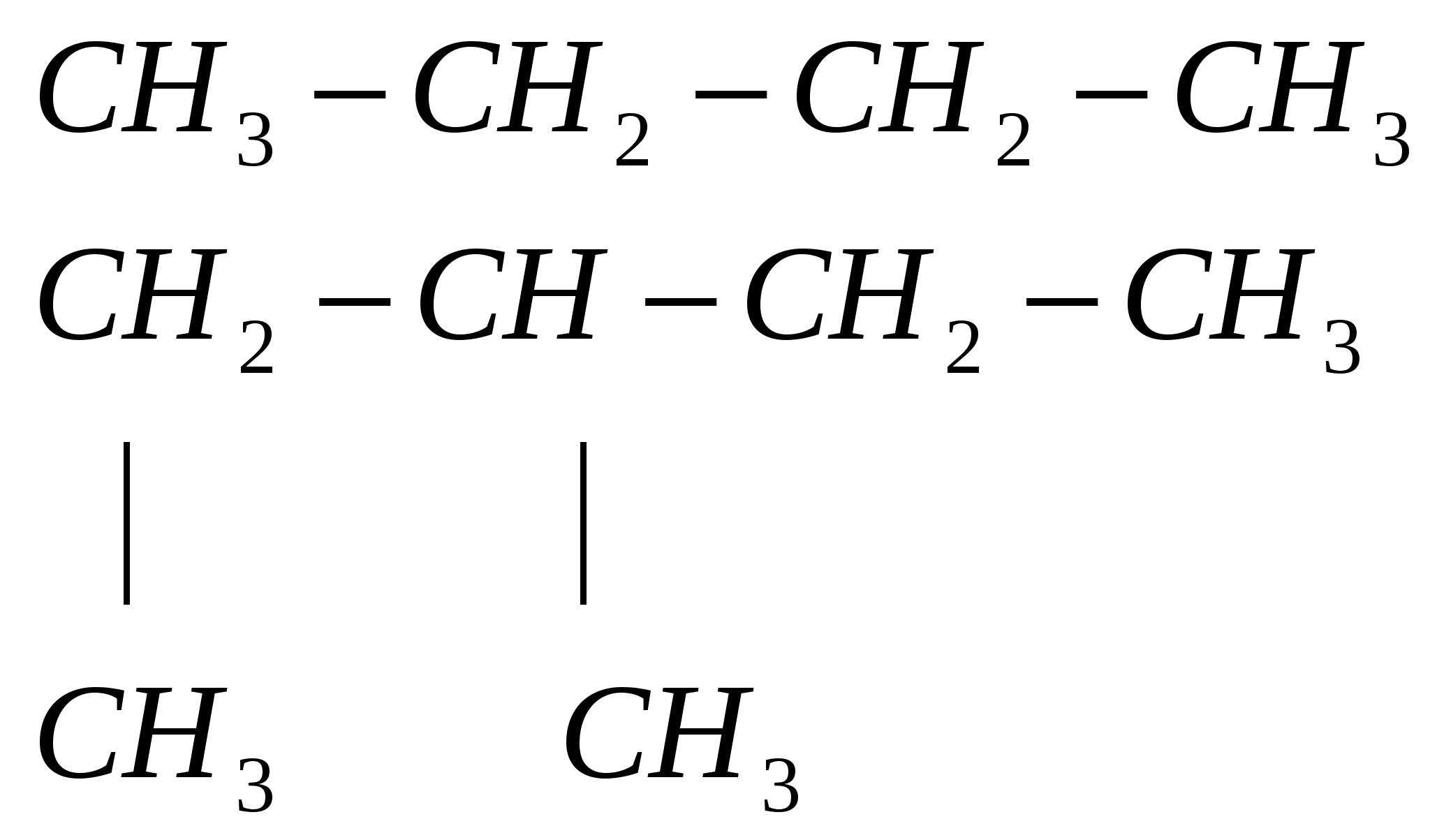
Лабораторная работа № 7
Тема: «Ознакомление с коллекциями нефти, каучуков и изделиями из резины»
Цель: ознакомиться с коллекциями нефти, каучуков и изделиями из резины.
Оборудование и реактивы: набор коллекций нефти, каучуков, резины.
Теоретические основы
Нефть - природная сложная смесь углеводородов, в основном алканов линейного и разветвленного строение, содержащих в молекулах от 5-50 атомов углерода, с другими органическими веществами. Состав ее зависит от места добычи, она может содержать циклоалканы и ароматические углеводороды. Так как нефть представляет собой смесь различных веществ, то каждый компонент в смеси сохраняет свои индивидуальные физические свойства, что и позволяет разделить нефть на ее составляющие с помощью фракционной перегонке, или ректификации. В процессе ректификации нефть разделяют на фракции:
-
ректификационные газы - смесь низкомолекулярных углеводородов, пропана и бутана, с tKиn. = 40°С;
-
газолиновая фракция(бензин) - состав от С5Н12 до С11Н22 (tKиn = 40°С), при более тонком разделении этой фракции получают газолин ( петролейный эфир, 40 - 70°С) и бензин (70 - 120°С);
-
лигроиновая фракция - состав от С8Н]8 до С14Н30 tKиn= 150-250°С;
-
керосиновая фракция - состав от С12Н26 до C18H38 tKиn =180-300°С;
-
дизельное топливо - состав от C13H28 до С19Нз6 tкип.200-350оС.
Остаток перегонки нефти - мазут - состав Ci8 до С5о Перегонкой при пониженном Р из мазута получают соляровое масло, смазочные масло, вазелин и парафин, а твердый остаток -гудрон и продукты его переработки - битум и асфальт.
Ход работы
1 .Рассмотрите выданную вам коллекцию нефти. Объясните, почему все нефтепродукты (кроме мазута) называют светлыми.
Запишите формулы углеводородов, образующих фракции светлых нефтепродуктов. Какие физические процессы лежат в основе их получения?
-
Познакомьтесь со смазочными маслами, получаемыми перегонкой мазута. Какие процессы лежат в основе их получения?
-
Познакомьтесь с образцами каучуков. Запишите их химические формулы.
-
Познакомьтесь с образцами резины. Что такое процесс вулканизации?
-
Ответьте на контрольные вопросы.
-
Вывод.
Контрольные вопросы
1. Назовите важнейшие месторождения нефти в Российской Федерации, используя карты из географического атласа.
-
Как мировые цены на нефть влияют на бюджет нашей страны? Предложите свои варианты уменьшения зависимости экономики России от колебаний мировых цен на нефть.
-
Какие утечки нефти при ее добыче и транспортировке влияют на состояние окружающей среды? Приведите примеры последних сообщений из средств массовой информации о катастрофах, связанных с разливами нефти.
-
Каков состав нефти? Какие физические свойства компонентов нефти лежат в основе ее перегонки?
-
Что такое бензин; октановое число? Как его повышают?
-
Назовите по международной номенклатуре изооктан
СН3
I
СН3 - СН2 - СН - СН3
I I
СНз СН3
-
Как связана ваша будущая профессия (например, экономист, юрист, геолог, инженер) с добычей и переработкой углеводородного сырья?
8. Как связана повседневная жизнь человека с добычей и переработкой углеводородного сырья и мировыми ценами на нефть?
Лабораторная работа № 8
Тема: «Качественные реакции на одноатомные и многоатомные спирты, крахмал. Химические свойства карбоновых кислот и глюкозы.
Цель: изучить химические свойства карбоновых кислот, глюкозы, качественные реакции спиртов и крахмала.
Реактивы и оборудование: спиртовки, медная проволока, глюкоза, крахмал сульфата меди( II), гидроксид натрия, гидроксид меди(П),уксусная кислота, цинк, карбонат натрия, индикаторная бумага, оксид серебра, порошок оксида магния, крахмал, глицерин
Теоретические основы
Производные углеводородов, в которых один или несколько атомов водорода замешены на гидроксильную группу - ОН, называют спиртами. Cn Н2n+1- ОН-общая формула предельных одноатомных спиртов. Качественная реакция на одноатомные спирты
О
//
С2Н5ОН + СиО-> СН3 - С + Си + Н20
н
запах ацетальдегида
Многоатомные спирты - органические соединения, в молекулах которых
содержатся две или более гидроксильных групп.
сн2 - ОН сн2 - он
сн2 - он сн - он
сн2 - он
этандиол -1,2 пропантриол - 1,2,3
(этиленгликоль) (глицерин)
Качественная реакция на многоатомные спирты
СН2 - ОН СН2 -О
I +Cu(OH)2 - I Cu+H2O
CH-OH CH-O
I I
СН2 - ОН СН2 - ОН
ярко-синий р-р глицерата меди
Альдегидами называют органические соединения, содержащие альдегидную
группу - CHO, связанную с углеводородным радикалом
О
//
R - С ( СпН2О) - общая формула альдегидов
\
Нсн, - он сн, - он
Реакция «серебряного зеркала»
О О
// //
СНз-С + Ag20 СН3 -С + 2 Ag|
\ аммиачный \
Н р-р ОН
ацетальдегид уксусная кислота
Карбоновые кислоты - это органические вещества, молекулы которых содержат карбоксильную группу - СООН, связанную с углеводородным радикалом.
R - СООН - общая формула предельных одноосновных кислот Химические свойства карбоновых кислот
1 Диссоциация
R - СООН R - СОО+Н +
2 Взаимодействие с активными металлами
2СН3 - COOH+Zn(CH3COO)2Zn +Н2|
ацетат цинка
3 Взаимодействие с основными оксидами
СНз-СООН + MgO-+ ( CH3COO)2Mg +Н20
ацетат магния
4 Взаимодействие с солями летучих кислот
2СН3- СООН + Na2C03-+2CH3COONa + Н20 + С02
ацетат натрия
Углеводами ( сахаридами) называют органические соединения, имеющие сходное строение и свойства, состав которых выражен формулой
Cn(H20)m(n.m>3).
С6Н12О6 - молекулярная формула глюкозы, альдегидоспирт
Химические свойства глюкозы
1 .Реакция «серебряного зеркала» на альдегидную группу глюкозы Н0СН2(СН0Н)4СН0 + Аg2О H0CH2(CH0H)4C00H+2Ag
аммиачный глюконовая
Р-р к-та
2. Реакция «медного зеркала»
Н0СН2CН0Н)4СН0 + 2Cu(0H)2 H0CH2(CH0H)4 С00Н+Си20«+2Н20
красно -кирпичное окрашивание
3. Реакция с участием гидроксильных групп.
С6Н12О6+ Сu(ОН)2комплексная соль + 2Н20
ярко-синей цвет
(С6Н1205)n - полисахариды, крахмал- природный полимер Качественная реакция на крахмал
(С6Н10О5 + J2 -> синее окрашивание.
Ход работы
Опыт 1 Проведение качественной реакции на одноатомные спирты
Поверхность медной проволоки очистите с помощью наждачной бумаги. Сверните на конце 3-4 ветка спирали. Прокалите спираль в пламени, при этом на поверхности меди образуется черный налет оксида меди (II). Быстро внесите спираль в пробирку с Змл этилового спирта. (Что происходит с медной спиралью?) Повторите операцию несколько раз. Содержимое пробирки приобретает новый запах. (Какому веществу принадлежит этот запах?) Напишите уравнение происходящей реакции.
Опыт 2 Проведение качественной реакции на многоатомные спирты
Налейте в пробирку 1мл 10%-го раствора сульфата меди (II) и добавьте немного 10%-го раствора гидроксида натрия до образования голубого осадка гидроксида меди (II). К полученному осадку добавьте по каплям раствор глицерина. Встряхните содержимое пробирки. Отметьте растворение осадка с образованием раствора ярко-синего цвета.
Опыт 3 Проведение реакции « серебряного зеркала» альдегидов
В тщательно вымытую пробирку, содержащую 1мл раствора формальдегида в воде, прибавьте несколько капель аммиачного раствора оксида серебра(1). Осторожно круговыми движениями вокруг пламени спиртовки нагревайте содержимое пробирки. Отметьте изменение цвета раствора и появление на стенках пробирки зеркального налета. Напишите уравнение происходящей реакции.
Опыт 4 Изучение кислотных свойств карбоновых кислот
Стеклянной палочкой, смоченной раствором уксусной кислоты, коснитесь полоски индикаторной бумаги. (Как изменяется цвет индикатора? О чем это свидетельствует?)
В первую пробирку поместите одну гранулу цинка и добавьте 2мл раствора уксусной кислоты. (Что наблюдаете?) Подогрейте содержимое пробирки на пламени спиртовки. (Что изменилось? Почему?) Напишите уравнение реакции.
Во вторую пробирку поместите немного порошка оксида магния и добавьте 1-2 мл раствора уксусной кислоты. (Что наблюдаете?) Напишите уравнение происходящей реакции.
В третью пробирку налейте 1мл раствора карбоната натрия и добавьте несколько капель раствора уксусной кислоты. (Что наблюдаете?) Напишите уравнение реакции.
Опыт 5 Изучение химических свойств глюкозы
В пробирку с 2-3 каплями раствора сульфата меди (II) добавьте 2-3 мл раствора гидроксида натрия. К полученному осадку гидроксида меди(II) прилейте равный обьем раствора глюкозы и встряхните содержимое пробирки. ( О чем свидетельствует растворение осадка с образованием раствора ярко-синего цвета?) Напишите уравнение реакции.
В чистую пробирку налейте 3-4 мл аммиачного раствора оксида серебра (I), добавьте 2мл раствора глюкозы. Вращательными движениями вокруг пламени спиртовки осторожно нагрейте стенки пробирки, не допуская кипения жидкости. На стенках пробирки появится металлический налет серебра. ( Какой вывод можно сделать на основании проведенного опыта?) Напишите уравнение происходящей реакции.
Опыт 6 Проведение качественной реакции на крахмал
Нанесите каплю разбавленной в 5 раз иодной настойки на свежий срез картофеля. Отметьте изменение цвета реагента. Вместо картофеля можно воспользоваться приготовленным заранее крахмальным клейстером или слабоокрашенным киселем. Напишите уравнение происходящей реакции.
Контрольные вопросы
-
Назовите согласно правилам международной номенклатуры следующие спирты:
а) CH3 CH CH3 б) CH3 CH CH2 OH
OH CH3
в) CH3 (CH2)4 OH г) CH3 CH CHCH3
OH CH3
2. Напишите структурные формулы следующих соединений:
а) 2- метилпропанола - 2
б) 2,3 - диметилпентанола - 3
в) 3- метилбутанола - 2
3. Можно ли назвать этиленгликоль и глицерин гомологами? Почему?
4. В трех пробирках без подписи находятся водные растворы пропанола - 1, глицерина и фенола. С помощью каких регентов можно определить каждый из растворов?
5. Напишите уравнение и укажите условие реакций, с помощью которых можно осуществить цепочку превращений:
CH3CHOCH3CH2OHCH2=CH2HCCHCH3CHO
6. Напишите структурные формулы следующих соединений:
а) 2,3 - диметилбутановая кислота
б) 2 - бромпропановая кислота
в) стеариновая кислота
7. Как при помощи одного реактива распознать следующие вещества:
уксусную кислоту, пропаналь, глюкозу, глицерин, метанол.
8. Найдите черты сходства и различие в строении, физических и химических свойствах крахмала и целлюлозы.
Лабораторная работа № 9
Тема: «Изучение свойств белков».
Цель: ознакомится на практике со свойствами белков.
Реактивы: раствор яичного белка; нитки - хлопчатобумажные, искусственные, шерстяные; капроновое волокно; растворы: щелочь, сульфат меди, концентрированная азотная кислота; кусочки полиэтилена, полистирола, и раствор перманганата калия, концентрированная серная кислота, 10% гидроксид натрия, красная лакмусовая бумажка, синяя лакмусовая бумажка.
Оборудование: все для нагревания, тигельные щипцы, асбестовые сетки, стеклянные палочки, фарфоровые чашки.
Краткая теория
Белки - это высокомолекулярные природные полимеры, молекулы которые построены из остатков аминокислот, соединенных амидной ( пептидной) связью.
Исключительное свойство белков - это способность самопроизвольно создавать определенную, свойственную только данному белку пространственною структуру. Белки имеют 4-е структуры.
Последовательность соединения аминокислотных остатков в полипептидной цепы получила название первичной структурой белка.
Вторичная структура белка - это закручивание полипептидной цепи в спираль и поддержание такой структуры за счет внутримолекулярных водородных связей.
Третичная структура белка - это упаковка вторичной спирали в клубок, поддержание структуры за счет дисульфидных и ионных связей.
Четвертичная структура белка -это когда отдельные субъединицы белка с помощью водородных связей и других взаимодействий образуют сложные ансамбли.
Существует несколько классификаций белков. В их основе лежат разные признаки:
-
степень сложности (простые и сложные)
-
форма молекул ( глобулярные и фибриллярные белки)
-
растворимость в отдельных растворителях ( водорастворимые, растворимые в разбавленных солевых растворах - альбумины, спирторастворимые - проламины, растворимые в разбавленных щелочах и кислотах - глутелины)
-
выполняемая функция (например, запасные белки, скелетные и т. п.). По существу, все деятельность организма ( развитие, движение, выполнение им различных функций и многое другое) связана с белками. Без белков невозможно представить себе жизнь.
Химические свойства. 1 Денатурация белков. При действии солей тяжелых металлов ( Fe, Pb, Hg и др.), концентрированных кислот и оснований, этанола, а также при нагревании происходит необратимое свертывание (осаждение) белков, т.е.их денатурация. При денатурации белок теряет биологическую активность вследствие разрушения его вторичной, третичной и четвертичной структуры; первичная структура при этом сохраняется. Иногда денатурация бывает обратимой.
2 Цветные реакции белков: 1)Биуретовая реакция если к небольшому количеству раствора белка прилить немного гидроксида натрия и по каплям добавлять раствор сульфата меди (II), то появятся красно-фиолетовая окраска. Такая же реакция происходит и с другими соединениями, которые содержат пептидные группы:
-
ксантопротеиновая реакция при действии концентрированной азотной кислоты белки окрашиваются в желтый цвет. Это реакция доказывает, что в состав белков входят остатки ароматических аминокислот;
-
если к раствору белков прилить ацетат свинца(П),а затем гидроксид натрия и нагреть, то выпадает черный осадок, что указывает на содержание серы.
3 Гидролиз белков. При нагревании белков со щелочами или кислотами происходит гидролиз.
Ход работы
Задания.
1. Выполнить опыты.
2. Заполнить таблицу, записать наблюдения.
3. Выполнить задание для самостоятельных выводов.
Опыт № 1 Свойства белков.
1.1. Нагреть в пробирке небольшое количество раствора яичного белка. 1.2.Биуретовая реакция. Влейте в пробирку 2-3 мл белка и добавьте
несколько мл раствора гидроксида натрия, а затем немного раствора
сульфата меди (II).
1.3. Ксантопротеиновая реакция. В пробирку налейте 2-3 мл раствора белка и добавьте 0,5 - 1 мл концентрированной азотной кислоты. (Осторожно!)
Задания для самостоятельных выводов:
1. Как можно доказать наличие белков в пищевых продуктах?
2. Какова сущность цветных реакций белков?
Контрольные вопросы
1. Охарактеризуйте строение белков. Какую роль играют различные виды химических связей в формировании различных структур белковых молекул?
2. Как соотносятся между собой понятия «пептид», «полипептид», «полиамид» и «белок»?
3. Охарактеризуйте важнейшие физические и химические свойства белков.
4. С помощью каких реакций можно распознать белки?
5. Какую роль каких реакций можно распознать белки?
Литература
1. Ахметов Н.С. Общая и неорганическая химия. - М.: Высш. шк.,1998.
2. Габриелян О.С., Остроумов И. Г., Карцова А.А. Химия: Органическая химия: Учебник для 10 класса общеобразовательных учреждений с углубленным изучением химии . - М.: Просвещение,2004.
3. Габриелян О.С., Остроумов И.Г. Органическая химия в текстах, задачах и упражнениях. - М.: Дрофа, 2003.
4. Габриелян О.С., Остроумов И.Г, Введенская А.Г. Общая химия в текстах, задачах и упражнениях. - М.: Дрофа, 2003.
5. Ерохин Ю.М. Химия. - М.: Издательский центр «Академия», 2003.
5. Лабораторные работы по органической химии / Под ред. О.Ф. Гинзбурга. - М.: Высш. шк., 1974.


