- Преподавателю
- Химия
- Рабочая папка учащегося по химии
Рабочая папка учащегося по химии
| Раздел | Химия |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Устинова Е.Н. |
| Дата | 26.09.2015 |
| Формат | doc |
| Изображения | Есть |
Основы химического языка и первоначальные сведения о классификации индивидуальных химических веществ
1. Химический язык и его части
Химический язык - система условных обозначений и понятий, предназначенная для краткой, ёмкой и наглядной записи и передачи химической информации.
Сообщение, написанное на большинстве естественных языков, делится на предложения, предложения - на слова, а слова - на буквы. Если предложения, слова и буквы мы назовем частями языка, то тогда мы сможем выделить аналогичные части и в химическом языке (таблица 2).
Таблица 2.Части химического языка
Информация об атомах и химических элементах
(" буквы" химического языка)
Информация о химических веществах
(" слова" химического языка)
Информация о химических реакциях (" предложения" химического языка)
СИМВОЛЫ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
ХИМИЧЕСКИЕ ФОРМУЛЫ
СХЕМЫ И УРАВНЕНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
Любым языком овладеть сразу невозможно, это относится и к химическому языку. Поэтому пока вы познакомитесь только с основами этого языка: выучите некоторые " буквы" , научитесь понимать смысл " слов" и" предложений" . В конце этой главы вы познакомитесь с названиями химических веществ - неотъемлемой частью химического языка. По мере изучения химии ваше знание химического языка будет расширяться и углубляться.
2. Символы химических элементов
Символ химического элемента - условное обозначение химического элемента.
Символ химического элемента обозначает сам элемент или один атом этого элемента.
Каждый такой символ представляет собой сокращенное латинское название химического элемента, состоящее из одной или двух букв латинского алфавита (латинский алфавит см. в приложении 1). Символ пишется с прописной буквы. Символы, а также русские и латинские названия некоторых элементов, приведены в таблице 3. Там же даны сведения о происхождении латинских названий. Общего правила произношения символов не существует, поэтому в таблице 3 приводится и " чтение" символа, то есть, как этот символ читается в химической формуле.
Заменять символом название элемента в устной речи нельзя, а в рукописных или печатных текстах это допускается , но не рекомендуется.В настоящее время известно 110 химических элементов, у 109 из них есть названия и символы, утвержденные Международным союзом теоретической и прикладной химии (ИЮПАК).
В таблице 3 приведена информация только о 33 элементах. Это те элементы, которые при изучении химии вам встретятся в первую очередь. Русские названия (в алфавитном порядке) и символы всех элементов приведены в приложении 2.
Таблица 3. Названия и символы некоторых химических элементов
Название
Символ
Русское
Латинское
Написание
Чтение
-
Написание
Происхождение
-
-
Азот
Nitrogenium
От греч. " рождающий селитру"
N
" эн"
Алюминий
Aluminium
От лат. " квасцы"
Al
" алюминий"
Аргон
Argon
От греч. " недеятельный"
Ar
" аргон"
Барий
Barium
От греч. " тяжелый"
Ba
" барий"
Бор
Borum
От арабск. " белый минерал"
B
" бор"
Бром
Bromum
От греч. " зловонный"
Br
" бром"
Водород
Hydrogenium
От греч. " рождающий воду"
H
" аш"
Гелий
Helium
От греч. " Солнце"
He.
" гелий"
Железо
Ferrum
От лат. " меч"
Fe
" феррум"
Золото
Aurum
От лат. " горящий"
Au
" аурум"
Йод
Iodum
От греч. " фиолетовый"
I
" йод"
Калий
Kalium
От арабск. " щёлочь"
К
" калий"
Кальций
Calcium
От лат. " известняк"
Ca
" кальций"
Кислород
Oxygenium
От греч. " рождающий кислоты"
O
" о"
Кремний
Silicium
От лат. " кремень"
Si
" силициум"
Криптон
Krypton
От греч. " скрытый"
Kr
" криптон"
Магний
Magnesium
От назв. полуострова Магнезия
Mg
" магний"
Марганец
Manganum
От греч. " очищающий"
Mn
" марганец"
Медь
Cuprum
От греч. назв. о. Кипр
Сu
" купрум"
Натрий
Natrium
От арабск, " моющее средство"
Na
" натрий"
Неон
Neon
От греч. " новый"
Ne
" неон"
Никель
Niccolum
От нем. " медь святого Николая"
Ni
" никель"
Ртуть
Hydrargyrum
Лат. " жидкое серебро"
Hg
" гидраргирум"
Свинец
Plumbum
От лат. названия сплава свинца с оловом.
Pb
" плюмбум"
Сера
Sulfur
От санскриттского " горючий порошок"
S
" эс"
Серебро
Argentum
От греч. " светлый"
Ag
" аргентум"
Углерод
Carboneum
От лат. " уголь"
С
" цэ"
Фосфор
Phosphorus
От греч. " несущий свет"
P
" пэ"
Фтор
Fluorum
От лат. глагола " течь"
F
" фтор"
Хлор
Clorum
От греч. " зеленоватый"
Cl
" хлор"
Хром
Chromium
От греч. " краска"
Cr
" хром"
Цезий
Caesium
От лат. " небесно-голубой"
Cs
" цезий"
Цинк
Zincum
От нем. " олово"
Zn
" цинк"
3. Химические формулы
Для обозначения химических веществ используют химические формулы.
Химическая формула - сложный знак химического языка, который используется для передачи информации о веществе.
Для молекулярных веществ химическая формула может обозначать и одну молекулу этого вещества.
Информация о веществе может быть разной, поэтому существуют разные типы химических формул.
В зависимости от полноты информации химические формулы делятся на четыре основных типа: простейшие, молекулярные, структурные и пространственные.
Простейшая формула - химическая формула, составленная из символов химических элементов и таких подстрочных индексов, отношение которых равно отношению чисел атомов соответствующих элементов в этом веществе.
Подстрочные индексы в простейшей формуле не имеют общего делителя.
Индекс " 1" в формулах не ставится.
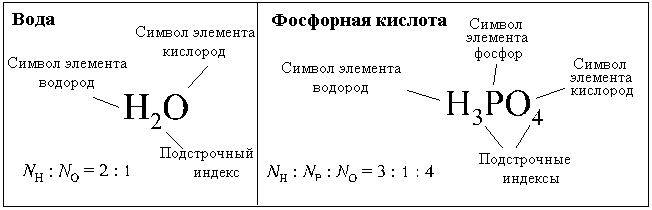
Примеры простейших формул: вода - Н2О, кислород - О, сера - S, оксид фосфора - P2O5, бутан - C2H5, фосфорная кислота - H3PO4, хлорид натрия (поваренная соль) - NaCl.
Простейшая формула воды (Н2О) показывает, что в состав воды входит элемент водород (Н) и элемент кислород (О), причем в любой порции (порция - часть чего-либо, что может быть разделено без утраты своих свойств.) воды число атомов водорода в два раза больше числа атомов кислорода.
Число частиц, в том числе и число атомов, обозначается латинской буквой N. Обозначив число атомов водорода - NH, а число атомов кислорода - NO, мы можем записать, что
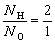 , или NH : NO = 2 : 1.
, или NH : NO = 2 : 1.
Простейшая формула фосфорной кислоты (Н3РО4) показывает, что в состав фосфорной кислоты входят атомы водорода, атомы фосфора и атомы кислорода, причем отношение чисел атомов этих элементов в любой порции фосфорной кислоты равно 3:1:4, то есть
NH : NP : NO = 3 : 1 : 4.
Простейшая формула может быть составлена для любого индивидуального химического вещества, а для молекулярного вещества, кроме того, может быть составлена молекулярная формула.
Молекулярная формула - химическая формула, составленная из символов химических элементов и таких подстрочных индексов, каждый из которых равен числу атомов соответствующего элемента в молекуле вещества.
Примеры молекулярных формул: вода - H2O, кислород - O2, сера - S8, оксид фосфора - P4O10, бутан - C4H10, фосфорная кислота - H3PO4.
Вода H2O
В молекуле воды:
2 атома водорода;
1 атом кислорода.
Фосфорная кислота H3PO4
В молекуле фосфорной кислоты:
3 атома водорода;
1 атом фосфора;
4 атома кислорода.
Бутан C4H10
В молекуле бутана:
4 атома углерода;
10 атомов водорода.
У немолекулярных веществ молекулярных формул нет.
Последовательность записи символов элементов в простейших и молекулярных формулах определяется правилами химического языка, с которыми вы познакомитесь по мере изучения химии. На информацию, передаваемую этими формулами, последовательность символов влияния не оказывает.
Структурная формула - химическая формула, составленная из символов химических элементов и специальных знаков, отражающих строение данного химического вещества, исключая взаимное расположение атомов в пространстве.
Из знаков, отражающих строение веществ, мы будем использовать пока только валентный штрих (" черточку" ). Этот знак показывает наличие между атомами так называемой ковалентной связи (что это за тип связи и каковы его особенности, вы скоро узнаете).
В молекуле воды атом кислорода связан простыми (одинарными) связями с двумя атомами водорода, а атомы водорода между собой не связаны. Именно это наглядно показывает структурная формула воды.
молекуле воды атом кислорода связан простыми (одинарными) связями с двумя атомами водорода, а атомы водорода между собой не связаны. Именно это наглядно показывает структурная формула воды. 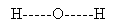
Другой пример: молекула серы S8. В этой молекуле 8 атомов серы образуют восьмичленный цикл, в котором каждый атом серы связан с двумя другими атомами простыми связями. Сравните структурную формулу серы с объемной моделью ее молекулы, показанной на рис. 3. Обратите внимание на то, что структурная
ф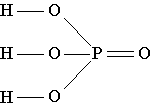 ормула серы не передает форму ее молекулы, а показывает только последовательность соединения атомов ковалентными связями.
ормула серы не передает форму ее молекулы, а показывает только последовательность соединения атомов ковалентными связями.
Структурная формула фосфорной кислоты показывает, что в молекуле этого вещества один из четырех атомов кислорода связан только с атомом фосфора двойной связью, а атом фосфора, в свою очередь, связан еще с тремя атомами кислорода простыми связями. Каждый из этих трех атомов кислорода, кроме того, связан простой связью с одним из трех имеющихся в молекуле атомов водорода.
Пространственная формула - химическая формула, составленная из символов элементов и специальных знаков, отражающих строение данного вещества, включая взаимное пространственное расположение атомов в молекулах этого вещества (или других сложных частицах).
Сравните приведенную ниже объемную модель молекулы метана с его пространственной, структурной и молекулярной формулой:
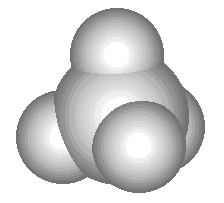
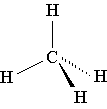
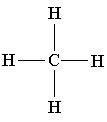
CH4
В пространственной формуле метана клиновидные валентные штрихи как бы в перспективе показывают, какой из атомов водорода находится " ближе к нам" , а какой " дальше от нас" .
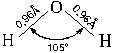
Иногда в пространственной формуле указывают длины связей и значения углов между связями в молекуле, как это показано на примере молекулы воды.
Немолекулярные вещества не содержат молекул. Для удобства проведения химических расчетов в немолекулярном веществе выделяют так называемую формульную единицу.
Формульная единица - группа атомов, входящих в состав немолекулярного вещества, соответствующая простейшей формуле этого вещества.
Примеры состава формульных единиц некоторых веществ: 1) диоксид кремния (кварцевый песок, кварц) SiO2 - формульная единица состоит из одного атома кремния и двух атомов кислорода; 2) хлорид натрия (поваренная соль) NaCl - формульная единица состоит из одного атома натрия и одного атома хлора; 3) железо Fe - формульная единица состоит из одного атома железа.Как и молекула, формульная единица - наименьшая порция вещества, сохраняющая его химические свойства.
Таблица 4
Информация, передаваемая формулами разных типов
Тип формулы
Информация, передаваемая формулой.
Простейшая
Молекулярная
Структурная
Пространственная
-
Атомы каких элементов входят в состав вещества.
-
Соотношения между числами атомов этих элементов.
-
Число атомов каждого из элементов в молекуле.
-
Типы химических связей.
-
Последовательность соединения атомов ковалентными связями.
-
Кратность ковалентных связей.
-
Взаимное расположение атомов в пространстве.
-
Длины связей и углы между связями (если указаны).
Рассмотрим теперь на примерах, какую информацию дают нам формулы разных типов.
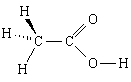
1. Вещество: уксусная кислота. Простейшая формула - СН2О, молекулярная формула - C2H4O2, структурная формула
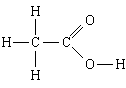
Простейшая формула говорит нам, что
1) в состав уксусной кислоты входит углерод, водород и кислород;
2) в этом веществе число атомов углерода относится к числу атомов водорода и к числу атомов кислорода, как 1:2:1, то есть NH : NC :NO = 1:2:1.
Молекулярная формула добавляет, что
3) в молекуле уксусной кислоты - 2 атома углерода, 4 атома водорода и 2 атома кислорода.
Структурная формула добавляет, что
4, 5) в молекуле два атома углерода связаны между собой простой связью; один из них, кроме этого, связан с тремя атомами водорода, с каждым простой связью, а другой - с двумя атомами кислорода, с одним - двойной связью, а с другим - простой; последний атом кислорода связан еще простой связью с четвертым атомом водорода.
2. Вещество: хлорид натрия. Простейшая формула - NaCl.
1) В состав хлорида натрия входит натрий и хлор.
2) В этом веществе число атомов натрия равно числу атомов хлора.
3. Вещество: железо. Простейшая формула - Fe.
1) В состав этого вещества входит только железо, то есть это простое вещество.
4. Вещество: триметафосфорная кислота. Простейшая формула - HPO3, молекулярная формула - H3P3O9, структурная формула
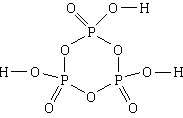
1) В состав триметафосфорной кислоты входит водород, фосфор и кислород.
2) NH : NP :NO = 1:1:3.
3) Молекула состоит из трех атомов водорода, трех атомов фосфора и девяти атомов кислорода.
4, 5) Три атома фосфора и три атома кислорода, чередуясь, образуют шестичленный цикл. Все связи в цикле простые. Каждый атом фосфора, кроме того, связан еще с двумя атомами кислорода, причем с одним - двойной связью, а с другим - простой. Каждый из трех атомов кислорода, связанных простыми связямис атомами фосфора, связан еще простой связью с атомом водорода.
Фосфорная кислота - H3PO4 (другое название - ортофосфорная кислота) - прозрачное бесцветное кристаллическое вещество молекулярного строения, плавящееся при 42 oС. Это вещество очень хорошо растворяется в воде и даже поглощает пары воды из воздуха (гигроскопично). Фосфорную кислоту производят в больших количествах и используют прежде всего в производстве фосфорных удобрений, а также в химической промышленности, при производстве спичек и даже в строительстве. Кроме того, фосфорная кислота применяется при изготовлении цемента в зубоврачебной технике, входит в состав многих лекарственных средств. Эта кислота достаточно дешева, поэтому в некоторых странах, например в США, очень чистая сильно разбавленная водой фосфорная кислота добавляется в освежающие напитки для замены дорогой лимонной кислоты.
Метан - CH4. Если у вас дома есть газовая плита, то с этим веществом вы сталкиваетесь ежедневно: природный газ, который горит в конфорках вашей плиты, на 95 % состоит из метана. Метан - газ без цвета и запаха с температурой кипения -161 oС. В смеси с воздухом он взрывоопасен, этим и объясняются происходящие иногда в угольных шахтах взрывы и пожары (другое название метана - рудничный газ). Третье название метана - болотный газ - связано с тем, что пузырьки именно этого газа поднимаются со дна болот, где он образуется в результате деятельности некоторых бактерий. В промышленности метан используется как топливо и сырье для производства других веществ.Метан является простейшим углеводородом. К этому классу веществ относятся также этан (C2H6), пропан (C3H8), этилен (C2H4), ацетилен (C2H2) и многие другие вещества.
Таблица 5. Примеры формул разных типов для некоторых веществ
Название
Химические формулы
вещества
Простейшая
Молекулярная
Структурная
Пространственная
Водород
H
H2
H-----H
H-----H
Белый фосфор
P
P4
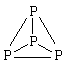
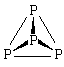
Алмаз
C
-
?
-
Железо
Fe
-
-
-
Хлороводород
HCl
HCl
H-----Cl
H-----Cl
Хлорид натрия
NaCl
-
?
-
Гидроксид натрия
NaOH
-
?
-
Формальдегид
CH2O
CH2O
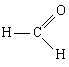

Уксусная кислота
CH2O
C2H4O2

Метилформиат
CH2O
C2H4O2
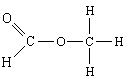
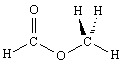
4. Схемы и уравнения химических реакций
При химических реакциях одни вещества превращаются в другие. Вспомним известную нам реакцию серы с кислородом. И в ней из одних веществ (исходных веществ или реагентов) образуются другие (конечные вещества или продукты реакции).
Для записи и передачи информации о химических реакциях используются схемы и уравнения реакций.
Схема химической реакции - условная запись,дающая качественнуюинформацию о химической реакции.
Схема реакции показывает, какие вещества вступают в реакцию и какие образуются в результате реакции. И в схемах, и в уравнениях реакций вещества обозначаются их формулами.
Схема горения серы записывается так: S8 + O2![]() SO2.
SO2.
Это означает, что при взаимодействии серы с кислородом протекает химическая реакция, в результате которой образуется диоксид серы (сернистый газ). Все вещества здесь молекулярные, поэтому при записи схемы использованы молекулярные формулы этих веществ.
Уравнение химической реакции - условная запись, дающая качественную и количественную информацию о химической реакции.
Для любой химической реакции справедлив один из важнейших законов химии:
При протекании химических реакций атомы не появляются, не исчезают и не превращаются друг в друга.
При записи уравнений химических реакций, кроме формул веществ, используются коэффициенты. Как и в алгебре, коэффициент "1" в уравнении химической реакции не ставится, но подразумевается. Рассмотренные нами реакции описываются следующими уравнениями:
1S8 + 8O2 = 8SO2, или S8 + 8O2 = 8SO2;
1P4 + 5O2 = 1P4O10, или P4 + 5O2 = P4O10;
1CaCO3 = 1CaO + 1CO2, или CaCO3 = CaO + CO2;
1PCl5 + 4H2O = 1H3PO4 + 5HCl, или PCI5 + 4H2O = H3PO4 + 5HCI.
Знак равенства между правой и левой частью уравнения означает, что число атомов каждого элемента, входящих в состав исходных веществ, равно числу атомов этого элемента, входящих в продукты реакции.
Коэффициенты в уравнении химической реакции показывают отношение между числом реагирующих и числом образующихся молекул (для немолекулярных веществ - числом формульных единиц) соответствующих веществ. Так, для реакции, протекающей при взаимодействии пентахлорида фосфора с водой
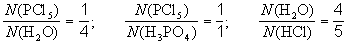
и так далее (всего 6 пропорций).Обычно отдельный коэффициент в уравнении реакции не имеет никакого смысла, но в некоторых случаях может означать число молекул или формульных единиц данного вещества. Примеры информации, даваемой схемами и уравнениями реакций.
1-й пример. Реакция горения метана в кислороде (или на воздухе):
СН4 + O2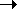 CO2 + H2O (схема),
CO2 + H2O (схема),
СН4+ 2O2 = CO2 + 2Н2О (уравнение).
Схема химической реакции показывает, что (1) в реакции, протекающей между метаном и кислородом, образуются углекислый газ и вода.
Уравнение реакции добавляет, что (2) число молекул метана, вступившего в реакцию, относится к числу молекул вступившего в реакцию кислорода, как 1 к 2, и так далее, то есть:
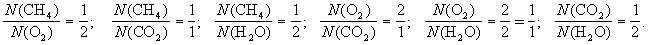
Кроме того, уравнение показывает, что одна молекула метана реагирует с двумя молекулами кислорода, при этом образуется одна молекула углекислого газа и две молекулы воды.
2.Какую информацию передают составленными вами уравнениями реакций (среди приведенных веществ молекулярными являются Cl2, N2О, N2, O2, H2SO4 и H2O; остальные - немолекулярные).
5. Первоначальные сведения о классификации чистых химических веществ
Вещества отличаются друг от друга своими свойствами, а свойства веществ определяются составом и строением. Поэтому важнейшие признаки, по которым классифицируют вещества - состав, строение и свойства.
По составу, а точнее, по числу входящих в их состав элементов, вещества делятся на простые и сложные (это вы уже знаете). Сложных веществ в сотни тысяч раз больше, чем простых, поэтому среди них выделяют бинарные вещества (бинарные соединения).
Бинарные вещества (бинарные соединения) - сложные вещества, в состав которых входят атомы двух элементов.
Признаком, по которому проводят дальнейшую классификацию веществ, являются их свойства.
Начнем с простых веществ.
По физическим свойствам простые вещества делятся на металлы и неметаллы.
Характерные физические свойства металлов:
1) высокая электропроводность (способность хорошо проводить электрический ток),
2) высокая теплопроводность (способность хорошо проводить теплоту),
3) высокая пластичность (ковкость, изгибаемость, вытягиваемость).
Кроме того все металлы обладают " металлическим" блеском. Но следует помнить, что таким блеском обладают не только металлы, но и часть неметаллов, и даже некоторые сложные вещества. Блестит кристаллический кремний, одна из полиморфных модификаций мышьяка, теллур, а это всё - неметаллы. Из сложных веществ - пирит FeS2, халькопирит CuFeS2 и некоторые другие.
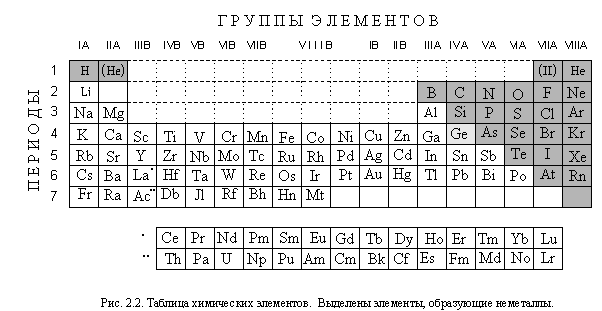
Основой систематизации химических элементов, простых веществ и соединений служит ЕСТЕСТВЕННАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ, открытая в 1869 году выдающимся русским химиком Дмитрием Ивановичем Менделеевым (1834 -1907) и названная им " периодической системой" . Усовершенствованная многими поколениями ученых, эта система продолжает называться " периодической" , хотя это и не совсем правильно. Графически система химических элементов выражается в виде таблицы элементов (рис. 2.2); со строением этой таблицы вы подробно познакомитесь, изучая главу 6. Пока же посмотрим, где в таблице элементов расположены элементы, образующие неметаллы, а где - элементы, образующие металлы. Оказывается, элементы, образующие неметаллы, группируются в правом верхнем углу таблицы элементов. Все остальные элементы - элементы , образующие металлы. Причину этого вы узнаете, изучив строение атомов и химические связи.
При комнатной температуре металлы - твердые вещества (исключение - ртуть, ее температура плавления - 39 oС).
В отличие от металлов, неметаллы не обладают каким-либо определенным набором характерных физических характеристик. Даже агрегатное состояние у них может быть разным. При комнатной температуре газообразныдвенадцать простых веществ (Н2, Не, N2, O2, O3, F2, Nе, Cl2, Аr, Кr, Хе, Rn), жидкость одна (Br2), а твердых веществ - более десяти (В, С(алмаз), С(графит), Si, P4, S8, As, Se, Те, I2 и др.). По своим химическим свойствам большинство металлов сильно отличается от большинства неметаллов, но резкой границы между ними нет.
Многие простые вещества при определенных условиях могут вступать в реакции друг с другом, например:
2H2 + O2 = 2H2O; 2Na + Cl2 = 2NaCl; 2Ca + O2 = 2CaO.
В результате таких реакций образуются бинарные соединения.
В принципе, в состав бинарного соединения могут входить любые элементы (кроме гелия и неона). Но часто один из этих элементов - кислород, водород или один из галогенов (фтор, хлор, бром или йод). Такие вещества называются кислородными соединениями, водородными соединениями или галогенидами. Примеры бинарных соединений: CaO, Al2O3, КН, HCl, АlI3, СаС2.
Кислородное соединение - бинарное соединение, один из элементов в котором кислород.
Примеры кислородных соединений: H2O (вода), H2O2 (пероксид водорода), Na2O (оксид натрия), Na2O2 (пероксид натрия), СО2 (диоксид углерода), OF2 (фторид кислорода). Большинство кислородных соединений является оксидами. Чем оксиды отличаются от остальных кислородных соединений, вы узнаете позже.
Примеры оксидов:
Li2O - оксид лития, CO2 - диоксид углерода, CaO - оксид кальция, SiO2 - диоксид кремния, Al2O3 - оксид алюминия, Н2О - вода,
MnO2 - диоксид марганца, SO3 -триоксид серы.
Водородное соединение - бинарное соединение, один из элементов в котором водород.
Примеры водородных соединений: NаН - гидрид натрия, H2O - вода, КН - гидрид калия, НСl - хлороводород, СаH2 - гидрид кальция,
NH3 - аммиак, BaH2 - гидрид бария, CH4 - метан.
Галогенид (фторид, хлорид, бромид или - бинарное соединение,один из элементов в котором - галоген.
Примеры галогенидов: CaF2 - фторид кальция, BF3 - трифторид бора, NaCl - хлорид натрия,PCl5 - пентахлорид фосфора, КВr - бромид калия, НВr - бромоводород, AlI3 - йодид алюминия, HI - йодоводород.
Примеры названий бинарных соединений приведены в таблице 6.
Таблица 6. Примеры названий бинарных соединений.
Элемент
Примеры бинарных соединений этого элемента
Их названия
Элемент
Примеры бинарных соединений этого элемента
Их названия
F
Cl
Br
I
O
NaF, CaF2, CF4, OF2
KCl, MgCl2, SiCl4, PCl5
LiBr, CuBr2, AlBr3,NBr3
CuI, BaI2, AlI3, SiI4, PI3
FeO, Fe2O3, CO2, SO3
фториды
хлориды
бромиды
йодиды
оксиды
S
N
P
C
H
Na2S, FeS, Cr2S3, CS2
Li3N, Mg3N2, AlN
Na3P, Ca3P2, CrP
CaC2, Al4C3, SiC
KH, CaH2, AlH3
сульфиды
нитриды
фосфиды
карбиды
гидриды
Обратите внимание, что все эти названия содержат суффикс -ид. Таким способом можно назвать любое бинарное соединение, кроме бинарных соединений элементов, образующих металлы (интерметаллических соединений). Вместе с тем, некоторые бинарные соединения имеют свои традиционные названия (вода, аммиак, хлороводород, метан и некоторые другие).
Среди бинарных соединений на Земле чаще всего встречаются оксиды. Это вызвано тем, что каждый второй атом в земной коре (в атмосфере, гидросфере и литосфере) - атом кислорода. А среди оксидов самое распространенное вещество - вода. Одна из причин этого в том, что водород - также один из самых распространенных э лементов в земной коре.
лементов в земной коре.
Теперь - о более сложных соединениях. Пусть в состав соединения входят три элемента. Таких соединений очень много. Какие из них наиболее важные? Конечно, кислородсодержащие соединения. И прежде всего, те, в состав которых входит водород. Важность этих соединений вызвана еще и тем, что в результате химических реакций между оксидами и водой получаются как раз такие вещества, например:
СаО + H2O = Ca(OH)2; P4O10 + 6H2O = 4H3PO4;
Li2O + H2O = 2LiOH; SO3 + H2O = H2SO4.
Образующиеся в результате этих реакций вещества называются гидроксидами. Название происходит от сочетания слов " гидрат оксида" , то есть соединение оксида с водой.
Существует много гидроксидов, в том числе и такие, которые не образуются при непосредственном взаимодействии оксида с водой, например: H2SiO3, Al(OH)3, Cu(OH)2 и другие. Эти вещества тоже называются гидроксидами потому, что при нагревании они разлагаются на оксид и воду.
Вообще-то почти все гидроксиды при нагревании разлагаются, образуя соответствующий оксид и воду, например:
Cu(OH)2 = CuO + H2O при 100oС;
Сa(OH)2 = CaO +H2O при 500oС;
H2SO4 = SO3 + H2O при 450oС;
2Аl(ОН)3 = Al2O3 + 3H2O при 200oС;
H2SiO3 = SiO2+ H2O ниже 100oС.
Но такие гидроксиды, как, например, NaОН и КОН, не разлагаются даже при нагревании до 1500 oС.
Гидроксиды - сложные вещества, образующие ся при химической реакции оксидов с водой или разлагающиеся при нагревании на оксид и воду.
Примеры названий некоторых гидроксидов приведены в таблице 7.
Формула
Название
Формула
Название
NаОН
Гидроксид натрия
H2SO4
Серная кислота
КОН
Гидроксид калия
H2SO3
Сернистая кислота
Ca(OH)2
Гидроксид кальция
HNO3
Азотная кислота
Ba(OH)2
Гидроксид бария
HNO2
Азотистая кислота
Аl(ОН)3
Гидроксид алюминия
H3PO4
Фосфорная кислота
Cu(OH)2
Гидроксид меди
H2CO3
Угольная кислота
Обратите внимание, что в левой половине таблицы собраны гидроксиды элементов, образующих металлы (название начинается со слова " гидроксид " ), а в правой - гидроксиды элементов, образующих неметаллы (название содержит слово " кислота " ). Разная форма названий связана с тем, что эти гидроксиды очен ь сильно отличаются по своим химическим свойствам. Например, их растворы по-разному изменяют окраску веществ, называемых индикаторами (точнее, кислотно-основными индикаторами ). Такими веществами-индикаторами являются красители, содержащиеся в чернике, малине, черной смородине, краснокочанной капусте и даже в чае. В лаборатории в качестве индикаторов обычно используют лакмус (природный краситель), метилоранж и фенолфталеин (оба синтетические). Так, лакмус в растворах, содержащих кислоты, окрашивается в красный цвет, а в растворах, содержащих растворимые гидроксиды металлов (щелочи) - в синий. Цвета других индикаторов приведены в приложении 3. Кислоты имеют кислый вкус, но пробовать их нельзя ни в коем случае, так как большинство из них ядовиты, или обладают обжигающим действием.
Из гидроксидов, приведенных в таблице 6, щелочами являются NaOH, КОН и Ba(OH) 2. Малорастворимый Са(ОН)2 тоже меняет окраску индикаторов. Из приведенных в этой же таблице кислот не меняет окраску индикаторов только кремниевая кислота, в частности потому, что она, в отличие от остальных кислот, нерастворима в воде.
Между собой кислоты, как правило, не реагируют, а с гидроксидами металлов вступают в реакции, например:
H2SO4 + 2КОН = К2SО4 + H2О;
2HNO3 + Ва(ОН)2 = Ва(NO 3)2 + 2H2O;
Н3РО4 + 3NаОН = Nа3РО4 + 3Н2О.
Кроме воды продуктами этих реакций являются соли - сложные вещества еще одного важнейшего класса. В результате реакции ни кислоты, ни щелочи в растворе не остается, и раствор становится нейтральным, поэтому такие реакции называют реакциями нейтрализации.
Обратите внимание на суффиксы в названиях солей, приведенных в таблице 8.
Таблица 8.Соли и их названия
Формула
Название
Формула
Название
К2SO3
Сульфит калия
Na2CO3
Карбонат натрия
CaSO4
Сульфат кальция
МgСО3
Карбонат магния
Al2(SO4)3
Сульфат алюминия
K2SiO3
Силикат калия
Ba(NO2)2
Нитрит бария
K3PO4
Фосфат калия
Ba(NO3)2
Нитрат бария
Ca3( PO4)2
Фосфат кал ьция
Некоторые гидроксиды из всех остальных гидроксидов реагируют только с кислотами. Такие гидроксиды называются основаниями. Те же гидроксиды, которые реагируют и с кислотами, и с ос нованиями (щелочами), называются амфотерными гидроксидами. Основаниям соответствуют основные оксиды, кислотам - кислотные оксиды, а амфотерным гидроксидам - амфотерные оксиды.
Примеры различных по своему химическому поведению оксидов приведены в таблице 9.
Таблица 9.Примеры основных, амфотерных и кислотных оксидов, а также соответствующие им гидроксидов.
Основные
Амфотерные
Кислотные
Оксиды
Гидроксиды
Оксиды
Гидроксиды
Ок сиды
Гидроксиды
Na2O
NaOH
BeO
Be(OH)2
B2O3
H3BO3
K2O
КОН
Cr2O3
Cr(ОН)3
CO2
H2CO3* *)
MgO
Mg(OH2
Ga2O3
Ga(OH) 3
SiO2
H2SiO3*)
CaO
Ca(OH)2
CuO
Cu(OH )2
N2O5
HNO3
BaO
Ba(OH)2
ZnO
Zn(OH)2
P4O10
H3PO4
La2O3
La(OH)3
Al2O3
Al(OH)3
SO2
H2SO3*)**)
FeO
Fe(OH)2
SnO
Sn(OH)2
SO3
H2SO4
Ag2O
-
PbO
Pb(OH)2
C rO3
H2CrO4**)
*)Приведена идеализированная формула гидроксида
**)Существует только в водном растворе
Соли образуются не только при реакциях кислот с основаниями, но и при взаимодействии металлов с кислотами:
Mg + H2SO4 = MgSO4 + H2O,
2Al + 6HCl = 2AlCl3 + 3H2 ,
а также при взаимодействии основных оксидов с кислотными оксидами Li2O + CO2 = Li2СО3,
основных оксидов с кислотами FeO + H2SO4 = FeSO4 + Н2О
и кислотных оксидов с основаниями SO2 + 2NаОН = Na2SO3 + H2O.
В аналогичные реакции вступают также амфотерные оксиды и гидроксиды.
А теперь вернемся к знакомому вам делению веществ на молекулярные и немолекулярные, то есть к классификации их по типу строения. Как распределяются молекулярные и немолекулярные вещества по различным классам сложных веществ, показано в таблице 10.
Таблица 10.Тип строения некоторых сложных веществ
Класс соединений
Молекулярное строение
Немолекулярное строение
Основные и амфотерные оксиды
-
Все
Кислотные оксиды
CO2, N2O3, N2O5, P4O10, SO2, SO3
B2O3, SiO2, CrO3
Основные и амфотерные гидроксиды
-
Все
Кислотные гидроксиды (кислоты)
H3BO3, H2CO3, HNO2, HNO3, H3PO4, H2SO3, H2SO4
H2SiO3
Гидриды
CH4, NH3, H2O, H2S, HF, HCl
NaH, KH, CaH2
Галогениды
BF3, SiCl4, CBr4, C2I6, NCl3
NaF, КС1, СаBr2, MgI2, BaF2
Соли
-
Все
Как видите, химические вещества - очень разные, разные по составу, по своим физическим характеристикам, разные по химическим свойствам. Но ответить на вопросы, почему данное вещество имеет такой состав, почему оно обладает такими характеристиками, почему оно реагирует именно с этими веществами и как оно с ними реагирует, вы пока не можете. Вспомните, что свойства вещества определяются его составом и строением. Поэтому для ответа на эти вопросы нужно прежде всего изучить, как вещества устроены, то есть - строение вещества.
Диоксид углерода - CO2, или углекислый газ. Молекулярное вещество, кислотный оксид. Несмотря на то, что его объемная доля в земной атмосфере всего 0,03 - 0,04 %, углекислый газ - один из существеннейших компонентов воздуха, и его роль в нашей жизни трудно переоценить. Он непосредственно участвует в двух важнейших природных процессах: дыхании и фотосинтезе. Например, за один час взрослый человек выдыхает около 20 литров углекислого газа. Повышение его содержания губительно для человека и животных: при объемной доле 0,2 - 0,15 % человек теряет сознание. Атмосферный СО2 предохраняет нашу планету от переохлаждения, так как способен удерживать тепловое излучение, исходящее от поверхности Земли, но его избыток может вызвать так называемый " парниковый эффект" . Твердый СО2 - " сухой лед" - используется для охлаждения: например, куски льда у продавщицы мороженого есть не что иное, как " сухой лед"
Оксид кальция - CaO, или негашеная (жженая) известь - основный оксид белого цвета, гигроскопичен (поглощает влагу). Это вещество энергично реагирует с водой, образуя "гашеную известь" - гидроксид кальция. Получают этот оксид обжигом различных горных пород, образованных карбонатом кальция, отсюда и название "жженая известь". При попадании на кожу вызывает ожоги. Особенно опасно попадание его в глаза.
Гидроксид кальция - Ca(OH)2, или гашеная известь, - основание белого цвета, малорастворимое в воде. Получают его так называемым гашением - добавлением воды к оксиду кальция. В реакции выделяется так много тепла, что реакционная смесь вскипает. Гашеную известь используют в строительстве как связующий материал и как сырье для изготовления белого силикатного кирпича, а также в производстве минеральных удобрений.
Конец формы


