- Преподавателю
- Химия
- Рабочая программа по химии 8 класс
Рабочая программа по химии 8 класс
| Раздел | Химия |
| Класс | 8 класс |
| Тип | Рабочие программы |
| Автор | Цекоева З.М. |
| Дата | 17.12.2015 |
| Формат | docx |
| Изображения | Есть |
I. ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Рабочая программа составлена на основе нормативных документов:
-
Учебного плана МБОУ СОШ с.Мичурино на 2015 - 2016 учебный год
-
Авторской программы курса химии для 8 - 11 классов общеобразовательных учреждений О.С.Габриеляна.
-
Федерального компонента государственного образовательного стандарта основного общего образования от 5 марта 2004 г.
-
Примерной программы по химии основного общего образования.
Календарно-тематический план ориентирован на использование учебно-методичекого комплекта:
-
Габриелян О.С. Химия. 8 класс: учебник для общеобразовательных учреждений. - М.: Дрофа, 2009.
-
Габриелян О.С. Программа курса химии для 8 - 11 классов общеобразовательных учреждений. - М.: Дрофа, 2011.
-
Габриелян О.С., Воскобойникова Н.П., Яшукова А.В. Настольная книга учителя. Химия. 8 кл: Методическое пособие. - М.: Дрофа, 2007.
-
Габриелян О.С., Яшукова А.В. Химия. 8 - 9 кл.: Методическое пособие. - М.: Дрофа, 2011.
-
Химия. 8 кл.: Контрольные и проверочные работы к учебнику О.С. Габриеляна «Химия. 8» / О.С. Габриелян, П.Н. Березкин, А.А. Ушакова и др. - М.: Дрофа, 2011.
-
Габриелян О.С., Яшукова А.В. Рабочая тетрадь. 8 кл. К учебнику О.С. Габриеляна «Химия. 8». - М.: Дрофа, 2011.
-
Габриелян О.С., Яшукова А.В. Тетрадь для лабораторных опытов и практических работ. 8 кл. К учебнику О.С. Габриеляна «Химия. 8». - М.: Дрофа, 2010.
Количество часов по плану:
в неделю - 3 ч (2 ч федеральный компонент и 1 ч школьный компонент);
всего - 105 ч;
контрольные работы - 6 ч.
Главной целью образования является развитие ребенка как компетентной личности путем включения его в различные виды ценностной человеческой деятельности: учеба, познания, коммуникация, профессионально-трудовой выбор, личностное саморазвитие, ценностные ориентации, поиск смыслов жизнедеятельности. С этих позиций обучение рассматривается как процесс овладения не только определенной суммой знаний и системой соответствующих умений и навыков, но и как процесс овладения компетенциями. Это определило цель обучения химии:
- освоение важнейших знаний об основных понятиях и законах химии, химической символике;
- овладение умениями наблюдать химические явления, проводить химический эксперимент, производить расчёты на основе химических формул веществ и уравнений химических реакций;
- развитие познавательных интересов и интеллектуальных способностей в процессе проведения химического эксперимента, самостоятельного приобретения знаний в соответствии с возникающими жизненными потребностями;
- воспитание отношения к химии как к одному из фундаментальных компонентов естествознания и элементу общечеловеческой культуры;
- применение полученных знаний и умений для безопасного использования веществ и материалов в быту, сельском хозяйстве и на производстве, решения практических задач в повседневной жизни, предупреждения явлений, наносящих вред здоровью человека и окружающей среде.
Задачи обучения:
- формирование знаний основ науки, важнейших фактов, понятий, законов и теорий, языка науки, доступных обобщений мировоззренческого характера;
- развитие умений наблюдать и объяснять химические явления, соблюдать правила техники безопасности при работе с веществами в химической лаборатории и в повседневной жизни;
- развитие интереса к химии как возможной области будущей практической деятельности;
- развитие интеллектуальных способностей и гуманистических качеств личности;
- формирование экологического мышления, убежденности в необходимости охраны окружающей среды.
Контроль знаний осуществляется посредством фронтального опроса, тестирования, письменных опросов. Промежуточная аттестация проводится в форме письменных и проверочных работ, взаимоконтроля.
II. ТЕМАТИЧЕСКОЕ ПЛАНИРОВАНИЕ
№
п/п
Наименование разделов и тем
Всего часов
Лабораторные опыты
Демонстрации
Контрольные работы
Экскурсии
Практические работы
Примечание
Введение
8
3
2
Атомы химических элементов
13
2
1
Простые вещества
9
6
1
Соединения химических элементов
18
2
8
1
2
Изменения, происходящие с веществами
14
5
16
1
1
Растворение. Растворы. Свойства растворов электролитов
30
6
11
1
4
Портретная галерея великих химиков
10
1
4
Резерв
3
Итого
105
13
46
6
4
9
III. ПОУРОЧНОЕ ПЛАНИРОВАНИЕ
№ урока
Тема урока
Эксперимент
(Д - демонстрационный,
Л - лабораторный)
Дата
Введение (8 уроков)
Предмет химии. Вещества. (§1)
Д. Коллекции изделий - тел из алюминия и стекла.
Предмет химии. Превращение веществ. Роль химии в жизни человека. (§2)
Д. 1. Взаимодействие соляной кислоты с мрамором.
2. Помутнение «известковой воды» при пропускании через неё углекислого газа.
Краткие сведения по истории развития химии. Основоположники отечественной химии. (§3)
Практическая работа №1. «Правила техники безопасности при работе в химическом кабинете. Приемы обращения с лабораторным оборудованием и нагревательными приборами»
Практическая работа №2. «Наблюдение за горящей свечой»
Знаки (символы) химических элементов. (§4)
Периодическая система химических элементов Д.И. Менделеева. (§4)
Химические формулы. Относительная атомная и молекулярная массы. Массовая доля элемента в соединении. (§5)
Тема 1. Атомы химических элементов (13 уроков)
Основные сведения о строении атомов. Состав атомных ядер: протоны, нейтроны. (§6)
Изменение числа протонов в ядре - образование новых химических элементов. Изменение числа нейтронов в ядре - образование изотопов. (§7)
Д. Модели атомов химических элементов.
Электроны. Строение электронных оболочек атомов. (§8)
Д. Периодическая система химических элементов Д.И. Менделеева.
Строение электронных оболочек атомов элементов № 1 - 20. (§8)
Металлические и неметаллические свойства элементов. Изменение свойств химических элементов по периодам и группам. (§9)
Ионная химическая связь. (§9)
Ковалентная неполярная химическая связь. (§10)
Электроотрицательность. Ковалентная полярная химическая связь. (§11)
Металлическая химическая связь атомов элементов-металлов между собой - образование металлических кристаллов. (§12)
Обобщение и систематизация знаний об элементах: металлах и неметаллах.
Обобщение и систематизация знаний о видах химической связи.
Решение расчетных задач.
Контрольная работа по теме «Атомы химических элементов»
Тема 2. Простые вещества (9 уроков)
Работа над ошибками. Простые вещества - металлы. Общие физические свойства металлов. (§13)
Д. Коллекция металлов: Fe, Al, Ca, Mg, Na, K.
Простые вещества - неметаллы. Физические свойства неметаллов - простых веществ. (§14)
Д. Коллекция неметаллов: S, P, Br (в ампуле), угля активированного.
Аллотропия. (§14)
Д. 1. Образцы белого и красного фосфора, белого и серого олова.
2. Получение озона.
Количество вещества. (§15)
Д. Некоторые металлы и неметаллы количеством 1 моль, 1 ммоль, 1 кмоль.
Молярная масса вещества. (§15)
Молярный объём газообразных веществ. (§16)
Д. Модель молярного объема газов.
Решение расчетных задач.
Обобщение и систематизация знаний по теме «Простые вещества».
Контрольная работа по теме «Простые вещества»
Тема 3. Соединения химических элементов (18 уроков)
Работа над ошибками. Степень окисления. Бинарные соединения металлов и неметаллов. (§17)
Л. Знакомство с образцами неорганических веществ различных классов.
Составление формул бинарных соединений по степеням окисления элементов. (§17)
Важнейшие классы бинарных соединений - оксиды, летучие водородные соединения. (§18)
Д. Образцы оксидов: 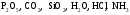 (газы и растворы)
(газы и растворы)
Основания, их состав и названия, классификация. (§19)
Д. 1. Образцы щелочей и нерастворимых оснований.
2. Изменение окраски индикаторов.
Основания. Расчеты по формулам оснований. (§19)
Кислоты, их состав и названия. Классификация кислот. (§20)
Д. 1. Образцы кислот: 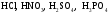 , некоторых других минеральных и органических кислот.
, некоторых других минеральных и органических кислот.
2. Изменение окраски индикаторов.
Кислоты. Расчеты по формулам оснований. (§20)
Соли как производные кислот и оснований. (§21)
Д. Образцы солей.
Соли. Расчеты по формулам солей. (§21)
Аморфные и кристаллические вещества. Кристаллические решетки. (§22)
Д. Модели кристаллических решеток NaCl, алмаза, графита, металлов,  .
.
Чистые вещества и смеси. (§23)
Д. 1. Взрыв смеси водорода с воздухом.
2. Способы разделения смесей.
3. Дистилляция воды.
Л. Разделение смесей.
Практическая работа №3. «Анализ почвы и воды»
Массовая и объемная доля компонентов смеси в том числе и доля примесей. (§24)
Расчеты, связанные с понятием «доля» (ω, φ)
Практическая работа №5. «Приготовление раствора сахара и расчет его массовой доли в растворе»
Обобщение и систематизация знаний по теме «Соединения химических элементов»
Решение расчетных задач.
Контрольная работа по теме «Соединения химических элементов»
Тема 4. Изменения, происходящие с веществами
(14 уроков)
Работа над ошибками. Физические явления. Разделение смесей. (§25)
Д. 1. Плавление парафина Возгонка бензойной кислоты.
2. Способы разделения смесей.
Л. Сравнение скорости испарения капель воды и спирта с фильтровальной бумаги.
Химические реакции. (§26)
Д. 1. Горение магния.
2. Взаимодействие HCl с мрамором, получение 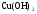 и последующее его растворение в кислоте.
и последующее его растворение в кислоте.
3. Взаимодействие 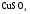 с Fe.
с Fe.
Л. Помутнение известковой воды от выдыхаемого углекислого газа.
Закон сохранения массы вещества. Химические уравнения. (§27)
Д. 1. Подтверждение закона сохранения массы веществ в результате химических реакций.
2. Электролиз воды.
Реакции разложения. Понятие о скорости химических реакций. Катализаторы. Ферменты. (§29)
Д. 1. Разложение нитратов калия или натрия, перманганата калия, азотной кислоты, гидроксида меди (II).
2. Разложение 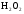 в присутствии
в присутствии 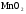 .
.
Реакции соединения. Цепочки переходов. (§30)
Д. Осуществление цепочки переходов
Л. Окисление меди в пламени спиртовки.
Реакции замещения. Ряд активности металлов. (§31)
Д. 1. Взаимодействие натрия с водой.
2. Взаимодействие цинка и алюминия с соляной кислотой.
3. Взаимодействие металлов с растворами солей.
Л. Замещение меди в растворе сульфата меди (II) железом.
(6 реакций)
Реакции обмена. Правило Бертолле. (§32)
Д. 1. Взаимодействие растворов щелочей, окрашенных фенолфталеином, с растворами кислот.
2. Взаимодействие серной кислоты и хлорида бария, соляной кислоты и нитрата серебра, гидроксида натрия и сульфата железа (III).
Л. Получение углекислого газа взаимодействием соды и кислоты.
Типы химических реакций на примере свойств воды. Понятие о гидролизе. (§33)
Д. 1. Взаимодействие 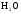 с
с 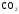 и CaO.
и CaO.
2. Взаимодействие 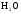 с Na, Li.
с Na, Li.
3. Гидролиз сульфида алюминия.
Расчёты по химическим уравнениям. (§28)
Расчёты по химическим уравнениям. (§28)
Практическая работа №4. «Признаки химических реакций».
Обобщение и систематизация знаний по теме «Изменения, происходящие с веществами»
Решение расчетных задач.
Контрольная работа по теме «Изменения, происходящие с веществами»
Тема 5. Растворение. Растворы. Свойства растворов электролитов. Окислительно-восстановительные реакции
(30 уроков)
Растворение как физико-химический процесс. (§34)
Д. 1. Кристаллизация пересыщенного раствора глауберовой соли.
2. Растворение безводного 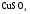 в воде.
в воде.
Растворимость. Типы растворов. (§34)
Д. Растворимость веществ при разных температурах. Тепловые явления при растворении.
Электролитическая диссоциация (ЭД). (§35)
Д. Испытание веществ и их растворов на электропроводность.
Степень электролитической диссоциации. Сильные и слабые электролиты. (§35)
Д. Зависимость ЭД уксусной кислоты от разбавления.
Основные положения теории электролитической диссоциации. (§36)
Д. Движение окрашенных ионов в электрическом поле.
Ионные уравнения реакций. (§37)
Д. Примеры реакций, идущих до конца.
Решение упражнений на составление молекулярных и ионных уравнений с использованием таблицы растворимости. (§37)
Практическая работа № 6 «Ионные реакции».
Кислоты в свете ТЭД, их классификация и свойства. (§38)
Л. Реакции, характерные для растворов кислот (на примере соляной и серной кислоты).
Молекулярные и ионные уравнения реакций кислот. (§38)
Решение упражнений на составление молекулярных и ионных уравнений реакций кислот. (§38)
Основания в свете ТЭД, их классификация и свойства. (§39)
Д. 1. Взаимодействие 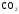 и NaOH.
и NaOH.
2. Разложение 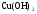 .
.
Л. Реакции, характерные для растворов щелочей (на примере гидроксида натрия или калия).
Молекулярные и ионные уравнения реакций оснований. (§39)
Л. Получение и свойства нерастворимого основания, например, гидроксида меди (II).
Решение упражнений на составление молекулярных и ионных уравнений реакций оснований. (§39)
Оксиды, их классификация и свойства. (§40)
Л. 1. Изучение свойств основных оксидов для CaO
2. Изучение свойств кислотных оксидов для 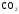 и
и 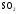 .
.
Решение упражнений на составление молекулярных и ионных уравнений реакций оксидов. (§40)
Соли в свете ТЭД, их свойства. (§41)
Л. Химические свойства солей.
Взаимодействие солей с кислотами и щелочами (повторение).
Практическая работа № 7 «Условия протекания химических реакций между растворами электролитов до конца».
Практическая работа №8 «Свойства кислот, оснований, оксидов и солей».
Генетическая связь между классами неорганических веществ. (§42)
Д. Осуществление цепочки переходов
Обобщение и систематизация знаний по теме «Теория электролитической диссоциации»
Контрольная работа по теме «Теория электролитической диссоциации»
Работа над ошибками. Классификация химических реакций.
Д. Примеры химических реакций разных типов.
Окислительно-восстановительные реакции (ОВР). (§43)
Д. 1. Взаимодействие Zn с HCl, S, 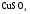 .
.
2. Горение магния.
3. Взаимодействие хлорной и сероводородной воды.
Составление уравнений окислительно-восстановительных реакций методом электронного баланса. (§43)
Свойства изученных классов веществ в свете окислительно-восстановительных реакций.
Практическая работа №9. «Решение экспериментальных задач».
Обобщение и систематизация знаний по теме «Окислительно-восстановительные реакции»
Решение расчетных задач. Проверочная работа по теме «Окислительно-восстановительные реакции»
Тема 6. Портретная галерея великих химиков (10 уроков)
Знакомство с жизнью и деятельностью Парацельса, Роберта Бойля, М.В. Ломоносова. Строение атомов. Закон сохранения массы вещества. Химические уравнения (повторение).
Экскурсия в аптеку.
Знакомство с жизнью и деятельностью Лавуазье и Бертолле. Условия протекания химических реакций (повторение).
Знакомство с жизнью и деятельностью Дальтона и Авогадро. Закон Авогадро.
Экскурсия на предприятия местного производства.
Знакомство с жизнью и деятельностью Д.И. Менделеева. Периодический закон и периодическая система химических элементов.
Экскурсия в агрохимлабораторию.
Экскурсия на предприятия местного производства.
Знакомство с жизнью и деятельностью Аррениуса и И.А. Каблукова. Окислительно-восстановительные реакции (повторение).
Итоговая контрольная работа.
Резерв
Резерв
Резерв
IV. ТРЕБОВАНИЯ К УРОВНЮ ПОДГОТОВКИ
восьмиклассников.
знать/понимать
-
химическую символику: знаки химических элементов, формулы химических веществ и уравнения химических реакций;
-
важнейшие химические понятия: химический элемент, атом, молекула, относительные атомная и молекулярная массы, ион, химическая связь, вещество, классификация веществ, моль, молярная масса, молярный объём, химическая реакция, классификация реакций, электролит и неэлектролит, электролитическая диссоциация, окислитель и восстановитель, окисление и восстановление;
-
основные законы химии: сохранения массы веществ, постоянства состава, периодический закон;
уметь
-
называть: химические элементы, соединения изученных классов;
-
объяснять: физический смысл атомного номера химического элемента, номеров группы и периода; закономерности изменения свойств элементов в пределах малых периодов и главных подгрупп; сущность реакций ионного обмена;
-
характеризовать: химические элементы(от водорода до кальция) на основе их положения в периодической системе Д.И.Менделеева и особенностей строения их атомов; связь между составом, строением и свойствами веществ; химические свойства основных классов неорганических веществ;
-
определять: состав веществ по их формулам, принадлежность веществ к определённому классу соединений, типы химических реакций, валентность и степень окисления элемента в соединениях, тип химической связи в соединениях, возможность протекания реакций ионного обмена;
-
составлять: формулы неорганических соединений; схемы строения атомов первых 20 элементов периодической системы; уравнения химических реакций;
-
обращаться: с химической посудой и лабораторным оборудованием;
-
распознавать опытным путём: кислород, водород, растворы кислот и щелочей,
-
вычислять: массовую долю химического элемента по формуле соединения; массовую долю вещества в растворе; количество вещества, объём или массу по количеству вещества, объёму или массе реагентов или продуктов реакции;
использовать приобретённые знания и умения в практической деятельности и повседневной жизни для:
-
безопасного обращения с веществами и материалами;
-
экологически грамотного поведения в окружающей среде;
-
оценки влияния химического загрязнения окружающей среды на организм человека;
-
критической оценки информации о веществах, используемых в быту;
-
приготовления растворов заданной концентрации.
V. ЛИТЕРАТУРА
а) литература для учащихся:
-
Е.А. Еремин, Н.Е. Кузьменко «Справочник школьника по химии 8-11 класс, М, «Дрофа», 2000 г.
-
Л.Ю. Аликберова «Занимательная химия», М, «АСТ - Пресс», 2002г.
-
А.Е. Савельев. Основные понятия и законы химии. Химические реакции. - М.: Дрофа, 2008.
б) литература для учителя:
-
М.Ю. Горковенко. Поурочные разработки по химии: 8 класс, - М.: ВАКО, 2007.
-
М.А. Рябов, Е.Ю. Невская. Тесты по химии: 8 класс: к учебнику О.С. Габриеляна. - М.: Издательство «Экзамен», 2009.
-
Н.С. Павлова. Дидактические карточки-задания по химии: 8 класс: к учебнику О.С. Габриеляна. - М.: Издательство «Экзамен», 2004.
-
Н.С. Павлова. Контрольные и самостоятельные работы по химии: 8 класс: к учебнику О.С. Габриеляна. - М.: Издательство «Экзамен», 2009.
-
О.С. Габриелян. Задачи по химии и способы их решения. 8 - 9 кл. - М.: Дрофа, 2010.
-
А.М. Радецкий. Химический тренажер: задания для организации самостоятельной работы учащихся 8 - 9 и 10 - 11 кл. - М.: Просвещение, 2008.
-
О.С. Габриелян. Тетрадь для оценки качества знаний по химии к учебнику О.С. Габриеляна «Химия. 8 класс». - М.: Дрофа, 2012.
-
Контрольно-измерительные материалы. Химия: 8 класс / Сост. Н.П. Троегубова. - М.: ВАКО, 2011.
в) электронные пособия:
СD диски:
«Общая и неорганическая химия»,
«Химия (8 - 11 классы). Виртуальная лаборатория»
«Неорганическая химия», мультимедийное сопровождение уроков.
«Химия. Демонстарционные таблицы»
«Химия. 8 - 9 классы. Интерактивные проверочные работы»
Интернет-ресурсы:
chem-astu.ru/chair/study/genchem/index.html
bril2002.narod.ru/chemistry.html
chemel.ru/
prosv.ru/ebooks/Gara_Uroki-himii_8kl/index.html
chem-inf.narod.ru/inorg/element.html
VI. ЛИСТ ИЗМЕНЕНИЙ
№ изменений
Номера листов
Дата
Подпись лица, внёсшего изменения
что изменилось
страницы
3


